
KHUYẾN CÁO
CHẨN ĐOÁN VÀ ĐIỀU TRỊ
VIÊM PHỔI BỆNH VIỆN VÀ
VIÊM PHỔI LIÊN QUAN ĐẾN THỞ MÁY
(Cập nhật năm 2023)
CHỦ BIÊN
GS.TS. Nguyễn Gia Bình – GS.TS. Ngô Quý Châu
BAN BIÊN SOẠN
GS.TS. Nguyễn Gia Bình
Chủ tịch Hội Hồi sức cấp cứu và Chống độc Việt Nam
Nguyên trưởng khoa Hồi sức tích cực – Bệnh viện Bạch Mai
GS.TS. Ngô Quý Châu
Chủ tịch Hội Hô hấp Việt Nam
Giám đốc chuyên môn Bệnh viện Đa khoa Tâm Anh, Hà Nội
PGS.TS. Đào Xuân Cơ
Phó Chủ tịch Hội Hồi sức cấp cứu và Chống độc Việt Nam
Giám đốc Bệnh viện Bạch Mai
PGS.TS. Vũ Văn Giáp
Tổng thư ký Hội Hô hấp Việt Nam
Phó Giám đốc Bệnh viện Bạch Mai
PGS.TS. Chu Thị Hạnh
Phó chủ tịch Hội Hô hấp Việt Nam
Chủ tịch Hội Hô hấp Hà Nội
Trưởng khoa Nội Hô hấp Bệnh viện Đa khoa Tâm Anh Hà Nội
PGS.TS. Phan Thu Phương
Phó Chủ tịch Hội Hô hấp Hà Nội
Giám đốc Trung tâm Hô hấp – Bệnh viện Bạch Mai
PGS.TS. Trần Quang Bính
Giám đốc chuyên môn Bệnh viện Đa khoa Tâm Anh TP. Hồ Chí Minh
PGS.TS. Trần Thanh Cảng
Trưởng khoa Hồi sức cấp cứu Nội – Bệnh viện Việt Tiệp – Hải Phòng
PGS.TS. Lê Tiến Dũng
Phó chủ tịch Hội Hô hấp TP. Hồ Chí Minh
PGS.TS. Trần Văn Ngọc
Phó Chủ tịch Hội Lao và bệnh Phổi Việt Nam
Chủ tịch Hội Hô hấp TP. Hồ Chí Minh
Nguyên Trưởng khoa Hô hấp Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
Phó trưởng khoa Y – Đại học Y dược TP. Hồ Chí Minh
PGS.TS. Đặng Quốc Tuấn
Phó Chủ tịch Hội Hồi sức cấp cứu và Chống độc Việt Nam
Chủ tịch Hội Hồi sức cấp cứu & Chống độc Hà Nội và các tỉnh phía Bắc
Phụ trách Trung tâm Hồi sức tích cực – Bệnh viện Bạch Mai
PGS.TS. Nguyễn Hoàng Anh
Giám đốc Trung tâm DI&ADR Quốc Gia
Phó Trưởng khoa Dược – Bệnh viện Bạch Mai
PGS.TS. Lê Thượng Vũ
Tổng thư ký Hội Hô hấp TP. Hồ Chí Minh
Trưởng khoa Hô hấp, Bệnh viện Đại học Y dược, TP. Hồ Chí Minh
PGS.TS. Phạm Thị Ngọc Thảo
Phó Chủ tịch Hội Hồi sức cấp cứu và Chống độc Việt Nam
Chủ tịch Liên Chi hội Hồi sức cấp cứu TP. Hồ Chí Minh
Phó Giám đốc Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
TS. Lê Đức Nhân
Phó Chủ tịch Hội Hồi sức cấp cứu và Chống độc Việt Nam Giám đốc Bệnh viện Đà Nẵng
TS. Phạm Hồng Nhung
Phó Trưởng khoa Vi sinh – Bệnh viện Bạch Mai
TS. Trương Thiên Phú
Trưởng khoa Vi sinh – Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
PGS.TS. Đỗ Ngọc Sơn
Giám đốc Trung tâm Hồi sức tích cực Bệnh viện Bạch Mai
TS. Bùi Thị Hương Giang
Trung tâm Hồi sức tích cực – Bệnh viện Bạch Mai
TS. Bùi Văn Cường
Trung tâm Hồi sức tích cực – Bệnh viện Bạch Mai
BSCKII. Trần Thị Thanh Nga
Giám đốc Trung tâm xét nghiệm BVĐK Tâm Anh TP. Hồ Chí Minh
Nguyên Trưởng khoa vi sinh – Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
BSCKII. Phan Thị Xuân
Trưởng khoa Hồi sức tích cực chống độc BVĐK Tâm Anh TP.
Hồ Chí Minh
Trưởng khoa Cấp cứu BVĐK Tâm Anh TP. Hồ Chí Minh
Nguyên Trưởng khoa Hồi sức cấp cứu Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
TS. Phạm Thế Thạch
Phó Giám đốc Trung tâm Hồi sức tích cực – Bệnh viện Bạch Mai
Tổng Thư ký Hội Hồi sức cấp cứu và Chống độc Việt Nam
TS. Trương Thái Phương
Trưởng khoa Vi sinh – Bệnh viện Bạch Mai
BSCKII. Đỗ Danh Quỳnh
Nguyên Giám đốc Trung tâm Gây mê và Hồi sức ngoại khoa – Bệnh viện Việt Đức
ThS. Nguyễn Thị Thanh Huyền
Phó chủ tịch Hội Hô hấp Hà Nội
Phó Giám đốc Trung tâm Hô hấp – Bệnh viện Bạch Mai
BSCKII. Đặng Vũ Thông
Trưởng khoa Hô hấp Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
TS.BS. Lê Quốc Hùng
Trưởng khoa Bệnh Nhiệt đới Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
TS.BS. Đoàn Thu Trà
Phó Giám đốc Trung tâm Bệnh Nhiệt đới Bệnh viện Bạch Mai
TS.BS. Trương Dương Tiễn
Khoa Hồi sức Cấp cứu khu D Bệnh viện Chợ Rẫy, TP. Hồ Chí Minh
TS.BS. Lưu Quang Thùy
Giám đốc Trung tâm Gây mê và Hồi sức ngoại khoa – Bệnh viện Việt Đức
Trưởng khoa Hồi sức tích cực 2 – Bệnh viện Việt Đức
BAN THƯ KÝ
ThS. Nguyễn Bá Cường
Trung tâm Hồi sức tích cực – Bệnh viện Bạch Mai
ThS. Trịnh Thế Anh
Trung tâm Hồi sức tích cực – Bệnh viện Bạch Mai
TS. Nguyễn Thanh Thuỷ
Trung tâm Hô hấp – Bệnh viện Bạch Mai
ThS. Nguyễn Ngọc Dư
Trung tâm Hô hấp – Bệnh viện Bạch Mai
ThS. Đào Ngọc Phú
Trung tâm Hô hấp – Bệnh viện Bạch Mai
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập – Tự do – Hạnh phúc
Hà Nội, ngày 10 tháng 10 năm 2023
QUYẾT ĐỊNH
Về việc ban hành tài liệu chuyên môn
“Khuyến cáo Chẩn đoán và điều trị viêm phổi bệnh viện và viêm phổi liên quan đến thở máy”
Nhằm cung cấp kiến thức cập nhật về chẩn đoán và điều trị viêm phổi bệnh viện và viêm phổi liên quan đến thở máy cho các y bác sĩ trong thực hành lâm sàng, Hội Hô hấp Việt Nam và Hội Hồi sức cấp cứu và Chống độc Việt Nam phối hợp đồng biên soạn và quyết định ban hành tài liệu chuyên môn “Khuyến cáo Chẩn đoán và điều trị viêm phổi bệnh viện và viêm phổi liên quan đến thở máy” với bản cập nhật năm 2023. Tài liệu chuyên môn này là cơ sở pháp lý để xây dựng phác đồ điều trị tại các cơ sở khám bệnh, chữa bệnh trên toàn quốc.
Quyết định có hiệu lực kể từ ngày ký, ban hành./.
| HỘI HỒI SỨC CẤP CỨU VÀ CHỐNG ĐỘC VIỆT NAM Chủ tịchGS.TS. Nguyễn Gia Bình |
HỘI HÔ HẤP VIỆT NAM
Chủ tịch GS.TS. Ngô Quý Châu |
LỜI NÓI ĐẦU
Viêm phổi bệnh viện (VPBV) và viêm phổi liên quan thở máy (VPLQTM) đã và đang làm tăng chi phí điều trị, tăng gánh nặng cho hệ thống y tế và cho người bệnh. Mặc dù có nhiều tiến bộ trong việc chẩn đoán và điều trị, nhưng tỷ lệ tử vong do VPBV và VPLQTM vẫn còn cao. Tỷ lệ vi khuẩn đề kháng kháng sinh ngày càng tăng cao, trong khi đó với các kháng sinh được cho là có tác dụng cho VPBV và VPLQTM thì nồng độ ức chế tối thiểu (MIC) đối với vi khuẩn cũng có xu hướng tăng. Chẩn đoán VPBV và VPLQTM không kịp thời, lựa chọn liệu pháp kháng sinh ban đầu không phù hợp sẽ góp phần làm tăng tỷ lệ tử vong. Khuyến cáo của Hội các bệnh nhiễm khuẩn Hoa Kỳ (IDSA) và Hiệp hội lồng ngực Hoa Kỳ (ATS) mới được công bố năm 2016 về chẩn đoán và điều trị VPBV và VPLQTM đã nhấn mạnh vai trò của chẩn đoán sớm, điều trị sớm dựa theo liệu pháp kháng sinh kinh nghiệm ban đầu phù hợp. Khuyến cáo cập nhật của IDSA 2022 về điều trị nhiễm khuẩn gram âm đa kháng cung cấp các phác đồ điều trị tác nhân gây bệnh cụ thể nhằm giảm tỷ lệ tử vong.
Tại Việt Nam, các công bố mới đây của các trung tâm y tế lớn trong cả nước cũng đã cho thấy một bức tranh tương đối rõ ràng về dữ liệu vi sinh vật gây VPBV và VPLQTM trong nước. Trong đó có thể thấy sự gia tăng của các chủng vi khuẩn kháng thuốc, nhất là vi khuẩn Gram âm ở mọi cơ sở điều trị.
Xuất phát từ những lý do trên, Hội Hô hấp Việt Nam phối hợp với Hội Hồi sức cấp cứu và Chống độc Việt Nam đã mời các chuyên gia đầu ngành đến từ các đơn vị y tế trên toàn quốc biên soạn “Khuyến cáo chẩn đoán và điều trị viêm phổi bệnh viện và viêm phổi liên quan đến thở máy” với mong muốn giúp các bác sỹ lâm sàng có được cái nhìn toàn diện, có phương hướng rõ ràng và hợp lý trong chẩn đoán, điều trị nhằm cải thiện tiên lượng VPBV và VPLQTM ở các bệnh nhân người lớn. Tài liệu này chủ yếu đề cập tới VPBV và VPLQTM do vi khuẩn.
Xin chân thành cảm ơn các nhà tài trợ đã đồng hành cùng Hội Hô hấp Việt Nam và Hội Hồi sức cấp cứu và Chống độc Việt Nam để hoàn thành Hướng dẫn này.
Bản cập nhật khuyến cáo chẩn đoán và điều trị VPBV và VPLQTM có thể còn những thiếu sót, ban biên soạn rất mong nhận được sự đóng góp ý kiến của các độc giả để phiên bản sau được hoàn chỉnh hơn.
Hà Nội, ngày 10 tháng 10 năm 2023
| Chủ tịch Hội Hồi sức cấp cứu và Chống độc Việt NamĐã kýGS. TS. Nguyễn Gia Bình |
Chủ tịch Hội Hô hấp Việt NamĐã kýGS. TS. Ngô Quý Châu |
MỤC LỤC
CHƯƠNG I: TỔNG QUAN VỀ VIÊM PHỔI BỆNH VIỆN VÀ VIÊM PHỔI LIÊN QUAN THỞ MÁY ………………………………………………………………….19
1. Định nghĩa …………………………………………………………………….19
2. Dịch tễ…………………………………………………………………………..19
2.1. Tỷ lệ mắc bệnh……………………………………………………………..19
2.1.1. Trên thế giới……………………………………………………………….19
2.1.2. Ở Việt Nam………………………………………………………………..20
2.2. Các yếu tố nguy cơ…………………………………………………………21
2.3. Căn nguyên vi sinh vật và đề kháng kháng sinh ……………………..21
2.3.1. Trên thế giới……………………………………………………………….22
2.3.2. Ở Việt Nam………………………………………………………………..31
2.3.2.1. Các căn nguyên vi khuẩn gây VPBV và VPLQTM………………….31
2.3.2.2. Mức độ nhạy cảm với kháng sinh của các chủng vi khuẩn thường gặp………………………………………………………………………………….35
CHƯƠNG II: CHẨN ĐOÁN VIÊM PHỔI BỆNH VIỆN VÀ VIÊM PHỔI LIÊN QUAN THỞ MÁY ………………………………………………………………….42
1. Các triệu chứng lâm sàng và xét nghiệm…………………………………42
1.1. Lâm sàng ……………………………………………………………………42
1.2. Xét nghiệm máu…………………………………………………………….43
1.3. X-quang ngực……………………………………………………………….43
1.4. Xét nghiệm vi khuẩn……………………………………………………….44
2. Tiêu chuẩn chẩn đoán………………………………………………………..46
2.1. Chẩn đoán xác định………………………………………………………..46
2.2. Chẩn đoán nguyên nhân…………………………………………………..48
2.3. Nguy cơ nhiễm vi khuẩn đa kháng………………………………………48
2.4. Chẩn đoán mức độ nặng…………………………………………………..49
CHƯƠNG III: ĐIỀU TRỊ VIÊM PHỔI BỆNH VIỆN VÀ VIÊM PHỔI
LIÊN QUAN THỞ MÁY…………………………………………………………….50
1. Nguyên tắc……………………………………………………………………..50
1.1. Điều trị kháng sinh ban đầu theo kinh nghiệm………………………..50
1.2. Điều chỉnh kháng sinh khi có kết quả xét nghiệm vi khuẩn
và kháng sinh đồ…………………………………………………………………51
1.3. Thời gian dùng kháng sinh………………………………………………..51
2. Điều trị kháng sinh ban đầu theo kinh nghiệm…………………………..52
2.1. Viêm phổi bệnh viện……………………………………………………….52
2.2. Viêm phổi liên quan thở máy ……………………………………………58
3. Điều trị đặc hiệu theo tác nhân vi khuẩn…………………………………65
3.1. Pseudomonas aeruginosa…………………………………………………65
3.2. Acinetobacter baumannii …………………………………………………67
3.3. Trực khuẩn Gram âm đường ruột sinh ESBL (Escherichia
coli, Klebsiella pneumoniae)……………………………………………………69
3.4. Vi khuẩn đường ruột kháng carbapenem (Carbapenem
resistant Enterobacterales, CRE……………………………………………….69
3.5. Staphylococcus aureus kháng methicillin (MRSA)…………………….72
4. Theo dõi điều trị và thời gian dùng kháng sinh………………………….78
CHƯƠNG IV: DỰ PHÒNG VIÊM PHỔI BỆNH VIỆN/VIÊM PHỔI
LIÊN QUAN THỞ MÁY…………………………………………………………….79
1. Tránh đặt ống và đặt lại ống nội khí quản nếu có thể ………………….79
1.1. Sử dụng thở oxy mũi dòng cao (HFNC) hoặc thở máy không xâm nhập khi cần thiết (bằng chứng cao)………………………………………….79
1.2. Cho bệnh nhân suy hô hấp cấp do COVID không có chỉ
định đặt nội khí quản…………………………………………………………….80
2. Dùng an thần tối thiểu……………………………………………………….80
2.1. Áp dụng các hướng dẫn sử dụng an thần ……………………………..80
2.2. Đánh giá cai thở máy hàng ngày cho bệnh nhân (bằng
chứng cao)…………………………………………………………………………82
2.2.1. Tiêu chuẩn cai thở máy………………………………………………….82
2.2.2. Tiến hành cai thở máy: sử dụng 1 trong các phương pháp sau….82
2.2.3. Đánh giá đáp ứng của người bệnh khi cai thở máy…………………83
2.2.4. Thôi thở máy………………………………………………………………83
3. Phục hồi chức nặng và tập vận động sớm………………………………..84
4. Nằm đầu cao 30-45 độ……………………………………………………….84
5. Chăm sóc răng miệng………………………………………………………..84
6. Cho ăn sớm qua đường tiêu hoá……………………………………………85
7. Quản lý dây máy thở ………………………………………………………..85
8. Vệ sinh tay……………………………………………………………………..85
9. Kiểm tra và quản lý áp lực bóng chèn …………………………………….86
10. Hút trên bóng chèn định kỳ ……………………………………………….87
TÀI LIỆU THAM KHẢO……………………………………………………………88
DANH MỤC BẢNG
Bảng 1.1. Tổng hợp các căn nguyên gây bệnh ở BN COVID-19 mắc VAP ………………………………………………………………………………………27
Bảng 1.2. Tác nhân vi khuẩn gây VPLQTM ở bệnh viện Bạch Mai và Chợ Rẫy………………………………………………………………………………..31
Bảng 1.3. Tác nhân vi khuẩn ở bệnh nhân VPBV và VPLQTM ở một số bệnh viện khác…………………………………………………………………..32
Bảng 1.4. Tỷ lệ % của 10 loài vi khuẩn gây bệnh thường gặp nhất trong bệnh phẩm đường hô hấp dưới ……………………………………………..33
Bảng 1.5. Tỷ lệ nhạy cảm với kháng sinh của 3 loài trực khuẩn Gram thường gặp gây nhiễm trùng đường hô hấp dưới, phân lập được trong năm 2020 của 16 bệnh viện trong hệ thống giám sát kháng kháng sinh quốc gia …………………………………………………………………………34
Bảng 1.6. Tỷ lệ nhạy cảm với kháng sinh của Acinetobacter baumannii …………………………………………………………………………………….35
Bảng 1.7. Mức độ nhạy cảm với kháng sinh của các chủng Klebsiella pneumoniae …………………………………………………………………….35
Bảng 1.8. Mức độ nhạy cảm với kháng sinh của các chủng Pseudomonas aeruginosa ……………………………………………………………………….37
Bảng 1.9. Mức độ nhạy cảm với kháng sinh của các chủng Escherichia coli………………………………………………………………………………….38
Bảng 1.10. Mức độ kháng methicillin của các chủng Staphylococcus aureus tại bệnh viện Bạch Mai…………………………………………………39
Bảng 1.11. Mức độ nhạy cảm kháng sinh của các trực khuẩn Gram âm ………………………………………………………………………………………40
Bảng 1.12. Mức độ nhạy cảm kháng sinh của S. aureus…………………41
Bảng 3.1. Các kháng sinh ban đầu điều trị theo kinh nghiệm viêm phổi bệnh viện…………………………………………………………………………53
Bảng 3.2. Các thuốc điều trị ban đầu theo kinh nghiệm viêm phổi liên quan thở máy…………………………………………………………………….60
Bảng 3.3. Hoạt tính in vitro của các kháng sinh BL/BLI mới (phối hợp beta-lactam/chất ức chế beta-lactamase) và cefiderocol trên các chủng vi khuẩn Gram âm kháng carbapenem………………………………………75
Bảng 3.4. Phổ tác dụng của các kháng sinh beta-lactam mới có/không phối hợp với chất ức chế beta-lactamase …………………………………..77
Bảng 4.1. Thang điểm RASS …………………………………………………..81
DANH MỤC HÌNH ẢNH
Hình 3.1. Đề xuất phác đồ kháng sinh điều trị HAP/VAP do vi khuẩn kháng thuốc ………………………………………………………………………………………………73
DANH MỤC CHỮ VIẾT TẮT
| ARDS | Hội chứng suy hô hấp cấp tiến triển | Acute Respiratory Distress Syndrome |
| ASHP | Hội Dược sĩ bệnh viện Hoa Kỳ | American Society of Health-System Pharmacists |
| ATS | Hội Lồng ngực Hoa Kỳ | American Thoracic Society |
| CRE | Vi khuẩn đường ruột kháng carbapenem | Carbapenem resistant Enterobacterales |
| CRP | Protein phản ứng C | C – reactive protein |
| DTR | Kháng thuốc khó điều trị | difficult-to-treat resistance |
| HAP | Viêm phổi bệnh viện | Hospital-acquired pneumonia |
| HKTM | Huyết khối tĩnh mạch | |
| HSTC | Hồi sức tích cực | |
| IDSA | Hội các Bệnh truyền nhiễm Hoa Kỳ | Infectious Diseases Society of America |
| MDR | Đa kháng thuốc | Multi Drug Resistant |
| MIC | Nồng độ ức chế tối thiểu | Minimum Inhibitory Concentration |
| MRSA | Staphylococcus aureus đề kháng methicillin | Methicillin- resistant Staphylococc -us aureus |
| nvHAP | Viêm phổi bệnh viện không cần thở máy | Nonventilator hospital-acquired pneumonia |
| TP. HCM | Thành phố Hồ Chí Minh | |
| VAP | Viêm phổi liên quan thở máy | Ventilator associated pneumonia |
| VAT | Viêm khí phế quản liên quan thở máy | Ventilator associated tracheobronchitis |
| vHAP | Viêm phổi bệnh viện nặng đáp ứng kém với điều trị và cần thở máy |
|
| VPBV | Viêm phổi bệnh viện | |
| VPLQTM | Viêm phổi liên quan thở máy |
Chương I. TỔNG QUAN VỀ VIÊM PHỔI BỆNH VIỆN VÀ VIÊM PHỔI LIÊN QUAN THỞ MÁY
1. ĐỊNH NGHĨA
– Viêm phổi bệnh viện (VPBV) là viêm phổi xuất hiện sau khi vào viện 48 giờ mà không có biểu hiện hoặc ủ bệnh tại thời điểm vào viện. VPBV có thể chia ra VPBV không cần thở máy (nvHAP) và VPBV nặng đáp ứng kém với điều trị và cần thở máy (vHAP) [1-3].
– Viêm phổi liên quan thở máy (VPLQTM) là viêm phổi xuất hiện sau khi đặt ống nội khí quản 48 giờ [4].
– VPBV và VPLQTM được coi là hai nhóm bệnh riêng biệt.
– Hiện nay viêm phổi liên quan đến chăm sóc y tế không được coi là VPBV.
2. DỊCH TỄ
2.1. Tỷ lệ mắc bệnh
2.1.1. Trên thế giới
– Ở Mỹ và các nước phát triển:
+ Trong giai đoạn từ 1998 đến 2003, tỷ lệ VPLQTM ở Mỹ và các nước phát triển từ 9 đến 27% [5, 6].
+ Các dữ liệu gần đây cho thấy tỷ lệ mắc VPLQTM khoảng 10%, và không giảm hơn so với các thập kỉ trước [7].
+ VPBV nhìn chung ít nặng hơn so với VPLQTM, khoảng 52% số bệnh nhân có các biến chứng nặng (suy hô hấp, tràn dịch màng phổi, sốc nhiễm khuẩn, suy thận) [8].
+ Nghiên cứu phân tích gộp của Muscedere (2010) nhận thấy tỷ lệ tử vong ở nhóm bệnh nhân có VPLQTM là 33,5% so với nhóm bệnh nhân không bị viêm phổi là 16,0% [9].
– Ở các nước đang phát triển: theo một nghiên cứu phân tích gộp từ 220 công trình nghiên cứu trong thời gian 1995 đến 2008 về nhiễm trùng bệnh viện tại các nước đang phát triển, tỷ lệ VPLQTM là 19,8% – 48,0% với tần suất trung bình là 56,9/1000 ngày thở máy [10].
– Khu vực châu Á:
+ Tại Úc, Singapore, Hàn Quốc tỷ lệ VPLQTM là 16% [11].
+ Tại Thái Lan, theo nghiên cứu của Unahalekhaka (2007) tần suất VPLQTM là 8,3/1000 ngày thở máy [12].
+ Tại Malaysia, một nghiên cứu tổng hợp tại 37 khoa hồi sức tích cực năm 2010, thấy tần suất VPLQTM trung bình là 10,1/1000 ngày thở máy [12].
+ Tại Trung Quốc (2018): nghiên cứu đa trung tâm trên 2492 bệnh nhân thở máy tại ICU trên 48 giờ thấy: 5% trong số đó đáp ứng tiêu chí VPLQTM, tần suất VPLQTM 4,5/1000 ngày thở máy, 29,5% VPLQTM sớm. Tỷ lệ tử vong trong 28 ngày là 45% [13].
2.1.2. Ở Việt Nam
Tình hình VPLQTM có thay đổi tùy vào các bệnh viện và giai đoạn:
– Trong giai đoạn từ 2004 – 2010: tỷ lệ VPLQTM tại các Bệnh viện Bạch Mai, BV Chợ Rẫy và một số bệnh viện khác là 21,3% – 64,8%.
– Trong giai đoạn từ 2011 – 2015: tỷ lệ VPLQTM tại khoa Hồi sức tích cực Bệnh viện Bạch Mai, BV Chợ Rẫy và BV Nhân dân Gia Định là 30,0 – 55,3% [14-16]. Tần suất VPLQTM ở Khoa Hồi sức tích cực BV Bạch Mai năm 2015 là 24,8/1000 ngày thở máy [17].
2.2. Các yếu tố nguy cơ
Các yếu tố nguy cơ VPBV và VPLQTM gồm: tuổi cao (> 55), bệnh mạn tính, hít phải, phẫu thuật bụng/hoặc ngực, đang có catheter tĩnh mạch hoặc catheter theo dõi áp lực nội sọ liên tục, tăng pH dịch dạ dày (do dùng ức chế bơm proton, kháng H2 hoặc kháng acid (a-xít)), dùng kháng sinh kéo dài đặc biệt phổ rộng, hội chứng suy hô hấp cấp tiến triển, thay dây dẫn khí máy thở thường xuyên, đa chấn thương, liệt, suy dinh dưỡng, suy thận mạn tính [6, 9, 18].
Thời gian thở máy cũng là yếu tố quan trọng liên quan đến viêm phổi. Thời gian thở máy càng ngắn, tỷ lệ viêm phổi càng thấp. Cai thở máy sớm, sử dụng thở máy không xâm nhập đã chứng minh được là có vai trò làm giảm tỷ lệ VPLQTM [19].
2.3. Căn nguyên vi sinh vật và đề kháng kháng sinh
Trong hướng dẫn này chúng tôi chỉ xem xét căn nguyên vi khuẩn, căn nguyên nấm sẽ được xem xét trong “Hướng dẫn chẩn đoán và điều trị nhiễm nấm xâm lấn“ đã được cập nhật và ban hành năm 2021.
2.3.1. Trên thế giới
Năm 2009 –2010, theo báo cáo của CDC, trong số8474 trường hợp VPLQTM tại Mỹ, các căn nguyên vikhuẩn thường gặp là: Staphylococcus aureus(24,1%), Pseudomonasaeruginosa(16,6%),Klebsiellaspecies (10,1%),Enterobacterspecies (8,6%), Acinetobacter baumannii(6,6%) và Escherichia coli (5,9%)[20].
Nghiên cứu phân tích gộp của Jones, tổng hợp các nghiên cứu ở châu Âu, Bắc Mỹ và Mỹ La tinh trong giai đoạn từ 1997 đến 2008 thấy rằng các vi khuẩn hay gặp nhất gây VPBV và VPLQTM là Staphylococcus aureus (28,0%), tiếp theo là Pseudomonas aeruginosa (21,8%), Klebsiella species (9,8%), Escherichia coli (6,9%) và Acinetobacter species (6,8%) [21].
Theo nghiên cứu của Djordjevic tại Serbia (2017), căn nguyên gây VPBV và VPLQTM thường gặp nhất ở các khoa Hồi sức là Acinetobacter spp và Pseudomonas aeruginosa, chiếm trên 60% [22].
Dưới đây là bảng tổng hợp căn nguyên vi sinh vật và đề kháng chính của vi sinh vật gây VPLQTM (VAP), viêm khí phế quản liên quan thở máy (VAT) và VPBV (HAP) không thở máy được điều trị tại ICU (dữ liệu từ các nghiên cứu được công bố từ năm 2010 đến năm 2019).[21, 23-30]
| Nghiên cứu | Loại nhiễm trùng | Tác nhân sinh học | ||||
| Ferrer et al. | HAP | S.aureus, 17,7% | P.aeruginosa, 17,7% | E.coli, 6,5% | Enterobacter spp., 4,3% | K.pneumoniae, 3.2% |
| Nseir et al. | VAP | P.aeruginosa, 24% | S. aureus, 23% | E. coli, 7% | Enterobacter spp., 6% | H. influenzae, 4% |
| Restrepo et al. | VAP | S. aureus, 38,7% | H.influenzae, 23,4% | P.aeruginosa, 14,7% | K.pneumoniae, 11,5% | E. coli, 11,1% |
| MDR, 30% | ||||||
| Quartin et al. | VAP | S. aureus, 60,3% | P.aeruginosa, 9,4% | Acinetobacter spp., 7,3% | Klebsiella spp., 6,8% | Enterobacter spp., 5,1% |
| Martín- Loeches et al. | VAT | P.aeruginosa, 25% | S. aureus, 23% | Klebsiella spp., 15% | E. coli, 12% | Enterobacter spp., 11% |
| MDR, 61% | ||||||
| VAP | P.aeruginosa, 24% | S. aureus, 24% | Klebsiella spp., 14% | Enterobacter spp., 12% | E. coli, 11% | |
| MDR, 61% | ||||||
| ECDC | VAP | P.aeruginosa, 20,8% | S. aureus, 17,8% | Klebsiella spp., 16,1% | E. coli, 13,3% | Enterobacter spp., 10,3% |
| Nghiên cứu | Loại nhiễm trùng | Tác nhân sinh học | ||||
| Koulenti et al. | HAP | Enterobacteriaceae, 32,9% | S. aureus, 24,9% | P.aeruginosa, 17,4% | A. baumanii, 15,4% | |
| ENVIN- HELICS |
VAP | P. aeruginosa, 23,8% | S. aureus, 13,5% | Klebsiella spp., 10,3% | E. coli, 9.1% | Enterobacter spp., 8,6% |
| PIP/TAZ R, 34,1% Carba R, 37,9% Colistin R, 8,6% |
MRSA, 12,7% | PIP/TAZ R, 50% Carba R, 23,5% 3°G cef R, 37% |
PIP/TAZ R, 21,7% Carba R, 0% 3°G cef R, 12,5% |
|||
| Pulido et al. | VAP | P. aeruginosa, 21,1% | A. baumanii, 17,9% | K.pneumoniae, 15,6% | S. aureus, 13,3% | E. coli, 7,8% |
| Huang et al. | VAP | A. baumanii, 33,9% | K. pneumoniae, 23,6% | P. aeruginosa, 19,8% | S. aureus, 7,1% | S.maltophilia, 3,8% |
| Carba R, 76,4% | Carba R, 44% | Carba R, 59,5% | MRSA, 60% | |||
| Ibn Saied et al. | VAP | P. aeruginosa, 33,5% | Enterobacteriacea e, 32,3% | S. aureus, 19% | S.pneumoniae, 4,9% | S.maltophilia, 4,7% |
Carba: carbapenem, HAP: viêm phổi bệnh viện, MDR: đa kháng thuốc, VAP: viêm phổi liên quan đến thở máy, VAT: viêm khí- phế quản liên quan đến thở máy, PIP/TAZ: piperacillin/tazobactam, R: resistance, 3°G cef: cephalosporin thế hệ 3
Liên quan đến dịch tễ VPBV, VPLQTM và COVID – 19: Một phân tích tổng hợp vào tháng 5 năm 2021 cho thấy tỷ lệ VPLQTM tăng ở bệnh nhân COVID so với bệnh nhân không COVID. Tỷ lệ VPLQTM trung bình là 45,4%, dao động từ 7,6 – 86% tuỳ từng nghiên cứu. Những khác biệt về tỷ lệ VPLQTM này có thể là do sự khác biệt về bối cảnh lâm sàng, các yếu tố bệnh nhân (chẳng hạn như lý do nhập viện và mức độ nghiêm trọng của bệnh) và tiêu chuẩn chẩn đoán VPLQTM được sử dụng trong mỗi nghiên cứu. Tỷ lệ tử vong do ICU là 42,7% ở những bệnh nhân COVID bị bệnh nặng, nhưng không hẳn là do VPLQTM. Thời gian lưu trú trung bình ở ICU là 28,58 ngày. Fumagalli và cộng sự đã mô tả tỷ lệ VPLQTM là ∼50%, với dao động từ 21–64%. Đợt đầu tiên của VPLQTM thường được phát hiện từ ngày 8 đến ngày 12 của thông khí xâm nhập. Thời gian thở máy trung bình là 12–30 ngày. Tử vong ICU của bệnh nhân COVID với VPLQTM tương tự như ở bệnh nhân không COVID với VAP, ở mức ∼40–55% tương tự với những phát hiện của Fumagalli và cộng sự. Jain và cộng sự đã mô tả tỷ lệ VPLQTM ở bệnh nhân COVID là 48,15%, với tỷ lệ tử vong là 51,4%. Bệnh nhân COVID có nguy cơ VPLQTM tăng so với những bệnh nhân không COVID. Bệnh nhân nam có nguy cơ tăng VPLQTM. Blonz và cộng sự cho thấy tỷ lệ VPLQTM là 48,9%, với tỷ lệ tái phát là 19,7%. VPLQTM được chứng minh là xảy ra muộn khi thở máy. NSEIR và cộng sự đã mô tả mối liên quan giữa VPLQTM và sự gia tăng tỷ lệ tử vong trong 28 ngày ở bệnh nhân COVID. Tuy nhiên, con số này không cao hơn bất kỳ bệnh nhân bị cúm hoặc được đặt nội khí quản vì lý do không phải do virus [31].
Một phân tích tổng hợp của Ippolito và cộng sự đã chứng minh rằng vi khuẩn trong VPLQTM chủ yếu các vi khuẩn gram âm: Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp và Escherichia coli, cùng với vi khuẩn gram dương S. aureus và Enterococcus faecium phù hợp với các mô tả trước đây. Fumagalli và cộng sự đã mô tả > 50% vi khuẩn phát triển là gram âm. Blonz và cộng sự đã chứng minh rằng Enterobacteriae chiếm một nửa vi sinh vật và Pseudomonas chiếm 15,1%. Papazian và cộng sự đã mô tả cách thức các vi sinh vật gây VPLQTM có thể khác nhau tùy thuộc vào nhiều yếu tố: bao gồm thời gian nằm viện và thời gian nằm ICU, thời gian thở máy, các chủng vi khuẩn tại chỗ và sử dụng thuốc kháng sinh. Các vi khuẩn được phân lập có thể không liên quan đến việc đặt nội khí quản; chúng có liên quan đến mức độ nghiêm trọng của bệnh lý có từ trước. Việc gia tăng sử dụng kháng sinh theo kinh nghiệm do đại dịch COVID-19 gây ra mối đe dọa gia tăng các sinh vật đa kháng thuốc trong tương lai [31].
Bảng 1.1. Tổng hợp các căn nguyên gây bệnh ở BN COVID-19 mắc VPLQTM [11]
| Tác giả | VK Gram (-) | VK Gram (+) | VK Kháng thuốc |
| Pickens CO. et al | H. influenzae 7%,
Stomatococcus spp. 7%, K. oxytoca 4%, M. catarrahalis 4% |
MSSA 39%, Streptococcus spp. 44%, Enterococcus 4%, |
MRSA 7% |
| Blonz G. et al. | Enterobacteria 49,8% Pseudomonas aeruginosa 15,1% | Staphylococcus aureus 13,7% Enterococcus faecalis 5,4% |
MRSA 1,5% Enterobacterales 3GC- resistant 52,5% |
| Grasselli G. et al. | P. aeruginosa 21%
Enterobacterales 14% Klebsiella spp. 11% |
S. aureus 28%
Enterococcus spp. 5% |
MRSA 51% P. aeruginosa 12% Enterobacterales 11% Enterococcus spp. 11% |
| Gragueb- Chatti I. et al | Enterobacteriaceae 64%
K. pneumoniae 20% K. aerogenes 22% Enterobacter cloacae 13% Non-fermenting GNB 32% including P. aeruginosa 81% S. maltophilia 11% Acinetobacter spp. 7% |
MSSA 58% Enterococcus 19% Corynebacterium 5% |
MRSA (7%) |
| Giacobbe D.R. et al | P. aeruginosa 36% K. pneumoniae 19% | S. aureus 23% | MRSA 10%
CR Gram-negative bacteria 32% |
| Rouzè A et al | P. aeruginosa 22,3%
Enterobacter Spp 18% Klebsiella Spp 11,5% E. coli 8,4% A. baumannii 7,3% |
MSSA 9.4%
Enterococcus spp. 3,1% S. pneumoniae 2,8% |
MDR bacteria 23,3%
MRSA 9,4% |
| Nseir S. et al. | P. aeruginosa 24,9%
Enterobacter 18% Klebsiella spp. 12,7% E. coli 9,2% A. baumannii 4,4% |
S. pneumoniae 3,4% Streptococcus spp. 0,5% | MDR 20.7%, with 2,9% of MRSA |
| Moretti M. et al. | K.pneumoniae 25,9%
K. oxytoca 11,11% K. aerogenes 7,4% P. aeruginosa 18,5% Enterobacter spp. 11,11% |
S. aureus 7,4% | MDR 66.67% including
ESBL Klebsiella spp. (29%); XDR 4,76% (1 P.aeruginosa VIM-producer) |
| Rouyer M. et al | Enterobacterales 55%
P. aeruginosa 19%. Other Gram-negative bacteria 7%. |
Gram-positive bacteria 29% | MDR 27% |
| Meawed TE et al | K.pneumoniae 41,1%
A. baumannii 27,4% P.aeruginosa 20,8% |
Không xác định | PDR
K. pneumoniae 41,1% XDR A. baumannii 27,4% ESBL P. aeruginosa 20,8% ESBL E. coli 9,1% MRSA 9,1% |
| Garcia- Vidal C. et al | P.aeruginosa 27,3%
S.maltophilia 18,2% K. pneumoniae 9% S. marcescens 9% |
S. aureus 36,5% | MDR Gram-negative bacteria were isolated in 7 patients: 3 were P. aeruginosa, 2 ESBL E. coli, 2 ESBL K. pneumoniae |
| Suarez-de- la-Rica A. et al. | Klebsiella spp. 25,7%
P. aeruginosa 31,4% E. coli 11,4% Serratia spp. 5,7% |
S.aureus (22,8%) | MDR bacteria 15,9%
Enterobacterales ESBL; VIM-producing K. pneumoniae; MRSA. |
| Martinez- Guerra BA. et al. | Enterobacter complex 42%
P. aeruginosa 14,5% Klebsiella spp. 13% S. maltophilia 8,7% |
Không xác định | AmpC producers 37,7%
ESBL producers 8,7% CRE 4,3% |
| Cohen R et al | P. aeruginosa 41,9%
K. pneumoniae 22,5% H. influenzae 12,9% E. cloacae 9,6% K. aerogenes 8% S. marcescens 6,4% |
S. aureus 37%
S. pneumoniae 6,4% S. agalactiae 4,8% |
MRSA CTX-M gene |
2.3.2. Ở Việt Nam
2.3.2.1. Các căn nguyên vi khuẩn gây VPBV và VPLQTM
Các nghiên cứu tại khoa Hồi sức tích cực của Bệnh viện Bạch Mai và Bệnh viện Chợ Rẫy nhận thấy tác nhân gây VPBV và VPLQTM thường gặp là các vi khuẩn Gram âm [15, 32-34].
Bảng 1.2. Tác nhân vi khuẩn gây VPLQTM ở Bệnh viện Bạch Mai và BV Chợ Rẫy
| Vi khuẩn | BV Bạch Mai | BV Chợ Rẫy [15] |
||
| 2011[35] | 2013[36] | 2015[17] | ||
| Acinetobacter baumannii | 59% | 56,7% | 66,2% | 61% |
| Pseudomonas aeruginosa | 7% | 8,5% | 8,8% | 11,7% |
| Klebsiella pneumoniae | 17% | 11,4% | 11,8% | 10,4% |
| Stenotrophomonas maltophilia | 0% | 4,1% | 0% | 0% |
| Escherichia coli | 1% | 1,4% | 0% | 5,2% |
| Staphylococcus aureus | 3% | 6,4% | 2,9% | 11,7% |
| Streptococcus pneumonia | 1% | 2,7% | 0% | 0% |
| Nấm | 13% | 0% | 11,7% | 0% |
Bảng 1.3. Tác nhân vi khuẩn ở bệnh nhân VPBV và VPLQTM ở một số bệnh viện khác
| Vi khuẩn | BV Nhân dân Gia Định[35] | BV Cấp cứu Trưng Vương[35] | Bệnh viện Lâm Đồng[37] | BV Thống Nhất[38] |
| Acinetobacter baumannii | 27,7% | 32,3% | 29,3% | 18,5% |
| Pseudomonas
aeruginosa |
25,0% | 7,7% | 14,7% | 38,1% |
| Klebsiellaspp | 33,3% | 13,8% | 24% | 28,2% |
| Enterobacter | 0% | 0% | 5,3% | 3,7% |
| Staphylococcus aureus | 0% | 15,4% | 14,7% | 13,2% |
| Escherichia coli | 8,3% | 9,7% | 9,3% | 3,7% |
| Proteus mirabilis | 0% | 0% | 1,3% | 0% |
| Stenotrophomonas
maltophilia |
2,8% | 0% | 0% | 0% |
Theo báo cáo giám sát kháng kháng sinh tại Việt Nam của Bộ y tế năm 2022 được tổng hợp từ dữ liệu năm 2020 của 16 bệnh viện từ 10 tỉnh của miền Bắc, miền Trung, miền Nam tham gia vào hệ thống giám sát kháng kháng sinh Quốc gia cho thấy trực khuẩn Gram âm vẫn chiếm ưu thế trong các căn nguyên gây viêm phổi phân lập được.
Bảng 1.4. Tỷ lệ % của 10 loài vi khuẩn gây bệnh thường gặp nhất trong bệnh phẩm đường hô hấp dưới (n=23.883)
| TT | Vi khuẩn | n | % |
| 1 | Acinetobacter baumannii | 5.991 | 25,1 |
| 2 | Klebsiella pneumoniae | 4.012 | 16,8 |
| 3 | Pseudomonas aeruginosa | 3.087 | 12,9 |
| 4 | Haemophilus influenzae | 2.605 | 10,9 |
| 5 | Streptococcus pneumoniae | 2.053 | 8,6 |
| 6 | Staphylococcus aureus | 1.598 | 6,7 |
| 7 | Moraxella catarrhalis | 1.200 | 5,0 |
| 8 | Escherichia coli | 873 | 3,7 |
| 9 | Stenotrophomonas maltophilia | 384 | 1,6 |
| 10 | Klebsiella aerogenes | 280 | 1,2 |
| Khác | 1.800 | 7,5 | |
| Tổng | 23.883 | 100 |
Mặc dù không đủ thông tin để phân loại căn nguyên VPBV và VPLQTM và viêm phổi cộng đồng nhưng S. pneumoniae, H. influenzae và M. catarrhalis chủ yếu phân lập từ các bệnh viện nhi còn các tác nhân còn lại chủ yếu từ các bệnh viện đa khoa. Trong đó, số lượng chủng thu thập được là rất lớn và tỷ trọng các chủng phân lập được từ Bệnh viện Bạch Mai, BV Chợ Rẫy, BV Việt Đức chiếm gần 50% và phần lớn là phân lập từ bệnh nhân VPBV, VPLQTM. Do vậy, bảng phân bố căn nguyên trên cũng phần nào phản ánh được bức tranh về tác nhân gây VPBV, VPLQTM ở Việt Nam.
Bảng 1.5. Tỷ lệ nhạy cảm với kháng sinh của 3 loài trực khuẩn gram thường gặp gây nhiễm trùng đường hô hấp dưới, phân lập được trong năm 2020 của 16 bệnh viện trong hệ thống giám sát kháng kháng sinh quốc gia
| Vi khuẩn | N | % S | |||||||||||||
| Pip/Taz | Ceftriaxon | Ceftazidim | Cefepim | Ertapenem | Imipenem | Meropenem | Gentamycin | Amikacin | Ciprofloxacin | Levofloxacin | Fosfomycin | Tri/Sul | Amp/Sul | ||
| A. baumannii | 5991 | 8,3 | – | 8,4 | 8,1 | – | 9,6 | 9,2 | 15,3 | 21,8 | 8,5 | 9,5 | – | 35,5 | 12,2 |
| P. aeruginosa | 3087 | 62,2 | – | 62,5 | 66,2 | – | 53,4 | 53,3 | 55,7 | 67,4 | 46,8 | 45,4 | – | – | – |
| K. pneumoniae | 4012 | 39,1 | 29,8 | 35,8 | 38,8 | 45,2 | 47,3 | 46,7 | 55,6 | 77,4 | 23,7 | 28,6 | 76,8 | 44,3 | – |
-: không thử nghiệm
2.3.2.2. Mức độ nhạy cảm với kháng sinh của các chủng vi khuẩn thường gặp
Bảng 1.6. Tỷ lệ nhạy cảm với kháng sinh của Acinetobacter baumannii
| Kháng sinh | BV Bạch Mai | BV Chợ Rẫy | BV Thống Nhất | BV Phạm Ngọc Thạch | BV 115 TPHCM |
|
| 2011[33] | 2015[17] | 2013[15] | 2014[37] | 2011[39] | 2012[16] | |
| Ceftriaxon | 0% | 0% | 0% | 7,1% | 0,9% | 0% |
| Ceftazidim | 0% | 0% | 4,3% | 9,2% | 0% | 0% |
| Cefepim | 0% | 0% | 0% | 13,3% | 3,2% | 0% |
| Levofloxacin | 0% | 0% | 0% | 31,6% | 0,9 % | 0% |
| Piperacillin+Taz | 0% | 0% | 0% | 18,4% | 5,6 % | 0% |
| Imipenem | 0% | 0% | 17,0% | 29,6% | 7,2% | 3% |
| Meropenem | 0% | 0% | 17,0% | 32,7% | 3,4% | 3% |
| Colistin | 100% | 100% | 100% | 83,7% | 100% | 100 |
| Minocyclin | 95,59% | 0% | – | – | – | – |
| Doxyciclin | 96,2% | 0% | 46,8% | – | – | 43,3% |
| Amikacin | 0% | 0% | 10,6% | 11,2% | 6,1% | 6% |
| Tobramycin | 0% | 0% | – | – | – | – |
Bảng 1.7. Mức độ nhạy cảm với kháng sinh của các chủng Klebsiella pneumoniae
| Loại kháng sinh | Bệnh viện Bạch Mai | BV Chợ Rẫy | BV Nhân dân Gia Định | BV Phạm Ngọc Thạch | |
| 2011[33] | 2015[35] | 2013[15] | 2016[40] | 2011[39] | |
| Meropenem | 90,9% | 85,7% | 62,5% | 28,0% | 67,7% |
| Ertapenem | 77,3% | 71,4% | 50,0% | 15,0% | – |
| Imipenem | 90,9% | 85,7% | 62,5% | 27,0% | 64,3% |
| Ceftazidim | 0% | 0% | 0% | 8,0% | 8,9% |
| Amikacin | 31,8% | 42,9% | 25% | 37,0% | 29,7% |
| Levofloxacin | 22,72% | 0% | 25% | 16,0% | 11,6% |
| Ciprofloxacin | 18,2% | 14,3% | 25% | 8,0% | 11,1% |
| Piperacilin + Tazobactam | 27,3% | 21,4% | 25% | 10% | 12,5% |
Bảng 1.8. Mức độ nhạy cảm với kháng sinh của các chủng Pseudomonas aeruginosa
| Kháng sinh | BV Bạch Mai | BV Chợ Rẫy | BV Phạm Ngọc Thạch | BV ND Gia Định | |
| 2011[33] | 2015[17] | 2013[15] | 2011[39] | 2009[35] | |
| Ceftazidim | 40% | 46,2% | 66,7% | 21,9% | 11,1% |
| Cefepim | 40% | 38,4% | 55,6% | 21,7% | 44,4 % |
| Piperacillin/taz | 60% | 61,5% | 66,7% | 35,8% | 55,6% |
| Cefoperazol/Sul | 53,3% | 53,8% | 66,7% | 29,9% | – |
| Amikacin | 53,3% | 53,8% | 55,6% | 15,4% | 77,8% |
| Tobramycin | 40% | 46,2% | – | – | – |
| Ciprofloxacin | 40% | 38,5% | 55,6% | 12,7% | 66,7% |
| Levofloxacin | 40% | 38,5% | – | 13,7% | – |
| Imipenem | 26,7% | 37,5% | 55,6% | 19,4% | 77,8% |
| Meronem | 40% | 50,0% | 66,7% | 20% | 77,8% |
| Colistin | – | 100% | 100% | 100% | – |
Bảng 1.9. Mức độ nhạy cảm với kháng sinh của các chủng Escherichia coli
| Kháng sinh | BV Bạch Mai | BV Chợ Rẫy | BV 115 TPHCM |
| 2013[33] | 2013.[15] | 2014[16] | |
| Ampicilin | 12,5 % | 0 % | – |
| Ertapenem | 88,9 % | 50% | – |
| Imipenem | 90,9 % | 50% | 0 % |
| Meropenem | 90 % | 75% | 0 % |
| Ceftazidim | 45,5% | 0% | 0 % |
| Ceftriaxon | 40 % | 0% | 0 % |
| Cefepim | 54,5 % | 0% | 0 % |
| Piperacillin + Tazobactam | 60 % | 50% | 0 % |
| Gentamycin | 54,5% | 25% | – |
| Amikacin | 81,8 % | 100% | 0 % |
| Ciprofloxacin | 30 % | 0% | 0 % |
| Levofloxacin | 36,4 % | 0% | 0 % |
| Colistin | 100 % | – | 100% |
Bảng 1.10. Mức độ kháng methicillin của các chủng Staphylococcus aureus tại Bệnh viện Bạch Mai[41]
| Loại bệnh phẩm | Số chủng | MRSA |
| Máu | 163 | 44,9 % |
| Mủ | 128 | 54,6 % |
| Dịch tiết hô hấp | 90 | 65,4 % |
Theo Phạm Hồng Nhung [41], hầu hết các chủng Staphylococcus aureus kháng với penicillin. Tỷ lệ Staphylococcus aureus đề kháng methicillin (MRSA) gia tăng trong vòng 10 năm vừa qua (năm 2003 15,6% và năm 2013 tỷ lệ MRSA trên 44,9%).
Theo các số liệu ở Bệnh viện Chợ Rẫy và Bệnh viện 115 TP. HCM [16]. Staphylococcus aureus phân lập được ở các bệnh viện này kháng hoàn toàn với methicillin (MRSA 100%).
Bảng 1.11. Mức độ nhạy cảm kháng sinh của các trực khuẩn gram âm
| Vi khuẩn | N | % S | ||||||||||||||
| Amp/Sul | Pip/Taz | Ceftriaxon | Ceftazidim | Cefepim | Ertapenem | Imipenem | Meropenem | Gentamycin | Amikacin | Ciprofloxacin | Levofloxacin | Fosfomycin | Tri/Sul | Minocyclin | ||
| A. baumannii | 5991 | 12,2 | 8,3 | – | 8,4 | 8,1 | 91,3 | 9,6 | 9,2 | 15,3 | 21,8 | 8,5 | 9,8 | – | 35,0 | 53,8 |
| P. aeruginosa | 3087 | – | 62,2 | – | 62,5 | 66,2 | – | 53,4 | 53,3 | 55,7 | 67,4 | 46,8 | 45,4 | – | – | – |
| K. pneumoniae | 4247 | – | 39,1 | 29,8 | 35,8 | 38,8 | 45,2 | 47,3 | 46,7 | 55,6 | 77,4 | 23,7 | 28,6 | 76,8 | 44,3 | – |
| E. coli | 873 | – | 71,3 | 20,2 | 39,8 | 41,4 | 81,5 | 84,7 | 86,1 | 51,1 | 92,3 | 17,7 | 18,8 | 93,4 | 28,9 | – |
Pip/Taz: Piperacillin/Tazobactam; Tri/Sul: trimethoprim/sulfamethoxazol; Amp/Sul: Ampicillin/sulbactam; -: Không áp dụng
Bảng 1.12. Mức độ nhạy cảm kháng sinh của S. aureus
| Vi khuẩn | N | % S | |||||||
| Penicillin | Oxacillin | Erythromycin | Clindamycin | Doxycycline | Tri/Sul | Vancomycin | Linezolid | ||
| Chung | 1598 | 3,2 | 24,9 | 25,2 | 30,1 | 70,9 | 74,3 | 100,0 | 100,0 |
| MRSA | 1200 | R | R | 16,4 | 21,4 | 67,5 | 71,8 | 100,0 | 100,0 |
| MSSA | 398 | 11,7 | 100.0 | 51,8 | 56,4 | 81,3 | 82,0 | 100,0 | 100,0 |
Tri/Sul: trimethoprim/sulfamethoxazol; Vancomycin MIC50 và MIC90 = 1 µg/ml
Chương II. CHẨN ĐOÁN VIÊM PHỔI BỆNH VIỆN VÀ VIÊM PHỔI LIÊN QUAN THỞ MÁY
1. CÁC TRIỆU CHỨNG LÂM SÀNG VÀ XÉT NGHIỆM
1.1. Lâm sàng
– Viêm phổi bệnh viện: VPBV thường gặp ở người bệnh tại khoa Hồi sức tích cực, là một viêm phổi mới (nhiễm trùng đường hô hấp dưới xác định bằng sự hiện diện của một thâm nhiễm phổi mới trên hình ảnh học) phát triển sau 48 giờ kể từ khi nhập viện ở người bệnh không đặt nội khí quản [42].
– Viêm phổi liên quan thở máy: là nhiễm khuẩn bệnh viện thường gặp nhất và tử vong cao ở khoa Hồi sức tích cực, là viêm phổi mới phát triển sau 48 giờ đặt nội khí quản. Quan trọng hơn ở thời điểm VPLQTM, người bệnh có thể đã được rút nội khí quản [42].
Tiêu chí lâm sàng:
+ Nhiệt độ > 38 độ C hoặc < 36 độ C
+ Bệnh nhân ≥ 70 tuổi có thay đổi ý thức mà không thấy nguyên nhân nào khác rõ ràng. Ở những bệnh nhân cao tuổi thay đổi ý thức thường hay gặp hơn các dấu hiệu đường hô hấp [42].
+ Đờm mủ mới xuất hiện, hoặc thay đổi tính chất đờm, hoặc tăng tiết đờm, hoặc cần tăng số lần hút đờm.
+ Ho mới xuất hiện hoặc nhiều lên, hoặc khó thở, hoặc thở nhanh.
+ Nghe phổi có ran nổ hoặc ran phế quản.
+ Tình trạng trao đổi khí xấu đi: giảm oxy máu (giảm độ bão hòa oxy máu, VD: PaO2/FiO2 ≤ 240), cần tăng nồng độ oxy khí thở vào (FiO2), hoặc cần thở máy và/hoặc tăng PEEP.
1.2. Xét nghiệm máu
– Công thức máu: tăng bạch cầu (≥ 12 x 109/L) hoặc giảm bạch cầu (≤ 4 x 109/L) [43].
– Tăng nồng độ procalcitonin máu. Procalcitonin là chất chỉ thị viêm, tăng trong trường hợp nhiễm khuẩn mà không tăng trong nhiễm virus, có thể giúp phân biệt giữa nhiễm vi khuẩn và virus. Trong VPBV và VPLQTM, nồng độ procalcitonin thường không được dùng như một tiêu chuẩn chẩn đoán xác định, nhưng có giá trị trong việc theo dõi đáp ứng điều trị và để quyết định ngừng kháng sinh [5, 44-48].
– Tăng nồng độ protein phản ứng C (CRP). Trong VPBV và VPLQTM, nồng độ CRP thường không được dùng như một tiêu chuẩn chẩn đoán xác định [5].
1.3. X-quang ngực
– Tổn thương mới xuất hiện hoặc tổn thương tiến triển trên phim phổi và không mất đi nhanh, có thể chụp X-quang phổi hoặc chụp cắt lớp vi tính phổi [5].
– Các dạng tổn thương trên phim phổi có thể gặp là: thâm nhiễm, đông đặc, tạo hang [5].
1.4. Xét nghiệm vi khuẩn
* Vi khuẩn trong đờm
– Kỹ thuật lấy bệnh phẩm: bệnh phẩm có thể lấy bằng phương pháp không xâm nhập hoặc xâm nhập [49].
+ Kỹ thuật lấy bệnh phẩm không xâm nhập:
- Đờm khạc: bệnh nhân súc họng bằng nước muối sinh lý sau đó ho khạc đờm vào lọ vô khuẩn. Nên tiến hành vỗ rung trước khi ho khạc.
- Đờm khí dung: cách lấy đờm tương tự phương pháp lấy đờm khạc nhưng trước khi khạc đờm bệnh nhân được khí dung nước muối ưu trương 2 – 10% trong 15 – 30 phút. Nên tiến hành vỗ rung trước khi ho khạc.
Đờm hút hầu họng: dùng ống thông vô khuẩn hút đờm ở vùng hầu họng. Biện pháp này áp dụng cho những bệnhnhân không có khả năng ho khạc đờm.
Nhược điểm của phương pháp không xâm nhập là dễ tạp nhiễm vi khuẩn.
+ Kỹ thuật lấy bệnh phẩm xâm nhập:
∙ Ở bệnh nhân không có ống nội khí quản:
✔ Lấy bệnh phẩm bằng cách chọc qua màng nhẫn giáp khí quản: dùng một catheter 18 – 20 F luồn qua màng nhẫn giáp khí quản xuống phế quản để hút dịch phế quản. Phương pháp này áp dụng cho bệnh nhân không đặt ống nội khí quản.
∙ Ở bệnh nhân có ống nội khí quản:
✔ Kỹ thuật lấy dịch phế quản bằng rửa phế quản phế nang qua nội soi phế quản: bơm 150 ml nước muối sinh lý vô khuẩn vào khu vực phế nang tổn thương qua ống nội soi sau đó hút triệt để lượng dịch đã bơm để làm các xét nghiệm vi sinh cần thiết.
✔ Kỹ thuật chải phế quản: qua ống nội soi dùng bàn chải có đầu bảo vệ để chải vùng tổn thương và lấy bệnh phẩm làm các xét nghiệm vi sinh cần thiết.
+ Cấy bán định lượng và cấy định lượng:
∙ Cấy bán định lượng là phương pháp cấy tìm vi khuẩn sau đó dựa vào khoảng nồng độ vi khuẩn để đưa ra các kết quản ước lượng 1+, 2+, 3+ và 4+.
∙ Cấy định lượng là phương pháp cấy cho ra nồng độ vi khuẩn trong 1 mL bệnh phẩm.
∙ Hiện nay các cơ sở y tế có điều kiện có thể thực hiện kỹ thuật PCR lồng đa tác nhân (nested multiplex PCR) hoặc kỹ thuật Film Array Bioassay với panel viêm phổi để chẩn đoán tác nhân gây bệnh viêm phổi bằng cách khuếch đại acid nucleic từ đờm hoặc dịch rửa phế quản phế nang (BAL). Xét nghiệm có thể cho kết quả sớm với nhiều tác nhân gây bệnh, rút ngắn thời gian chẩn đoán và tối ưu trị liệu kháng sinh. Tuy nhiên việc biện luận kết quả cần thận trọng vì xét nghiệm có thể xác định các tác nhân có thể là khúm khuẩn thường trú (colonization) hoặc tác nhân gây bệnh được phát hiện có thể phối hợp giữa vi khuẩn và virus, hoặc đa vi khuẩn.
Theo hướng dẫn của ATS/IDSA về quản lý VPBV và VPLQTM, nên cấy bán định lượng với bệnh phẩm lấy bằng
phương pháp không xâm nhập để xác định loại vi khuẩn gây VPBV và VPLQTM.
* Cấy máu
Nên cấy máu một cách hệ thống cho các bệnh nhân nghi ngờ VPBV/VPLQTM. Cần cấy đồng thời 2 mẫu máu lấy ở 2 vị trí khác nhau [12].
2. TIÊU CHUẨN CHẨN ĐOÁN
2.1. Chẩn đoán xác định
Chẩn đoán VPBV và VPLQTM dựa vào;
– Cấy bán định lượng hoặc xét nghiệm PCR bệnh phẩm với phương pháp không xâm nhập.
– Cấy định lượng dịch phế quản hoặc dịch rửa phế quảnphế nang với phương pháp xâm nhập nội soi ống mềm hoặc chải bảo vệ phế quản phế nang (BAL – mini BAL).
– Cấy máu.
– Hình ảnh học X-quang ngực hoặc chụp cắt lớp vi tính (CT scan) phổi.
– Siêu âm phổi (phối hợp với hỏi bệnh sử người bệnh, thăm khám lâm sàng và phân tích xét nghiệm): là phương pháp hình ảnh học tiềm năng thực hiện tại giường trong chẩn đoán viêm phổi.
Chẩn đoán VPBV và VPLQTM sau 48 giờ kể từ khi nhập viện hoặc sau khi đặt ống nội khí quản, xuất hiện các dấu hiệu lâm sàng/xét nghiệm và tổn thương trên phim phổi, theo các tiêu chuẩn sau.
Các dấu hiệu lâm sàng và xét nghiệm:
Ít nhất là một trong các dấu hiệu sau:
+ Nhiệt độ > 38 độ C (ít nhất 2 lần) hoặc < 36 độ C loại trừ các nguyên nhân khác.
+ Tăng bạch cầu (≥ 12 x 109/L) hoặc giảm bạch cầu (≤ 4 x 109/L).
+ Thay đổi ý thức ở bệnh nhân cao tuổi (> 70 tuổi) loại trừ các nguyên nhân khác và ít nhất hai trong các dấu hiệu sau:
∙ Đờm mủ hoặc thay đổi tính chất của đờm hoặc tăng tiết đờm hoặc tăng nhu cầu hút đờm [43].
∙ Ho hoặc ho tăng lên, hoặc khó thở hoặc thởnhanh.
+ Khám phổi có ran.
+ Xét nghiệm khí máu xấu đi: giảm oxy máu, tăng nhu cầu oxy hoặc cần thở máy cần tăng nồng độ oxy khí thở vào (FiO2), hoặc cần thở máy và/hoặc tăng PEEP.
Tổn thương trên phim phổi:
Tổn thương mới xuất hiện hoặc tổn thương tiến triển trên phim phổi và không mất đi nhanh, có thể chụp X-quang phổi hoặc chụp cắt lớp vi tính phổi. Các dạng tổn thương trên phim phổi có thể gặp là: thâm nhiễm, đông đặc, tạo hang.
Chú ý: khi có đủ tiêu chuẩn chẩn đoán như trên, cần phải chỉ định điều trị kháng sinh kinh nghiệm ngay, không cần chờ kết quả xét nghiệm procalcitonin hoặc protein phản ứng C (CRP) [50].
2.2. Chẩn đoán nguyên nhân
– VPBV dựa vào cấy bán định lượng bệnh phẩm không xâm nhập [51].
– VPLQTM dựa vào cấy bán định lượng bệnh phẩm không xâm nhập [51].
– Tác nhân gây bệnh thường gặp của VPBV là Streptococcus pneumoniae, Staphylococcus aureus, và các chủng vi khuẩn gram âm (GNB) như Escherichia coli, Pseudomonas aeruginosa, Acinetobacter baumanii và Klebsiella pneumoniae.
– Tác nhân gây bệnh thường gặp nhất của VPLQTM là Escherichia coli, Pseudomonas aeruginosa, Acinetobacterbaumannii, Klebsiella pneumoniae, và Staphylococcus aureus (gồm cả MRSA). Những vi sinh vật gây bệnh ghi nhận được trong dịch tiết hô hấp chủ yếu là các trực khuẩn gram âm. Thêm vào đã ghi nhận Escherichia coli có mức độ kháng thuốc cao [52]. Vi khuẩn yếm khí là tác nhân không thường gặp của VPLQTM. Có thể gặp nhiễm đa vi khuẩn trong VPLQTM, đặc biệt viêm phổi từ đường hô hấp. Viêm phổi liên quan đến nhiễm virus và nhiễm nấm bệnh viện cũng vậy là nguyên nhân chính gây tử vong ở người bệnh suy giảm miễn dịch [43].
2.3. Nguy cơ nhiễm vi khuẩn đa kháng
– Nguy cơ nhiễm vi khuẩn đa kháng thuốc trong VPBV: Điều trị kháng sinh tĩnh mạch trong vòng 90 ngày trước đó.
– Nguy cơ nhiễm vi khuẩn đa kháng thuốc trong VPLQTM.
+ Điều trị kháng sinh tĩnh mạch trong vòng 90 ngày trước đó.
+ Sốc nhiễm khuẩn tại thời điểm chẩn đoán VPLQTM. + VPLQTM xuất hiện sau ARDS.
+ Nằm viện quá 5 ngày.
+ Lọc máu cấp cứu.
2.4. Chẩn đoán mức độ nặng
– VPBV mức độ nặng: có suy hô hấp và/hoặc tụt huyết áp [51].
– VPLQTM mức độ nặng: PaO2/FiO2 giảm nặng và/hoặc tụt huyết áp.
– Bệnh nhân có nhiễm khuẩn huyết hoặc viêm phổi do vi khuẩn đa kháng [51].
– Bệnh nhân có các bệnh lý nặng khác đi kèm.
Chương III. ĐIỀU TRỊ VIÊM PHỔI BỆNH VIỆN VÀ VIÊM PHỔI LIÊN QUAN THỞ MÁY
1. NGUYÊN TẮC
Trong điều trị viêm phổi bệnh viện và viêm phổi liên quan thở máy, kháng sinh phải được chỉ định sớm nhất có thể được (trong vòng 1 giờ đầu nếu có kèm theo sốc nhiễm khuẩn).
Khi nghĩ đến viêm phổi bệnh viện hoặc viêm phổi liên quan thở máy, khuyến cáo hiện nay là dựa vào tiêu chuẩn lâm sàng đơn thuần, hơn là dựa vào thay đổi nồng độ procalcitonin/protein phản ứng C kết hợp với tiêu chuẩn lâm sàng để quyết định điều trị kháng sinh ban đầu [5, 46].
1.1. Điều trị kháng sinh ban đầu theo kinh nghiệm
– Các kháng sinh được chọn phải bao phủ được các vi khuẩn có khả năng là tác nhân gây bệnh. Việc dự đoán loại vi khuẩn gây bệnh và chọn kháng sinh nên dựa vào dữ liệu vi khuẩn và mức độ nhạy cảm kháng sinh của vi khuẩn tại mỗi cơ sở điều trị cụ thể [5, 46].
– Lựa chọn kháng sinh ban đầu cũng cần dựa vào mức độ nặng của viêm phổi và nguy cơ nhiễm vi khuẩn đa kháng [5, 46].
– Liều lượng và cách dùng thuốc phải tuân thủ các nguyên tắc dược lực và dược động học của kháng sinh được dùng [5].
1.2. Điều chỉnh kháng sinh khi có kết quả xét nghiệm vi khuẩn và kháng sinh đồ
– Đánh giá hiệu quả của điều trị ban đầu sau 48-72 giờ [5].
– Nếu bệnh nhân đáp ứng điều trị và kháng sinh ban đầu phù hợp với kháng sinh đồ thì giữ nguyên kháng sinh đang điều trị và xem xét xuống thang kháng sinh. Lưu ý, đáp ứng lâm sàng có ý nghĩa quan trọng.
– Nếu bệnh nhân không đáp ứng với điều trị và kháng sinh ban đầu không phù hợp cần điều chỉnh kháng sinh theo kết quả kháng sinh đồ.
– Nếu bệnh nhân không đáp ứng với điều trị mặc dù kháng sinh đang dùng phù hợp với kết quả kháng sinh đồ, cần làm lại xét nghiệm vi sinh, tìm ổ di bệnh hoặc một nguyên nhân khác gây sốt (nấm, …).
1.3. Thời gian dùng kháng sinh
– Thời gian điều trị kháng sinh thông thường là 7 ngày nếu không phải là vi khuẩn đa kháng và bệnh nhân có đáp ứng tốt với điều trị ban đầu [5].
– Quyết định ngừng kháng sinh dựa vào đáp ứng lâm sàng và kết quả xét nghiệm procalcitonin. Nồng độ procalcitonin được khuyến cáo để xem xét ngừng kháng sinh là 0,25 – 0,5 ng/lít [48].
* Cần chú ý đảm bảo việc điều trị toàn diện: hồi sức tích cực, điều trị biến chứng, chăm sóc hô hấp, điều trị các bệnh kèm theo, nuôi dưỡng, dự phòng tắc mạch,…
2. ĐIỀU TRỊ KHÁNG SINH BAN ĐẦU THEO KINH NGHIỆM
2.1. Viêm phổi bệnh viện
* Bệnh nhân VPBV có nguy cơ tử vong cao:
– VPBV phải thở máy.
– Có sốc nhiễm khuẩn.
* Bệnh nhân VPBV có nguy cơ mắc vi khuẩn đa kháng thuốc:
Đã dùng kháng sinh tĩnh mạch trong vòng 90 ngày trước đó.
* Bệnh nhân VPBV có nguy cơ cao mắc trực khuẩn gram âm và Pseudomonas aeruginosa đa kháng thuốc:
– Đã dùng kháng sinh tĩnh mạch trong vòng 90 ngày trước đó.
– Bệnh phổi cấu trúc: giãn phế quản hoặc bệnh xơ nang.
– Đã phân lập được trước đó hoặc có trực khuẩn gram âm và Pseudomonas aeruginosa đa kháng cư trú.
* Bệnh nhân VPBV có nguy cơ cao mắc MRSA:
– Đã dùng kháng sinh tĩnh mạch trong vòng 90 ngày trước đó.
– Điều trị tại đơn vị có tỷ lệ MRSA > 10%.
– Điều trị tại đơn vị chưa biết tỷ lệ MRSA.
Đã phân lập được trước đó hoặc có MRSA cư trú.
Bảng 3.1. Các kháng sinh ban đầu điều trị theo kinh nghiệm viêm phổi bệnh viện [5, 46-49]
| Viêm phổi bệnh viện không phải mức độ nặng và không có nguy cơ nhiễm vi khuẩn đa kháng | Viêm phổi bệnh viện nặng hoặc có nguy cơ nhiễm vi khuẩn đa kháng | Viêm phổi bệnh viện không phải mức độ nặng nhưng có nguy cơ nhiễm Staphylococcus aureus kháng methicillin |
| Một trong những lựa chọn sau | Hai trong các lựa chọn sau, tránh dùng 2 beta lactam | Một trong những lựa chọn sau |
| + Piperacillin tazobactam 4,5g truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ [51, 52] | + Piperacillin tazobactam 4,5g truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ. Có thể cân nhắc truyền liên tục 20 g/ngày sau khi dùng liều bolus ban đầu 4,5 g truyền tĩnh mạch trong 30 phút [51, 52] | + Piperacillin-tazobactam 4,5g truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ [51, 52] |
| HOẶC | HOẶC | HOẶC |
| + Cefepim 2g truyền tĩnh mạch trong 3 giờ, mỗi 8 giờ [51, 52] | + Cefepim [51, 52] hoặc ceftazidim 2g truyền tĩnh mạch trong 3 giờ, mỗi 8 giờ. Có thể cân nhắc truyền liên tục cefepim hoặc ceftazidim 6 g/ngày sau khi dùng liều bolus 15 mg/kg truyền tĩnh mạch trong 30 phút | + Cefepim 2g truyền tĩnh mạch trong 3 giờ, mỗi 8 giờ [51, 52] |
| HOẶC | ||
| + Levofloxacin
. 750mg truyền tĩnh mạch mỗi 24 giờ . hoặc 500 mg truyền tĩnh mạch mỗi 12 giờ |
+ Levofloxacin
. 750mg truyền tĩnh mạch mỗi 24 giờ hoặc 500 mg truyền tĩnh mạch mỗi 12 giờ + Ciprofloxacin 400mg truyền tĩnh mạch mỗi 8 giờ |
+ Levofloxacin
. 750mg truyền tĩnh mạch mỗi 24 giờ hoặc 500 mg truyền tĩnh mạch mỗi 12 giờ + Ciprofloxacin 400mg truyền tĩnh mạch mỗi 8 giờ |
| HOẶC | HOẶC | HOẶC |
| + Imipenem 500mg truyền tĩnh mạch mỗi 6 giờ*
+ Meropenem 1 g truyền tĩnh mạch mỗi 8 giờ |
+ Imipenem 0,5 g-1g truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ hoặc truyền liên tục qua bơm tiêm điện (thay thuốc mỗi 3 giờ)*
+ Meropenem 1-2 g truyền tĩnh trong mạch trong 3 giờ, mỗi 8 giờ, hoặc truyền liên tục qua bơm tiêm điện (thay thuốc mỗi 3 giờ)* |
+ Imipenem 500mg truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ*
+ Meropenem 1 g truyền tĩnh mạch trong 3 giờ, mỗi 8 giờ[51, 52] |
| HOẶC | HOẶC | |
| + Amikacin 20mg/kg truyền tĩnh mạch mỗi 24 giờ.**
+ Gentamycin 5 – 7mg/kg truyền tĩnh mạch mỗi 24 giờ + Tobramycin 5- 7mg/kg truyền tĩnh mạch mỗi 24 giờ |
Aztreonam 2g truyền tĩnh mạch mỗi 8 giờ | |
| HOẶC | ||
| Aztreonam 2g truyền tĩnh mạch mỗi 8 giờ | ||
| Xem xét kết hợp | Kết hợp | |
| Vancomycin 15 -20 mg/kg truyền tĩnh mạch trong 1-2 giờ, mỗi 8 giờ hoặc mỗi 12 giờ (cân nhắc liều nạp 25-30 mg/kg trước khi sử dụng liều duy trì với những trường hợp nặng). Cân nhắc hiệu chỉnh liều theo nồng độ thuốc trong máu để đảm bảo hiệu quả điều trị. Có thể cân nhắc chế độ liều truyền liên tục cho các bệnh nhân nặng*** | – Vancomycin 15 -20 mg/kg truyền tĩnh mạch trong 1-2 giờ, mỗi 8 giờ hoặc mỗi 12 giờ (cân nhắc liều nạp 25-30 mg/kg trước khi sử dụng liều duy trì với những trường hợp nặng). Cân nhắc hiệu chỉnh liều theo nồng độ thuốc trong máu để đảm bảo hiệu quả điều trị. Có thể cân nhắc chế độ liều truyền liên tục cho các bệnh nhân nặng*** | |
| HOẶC | HOẶC | |
| – Teicoplanin
Liều nạp: 6 mg/kg/12 giờ x 3 – 4 liều (400mg) truyễn tĩnh mạch trong 30 phút – 1 giờ. Liều duy trì: 6 mg/kg/24 giờ (400mg) truyền tĩnh mạch trong 30 phút – 1 giờ. |
– Teicoplanin
Liều nạp: 6 mg/kg/12 giờ x 3 – 4 liều (400mg) truyễn tĩnh mạch trong 30 phút – 1 giờ. Liều duy trì: 6 mg/kg/24 giờ (400mg) truyền tĩnh mạch trong 30 phút – 1 giờ. |
|
| HOẶC | HOẶC | |
| Linezolid 600mg truyền tĩnh mạch mỗi 12 giờ | Linezolid 600mg truyền tĩnh mạch mỗi 12 giờ |
* Chú thích:
(*) Sử dụng imipenem, meropenem: cân nhắc sử dụng liều bolus đầu tiên (đặc biệt cho các bệnh nhân thừa cân (BMI ≥ 30), các bệnh nhân có giảm albumin máu (dưới 25 g/L), bệnh nhân có tăng thanh thải thận (mức lọc cầu thận ước tính theo thanh thải creatinin > 130 ml/phút), các trường hợp viêm phổi bệnh viện, viêm phổi thở máy nặng, nghi ngờ do tác nhân vi sinh vật đa kháng thuốc): 0,5 g-1g truyền tĩnh mạch trong 30 phút – 1 giờ trước khi truyền kéo dài hoặc truyền liên tục thuốc để nhanh chóng đạt được nồng độ hữu hiệu của kháng sinh tại mô nhiễm trùng.
(**) Trường hợp nặng nghi ngờ do Klebsiella pneumoniae kháng carbapenem cân nhăc sử dụng amikacin liều cao 25-30 mg/kg, kết hợp với giám sát nồng độ thuốc trong máu để xác định khoảng cách đưa liều và giảm thiểu độc tính trên thận của thuốc.
(***) Giám sát nồng độ thuốc trong máu để hiệu chỉnh liều với vancomycin được khuyến cáo theo đồng thuận của Hội Truyền nhiễm Hoa kỳ (IDSA) và Hội Dược sĩ bệnh viện Hoa kỳ (ASHP) năm 2020, áp dụng cho các bệnh nhân có nguy cơ gặp độc tính trên thận, bệnh nhân có chức năng thận không ổn định hoặc những bệnh nhân có thời gian điều trị vancomycin kéo dài hơn 3-5 ngày. Tham khảo quy trình giám sát điều trị vancomycin thông qua nồng độ thuốc trong máu tại các bệnh viện. Với bệnh nhân nặng (đặc biệt bệnh nhân có can thiệp thay thế thận liên tục, CRRT), có thể cân nhắc sử dụng chế độ liều vancomycin truyền tĩnh mạch liên tục (tổng liều 24 h từ 30-40 mg/kg, tối đa 60 mg/kg, sau khi dùng liều nạp) với nồng độ đích trong khoảng 20-25 mg/L.
Lưu ý liều kháng sinh khuyến cáo trong bảng dành cho bệnh nhân không có suy giảm chức năng thận. Liều kháng sinh cần được hiệu chỉnh tùy theo mức lọc cầu thận hoặc khi có can thiệp như lọc máu liên tục hoặc ngắt quãng (CRRT, IHD), thay thế huyết tương (PEX) hoặc trao đổi oxy qua màng ngoài cơ thể (ECMO).
– Do phần lớn các tác nhân gây viêm phổi bệnh viện ở Việt Nam là Pseudomonas aeruginosa và các vi khuẩn gram âm khác [13, 15, 18, 25, 52, 53] nên cần chọn kháng sinh có tác dụng trên Pseudomonas aeruginosa và vi khuẩn gram âm. Nếu bệnh nhân viêm phổi bệnh viện nặng hoặc có nguy cơ nhiễm vi khuẩn đa kháng cần phối hợp hai kháng sinh. Với các bệnh nhân còn lại có thể dùng đơn trị liệu với một kháng sinh có tác dụng trên Pseudomonas aeruginosa.
– Đối với các cơ sở điều trị có tỷ lệ nhiễm Acinetobacter baumannii kháng carbapenem cao (tỷ lệ trên 25%), nếu viêm phổi bệnh viện mức độ nặng và bệnh nhân không đáp ứng với điều trị sau 48 -72 giờ, có thể xem xét chỉ định dùng colistin. Để chọn liều colistin phù hợp phải dựa vào các dữ liệu cập nhật về nồng độ ức chế tối thiểu của vi khuẩn với colistin [5, 24, 54-56].
– Khi nghi ngờ viêm phổi bệnh viện do Staphylococcus aureus [5].
∙ Nếu viêm phổi bệnh viện không nặng hoặc tại cơ sở điều trị có tỷ lệ nhiễm Staphylococcus aureus kháng methicillin dưới 10%: không sử dụng kháng sinh có phổ trên MRSA như nhóm glycopeptid (vancomycin hoặc teicoplanin) hoặc nhóm oxazolidinon (linezolid). Các thuốc đã chỉ định để điều trị vi khuẩn gram âm như piperacillin-tazobactam, cefepim, levofloxacin, imipenem, hoặc meropenem cũng có hiệu quả trên Staphylococcus aureus còn nhạy với methicillin (MSSA).
∙ Nếu viêm phổi bệnh viện nặng hoặc bệnh nhân có nguy cơ nhiễm Staphylococcus aureus kháng methicillin (cơ sở điều trị có tỷ lệ nhiễm Staphylococcus aureus kháng methicillin trên 10% hoặc cơ sở không có dữ liệu về vi sinh): cân nhắc bổ sung kháng sinh có phổ tác dụng trên MRSA như nhóm glycopeptid (vancomycin hoặc teicoplanin) hoặc nhóm oxazolidinon (linezolid). Khi dùng vancomycin nên theo dõi nồng độ thuốc trong máu (nếu có điều kiện) để đảm bào hiệu quả của thuốc.
– Không dùng aminoglycosid hoặc colistin đơn độc trong điều trị viêm phổi bệnh viện.
2.2. Viêm phổi liên quan thở máy
Phân tần nguy cơ mắc vi khuẩn đa kháng
Bệnh nhân VPLQTM có nguy cơ cao mắc vi khuẩn đa kháng: 1 trong các tiêu chuẩn sau:
– Đã dùng kháng sinh tĩnh mạch trong vòng 90 ngày trước đó.
– Có sốc nhiễm khuẩn tại thời điểm bị VPLQTM.
– ARDS trước bị VPLQTM.
– Nằm viện kéo dài > 5 ngày trước khi xuất hiện VPLQTM.
– Điều trị thay thế thận trước khi bị VPLQTM.
Bệnh nhân VPLQTM có nguy cơ cao mắc trực khuẩn gram âm và Pseudomonas đa kháng thuốc:
– Có 1 trong các tiêu chuẩn nguy cơ cao mắc vi khuẩn đa kháng thuốc.
– Điều trị ở đơn vị có tỷ lệ vi khuẩn Gram âm đa kháng > 10%.
– Điều trị ở đơn vị chưa biết tỷ lệ vi khuẩn Gram âm đa kháng.
– Đã phân lập được trước đó hoặc có trực khuẩn gram âm và Pseudomonas đa kháng cư trú.
Bệnh nhân VPLQTM có nguy cơ cao mắc MRSA:
– Có 1 trong các tiêu chuẩn nguy cơ cao mắc vi khuẩn đa kháng thuốc.
– Điều trị ở đơn vị có tỷ lệ MRSA > 10%.
– Điều trị ở đơn vị chưa biết tỷ lệ MRSA.
– Đã phân lập được trước đó hoặc có MRSA cư trú.
Bảng 3.2. Các thuốc điều trị ban đầu theo kinh nghiệm viêm phổi liên quan thở máy [5, 46, 47, 49]
| A. Kháng sinh tác dụng trên vi khuẩn gram dương – Staphylococcus aureus kháng methicillin | B. Kháng sinh tác dụng trên vi khuẩn gram âm, Pseudomonas aeruginosa: Nhóm beta-lactam | C. Kháng sinh tác dụng trên vi khuẩn gram âm, Pseudomonas aeruginosa: Nhóm không phải beta lactam |
| Nhóm glycopeptid:
– Vancomycin 15 -20 mg/kg truyền tĩnh mạch trong 1-2 giờ, mỗi 8 giờ hoặc mỗi 12 giờ (cân nhắc liều nạp 25-30 mg/kg trước khi sử dụng liều duy trì với những trường hợp nặng). Cân nhắc hiệu chỉnh liều theo nồng độ thuốc trong máu để đảm bảo hiệu quả điều trị. Có thể cân nhắc chế độ liều truyền liên tục cho các bệnh nhân nặng*** – Teicoplanin Liều nạp: 6 mg/kg/12 giờ x 3 – 4 liều (400mg) truyễn tĩnh mạch trong 30 phút – 1 giờ. Liều duy trì: 6 mg/kg/24 giờ (400mg) truyền tĩnh mạch trong 30 phút – 1 giờ. |
Penicillin kháng Pseudomonas aeruginosa:
+ Piperacillin tazobactam 4,5g truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ. Có thể cân nhắc truyền liên tục 20 g/ngày sau khi dùng liều bolus ban đầu 4,5 g truyền tĩnh mạch trong 30 phút [51, 52] |
Fluoroquinolon
+ Ciprofloxacin 400mg truyền tĩnh mạch mỗi 8 giờ + Levofloxacin 750mg truyền tĩnh mạch mỗi 24 giờ Hoặc 500 mg truyền tĩnh mạch mỗi 12 giờ trong nhiễm khuẩn nặng |
| HOẶC | HOẶC | HOẶC |
| Oxazolidinon:
Linezolid 600mg truyền tĩnh mạch mỗi 12 giờ |
Cephalosporin
+ Cefepim 2g truyền tĩnh mạch trong 3 giờ, mỗi 8 giờ [51, 52] + Ceftazidim 2g truyền tĩnh mạch trong 3 giờ mỗi 8 giờ + Có thể cân nhắc truyền liên tục cefepim hoặc ceftazidim 6 g/ngày sau khi dùng liều bolus 15 mg/kg truyền tĩnh mạch trong 30 phút. |
Aminoglycosid
+ Amikacin 20 mg/kg truyền tĩnh mạch mỗi 24 giờ** + Gentamycin 5-7 mg/kg truyền tĩnh mạch mỗi 24 giờ + Tobramycin 5- 7mg/kg truyền tĩnh mạch mỗi 24 giờ |
| HOẶC | HOẶC | |
| Carbapenem
+ Imipenem 0,5 g-1g truyền tĩnh mạch trong 3 giờ, mỗi 6 giờ hoặc truyền liên tục qua bơm tiêm điện (thay thuốc mỗi 3 giờ)* + Meropenem 1-2 g truyền tĩnh trong mạch trong 3 giờ, mỗi 8 giờ, hoặc truyền liên tục qua bơm tiêm điện (thay thuốc mỗi 3 giờ)* [51, 52] |
Polymyxin
+ Colistin: sử dụng chế độ liều khuyến cáo theo đồng thuận về kháng sinh Polymyxin 2019 (liều nạp 9 MUI, liều duy trì tương đương với 9 MUI và được hiệu chỉnh theo mức lọc cầu thận, sử dụng sau liều nạp 8-12 giờ tùy theo khoảng cách giữa các lần đưa thuốc) hoặc liều khuyến cáo theo quy trình sử dụng colistin được bệnh viện phê duyệt |
|
| HOẶC | ||
| Monobactam
Aztreonam 2g truyền tĩnh mạch mỗi 6-8 giờ (truyền dài trong 3 giờ) |
* Chú thích:
(*) Sử dụng imipenem, meropenem: cân nhắc sử dụng liều bolus đầu tiên (đặc biệt cho các bệnh nhân thừa cân (BMI ≥ 30), các bệnh nhân có giảm albumin máu (dưới 25 g/L), bệnh nhân có tăng thanh thải thận (mức lọc cầu thận ước tính theo thanh thải creatinin > 130 ml/phút), các trường hợp viêm phổi bệnh viện, viêm phổi thở máy nặng, nghi ngờ do tác nhân vi sinh vật đa kháng thuốc): 0,5 g-1g truyền tĩnh mạch trong 30 phút – 1 giờ trước khi truyền kéo dài hoặc truyền liên tục thuốc để nhanh chóng đạt được nồng độ hữu hiệu của kháng sinh tại mô nhiễm trùng.
(**) Trường hợp nặng nghi ngờ do Klebsiella pneumoniae kháng carbapenem cân nhăc sử dụng amikacin liều cao 25-30 mg/kg, kết hợp với giám sát nồng độ thuốc trong máu để xác định khoảng cách đưa liều và giảm thiểu độc tính trên thận của thuốc.
(***) Giám sát nồng độ thuốc trong máu để hiệu chỉnh liều với vancomycin được khuyến cáo theo đồng thuận của Hội Truyền nhiễm Hoa kỳ (IDSA) và Hội Dược sĩ bệnh viện Hoa kỳ (ASHP) năm 2020, khuyến cáo cho các bệnh nhân có nguy cơ gặp độc tính trên thận, bệnh nhân có chức năng thận không ổn định hoặc những bệnh nhân có thời gian điều trị vancomycin kéo dài hơn 3-5 ngày. Tham khảo quy trình giám sát điều trị vancomycin thông qua nồng độ thuốc trong máu tại các bệnh viện. Với bệnh nhân nặng (đặc biệt bệnh nhân có can thiệp thay thế thận liên tục, CRRT) có thể cân nhắc sử dụng chế độ liều vancomycin truyền tĩnh mạch liên tục (tổng liều 24 h từ 30-40 mg/kg, tối đa 60 mg/kg, sau khi dùng liều nạp) với nồng độ đích trong khoảng 20- 25 mg/L.
Lưu ý liều kháng sinh khuyến cáo trong bảng dành cho bệnh nhân không có suy giảm chức năng thận. Liều kháng sinh cần được hiệu chỉnh tùy theo mức lọc cầu thận hoặc khi có can thiệp như lọc máu liên tục hoặc ngắt quãng (CRRT, IHD), thay thế huyết tương (PEX) hoặc trao đổi oxy qua màng ngoài cơ thể (ECMO).
– Do phần lớn các tác nhân gây viêm phổi bệnh viện ở Việt Nam là Pseudomonas aeruginosa và các vi khuẩn gram âm đa kháng khác [13, 15, 18, 25, 52, 53], nên cần chọn kháng sinh có tác dụng trên Pseudomonas aeruginosa và vi khuẩn gram âm:
+ Nếu bệnh nhân VPLQTM có bất kỳ yếu tố nào sau đây: một yếu tố nguy cơ đa kháng kháng sinh, điều trị ở đơn vị có > 10% vi khuẩn phân lập được sử dụng đơn trị liệu, điều trị ở đơn vị không biết tỷ lệ nhạy cảm kháng sinh, cần phối hợp hai kháng sinh thuộc các nhóm khác nhau có tác dụng trên P. aeruginosa và vi khuẩn gram âm.
+ Với các bệnh nhân VPLQTM không có nguy cơ kháng thuốc, điều trị ở các đơn vị có < 10% vi khuẩn gram âm phân lập kháng với các kháng sinh đang được xem xét dùng đơn trị liệu có thể dùng đơn trị liệu với một kháng sinh có tác dụng trên P. aeruginosa.
– Đối với các cơ sở điều trị có tỷ lệ nhiễm Acinetobacter baumannii đa kháng cao (tỷ lệ trên 25%), nếu viêm phổi bệnh viện mức độ nặng và bệnh nhân không đáp ứng với điều trị sau 48 -72 giờ, có thể xem xét chỉ định dùng colistin. Để chọn liều colistin phù hợp phải dựa vào các dữ liệu cập nhật về nồng độ ức chế tối thiểu của vi khuẩn với colistin [5, 24, 54-56].
– Khi nghi ngờ VPLQTM do S. aureus [5]:
+ Nếu VPLQTM không có yếu tố nguy cơ mắc vi khuẩn đa kháng kháng sinh hoặc tại cơ sở điều trị có tỷ lệ nhiễm S. aureus kháng methicillin ≤ 10%: không sử dụng nhóm glycopeptid (vancomycin hoặc teicoplanin) hoặc nhóm oxazolidinon (linezolid). Các thuốc đã chỉ định để điều trị vi khuẩn gram âm như piperacillin-tazobactam, cefepim, levofloxacin, imipenem, hoặc meropenem cũng có hiệu quả trên Staphylococcus aureus nhạy methicillin (MSSA).
+ Nếu VPLQTM có bất kỳ một yếu tố nào sau đây: có một yếu tố mắc vi khuẩn đa kháng kháng sinh, cơ sở điều trị có tỷ lệ nhiễm S. aureus kháng methicillin trên 10% hoặc cơ sở không có dữ liệu về tỷ lệ nhiễm S. aureus kháng methicillin, cần chọn kháng sinh nhóm glycopeptid (vancomycin hoặc teicoplanin) hoặc nhóm oxazolidinon (linezolid). Khi dùng vancomycin nên theo dõi nồng độ thuốc trong máu (nếu có điều kiện) để đảm bào hiệu quả của thuốc.
– Không dùng aminoglycosid hoặc colistin đơn độc trong điều trị VPLQTM.
3. ĐIỀU TRỊ ĐẶC HIỆU THEO TÁC NHÂN VI KHUẨN
Khi có kết quả phân lập vi sinh vật và kháng sinh đồ:
3.1. Pseudomonas aeruginosa
Khuyến cáo lựa chọn thuốc trong điều trị viêm phổi bệnh viện và viêm phổi liên quan thở máy dựa vào kết quả kháng sinh đồ. [5]
Tùy theo kết quả độ nhạy cảm trên kháng sinh đồ, phân loại mức độ kháng thuốc của chủng phân lập:
+ Pseudomonas aeruginosa đa kháng (MDR), khi chủng phân lập không nhạy cảm với ít nhất 1 kháng sinh trong 3 nhóm kháng sinh có phổ trên Pseudomonas aeruginosa bao gồm: penicillin chống Pseudomonas aeruginosa (piperacillin/tazobactam, ticarcillin/acid clavulanic), cephalosporin (ceftazidim, cefepim), quinolon (ciprofloxacin, levofloxacin), aminoglycosid (Gentamycin, tobramycin, amikacin) và carbapenem (imipenem, meropenem, doripenem).
+ Pseudomonas aeruginosa kháng thuốc khó điều trị (difficult-to-treat resistance-DTR), khi chủng phân lập không nhạy cảm với tất cả các kháng sinh sau đây: piperacillin/tazobactam, ceftazidim, cefepim, aztreonam, meropenem, imipenem, ciprofloxacin và levofloxacin.
Với Pseudomonas aeruginosa (MDR) còn nhạy cảm với các kháng sinh beta-lactam không thuộc nhóm carbapenem như piperacillin/tazobactam, ceftazidim, cefepim, aztreonam (cả trường hợp còn nhạy cảm hay không còn nhạy cảm với carbapenem), ưu tiên sử dụng các kháng sinh này hơn kháng sinh carbapenem. Các kháng sinh này cần được sử dụng với mức liều cao kết hợp với truyền kéo dài hoặc truyền liên tục (bảng 3.1 và bảng 3.2) để đảm bảo hiệu quả điều trị. Với các trường hợp viêm phổi bệnh viện, viêm phổi thở máy khó kiểm soát nguồn ổ nhiễm do các chủng Pseudomonas aeruginosa kháng carbapenem nhưng còn nhạy với kháng sinh beta lactam không thuộc nhóm carbapenem, có thể cân nhắc sử dụng kháng sinh mới có hoạt tính ưu tiên trên Pseudomonas aeruginosa như ceftolozan/tazobactam (2,5 g mỗi 8 giờ, truyền dài trong vòng 3 giờ).
Với các nhiễm khuẩn nặng do Pseudomonas aeruginosa kháng thuốc khó điều trị (DTR), tùy theo tính sẵn có của thuốc tại bệnh viện và kết quả kháng sinh đồ với chủng vi khuẩn phân lập, cân nhắc sử dụng phối hợp 2 trong 3 kháng sinh: colistin, aminoglycosid (amikacin, tobramycin) (chế độ liều tham khảo tại bảng 3.1 và bảng 3.2) hoặc fosfomycin (4 g mỗi 8 giờ hoặc mỗi 6 giờ, tối đa 24 g/ngày) hoặc sử dụng đơn trị liệu với kháng sinh mới có hoạt tính trên Pseudomonas aeruginosa như ceftolozan/tazobactam (3 g mỗi 8 giờ, truyền dài trong vòng 3 giờ).
Đơn trị liệu dựa vào kết quả kháng sinh đồ có thể được sử dụng cho các bệnh nhân viêm phổi bệnh viện, viêm phổi thở máy do Pseudomonas aeruginosa không phải mức độ nặng [5]. Trong trường hợp nhiễm khuẩn nặng, ưu tiên phối hợp 2 kháng sinh còn hoạt tính trên kháng sinh đồ [5].
Không sử dụng aminoglycosid, fosfomycin hoặc colistin đơn độc trong điều trị viêm phổi bệnh viện [5, 46]
Mặc dù chưa có sự thống nhất giữa các khuyến cáo trên thế giới do bằng chứng về hiệu quả và tính an toàn còn hạn chế, có thể cân nhắc bổ sung kháng sinh khí dung (colistin: 1- 2 MUI pha trong 6 ml NaCl 0,9% x 2-3 lần/ngày hoặc aminoglycosid: amikacin 15-20 mg/kg, pha trong 6 ml NaCl 0,9%, chia 1-2 lần trong ngày) phối hợp với kháng sinh tĩnh mạch trong trường hợp viêm phổi thở máy do Pseudomonas aeruginosa chỉ còn nhạy cảm với colistin hoặc aminoglycosid trên kháng sinh đồ. Khí dung được thực hiện trước mỗi lần sử dụng truyền thuốc qua đường tĩnh mạch, nếu điều kiện cho phép nên sử dụng thiết bị khí dung màng rung (vibrating mesh nebilizer) hoặc thiết bị khí dung theo nguyên lý dòng phụt (jet nebulizer) để tối ưu phân bố thuốc vào mô phổi.
3.2. Acinetobacter baumannii
Phối hợp ít nhất 2 kháng sinh còn nhạy cảm trên kháng sinh đồ để điều trị viêm phổi bệnh viện, viêm phổi thở máy do Acinetobacter baumannii kháng carbapenem, ít nhất cho đến khi các tình trạng lâm sàng nhiễm trùng được cải thiện. Colistin (liều khuyến cáo trong bảng 3.2) kết hợp với meropenem (liều cao, 2 g mỗi 8 giờ truyền kéo dài 3 giờ); kết hợp với ampicillin/sulbactam (sử dụng liều cao 6-9 g/ngày tính theo sulbactam; tương ứng 3 g sulbactam mỗi 8 giờ, truyền dài 4 giờ (9 g sulbactam/ngày) hoặc 1 g mỗi 4 giờ, truyền trong vòng 30 phút (6 g sulbactam/ngày)), hoặc minocyclin (nếu còn nhạy cảm, liều 200 mg mỗi 12 giờ) hay doxycyclin (200 mg liều nạp, 100 mg mỗi 12 giờ liều duy trì).
Ampicillin/sulbactam được khuyến cáo là thành phần trong phác đồ phối hợp kháng sinh, không phụ thuộc vào chủng A. baumannii phân lập có còn nhạy cảm với thuốc hay không.
Phác đồ phối hợp kháng sinh có carbapenem nên cân nhắc chỉ sử dụng nếu MIC với meropenem hoặc imipenem của chủng A. baumannii phân lập ≤ 8 mg/L. Imipenem có thể là lựa chọn thay thế cho meropenem, tuy nhiên cần cân nhắc đến độc tính trên thần kinh khi sử dụng liều cao imipenem.
Lưu ý mặc dù không có giá trị điểm gãy (breakpoint) để phiên giải nhạy cảm/đề kháng của Acinetobacter baumannii với colistin, tuy nhiên hiệu quả của kháng sinh này sẽ không được đảm bảo nếu MIC > 2 mg/L. Cân nhắc bổ sung kháng sinh khí dung (colistin: 1-2 MUI pha trong 6 ml NaCl 0,9% x 2-3 lần/ngày) phối hợp với kháng sinh tĩnh mạch trong trường hợp viêm phổi thở máy do Pseudomonas aeruginosa chỉ còn nhạy cảm với colistin trên kháng sinh đồ. Khí dung được thực hiện trước mỗi lần sử dụng truyền thuốc qua đường tĩnh mạch, nếu điều kiện cho phép nên sử dụng thiết bị khí dung màng rung (vibrating mesh nebilizer) hoặc thiết bị khí dung theo nguyên lý dòng phụt (jet nebulizer) để tối ưu phân bố thuốc vào mô phổi. Theo dõi chặt chức năng thận trong quá trình điều trị bằng phác đồ phối hợp có colistin.
Tigecylin mặc dù có hoạt tính trên Acinetobacter baumannii, tuy nhiên không được khuyến cáo điều trị viêm phổi bệnh viện, viêm phổi thở máy do có bằng chứng làm gia tăng nguy cơ tử vong trên bệnh nhân.
Cefiderocol, nếu được cấp phép lưu hành, nên được dữ trữ cho các trường hợp viêm phổi bệnh viện, viêm phổi thở máy không thể sử dụng các kháng sinh khác do đề kháng, không đáp ứng, hoặc không dung nạp với các kháng sinh này. Cefiderocol nên được sử dụng phối hợp với các kháng sinh khác trong phác đồ điều trị.
3.3. Trực khuẩn gram âm đường ruột sinh ESBL (Escherichia coli, Klebsiella pneumoniae)
Với bệnh nhân viêm phổi bệnh viện và viêm phổi liên quan thở máy do trực khuẩn gram âm đường ruột sinh ESBL, lựa chọn hàng đầu là carbapenem (imipenem, meropenem, liều khuyến cáo trong bảng 3.1 và bảng 3.2). Trong trường hợp viêm phổi bệnh viện không kèm theo sốc nhiễm trùng, bệnh nhân không có giảm albumin huyết thanh, nếu chủng phân lập còn nhạy cảm với ertapenem, có thể cân nhắc sử dụng ertapenem (liều 1 g mỗi 24 giờ, truyền trong 30 phút). Chỉ cân nhắc sử dụng piperacillin/tazobactam hoặc cefepim trong trường hợp viêm phổi nhẹ, không có yếu tố nguy cơ, kết quả còn nhạy cảm trên kháng sinh đồ, vì hiệu quả của các kháng sinh này không chắc chắn so với carbapenem, đặc biệt trong trường hợp viêm phổi mắc kèm nhiễm khuẩn huyết [5, 15, 25].
3.4. Vi khuẩn đường ruột kháng carbapenem (Carbapenem resistant Enterobacterales – CRE)
Lựa chọn kháng sinh điều trị nên dựa trên kết quả độ nhạy cảm của chủng phân lập trên kháng sinh đồ; nồng độ ức chế tối thiểu (MIC) của kháng sinh và kiểu hình carbapenemase (nếu xác định được). Các kháng sinh có thể cân nhắc trong phác đồ đơn trị liệu hoặc phối hợp để điều trị viêm phổi bệnh viện, viêm phổi thở máy do CRE bao gồm: colistin (liều khuyến cáo trong bảng 3.2), aminoglycosid (amikacin, Gentamycin, liều khuyến cáo trong bảng 3.2), fosfomycin (liều 4 g mỗi 8 giờ hoặc mỗi 6 giờ, tối đa 24 g/ngày), carbapenem (imipenem, meropenem) và kháng sinh mới phối hợp beta-lactam/chất ức chế beta-lactamase (ceftazidim/avibactam, liều 2,5 g mỗi 8 giờ, truyền dài 3 giờ). Ceftazidim/avibactam là lựa chọn ưu tiên điều trị các nhiễm trùng do các chủng sinh KPC hoặc OXA-48. Meropenem/vaborbactam, imipenem/relebactam có thể là các lựa chọn cân nhắc tương tự ceftazidim/avibactam với các nhiễm trùng do các chủng sinh KPC, nếu các thuốc được cấp phép lưu hành. Ở các đơn vị lâm sàng có dịch tễ lưu hành cao các chủng vi khuẩn sinh NDM hoặc các metallo-β-lactamase khác hoặc kết quả phân lập trước đó (quần cư hoặc xác định là căn nguyên gây bệnh) trên người bệnh là chủng sinh metallo-β-lactamase, cân nhắc sử dụng ceftazidim/avibactam phối hợp với aztreonam hoặc đơn trị liệu bằng cefiderocol, nếu các kháng sinh này được cấp phép lưu hành.
Chỉ nên sử dụng carbapenem trong phác đồ phối hợp nếu MIC của chủng vi khuẩn phân lập với meropenem hoặc imipenem ≤ 8 mg/L. Trong trường hợp này, cần sử dụng liều cao kết hợp truyền kéo dài carbapenem (2 g mỗi 8 h, truyền dài 3 h với meropenem; 1 g mỗi 6-8 h, truyền dài 3 h với imipenem với bệnh nhân không suy giảm chức năng thận).
Khuyến cáo phối hợp ít nhất 2 kháng sinh còn nhạy cảm trên kháng sinh đồ nếu chủng vi khuẩn phân lập chỉ còn nhạy cảm với colistin, aminoglycosid hoặc fosfomycin.
Chế độ liều kháng sinh aminoglycosid cần được tối ưu để đảm bảo hiệu quả điều trị, ưu tiên sử dụng chế độ liều cao (ví dụ 25-30 mg/kg với amikacin) có kèm theo giám sát nồng độ thuốc trong máu.
Cân nhắc sử dụng ceftazidim/avibactam (đơn trị liệu) khi xác định chủng vi khuẩn còn nhạy cảm trên kháng sinh đồ và việc sử dụng colistin hay aminoglycosid không phù hợp cho người bệnh do độc tính trên thận hoặc không có điều kiện giám sát nồng thuốc trong máu với kháng sinh aminoglycosid hoặc đáp ứng lâm sàng kém với phác đồ phối hợp có colistin hay aminoglycosid.
Cân nhắc bổ sung kháng sinh khí dung (colistin: 1-2 MUI pha trong 6 ml NaCl 0,9% x 2-3 lần/ngày hoặc aminoglycosid: amikacin 15-20 mg/kg, pha trong 6 ml NaCl 0,9%, chia 1-2 lần trong ngày) phối hợp với kháng sinh tĩnh mạch trong trường hợp viêm phổi thở máy do CRE chỉ còn nhạy cảm với colistin hoặc aminoglycosid trên kháng sinh đồ. Khí dung được thực hiện trước mỗi lần sử dụng truyền thuốc qua đường tĩnh mạch, nếu điều kiện cho phép nên sử dụng thiết bị khí dung màng rung (vibrating mesh nebilizer) hoặc thiết bị khí dung theo nguyên lý dòng phụt (jet nebulizer) để tối ưu phân bố thuốc vào mô phổi.
3.5. Staphylococcus aureus kháng methicillin (MRSA)
Kháng sinh lựa chọn trong điều trị viêm phổi bệnh viện và viêm phổi liên quan thở máy do MRSA là glycopeptid (vancomycin, teicoplanin) hoặc linezolid [5, 18, 54]. Việc lựa chọn linezolid hay kháng sinh glycopeptid tùy thuộc vào người bệnh để giảm thiểu biến cố bất lợi liên quan đến thuốc (giảm bạch cầu và độc tính trên thận với vancomycin, giảm tiểu cầu và các tương tác thuốc với linezolid) và mức độ nhạy cảm của chủng vi khuẩn phân lập với vancomycin (khuyến cáo sử dụng linezolid nếu MIC của tụ cầu với vancomycin ≥ 1,5 mg/L).
Không khuyến cáo phối hợp các kháng sinh có phổ trên MRSA, hay sử dụng các kháng sinh khác ngoài nhóm glycopepetid và linezolid để điều trị viêm phổi bệnh viện, viêm phổi thở máy.
Liều vancomycin (bảng 3.1 và 3.2) nên được tối ưu theo khuyến cáo đồng thuận của Hội Truyền nhiễm Hoa Kỳ (IDSA) và Hội Dược sĩ bệnh viện Hoa Kỳ (ASHP) năm 2020, để đạt đích AUC/MIC từ 400-600.
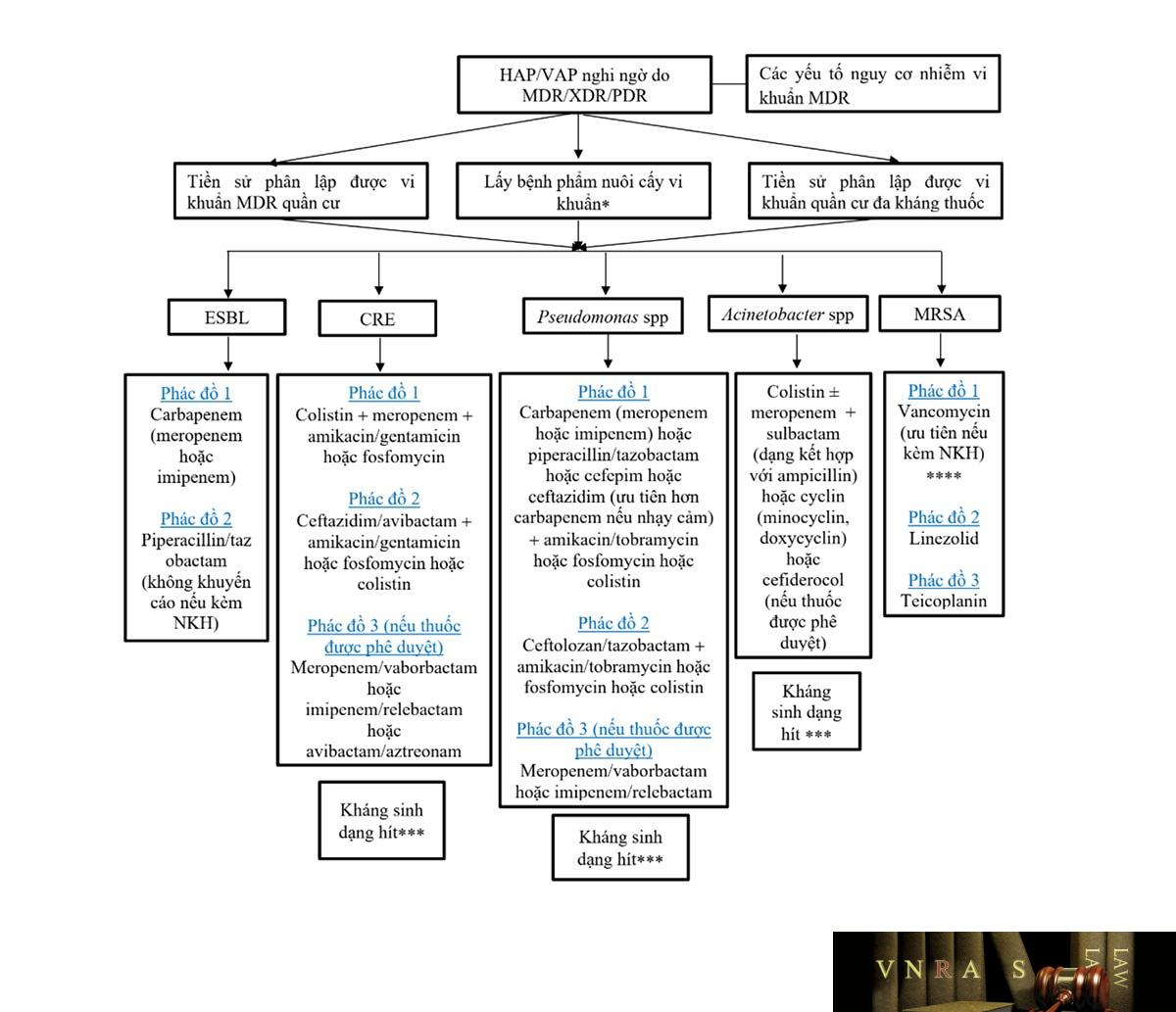
CRE: Enterobacterales kháng carbapenem; ESBL: men beta-lactamase phổ rộng; HAP: viêm phổi mắc phải tại bệnh viện; VAP: viêm phổi liên quan đến thở máy; MDR: đa kháng; XDR: kháng mở rộng; PDR: toàn kháng; * mẫu bệnh phẩm hô hấp xâm lấn được lấy bằng kĩ thuật sinh thiết xuyên phế quản như: rửa phế quản phế nang, chải đờm có bảo vệ; mẫu bệnh phẩm hô hấp không xâm lấn như dịch hút nội khí quản. Cấy máu đồng thời với bệnh phẩm hô hấp. ** Tùy vào mức độ kháng thuốc ở cơ sở. *** Kháng sinh dạng hít phụ thuộc kháng sinh đồ: colistin 1-2MUI dạng khí dung mỗi 8 giờ; Tobramycin 300mg dạng khí dung mỗi 12 giờ; amikacin 250mg hoặc 500mg dạng khí dung mỗi 12 giờ; gentamycin 80mg dạng khí dung mỗi 12 giờ. **** Khuyến cáo giám sát nồng độ thuốc trong máu để hiệu chỉnh liều.
Bảng 3.3. Hoạt tính in vitro của các kháng sinh BL/BLI mới (phối hợp beta-lactam/chất ức chế beta-lactamase) và cefiderocol trên các chủng vi khuẩn gram âm kháng carbapenem
| Cơ chế chính đề kháng carbapenem | Enterobacterales | Pseudomonas aeruginosa
Đột biến OprD2 Bơm tống thuốcc MBLd |
Acinetobacter
baumanii OXAe |
||
| Carbapenemase nhóm A (KPC) | Carbapenemase nhóm D (tương tự OXA-48a) | Carbapenemase nhóm B (MBLb) | |||
| Ceftolozan
tazobactam |
– | – | – | +++
75%-90%f |
–g |
| Ceftazidim
avibactam |
+++
96%-99% |
+++
96%-99% |
– | ++
60%-70% |
–g |
| Ceftazidim
avibactam + aztreonam |
+++
96%-99% |
+++
96%-99% |
+++
>90% |
± (MBL)
0-25% |
–g |
| Meropenem
vaborbactam |
+++
95%-99% |
– | – | – | – |
| Imipenem
relebactam |
+++
88%-95% |
± | _ | ++
70%-90% |
– |
| Cefiderocol | +++
84%-91% |
+++
88%-93% |
++
VIM: 79%-81% NDM: 41%-51% |
+++
>90% |
+++i
MIC ≤ 2mg/L với > 90% các chủng phân lập |
Mức độ nhạy cảm chỉ được phân tích trên các chủng kháng carbapenem
Chú thích: KPC: Klebsiella pneumoniae carbapenemase; MBL: Metallo-beta-lactamase; NDM: New-Delhi MBL; MIC: Nồng độ ức chế tối thiểu; a OXA-48 và các dẫn chất (e.g., OXA-181 and OXA-232) thủy phân các penicillin và carbapenem nhưng không thủy phân các cephalosporin phổ mở rộng; b NDM là tuýp MBL chính trên các chủng Enterobacterales (các tuýp khác như VIM ít phổ biến hơn); c Bơm tống thuốc chính liên quan đến tình trạng P.aeruginosa kháng carbapenem là MexAB-OprM và MexEF-OprN; d các type MBL khác (VIM, IMP, NDM, SPM) đôi khi được ghi nhận trên cả P.aeruginosa sinh carbapenemase nhóm A (KPC và GES) và nhóm C (cấu trúc tương tự OXA-48); e Chủ yếu là các enzym có cấu trúc tương tự OXA-23, OXA-24/40 và OXA-58; f ceftolozan–tazobactam không có hoạt tính trên các chủng P.aeruginosa sinh carbapenemase được phân lập; g khả năng đề kháng nội tại hoặc mức độ nhạy cảm hạn chế; h hoạt tính dựa trên sự phối hợp của aztreonam và avibactam; i Không có điểm gãy nhạy cảm theo EUCAST (dữ liệu không đầy đủ).
Bảng 3.4. Phổ tác dụng của các kháng sinh beta-lactam mới có/không phối hợp với chất ức chế beta-lactamase

Chú thích: KPC=Klebsiella pneumoniae carbapenemases; MBL=metallo-beta-lactamases; NDM=New-Delhi MBL; OXA 48=oxacilinase-48; XDR=Kháng thuốc mở rộng; màu xanh: Đa số các chủng còn nhạy cảm; màu đỏ: đa số các chủng đã đề kháng; màu cam: Tỷ lệ nhạy cảm cao trong in vitro, tuy nhiên hiệu quả lâm sàng không ổn định, tỷ lệ tử vong lớn được ghi nhận trên 1 nhóm bệnh nhân trong thử nghiệm lâm sàng.
4. THEO DÕI ĐIỀU TRỊ VÀ THỜI GIAN DÙNG KHÁNG SINH
– Đánh giá đáp ứng điều trị[5]:
Đánh giá đáp ứng đièu trị viêm phổi bệnh viện/viêm phổi liên quan thở máy dựa vào tiêu chuẩn lâm sàng và procalcitonin [5, 48].
– Thời gian dùng kháng sinh:
+ Thời gian điều trị thông thường là 7 ngày nếu không phải vi khuẩn đa kháng và bệnh nhân đáp ứng tốt với điều trị ban đầu. Thời gian điều trị có thể kéo dài tùy theo loại vi khuẩn gây bệnh và cơ địa bệnh nhân[5].
+ Quyết định ngừng kháng sinh dựa vào đáp ứng lâm sàng và kết quả xét nghiệm procalcitonin. Nồng độ procalcitonin được khuyến cáo để xem xét ngừng kháng sinh là 0,25 – 0,5 ng/lít hoặc giảm ít nhất 80% so với giá trị cao nhất ghi nhận được trong quá trình điều trị [48].
– Trường hợp không đáp ứng sau một thời gian điều trị, phải hội chẩn với dược lâm sàng, vi sinh, tìm căn nguyên khác…
Chương IV. DỰ PHÒNG VIÊM PHỔI BỆNH VIỆN/VIÊM PHỔI LIÊN QUAN THỞ MÁY
Có nhiều các biện pháp chăm sóc, điều trị đã được chứng minh giảm đáng kể tỷ lệ VPBV/VPLQTM. Trong đó có các biện pháp thực hành lâm sàng thiết yếu giúp giảm thời gian thở máy, thời gian nằm viện, tỷ lệ tử vong, sử dụng kháng sinh và/hoặc giảm chi phí ít hơn và các biện pháp thêm vào giúp cải thiện các kết quả khách quan (bao gồm cả VAE) nhưng có một số nguy cơ gây hại và các biện pháp can thiệp làm giảm tỷ lệ VPBV nhưng mức độ bằng chứng còn thấp [36, 57-59].
Các biện pháp giúp dự phòng VPBV/VPLQTM bao gồm [5, 60, 61]:
1. TRÁNH ĐẶT ỐNG VÀ ĐẶT LẠI ỐNG NỘI KHÍ QUẢN NẾU CÓ THỂ
1.1. Sử dụng thở oxy mũi dòng cao (HFNC) hoặc thở máy không xâm nhập khi cần thiết (bằng chứng cao)
– HFNC có thể giúp tránh đặt nội khí quản ở bệnh nhân bị suy hô hấp do thiếu oxy và ngăn ngừa việc đặt lại nội khí quản sau khi rút ống ở bệnh nhân nặng và bệnh nhân sau phẫu thuật so với liệu pháp oxy thông thường và HFNC xu hướng giúp giảm viêm phổi bệnh viện ở bệnh nhân suy hô hấp do thiếu oxy.
– Thở máy không xâm nhập giúp tỷ lệ đặt nội khí quản, đặt lại nội khí quản, VPLQTM và tỷ lệ tử vong thấp hơn so với liệu pháp oxy thông thường ở bệnh nhân suy hô hấp cấp tính do tăng CO2 hoặc giảm oxy máu.
1.2. Cho bệnh nhân suy hô hấp cấp do COVID không có chỉ định đặt nội khí quản
Nằm sấp giúp giảm nguy cơ đặt nội khí quản hơn.
2. DÙNG AN THẦN TỐI THIỂU
2.1. Áp dụng các hướng dẫn sử dụng an thần
Những bệnh nhân nặng thường cần các thủ thuật can thiệp cũng như có tổn thương phổi nặng phải thở máy do vậy dẫn đến lo lắng, đau và giảm oxy máu do vậy họ cần dùng thuốc an thần, giảm đau để giảm lo lắng, giảm căng thẳng, giúp cho bệnh nhân đồng thì với máy thở và ngăn ngừa tổn thương do kích thích, ngăn ngừa bệnh nhân tự rút ống nội khí quản hoặc các đường truyền. Có nhiều phương pháp cũng như các bảng điểm để theo dõi tuy nhiên thang điểm RASS (Richmond Agitation-Sedation Scale) hiện được dùng phổ biến và có giá trị trên lâm sàng. Duy trì mức an thần hợp lý giúp tránh bệnh nhân dùng quá liều an thần, làm chậm thời gian cai thở máy và bỏ máy thở cho bệnh nhân, ngược lại nếu không đủ liều an thần ở bệnh nhân kích động, tổn thương phổi nặng dẫn đến nguy cơ bệnh nhân tổn thương phổi nặng hơn do gắng sức hoặc nguy cơ bệnh nhân tự rút nội khí quản. Hiện nay các hướng dẫn trên thế giới đều khuyến cáo ngừng an thần đánh giá ý thức bệnh nhân hàng ngày, và duy trì điểm RASS từ -1 đến + 1 trong quá trình thở máy.
Bảng 4.1. Thang điểm RASS
| Điểm | Mức độ | Mô tả |
| +4 | Kích động | Kích động hoặc quá khích mạnh, gây nguy hiểm nhân viên y tế |
| +3 | Kích thích mạnh | Tự rút nội khí quản hoặc rút catheter hoặc có hành vi quá khích với nhân viên y tế |
| +2 | Kích thích | Thường xuyên giãy giụa hoặc người bệnh thở chống máy |
| +1 | Bồn chồn | Lo lắng hoặc sợ hãi nhưng không giãy giụa quá mức |
| 0 | Tỉnh và yên lặng | Chú ý tự nhiên với nhân viên y tế |
| -1 | Ngủ gà | Không tỉnh hoàn toàn, nhưng thức tỉnh, đáp ứng bằng ánh mắt theo mệnh lệnh duy trì trên 10 giây |
| -2 | An thần nhẹ | Thức tỉnh, đáp ứng bằng ánh mắt theo mệnh lệnh trong thời gian ngắn (dưới 10 giây) |
| -3 | An thần vừa | Cựa quậy theo mệnh lệnh (nhưng không có đáp ứng bằng ánh mắt) |
| -4 | An thần sâu | Không đáp ứng với lời nói, nhưng người bệnh có cựa quậy với các kích thích cơ thể |
| -5 | Không thể đánh thức | Không đáp ứng bằng mệnh lệnh và các kích thích cơ thể |
| Mục tiêu duy trì điểm RASS từ -1 đến 1 | ||
2.2 Đánh giá cai thở máy hàng ngày cho bệnh nhân (bằng chứng cao)
Thở máy kéo dài sẽ dẫn đến VPLQTM tăng, tổn thương phổi do thở máy, khó bỏ máy làm tăng nguy cơ tử vong và tăng chi phí điều trị. Do vậy, mỗi khi người bệnh phải thở máy, bác sĩ cần phải đánh giá khả năng cai thở máy hàng ngày của người bệnh để xem xét bỏ máy thở càng sớm càng tốt.
Có nhiều phương thức cai thở máy như: SIMV, PSV, CPAP, thở qua ống chữ T. Tuy nhiên, dù bằng phương thức nào thì người thực hiện cũng phải tuân theo các tiêu chuẩn cai thở máy chung.
2.2.1. Tiêu chuẩn cai thở máy
– Nguyên nhân phải thở máy đã được giải quyết.
– Khí máu: PaO2 > 60mmHg với FiO2 < 0,5 và PEEP ≤ 5cmH2O. pH và PaCO2 phù hợp với bệnh lý hô hấp nền của người bệnh.
– HA ổn định: không hoặc dùng liều nhỏ thuốc co mạch, trợ tim.
– Nhịp tim <140 chu kỳ/phút. – Nhiệt độ < 38 độ C.
2.2.2. Tiến hành cai thở máy: sử dụng 1 trong các phương pháp sau
- PSV (pressure support ventilation).
- CPAP (continuous positive airway pressure).
- Ống chữ T (T-tube)
- SIMV (synchronized intermittent mandatory ventilation): thường dùng cho bệnh nhân thở máy kéo dài).
- Hoặc phương thức thở máy khác tuỳ điều kiện bệnh nhân và thực tế tại các đơn vị như NAVA, PAV….
2.2.3. Đánh giá đáp ứng của người bệnh khi cai thở máy
- Chỉ số thở nhanh nông: RSBI < 100 chu kỳ/phút/lít.
- Oxy hóa máu: SaO2 > 90%, PaO2 > 60mmHg, pH > 7,32, PaCO2 tăng dưới 10 mmHg so với trước khi cai máy.
- Tần số thở < 30 chu kỳ/phút hoặc thay đổi dưới 50% so với trước.
- Nhịp tim < 140 chu kỳ/phút hoặc thay đổi < 20%. 90 mmHg <HATT < 180 mmHg hoặc thay đổi < 20%.
- Ý thức không thay đổi, không kích thích.
- Không gắng sức (sử dụng cơ hô hấp phụ, thở nghịch thường).
2.2.4. Thôi thở máy
- Nếu người bệnh đáp ứng cai thở máy ống chữ T, bỏ máy thở và xem xét rút ống nội khí quản nếu có (đánh giá ho khạc đờm, ý thức).
- Nếu người bệnh không đáp ứng cai thở máy ống chữ T, chuyển lại phương thức thở trước khi cai thở máy. Đánh giá và cai thở máy hàng ngày.
3. PHỤC HỒI CHỨC NẶNG VÀ TẬP VẬN ĐỘNG SỚM
Giúp giảm VPLQTM, thời gian thở máy, giảm thời gian nằm viện và khoa Hồi sức tích cực, tỷ lệ VAP thấp hơn và phục hồi chức năng vận động, hô hấp của cơ thể nhanh hơn.
4. NẰM ĐẦU CAO 30-45 ĐỘ
Vi khuẩn gây VPTM có thể xâm nhập qua đường nội sinh và dịch tiết dạ dày từ đường tiêu hóa. Những chất tiết này có thể trào ngược vào đường hô hấp dưới và gây viêm phổi. Đối với các bệnh nhân có nuôi ăn qua đường tiêu hóa, nếu đặt bệnh nhân tư thế nằm ngửa đầu thấp dịch tiết từ đường tiêu hóa sẽ xâm nhập vào đường hô hấp dưới. Tư thế bệnh nhân nằm đầu bằng đã được chứng minh gây trào ngược dịch dạ dày vào đường hô hấp và có liên quan tới sự phát triển VPLQTM.
Tư thế của bệnh nhân hay độ cao 30-45 độ của đầu giường là một phần không thể thiếu trong các biện pháp dự phòng VPLQTM và qua rất nhiều nghiên cứu đã chứng minh có mối tương quan giữa nâng đầu giường bệnh nhân lên và giảm tỷ lệ VPLQTM.
5. CHĂM SÓC RĂNG MIỆNG
Vệ sinh răng miệng đặc biệt là một quy trình làm sạch khoang miệng từ răng lưỡi lợi nhằm hạn chế tối đa các vi khuẩn từ miệng xuống phế quản phổi và làm mất nơi cư trú của vi khuẩn virus gây bệnh, đây cũng là một trong các bước trong gói dự phòng VPLQTM.
Clorhexidin là một chất khử trùng hoạt động tiêu diệt cả vi khuẩn grám dương và gram âm và từ lâu đã được phê duyệt là chất ức chế sự hình thành mảng bám răng và viêm nướu. Cho đến náy đã có rất nhiều nghiên cung cấp bằng chứng chắc chắn sử dụng Chlorhexidin để vệ sinh, chăm sóc răng miệng cho bệnh nhân làm giảm tỷ lệ VPLQTM, thời gian nằm viện, thời gian nằm khoa Hồi sức tích cực ngắn hơn.
6. CHO ĂN SỚM QUA ĐƯỜNG TIÊU HOÁ
Cho ăn đường tiêu hoá sớm có liên quán đến nguy cơ thấp hơn viêm phổi bệnh viện, thời gian nằm khoa Hồi sức tích cực ngắn hơn và thời gian nằm viện ngắn hơn so với nuôi dưỡng ngoài đường tiêu hóa sớm.
7. QUẢN LÝ DÂY MÁY THỞ
- Tháy đổi dây máy thở khi cần thiết hơn là trên một lịch cố định không ảnh hưởng đến tỷ lệ VPLQTM đồng thời làm giảm chi phí.
- Một số dây máy thở thay theo tình trạng lâm sàng và theo hướng dẫn sử dụng của nhà sản xuất.
8. VỆ SINH TAY
Vệ sinh tay giúp loại bỏ vi sinh vật có ở bàn tay. Vệ sinh táy đúng kỹ thuật và đủ thời gian loại bỏ VSV trên bàn tay nhiều hơn là vệ sinh tay không đủ các bước và không đủ thời gian (20 – 30 giây). Thực hiện tốt vệ sinh tay giúp làm giảm 30% – 50% nhiễm khuẩn bệnh viện vệ sinh tay là biện pháp đơn giản và hiệu quả trong phòng ngừa nhiễm khuẩn bệnh viện, đồng thời cũng là biện pháp hữu ích nhằm đảm bảo an toàn cho nhân viên y tế trong thực hành chăm sóc và điều trị người bệnh.
- Thời điểm rửa tay:
+ Trước và sau khi tiếp xúc với bệnh nhân.
+ Trước khi làm thủ thuật vô trùng.
+ Sau khi tiếp xúc với máu, dịch cơ thể.
+ Sau khi tiếp xúc với vùng xung quanh bệnh nhân.
- Các bước vệ sinh tay gồm 6 bước dưới đây, mỗi bước lặp lại 5 lần:
+ Bước 1: chà 2 lòng bàn tay vào nhau.
+ Bước 2: chà lòng bàn tay này lên mu bàn tay kia và ngược lại.
+ Bước 3: chà 2 lòng bàn tay vào nhau, miết mạnh các ngón tay vào các kẽ ngón.
+ Bước 4: chà mu các ngón tay này lên lòng bàn tay kia và ngược lại (mu tay để khum khớp với lòng bàn tay).
+ Bước 5: chà ngón cái của bàn tay này vào lòng bàn tay kia và ngược lại (lòng bàn tay ôm lấy ngón cái).
+ Bước 6: chà các đầu ngón tay này vào lòng bàn tay kia và ngược lại.
9. KIỂM TRA VÀ QUẢN LÝ ÁP LỰC BÓNG CHÈN
Một trong những vấn đề quan trọng ở bệnh nhân đặt ống nội khí quản thở máy là quản lý và duy trì áp lực bóng chèn. Duy trì áp lực bóng chèn ở mức 20-30 cmH2O. Đo áp lực bóng chèn trước khi làm các kỹ thuật chăm sóc bệnh nhân sau khi chăm sóc bệnh nhân, đo lại định kỳ mỗi 8-12 giờ.
Nếu áp lực dưới 20 cmH2O sẽ làm dịch tiết ở trên họng miệng bệnh nhân chảy xuống gây viêm phổi làm tăng nguy cơ VPLQTM, tuy nhiên, nếu áp lực bóng chèn trên 30 cmH2O sẽ dẫn đến tổn thương niêm mạc khí quản như sẹo khí quản, tạo thành lỗ dò do giảm tưới máu đến vị trí dưới bóng chèn.
10. HÚT TRÊN BÓNG CHÈN ĐỊNH KỲ
Phương pháp hút trên bóng chèn nội khí quản (dẫn lưu trên thanh môn) làm giảm nguy cơ viêm phổi hít, làm giảm tỷ lệ VPLQTM. Nhiều nhà sản xuất thiết kế ống nội khí quản đặc biệt như Hi lo Evac có thể hút liên tục hoặc ngắt quãng chất tiết trên thanh môn. Nhiều báo cáo cho thấy hút trên bóng chèn nội khí quản làm giảm thời gian nằm tại Hồi sức tích cực trung bình 1,52 ngày, giảm thời gian thở máy trung bình 1,08 ngày, kéo dài thời gian mới mắc VPLQTM lên 2,66 ngày.
TÀI LIỆU THAM KHẢO
- Jones, B.E., et al., Incidence and Outcomes of NonVentilator-Associated Hospital-Acquired Pneumonia in 284 US Hospitals Using Electronic Surveillance Criteria. JAMA Network Open, 2023. 6(5): p. e2314185-e2314185.
- Lukasewicz Ferreira, S.A., et al., Factors predicting nonventilated hospital-acquired pneumonia: systematic review and meta-analysis. Journal of Hospital Infection, 2022. 119: p. 64-76.
- Giuliano, K.K., D. Baker, and B. Quinn, The epidemiology of nonventilator hospital-acquired pneumonia in the United States. American Journal of Infection Control, 2018. 46(3): p. 322-327.
- Maria Sole, V., et al., Is ventilated hospital-acquired pneumonia a worse entity than ventilator-associated pneumonia? European Respiratory Review, 2020. 29(157): p. 20-23.
- Kalil, A.C., et al., Management of Adults With Hospital- acquired and Ventilator-associated Pneumonia: 2016 Clinical Practice Guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 2016. 63(5): p. e61-e111.
- Cook, D.J., et al., Incidence of and risk factors for ventilator- associated pneumonia in critically ill patients. Annals of Internal Medicine, 1998. 129(6): p. 433-440.
- Wang, Y., et al., National trends in patient safety for four common conditions, 2005-2011. The New England Journal of Medicine, 2014. 370(4): p. 341-351.
- Sopena, N., M. Sabrià, and G. Neunos Study, Multicenter study of hospital-acquired pneumonia in non-ICU patients. Chest, 2005. 127(1): p. 213-219.
- Muscedere, J.G., A. Day, and D.K. Heyland, Mortality, attributable mortality, and clinical events as end points for clinical trials of ventilator-associated pneumonia and hospital-acquired pneumonia. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 2010. 51 Suppl 1: p. S120-125.
- Allegranzi, B., et al., Burden of endemic health-care- associated infection in developing countries: systematic review and meta-analysis. Lancet (London, England), 2011. 377(9761): p. 228-241.
- Kollef, M.H., et al., Global prospective epidemiologic and surveillance study of ventilator-associated pneumonia due to Pseudomonas aeruginosa. Critical Care Medicine, 2014. 42(10): p. 2178-2187.
- Unahalekhaka, A., et al., Using a collaborative to reduce ventilator-associated pneumonia in Thailand. Joint Commission Journal on Quality and Patient Safety, 2007. 33(7): p. 387-394.
- Xie, J.-F., et al., The Current Epidemiological Landscape of Ventilator-associated Pneumonia in the Intensive Care Unit: A Multicenter Prospective Observational Study in China. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America, 2018. 67: p. S153-S161.
- Giang, B.H., Nghiên cứu đặc điểm vi khuẩn và điều trị nhiễm khuẩn bệnh viện tại khoa Hồi sức tích cực, Bệnh viện Bạch Mai năm 2012. Trường đại học Y Hà Nội.
- Nghiên cứu đặc điểm viêm phổi liên quan đến thở máy tại khoa săn sóc đặc biệt Bệnh viện Chợ Rẫy.
- Vũ Đình Thắng, N.T.T.B., Khảo sát đặc điểm đề kháng kháng sinh của vi khuẩn gây viêm phổi bệnh viện ở bệnh nhân thở máy điều trị tại khoa HSTC _CĐ BV 115, Y Học TP.HCM. 2014. p. 1,324-329.
- Bình, H.S., Nhận xét một số yếu tố liên quan và hiệu quả điều trị ở bệnh nhân viêm phổi liên quan đến thở máy. 2015: Bệnh viện Bạch Mai.
- Coffin, S.E., et al., Strategies to prevent ventilator- associated pneumonia in acute care hospitals. Infection Control and Hospital Epidemiology, 2008. 29 Suppl 1: p. S31-40.
- Epidemiology, pathogenesis, microbiology, and diagnosis of hospital-acquired and ventilator-associated pneumonia in adults.
- Sievert, D.M., et al., Antimicrobial-resistant pathogens associated with healthcare-associated infections: summary of data reported to the National Healthcare Safety Network at the Centers for Disease Control and Prevention, 2009-2010. Infection Control and Hospital Epidemiology, 2013. 34(1): p. 1-14.
- Jones, R.N., Microbial Etiologies of Hospital-Acquired Bacterial Pneumonia and Ventilator-Associated Bacterial Pneumonia. Clinical Infectious Diseases, 2010. 51: p. S81-S87.
- Djordjevic, Z.M., M.M. Folic, and S.M. Jankovic, Distribution and antibiotic susceptibility of pathogens isolated from adults with hospital-acquired and ventilator-associated pneumonia in intensive care unit. Journal of Infection and Public Health, 2017. 10(6): p. 740-744.
- Ferrer, M., et al., Validation of the American Thoracic Society-Infectious Diseases Society of America guidelines for hospital-acquired pneumonia in the intensive care unit. 2010: p. 945-52.
- Nseir, S., et al., Is there a continuum between ventilator- associated tracheobronchitis and ventilator- associated pneumonia? Intensive Care Med.: p. 42(7):1190-2.
- Restrepo, M.I., et al., Comparison of the bacterial etiology of early-onset and late-onset ventilator-associated pneumonia in subjects enrolled in 2 large clinical studies. 2013: p. 58(7):1220-
- Quartin, A.A., et al., A comparison of microbiology and demographics among patients with healthcare – associated, hospital-acquired, and ventilator-associated pneumonia: a retrospective analysis of 1184 patients from a large, international study. 2013: p. 13:561.
- Hortal, J., et al., Incidence and risk factors for ventilator- associated pneumonia after major heart surgery. Intensive Care Medicine, 2009. 35(9): p. 1518-1525.
- European Centre for Disease, P. and Control, Healthcare- associated infections in intensive care units. 2018.
- Koulenti, D., E. Tsigou, and J. Rello, Nosocomial pneumonia in 27 ICUs in Europe: perspectives from the EU- VAP/CAP study. 2017: p. 36(11):1999-2006.
- Pulido Mr, -M.P.G.-G.V.F.C.F.P.Á.G.-M.J. and et al., Application of BioFire FilmArray Blood Culture Identification panel for rapid identification of the causative agents of ventilator- associated pneumonia. 2018: p. 24(11):1213.e1-4.
- Boyd, S., et al., Ventilator-associated pneumonia in critically ill patients with COVID-19 infection: a narrative review. ERJ Open Research, 2022. 8(3).
- Giang Thục, A., Đánh giá sử dụng kháng sinh điều trị nhiễm khuẩn bệnh viện tại khoa điều trị tích cực, bệnh viện Bạch Mai năm 2003-2004. 2004, Đại học Y Hà Nội: Bệnh viện Bạch
- Bùi Hồng, , Nghiên cứu đặc điểm vi khuẩn và điều trị nhiễm khuẩn bệnh viện tại khoa Hồi sức tích cực Bệnh viện Bạch Mai. 2013, Đại học Y Hà Nội.
- Trần Hữu, , A. Nguyễn Đạt, and T. Đặng Quốc, Nghiên cứu căn nguyên gây viêm phổi liên quan đến thở máy tại khoa Cấp cứu và Hồi sức tích cực bệnh viện Bạch Mai. 2012, Y học Việt Nam. 65-69.
- Huynh Van, B., et al., KHẢO SÁT TÌNH HÌNH VIÊM PHỔI BỆNH NHÂN SAU MỔ CÓ THỞ MÁY TẠI KHOA PTGMHS -BV NHÂN DÂN GIA ĐỊNH. Y học Thành phố Hồ Chí Minh, 2009. 13: p. 208-214.
- Nguyễn Ngọc, Q., Nghiên cứu tình hình và hiệu quả điều trị viêm phổi liên quan đến thở máy. 2011: Đại Học Y Hà Nội.
- Nguyễn Kỳ, and B. Ngô Thanh, Khảo sát các yếu tố nguy cơ liên quan đến tử vong ở bệnh nhân viêm phổi tại BV đa khoa Lâm Đồng. 2013: Y học TP.HCM. p. 105-113.
- Lê Bảo Huy, Đ.T., Đặc điểm vi khuẩn gây bệnh và tình hình kháng kháng sinh ở bệnh nhân lớn tuổi viêm phổi liên quan thở máy tại khoa hồi sức cấp cứu Y Học TP. Hồ Chí Minh. 2012. p. 78-86.
- Phạm, L., Khảo sát in vitro vi khuẩn gây viêm phổi bệnh viện tại khoa Hồi sức cấp cứu bệnh viện Phạm Ngọc Thạch năm 2010 – 2011. 2013: Y Học HCM. p. 97-104.
- Nguyễn Xuân, V., et al., Đặc điểm lâm sàng và cận lâm sàng của viêm phổi bệnh viện do vi khuẩn Acinetobacter Baumannii ở người cao tuổi tại bệnh viện Thống Nhất. 2014: Y Học HCM. p. 312 – 317.
- Phạm Hồng, , P. Đoàn Mai, and A. Lê Vân, Mức độ kháng kháng sinh của Staphyloccoccus aureus phân lập tại Bệnh viện Bạch Mai. 2014: p. 66-74.
- Modi, A.R. and C.S. Kovacs, Hospital-acquired and ventilator-associated pneumonia: Diagnosis, management, and prevention. Cleveland Clinic Journal of Medicine, 2020. 87(10): p. 633-639.
- Zade, P., et al., A Literature Review on Hospital-Acquired Pneumonia (HAP), Community-Acquired Pneumonia (CAP), and Ventilator-Associated Pneumonia (VAP). Gene, Cell and Tissue, 2022. In Press.
- Maruna, P., K. Nedelníková, and R. Gurlich, Physiology and genetics of procalcitonin. Physiological Research, 2000. 49 Suppl 1: p. S57-61.
- Charles, P.E., et al., Serum procalcitonin for the early recognition of nosocomial infection in the critically ill patients: a preliminary report. BMC infectious diseases, 2009. 9: p. 49.
- Muller, F., et al., Procalcitonin levels predict bacteremia in patients with community-acquired pneumonia: a prospective cohort trial. Chest, 2010. 138(1): p. 121-129.
- Assicot, M., et al., High serum procalcitonin concentrations in patients with sepsis and infection. Lancet (London, England), 1993. 341(8844): p. 515-518.
- Ramirez, P., et al., Sequential measurements of procalcitonin levels in diagnosing ventilator-associated pneumonia. The European Respiratory Journal, 2008. 31(2): p. 356-362.
- Specimen Collection for Unexplained Respiratory Outbreaks (URDO) | CDC.
- Zilberberg, M.D., et al., Inappropriate Empiric Therapy Impacts Complications and Hospital Resource Utilization Differentially Among Different Types of Bacterial Nosocomial Pneumonia: A Cohort Study, United States, 2014-2019. Critical Care Explorations, 2022. 4(4): p. e0667.
- Torres, A., et al., Summary of the international clinical guidelines for the management of hospital-acquired and ventilator-acquired pneumonia. ERJ Open Research, 2018. 4(2): p. 00028-2018.
- Bart, S.M., et al., Trends in Hospital-Acquired and Ventilator-Associated Bacterial Pneumonia Trials. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 2021. 73(3): p. e602-e608.
- Sự đề kháng kháng sinh của các vi khuẩn gây bệnh thường gặp tại Bệnh viện Đại học Y Dược thành phố Hồ Chí
- Dalhoff, K., et al., Adult patients with nosocomial pneumonia: epidemiology, diagnosis, and treatment. Deutsches Arzteblatt International, 2013. 110(38): p. 634-640.
- Wang, Q., et al., Procalcitonin-guided antibiotic discontinuation in ventilator-associated pneumonia: a prospective observational study. Infection and Drug Resistance, 2019. 12: p. 815-824.
- Cao Minh, N., B. Nguyễn Thanh, and V.T.K. Cương, Nhiễm khuẩn do Acinetobacter baumannii và tính kháng thuốc. 2008, Y học HCM. 12.
- Cường T., T.H., Tuấn N. T., & Hiên M. X., Đánh giá bước đầu vai trò của procalcitonin trong định hướng dừng kháng sinh ở bệnh nhân viêm phổi thở máy. ournal of 108 – Clinical Medicine and Phamarcy, 2020. 15.
- Quân, N.Đ., Đánh giá sự tuân thủ và hiệu quả của gói dự phòng viêm phổi liên quan đến thở máy, tại khoa Hồi sức tích cực Bệnh viện Bạch Mai, L.v.T.s.Y. học, 2020: Trường Đại học Y Hà Nội.
- Lim, K.P., et al., Efficacy of ventilator-associated pneumonia care bundle for prevention of ventilator-associated pneumonia in the surgical intensive care units of a medical center. J Microbiol Immunol Infect, 2015. 48(3): p. 316-21.
- Đào Xuân Cơ, Đ.Q.T., Tài liệu hướng dẫn dự phòng viêm phổi liên quan thở máy. Nhà xuất bản Thanh Niên,
- Klompas, M., et al., Strategies to prevent ventilator- associated pneumonia, ventilator-associated events, and nonventilator hospital-acquired pneumonia in acute-care hospitals: 2022 Update. Infect Control Hosp Epidemiol, 2022. 43(6): p. 687-713.































