Một số điểm mới trong Luật Dược 105/2016/QH13
I. QUAN ĐIỂM CHỈ ĐẠO XÂY DỰNG LUẬT
1. Tiếp tục thể chế hoá đường lối, chủ trương, chính sách của Đảng và Nhà nước về phát triển ngành Dược.
2. Bảo đảm hợp hiến, hợp pháp, thống nhất và đồng bộ trong hệ thống pháp luật VN (Luật đầu tư, Luật DN, Luật giá, Luật đấu thầu) cũng như với các cam kết quốc tế mà Việt Nam là thành viên.
3. Thiết lập được hệ thống quản lý từ sản xuất, xuất khẩu, nhập khẩu, bán buôn, bán lẻ, cung ứng thuốc, thông tin, quảng cáo đến sử dụng thuốc bảo đảm mục tiêu cung ứng đủ thuốc có chất lượng, an toàn hiệu quả và nâng cao khả năng tiếp cận thuốc của người dân.
4. Đơn giản, minh bạch, tạo thuận lợi cho tổ chức, cá nhân hoạt động trong lĩnh vực dược; cải cách thủ tục hành chính, hiện đại hoá công tác quản lý dược và hội nhập với các nước trong khu vực và thế giới.
II. BỐ CỤC CỦA LUẬT DƯỢC
Luật Dược số 105/2016/QH13 gồm 14 Chương, 116 Điều (so với Luật Dược số 34/2005/QH11 tăng 43 điều và có 4 Chương mới: Chương 2, 3,11, 13) cụ thế:
Chương I. Những quy định chung
Chương II. Chính sách của nhà nước về dược và phát triến công nghiệp dược
Chương III. Hành nghề dược
Chương IV. Kinh doanh dược
Chương V. Đăng ký, lưu hành, thu hồi thuốc và nguyên liệu làm thuốc
Chương VI. Dược liệu và thuốc cổ truyền
Chương VII. Đơn thuốc và sử dụng thuốc
Chương VIII. Thông tin thuốc, quảng cáo thuốc và cảnh giác dược
Chương IX. Dược lâm sàng
Chương X. Quản lý thuốc trong cơ sở khám bệnh, chữa bệnh
Chương XI. Thử thuốc trên lâm sàng, thử tương đương sinh học của thuốc
Chương XII. Quy chuẩn, tiêu chuẩn chất lượng và việc kiểm nghiệm thuốc, nguyên liệu làm thuốc, bao bì tiếp xúc trực tiếp với thuốc
Chương XIII. Quản lý giá thuốc
Chương XIV. Điều khoản thi hành
III. MỘT SỐ ĐIỂM MỚI SO VỚI LUẬT DƯỢC 34/2005/QH11
So với Luật dược 2005, Luật Dược 2016 có những điểm mới ở những nội dung sau:
1. Sửa đổi, bổ sung một số thuật ngữ
2. Chính sách của Nhà nước về dược và phát triển công nghiệp dược
3. Hành nghề dược
4. Kinh doanh dược
5. Đăng ký thuốc
6. Phát triển dược liệu, thuốc dược liệu và thuốc cổ truyền
7. Dược lâm sàng
8. Thử thuốc trên lâm sàng
9. Quản lý nhà nước về giá thuốc
10. Tăng cường quản lý chất lượng thuốc
SỬA ĐỔI BỔ SUNG MỘT SỐ THUẬT NGỮ
Có 43 từ ngữ được sử dụng và giải thích (LD 2005: 32)
Sửa đổi một số thuật ngữ:
• Thuốc/nguyên liệu làm thuốc
• Sinh phẩm (sinh phẩm tham chiếu, sinh phẩm tương tự)
• Thuốc dược liệu/ thuốc cổ truyền/Vị thuốc cổ truyền
• Thuốc mới
• Thuốc giả
• Hạn dùng của thuốc
• Hành nghề dược, thực hành tốt…
Bổ sung giải thích các thuật ngữ
• Thuốc generic
• Biệt dược gốc
• Sinh khả dụng/Tương đương sinh học
• Dược lâm sàng
• Cảnh giác dược
• Bao bì tiếp xúc trực tiếp với thuốc
• Dược liệu, dược liệu giả, thuốc hóa dược
• Thuốc hiếm
• Thuốc dạng phối hợp có chứa dược chất gây nghiện/ dược chất hướng tâm thần/ tiền chất
CHÍNH SÁCH NHÀ NƯỚC VỀ DƯỢC VÀ PHÁT TRIỂN CÔNG NGHIỆP DƯỢC
1. Quy định các lĩnh vực tập trung ưu tiên:
Nghiên cứu sản xuất nguyên liệu làm thuốc từ nguồn dược liệu sẵn có tại Việt Nam để phục vụ công nghiệp bào chế, sản xuất thuốc dược liệu, thuốc cổ truyền;
Phát triển nguồn dược liệu làm thuốc, vùng nuôi trồng dược liệu; bảo tồn nguồn gen và những loài dược liệu quý, hiếm, đặc hữu.
Thay cho ưu tiên phát triển sản xuất nguyên liệu hóa dược tại Luật Dược 2005.
1.2. Quy định chính sách ưu tiên sử dụng thuốc trong nước
• Không chào thầu thuốc nhập khẩu thuộc danh mục do Bộ trưởng Bộ Y tế ban hành trên cơ sở nhóm tiêu chí kỹ thuật khi thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị, giá thuốc và khả năng cung ứng.
• Ưu tiên mua thuốc generic, sinh phẩm tương tự đầu tiên sản xuất trong nước; thuốc dược liệu, thuốc cổ truyền được sản xuất từ nguồn dược liệu trong nước; thuốc có sử dụng dược chất, tá dược, vỏ nang hoặc bao bì tiếp xúc trực tiếp được sản xuất bởi cơ sở trong nước đáp ứng GMP; dược liệu tươi; thuốc dược liệu, thuốc cổ truyền được sản xuất trên cơ sở nhiệm vụ KH&CN cấp quốc gia, cấp bộ, cấp tỉnh.
• Không chào thầu dược liệu nhập khẩu thuộc danh mục do Bộ trưởng Bộ Y tế ban hành khi dược liệu được nuôi trồng, thu hái trong nước đáp ứng nhu cầu về điều trị và khả năng cung cấp, giá hợp lý.
1.3. Bổ sung các chính sách ưu tiên đối với thuốc sắp hết hạn bằng sáng chế hoặc các độc quyền có liên quan; tạo điều kiện thuận lợi trong việc cấp số đăng ký thuốc generic.
1.4. Sản xuất thuốc ngay khi hết hạn bằng sáng chế hoặc các độc quyền có liên quan; vắc xin, sinh phẩm, thuốc dược liệu, thuốc cổ truyền.
Tăng cường khả năng tiếp cận thuốc của người dân
NHỮNG HÀNH VI BỊ NGHIÊM CẤM (ĐIỀU 6)
Kinh doanh không có Giấy CNĐ ĐKKDD
Kinh doanh dược tại nơi không phải là địa điểm đã đăng ký
Kinh doanh thuốc, nguyên liệu làm thuốc quy định tại khoản 26 Điều 2 và các loại khác không đúng mục đích hoặc cung cấp không đúng đối tượng được phép
Kinh doanh không thuộc phạm vi chuyên môn
Kinh doanh thuộc một trong các trường hợp:
-Thuốc giả/Thuốc đã có thông báo thu hồi của cơ quan nhà nước có thẩm quyền/thuốc không rõ nguồn gốc, xuất xứ, hết hạn dùng
-Thuốc thuộc danh mục cấm
-Thuốc thử lâm sàng/thuốc của chương trình mục tiêu quốc gia/thuốc làm mẫu đăng ký, kiểm nghiệm/ thuốc viện trợ
Làm giả, sửa chữa hồ sơ, sửa chữa hạn dùng khi chưa được phép…giấy chứng nhận của cơ quan, tổ chức có thẩm quyền
Hành nghề mà không có CCHND tại các vị trí công việc yêu cầu phải có CCHND
Thuê, mượn, cho thuê, cho mượn hoặc cho người khác sử dụng CCHND/ Giấy CNĐ ĐKKDD
Sử dụng chứng nhận/kết quả nghiên cứu chưa được Bộ Y tế công nhận …. Để quảng cáo thuốc
Khuyến mại thuốc trái quy định của pháp luật
Cấp phát, bán thuốc hết hạn dùng….
Thông tin, quảng cáo, tiếp thị, tư vấn, ghi nhãn…có nội dung phòng bệnh, chữa bệnh đối với sản phẩm không phải là thuốc, trừ TTBYT
Xuất khẩu dược liệu thuộc danh mục loài, chủng loại dược liệu quý, hiếm, đặc hữu phải kiểm soát khi chưa được phép của cơ quan quản lý có thẩm quyền
CHỨNG CHỈ HÀNH NGHỀ DƯỢC
Bổ sung các vị trí phải có Chứng chỉ hành nghề dược:
Ngoài người chịu trách nhiệm chuyên môn dược của cơ sở, yêu cầu:
Người phụ trách về bảo đảm chất lượng thuốc đối với cơ sở sản xuất thuốc, nguyên liệu làm thuốc;
Người phụ trách công tác dược lâm sàng của cơ sở khám bệnh, chữa bệnh;
Đưa các nội dung về điều kiện cấp Chứng chỉ hành nghề dược quy định tại Nghị định số 79/2006/NĐ-CP để nâng lên Quy định tại Luật.
CCHND không quy định thời hạn hiệu lực
Điều kiện cấp CCHND:
• Có văn bằng, chứng chỉ, giấy chứng nhận chuyên môn
• Có thời gian thực hành
• Có GCN đủ sức khỏe
• Không thuộc một trong các trường hợp: Truy cứu trách nhiệm hình sự/đang chấp hành bản án, quyết định của tòa án, trong thời gian bị cấm hành nghề…
• Người nước ngoài/ Người VN định cư nước ngoài: phải đáp ứng điều kiện sử dụng Tiếng Việt
Giảm điều kiện về thời gian thực hành trước khi được cấp CCHN từ 05 năm xuống còn 02 hoặc 03 năm với một số vị trí hành nghề, trừ người chịu trách nhiệm chuyên môn và người phụ trách đảm bảo chất lượng của cơ sở sản xuất thuốc, nguyên liệu làm thuốc là 05 năm (như trước)
Bổ sung cấp CCHND hình thức thi quốc gia để tiến tới hội nhập và công nhận CCHND lẫn nhau với các nước
• Tự nguyên đăng ký
• Thẩm quyền cấp: Bộ Y tế
• Không ghi thời hạn và có giá trị sử dụng trên phạm vi cả nước như CCHND do Sở Y tế cấp
Thẩm quyền cấp CCHND:
• Bộ Y tế: Cấp CCHND hình thức thi
• Sở Y tế: Cấp CCHND hình thức xét hồ sơ
Hồ sơ đề nghị cấp CCHND:
• Đơn
• Bản sao có chứng thực văn bằng chuyên môn
• Giấy chứng nhận sức khỏe để hành nghề dược
• Giấy xác nhận về thời gian thực hành chuyên môn
• Giấy xác nhận hoàn thành chương trình đào tạo, cập nhật kiến thức chuyên môn đối với một số trường hợp bị thu hồi
• Bản sao có chứng thực căn cước công dân/CMND/Hộ chiếu
• Phiếu lý lịch tư pháp
Hồ sơ đề nghị cấp lại
• Đơn
• Bản sao CCHND đã được cấp/trường hợp bị mất, có cam kết
Hồ sơ điều chỉnh nội dung CCHND
Quyền của người hành nghề dược
Cấp CCHND khi đáp ứng đủ điều kiện
Được đào tạo, cập nhật kiến thức chuyên môn, trao đổi thông tin chuyên môn, pháp luật về dược
Được ủy quyền cho người có CCHND phù hợp khi vắng mặt
Được thay thế thuốc theo quy định: cùng hoạt chất/cách dùng/liều lượng
Từ chối thực hiện hoạt động chuyên môn trái với với quy định
Nghĩa vụ của người hành nghề dược
• Tuân thủ đạo đức nghề nghiệp
• Chịu trách nhiệm chuyên môn của một cơ sở kinh doanh dược
• Có mặt toàn bộ thời gian đối với cơ sở bán lẻ thuốc
• Hành nghề theo đúng phạm vi
• Hoàn thành chương trình đào tạo, cập nhật kiến thức chuyên môn
Thu hồi CCHND
• Cấp không đúng thẩm quyền
• Người được cấp đề nghị thu hồi
• Bị ghi sai do lỗi của cơ quan cấp
• Giả mạo giấy tờ
• Cá nhân có từ 02 CCHND trở lên
• Cho thuê, mượn, sử dụng CCHND
• Không đáp ứng một trong các điều kiện được cấp CCHND
• Không hành nghề liên tục trong 12 tháng
• Không hoàn thành cập nhật kiến thức chuyên môn về dược trong 3 năm kể từ ngày được cấp CCHND
• Vi phạm đạo đức nghề nghiệp
• Đã bị xử phạt vi phạm hành chính bằng hình thức tước CCHND từ 02 lần trở lên
Điều khoản chuyển tiếp
• CCHND được sử dụng đến hết thời hạn hiệu lực (không ghi thời hạn thì có giá trị vĩnh viễn)
• CCHND có ghi thời hạn: đề nghị cấp theo thủ tục cấp lại
• Người có CCHND đã được cấp theo Luật Dược 2005, phải cập nhật kiến thức chuyên môn trong vòng 03 năm kể từ ngày Luật Dược 2016 có hiệu lực.
KINH DOANH DƯỢC
CÁC HÌNH THỨC KINH DOANH
Luật quy định kinh doanh Dược bao gồm kinh doanh thuốc, nguyên liệu làm thuốc và kinh doanh một số dịch vụ liên quan đến thuốc, nguyên liệu làm thuốc để thống nhất với Quy định tại Luật Đầu tư năm 2014
GCNĐĐKDD không quy định thời hạn hiệu lực, nhưng có đánh giá đủ điều kiện định kỳ 03 năm/lần hoặc đột xuất
Thời hạn giải quyết thủ tục cấp GCNĐĐKKDD rút ngắn
Bổ sung hình thức kinh doanh dịch vụ thử thuốc trên lâm sàng và dịch vụ thử tương đương sinh học của thuốc
Thẩm quyền cấp:
Bộ Y tế: Sản xuất/XNK/Dịch vụ bảo quản/kiểm nghiệm/thử BA/BE/ thử thuốc trên LS
Sở Y tế: bán buôn/bán lẻ
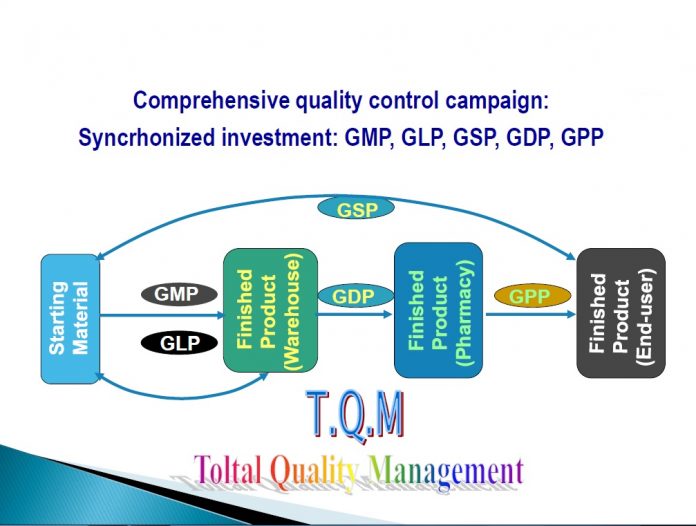
ĐIỀU KIỆN CẤP GIẤY CHỨNG NHẬN ĐỦ ĐIỀU KIỆN KINH DOANH DƯỢC
– Sản xuất thuốc, nguyên liệu làm thuốc: GMP
– Xuất- Nhập khẩu thuốc: GSP
– Dịch vụ bảo quản: GSP
– Bán buôn thuốc, nguyên liệu: GDP
– Bán lẻ thuốc: GPP
– Dịch vụ KN thuốc, nguyên liệu: GLP
– Dịch vụ thử thuốc trên lâm sàng: GCP
– Dịch vụ BA/BE: GLP, GCP
– Kinh doanh dược liệu, thuốc cổ truyền: Chính phủ quy định
Sản xuất Bao bì trực tiếp với thuốc: không bắt buộc điều kiện kinh doanh, có chính sách ưu tiên và khuyến khích sử dụng bao bì trực tiếp với thuốc sản xuất tại các cơ sở SX trong nước đạt GMP về sản xuất bao bì.
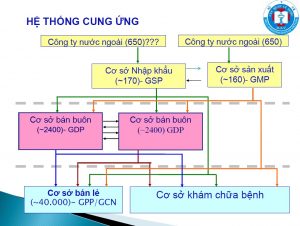
CÁC CƠ SỞ KHÔNG YÊU CẦU CẤP GIẤY CHỨNG NHẬN ĐỦ ĐK KINH DOANH DƯỢC
Cơ sở dược nhưng không vì mục đích thương mại
Bán một số thuốc không kê đơn tại các cơ sở kinh doanh hàng hóa tiêu dùng dưới hình thức kệ thuốc. (Bộ Y tế quy định chi tiết danh mục các thuốc)
Huy động sự tham gia của lực lượng vũ trang trong việc cung ứng thuốc và nuôi trồng dược liệu ở các vùng có điẽu kiện kinh tế – xã hội đặc biệt khó khăn, vùng đồng bào dân tộc thiểu số, vùng sâu, vùng xa, biên giới, hải đảo.
Cơ sở nuôi trồng thu hái dược liệu
QUYỀN VÀ TRÁCH NHIỆM CỦA CƠ SỞ KINH DOANH DƯỢC
Quyền chung của cơ sở kinh doanh dược
• Thực hiện một, một số hoặc tất cả hoạt động kinh doanh dược nếu đáp ứng đủ điều kiện tương ứng
• Hưởng chính sách ưu đãi theo quy định
• Được thông tin, quảng cáo thuốc theo quy định của pháp luật
• Thực hiện chương trình hỗ trợ thuốc miễn phí cho cơ sở khám bệnh, chữa bệnh để điều trị cho bệnh nhân theo quy định của Bộ trưởng Bộ Y tế
• Tổ chức bán lẻ thuốc lưu động
Trách nhiệm chung của cơ sở kinh doanh dược
• Có giấy chứng nhận ĐĐKKD Dược
• Duy trì các điều kiện kinh doanh trong quá trình hoạt động
• Thu hồi thuốc, nguyên liệu làm thuốc theo quy định tại Điều 62 của LD
• Chấp hành quyết định của cơ quan nhà nước có thẩm quyền trong trường hợp bảo đảm cung ứng thuốc khi xảy ra dịch bệnh nguy hiểm, thiên tai, thảm họa
Báo cáo Bộ Y tế/Sở Y tế trong trường hợp ngừng hoạt động dược từ 06 tháng trở lên hoặc chấm dứt hoạt động
Thông báo, cập nhật danh sách người có CCHN Dược đang hành nghề tại cơ sở đến cơ quan có thẩm quyền theo quy định của Bộ trưởng Bộ Y tế
Niêm yết công khai CCHND & Giấy CNĐ DDKKDDD tại cơ sở kinh doanh
Tuân thủ quy định của Bộ Y tế trong việc mua, bán thuốc thuốc Danh mục hạn chế bán lẻ
Niêm yết giá bán buôn, bán lẻ bằng đồng VN tại nơi giao dịch
Lưu giữ chứng từ, tài liệu có liên quan đến từng lô thuốc, nguyên liệu làm thuốc trong thời gian ít nhất 01 năm
Bảo quản thuốc, nguyên liệu làm thuốc theo đúng điều kiện ghi trên nhãn
Ghi rõ thông tin về thuốc trong trường hợp bán lẻ thuốc không đựng trong bao bì ngoài của thuốc
Chỉ được bán thuốc kê đơn tại cơ sở bán lẻ thuốc khi có đơn thuốc
Quy định cụ thể quyền và trách nhiệm của từng loại hình cơ sở kinh doanh dược
Quyền của cơ sở kinh doanh dược tương ứng với điều kiện kinh doanh cơ sở đó đáp ứng
Một số hoạt động liên quan được quy định cụ thể trên nguyên tắc không cấp riêng giấy CN ĐĐKKD mà các điều kiện đối với hoạt động liên quan sẽ được đánh giá chung khi đánh giá điều kiện kinh doanh
Cơ sở sản xuất: tất cả các quyền chung
– Nghiên cứu, sản xuất thử, nhượng quyền sản xuất & nhận nhượng quyền; gia công và nhận gia công thuốc
– Đăng ký lưu hành thuốc
– Nhập khẩu, mua nguyên liệu để phục vụ sản xuất, nghiên cứu, sản xuất thử
– Bán nguyên liệu cho các cơ sở sản xuất khác
– Bán thuốc, nguyên liệu làm thuốc do cơ sở sản xuất cho cơ sở bán buôn, bán lẻ thuốc và cơ sở khám bệnh, chữa bệnh
– Xuất khẩu thuốc, nguyen liệu làm thuốc
Cơ sở nhập khẩu, xuất khẩu:
– Các quyền chung trừ quyền tổ chức bán lẻ thuốc lưu động
– Nhập khẩu, xuất khẩu thuốc, nguyên liệu làm thuốc theo quy định tại Điều 60
– Đăng ký lưu hành thuốc
– Bán thuốc do chính cơ sở nhập khẩu cho các cơ sở bán buôn bán, bán lẻ, cơ sở khám, chữa bệnh (Trường hợp không được thực hiện quyền phân phối thuốc tại VN, theo quy định của Bộ trưởng Bộ Y tế)
Cơ sở bán buôn thuốc: tất cả các quyền chung
– Bán buôn thuốc, nguyên liệu làm thuốc
– Mua thuốc, nguyên liệu làm thuốc
– Đăng ký lưu hành thuốc, nguyên liệu làm thuốc
– Xuất khẩu thuốc, nguyên liệu làm thuốc
Cơ sở kinh doanh dịch vụ bảo quản
– Các quyền chung trừ 02 quyền: (1) Thực hiện chương trình hỗ trợ thuốc (2) Tổ chức bán lẻ thuốc lưu động
– Bảo quản thuốc, nguyên liệu làm thuốc cho tổ chức, cá nhân
– Xuất khẩu thuốc
Cơ sở bán lẻ là Nhà thuốc
– Mua nguyên liệu để pha chế theo đơn
– Mua thuốc để bán lẻ, trừ vắc xin
– Mua, bán lẻ Thuốc quản lý đặc biệt/thuốc hạn chế bán lẻ theo quy định Điều 34
– Cấp phát thuốc bảo hiểm khi đáp ứng yêu cầu và điều kiện của BHYT/Chương trình, dự án
– Dược sĩ bán lẻ thuốc được quyền thay thế thuốc theo quy định
Quầy thuốc
– Các quyền chung trừ quyền thực hiện chương trình hỗ trợ thuốc miễn phí
– Mua và bán lẻ thuốc thuộc: Danh mục thuốc thiết yếu và Danh mục thuốc không kê đơn, trừ vắc xin.
– Mua và bán lẻ thuốc KSĐB, thuốc hạn chế bán lẻ thực hiện theo quy định tại Điều 34.
– Có thể mua/bán một số thuộc theo quy định của Sở Y tế đối với Vùng đồng bào dân tộc thiểu số, miền núi, hải đảo, đặc biệt khó khăn.
– Cấp phát thuốc bảo hiểm khi đáp ứng yêu cầu và điều kiện của BHYT/Chương trình, dự án
Tủ thuốc trạm y tế xã
– Các quyền chung trừ quyền thực hiện chương trình hỗ trợ thuốc miễn phí
– Mua và bán lẻ thuốc thuộc: Danh mục thuốc thiết yếu phù hợp với phân tuyến kỹ thuật, trừ vắc xin.
– Mua và bán lẻ thuốc KSĐB, thuốc hạn chế bán lẻ thực hiện theo quy định tại Điều 34.
– Cấp phát thuốc bảo hiểm khi đáp ứng yêu cầu và điều kiện của BHYT/Chương trình, dự án
Cơ sở kinh doanh thuốc được phép tổ chức bán thuốc lưu động tại các vùng có điều kiện kinh tế – xã hội đặc biệt khó khăn, vùng đồng bào dân tộc thiểu số, vùng sâu, vùng xa, biên giới, hải đảo. Chính phủ quy định chi tiết nội dung này.
Dự thảo Nghị định quy định theo hướng:
• Cơ sở tổ chức bán lẻ thuốc lưu động phải đăng ký với Sở Y tế địa phương về phương tiện, thiết bị bảo quản, địa bàn hoạt động
• Phương tiện, thiết bị bảo quản phải đáp ứng điều kiện bảo quản thuốc
• Sở Y tế xem xét duyệt danh mục thuốc được phép bán lưu động phù hợp với nhu cầu sử dụng trên địa bàn
THUỐC PHẢI KIỂM SOÁT ĐẶC BIỆT
Thuốc kiểm soát đặc biệt:
•Thuốc, nguyên liệu GN, HTT, thuốc tiền chất
•Thuốc dạng phối hợp (có chứa dược chất GN, HTT, TC)
•Thuốc phóng xạ; đồng vị phóng xạ; chất đánh dấu
•Thuốc, nguyên liệu độc (BYT ban hành danh mục)
•Thuốc, dược chất thuộc danh mục chất bị cấm sử dụng trong một số ngành, lĩnh vực (Chính phủ quy định)
Chính phủ quy định:
– Trình tự, thủ tục cho phép kinh doanh thuốc phải kiểm soát đặc biệt và thuốc thuộc danh mục hạn chế bán lẻ
– Biện pháp về an ninh, bảo đảm không thất thoát thuốc phải kiểm soát đặc biệt.
THUỐC, NGUYÊN LIỆU LÀM THUỐC LƯU HÀNH
Thuốc/NLLT được cấp giấy đăng ký lưu hành
Thuốc/NLLT được phép nhập khẩu theo quy định tại khoản 1, 2, 3 và 4 Điều 60 (trừ các loại cấm kinh doanh): ĐKLH/Công bố/GPNK
Thuốc quy định tại điểm b Điều 47 (pha chế tại nhà thuốc), khoản 1 và khoản 2 Điều 70 (pha chế trong bệnh viện), khoản 3 Điều 85 (thuốc cổ truyền bào chế trong cơ sơ KCB)
Thuốc/NLLT được lưu hành đến hết hạn dùng của thuốc trong trường hợp sản xuất trước ngày giấy đăng ký lưu hành hết hiệu lực
Thuốc/NLLT được phép lưu hành đến hết hạn dùng của thuốc trong trường hợp giao hàng tại cảng đi của nước xuất khẩu trước ngày giấy đăng ký lưu hành hết hiệu lực
Thuốc/NLLT được sản xuất hoặc nhập khẩu trước ngày giấy đăng ký lưu hành bị thu hồi theo quy định tại điểm c và g khoản 1 Điều 58 (Nước sản xuất thu hồi GPLH/nhà sx tự thu hồi- Cụ thể trong quyết định thu hồi giấy phép lưu hành)
YÊU CẦU ĐỐI VỚI THUỐC LƯU HÀNH
Thuốc thành phẩm:
Đạt tiêu chuẩn chất lượng và bảo đảm về an toàn, hiệu quả
Đáp ứng yêu cầu về nhãn thuốc (theo Điều 61 của Luật Dược và các quy định liên quan)
Vật liệu bao bì và dạng đóng gói phải đáp ứng yêu cầu bảo đảm chất lượng thuốc
Nguyên liệu
Đạt tiêu chuẩn chất lượng để sản xuất thuốc và bảo đảm về an toàn, hiệu quả
Đáp ứng yêu cầu về nhãn thuốc (theo Điều 61 của Luật Dược và các quy định liên quan)
Vật liệu bao bì và dạng đóng gói phải đáp ứng yêu cầu bảo đảm chất lượng thuốc
36
ĐĂNG KÝ THUỐC, NGUYÊN LIỆU LÀM THUỐC
1. Bổ sung quy định hình thức gia hạn giấy đăng ký lưu hành thuốc – thay cho hình thức cấp lại SĐK
Cấp Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc
Gia hạn Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc
Thay đổi, bổ sung giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
2. Quy định cụ thể về thời hạn cấp giấy đăng ký lưu hành thuốc đối với từng trường hợp, cụ thể:
Không quá 03 tháng đối với việc gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc;
Không quá 12 tháng đối với việc cấp mới giấy đăng ký lưu hành.
Cơ sở đứng tên đăng ký thuốc
• Cơ sở sản xuất, bán buôn, XNK thuốc/nguyên liệu làm thuốc
• Cơ sở kinh doanh thuốc nước ngoài có VPĐD tại Việt Nam
Thuốc, nguyên liệu làm thuốc được cấp GLH khi đáp ứng yêu cầu:
• Bảo đảm về an toàn, hiệu quả
• Được sản xuất tại cơ sở sản xuất thuốc, NLLT đáp ứng điều kiện theo quy định
• Được sản xuất theo quy trình sản xuất thuốc/NLLT và đạt tiêu chuẩn chất lượng theo quy định tại Điều 102 và Điều 103
Yêu cầu phải đánh giá cơ sở sản xuất thuốc nước ngoài theo một trong các hình thức sau:
a) Thẩm định hồ sơ liên quan đến điều kiện sản xuất
b) Công nhận, thừa nhận lẫn nhau kết quả thanh tra, kiểm tra của cơ quan quản lý nhà nước về dược đối với yêu cầu đáp ứng nguyên tắc, tiêu chuẩn GMP
c) Kiểm tra tại cơ sở sản xuất thuốc
Bổ sung trách nhiệm của cơ sở ĐKT:
• Thông báo cho cơ quan quản lý trong một số trường hợp
• Lưu trữ đủ hồ sơ và cung cấp khi có yêu cầu
• Thực hiện các yêu cầu về kiểm tra, đánh giá cơ sở SX khi có yêu cầu của cơ quan quản lý
NHẬP KHẨU THUỐC, NGUYÊN LIỆU LÀM THUỐC, DƯỢC LIỆU, BAO BÌ TIẾP XÚC TRỰC TIẾP VỚI THUỐC
Một số quy định tại Luật Dược 2005 được giữ lại và một số nội dung tại Quyết định 151/2007/QĐ-TTg được đưa lên Luật.
Thuốc, nguyên liệu làm thuốc, dược liệu có Giấy phép lưu hành được phép nhập khẩu không yêu cầu có Giấy phép nhập khẩu của Bộ Y tế, không hạn chế số lượng, Trừ thuốc kiểm soát đặc biệt (Narcotics, Psychotropics, Precursors,….)
– Không cấp phép nhập khẩu nguyên liệu (dược chất) theo đơn hàng
Dược liệu, tá dược, bao bì trực tiếp với thuốc được nhập khẩu dưới hình thức giấy phép nhập khẩu theo quy định cụ thể của Chính phủ
Chính phủ quy định các thuốc, nguyên liệu làm thuốc phải kiểm soát nhập khẩu
PHÁT TRIỂN DƯỢC LIỆU, THUỐC DƯỢC LIỆU VÀ THUỐC CỔ TRUYỀN
1.Ưu tiên mua thuốc dược liệu, thuốc cổ truyền sản xuất trong nước
Không chào thầu dược liệu nhập khẩu thuộc danh mục do Bộ trưởng Bộ Y tế ban hành khi dược liệu được nuôi trồng, thu hái trong nước đáp ứng nhu cầu về điều trị và khả năng cung cấp, giá hợp lý.
2. Hỗ trợ, tạo điều kiện phát triển, đăng ký lưu hành, đăng ký bảo hộ SHTT;
kế thừa thuốc cổ truyền, thuốc dược liệu có đề tài KH&CN Quốc gia, cấp Bộ hoặc cấp Tỉnh.
3. Tiêu chuẩn hóa nguyên liệu đầu vào trong sản xuất thuốc dược liệu, thuốc cổ truyền thông qua việc quy định dược liệu phải đáp ứng tiêu chuẩn, quy chuẩn chất lượng và phải có nguồn gốc, xuất xứ rõ ràng.
4. Quy định thuốc dược liệu được miễn thử lâm sàng hoặc miễn một số giai đoạn thử lâm sàng khi đăng ký lưu hành
5. Thời hạn cấp mới, gia hạn, cấp thay đổi, bổ sung giấy đăng ký lưu hành thuốc cổ truyền ngắn hơn rất nhiều so với thuốc hóa dược (không quá 06 tháng đối với việc cấp giấy đăng ký lưu hành; không quá 01 tháng đối với việc gia hạn, thay đổi, bổ sung giấy đăng ký lưu hành thuốc cổ truyền).
6. Quy định điều kiện cấp CCHND, điều kiện cấp GCNĐĐKDD phù hợp với thực tế.
7. Phân định cách quản lý các loại thuốc cổ truyền:
Thuốc cổ truyền đã được Bộ Y tế công nhận được miễn thử lâm sàng khi đăng ký lưu hành
Thuốc cổ truyền đã được cấp giấy đăng ký lưu hành trước ngày Luật có hiệu lực (01.01.2017) được miễn thử lâm sàng trừ các trường hợp có yêu cầu của Hội đồng tư vấn cấp giấy phép lưu hành
Thuốc cổ truyền được bốc theo bài thuốc, đơn thuốc, được chế biến, bào chế trong cơ sở KCB để cấp phát, bán lẻ theo đơn tại chính cơ sở không phải đăng ký lưu hành và không phải thử thuốc trên lâm sàng
Thuốc cổ truyền do bệnh viện có chức năng KCB bằng YHCT tuyến tỉnh trở lên chế biến, bào chế không phải đăng ký lưu hành và không phải thử thuốc trên lâm sàng được bán cho cơ sở KCB có thực hiện hoạt động KCB bằng YHCT khác trong cùng địa bàn Tỉnh, thành phố trực thuộc TW
DƯỢC LÂM SÀNG
Bổ sung 01 Chương về Dược lâm sàng, cụ thể:
1) Nội dung hoạt động
2) Quyền, nghĩa vụ của dược sĩ làm công tác dược lâm sàng.
3) Điều kiện bảo đảm để triển khai hoạt động dược lâm sàng.
4) Tổ chức triển khai hoạt động dược lâm sàng
Lộ trình triển khai công tác dược lâm sàng, cụ thể:
Đến ngày 01/01/2021:
Các bệnh viện từ hạng 1 trở lên phải tổ chức hoạt động dược lâm sàng quy định tại Điều 80.
Dược sỹ trực tiếp làm công tác dược lâm sàng của cơ sở khám bệnh, chữa bệnh phải có Chứng chỉ hành nghề dược.
THỬ THUỐC TRÊN LÂM SÀNG, THỬ THUỐC TƯƠNG ĐƯƠNG SINH HỌC
1. Quy định thử lâm sàng gồm 4 giai đoạn và phân loại thử thuốc trên lâm sàng:
Thử lâm sàng trước khi cấp phép lưu hành gồm giai đoạn 1, 2 và 3.
Thử lâm sàng đánh giá an toàn, hiệu quả sau khi được cấp phép lưu hành là giai đoạn 4.
2. Bỏ quy định thuốc mới lưu hành ở nước ngoài chưa đủ 05 năm phải thử lâm sàng tại Việt Nam bảo đảm rút ngắn thời gian tiếp cận thuốc mới cho người dân. (*)
Các trường hợp thuốc phải thử lâm sàng, thuốc miễn thử lâm sàng, thuốc miễn một số giai đoạn thử lâm sàng.
QUẢN LÝ NHÀ NƯỚC VỀ GIÁ THUỐC
1. Nguyên tắc quản lý giá thuốc: theo cơ chế thị trường, tôn trọng quyền tự định giá của Doanh nghiệp.
Kiểm soát giá bằng hình thức Kê khai giá và Đấu thầu
2. Bình ổn giá đối với thuốc thiết yếu khi có biến động bất thường.
3. Quy định rõ phạm vi, biện pháp quản lý giá thuốc trong đó tập trung quản lý giá thuốc do ngân sách nhà nước, BHYT chi trả và nguồn thu viện phí thông qua đấu thầu/đặt hàng/giao kế hoạch.
4. Bỏ nội dung không phù hợp (tham khảo giá thuốc tại các nước có điều kiện y tế, thương mại tương tự Việt Nam và công bố giá tối đa đối với thuốc do ngân sách nhà nước và bảo hiểm y tế chi trả).
5. Quy định về đàm phán giá đối với một số thuốc có nguy cơ độc quyền (thuốc hiếm, thuốc biệt dược gốc, có ít đơn vị cung ứng…)
6. Khẳng định trách nhiệm của Bộ Y tế trong việc chủ trì quản lý giá thuốc và phân công rõ trách nhiệm các Bộ, ngành, Ủy ban nhân dân tỉnh và BHXHVN trong việc quản lý giá thuốc.
TĂNG CƯỜNG QUẢN LÝ CHẤT LƯỢNG THUỐC
Quy định cụ thể về hình thức thu hồi, mức độ thu hồi, phạm vi thu hồi, xử lý thuốc; trách nhiệm thu hồi
Quy định chi tiết các trường hợp thuốc phải thu hồi (7 trường hợp)
Hình thức thu hồi theo 2 mức độ: Bắt buộc và Tự nguyện
Mức độ thu hồi theo 3 mức độ (1,2,3) tùy thuộc mức độ nghiêm trọng đến sức khỏe hoặc tính mạng con người
• Mức độ 1: 03 ngày/ Tất cả các cơ sở KDD, KCB, người sử dụng
• Mức độ 2: 15 ngày/ Tất cả các cơ sở KDD, KCB, người sử dụng
• Mức độ 3: 30 ngày/ Tất cả cơ sở KDD
Xử lý thuốc bị thu hồi: tiêu hủy hoặc có thể khắc phục đối với mức độ 3
Trách nhiệm: Cụ thể hóa trách nhiệm của từng đối tượng có liên quan đến thuốc bị thu hồi.
Cơ sở sản xuất, cơ sở nhập khẩu có trách nhiệm (Khoản 1 Đ.64)
a. Ngừng kinh doanh thuốc bị thu hồi
b. Công bố thông tin về thuốc bị thu hồi, tổ chức thu hồi
c. Chi trả chi phí cho việc thu hồi, xử lý thuốc bị thu hồi, bồi thường theo quy định của pháp luật
d. Báo cáo Bộ Y tế về việc thu hồi và kết quả thu hồi
e. Thu hồi tự nguyện: tạm ngừng kinh doanh và báo cáo Bộ Y tế trước khi thu hồi
Cơ sở bán buôn, bán lẻ thuốc có trách nhiệm (Khoản 2 Đ. 64):
a. Ngừng kinh doanh, cấp phát thuốc bị thu hồi
b. Thông báo và tổ chức thu hồi, tiếp nhận thuốc bị thu hồi do cơ sở kinh doanh, cung cấp, người sử dụng trả lại
c. Trả thuốc bị thu hồi cho cơ sở đã cung cấp (nhà sản xuất/nhập khẩu)
d. Chi trả chi phí cho việc thu hồi, xử lý thuốc bị thu hồi và bồi thường thiệt hại theo quy định của pháp luật trong trường hợp có lỗi
Bổ sung 01 Điều về Chất lượng dược liệu
Yêu cầu phải đảm bảo chất lượng, có nguồn gốc, xuất xứ rõ ràng
Tiêu chuẩn phải được công bố theo quy định của pháp luật về tiêu chuẩn và quy chuẩn kỹ thuật; trách nhiệm của các cơ sở sản xuất, cung ứng dược liệu đối với nguồn gốc, xuất xứ và tiêu chuẩn của dược liệu
Yêu cầu về thử tương đương sinh học (TĐSH)
Bổ sung 01 Mục quy định lộ trình thử TĐSH của các thuốc generic
Nguyên tắc thử TĐSH, quy định hồ sơ, quy trình, thủ tục thử tương đương sinh học.
Một số điểm mới trong Luật Dược 105/2016/QH13
TÀI LIỆU ĐÍNH KÈM:
[sociallocker id=7424]
[/sociallocker]