
|
BỘ Y TẾ |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM |
|
Số: 3127/QĐ-BYT |
Hà Nội, ngày 17 tháng 7 năm 2020 |
QUYẾT ĐỊNH
Về việc ban hành tài liệu chuyên môn
“Hướng dẫn chẩn đoán và điều trị ung thư dạ dày”
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật Khám bệnh, chữa bệnh năm 2009;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị ung thư dạ dày”.
Điều 2. Tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị ung thư dạ dày” được áp dụng tại các cơ sở khám bệnh, chữa bệnh trong cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký, ban hành.
Điều 4. Các ông, bà: Chánh Văn phòng Bộ, Chánh thanh tra Bộ, Tổng Cục trưởng, Cục trưởng và Vụ trưởng các Tổng cục, Cục, Vụ thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương, Giám đốc các Bệnh viện trực thuộc Bộ Y tế, Thủ trưởng Y tế các ngành chịu trách nhiệm thi hành Quyết định này./.
Nơi nhận:– Như Điều 4; – Quyền Bộ trưởng (để báo cáo); – Các Thứ trưởng; – Cổng thông tin điện tử Bộ Y tế; Website Cục KCB; – Lưu: VT, KCB. |
KT. BỘ TRƯỞNG
Nguyễn Trường Sơn |
HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ UNG THƯ DẠ DÀY
(Ban hành kèm theo Quyết định số 3127/QĐ-BYT ngày 17 tháng 07 năm 2020)
CHỈ ĐẠO BIÊN SOẠN
PGS.TS. Nguyễn Trường Sơn, Thứ trưởng Bộ Y tế
CHỦ BIÊN
PGS.TS. Lương Ngọc Khuê, Cục trưởng Cục Quản lýKhám, chữa bệnh, Bộ Y tế
ĐỒNG CHỦ BIÊN
GS.TS. Mai Trọng Khoa, Nguyên Phó Giám đốc Bệnh viện Bạch Mai
THAM GIA BIÊN SOẠN
GS.TS. Mai Trọng Khoa, Nguyên Phó Giám đốc Bệnh viện Bạch Mai
PGS.TS. Lương Ngọc Khuê, Cục trưởng Cục Quản lýKhám, chữa bệnh, Bộ Y tế
GS.TS. Trần Văn Thuấn, Thứ trưởng Bộ Y tế
GS.TS. Trịnh Hồng Sơn, Phó Giám đốc Bệnh viện Việt Đức
PGS.TS. Bùi Văn Giang, Giám đốc Trung tâm Chẩn đoán hình ảnh, Bệnh viện K
PGS.TS. Tạ Văn Tờ, Giám đốc Trung tâm Giải phẫu bệnh vàSinh học phân tử, Bệnh viện K
PGS.TS. Trần Đình Hà, Nguyên Phụ trách Trung tâm Y học hạt nhân và Ung bướu, Bệnh viện Bạch Mai
BSCKII. Vũ Hải Thanh, Trưởng khoa Chẩn đoán hình ảnh, Bệnh viện Việt Đức
TS. Lâm Việt Trung, Trưởng khoa Ngoại tiêu hóa, Bệnh viện Chợ Rẫy
TS. Phạm Văn Bình, Giám đốc Trung tâm Phẫu thuật nội soi robot, Bệnh viện K
TS. Nguyễn Tiến Quang, Phó Giám đốc Bệnh viện K
TS. Đỗ Anh Tú, Phụ trách cơ sở Tam Hiệp, Bệnh viện K
ThS. Nguyễn Sỹ Lánh, Trưởng khoa Giải phẫu bệnh, Bệnh viện Việt Đức
TS. Vương Ánh Dương, Trưởng phòng Nghiệp vụ – Thanh tra – Bảo vệ sức khỏe cán bộ, Cục Quản lý Khám, chữa bệnh
TỔ THƯ KÝ
TS. Đỗ Anh Tú, Phụ trách cơ sở Tam Hiệp, Bệnh viện K
ThS.BS. Trương Lê Vân Ngọc, Chuyên viên Cục Quản lýKhám, chữa bệnh
MỤC LỤC
CÁC CHỮ VIẾT TẮT
1. ĐẠI CƯƠNG
2. NGUYÊN NHÂN – CÁC YẾU TỐ NGUY CƠ
2.1. Yếu tố môi trường vàchế độ ăn uống
2.2. Vai trò của Helicobacter Pylori (HP)
2.3. Yếu tố di truyền
2.4. Các yếu tố khác
3. CHẨN ĐOÁN
3.1. Lâm sàng
3.2. Cận lâm sàng
3.3. Chẩn đoán xác định
3.4. Chẩn đoán phân biệt
3.5. Chẩn đoán giai đoạn
3.6. Sàng lọc – phát hiện sớm
4. ĐIỀU TRỊ
4.1. Nguyên tắc chung
4.2. Điều trị ung thư dạ dày cắt bỏ được theo giai đoạn
4.3. UTDD giai đoạn không có khả năng phẫu thuật triệt căn
4.4. Các phác đồ hóa trị ung thư dạ dày
5. THEO DÕI VÀ TIÊN LƯỢNG
5.1. Theo dõi
5.2. Tiên lượng
TÀI LIỆU THAM KHẢO
CÁC CHỮ VIẾT TẮT
| AGC | Advanced stages Gastric Cancer (Ung thư dạ dày tiến triển) |
| AJCC | American Joint Commitee on Cancer (Hiệp hội ung thư Mỹ) |
| CLVT | Computed Tomography (Chụp cắt lớp vi tính) |
| dMMR | Deficient mismatch repair (thiếu hụt hệ thống sửa chữa ghép cặp sai) |
| ECOG | Eastern Cooperative Oncology Group (Nhóm hợp tác ung thư học phía Đông) |
| EGC | Early Gastric Cancer (Ung thư dạ dày sớm) |
| EGF | Epidermal growth factor (Yếu tố tăng trưởng biểu bì) |
| EMR | Endoscopic mucosal resection (Cắt niêm mạc nội soi) |
| ESD | Endoscopic submucosal dissection (Cắt hạ niêm mạc nội soi) |
| ESMO | European Society for Medical Oncology (Hội Nội khoa Ung thư Châu Âu) |
| MRI | Cộng hưởng từ (Magnetic Resonance Imaging) |
| MSI | Microsatellite instability (mất ổn định vi vệ tinh) |
| NCCN | National Comprehensive Cancer Network (Mạng lưới ung thư quốc gia của Mỹ) |
| PET/CT | Positron emission tomography – computed tomography (Chụp cắt lớp phát bức xạ positron) |
| PD-L1 | Programmed death-ligand 1(thụ thể gây chết tế bào theo chương trình 1) |
| UICC | Union for International Cancer Control (Hiệp hội phòng chống ung thư Quốc tế) |
| UT | Ung thư |
| UTDD | Ung thư Dạ dày |
| WHO | World Health Organization (Tổ chức Y tế thế giới) |
HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ UNG THƯ DẠ DÀY
(Ban hành kèm theo Quyết định số 3127/QĐ-BYT ngày 17 tháng 07 năm 2020)
1. ĐẠI CƯƠNG
Ung thư dạ dày (UTDD) là một trong những bệnh ung thư (UT) phổ biến nhất trên thế giới. Năm 2018, ước tính trên thế giới có1.033.700 trường hợp ung thư dạ dày mắc mới và hơn 782.600 trường hợp tử vong. Tại Việt nam theo Globocan 2018, UTDD đứng thứ 3 ở cả hai giới sau ung thư gan và ung thư phổi với tỷ lệ mắc chuẩn theo tuổi là11,38/100.000 dân. Trong đó, loại ung thư biểu mô tuyến chiếm chủ yếu (90-95%).
UTDD có tính chất vùng miền rõ rệt liên quan tới chế độ ăn uống vàbảo quản thực phẩm. Phân bố không đồng đều theo khu vực địa lý và thời gian. Tỷ lệ mắc bệnh thường ở độ tuổi cao, hiếm gặp ở những người bệnh dưới 30 tuổi, nam giới chiếm tỷ lệ cao ở tất cả các quốc gia trên thế giới với tỷ lệ gấp 2- 4 lần so với nữ giới. Vị tríhay gặp ở vùng hang môn vị (chiếm 60-70%), sau đó là ở vùng bờ cong nhỏ (18-30%), các vùng khác ít gặp hơn như bờ cong lớn khoảng 3%, đáy vị 12%, tâm vị 9%, UT toàn bộ dạ dày chiếm 8-10%. Theo nghiên cứu gần đây ở Nhật Bản và Châu Âu cho thấy UT vùng tâm vị cóchiều hướng tăng lên. Tỷ lệ UT tâm vị từ 25-55%, UT thân vị vàhang môn vị từ 45-75%.
2. NGUYÊN NHÂN – CÁC YẾU TỐ NGUY CƠ
2.1. Yếu tố môi trường và chế độ ăn uống
Môi trường sống và chế độ ăn uống đóng vai trò quan trọng liên quan tới UTDD. Các yếu tố có thể làm tăng nguy cơ mắc UTDD gồm:
– Sử dụng hàm lượng muối cao trong thức ăn
– Thức ăn có chứa hàm lượng nitrat cao
– Chế độ ăn ít vitamin A, C
– Những thức ăn khô, thức ăn hun khói
– Thiếu phương tiện bảo quản lạnh thức ăn
– Rượu, thuốc lá…
Các thức ăn tươi, hoa quả tươi như cam, chanh, nhiều chất xơ, thức ăn giàu vitamin A, C, các yếu tố vi lượng như kẽm, đồng, sắt, magiê, … có tác dụng làm giảm nguy cơ mắc bệnh.
2.2. Vai trò của Helicobacter Pylori (HP)
Vai trò của H.pylori trong UTDD đã được chứng minh. Các nghiên cứu cho rằng nhiễm H.pylori gây viêm niêm mạc dạ dày dẫn tới teo niêm mạc và dị sản ruột, loạn sản và cuối cùng là ung thư. Nhiễm H.pylori làm tăng nguy cơ UTDD lên gấp 6 lần.
2.3. Yếu tố di truyền
Ước tính UTDD có tính chất gia đình chiếm tỷ lệ 1-15% trong số người bệnh mắc UTDD. Một số bệnh lý di truyền cũng tăng nguy cơ.
2.4. Các yếu tố khác
Các bệnh lý tại dạ dày cũng là nguyên nhân gây UTDD. Nhiễm xạ cũng được coi là một yếu tố làm tăng nguy cơ mắc UTDD.
3. CHẨN ĐOÁN
3.1. Lâm sàng
Ở giai đoạn sớm thường tình cờ khám phát hiện bệnh. Giai đoạn này các triệu chứng thường rất nghèo nàn và không đặc hiệu với các biểu hiện ậm ạch, đầy hơi vùng thượng vị, đau thượng vị không cóchu kỳ, nuốt nghẹn, mệt mỏi, chán ăn. Có thể gầy sút cân gặp ở trên 80% các trường hợp, khi sút cân trên 10% trọng lượng cơ thể là một dấu hiệu tiên lượng xấu.
Ở giai đoạn muộn, triệu chứng của bệnh rõ ràng hơn, xuất hiện thường xuyên và liên tục: sụt cân không rõ nguyên nhân, đau bụng vùng thượng vị, đầy bụng, chán ăn… Khám lâm sàng có thể thấy các triệu chứng thiếu máu, sờ thấy khối u bụng thường khi bệnh đã tiến triển tại vùng.
Các dấu hiệu bệnh lan tràn đôi khi lại làbiểu hiện đầu tiên như hạch di căn, tổn thương lan tràn phúc mạc được thể hiện bằng dịch ổ bụng hay tắc ruột, di căn gan hay di căn buồng trứng.
Tùy theo các trường hợp cóbiểu hiện triệu chứng hoặc không và giai đoạn phát hiện bệnh có thể chia ra các nhóm:
– Tình cờ phát hiện bệnh khi khám kiểm tra sức khỏe cónội soi dạ dày.
– Có các triệu chứng điển hình của bệnh kết hợp khám lâm sàng và cận lâm sàng.
– Không có triệu chứng đặc hiệu, chỉ phát hiện khi cócác biểu hiện di căn.
– Nhóm biểu hiện bệnh ở giai đoạn muộn, có các biến chứng: dịch ổ bụng, di căn gan, tắc ruột …
3.2. Cận lâm sàng
3.2.1. Chụp X quang
Chụp X-quang dạ dày có thuốc cản quang: là phương pháp kinh điển chẩn đoán UTDD. Tổn thương UTDD sẽ tồn tại thường xuyên trên các phim chụp hàng loạt. Ngoài ra trên phim chụp có thuốc cản quang sau 6 giờ cóhình ảnh của hẹp môn vị như hình ảnh tuyết rơi … Ngày nay, với sự tiến bộ của nội soi đã dần thay thế chụp X-quang dạ dày.
X-quang tim phổi: phát hiện các di căn phổi. Nếu có tổn thương trên X-quang có thể sử dụng thêm các phương tiện chẩn đoán hình ảnh khác như CLVT.
3.2.2. Nội soi dạ dày bằng ống soi mềm
Nội soi ống soi mềm kết hợp với sinh thiết là biện pháp quan trọng trong chẩn đoán UTDD. Nội soi cho biết vị trí và tính chất của khối u. Độ chính xác của nội soi trên 95% với những trường hợp ung thư tiến triển. Khi sinh thiết qua nội soi từ 6 đến 8 mảnh cho kết quả chẩn đoán đúng trên 95%.
Nhờ các tiến bộ như nội soi phóng đại, nội soi ánh sáng xanh, nội soi kết hợp với phương pháp nhuộm màu để chỉ điểm vùng bấm sinh thiết…cho độ chính xác cao, phát hiện các tổn thương còn rất nhỏ, giúp cho chẩn đoán sớm UTDD.
3.2.3. Siêu âm qua thành bụng vàsiêu âm nội soi
Siêu âm qua thành bụng giúp đánh giá tổn thương của dạ dày và tình trạng di căn hạch, phát hiện các tổn thương thứ phát, dịch ổ bụng… Tuy nhiên, độ chính xác của siêu âm phụ thuộc rất nhiều yếu tố.
Kỹ thuật siêu âm kết hợp nội soi tiêu hoá và siêu âm có đầu dò tần số cao (7,5-12MHz) giúp xác định chính xác mức độ xâm lấn của u nguyên phát qua các lớp của thành dạ dày và tổ chức xung quanh hơn so với các kỹ thuật khác, nhất làvới khối u ở giai đoạn sớm. Đối với đánh giá sự di căn hạch lân cận thì có phần hạn chế nhất là những trường hợp di căn xa thành dạ dày.
3.2.4. Nội soi ổ bụng
Nội soi ổ bụng xác định chính xác tình trạng xâm lấn u vào cơ quan lân cận, di căn gan, di căn phúc mạc. Giúp đánh giá chính xác giai đoạn, tránh được mở bụng thăm dò một số trường hợp bệnh lan rộng không phẫu thuật được.
3.2.5. Chụp cắt lớp vi tính (CLVT)
CLVT được sử dụng chủ yếu để xác định giai đoạn như sự xâm lấn của khối u với thành ống tiêu hóa, sự di căn vào các tạng, hạch trong ổ bụng. Ngoài ra, CLVT còn được sử dụng để theo dõi đáp ứng điều trị của người bệnh giai đoạn tiến xa
3.2.6. Chụp cộng hưởng từ (MRI)
Cho thông tin về tổn thương u cũng như mức độ xâm lấn và di căn.
3.2.7. Xạ hình
Xạ hình xương bằng máy SPECT, SPECT/CT với 99mTc-MDP để đánh giá tổn thương di căn xương, chẩn đoán giai đoạn bệnh trước điều trị, theo dõi đáp ứng điều trị, đánh giá tái phát và di căn. Phát hiện tổn thương di căn xương từ rất sớm so với chụp X-quang thông thường. Từ đó, giúp lựa chọn biện pháp điều trị thích hợp. Tổn thương có thể ở xương sườn, xương chậu, xương cột sống…
Xạ hình thận chức năng bằng máy SPECT, SPECT/CT với 99mTc -DTPA để đánh giáchức năng thận trước điều trị và sau điều trị.
3.2.8. PET/CT (Positron Emission Tomography/ Computer Tomography)
PET/CT có giá trị trong phát hiện các tổn thương nguyên phát tại dạ dày, tổn thương xâm lấn, di căn hạch, di căn xa tới các tạng xa, di căn xương. Chỉ định của PET/CT là đánh giá giai đoạn bệnh, phát hiện tái phát, di căn, đánh giá đáp ứng sau điều trị.
3.2.9. Các chất chỉ điểm ung thư
Kháng nguyên ung thư bào thai CEA tăng trong khoảng 33% trong số UTDD. Khi kết hợp với các chất chỉ điểm khác như CA19-9 vàCA72-4 có giá trị trong theo dõi sau điều trị và tiên lượng bệnh.
3.2.10. Mô bệnh học
Có nhiều hệ thống phân loại đã được đề nghị và đang cùng tồn tại, gây không ít khó khăn trong công tác thực hành cũng như trong việc đánh giá tiên lượng, lựa chọn phương pháp điều trị và trao đổi thông tin giữa các cơ sở với nhau.
Đến năm 2000, Tổ chức Y tế Thế giới (TCYTTG) đưa ra phân loại UTDD đã được sửa đổi, bao gồm cả phân loại của Lauren và có bổ sung thêm típ môhọc ung thư biểu mô tế bào nhỏ và các típ mô bệnh học được mã hóa.
Hiện được sử dụng rộng rãi hơn cả là phân loại của TCYTTG năm 2010. Đây là phân loại mới nhất, chi tiết trong các hệ thống phân loại bao gồm ung thư biểu mô tuyến của dạ dày và các khối u khác ít gặp của dạ dày.
Bảng 1: Phân loại ung thư dạ dày của TCYTTG năm 2010
|
Típ mô học |
Mã số bệnh |
| Tân sản nội biểu mô- u tuyến |
8140/0 |
| Ung thư biểu mô tuyến |
8140/3 |
| Típ ruột | |
| Típ lan toả | |
| Ung thư biểu mô tuyến nhú | |
| Ung thư biểu mô tuyến ống nhỏ | |
| Ung thư biểu mô tuyến nhầy | |
| Ung thư biểu mô tế bào kém kết dính (bao gồm típ tế bào nhẫn và các biến thể típ tế bào khác) | |
| Ung thư biểu mô thể hỗn hợp | 8255/3 |
| Ung thư biểu mô típ dạng gan | 8576/3 |
| Ung thư biểu mô thể tủy | 8512/3 |
| Ung thư biểu mô tuyến vảy | |
| Ung thư biểu mô tế bào vảy | |
| Ung thư biểu mô không biệt hóa | |
| Các loại khác | |
| U thần kinh nội tiết (NET) | |
| U thần kinh nội tiết biệt hóa cao, độ 1 hay U carcinoid | 8240/3 |
| U thần kinh nội tiết, độ 2 | 8249/3 |
| Ung thư biểu môthần kinh nội tiết (NEC) | 8246/3 |
| Ung thư biểu môthần kinh nội tiết, típ tế bào lớn (Large cell NEC) | 8013/3 |
| Ung thư biểu mô thần kinh nội tiết, típ tế bào nhỏ (Small cell NEC) | 8041/3 |
| Ung thư biểu mô thể hỗn hợp ngoại tiết và thần kinh nội tiết (MANC) | 8244/3 |
| U thần kinh nội tiết thể chế tiết serotonin (serotonin – producting NET) | 8241/3 |
| U thần kinh nội tiết thể chế tiết gastrin (Gastrin–producting NET) | 8153/3 |
3.2.11.Sinh học phân tử
Nhờ các tiến bộ trong sinh học phân tử đã xác định những biến đổi gen cũng như các yếu tố phát triển của tế bào ung thư biểu môdạ dày. Gồm các yếu tố như: HER2, E- cadherin, EGFR, DNA thay đổi số lượng bản sao, mất ổn định di truyền:
– HER2 (ErbB-2 hay HER-2/neu): là thụ thể của yếu tố tăng trưởng biểu bì- EGFR nằm trên bề mặt tế bào. Giữ vai trò điều hòa sự phân bào, sự sống và biệt hóa của nhiều loại tế bào. Kết quả các nghiên cứu cho thấy tỷ lệ bộc lộ HER2 ở đoạn tiếp nối thực quản – dạ dày cao hơn (24%-32%) so với các khối u tại dạ dày (12%-18%). Khi biểu hiện bộc lộ quámức HER2 làm gia tăng nguy cơ ung thư. Xét nghiệm thực hiện qua nhuộm hóa mô miễn dịch hoặc kỹ thuật FISH (Fluorescent insitu hybridization), Dual ISH và giải trình tự gene. Với UTDD giai đoạn muộn có chỉ định điều trị đích trong những trường hợp có bộc lộ HER2.
– MSI (microsatellite instability –mất ổn định vi vệ tinh) hoặc dMMR (deficient mismatch repair – thiếu hụt hệ thống sửa chữa ghép cặp sai): sự mất ổn định vi vệ tinh (MSI) làsự tích tụ các lỗi trong vùng vi vệ tinh của DNA dẫn đến sự tăng đột biến và do thiếu hụt hệ thống sửa chữa ghép cặp sai DNA. Các trường hợp MSI biểu hiện cao hoặc có thiếu hụt hệ thống sửa chữa ghép cặp sai là các yếu tố biểu hiện tiên lượng xấu của bệnh và là yếu tố chỉ điểm bệnh có đáp ứng với điều trị ức chế điểm miễn dịch. Xét nghiệm thực hiện qua nhuộm hóa mô miễn dịch hoặc kỹ thuật xét nghiệm khuếch đại chuỗi ADN polymerase (PCR), giải trình tự gene.
– PD-L1 (programmed death-ligand 1: thụ thể gây chết tế bào theo chương trình 1): khi các thụ thể này bộc lộ trên tế bào ung thư, nó sẽ gắn với tế bào T miễn dịch tại vị trí PD-1, nên sẽ làm cho tế bào T không nhận diện tế bào ác tính. Điều trị miễn dịch dựa trên cơ sở gắn ức chế thụ thể làm cho tế bào miễn dịch nhận diện được tế bào ung thư và gây chết theo chương trình. Xét nghiệm thực hiện qua nhuộm hóa mô miễn dịch hoặc kỹ thuật FISH, giải trình tự gene.
3.3. Chẩn đoán xác định
– Lâm sàng.
– Cận lâm sàng:
+ Tổn thương xác định qua nội soi.
+ Hình ảnh học (siêu âm nội soi, CT, MRI, PET/CT để đánh giá giai đoạn).
+ Mô bệnh học: là tiêu chuẩn vàng để chẩn đoán xác định bệnh ung thư
3.4. Chẩn đoán phân biệt
– Viêm loét dạ dày
– Loạn sản dạ dày
– U lympho biểu hiện ở dạ dày
– U mô đệm đường tiêu hóa (GIST) biểu hiện tại dạ dày
– Một số ung thư khác di căn, xâm lấn dạ dày
3.5. Chẩn đoán giai đoạn
Xếp loại T.N.M, giai đoạn theo AJCC 2017 phiên bản lần thứ 8:
– T (Primary Tumor): u nguyên phát
+ Tx: không đánh giá được u nguyên phát
+ T0: không có bằng chứng của u nguyên phát
+ Tis: UT biểu môtại chỗ, u nội biểu mô không có xâm nhập mô đệm
+ T1: u khu trú ở lớp niêm mạc hoặc dưới niêm
T1a: u khu trú ở lớp niêm mạc hoặc cơ niêm
T1b: u xâm lấn lớp dưới niêm
+ T2: u xâm lấn lớp cơ
+ T3: u xâm nhập mô liên kết dưới thanh mạc, chưa xâm lấn thanh mạc hoặc cấu trúc lân cận
+ T4: u xâm lấn thanh mạc hoặc cấu trúc lân cận
T4a: u xâm lấn lớp thanh mạc
T4b: u xâm lấn cấu trúc lân cận
– N (Regional Lymph Nodes): hạch lympho vùng
+ Nx: không đánh giá được hạch vùng
+ N0: không có di căn hạch vùng
+ N1: di căn 1-2 hạch vùng
+ N2: di căn 3-6 hạch vùng
+ N3: di căn ≥ 7 hạch vùng
N3a: di căn 7-15 hạch vùng
N3b: di căn ≥ 16 hạch vùng
– M (Distant Metastasis): di căn xa
+ M0: không có di căn xa
+ M1: có di căn xa
Phân loại giai đoạn TNM
Bảng 2: Phân loại giai đoạn TNM
| Giai đoạn bệnh theo TNM | ||
| Giai đoạn 0 | TisN0M0 | |
| Giai đoạn I | IA | T1N0M0 |
| IB | T1N1M0
T2N0M0 |
|
| Giai đoạn II | IIA | T1N2M0
T2N1M0 T3N0M0 |
| IIB | T1N3a M0
T2 N2 M0 T3 N1 M0 T4a N0 M0 |
|
| Giai đoạn III | IIIA | T2 N3a M0
T3 N2 M0 T4a N1 M0 T4a N2 M0 T4b N0 M0 |
| IIIB | T1 N3b M0
T2 N3b M0 T3 N3a M0 T4a N3a M0 T4b N1 M0 T4b N2 M0 |
|
| IIIC | T3 N3b M0
T4a N3b M0 T4b N3a M0 T4b N3b M0 |
|
| Giai đoạn IV | T bất kỳ, N bất kỳ, M1 | |
Xếp nhóm giai đoạn theo mức độ lan tràn của bệnh:
– Ung thư dạ dày sớm (Early Gastric Cancer – EGC): được hiệp hội ung thư dạ dày xác định năm 1962 gồm các trường hợp ung thư dạ dày mới xâm lấn nông đến mức T1 (thuộc giai đoạn I: T1N0M0; T1N1M0; T2N0M0).
– Ung thư dạ dày tiến triển (Advanced stages Gastric Cancer): gồm nhóm người bệnh thuộc giai đoạn T3-T4b; N2-3; M0-M1.
3.6. Sàng lọc – phát hiện sớm:
UTDD là bệnh có thể sàng lọc, phát hiện sớm được, tuy nhiên tại Việt Nam chưa triển khai được chương trình sàng lọc quốc gia. Đối tượng sàng lọc cần lưu ý những người có tiền sử gia đình UTDD hoặc bệnh lý ác tính đường tiêu hóa. Tiền sử viêm loét dạ dày mãn tính.
Do các triệu chứng của bệnh giai đoạn sớm thường không rõ hoặc khámơ hồ nên việc sàng lọc chủ yếu dựa vào nội soi dạ dày. Các kỹ thuật ngoài nội soi thông thường còn bao gồm nội soi phóng đại, nội soi nhuộm màu có chỉ điểm …
Độ tuổi khuyến cáo nên nội soi tầm soát khác nhau tùy quốc gia: tại Nhật bản khuyến cáo chụp dạ dày đối quang kép hàng năm cho những người từ 50 tuổi trở lên hoặc nội soi tiêu hóa trên mỗi 2 hoặc 3 năm. Hàn Quốc khuyến cáo nội soi tiêu hóa trên cho người từ 40 tuổi trở lên mỗi 2 năm. Theo nhiều nghiên cứu về UTDD tại Việt Nam cho thấy độ tuổi mắc ngày càng trẻ do đó những người cótiền sử viêm loét dạ dày mãn tính, nhiễm HP cần theo dõi thường xuyên. Những đối tượng có tiền sử gia đình cần nội soi thường xuyên từ 40 tuổi trở lên. Còn lại nếu có điều kiện nội soi kiểm tra từ 45-50 tuổi.
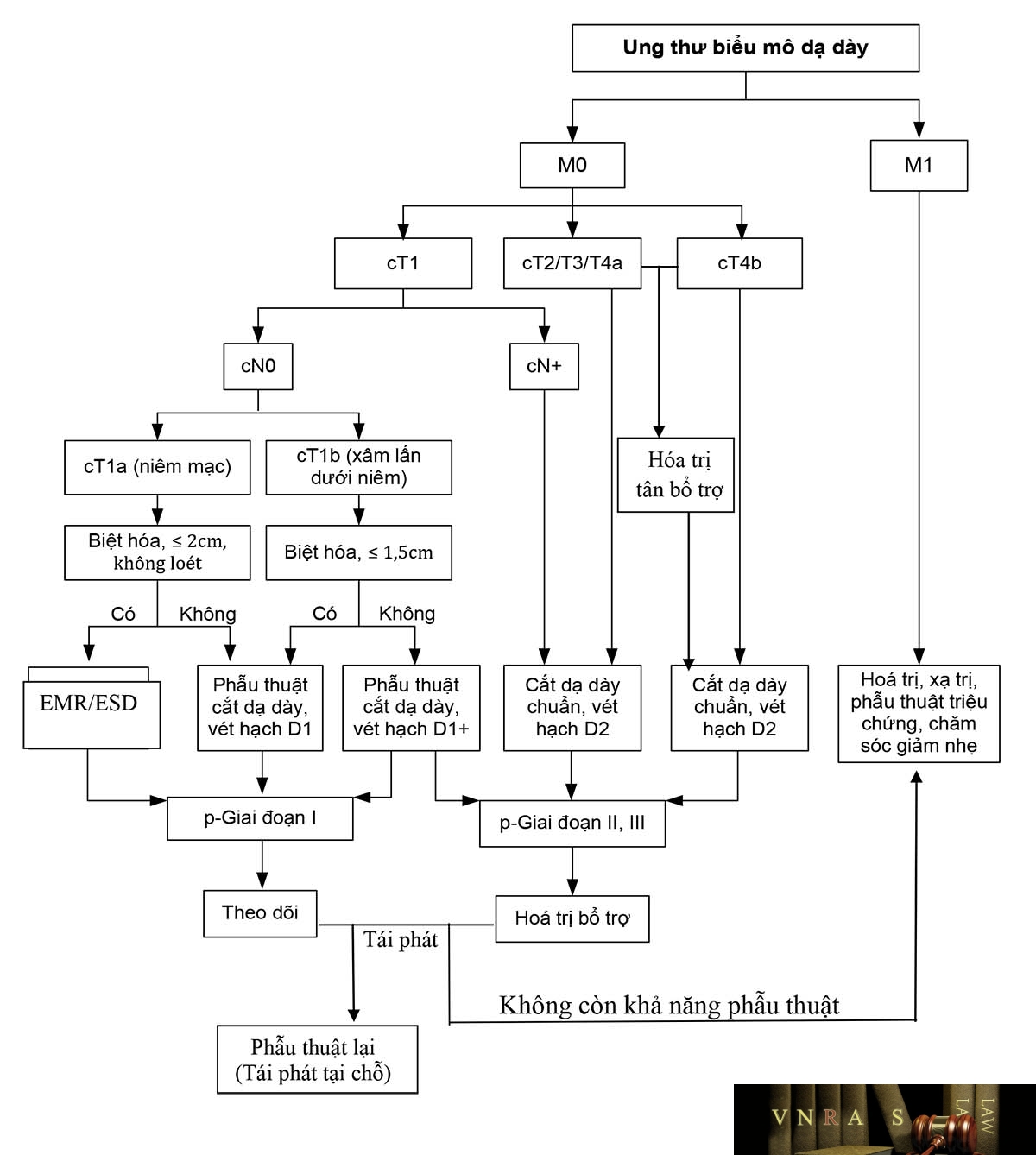
4. ĐIỀU TRỊ
4.1. Nguyên tắc chung
– Phẫu thuật là phương pháp đóng vai trò quan trọng và chủ đạo trong điều trị ung thư dạ dày. Phẫu thuật có vai trò điều trị triệt căn trong giai đoạn sớm, là phương pháp chính trong giai đoạn còn phẫu thuật được và là biện pháp điều trị triệu chứng ở giai đoạn muộn.
– Hóa trị, xạ trị đóng vai trò điều trị bổ trợ, tân bổ trợ trong giai đoạn còn chỉ định điều trị triệt căn và vai trò giảm nhẹ, kéo dài thời gian sống thêm khi bệnh ở giai đoạn muộn, tái phát, di căn.
4.2. Điều trị ung thư dạ dày cắt bỏ được theo giai đoạn
4.2.1. Ung thư dạ dày giai đoạn Ia (cTis, cT1aNoMo): cắt u nội soi
A. Các phương pháp cắt u nội soi
* Cắt niêm mạc nội soi (Endoscopic mucosal resection: EMR)
* Cắt hạ niêm mạc nội soi (Endoscopic submucosal dissection: ESD)
B. Chỉ định cắt u qua nội soi
* Nguyên lýchỉ định: xem xét điều trị ở những khối u rất ít có khả năng di căn hạch và thích hợp cho việc cắt tổn thương thành một khối.
* Các khối u có chỉ định tuyệt đối cắt qua nội soi
– EMR và ESD được chỉ định cho khối u: thể biệt hóa cao không có loét, chẩn đoán lâm sàng giai đoạn T1a và kích thước dưới 2cm.
* Các khối u chỉ định tương đối cắt qua nội soi (mở rộng chỉ định)
– Các khối u rất ít khả năng di căn hạch và không cóxâm nhập mạch bạch huyết có thể chỉ định cắt u nội soi. Phương pháp ESD cắt rộng rãi lớp hạ niêm mạc nên hay được dùng hơn EMR.
– Các khối u được chẩn đoán T1a và:
+ Thể mô bệnh học biệt hóa cao, không có loét, nhưng kích thước > 2cm
+ Thể mô bệnh học biệt hóa cao, có loét, và đường kính khối u ≤ 3cm
+ Thể mô bệnh học kém biệt hóa, không có loét, và đường kính khối u ≤ 2cm
* Cắt khối u qua nội soi
– Bệnh phẩm cắt ra cần được kiểm tra mô bệnh học tỷ mỉ. Hai yếu tố đánh giá khả năng cắt triệt căn khối u qua nội soi: loại bỏ hoàn toàn khối u nguyên phát và không có khả năng di căn hạch.
– Cắt triệt căn khi: cắt tổn thương thành một khối, u kích thước ≤ 2cm, giải phẫu bệnh thể biệt hóa, giai đoạn pT1a, diện cắt chu vi âm tính (HM0), diện cắt đáy âm tính (VM0) và chưa có xâm nhập mạch bạch huyết.
– Cắt triệt căn cho những khối u mở rộng chỉ định: cắt triệt căn khi
+ Cắt u thành một khối, diện cắt chu vi âm tính (HM0), diện cắt đáy âm tính (VM0), không xâm lấn hạch [ly (-): no lymphatic invasion], không xâm lấn mạch [v (-): no venous invasion] và
a. Khối u > 2cm, giải phẫu bệnh biệt hóa cao, pT1a, không có loét.
b. Khối u đường kính ≤ 3cm, giải phẫu bệnh biệt hóa cao, pT1a, có loét
c. Khối u đường kính ≤ 2cm, thể giải phẫu bệnh kém biệt hóa, pT1a, không có loét
d. Khối u đường kính ≤ 3cm, thể giải phẫu bệnh biệt hóa cao, pT1b.
Vì các bằng chứng không đủ cho các khối u biệt hóa cao có đi kèm với một số vùng thể giải phẫu bệnh không biệt hóa, cắt khối u qua nội soi không được cho là triệt căn và cần phải phẫu thuật thêm cho những trường hợp sau:
+ Các vùng carcinoma kém biệt hóa vượt quá 2cm như trường hợp (a) ở trên.
+ Thành phần kém biệt hóa đã xâm nhập lớp hạ niêm mạc như trường hợp (b) ở trên. Hoặc diện cắt dương tính.
Nếu thành phần carcinoma kém biệt hóa được tìm thấy ở trên (b) nhưng không chiếm ưu thế, nguy cơ di căn hạch được ước tính làthấp thìphương pháp cắt qua nội soi được coi như là triệt căn.
C. Điều trị sau khi cắt u qua nội soi
* Điều trị sau cắt triệt căn: Theo dõi bằng nội soi định kỳ 2 tháng/ lần.
* Những trường hợp nghi ngờ vẫn còn tổn thương cần cân nhắc cắt dạ dày triệt căn.
* Điều trị sau cắt triệt căn cho những khối u được mở rộng chỉ định:
– Theo dõi người bệnh bằng siêu âm hoặc chụp CLVT kết hợp với nội soi định kỳ
– Điều trị vi khuẩn Helicobacter Pylori (HP). Tuy nhiên một số nghiên cứu cho thấy điều trị HP không làm thay đổi tỷ lệ xuất hiện ung thư dạ dày.
4.2.2. Ung thư dạ dày giai đoạn Ib-III
a. Phẫu thuật
A. Nguyên tắc phẫu thuật triệt căn:
– Phẫu thuật cắt dạ dày tiêu chuẩn thực hiện với mục tiêu điều trị triệt căn bao gồm phẫu thuật cắt ít nhất 2/3 dạ dày và nạo vét hạch D2 (số lượng hạch vét được tối thiểu ≥15 hạch).
– Phẫu thuật cắt dạ dày không tiêu chuẩn: cắt dạ dày và/hoặc vét hạch tùy thuộc vào giai đoạn và vị trí khối u.
– Phẫu thuật biến đổi: cắt dạ dày và vét hạch D1 hoặc D1+ ít hơn so với cắt dạ dày tiêu chuẩn.
– Phẫu thuật cắt dạ dày mở rộng: bao gồm cắt dạ dày kèm các tạng xâm lấn và vét hạch D2+
– Diện cắt: đảm bảo không còn tế bào ung thư ở diện cắt trên và dưới: giới hạn trên cách khối u tối thiểu 6cm, giới hạn dưới qua môn vị 2cm. Trong trường hợp không đạt được diện cắt đủ xa, cần làm tức thì diện cắt. Với những khối u xâm lấn thực quản, không cần thiết đảm bảo diện cắt xa u màcần làm sinh thiết tức thìdiện cắt để đảm bảo diện cắt R0.
– Phẫu thuật để điều trị biến chứng chảy máu, tắc ruột trong giai đoạn muộn.
B. Các phương pháp cắt dạ dày
– Cắt toàn bộ dạ dày: cắt toàn bộ dạ dày bao gồm cả môn vị và tâm vị.
– Cắt gần toàn bộ dạ dày: đảm bảo theo nguyên tắc phẫu thuật triệt căn.
C. Vét hạch trong phẫu thuật ung thư dạ dày
– Vét hạch D0: Vét các nhóm hạch ít hơn D1
– Vét hạch D1: Vét các nhóm hạch từ nhóm 1 đến nhóm 7
– Vét hạch D1+: Vét hạch D1 + các nhóm hạch 8a, 9, 11p
– Vét hạch D2: bao gồm vét hạch D1 + các nhóm hạch 8a, 9,11d, 12a
D. Chỉ định vét hạch theo giai đoạn
Về nguyên tắc: với khối u giai đoạn T1N0M0 chỉ định vét hạch D1 hoặc D1+. Với khối u giai đoạn cN+ hoặc T2-T4 chỉ định vét hạch D2. Vét hạch D2 chỉ định nếu trong mổ có hạch nghi ngờ di căn
* Vét hạch D1: được chỉ định cho khối u giai đoạn T1a (những trường hợp không có chỉ định làm EMR/ESD), và cho những khối u giai đoạn cT1bN0 có giải phẫu bệnh thể biệt hoá và khối u nhỏ hơn 1,5cm.
* Vét hạch D1+: được chỉ định cho giai đoạn cT1N0 ngoài những trường hợp chỉ định vét hạch D1 ở trên.
* Vét hạch D2: được chỉ định cho những khối u từ T2-T4 vàcT1N+ có khả năng phẫu thuật triệt căn. Vai trò của cắt lách cùng với vét hạch triệt căn nhóm 10,11 vẫn còn nhiều tranh luận, và kết quả của thử nghiệm lâm sàng JCOG 0110 về vét hạch triệt căn nhóm 10, 11 kèm theo bảo tồn lách mang lại kết quả tương tự như cắt lách kèm theo. Những khối u T2-T4 có xâm lấn phình vị, bờ cong lớn hoặc xâm lấn lách thì chỉ định cắt lách kèm theo vét hạch triệt căn nhóm 10.
* Vét hạch D2+: những trường hợp có di căn hạch chủ bụng được điều trị hóa chất tân bổ trợ sau đó phẫu thuật cắt dạ dày kèm vét hạch D2+ (hạch chủ bụng).
Vét hạch D2 + vét hạch nhóm 14v (hạch gốc tĩnh mạch mạc treo tràng trên) ở người bệnh có di căn hạch nhóm 6.
Di căn hạch nhóm 13 coi như di căn xa. Tuy nhiên, vét hạch D2+ nhóm hạch 13 triệt căn ở người bệnh có khối u xâm lấn tá tràng.
E. Một số vấn đề khác
Bảo tồn thần kinh phế vị
Trong phẫu thuật bảo tồn nhánh gan của thần kinh phế vị trước và/hoặc nhánh tạng của thần kinh phế vị sau làm tăng chất lượng cuộc sống do làm giảm tỷ lệ sỏi túi mật, tiêu chảy hoặc giảm cân nặng sau phẫu thuật.
Cắt mạc nối lớn
Cắt mạc nối lớn thường cắt cùng với dạ dày cho những khối u T3, T4. Với khối u giai đoạn T1/T2 có thể để lại mạc nối lớn, cắt dọc theo bờ ngoài của cung mạch bờ cong lớn.
Cắt kèm cơ quan bị xâm lấn
Với khối u xâm lấn cơ quan lân cận có thể cắt kèm theo (gan, lách, tụy…) để đảm bảo diện cắt R0.
Phẫu thuật nội soi
Năm 2014, hướng dẫn điều trị của Ủy ban phẫu thuật nội soi của Nhật bản đề xuất phẫu thuật nội soi cắt bán phần xa của dạ dày.
Tóm lại, phẫu thuật bệnh ung thư dạ dày, có thể:
1. Thăm dò sinh thiết (một số trường hợp không đánh giá được trước mổ nhưng mổ ra có di căn xa hay một số không đánh giá giai đoạn trước mổ bằng cắt lớp nên thăm dò sinh thiết bằng nội soi hoặc mổ mở)
2. Mở thông hỗng tràng trong trường hợp có hẹp môn vị nhưng tình trạng không cho phép nối vị tràng hoặc cắt dạ dày không triệt căn (dẫn lưu ngoài).
3. Dẫn lưu lỗ thủng do ung thư – phẫu thuật Newman (dẫn lưu ngoài).
4. Nối vị – tràng hoặc nối tắt ruột – ruột trong trường hợp hẹp môn vị hoặc hẹp các quai ruột do ung thư di căn xâm lấn (dẫn lưu trong).
5. Cắt đoạn dạ dày, mạc nối lớn (cắt 3/4, 4/5…) và nạo vét hạch: có thể triệt để hoặc không triệt để (giai đoạn III, IV có biến chứng chảy máu, thủng, hẹp)
6. Cắt toàn bộ dạ dày, mạc nối lớn và nạo vét hạch: có thể triệt để hoặc không triệt để (giai đoạn III, IV có biến chứng chảy máu, thủng, hẹp).
7. Cắt đoạn hoặc toàn bộ dạ dày kèm cắt tạng lân cận (gan, đoạn đại tràng, lách và đuôi tụy….), mạc nối lớn, nạo vét hạch: Có thể triệt để hoặc không triệt để. Các trường hợp cắt dạ dày có hoặc không kèm cắt tạng lân cận dù phẫu thuật vẫn không triệt để là để điều trị các biến chứng như thủng, hẹp hay chảu máu).
8. Cắt u qua nội soi ống mềm trong trường hợp ung thư dạ dày sớm.
9. Cắt dạ dày hình chêm trong trường hợp ung thư giai đoạn sớm mà không có điều kiện cắt u qua nội soi ống mềm.
10. Lí do cần nạo vét hạch trong ung thư biểu mô dạ dày: Thứ nhất là hạch bạch huyết là con đường di căn chính của ung thư dạ dày. Thứ hai là nạo vét hạch làm cho phẫu thuật trở nên triệt để hơn. Thứ ba là nạo vét hạch giúp đánh giá chính xác giai đoạn bệnh và tiên lượng. Thứ tư là có hiện tượng di căn nhảy cóc trong ung thư dạ dày (không di căn hạch chặng 1 nhưng di căn hạch chặng 2 hoặc chặng 3).
Nạo vét hạch D1, D2, D3, D4 dựa vào bảng sau đây của tác giả Kodama (Nhật bản)
|
Vị trí |
D1 |
D2 |
D3 |
D4 |
| Ung thư 1/3 trên | 1,2,3,4 | 5,6,7,8,9,10,11 | 12,13,14 | 15,16 |
| Ung thư 1/3 giữa | 3,4,5,6,1 | 4,8,9,11,2,10 | 12,13,14 | 15,16 |
| Ung thư 1/3 dưới | 3,4,5,6 | 1,2,7,9 | 11,12,13,14,2,10 | 15,16 |
| Toàn bộ dạ dày | 1,2,3,4,5,6 | 7,8,9,10,11,12 | 13,14 | 15.16 |
Trong đó nhóm 1: Các hạch ở bên phải tâm vị. Nhóm 2: Các hạch bên trái tâm vị. Nhóm 3: Các hạch dọc theo bờ cong nhỏ. Nhóm 4: Các hạch dọc theo bờ cong lớn (4sa: Vị ngắn, 4sb: Vị mạc nối trái). Nhóm 5: Các hạch trên môn vị. Nhóm 6: Các hạch dưới môn vị. Nhóm 7: Các hạch dọc theo động mạch vị trái. Nhóm 8: Các hạch dọc theo động mạch gan chung. Nhóm 9: Các hạch dọc theo động mạch thân tạng. Nhóm 10: Các hạch tại rốn lách. Nhóm 11: Các hạch dọc theo động mạch lách. Nhóm 12: Các hạch trong dây chằng gan tá tràng, cuống gan. Nhóm 13: Các hạch mặt sau đầu tụy. Nhóm 14: Các hạch dọc mạch mạc treo tràng trên. Nhóm 15: Các hạch dọc theo các mạch máu đại tràng giữa. Nhóm 16: Các hạch dọc động mạch chủ.
b. Xạ trị
– Xạ trị đơn thuần chủ yếu điều trị triệu chứng như hẹp môn vị, chảy máu…
– Xạ trị phối hợp với hoátrị trong điều trị bổ trợ, tân bổ trợ.
c. Hóa – xạ trị kết hợp
– Hóa xạ trị đồng thời bổ trợ sau mổ phối hợp với 5-FU (fluorouracil) được khuyến cáo cho những người bệnh giai đoạn từ IB trở đi.
– Hóa xạ trị đồng thời còn được chỉ định cho các UTDD tại chỗ không cắt bỏ được hoặc thể trạng người bệnh không cho phép phẫu thuật. Khi đó, mục đích điều trị có thể là triệt căn hay tạm thời tùy theo từng tình huống lâm sàng.
– Hóa xạ trị bổ trợ sau phẫu thuật trong trường hợp diện cắt sau phẫu thuật còn tế bào u trên vi thể (R1) hoặc trên đại thể (R2). Những người bệnh được cắt dạ dày không triệt để hay có diện cắt dương tính cũng có thể được điều trị phối hợp đa mô thức sau mổ một cách phù hợp.
d. Hóa trị
◊ Hóa trị trước mổ (hóa trị tân bổ trợ)
Mục tiêu:
– Giảm giai đoạn (kích thước và sự xâm lấn của u, giảm di căn hạch), tăng khả năng phẫu thuật triệt căn R0.
– Giảm vi di căn trước phẫu thuật, giảm tỉ lệ tái phát tại chỗ và di căn xa, cải thiện thời gian sống thêm toàn bộ.
– Đánh giá được độ nhạy với hóa chất.
Lựa chọn người bệnh:
– Những trường hợp UTDD tiến triển tại chỗ còn khả năng phẫu thuật.
– Bệnh ở giai đoạn phẫu thuật được nhưng chưa có khả năng mổ ngay (thể trạng, bệnh toàn thân, kinh tế…)
Các hướng dẫn thực hành điều trị của NCCN và ESMO đã đưa ra khuyến cáo về điều trị hóa chất trước mổ cho các người bệnh UTDD tiến triển tại chỗ. Các phác đồ bao gồm ECF và các biến thể (ECX, EOX…) hoặc gần đây nhất là phác đồ FLOT.
◊ Hóa trị sau phẫu thuật (hóa trị bổ trợ)
Mục tiêu:
– Diệt các tế bào ung thư còn sót lại.
– Giảm nguy cơ tái phát, cải thiện thời gian sống thêm.
Chỉ định:
– Người bệnh ung thư dạ dày giai đoạn II-III, được phẫu thuật triệt căn vét hạch D2, diện cắt không còn tế bào UT.
Hóa trị sau phẫu thuật giúp người bệnh có nguy cơ cao được xác định chính xác bởi các yếu tố bệnh lývànhững người bệnh nguy cơ thấp sẽ tránh được các rủi ro độc tính của hóa trị trước do sự đánh giá giai đoạn không chính xác. Ngoài ra, do phẫu thuật là phương thức điều trị hiệu quả nhất, khi đã cắt bỏ được u nguyên phát sẽ giảm nguy cơ không còn cơ hội phẫu thuật cho những trường hợp hóa trị trước không hiệu quả.
Tùy theo tình trạng tổn thương nguyên phát và mức độ di căn hạch mà phác đồ thay đổi có thể bao gồm ECF hoặc các biến thể hay kết hợp oxaliplatin với capecitabine và/ hoặc TS-1 ở các người bệnh châu Á.
4.3. UTDD giai đoạn không có khả năng phẫu thuật triệt căn
Chỉ định:
– Ung thư dạ dày giai đoạn muộn có di căn xa nhiều tạng; di căn phúc mạc; tình trạng toàn thân không cho phép phẫu thuật triệt căn
– Người bệnh không có khả năng phẫu thuật hoặc không chấp nhận phương pháp điều trị phẫu thuật.
4.3.1. Phẫu thuật triệu chứng
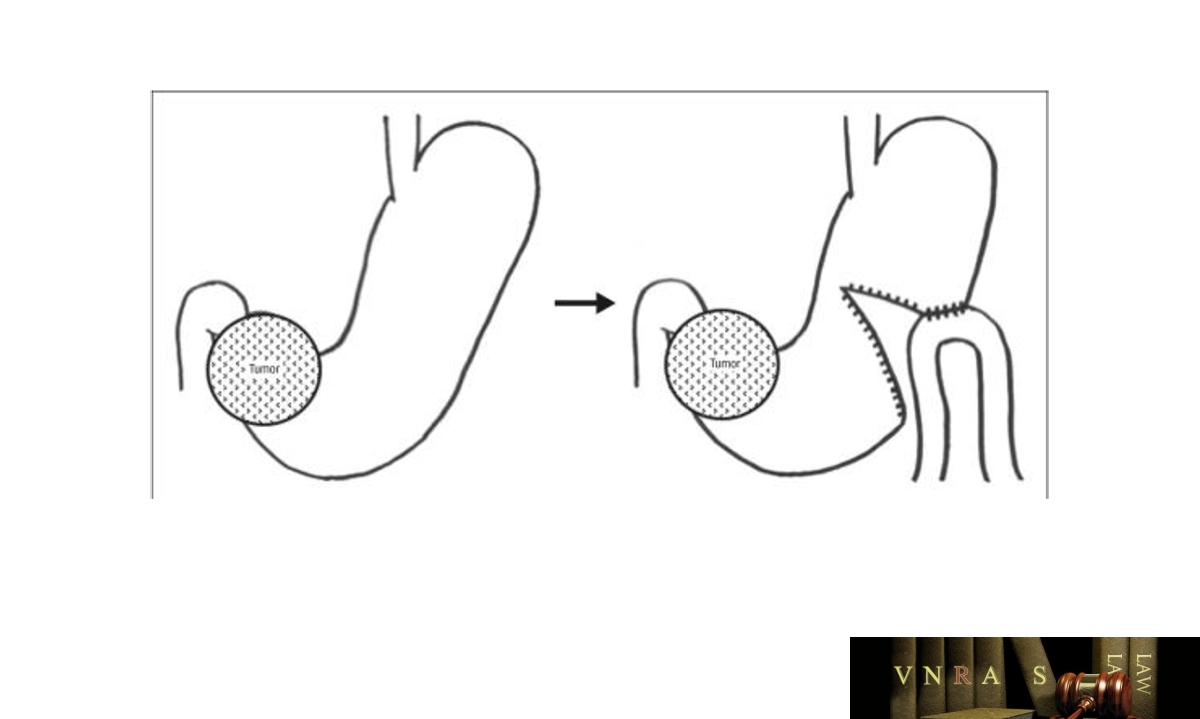
Ở những người bệnh UTDD giai đoạn di căn xa có biểu hiện xuất huyết tiêu hóa hoặc hẹp môn vị có thể chỉ định cắt dạ dày triệu chứng hoặc nối vị tràng tùy thuộc vào khả năng cắt bỏ khối u nguyên phát và các nguy cơ của phẫu thuật. Nối vị tràng bán phần dạ dày đảm bảo chức năng tốt hơn so với nối vị tràng đơn thuần.
4.3.2. Hóa trị
Mục đích:
– Điều trị triệu chứng, cải thiện chất lượng cuộc sống cho người bệnh.
– Kéo dài thời gian sống thêm không tiến triển, thời gian sống toàn bộ.
• Vai trò của hóa trị trong UTDD giai đoạn muộn
Kết quả từ các nghiên cứu thử nghiệm gần đây cho thấy những người bệnh UTDD giai đoạn muộn không còn khả năng phẫu thuật triệt căn mà có thể dung nạp được hóa trị sẽ đạt được lợi ích dù nhỏ nhưng rõ ràng về thời gian sống so với chỉ chăm sóc giảm nhẹ đơn thuần.
• Đơn hóa chất trong điều trị UTDD
Một số hóa chất được chỉ định trong điều trị ung thư dạ dày bao gồm: 5- fluorouracil, Capecitabine, TS-1, Cisplatin, Carboplatin, Oxaliplatin, Docetaxel, Paclitaxel, Doxorubicin, Epirubicin, Irinotecan, trifluridine phối hợp tipiracil,..
• Điều trị đơn hóa chất so với đa hóa chất
Đã có nhiều nghiên cứu để phát triển các công thức phối hợp hiệu quả hơn cho bệnh UTDD di căn bằng cách kết hợp các loại thuốc. Các thử nghiệm cho thấy tỷ lệ đáp ứng cao hơn với các phác đồ đơn chất. Một số nghiên cứu cho tỷ lệ đáp ứng 30%-50%. Các phân tích tổng hợp cho thấy các phối hợp hóa trị đem lại lợi ích sống còn khiêm tốn nhưng có ý nghĩa khi so sánh với đơn hóa trị.
Từ kết quả của các thử nghiệm ngẫu nhiên, ECF, DCF vàcác biến thể hiện được xem là phác đồ chuẩn trong điều trị bước một. Các dữ liệu từ thử nghiệm REAL-2 gợi ý rằng các kết quả là tương đương khi thay thế capecitabine cho 5-FU truyền, và thay thế oxaliplatin cho cisplatin trong phác đồ ECF.
Có 5 nhóm tác nhân hóa chất có hoạt tính trong UTDD với tỷ lệ đáp ứng là10-25%, thời gian đáp ứng trung bình tương đối ngắn bao gồm fluorouracil, cisplatin, docetaxel vàít sử dụng hơn làpaclitaxel, epirubicin vàirinotecan là các thành phần chính trong các phác đồ. Gần đây thì oxaliplatin vàcapecitabine cũng được dùng nhiều trong điều trị đa hóa chất.
• Các phác đồ điều trị phối hợp
– Cisplatin-Fluoropyrimidine (CF): là một trong những phác đồ đã được áp dụng rộng rãi.
Cisplatin kết hợp với các fluoropyrimidine dạng uống – do mối nguy cơ tiềm năng và sự bất tiện khi dùng 5-FU truyền liên tục. Các nghiên cứu đã nỗ lực thay thế bằng các dẫn xuất fluoropyrimidine đường uống như uracil-ftorafur (UFT), capecitabine vàTS-1.
– Docetaxel, Cisplatin và Fluoropyrimidine (DCF): kết quả của thử nghiệm ngẫu nhiên so sánh phối hợp DCF với CF (thử nghiệm TAX325) cho thấy phác đồ phối hợp 3 thuốc có hiệu quả hơn mặc dù độc tính tương ứng cũng tăng đáng kể. Tuy nhiên, không có sự khác biệt về tỷ lệ tử vong do điều trị.
– Docetaxel kết hợp capecitabine – cho tỷ lệ đáp ứng trong khoảng 39-46%. Thời gian bệnh không tiến triển trung bình là 4,2-6,1 tháng, thời gian sống thêm toàn bộ trung bình là 8,4-15,8 tháng.
– Irinotecan với Fluoropyrimidine-Leucovorin (FOLFIRI): Một thử nghiệm phase III đã so sánh IF (irinotecan-fluorouracil) vàCF cho thấy hiệu quả không kém hơn. Không có sự khác biệt trong tỷ lệ đáp ứng toàn bộ (31,8% với IF và 25,8% với CF), thời gian tới khi bệnh tiến triển (5 tháng với IF và 4,2 tháng với CF) cũng như thời gian sống toàn bộ (9 tháng với IF và 8,7 tháng với CF). Độc tính ở nhóm IF thấp hơn, đặc biệt tỷ lệ sốt hạ bạch cầu. Kết luận được đưa ra là IF không kém hơn CF mà có vẻ ít độc tính hơn.
– Epirubicin, Cisplatin, vàFluoropyrimidine (ECF): phác đồ 3 thuốc epirubicin, cisplatin và fluorouracil (ECF) đã được nghiên cứu. Hai thử nghiệm ngẫu nhiên phase III đã so sánh ECF với một phối hợp không có cisplatin (FAMTX) hay không có anthracycline (MCF). Trong nghiên cứu đầu tiên, ECF hiệu quả hơn FAMTX cả về tỷ lệ đáp ứng và thời gian sống trung bình (8,7 tháng so với 6,1 tháng). Thử nghiệm thứ hai so sánh ECF với MCF ở 574 người bệnh, tỷ lệ đáp ứng toàn bộ là tương đương ở 2 nhóm nhưng thời gian sống trung bình ở nhóm ECF cao hơn đôi chút (9,4 so với 8,7 tháng), độc tính dung nạp được dù ức chế tủy xương gặp nhiều hơn ở nhóm MCF.
– Cisplatin và Irinotecan (IC): trong một thử nghiệm phase II, tỷ lệ đáp ứng đạt được khá và độc tính dung nạp được.
– Phác đồ phối hợp Oxaliplatin: một số chế độ phối hợp khác nhau đã được nghiên cứu bao gồm FOLFOX, EOF, XELOX [CAPOX], TS-1 với oxaliplatin. Tỷ lệ đáp ứng trong khoảng từ 40%-67%, thời gian sống trung bình từ 8-15 tháng.
– Phác đồ có TS-1: kết hợp TS-1 với irinotecan cho đáp ứng toàn bộ là 47,7% và với nhóm chưa được hóa trị trước đó là 59%. Trung vị sống thêm toàn bộ là 272 ngày vàvới nhóm hóa trị lần đầu là 322 ngày. Kết hợp TS-1 với Docetaxel cho đáp ứng toàn bộ và trung vị sống thêm tăng lên.
Phác đồ TS-1 kết hợp Cisplatin chỉ định cho UTDD tiến xa, di căn.
4.3.3. Điều trị sinh học
Yếu tố có đích là EGFR: khoảng 25% UT dạ dày giai đoạn muộn có bộc lộ yếu tố phát triển biểu mô loại týp II EGFR (Her 2/neu), có tỷ lệ tương tự trong UT vú, hay xảy ra ở týp ruột hơn týp lan tỏa. Trastuzumab: là một kháng thể đơn dòng tái tổ hợp ADN gắn chọn lọc có nguồn gốc từ người, tác động chọn lọc lên ngoại bào thụ thể 2 của yếu tố phát triển biểu mô người (HER2). Ức chế sự tăng sinh các tế bào khối u người có biểu hiện quá mức HER2. Thuốc được chỉ định trong ung thư dạ dày loại biểu mô tuyến giai đoạn di căn xa hoặc tiến triển tại vùng không phẫu thuật được; tái phát và HER2 (+++) trên phương pháp nhuộm hóa mô miễn dịch (IHC: Immunohistochemistry) hoặc HER2 (++) trên IHC nhưng dương tính (+) trên phương pháp lai huỳnh quang tại chỗ (FISH: Fluorescence In Situ Hybridization).
Yếu tố có đích là VEGF: việc tăng yếu tố phát triển nội mạch máu liên quan đến tiên lượng xấu trong UT dạ dày giai đoạn có thể mổ được, bởi vì khi yếu tố phát triển nội mạch tăng lên, thì nhiều mạch máu tân tạo được hình thành, do vậy u sẽ phát triển nhanh hơn, mạnh hơn. Ramucirumab là một kháng thể đơn dòng tái tổ hợp của lớp IgG1 gắn với các VEGFR-2, ngăn chặn kích hoạt thụ thể. Thuốc được chỉ định sử dụng đơn trị liệu hoặc kết hợp với paclitaxel bước hai ung thư dạ dày loại biểu mô tuyến giai đoạn di căn xa, tiển triển tại vùng không phẫu thuật được hoặc thất bại sau một phác đồ có 5-FU hoặc platin (bước 2 và các bước tiếp theo).
Pembrolizumab: là kháng thể đơn dòng gắn trực tiếp vào thụ thể PD1 và được FDA chấp thuận trong điều trị ung thư dạ dày, đoạn nối dạ dày thực quản và thực quản giai đoạn tiến xa có biểu hiện bộc lộ MSI cao hoặc sai lầm sửa chữa ghép cặp dMMR sau thất bại hóa trị bước 1 hoặc trường hợp PD-L1 dương tính (chỉ số CPS ≥1) trong trường hợp sau ít nhất 2 liệu pháp hóa trị trước đó.
4.3.4. Điều trị ung thư dạ dày giai đoạn di căn một số vị trí đặc biệt
– Di căn xương: xạ trị chiếu ngoài 30Gy trong 10 buổi hoặc 40Gy trong 20 buổi hoặc 20Gy trong 5 buổi hoặc xạ trị chiếu trong (P-32, Strontium-89 hoặc Samarium-153).
– Di căn não: xạ phẫu bằng dao gamma liều 16-24Gy nếu không quá 3 tổn thương, đường kính mỗi tổn thương ≤5cm. Hoặc xạ trị toàn não 30Gy trong 10 buổi, 36Gy trong 20 buổi …
4.3.5. Dinh dưỡng- chăm sóc giảm nhẹ:
Dinh dưỡng:
Ung thư dạ dày ngoài gây ảnh hưởng hấp thu dinh dưỡng còn bị chính bệnh lý ung thư gây suy mòn cơ thể. Vì vậy, vấn đề tăng cường dinh dưỡng, nâng cao thể trạng người bệnh trước, sau phẫu thuật và trong quá trình điều trị bổ trợ cũng như chăm sóc giai đoạn muộn là hết sức cần thiết. Cần tăng cường chế độ ăn giàu năng lượng, bổ sung vi chất qua đường tiêu hóa và cả đường tĩnh mạch như truyền các dung dịch acid amin, lipid, các chế phẩm chứa cả dinh dưỡng và điện giải như các chế phẩm túi 2 ngăn, 3 ngăn: Kabiven, nutriplex, combilipid, …
Dinh dưỡng sau phẫu thuật cắt dạ dày
Tăng dần theo từng ngày được số lượng 2000ml. Ăn nhiều bữa, mỗi bữa (≥ 6 bữa, 200-300ml/bữa), mỗi ngụm vừa phải, 30-50ml để nuốt, ăn chậm, khi thấy no nghỉ 10 phút tiếp tục ăn cho đến hết suất ăn (45-60 phút/ bữa).
Thức ăn chế biến
• Sữa, súp lỏng: 3-5 ngày
• Súp xay: 3-5 ngày
• Cháo hạt: 5-7 ngày (nên nấu 50gam = nửa lạng gạo + ≥ 50gam thịt + rau)
Nếu ăn vào dung nạp tốt thìchuyển dần cách chế biến từ lỏng sang đặc
Ăn cơm từ ngày 21-30 sau phẫu thuật: ăn chậm, nhai kỹ, nấu nhừ với rau non, rau mầm trong 2 tháng đầu, hạn chế chất xơ nhiều: măng, rau già…
Nên bổ sung 200ml quả chín/ ngày (xay, bỏ chất xơ) và sữa 2 cốc / ngày.
Lượng thực phẩm đủ để ăn 01 ngày đảm bảo:
• Thịt cá các loại (thịt, hải sản, đậu… → thay đổi theo bữa) ≥ 200 -300gam/ngày
• Rau (các loại thay đổi) ≥ 200 gam/ngày
• Gạo ≥ 150-200 gam/ngày
• Dầu ăn ≥ 10-20 gam/ngày
• Sữa 500ml
Hạn chế các chất kích thích: rượu, bia, thuốc lá, café..
Chăm sóc giảm nhẹ:
Mục đích nâng cao chất lượng sống các người bệnh không còn chỉ định điều trị bằng phẫu thuật, xạ trị hay hóa trị, hạn chế và kiểm soát tốt các những triệu chứng gây khó chịu, đau đớn cho người bệnh. Bằng các biện pháp đơn giản, dễ thực hiện ở các cơ sở y tế khác nhau như dùng thuốc làm giảm triệu chứng, dùng các thuốc chống hủy xương khi có di căn xương, chọc hút dịch ổ bụng, dịch màng phổi…+
4.4. Các phác đồ hóa trị ung thư dạ dày
4.4.1. Hóa trị trước mổ
*Hoá xạ kết hợp:
Phác đồ Paclitaxel + Carboplatin
Paclitaxel 50mg/m2 truyền tĩnh mạch ngày 1
Carboplatin AUC 2 truyền tĩnh mạch ngày 1
Truyền hàng tuần cùng xạ trị x 5 tuần
Phác đồ Oxaliplatin + 5FU
Oxaliplatin 85mg/m2 truyền tĩnh mạch ngày 1
Leucovorin 400 mg/m2 truyền tĩnh mạch ngày 1
5-FU 400 mg/m2 truyền tĩnh mạch bolus ngày 1
5-FU 800 mg/m2 truyền tĩnh mạch 24 giờ ngày 1-2
Chu kỳ 14 ngày x 3 chu kỳ cùng xạ trị và 3 chu kỳ sau xạ trị
Phác đồ Oxaliplatin + Capecitabine
Oxaliplatin 85mg/m2 truyền tĩnh mạch ngày 1, 15 và29
Capecitabine 625mg/m2 uống x 2 lần/ ngày 1-5 trong 5 tuần cùng xạ trị
Phác đồ Cisplatin + Capecitabine
Cisplatin 30mg/m2 truyền tĩnh mạch ngày 1
Capecitabine 800mg/m2 uống x 2 lần/ ngày 1
Truyền hàng tuần cùng xạ trị x 5 tuần
*Hoá trị đơn thuần:
Phác đồ EOX
Epirubicin 50mg/m2 truyền tĩnh mạch ngày 1
Oxaliplatin 130mg/m2 truyền tĩnh mạch ngày 1
Capecitabine 625mg/m2 uống 2 lần/ ngày, ngày 1-21
Chu kỳ 21 ngày x 3 chu kỳ trước mổ và 3 chu kỳ sau mổ
Phác đồ ECX
Epirubicin 50mg/m2 truyền tĩnh mạch ngày 1
Cisplatin 60mg/m2 truyền tĩnh mạch ngày 1
Capecitabine 1000-1250mg/m2 uống ngày 1-21
Chu kỳ 21 ngày x 3 chu kỳ trước mổ và3 chu kỳ sau mổ
Phác đồ FLOT
Docetaxel 50mg/m2 truyền tĩnh mạch ngày 1
Oxaliplatin 85mg/m2 truyền tĩnh mạch ngày 1
Leucovorin 200 mg/m2 truyền tĩnh mạch ngày 1
5-FU 1200 mg/m2 truyền tĩnh mạch 24 giờ ngày 1, 2
Chu kỳ 14 ngày x 4 chu kỳ trước mổ và 4 chu kỳ sau mổ
Phác đồ Cisplatin + TS-1
Cisplatin 30mg/m2 truyền tĩnh mạch ngày 1
TS-1 40mg-50mg/m2 x 2 lần/ngày uống ngày 1-14
Chu kỳ 3 tuần
Phác đồ Cisplatin + TS-1
Cisplatin 30mg/m2 truyền tĩnh mạch ngày 1
TS-1 40mg-50mg/m2 x 2 lần/ngày uống ngày 1-28
Chu kỳ 6 tuần
Các phác đồ khác:
Phác đồ 5-FU + cisplatin
Cisplatin 75-100mg/m2, truyền tĩnh mạch ngày 1, 29
5-FU 750-1.000mg/m2, truyền tĩnh mạch 24 giờ vào các ngày 1-4 và 29-32. Chu kỳ 35 ngày.
Phác đồ 5-FU + cisplatin
Cisplatin 15mg/m2, truyền tĩnh mạch ngày 1-5
5-FU 800mg/m2, truyền tĩnh mạch 24 giờ vào các ngày 1-5. Chu kỳ 21 ngày x 2 chu kỳ.
Phác đồ paclitaxel + 5-FU
Paclitaxel 45-50mg/m2, truyền tĩnh mạch ngày 1, hàng tuần
5-FU 300mg/m2, truyền tĩnh mạch liên tục hàng ngày, ngày 1-5, hàng tuần x 5 tuần.
Phác đồ paclitaxel + capecitabine
Paclitaxel 45-50mg/m2, truyền tĩnh mạch ngày 1
Capecitabine 625-825mg/m2, uống 2 lần/ngày, ngày 1-5, hàng tuần x 5 tuần
4.4.2. Hóa trị bổ trợ
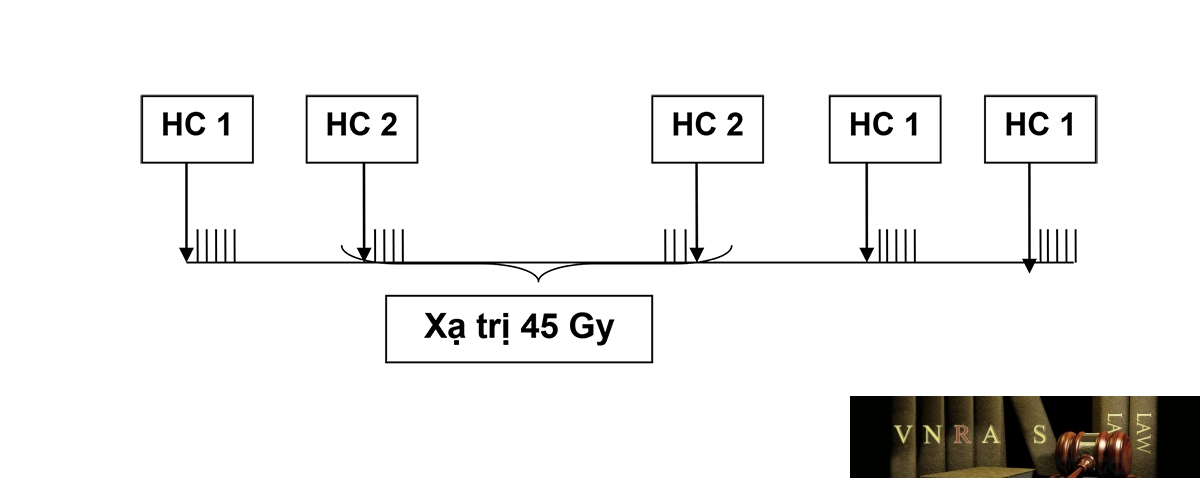
*Hóa xạ trị kết hợp:
5-FU + leucovorin
Hóa trị 1:
5-FU 425 mg/m2 truyền tĩnh mạch ngày 1-5
Leucovorin 20 mg/m2 truyền tĩnh mạch ngày 1-5
Hóa trị 2:
5-FU 400 mg/m2 truyền tĩnh mạch ngày 1-4 và 3 ngày cuối của đợt xạ trị
Leucovorin 20 mg/m2 truyền tĩnh mạch ngày 1-4 và 3 ngày cuối của đợt xạ trị
Hoá xạ trị đồng thời (5 tuần). Liều xạ trị: 45-50,4 Gy. Phân liều: 1,8 Gy/ngày.
Capecitabine
Capecitabine 750-1000mg/ m2 uống x 2 lần/ ngày 1-14
Chu kỳ 28 ngày. Điều trị 1 chu kỳ trước và2 chu kỳ sau xạ trị.
Hoặc
Capecitabine 625-825mg/ m2 uống x 2 lần/ ngày 1-5 hoặc ngày 1-7
Dùng hàng tuần trong 5 tuần
Phác đồ 5-FU
Với xạ trị: 5-FU 200-250mg/m2, truyền tĩnh mạch liên tục 24 giờ vào ngày 1-5 hoặc ngày 1-7. Hàng tuần x 5 tuần.
*Hoá trị đơn thuần:
Phác đồ XELOX
Oxaliplatin 130mg/ m2 truyền tĩnh mạch ngày 1
Capecitabine 1000-1250 mg/ m2 uống x 2 lần/ ngày 1-14
Chu kỳ 3 tuần x 8 chu kỳ
Phác đồ EOX
Epirubicin 50mg/ m2 truyền tĩnh mạch ngày 1
Oxaliplatin 130mg/ m2 truyền tĩnh mạch ngày 1
Capecitabine 625mg/ m2 uống 2 lần/ ngày, ngày 1-21
Chu kỳ 3 tuần x 6 chu kỳ
Hóa trị TS-1
TS-1 40mg-50mg/ m2 x 2 lần/ngày uống ngày 1-28
Chu kỳ 6 tuần x 12 tháng
Phác đồ SOX
Oxaliplatin 130mg/ m2 truyền tĩnh mạch ngày 1
TS-1 40mg/ m2 x 2 lần/ngày uống ngày 1-14
Chu kỳ 3 tuần x 8 chu kỳ.
Sau đó:
TS-1 40mg/ m2 x 2 lần/ngày uống ngày 1-28
Chu kỳ 6 tuần tới đủ 12 tháng kể từ khi điều trị hóa chất
Phác đồ Docetaxel + TS-1
Docetaxel 40mg/ m2 truyền tĩnh mạch ngày 1 chu kỳ 2-7
TS-1 40mg/ m2 x 2 lần/ngày uống ngày 1-14
Chu kỳ 3 tuần x 12 tháng.
Phác đồ TS-1 + cisplatin
TS-1 liều 40 – 60mg đường uống 2 lần 1 ngày (tuỳ theo diện tích da nếu: < 1,25m2: 40mg; 1,25 -1,5 m2: 50mg; > 1,5m2: 60mg), sử dụng ngày 1-21
Cisplatin 60mg/m2, truyền tĩnh mạch ngày 8. Chu kỳ 5 tuần.
Phác đồ TS-1 + cisplatin
TS-1 liều 40 – 60mg đường uống 2 lần 1 ngày (tuỳ theo diện tích da nếu: < 1,25m2: 40mg; 1,25 – 1,5m2: 50mg; > 1,5m2: 60mg), sử dụng ngày 1-14.
Cisplatin 60mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 3 tuần.
Phác đồ capecitabine
Capecitabine 1.000 – 1.250mg/m2, uống 2 lần/ngày, ngày 1 – 14. Chu kỳ 3 tuần.
Hoặc dùng liều thấp kéo dài (Metronomic)
500mg/m2, uống 3 lần/ngày vào tất cả các ngày. Chu kỳ 3 tuần
Hoặc dùng liều thấp kéo dài (Metronomic)
625mg/m2, uống 2 lần/ngày vào tất cả các ngày. Chu kỳ 3 tuần.
Phác đồ Tegafur – Uracil (Ufur, Mefuform)
Tegafur – Uracil 360mg tegafur/m2 uống ngày 1 – 5/1 tuần, uống trong 16 tháng.
* Hóa trị kết hợp phẫu thuật (Perioperation)
Dùng 3 chu kỳ trước phẫu thuật và 3 chu kỳ sau phẫu thuật.
* Các phác đồ được ưu tiên lựa chọn:
Phác đồ oxaliplatin + 5-FU
Oxaliplatin 85mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 1.200mg/m2, truyền tĩnh mạch liên tục 24 giờ vào ngày 1, 2. Chu kỳ 14 ngày.
Phác đồ oxaliplatin + 5-FU
Oxaliplatin 85mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 200mg/m2, truyền tĩnh mạch ngày 1
5-FU 2.600mg/m2, truyền tĩnh mạch liên tục 24 giờ vào ngày 1.
Chu kỳ 14 ngày.
Phác đồ oxaliplatin + capecitabine
Oxaliplatin 130mg/m2, truyền tĩnh mạch ngày 1
Capecitabine 1000-1250 mg/m2, uống 2 lần/ngày, ngày 1-14.
Chu kỳ 21 ngày.
Phác đồ oxaliplatin + 5-FU + docetaxel
Oxaliplatin 85mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 200mg/m2, truyền tĩnh mạch ngày 1
5-FU 2.600mg/m2, truyền tĩnh mạch liên tục 24 giờ vào ngày 1
Docetaxel 50mg/m2, truyền tĩnh mạch ngày 1
Chu kỳ 14 ngày x 4 chu kỳ trước phẫu thuật + 4 chu kỳ sau phẫu thuật (tổng 8 chu kỳ).
* Một số phác đồ khác:
Phác đồ 5-FU + cisplatin
5-FU 2.000mg/m2, truyền tĩnh mạch liên tục 48 giờ vào ngày 1, 2
Cisplatin 50mg/m2, truyền tĩnh mạch ngày 1.
Chu kỳ 14 ngày x 4-6 chu kỳ trước phẫu thuật + 4-6 chu kỳ sau phẫu thuật (tổng 12 chu kỳ).
Phác đồ epirubicin + cisplatin + 5-FU (ECF)
Epirubicin 50mg/m2, truyền tĩnh mạch ngày 1
Cisplatin 60mg/m2, truyền tĩnh mạch ngày 1
5-FU 200mg/m2/ngày, truyền tĩnh mạch 21 ngày. Chu kỳ 3 tuần
Phác đồ epirubicin + oxaliplatin + capecitabine (EOX)
Epirubicin 50mg/m2, truyền tĩnh mạch ngày 1
Oxaliplatin 130mg/m2, truyền tĩnh mạch ngày 1 trong 2 giờ Capecitabine 625mg/m2/ngày, uống 2 lần/ngày, ngày 1-21. Chu kỳ 21 ngày
Phác đồ epirubicin + oxaliplatin + 5-FU
Epirubicin 50mg/m2, truyền tĩnh mạch ngày 1
Oxaliplatin 135mg/m2, truyền tĩnh mạch ngày 1 trong 2 giờ
5-FU 200mg/m2/ngày, truyền tĩnh mạch 21 ngày.
Chu kỳ 3 tuần.
Phác đồ epirubicin + cisplatin + capecitabine (ECX)
Epirubicin 50mg/m2, truyền tĩnh mạch ngày 1
Cisplatin 60mg/m2, truyền tĩnh mạch ngày 1
Capecitabine 625mg/m2/ngày, uống 2 lần/ngày, ngày 1-21.
Chu kỳ 21 ngày
* Hóa xạ trị kế tiếp
Phác đồ paclitaxel + cisplatin
Paclitaxel 50mg/m2, truyền tĩnh mạch ngày 1
Cisplatin 30mg/m2, truyền tĩnh mạch ngày 1. Hàng tuần × 5 tuần trước phẫu thuật. Sau đó:
Paclitaxel 175mg/m2, truyền tĩnh mạch ngày 1
Cisplatin 75mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày × 3 chu kỳ sau phẫu thuật.
Phác đồ docetaxel + cisplatin
Trước phẫu thuật:
Docetaxel 75mg/m2, truyền tĩnh mạch ngày 1
Cisplatin 75mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày × 2 chu kỳ. Sau đó:
Docetaxel 20mg/m2, truyền tĩnh mạch ngày 1, 8, 15, 22, 29
Cisplatin 25mg/m2, truyền tĩnh mạch ngày 1, 8, 15, 22, 29. Kết hợp cùng xạ trị.
Phác đồ cisplatin + irinotecan
Cisplatin 30mg/m2, truyền tĩnh mạch ngày 1, 8, 22, 29
Irinotecan 50mg/m2, truyền tĩnh mạch ngày 1, 8, 22, 29. Kết hợp với xạ trị trước phẫu thuật. Sau đó:
Cisplatin 30mg/m2, truyền tĩnh mạch ngày 1, 8
Irinotecan: 65mg/m2, truyền tĩnh mạch ngày 1, 8. Chu kỳ 21 ngày × 3 chu kỳ sau phẫu thuật.
Phác đồ cisplatin + irinotecan
Trước phẫu thuật:
Cisplatin 30mg/m2, truyền tĩnh mạch ngày 1, 8
Irinotecan: 65mg/m2, truyền tĩnh mạch ngày 1, 8. Chu kỳ 21 ngày × 2 chu kỳ.
Sau đó:
Cisplatin 30mg/m2, truyền tĩnh mạch ngày 1, 8
Irinotecan: 65mg/m2, truyền tĩnh mạch kết hợp với xạ trị vào các ngày 1, 8, 15, 22 hoặc 1, 8, 22, 29.
Phác đồ cisplatin + 5-FU + paclitaxel
Trước phẫu thuật:
Cisplatin 20mg/m2, truyền tĩnh mạch ngày 1-5
5-FU 200mg/m2, truyền tĩnh mạch 24 giờ ngày 1-21.
Chu kỳ 28 ngày × 2 chu kỳ. Sau đó:
Paclitaxel 45mg/m2, truyền tĩnh mạch ngày 1
5-FU 300mg/m2, truyền tĩnh mạch 24 giờ ngày 1-5.
Hàng tuần × 5 tuần kết hợp cùng xạ trị.
4.4.3. Điều trị triệu chứng
* Các phác đồ phối hợp
Phác đồ ECF
Epirubicin 50mg/ m2 truyền tĩnh mạch ngày 1
Cisplatin 60mg/ m2 truyền tĩnh mạch ngày 1
5-Fluorouracil 200 mg/ m2 truyền tĩnh mạch ngày 1-21
Chu kỳ 21 ngày
Phác đồ EOX
Epirubicin 50mg/ m2 truyền tĩnh mạch ngày 1
Oxaliplatin 130mg/ m2 truyền tĩnh mạch ngày 1
Capecitabine 625 mg/ m2 uống 2 lần/ ngày, ngày 1-21
Chu kỳ 21 ngày x 6 chu kỳ
Phác đồ DCF
Docetaxel 75mg/ m2 truyền tĩnh mạch ngày 1
Cisplatin 75mg/ m2 truyền tĩnh mạch ngày 1
5FU 750mg/ m2 truyền tĩnh mạch liên tục ngày 1-5
Chu kỳ 21 ngày
Hoặc
Docetaxel 75mg/ m2 truyền tĩnh mạch ngày 1
Cisplatin 75mg/ m2 truyền tĩnh mạch ngày 1
Capecitabine 650mg/ m2 uống 2 lần/ ngày, ngày 1-21
Chu kỳ 21 ngày
Hoặc
Docetaxel 50mg/m2 truyền tĩnh mạch ngày 1
Oxaliplatin 100mg/m2 truyền tĩnh mạch ngày 1
Capecitabine 650mg/m2 uống 2 lần/ ngày, ngày 1-21
Chu kỳ 21 ngày
Hoặc
Docetaxel 50mg/m2 truyền tĩnh mạch chậm ngày 1
Oxaliplatin 85mg/m2 truyền tĩnh mạch ngày 1
5 FU 2400mg/m2 truyền tĩnh mạch 46 giờ
Folinic acid 400mg/m2 truyền tĩnh mạch ngày 1-2
Chu kỳ 14 ngày
Phác đồ Docetaxel + Cisplatin
Docetaxel 70-85mg/ m2 truyền tĩnh mạch ngày 1
Cisplatin 70-75mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
Phác đồ Paclitaxel + Cisplatin hoặc Carboplatin
Paclitaxel 135-200mg/ m2 truyền tĩnh mạch ngày 1
Cisplatin 75mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
Hoặc
Paclitaxel 90mg/ m2 truyền tĩnh mạch ngày 1
Cisplatin 75mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 14 ngày
Hoặc
Paclitaxel 200mg/ m2 truyền tĩnh mạch ngày 1
Carboplatin AUC 5 truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
Phác đồ Docetaxel + Irinotecan
Docetaxel 35mg/ m2 truyền tĩnh mạch ngày 1, 8
Irinotecan 50mg/ m2 truyền tĩnh mạch ngày 1, 8
Chu kỳ 21 ngày
Phác đồ IRI-CIS
Irinotecan 50mg/ m2 truyền tĩnh mạch ngày 1, 8
Cisplatin 25-30mg/ m2 truyền tĩnh mạch ngày 1, 8
Chu kỳ 21 ngày
Phác đồ Irinotecan + cisplatin
Irinotecan 65mg/m2, truyền tĩnh mạch ngày 1, ngày 8.
Cisplatin 25-50mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày
Phác đồ Irinotecan + capecitabine
Irinotecan 250mg/m2, truyền tĩnh mạch ngày 1
Capecitabine 1000-1250mg/m2, uống 2 lần/ngày, ngày 1-14.
Chu kỳ 21 ngày
Phác đồ Cisplatin + TS-1
Cisplatin 75mg/m2 truyền tĩnh mạch ngày 1
TS-1 25mg/m2 x 2 lần/ngày uống 21 ngày
Phác đồ TS-1 + cisplatin
TS-1 liều 40-60mg đường uống 2 lần 1 ngày (tuỳ theo diện tích da nếu: <1,25m2: 40mg; 1,25-1,5m2: 50mg; >1,5m2: 60mg), sử dụng ngày 1-14.
Cisplatin 60mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 3 tuần.
Phác đồ TS-1 + oxaliplatin
TS-1 liều 40-60mg đường uống 2 lần 1 ngày (tuỳ theo diện tích da nếu: <1,25m2: 40mg; 1,25-1,5m2: 50mg; >1,5m2: 60mg), sử dụng ngày 1-14.
Oxaliplatin 100mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 3 tuần.
Phác đồ Docetaxel + TS-1
Docetacel 40mg/ m2 truyền tĩnh mạch ngày 1
TS-1 40mg/ m2 x 2 lần/ngày uống ngày 1-14
Chu kỳ 3 tuần.
Phác đồ irinotecan + 5-FU
Irinotecan 180mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 1200mg/m2, truyền tĩnh mạch 24 giờ ngày 1,2. Chu kỳ 14 ngày
Phác đồ 5-FU + cisplatin
Cisplatin 75-80mg/m2, truyền tĩnh mạch ngày 1
5-FU 750-1000mg/m2, truyền tĩnh mạch 24 giờ ngày 1-4.
Chu kỳ 28 ngày.
Phác đồ 5-FU + cisplatin
Cisplatin 50mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 200mg/m2, truyền tĩnh mạch ngày 1
5-FU 2000mg/m2, truyền tĩnh mạch 24 giờ, ngày 1. Chu kỳ 14 ngày.
Phác đồ cisplatin + capecitabine
Cisplatin 80mg/m2, truyền tĩnh mạch ngày 1
Capecitabine 1000-1250mg/m2, uống 2 lần/ngày, ngày 1-14.
Chu kỳ 21 ngày.
Phác đồ oxaliplatin + 5-FU
Oxaliplatin 85mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 1200mg/m2, truyền tĩnh mạch 24 giờ ngày 1,2.
Chu kỳ 14 ngày.
Phác đồ oxaliplatin + 5-FU
Oxaliplatin 85mg/m2, truyền tĩnh mạch ngày 1
Leucovorin 200mg/m2, truyền tĩnh mạch ngày 1
5-FU 2600mg/m2, truyền tĩnh mạch 24 giờ, ngày 1. Chu kỳ 14 ngày.
Phác đồ 5-FU
Leucovorin 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 400mg/m2, truyền tĩnh mạch ngày 1
5-FU 1200mg/m2, truyền tĩnh mạch 24 giờ ngày 1, 2. Chu kỳ 14 ngày.
Phác đồ capecitabine + oxaliplatin
Capecitabine 1000-1250mg/m2, uống 2 lần/ngày, ngày 1-14
Oxaliplatin 130mg/m2, truyền tĩnh mạch ngày 1. Chu kỳ 21 ngày
Phác đồ trifluridine + tipiracil:
Trifluridine + tipiracil 35mg/m2, 2 lần/ngày, vào ngày 1-5, 8-12 mỗi 4 tuần
Phác đồ Ramucirumab + paclitaxel
Ramucirumab 8mg/kg, truyền tĩnh mạch ngày 1, 15
Paclitaxel 80mg/m2, truyền tĩnh mạch ngày 1, 8, 15. Chu kỳ 28 ngày
* Đơn hóa trị
Taxane
Docetaxel 75-100mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
Hoặc
Paclitaxel 135-250mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
Hoặc
Paclitaxel 80mg/ m2 truyền tĩnh mạch ngày 1, 8, 15, 22
Chu kỳ 28 ngày
Phác đồ 5-FU
5-FU 800mg/m2, truyền tĩnh mạch 24 giờ ngày 1-5. Chu kỳ 28
ngày
Irinotecan
Irinotecan 250-350mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
Hoặc
Irinotecan 150-180mg/ m2 truyền tĩnh mạch ngày 1
Chu kỳ 14 ngày
Hoặc
Irinotecan 125mg/ m2 truyền tĩnh mạch ngày 1, 8
Chu kỳ 21 ngày
5-FU đường uống
Capecitabine 1000-1250mg/ m2 uống x 2 lần/ ngày 1-14
Chu kỳ 21 ngày cho tới khi bệnh tiến triển.
Hoặc
TS-1 80-120 mg/ngày, uống 4 tuần, nghỉ 2 tuần, chu kỳ 6 tuần cho tới khi bệnh tiến triển.
Hoặc
TS-1 80-120 mg/ngày, uống 2 tuần, nghỉ 1 tuần, chu kỳ 3 tuần cho tới khi bệnh tiến triển.
UFT (liều Tegafur) 100 mg/m2 uống 3 lần ngày trong 4 tuần, nghỉ 1 tuần, chu kỳ 5 tuần cho tới khi bệnh tiến triển.
*Điều trị đích
Phác đồ Trastuzumab + hóa trị (cho người bệnh bộc lộ Her-2 qua mức)
Trastuzumab 8mg/ kg truyền tĩnh mạch ngày 1 chu kỳ đầu, sau đó:
Trastuzumab 6mg/ kg truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày (cùng hóa trị)
Hoặc
Trastuzumab 6mg/ kg truyền tĩnh mạch ngày 1 chu kỳ đầu, sau đó:
Trastuzumab 4mg/ kg truyền tĩnh mạch ngày 1
Chu kỳ 14 ngày (cùng hóa trị)
Hóa trị
Cisplatin 80mg/ m2 truyền tĩnh mạch ngày 1
Capecitabine 1000-1250mg/ m2 uống x 2 lần/ ngày 1-14
Chu kỳ 21 ngày
*Điều trị miễn dịch
Pembrolizumab (điều trị bước hai hoặc thay thế cho người bệnh có MSI cao hoặc dMMR; bước ba hoặc thay thế cho người bệnh cóPD-L1 dương tính)
Pembrolizumab 200mg truyền tĩnh mạch ngày 1
Chu kỳ 21 ngày
5. THEO DÕI VÀ TIÊN LƯỢNG
5.1. Theo dõi
– Khám lâm sàng 3-6 tháng/lần trong 2 năm đầu, 6 tháng/lần trong 3 năm tiếp theo. Trong các trường hợp khác (nguời bệnh có nguy cơ cao, có tổn thương theo dõi…) có thể theo dõi định kì sát hơn 2 tháng/lần.
– Xét nghiệm CEA, CA 72-4, CA 19-9: 3-6 tháng/lần trong 2 năm đầu, 6 tháng/lần trong 3-5 năm.
– Chẩn đoán hình ảnh (CT, siêu âm, XQ) ngực/bụng 3-6 tháng/lần trong 2 năm đầu, 6-12 tháng/lần đến 5 năm.
– Chụp PET/CT: khi nghi ngờ tái phát hoặc di căn hoặc CEA hoặc CA 72-4 hoặc CA 19-9 tăng.
– Nội soi dạ dày 6-12 tháng/lần
5.2. Tiên lượng
– Thời gian sống thêm 5 năm từ 20-25%.
– Các yếu tố tiên lượng bệnh bao gồm độ xâm lấn u, di căn hạch và giai đoạn bệnh.
– Một số yếu tố khác cũng ảnh hưởng đến tiên lượng như: thể giải phẫu bệnh, độ môhọc…
TÀI LIỆU THAM KHẢO
1. Nguyễn Bá Đức, Trần Văn Thuấn, Nguyễn Tuyết Mai (2010). Điều trị nội khoa bệnh ung thư. Nhà xuất bản Y học. 445-446
2. Nguyễn Chấn Hùng (2004). Ung bướu học nội khoa. Nhà xuất bản Y học.
3. Nguyễn Bá Đức (2008). Ung thư dạ dày, Chẩn đoán và điều trị bệnh ung thư, Nhà xuất bản Y học.
4. Lương Ngọc Khuê, Mai Trọng Khoa (2020). Hướng dẫn chẩn đoán và điều trị một số bệnh ung bướu, Nhà xuất bản Y học.
5. Mai Trọng Khoa (2014). Hướng dẫn chẩn đoán và điều trị một số bệnh ung bướu. Nhà xuất bản Y học.
6. Mai Trọng Khoa (2016). Kháng thể đơn dòng và phân tử nhỏ trong điều trị bệnh ung thư. Nhà xuất bản Y học.
7. Mai Trọng Khoa (2013). Ứng dụng kỹ thuật PET/CT trong ung thư. Nhà xuất bản Y học.
8. Bùi Diệu và cs (2016). Hướng dẫn chẩn đoán và điều trị các bệnh ung thư thường gặp. Nhà xuất bản Y học.
9. Nguyễn Văn Hiếu (2010). Điều trị phẫu thuật bệnh ung thư. Nhà xuất bản Y học.
10. Trần Văn Thuấn, Bùi Diệu vàcộng sự (2018). Ung thư dạ dày, sổ tay điều trị nội khoa ung thư, Nhà xuất bản Y học.
11. Trần Văn Thuấn, Lê Văn Quảng, Nguyễn Tiến Quang (2019). Hướng dẫn chẩn đoán điều trị bệnh ung thư thường gặp. Nhà xuất bản Y học.
12. Siegel RL, Miller KD, Jemal A (2018). Cancer statistics. CA Cancer J Clin 2018; 68:7.
13. Cunningham D, Allum WH, Stenning SP, et al (2006). Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med; 355:11.
14. Macdonald JS, Smalley SR, Benedetti J, et al (2001). Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med; 345:725.
15. Ajani JA, In H, Sano T, et al (2017). Stomach.In: AJCC Cancer Staging Manual, 8th, Amin MB. (Ed), AJCC, Chicago. p.203.
16. Boige V, Pignon J, Saint-Aubert B, et al (2007). Final results of a randomized trial comparing preoperative 5-fluorouracil/cisplatin to surgery alone in adenocarcinoma of stomach and lower esophagus (ASLE): FNLCC ACCORD07-FFCD 9703 trial (abstract). J Clin Oncol; 25:200s.
17. Schuhmacher C, Gretschel S, Lordick F, et al (2010). Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954. J Clin Oncol; 28:5210.
18. Kobayashi T, Kimura T (2000). Long-term outcome of preoperative chemotherapy with 5′-deoxy-5-fluorouridine (5′-DFUR) for gastric cancer. Gan To Kagaku Ryoho; 27: 1521.
19. Namikawa T, Maeda H, Kitagawa H, et al (2018). Treatment using oxaliplatin and S-1 adjuvant chemotherapy for pathological stage III gastric cancer: a multicenter phase II study (TOSA trial) protocol, BMC Cancer 18:186.
20. Japanese Gastric Cancer Association (2017). Japanese gastric cancer treatment guidelines 2014 (ver. 4). Gastric Cancer 20:1–19.
21. Hamashima C (2018). Update version of the Japanese Guidelines for Gastric Cancer Screening. Japanese Journal of Clinical Oncology, 48(7) 673–683.
22. Veer E, Mohammad N H, Lodder P, et al (2016). The efficacy and safety of S-1-based regimens in the first-line treatment of advanced gastric cancer: a systematic review and meta-analysis. Gastric Cancer 19:696–712.
23. Bang YJ, Kim YW, Yang HK, et al (2012). Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase 3 open- label, randomised controlled trial, Lancet, January 7, DOI: 10. 1016/S0140-6736 (11). 61873-4.
24. Bang YJ, Van Custem E, et al (2010). Phase III Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial, Lancet,; 376: 687–97.
25. Diaz-Nieto R, Orti-Rodríguez R, Winslet M (2013). Post-surgical chemotherapy versus surgery alone for resectable gastric cancer, Cochrane Database Syst Rev; 9:CD008415.
26. Vincent t DeVita, Theodore S. Lawrence, Steven A. Rosenberg (2014), Cancer Principles and Practice of Oncology, 10th edition. Lippincott Ravell publishers. Philadelphia, United States.
27. World Health Organization (2018). Gastric Cancer. International Agency for Research on Cancer, GLOBOCAN 2018.
28. Pan-Asian adapted ESMO consensus guidelines for the management of patients with metastatic colorectal cancer 2018.
29. Kazuhiro Yoshida, Yasuhiro Kodera, Mitsugu Kochi, et al. Addition of Docetaxel to Oral Fluoropyrimidine Improves Efficacy in Patients with Stage III Gastric Cancer: Interim Analysis of JACCRO GC-07, a Randomized Controlled Trial. Journal of Clinical Oncology 2019 37(15): 1296-1304.
30. K. Muro, E. Van Cutsem, Y. Narita et al (2019). Pan-Asian adapted ESMO Clinical Practice Guidelines for the management of patients with metastatic gastric cancer: a JSMO–ESMO initiative endorsed by CSCO, KSMO, MOS, SSO and TOS. Annals of Oncology 2019; 30: 19-33.
31. Kohei Shitara, Toshihiko Doi, Mikhail Dvorkin, Wasat Mansoor, Hendrik- Tobias Arkenau, Prof Aliaksandr Prokharau et al. Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Oncology 2018, 19(11): 1437-1448.
32. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2014 (ver. 4). Gastric Cancer 2017; 20 (1):1-19.
33. National Comprehensive Cancer Network (2020). Gastric Cancer, version 1.2020. NCCN Clinical Practice Guideline in Oncology.
































