
HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ MỘT SỐ BỆNH VỀ THẬN – TIẾT NIỆU
(Ban hành kèm theo Quyết định số 3931/QĐ-BYT ngày 21/9/2015 của Bộ trưởng Bộ Y tế)
Chủ biên
PGS.TS. Nguyễn Thị Xuyên
Đồng Chủ biên:
PGS.TS. Nguyễn Quốc Anh
PGS.TS. Đinh Thị Kim Dung
PGS.TS. Lương Ngọc Khuê
Ban biên soạn
PGS.TS. Đinh Thị Kim Dung
PGS.TS. Đỗ Thị Liệu
PGS.TS. Đỗ Gia Tuyển
PGS.TS. Trần Thị Bích Hương
PGS.TS. Võ Tam
TS.BS. Đặng Thị Việt Hà
TS.BS Vương Tuyết Mai
TS.BS Trần Quý Tường
TS.BS Nguyễn Vĩnh Hưng
BSCK II. Châu Thị Kim Liên
BSCK II. Tạ Phương Dung
Ths.BS Lê Danh Vinh
Ths.BS Nguyễn Thị Hương
Ths.BS. Nguyễn Văn Thanh
Thư ký
TS.BS Vương Tuyết Mai
ThS.BS Lê Danh Vinh
Ths. Ngô Thị Bích Hà
Ths. Trương Lê Vân Ngọc
MỤC LỤC
Chữ viết tắt
1. Protein niệu
2. Protein niệu ở thai kỳ
3. Đái máu
4. Hội chứng thận hư nguyên phát ở người trưởng thành
5. Bệnh thận IgA
6. Viêm thận Lupus
7. Bệnh thận đái tháo đường
8. Viêm thận bể thận cấp
9. Chẩn đoán và điều trị nội khoa sỏi thận tiết niệu
10. Ứ nước, ứ mủ bể thận
11. Viêm bàng quang cấp
12. Viêm niệu đạo cấp không do lậu
13. Viêm ống kẽ thận cấp
14. Viêm tuyến tiền liệt cấp
15. Nang đơn thận
16. Thận đa nang
17. Tăng kali máu trong bệnh thận
18. Tăng huyết áp trong bệnh thận mạn
19. Tổn thương thận cấp
20. Suy thận cấp
21. Bệnh thận mạn
22. Bệnh thận mạn giai đoạn cuối
23. Thiếu máu ở bệnh thận mạn
24. Điều trị thiếu máu bằng Erythropoietin ở bệnh thận mạn
25. Chẩn đoán và điều trị nội khoa cường cận giáp trạng thứ phát ở bệnh nhân bệnh thận mạn tính
26. Chẩn đoán nguyên nhân và xử trí một số biến chứng thường gặp trong quá trình lọc máu
27. Chẩn đoán nguyên nhân và xử trí hạ huyết áp trong thận nhân tạo
28. Biến chứng thường gặp ở bệnh nhân lọc màng bụng liên tục ngoại trú
29. Chẩn đoán và xử trí ban đầu viêm phúc mạc ở người bệnh lọc màng bụng liên tục ngoại trú
30. Thải ghép thận cấp
CHỮ VIẾT TẮT
| ACE: | Angiotensin Converting Enzyme |
| ARB: | Angiotensin Receptor Blockers |
| BMI: | Body Mass Index (Chỉ số khối cơ thể) |
| BTM: | Bệnh thận mạn |
| CCGTP: | Cường cận giáp thứ phát |
| CTNT: | Chạy thận nhân tạo |
| ĐTĐ: | Đái tháo đường |
| ESRD: | End-Stage-Renal- Disease |
| GFR: | Glomerular Filtration Rate |
| HDL-C: | Cholesterol Liprotein tỉ trọng cao |
| KDIGO: | Kidney Disease Improving Global Outcomes |
| KS: | Kháng sinh |
| LDL-C: | Cholesterol Liprotein tỉ trọng thấp |
| Min: | Bé nhất |
| Max: | Lớn nhất |
| MLCT: | Mức lọc cầu thận |
| PTH: | Parathoid hormone |
| STM: | Suy thận mạn |
| THA | Tăng huyết áp |
| TB: | Trung bình |
| TCG: | Tuyến cận giáp |
| TNT: | Thận nhân tạo |
| TPPM: | Thẩm phân phúc mạc |
| ƯCMC: | Ức chế men chuyển |
| UCTT: | Ức chế thụ thể |
| ƯCCC: | Ức chế canci |
| VTBT: | Viêm thận bể thận |
| VCT: | Viêm cầu thận |
| VCTM: | Viêm cầu thận mạn |
| VK: | Vi khuẩn |
PROTEIN NIỆU
1. ĐẠI CƯƠNG
Bình thường protein không có hoặc rất ít trong nước tiểu. Khi protein xuất hiện thường xuyên và số lượng nhiều trong nước tiểu thường có ý nghĩa bệnh lý và là một trong những chỉ điểm quan trọng của bệnh lý thận tiết niệu.
Xác định protein niệu (Proteinuria) rất có giá trị trong chẩn đoán các bệnh lý thận tiết niệu. Hiện nay, xét nghiệm protein niệu được xem như là một test sàng lọc bệnh lý thận, tiết niệu.
Về mặt số lượng, có thể phân loại:
– Protein niệu sinh lý: Khi protein dưới 30 mg/ 24 giờ.
– Microprotein niệu (protein niệu vi thể): Khi protein 30 – 300 mg/ 24 giờ.
– Protein niệu thực sự: Khi protein trên 300 mg/24 giờ.
Mã số (theo ICD 10): N06
Protein niệu sinh lý:
Mỗi ngày, có từ 10 kg đến 15 kg protein huyết tương đi qua tuần hoàn thận, nhưng chỉ có 100 đến 150 mg được bài tiết ra trong nước tiểu trong vòng 24 giờ.
Protein được tiết ra nước tiểu từ thành mao mạch cầu thận và hầu hết lượng protein này được tái hấp thu ở ống lượn gần.
Ở người bình thường, khoảng 60% lượng protein niệu có nguồn gốc từ huyết tương, 40% còn lại có nguồn gốc từ thận và từ đường tiết niệu.
Các thành phần của protein niệu sinh lý gồm:
– Protein có nguồn gốc từ huyết tương, bao gồm:
+ Albumin.
+ Các Globuline có trọng lượng phân tử thấp.
+ Các Hormone có cấu trúc là các chuỗi peptid.
– Protein có nguồn gốc từ thận và từ đường tiết niệu, bao gồm:
+ Protein Tamm – Horsfall: Được tổng hợp ở nhánh lên của quai Henlé, chức năng của nó đến nay vẫn chưa được biết rõ.
+ IgA.
+ Urokinase.
2. CÁC PHƯƠNG PHÁP XÁC ĐỊNH PROTEIN NIỆU
a) Phương pháp định tính
– Đốt nước tiểu: Đặc điểm lý học của protein là đông vón ở nhiệt độ cao, lợi dụng đặc điểm này, có thể phát hiện được protein có trong nước tiểu bằng cách đốt nước tiểu. Đựng nước tiểu trong một ống nghiệm và đốt trên ngọn đèn cồn, protein trong nước tiểu sẽ đông vón khi nhiệt độ của nước tiểu trên 70oC. Hiện tượng đông vón của protein trong nước tiểu sẽ làm vẩn đục nước tiểu và dễ dàng nhận ra bằng mắt thường. Tùy thuộc vào nồng độ protein niệu cao hay thấp mà mức độ vẫn đục nước tiểu thay đổi, có thể chỉ lởn vởn đục ít, có thể nước tiểu đông quánh lại khi lượng protein trong nước tiểu nhiều.
– Làm lạnh bởi acide sulfosalicylique hay trichloracétique: Dựa vào tính chất lý học của protein là đông vón trong môi trường acid, khi nhỏ acid vào để tìm hiện tượng đông vón protein.
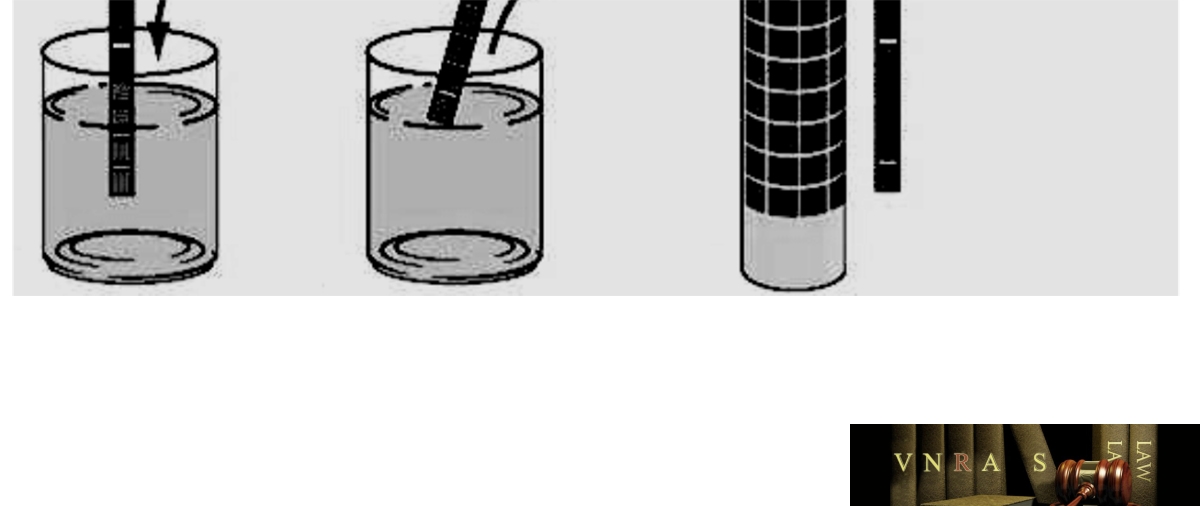
b) Phương pháp bán định lượng: Dùng que thử nước tiểu
Là phương pháp được áp dụng phổ biến nhất hiện nay, nhất là trong vấn đề sàng lọc bệnh thận trong cộng đồng. Các que thử này được tẩm Tétra bromephénol citraté (pH3), màu bị biến đổi từ vàng sang xanh khi có protein trong nước tiểu.
Phản ứng này phát hiện protein với lượng ít nhất là 150 – 200 mg/l.
Kết quả được biểu thị dưới dạng kết quả: âm tính, Protein niệu vết, 1+ đến 4+ tùy thuộc vào mức độ thay đổi màu sắc của que thử khi so sánh với bảng màu chuẩn.
Nhược điểm của phương pháp này là không phát hiện được các Globulin miễn dịch chuỗi nhẹ.
Que thử nước tiểu ngày nay không chỉ được dùng để xác định protein niệu mà còn kết hợp với việc phát hiện các thông số khác. Ví dụ que thử 10 thông số bao gồm các yếu tố sau:
| – Tỷ trọng.
– pH. – Glucose. – Bilirubin. – Urobilinogen. – Ceton. – Hồng cầu. – Bạch cầu. – Nitrit. – Protein. |
 |
| 10 thông số | Cách tiến hành thử nước tiểu bằng que thử |
c) Định lượng Protein niệu
– Cách lấy nước tiểu 24 giờ: sáng ngủ dậy, lúc 6h sáng người bệnh đi tiểu hết sau đó tính từ lúc này đến 6 h sáng hôm sau khi nào đi tiểu đều phải đi vào trong bô đó, sáng hôm sau ngủ dậy đi tiểu bãi cuối cùng lúc 6h và đong xem nước tiểu cả ngày là bao nhiêu, lấy 5 ml nước tiểu để làm xét nghiệm.
– Được tiến hành tại phòng xét nghiệm hóa sinh. Có nhiều phương pháp, có thể dùng ion đồng (Cu2+).
– Cần phải tính ra lượng Protein niệu / 24 giờ.
– Xác định được MicroProtein niệu (Protein niệu vi thể, từ 30 -300 mg/24giờ).
– Phát hiện được cả Globulin chuỗi nhẹ.
d) Điện di Protein niệu
– Thường áp dụng phương pháp dùng Cellulose Acetate.
– Xác định được bản chất của protein niệu, rất có ích trong việc xác định nguyên nhân của protein niệu.
– Dựa vào kết quả điện di, có thể chia Protein niệu thành các loại:
+ Protein niệu chọn lọc: Khi thành phần Albumin chiếm trên 80% tổng lượng protein niệu. Thường do bệnh cầu thận gây ra, hay gặp nhất là hội chứng thận hư có tổn thương tối thiểu trên sinh thiết thận.
+ Protein niệu không chọn lọc: Khi Albumin chiếm dưới 80% tổng lượng protein niệu, loại này thường bao gồm hầu hết các thành phần protein có trong huyết tương. Hầu như tất cả các bệnh lý thận, tiết niệu đều thuộc loại protein niệu không chọn lọc này.
+ Protein niệu gồm phần lớn là các protein bất thường: Gồm một đỉnh nhọn của Beta hoặc gamma globulin, do bài tiết bất thường một Globulin miễn dịch đơn dòng chuỗi nhẹ, thường là Protein Bence-Jones. Protein này có đặc tính lý học là động vón ở nhiệt độ khoảng 50oC và tan ra ở nhiệt độ 100oC. Đặc tính này có được khi trong thành phần Protein niệu có trên 50% là Protein Bence-Jones.
+ Các Protein ống thận: Chủ yếu là các Globulin trọng lượng phân tử thấp, các loại này dễ phát hiện khi điện di trên thạch Polyacrylamide. Với phương pháp này thì các protein với trọng lượng phân tử khác nhau có trong nước tiểu sẽ tách biệt nhau dễ dàng.
3. CÁC TÌNH HUỐNG LÂM SÀNG CỦA PROTEIN NIỆU
a) Protein niệu thoáng qua
Là loại protein niệu không xảy ra thường xuyên, liên quan đến một vài tình trạng sinh lý hoặc bệnh lý sau:
– Gắng sức.
– Sốt cao.
– Nhiễm trùng đường tiểu.
– Suy tim phải.
– PolyGlobulin.
– Protein niệu tư thế.
Trong đó, cần chú ý đến Protein niệu tư thế: Là protein niệu thường gặp ở người trẻ và biến mất sau tuổi dậy thì. Protein niệu tư thế không có ý nghĩa bệnh lý.
Để chẩn đoán Protein niệu tư thế, phải khẳng định protein này biến mất ở tư thế nằm, bằng cách lấy nước tiểu sau khi cho người bệnh nằm nghỉ 2 giờ.
b) Protein niệu thường xuyên
Protein có thường xuyên trong nước tiểu thường là biểu hiện của bệnh lý thận tiết niệu hoặc có bất thường về protein huyết tương. Có thể phân loại protein niệu theo 3 loại như sau:
– Protein niệu do tăng lưu lượng.
Xuất hiện một lượng lớn protein có trọng lượng phân tử thấp, các protein này được lọc qua các cầu thận bình thường. Khi lượng lọc ra vượt quá khả năng tái hấp thu của ống thận thì protein xuất hiện trong nước tiểu.
Trường hợp này được quan sát thấy trong các bệnh lý tiểu ra protein Bence- Jones (đa u tủy xương), tiểu ra Hemoglobin (do tan huyết) và tiểu ra Myoglobin (do hủy cơ vân).
– Protein niệu ống thận.
Thường không quá 2 gam/24 giờ. Gồm có 3 loại:
+ Protein có trọng lượng phân tử trung bình (Beta 2 Microglobulin, Amylase) được lọc qua cầu thận nhưng ống thận không tái hấp thu hết.
+ Protein niệu do ống thận bị tổn thương bài tiết ra (N-Acetylglucosamin, Lysozym).
+ Protein Tamm-Horsfall.
– Protein niệu cầu thận.
Trên điện di chủ yếu là Albumin, thường lượng nhiều, khi có trên 3,5 g/24 giờ/1,73 m2 da thì chẩn đoán hội chứng thận hư.
Một số điều cần chú ý khi phân tích Protein niệu:
– Protein niệu cao nhiều không do hội chứng thận hư mà có thể do tăng Globulin chuỗi nhẹ.
– Lượng Protein niệu thường giảm xuống khi chức năng thận giảm dưới 50 ml/phút.
– Một bệnh lý cầu thận có thể phối hợp với 1 bệnh lý thận kẽ hoặc bệnh mạch máu thận.
– MicroProtein niệu: Được định nghĩa khi lượng protein niệu từ 30 – 300 mg/24 giờ, đây là một dấu chỉ điểm rất tốt và tương đối sớm trên lâm sàng cho bệnh cầu thận đái tháo đường. MicroProtein niệu có thể biến mất sau khi điều trị các thuốc ức chế men chuyển.
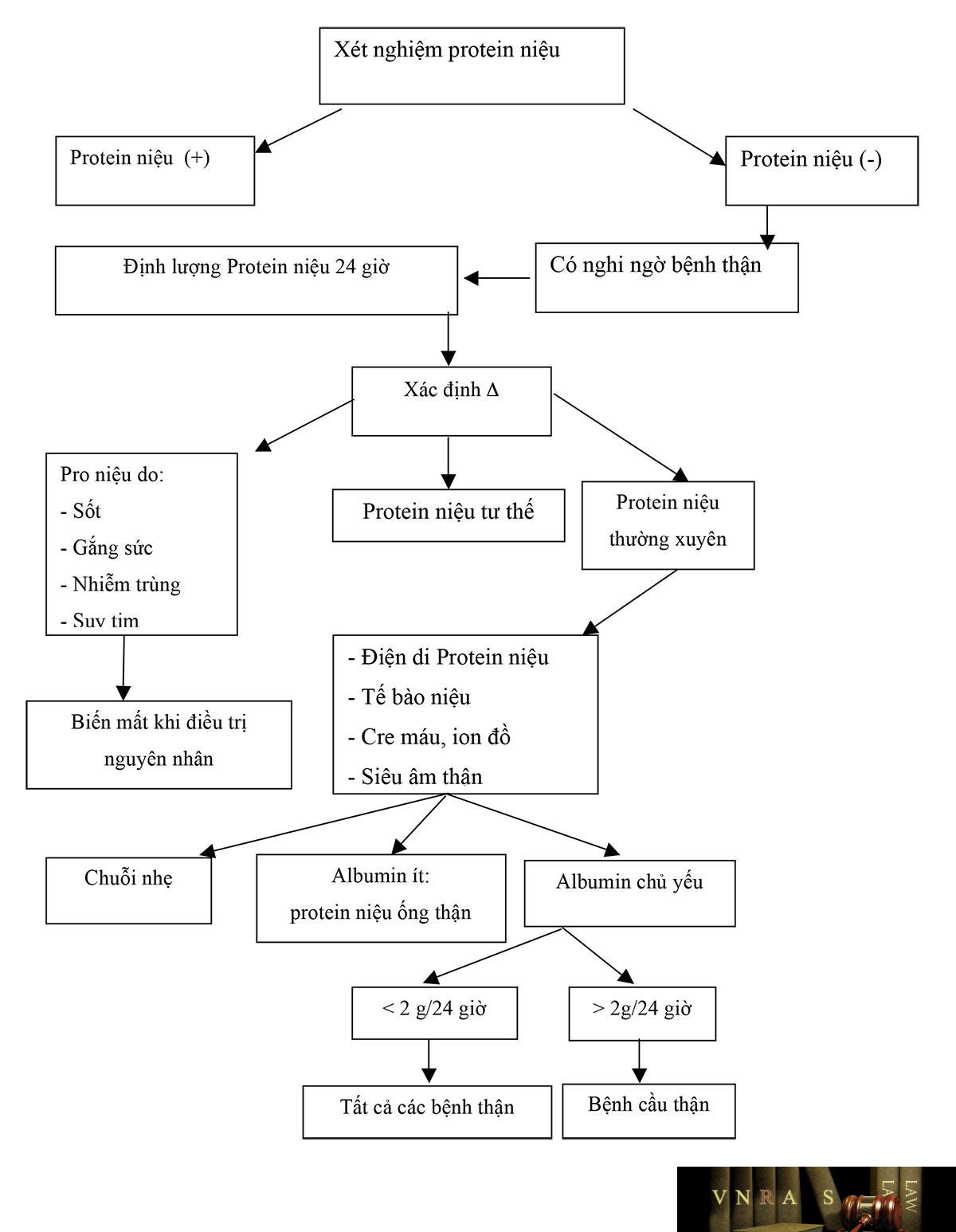
Sơ đồ chẩn đoán protein niệu
Tài liệu tham khảo
1. Nội khoa cơ sở, tập 2, 2003.Trường Đại học Y Hà nội, NXB Y học.
2. Giáo trình nội khoa cơ sở, tập 2, 2009. Bộ Môn Nội Trường Đại học Y Dược Huế, NXB Đại Học Huế.
3. Giáo trình Bệnh học nội khoa, 2008. Bộ Môn Nội – Trường Đại học Y Dược Huế, NXB Y học.
4. Néphrologie, 2005. Collège Universitaire Des Enseignants De Néphrologie, nouvelle édition, Ellipses.
5. The Washington Manual of Medical Therapeutics, 33rd Edition, 2010. Wolters Kluwer, Lippincott Williams & Wilkins.
PROTEIN NIỆU THAI KỲ
1. ĐỊNH NGHĨA
Ở phụ nữ có thai khi protein niệu vượt quá 0,3 g trong 24 giờ hoặc trên 1g/l được coi là protein niệu dương tính.
Ở phụ nữ có thai khi xuất hiện protein niệu trên mức bình thường cho phép là một biểu hiện lâm sàng cần được các bác sĩ sản khoa và thận học quan tâm và cần tìm kiếm nguyên nhân để có hướng theo dõi và điều trị cũng như tiên lượng. Ở những phụ nữ này cần xác định rõ có biểu hiện tiền sản giật hay không để có điều trị phù hợp. Thông thường sau 20 tuần tuổi thai nếu lượng protein vượt quá các mức cho phép được coi là bất thường và là dấu hiệu của tiền sản giật. Tuy nhiên, nếu trước khi mang thai hoặc trước 20 tuần tuổi thai, nếu protein niệu xuất hiện trong nước tiểu được coi là một dấu hiệu của bệnh thận trước đó.
2. NGUYÊN NHÂN
Nguyên nhân xuất hiện protein niệu trên mức bình thường trong thời kỳ có thai có thể gặp:
– Có bệnh thận trước đó chưa được phát hiện
– Có bệnh thận trước đó khi có thai nặng lên
– Có biểu hiện của tiền sản giật
3. CƠ CHẾ CHUNG XUẤT HIỆN PROTEIN NIỆU:
– Do sự thay đổi cấu trúc thành mao mạch làm tăng tính thấm thành mao mạch cầu thận và do giảm khả năng tái hấp thu ở tế bào ống thận làm xuất hiện protein trong nước tiểu, kể cả protein niệu có trọng lượng phân tử thấp và trọng lượng phân tử cao.
• Cơ chế xuất hiện protein niệu trong thai kỳ:
– Ở phụ nữ có thai có sự thay đổi chức năng của hệ thận tiết niệu cả về cấu trúc giải phẫu và và sinh lý. Kích thước thận thường to hơn bình thường và có biểu hiện giãn đài thận – bể thận và niệu quản do có sự chèn ép của thai nhi vào đường tiết niệu, mặt khác tình trạng tưới máu thận cũng tăng lên ở phụ nữ có thai làm mức lọc cầu thận cũng tăng lên một cách đáng kể khoảng 50%. Sự thay đổi này bắt đầu xuất hiện ở 4 tuần đầu của thai nhi, cao nhất ở tuần thứ 9-11 và duy trì cho đến cuối thai kỳ. Ở 4 tuần cuối của thai kỳ mức lọc cầu thận có xu hướng giảm dần. Đồng thời sự tăng huyết động đến thận làm thay đổi tính thấm thành mao mạch và khả năng tái hấp thu ở ống thận giảm dẫn đến sự xuất hiện protein niệu, bình thường < 0,3g/24h mặc dù không có bệnh lý thận.
– Bài tiết protein niệu tăng trong thai kỳ còn có thể do sự đè ép tĩnh mạch thận do tử cung lớn, đặc biệt khi thai phụ nằm ngửa. Như vậy khi thai phụ được xét nghiệm đạm niệu tư thế thì nên được đặt ở vị trí nằm nghiêng bên[82].
• Cơ chế bệnh sinh của tiền sản giật:
Do tế bào nội mô mạch máu bị tổn thương đồng thời với sự xuất hiện phản ứng viêm quá mức ở phụ nữ có thai dẫm đến:
– Tăng tính thấm thành mạch gây phù nề và xuất hiện protein niệu
– Co mạch gây tăng huyết áp, giảm tưới máu não (xuất hiện co giật), tổn thương gan
– Giảm lưu lượng máu qua nhau thái dẫn đến hạn chế sự tăng trưởng của thái nhỉ
– Rối loạn đông máu
4. CHẨN ĐOÁN
– Khi protein niệu xuất hiện sớm và > 0,3g/ 24h cần nghĩ đến sự có mặt của một số bệnh lý thận như: nhiễm trùng đường tiểu, bệnh thận mạn, nhưng quan trọng nhất để tìm kiếm tiền sản giật. [6]
Chẩn đoán tiền sản giật:
– Xuất hiện protein niệu ở thời kỳ muộn, sau 20 tuần thai trên mức bình thường cho phép
– Kèm theo tăng huyết áp,
– Có thể có phù ở các mức độ.
– Các triệu chứng bao gồm đau đầu, rối loạn thị giác, nôn, buồn ngủ, đau thượng vị, phù nề.
– Đây là một bệnh lý chỉ xuất hiện khi mang thai, có nguồn gốc nhau thai và chỉ chấm dứt tình trạng này khi giải phóng được thai nhi ra ngoài cơ thể mẹ.
Một số yếu tố nguy cơ xuất hiện tiền sản giật:
– Yếu tố nguy cơ bao gồm: gia đình , tiền sử trước đó, bà mẹ lớn tuổi, béo phì, bệnh mạch máu (tăng huyết áp mãn tính, bệnh thận mãn tính, bệnh hồng cầu hình liềm, bệnh tiểu đường và các bệnh tự miễn như hội chứng kháng phospholipid) và có thai với một nhau thai lớn (đôi và thai trứng). [7]
Chẩn đoán bệnh thận ở phụ nữ có thai
– Khai thác tiền sử bệnh thận trước đó.
– Sau khi phát hiện tiểu đạm và có bằng chứng của bệnh thận, tất cả bệnh nhân được khám lâm sàng, xác định chức năng thận (BUN, Creatinin, độ thanh lọc Creatinin, đạm niệu 24 giờ). Chức năng thận có thể giảm, có triệu chứng thiếu máu kèm theo ở các mức độ.
– Tùy thuộc vào các kết quả ban đầu này, người ta sẽ chọn lựa thêm các xét nghiệm chuyên biệt cần thiết. Xét nghiệm máu, xét nghiệm hình ảnh, chỉ sinh thiết thận khi thật cần thiết.
– Nói chung tiểu đạm lượng nhiều đặc biệt ở mức thận hư (>3,5g/24 giờ) cũng không loại trừ bệnh ống thận mô kẽ nhưng thông thường là do tổn thương cầu thận.
– Các xét nghiệm hình ảnh giúp phát hiện lao thận, tắt nghẽn đường tiểu, bệnh thận trào ngược, nang thận hoặc u thận.
– Điều quan trọng là tất cả bệnh nhân tiểu đạm do bệnh thận hoặc bệnh toàn thân có nguy cơ bị suy thận tiến triển cho dù lúc đầu chức năng thận còn bình thường. Vì vậy, cần phải lập lại các xét nghiệm đánh giá chức năng thận để có chẩn đoán và điều trị thích hợp.
– Nếu protein niệu > 2g/ ngày nghĩ đến bệnh cầu thận. Tìm kiếm các triệu chứng của bệnh cầu thận như: có hồng cầu niệu, phù tái phát, có bệnh hệ thống…
– Nếu protein niệu < 2g/ngày nghĩ đến bệnh ống kẽ thận. Cần tìm kiếm các triệu chứng liên quan như: có bạch cầu niêu, có triệu chứng nhiễm khuẩn đường tiết niệu, sỏi thận, sử dụng thuốc không kiểm soát…
5. ĐIỀU TRỊ
Tùy thuộc vào nguyên nhân xuất hiện protein niệu và mức độ xuất hiện cũng như tình trạng lâm sàng toàn thân mà có thái độ xử trí phù hợp.
– Nếu phụ nữ có thai có bệnh thận cần theo dõi đồng thời ở chuyên khoa thận và chuyên khoa sản để phối hợp điều trị bệnh thận và triệu chứng. Cần cân nhắc lợi ích điều trị cho mẹ và cho thai nhi một cách hợp lý. Việc sử dụng thuốc ở phụ nữ có thai cần hết sức thận trọng vì một số thuốc có thế qua hàng rào rau thai và ảnh hưởng đến thai.
– Nếu có biểu hiện của tiền sản giật cần theo dõi sát tình trạng lâm sàng toàn thân của mẹ và sự phát triển của thai nhi thường xuyên để có biện pháp xử trí kip thời nhằm an toàn cho tính mạng của mẹ và của con nêu có thể.
Tài liệu tham khảo
1.Cunningham Macdonal,2004. Renal and Urinary tract disorders, Williams Obstetrics 20th Edition, pp1251-1271
2. David B.Bernard ,David J.Salant, 1996. Clinical Approach to the pateint with Proteinuria and the Nephrotic syndrome .In The Principles and Practice of Nephrology 2th Edition, pp 110-121
3. Knneth Higby,MD,Cheryl R,Suiter, MD,John Y, Phelps, MD,Therasa Siler- Khodr, PhD,and Oded Langer, 1994. Normal values of urinary albumin and total protein excretion during prenancy, Am J Obstet Gynecol, 171, pp984-989
4. Phyllis August ,Adrian I.katz, Marshall D, 2000. Lindheimer The patient with kidney disease and Hypertension in Pregnancy .In Manual of Nephrology .5th Edition chapter 13 pp 203-2309
ĐÁI MÁU
1. ĐỊNH NGHĨA:
Đái máu là tình trạng nước tiểu có máu. Có đái máu đại thể và đái máu vi thể.
– Đái máu đại thể: khi nước tiểu đỏ sẫm màu, nhận biết được bằng mắt thường.
– Đái máu vi thể: mắt thường không nhận thấy, chỉ phát hiện được khi làm xét nghiệm tế bào học nước tiểu với số lượng hồng cầu > 10.000 hồng cầu/ml.
2. CHẨN ĐOÁN:
a) Chẩn đoán xác định
Có hồng cầu trong nước tiểu ở các mức độ khác nhau (vi thể hoặc đại thể). Có thể phát hiện nước tiểu có máu bằng mắt thường hoặc có thể phát hiện hồng cầu niệu vi thể bằng xét nghiệm tổng phân tích nước tiểu hoặc xét nghiệm tế bào niệu.
– Triệu chứng lâm sàng: tùy theo nguyên nhân gây đái máu sẽ có triệu chứng lâm sàng tương ứng
+ Đái máu đại thể hoặc vi thể,
+ Có thể kèm theo tiểu buốt, dắt, khó, ngắt quãng, bí tiểu,
+ Có thể có sốt có hoặc không rét run
+ Có thể cơn đau quặn thận, đau hố thắt lưng 1 hoặc 2 bên,
+ Có thể đau tức, nóng rát vùng bàng quang
– Cận lâm sàng:
+ Xét nghiệm nước tiểu để khẳng định đái máu: có hồng cầu niệu ở các mức độ
Để tìm nguyên nhân đái máu cần làm thêm một số thăm dò, tùy thuộc lâm sàng:
+ Tế bào niệu: tìm tế bào ác tính
+ Cấy Vi khuẩn
+ Siêu âm hệ thận – tiết niệu
+ Chụp bụng không chuẩn bị
+ Protein niệu 24h
+ Soi bàng quang, có thể tiến hành trong giai đoạn đang đái máu.
+ Chụp bể thận ngược dòng
+ Chụp cắt lớp vi tính
+ Chụp mạch
+ Định lượng các Ig
+ Sinh thiết thận: hiển vi quang học và miễn dịch huỳnh quang
b) Chẩn đoán phân biệt:
– Nước tiểu đỏ không do đái máu do:
+ Một số thức ăn
+ Một số thuốc (rifampicine, metronidazole…)
– Chảy máu niệu đạo: chảy máu từ niệu đạo không phụ thuộc vào các lần đi tiểu tiện.
– Nước tiểu lẫn máu: ở phụ nữ đang có kinh nguyệt
– Myoglobine niệu khi có tiêu cơ
– Hemoglobine niệu khi có tan máu trong lòng mạch, porphyline niệu (nước tiểu đỏ sẫm không có máu cục). Cần xét nghiệm tế bào học để khẳng định có đái máu.
c) Chẩn đoán nguyên nhân đái máu: tùy thuộc vào nguyên nhân
Các nguyên nhân có thể gây đái máu:
* Đái máu do nguyên nhân tiết niệu: trước hết phải cảnh giác với khối u thận tiết niệu gây ra đái máu.
– Đái máu do sỏi thận, tiết niệu:
– Đái máu do khối u:
+ Khối u nhu mô thận
+ U biểu mô tiết niệu
+ U bàng quang
+ U tuyến tiền liệt
– Đái máu do nhiễm trùng tiết niệu
– Đái máu do chấn thương:
+ Chấn thương vùng thắt lưng
+ Chấn thương vùng hạ vị
+ Chấn thương niệu đạo
* Đái máu do nguyên nhân thận:
– Viêm cầu thận:
+ Viêm cầu thận cấp:
+ Viêm cầu thận mạn:
– Viêm kẽ thận:
* Đái máu do các nguyên nhân hiếm gặp:
– Nghẽn, tắc mạch thận (động mạch và tĩnh mạch)
– Tắc tĩnh mạch chủ
– Sán máng
Các thăm dò chuyên sâu có thể thực hiện:
– Nội soi bàng quang: tiến hành khi đang có đái máu
– Chụp bể thận ngược dòng, chụp cắt lớp vi tính, chụp mạch: khi có đái máu từ 1 bên niệu quản cần tiến hành để tìm kiếm khối u thận kích thước nhỏ hoặc dị dạng mạch máu.
– Sinh thiết thận: khi có đái máu từ 2 bên niệu quản ở bệnh nhân trẻ tuổi nghĩ nhiều đến bệnh thận IgA.
3. ĐIỀU TRỊ:
– Điều trị triệu chứng:
Nội khoa:
+ Thuốc cầm máu: Transamin đường uống hoặc truyền tĩnh mạch
+ Truyền máu nếu mất nhiều máu
+ Kháng sinh nếu có dấu hiệu nhiễm trùng: Sulfamid, Quinolone, có thể phối hợp với nhóm khác tùy theo diễn biến lâm sàng và kết quả cấy vi khuẩn máu và nước tiểu.
+ Tùy thuộc vào nguyên nhân gây đái máu cần phối hợp thêm thuốc khác
Ngoại khoa:
Trong một số trường hợp nếu có tắc nghẽn nhiều đường tiết niệu do máu cục tạo thành, cần can thiệp ngoại khoa tạm thời dẫn lưu, lấy máu cục tai bang quang, trước khi giải quyết nguyên nhân.
– Điều trị nguyên nhân: can thiệp ngoại khoa tùy vào nguyên nhân đái máu và tình trạng lâm sàng cụ thể của bệnh nhân.
4. PHÒNG BỆNH: nên khám và kiểm tra định kỳ để phát hiện bệnh sớm và điều trị kịp thời
Tài liệu tham khảo
1. Hematuria Causes Original Date of Publication: 15 Jun 1998. Reviewed by: Stacy J. Childs, M.D., Stanley J. Swierzewski, III, M.D. Last Reviewed: 10 Jul 2008
2. Hebert, DN.; Nadasdy, T.; Nadasdy, G.; Agarwal, G.; Mauer, M.; Agarwal, AK.; Khabiri, H.; Nagaraja, HN. et al. (Mar 2006). “Proposed pathogenesis of idiopathic loin pain-hematuria syndrome.”. Am J Kidney Dis 47 (3): 419-27.
3. Russo, D.; Minutolo, R.; Iaccarino, V.; Andreucci, M.; Capuano, A.; Savino, FA. (Sep 1998). “Gross hematuria of uncommon origin: the nutcracker syndrome.”. Am J Kidney Dis 32 (3): E3
HỘI CHỨNG THẬN HƯ NGUYÊN PHÁT Ở NGƯỜI TRƯỞNG THÀNH
1. Định nghĩa:
Hội chứng thận hư là một hội chứng lâm sàng và sinh hóa, xuất hiện khi có tổn thương ở cầu thận do nhiều tình trạng bệnh lý khác nhau gây nên, đặc trưng bởi phù, protein niệu cao, protein máu giảm, rối loạn lipid máu và có thể đái ra mỡ.
2. Chẩn đoán
2.1. Tiêu chuẩn chẩn đoán hội chứng thận hư:
– 1. Phù
– 2. Protein niệu > 3,5 g/24 giờ
– 3. Protein máu giảm dưới 60 g/lít, albumin máu giảm dưới 30 g/lít
– 4. Tăng cholesterol máu ≥ 6,5 mmol/lít
– 5. Có hạt mỡ lưỡng chiết, trụ mỡ trong nước tiểu
Trong đó tiêu chuẩn 2 và 3 là bắt buộc, các tiêu chuẩn khác có thể không đầy đủ.
2.2. Chẩn đoán thể lâm sàng
– Hội chứng thận hư thể đơn thuần: có đầy đủ các tiêu chuẩn chẩn đoán hội chứng thận hư, không có tăng huyết áp, đái máu hoặc suy thận kèm theo.
– Hội chứng thận hư thể không đơn thuần: ngoài các tiêu chuẩn chẩn đoán hội chứng thận hư, còn phối hợp với tăng huyết áp, đái máu đại thể hoặc vi thể, hoặc suy thận kèm theo.
2.3. Chẩn đoán nguyên nhân
2.3.1. Nguyên nhân gây hội chứng thận hư nguyên phát:
– Bệnh cầu thận thay đổi tối thiểu
– Viêm cầu thận màng, là nguyên nhân gây hội chứng thận hư thường gặp ở người trưởng thành tại các nước đang phát triển
– Xơ hóa cầu thận ổ- cục bộ
– Viêm cầu thận màng tăng sinh
– Viêm cầu thận tăng sinh gian mạch
– Viêm cầu thận tăng sinh ngoại mạch
2.3.2. Nguyên nhân gây hội chứng thận hư thứ phát:
Bệnh lý di truyền, bệnh lý chuyển hóa bệnh tự miễn, bệnh ác tính, bệnh nhiễm trùng, nhiễm ký sinh trùng, thuốc, độc chất…
2.4. Chẩn đoán mô bệnh học
– Bệnh cầu thận thay đổi tối thiểu
– Viêm cầu thận màng
– Viêm cầu thận mảnh, ổ
– Viêm cầu thận màng tăng sinh
– Viêm cầu thận tăng sinh gian mạch
– Viêm cầu thận tăng sinh ngoại mạch
2.5. Chẩn đoán biến chứng
– Nhiễm khuẩn: các nhiễm khuẩn cấp hoặc mạn tính, đặc biệt hay gặp là:
+ Viêm mô tế bào
+ Viêm phúc mạc
– Tắc mạch (huyết khối)
+ Tắc tĩnh mạch thận cấp tính hoặc mạn tính
+ Tắc tĩnh mạch và động mạch ngoại vi: tắc tĩnh động mạch chậu, tĩnh mạch lách,
+ Tắc mạch phổi: Hiếm gặp
– Rối loạn điện giải
– Suy thận cấp
– Thiếu dinh dưỡng
– Biến chứng do dùng thuốc
Biến chứng do sử dụng corticoid kéo dài, biến chứng do dùng các thuốc ức chế miễn dịch khác hoặc biến chứng do dùng lợi tiểu
– Suy thận mạn tính
3. Điều trị hội chứng thận hư
3.1. Điều trị hội chứng thận hư nguyên phát
3.1.1. Điều trị triệu chứng: giảm phù
– Chế độ ăn:
+ Đảm bảo khẩu phần đủ protein ở bệnh nhân (0,8-1g/kg/ngày + lượng protein mất qua nước tiểu).
+ Hạn chế muối và nước khi có phù nhiều .
– Bổ sung các dung dịch làm tăng áp lực keo: nếu bệnh nhân có phù nhiều (áp dụng khi albumin máu dưới 25 g/l), tốt nhất là dùng Albumin 20% hoặc 25% lọ 50 ml,100ml. Nếu albumin < 20g/l có thể dùng Albumin 20% loại 100 ml.
– Lợi tiểu: dùng lợi tiểu khi đã có bù protein và bệnh nhân không còn nguy cơ giảm thể tích tuần hoàn. Ưu tiên dùng lợi tiểu loại kháng aldosteron như spironolactone (verospirone, aldactone) hoặc phối hợp với furosemide. Liều dùng verospirone bắt đầu từ 25 mg/ngày hoặc furosemid bắt đầu từ 20 mg/ngày, tùy theo đáp ứng của bệnh nhân để điều chỉnh liều lợi tiểu. Cần phải theo dõi số lượng nước tiểu, cân nặng hàng ngày và xét nghiệm điện giải đồ máu.
3.1.2. Điều trị đặc hiệu:
Cần phải điều trị theo thể tổn thương mô bệnh học, tuy nhiên trong điều kiện không thể sinh thiết thận có thể áp dụng theo phác đồ dưới đây:
– Corticoid (prednisolone, prednisone, methyprednisolone, trong đó 4mg methyprednisolone tương đương với 5 mg prednisolone)
+ Liều tấn công: prednisolone 5mg dùng liều 1-2 mg /kg /ngày kéo dài 1-2 tháng, uống cả liều vào 1 lần trước 8h sáng sau ăn no. (Liều tấn công corticoid không được vượt quá 80 mg prednisolone/ ngày).
+ Liều củng cố (bắt đầu khi protein niệu 24h âm tính): prednisolone 5mg dùng liều 0,5 mg/kg/ngày, kéo dài 4-6 tháng
+ Liều duy trì: prednisolone 5-10mg/ngày dùng cách ngày, kéo dài hàng năm.
+ Cần theo dõi các biến chứng như: Nhiễm khuẩn, tăng huyết áp, đái tháo đường, xuất huyết tiêu hóa, rối loạn tâm thần, hội chứng giả cushing vv…
– Thuốc ức chế miễn dịch khác
Trong trường hợp đáp ứng kém với corticoid, không đáp ứng, hay tái phát hoặc có suy thận kèm theo nên chuyển bệnh nhân lên tuyến trên để phối hợp điều trị với một trong số các thuốc giảm miễn dịch dưới đây. Nếu bệnh nhân không đáp ứng, hoặc có tác dụng phụ của thuốc không dự phòng được, nên xét chỉ định sinh thiết thận để hướng dẫn điều trị theo tổn thương bệnh học.
+ Cyclophosphamide (50 mg): dùng liều 2-2,5mg/Kg/ngày,tấn công 4-8 tuần. Khi protein niệu âm tính thì duy trì 50mg/ngày trong thời gian 4-8 tuần. Cần theo dõi và duy trì số lượng bạch cầu không dưới 4,5 giga/lit.
+ Chlorambucil 2mg: dùng liều 0,15-0,2/mg/kg/ngày, kéo dài 4-8 tuần, sau đó duy trì liều 0,1mg/kg/ngày.
+ Azathioprine (50 mg): dùng liều 1-2mg/kg/ngày. Cần theo dõi số lượng bạch cầu và tiểu cầu.
+ Cyclosporine A (25 mg, 50mg, 100mg): dùng liều 3-5mg/kg/ngày, uống chia hai lần, trong thời gian 6-12 tháng hoặc hơn nữa tùy từng trường hợp.
+ Mycophenolate mofetil (250 mg, 500mg) hoặc Mycophenolate acid (180 mg, 360mg,720 mg): dùng liều 1-2 g /ngày (uống chia 2 lần mỗi ngày) trong 6 đến 12 tháng.
– Các thuốc ức chế miễn dịch trên được dùng khi bệnh nhân không có đáp ứng với corticoid hoặc có nhiều tác dụng phụ, cần phải giảm liều hoặc ngừng corticoid.
3.1.3. Điều trị biến chứng
– Điều trị nhiễm trùng: Dựa vào kháng sinh đồ để cho kháng sinh phù hợp. Nếu cần thiết cần giảm liều hoặc ngừng corticoid và ức chế miễn dịch nếu nhiễm trùng nặng, khó kiểm soát.
– Điều trị dự phòng một số tác dụng phụ như loét dạ dày tá tràng , loãng xương…
– Điều trị tăng huyết áp, rối loạn mỡ máu, dự phòng tắc mạch đặc biệt khi albumin máu giảm nặng
– Điều trị suy thận cấp: cân bằng nước, điện giải, đảm bảo bù đủ albumin.
3.2. Điều trị hội chứng thận hư thứ phát:
Theo nguyên nhân gây bệnh
4. Phòng bệnh
– Bệnh có tính chất mạn tính, có thể tái phát
– Cần theo dõi và điều trị lâu dài
– Không sử dụng các loại thuốc và các chất không rõ nguồn gốc, gây độc cho thận.
TÀI LIỆU THAM KHẢO
1) Nguyễn Ngọc Sáng, Hà Phan Hải An: Hội chứng thận hư tiên phát ở người lớn và trẻ em. Nhà xuất bản Y học, 2007, tr 9-62.
2) Jha V., Ganguli A., and all: A Randomized, Controlled Trial of Steroids and Cyclophosphamide in Adults with Nephrotic Syndrome Caused by Idiopathic MembranousNephropathy. J. Am. Soc. Nephrol., 2007 Jun,18(6): 1899 – 1904.
3) L. Lee Hamm and Vecihi Batuman: Edema in the Nephrotic Syndrome: New Aspect of an Old Enigma. J. Am. Soc. Nephrol., Dec 2003; 14: 3288 – 3289.
4) Néphropathies glomérulaires primitives: Néphropathies et troubles hydro-électrolitique. Maison 1998, pages 13-27.
BỆNH THẬN IgA
1. ĐẠI CƯƠNG
Bệnh thận IgA (IgA nephropathy) là một trong những tổn thương cầu thận hay gặp nhất trong viêm cầu thận. Bệnh thận IgA thường gặp hơn trong các quần thể da trắng và người châu Á [1]. Tỷ lệ mắc mới bệnh thận IgA ước tính tại Pháp là khoảng 26 và 30 trường hợp mới phát hiện bệnh trên một triệu dân, ở trẻ em Nhật Bản 45 trường hợp trên một triệu dân, và ở Hoa Kỳ 12 trường hợp trên một triệu dân [2, 3].
2. NGUYÊN NHÂN
Nhiều nghiên cứu về cơ chế bệnh sinh của bệnh thận IgA đã đưa ra những yếu tố đã được xác định có thể góp phần vào sự hình thành bệnh thận IgA và những yếu tố có ảnh hưởng đến tiến triển nặng mà đặc biệt là gây suy giảm chức năng thận ở bệnh thận IgA. Ví dụ như các yếu tố tham gia vào sự tổng hợp và lưu hành trong chu trình lưu thông của polymeric IgA1 và gây tình trạng lắng đọng polymeric IgA1 tại gian mạch cầu thận.
Đáp ứng của sự đáp ứng viêm tại gian mạch cầu thận hình thành nhằm giải quyết hiện tượng viêm, tuy nhiên sự đáp ứng viêm quá mức có thể tiến triển thành xơ cứng cầu thận gây suy giảm chức năng thận. Một yếu tố quan trọng khác là xu hướng của toàn bộ thận phản ứng để đối phó với tổn thương và do đó dẫn đến suy giảm chức năng thận mà triệu chứng bao gồm tăng huyết áp, protein niệu, teo ống thận và xơ hóa kẽ.
Điều quan trọng cần nhớ là thực sự toàn bộ bệnh lý được gọi là bệnh thận IgA biểu hiện tổn thương tại thận nhưng được xác định là do kết hợp nhiều cơ chế trong phản ứng hệ thống của toàn bộ cơ thể. Cơ chế sinh mô bệnh học dẫn đến sự lắng đọng của phức hợp IgA trong gian mạch cầu thận thực sự là chưa biết. Nồng độ IgA1 và IgA trong dạng phức hợp lưu hành được tìm thấy trong huyết thanh của hầu hết các bệnh nhân bệnh thận IgA.
Sự giảm glycosyl hóa tại khu vực bản lề không chỉ tạo điều kiện hình thành các cao phân tử IgA1, mà hệ miễn dịch còn nhận biết các dạng IgA1 này như neoantigen và tạo ra tự kháng thể IgG chống lại các phân tử IgA1 thiếu glycosyl hóa (Gal-deficient IgA1). Gal-deficient IgA1 hoặc kháng thể IgG kháng IgA1, gắn với CD89 (FcR) được bài tiết ở bề mặt tế bào gian mạch dẫn đến sự tổng hợp các yếu tố tiền viêm cytokine làm thu hút các tế bào lưu hành trong máu đến và làm quá trình viêm phát triển quá mức [4].
3. CHẨN ĐOÁN
a) Triệu chứng lâm sàng và cận lâm sàng
Bệnh thận IgA có thể bắt đầu từ việc giãn rộng gian mạch cầu thận và lâm sàng là biểu hiện từ đái máu đơn thuần đại thể hoặc vi thể cho đến các triệu chứng đầy đủ của một viêm cầu thận tiến triển nhanh với sự tăng sinh nội mạch và hình thành tổn thương hình liềm [5].
Bệnh nhân có bệnh thận IgA thường xuất hiện ở độ tuổi tương đối trẻ, tuy nhiên cũng có thể ở bất cứ lứa tuổi. Bệnh nhân thông thường mang triệu chứng trong một khoảng thời gian dài trước khi chẩn đoán xác định được thực hiện vì các triệu chứng lâm sàng thường không rầm rộ nên bệnh nhân không tự nhận biết được.
Đái máu đại thể tái phát, thường đi kèm với triệu chứng đau thắt lưng, xảy ra trong vòng 48 giờ sau một viêm nhiễm đường hô hấp trên, hoặc nhiễm trùng khác, là một triệu chứng kinh điển của bệnh thận IgA và được thấy xuất hiện trong hơn 40% bệnh nhân. Đái máu vi thể tồn tại liên tục xuất hiện trong phần lớn các bệnh nhân, thường đi kèm với protein niệu và đặc biệt có số lượng tế bào bạch cầu và hồng cầu khi ly tâm nước tiểu và quan sát dưới kính hiển vi.
Trong thời điểm chẩn đoán, triệu chứng albumin niệu với ở trên 1gam/ ngày xuất hiện ở gần 50% bệnh nhân và số bệnh nhân có trên 3 gam/ngày xuất hiện ở xấp xỉ 10% tổng số bệnh nhân.
Tăng creatinine huyết thanh gặp ở 1/3 bệnh nhân và biểu hiện nặng của suy thận xuất hiện ở khoảng 5% bệnh nhân.
Tăng huyết áp gặp ở khoảng 25% bệnh nhân tại thời điểm chẩn đoán và khoảng 25% được chẩn đoán trong giai đoạn theo dõi quá trình phát triển của bệnh thận IgA.
b) Chẩn đoán xác định bệnh thận IgA
Tăng tỷ lệ IgA/C3 trong huyết thanh, phối hợp với trên 5 tế bào hồng cầu trong một vi trường trong phân tích cặn nước tiểu, protein niệu trên 0,3 gam/ngày và nồng độ IgA huyết thanh 315 mg/dl có thể chẩn đoán đúng cho rất nhiều bệnh nhân bị bệnh thận IgA, tuy nhiên, sinh thiết thận vẫn là tiêu chuẩn vàng cho chẩn đoán xác định bệnh thận IgA.
Sinh thiết thận nên được đánh giá dưới kính hiển vi quang học và miễn dịch huỳnh quang cho việc xác định chính xác có lắng đọng IgA tại gian mạch cầu thận. Biểu hiện trên kính hiển vi quang học có thể từ tăng sinh gian mạch đến những phần tổn thương cục bộ hoặc tổn thương của viêm cầu thận hình liềm. Những phát hiện của hóa mô miễn dịch bao gồm lắng đọng tại gian mạch cầu thận polymeric IgA1, thường xuyên phối hợp với C3, và IgG hoặc IgM, hoặc cả hai và C5b-9.
4. ĐIỀU TRỊ
Hai tiêu chí cơ bản nhất của điều trị bệnh thận IgA là khống chế huyết áp, và giảm albumin niệu xuống dưới 0,5gam/24h. Tốt nhất là với thuốc ức chế men chuyển (ACE) hoặc thuốc ức chế thụ thể angiotensin II (ARB).
Nếu hai mục tiêu được đáp ứng mà không có tác dụng phụ hoặc không đáng kể và bệnh nhân vẫn phù hợp trong thời gian dài, nhiều bệnh nhân có thể tránh được bệnh thận mạn tính tiến triển nặng.
Nếu bệnh nhân không thể đạt được các mục tiêu trên cho dù đã có những điều trị tích cực thì nên điều trị kết hợp với corticosteroids, chỉ định corticosteroids khi protein niệu/24h > 1 gam. Có thể cân nhắc sử dụng thuốc độc tế bào kết hợp với corticosteroids khi có biểu hiển của tình trạng suy thận tiến triển nhanh và tổn thương hình liềm trong kết quả mô bệnh học của sinh thiết thận.
Những nghiên cứu quan sát thấy một tỷ lệ cao hơn của sự khống chế triệu chứng lâm sàng ở bệnh thận IgA sau khi phẫu thuật cắt amiđan, so với điều trị steroid đơn độc.
Axit béo Omega-3 cũng có thể được xem xét như là một biện pháp điều trị thêm vào, đặc biệt đối với bệnh nhân có protein niệu nặng và mức lọc cầu thận giảm.
Tài liệu tham khảo
1. Schena FP. A retrospective analysis of the natural history of primary IgA nephropathy worldwide. Am J Med. Aug 1990;89(2):209-215.
2. Utsunomiya Y, Koda T, Kado T, et al. Incidence of pediatric IgA nephropathy. Pediatr Nephrol. Jun 2003;18(6):511-515.
3. Wyatt RJ, Julian BA, Baehler RW, et al. Epidemiology of IgA nephropathy in central and eastern Kentucky for the period 1975 through 1994. Central Kentucky Region of the Southeastern United States IgA Nephropathy DATABANK Project. J Am Soc Nephrol. May 1998;9(5):853-858.
4. Alamartine E, Sabatier JC, Guerin C, Berliet JM, Berthoux F. Prognostic factors in mesangial IgA glomerulonephritis: an extensive study with univariate and multivariate analyses. Am J Kidney Dis. Jul 1991;18(1):12-19.
5. Haas M. Histologic subclassification of IgA nephropathy: a clinicopathologic study of 244 ases. Am J Kidney Dis. Jun 1997;29(6):829-842.
VIÊM THẬN LUPUS
I. ĐỊNH NGHĨA.
Lupus ban đỏ hệ thống là một bệnh tự miễn điển hình. Biểu hiện tổn thương thận rất thường gặp ở những bệnh nhân Lupus ban đỏ hệ thống mà tổn thương chủ yếu là ở cầu thận. Viêm thận lupus đã được nhiều tác giả coi là một mẫu hình bệnh lý kiểu “phức hợp miễn dịch” đó là đáp ứng quá mẫn típ III. Theo nhiều tác giả thì tỷ lệ biểu hiện then ở bệnh nhõn Lupus giao động từ 60-75%.
1. Chẩn đoán xác định
Chẩn đoán xác định thận lupus phải khẳng định được 2 yếu tố sau:
1. Đủ tiêu chuẩn chẩn đoán Lupus ban đỏ hệ thống theo tiêu chuẩn quốc tế. (Xem bài Lupus)
2. Có tổn thương thận được biểu hiện bằng có protein niệu thường xuyên và /hoặc hồng cầu, trụ hạt mà chủ yếu là trụ hồng cầu.
Qua kinh nghiệm lâm sàng và sinh thiết thận, khoa thận bệnh viện Bạch Mai đã đưa ra những kinh nghiệm chẩn đoán viêm thận lupus như sau:
1. Có biểu hiện viêm không đặc hiệu:
– Sốt kéo dài không rõ nguyên nhân nhiễm khuẩn, đặc biệt là lao.
– Tốc độ máu lắng tăng, Gamaglobulin máu tăng
2. Có 4/11 tiêu chuẩn chẩn đoán Lupus ban đỏ hệ thống trong đó có 1 tiêu chuẩn về miễn dịch học [hoặc kháng thể kháng nhân (+), hoặc kháng thể kháng DNA (+), hoặc tế bào LE (+)].
3. Biểu hiện thận: phải có protein niệu dương tính 1(+) trở lên ( >0,2 g/24 h), có thể có kèm theo hồng cầu niệu, trụ niệu.
II. ĐIỀU TRỊ
1. Nguyên tắc
– Chưa có điều trị đặc hiệu. Các thuốc sử dụng chủ yếu là ức chế quá trình viêm hoặc can thiệp vào chức năng miễn dịch.
– Điều trị các đợt kịch phát xen kẽ các đợt bệnh ổn định.
– Cân nhắc giữa tác dụng chính và tác dụng phụ của thuốc.
– Nếu có điều kiện, điều trị dựa trên phân loại mô bệnh học là tốt nhất
– Điều trị các biểu hiện ngoài thận của bệnh Lupus
2. Mục tiêu của điều trị là:
1- Nhanh chóng phục hồi chức năng thận
2- Tránh gây tổn thương thêm cho thận
3- Hạn chế tiến triển đến suy thận mạn tính
4- Đạt được 3 mục tiêu trên bằng các liệu pháp miễn dịch với ít độc tính nhất
3. Điều trị cụ thể viêm thận lupus
Phụ thuộc rất nhiều với thể tổn thương mô bệnh học.
A. Dựa trên tổn thương mô bệnh học thận thì điều trị có thể tóm tắt như sau:
3.1. Viêm thận lupus class I: chỉ điều trị những biểu hiện ngoài thận.
3.2. Viêm thận lupus class II: điều trị những biểu hiện ngoài thận. Khi có tình trạng lâm sàng nặng nên cần sinh thiết lại thận. Nếu có thay đổi về thể tổn thương mô bệnh học thận sẽ điều trị như thể tổn thương (class) mới.
3.3. Viêm thận lupus class III: tổn thương nhẹ chủ yếu điều trị bằng liệu pháp corticoids. Nếu tổn thương nặng điều trị như viêm cầu thận lupus type IV.
3.4. Viêm thận lupus class IV-V: là thể nặng nhất, cần điều trị tích cực. Có nhiều thuốc ức chế miễn dịch có thể lựa chọn tùy thuộc vào bệnh nhân có chống chỉ định với nhóm nào, thầy thuốc có thể lựa chọn một trong những phác đồ sau đây:
a) Prednisolon ( hoặc cùng nhóm tính liều tương đương) 1mg/kg/24h hoặc 2mg/kg/cách ngày trong 3 – 6 tháng, không quá 80mg/ngày và không quá 120mg cách ngày.
b) Liều uống cyclophosphamid (Endoxan) hoặc azathioprin (Imurel) tấn công (3mg/kg/24h) trong 2 – 3 tháng, liều cyclosporine A (3-4mg/kg/24h) 3 tháng hoặc hơn.
c) Nếu bệnh nhân không đáp ứng, đáp ứng kém hoặc có biểu hiện lâm sàng nặng ngay từ đầu có thể dùng những liều bolus (liều mạnh) methylprednison hoặc cyclophosphamid theo liệu trình như sau:.
1) Methylprednison liều pulse: Dùng 1000mg pha trong dung dich glucose 5% truyền tĩnh mạch chậm trên một giờ, 3 ngày liên tục, sau đó tiếp tục liều uống 0,4 – 0,5mg/kg/24h, có thể nhắc lại mỗi tháng 1 liều đơn (1 ngày) trong 6 tháng. Chú ý nguy cơ tăng huyết áp và tình trạng nhiễm trùng
2) Cyclophosphamid: Dùng (0,7g – 1g/m2 diện tích cơ thể) pha truyền tĩnh mạch 1 tháng 1 lần trong 6 tháng, sau đó 3 tháng 1 lần có thể đến 9 lần tùy theo đáp ứng của bệnh nhân. Chú ý tác dụng phụ giảm bạch cầu và tình trạng nhiễm trùng.
B. Trong điều kiện ở Việt Nam chưa sinh thiết thận được cho tất cả các bệnh nhân (BN) viêm thận lupus, việc điều trị có thể xem xét như sau:
a) BN không có triệu chứng lâm sàng, chỉ có rối loạn nhẹ về nước tiểu: protein niệu dưới 1g/24g, không có hồng cầu niệu hoặc hồng cầu niệu ít: điều trị chủ yếu là điều trị các biểu hiện ngoài thận.
b) Bệnh nhõn có hội chứng cầu thận cấp: Có thể chọn 1 trong các phác đồ sau:
1. Prednison uống 1 – 1,5 mg/kg/24g hàng ngày hoặc cách nhật trung bình khoảng 1,5 – 2 tháng, cũng có thể kéo dài 3 tháng hoặc hơn, không vượt quá 6 tháng. Liều hàng ngày không vượt quá 80mg. Liều cách ngày tấn công không nên vượt quá 120mg. Sau đó giảm liều dần xuống liều củng cố bằng nửa liều tấn công và duy trì có thể hàng năm với liều thấp ≤ 20mg/24h.
2. Cyclophosphamid 2,5 – 3 mg/kg/24h không vượt quá 4mg/kg/24h. Tấn công trong 1,5 – 2 tháng, sau đó giảm liều củng cố bằng nửa liều tấn công và duy trì liều thấp ≈ 50mg/24h, thời gian điều trị không nên quá 1 năm.
– Tác dụng phụ: giảm bạch cầu, suy buồng trứng, vô tinh trùng, viêm bàng quang chảy máu, ung thư bàng quang
3. Azathioprine (imurel) uống liều 2,5 – 3mg/kg/24h từ 1,5 – 2 tháng, sau đó giảm liều củng cố bằng nửa liều tấn công và duy trì liều thấp 50mg/24h trong 1 năm hoặc hơn nếu bệnh nhân dung nạp được thuốc.
-Tác dụng phụ: gây độc cho tủy xương làm giảm bạch cầu, giảm tiểu cầu, thiếu máu, tăng nguy cơ gây ung thư.
4. Cyclosporine A: 3 – 4mg/kg/24h từ 1,5 – 3 tháng hoặc hơn, phối hợp với liều thấp corticoids (≈20mg/24h) nếu điều trị corticoids và các thuốc ức chế miễn dịch khác ít tác dụng. Sau đó giảm xuống liều duy trì khoảng 2mg/kg/24h có thể hàng năm. Tuy nhiên bệnh cũng hay tái phát sau khi giảm liều hoặc dừng thuốc.
– Tác dụng phụ: suy gan, suy thận, tăng nguy cơ ung thư.
5. Mycophenolate Mofetil (CELLCEPT): Được dùng rộng rãi trong chống đào thải tạng ghép. Gần đây MMF đưa vào điều trị viêm thận lupus do: làm giảm protein niệu và hồng cầu niệu, đưa nồng độ bổ thể về mức bình thường, tăng nồng độ albumin máu, tỷ lệ tái phát thấp và ít tác dụng phụ. Liều dùng ban đầu từ 2-3g/24h có thể dùng kéo dài tới 12 tháng.
6. Có thể phối hợp corticoids với các thuốc miễn dịch khác với liều trung bình thường bằng nửa liều tấn công.
7. Cân nhắc điều trị bằng truyền liều cao methylprednison hoặc Cyclophosphamid (xem phần trên) ngay cả khi không cú mô bệnh học trong trường hợp không đáp ứng với điều trị bằng 1 trong các biện pháp nêu trên.
8. Các phương pháp mới điều trị viêm thận Lupus đang được đưa vào thử nghiệm lâm sàng
a) Kháng thể đơn dòng (Rituximax): tiêu diệt tế bào Lympho B (được cho là có vai trò trung tâm)
b) Lọc huyết tương (plasmapheresis-plasma exchange):
– Thay 3-4 lit huyết tương mỗi tuần bằng huyết tương hay sản phẩm thay thế. Được chỉ định đặc biệt cho những bệnh nhân có bằng chứng tăng rõ rệt phức hợp miễn dịch lưu hành. Đồng thời vẫn phải kết hợp điều trị tấn công bằng corticoids và các thuốc ức chế miễn dịch
3. Điều trị các biểu hiện ngoài thận và biến chứng của bệnh lupus ban đỏ hệ thống.
Những biểu hiện ngoài thận nặng hơn bao gồm viêm khớp không đáp ứng với thuốc kháng viêm giảm đau không steroids, viêm tràn dịch màng tim, màng phổi; viêm cơ tim, biểu hiện não, viêm phổi do Lupus cần sử dụng liệu pháp corticoid và điều trị hỗ trợ theo chuyên khoa, tùy theo tình trạng của bệnh nhân.
III. PHÒNG BỆNH
Bệnh nhân cần được đến khám chuyên khoa thận khi đã có biểu hiện viêm thận do lupus, cần được bác sĩ chuyên khoa tư vấn, đưa ra lời khuyên về chế độ điều trị, chế độ sinh hoạt và theo dõi định kỳ.
TÀI LIỆU THAM KHẢO
1. Waldman M, Appel GB: Update on the treatment of lupus nephritis. Kidney Int 70: 1403 -1412, 2006
2. Gerald B. Appel*, Gabriel Contreras…Mycophenolate Mofetil versus Cyclophosphamide for Induction Treatment of Lupus Nephritis. J Am Soc Nephrol 20: 1103-1112, 2009
3. Y. Lee, J. H. Woo, S. Choi, J. Ji, and G. Song:Induction and maintenance therapy for lupus nephritis: a systematic review and meta-analysis Lupus, May 1, 2010; 19(6): 703 – 710
4. Fresdéric A. Houssiau: Management of Lupus Nephritis: An UpdateAm Soc Nephrol 15: 2694-2704, 2004
BỆNH THẬN ĐÁI THÁO ĐƯỜNG
1- ĐAI CƯƠNG:
Bệnh thận đái tháo đường là một trong các biến chứng mạn tính gây tổn thương mạch máu nhỏ của đái tháo đường (ĐTĐ), bên cạnh biến chứng võng mạc, và biến chứng thần kinh ngọai biên và thần kinh thực vật. Bệnh thận do đái tháo đường cũng là nguyên nhân hằng đầu gây suy thận mạn (STM) giai đoạn cuối tại các nước như Mỹ, Châu Âu và ngay cả các nước Châu Á, như Đài Loan, Nhật, với tỷ lệ thay đổi từ 24-45% bệnh nhân suy thận mạn giai đoạn cuối.
Tổn thương thận do đái tháo đường nằm trong nhóm biến chứng mạch máu nhỏ của đái tháo đường. Những yếu tố liên quan đến bệnh sinh của tổn thương thận là
• Tăng đường huyết: Tăng đường huyết là điều kiện cần thiết, tuy không phải là duy nhất để cho tổn thương thận phát triển, tổn tại và tiến triển. Ổn định đường huyết làm chậm xuất hiện tổn thương thận ở bệnh nhân ĐTĐ, làm cải thiện và ngăn ngừa tiến triển của tổn thương thận đến xơ hóa cầu thận. Sau khi ghép tụy ở bệnh nhân ĐTĐ type 1, với đường huyết ổn định trong 10 năm, các tổn thương thận do ĐTĐ cũng hồi phục.
• Tăng lọc cầu thận (glomerular hyperfiltration) ở bệnh nhân ĐTĐ, trực tiếp làm tăng lắng đọng các chất ở vùng ngoài tế bào, qua cơ chế tăng bộc lộ TGF-β, gây căng dãn tế bào trung mô, tăng hoạt hệ renin-angiotensin, và hệ thống protein kinase C.
• Tăng huyết áp thúc đẩy tiến triển bệnh thận do ĐTĐ, ngược lại, kiểm soát tốt huyết áp làm giảm tiến triển đến tiểu albumine và từ tỉểu albumine vi lượng thành đại lượng.
• Di truyền: Trong nghiên cứu ở nhóm người Pima Indian mà cả 2 thể hệ kế tiếp nhau (cha mẹ và con) đều bị ĐTĐ, nguy cơ của con ĐTĐ bị tiểu protein là 14% nếu không cha hoặc mẹ không tiểu protein, 23% nếu cha hoặc mẹ của bệnh nhân bị tiểu protein, và nguy cơ này sẽ tăng lên 46% khi cả cha và mẹ đều bị tiểu protein. Bệnh nhân ĐTĐ trong gia đình có tiền căn tăng huyết áp hoặc bệnh tim mạch, sẽ tăng nguy cơ bệnh thận ĐTĐ.
Các yếu tố nguy cơ của bệnh thận ĐTĐ: Tăng đường huyết, thời gian ĐTĐ, tăng huyết áp, tăng cholesterol, nam giới, hút thuốc lá, di truyền.
2- CHẨN ĐOÁN
2.1. Hỏi bệnh sử:
a- Liên quan đến bệnh đái tháo đường:
– Type 1 hoặc type 2
– Thời gian mắc bệnh ĐTĐ: biến chứng thận có thể gặp sau 5 năm chẩn đoán ĐTĐ type 1, hoặc vào thời điểm phát hiện ĐTĐ type 2. Thời gian dễ mắc bệnh thận ĐTĐ nhất là sau 10-20 năm mắc bệnh ĐTĐ.
– Chế độ kiểm soát đường huyết: đường huyết, HbA1C gần đây, biến chứng tăng hơặc hạ đường huyết, thuốc hạ đường huyết đang dùng, liều lượng và thời điểm dùng trong ngày
– Chế độ ăn, chế độ tập luyện, chế độ sinh họat, cân nặng
b- Tiền căn các biến chứng cấp tính do tăng đường huyết: hôn mê nhiễm ceton, hôn mê tăng áp lực thẩm thấu
c- Thống kê các biến chứng lên mạch máu lớn của ĐTĐ: tăng huyết áp, bệnh mạch vành, tai biến mạch máu não, cơn đau cách hồi.
d- Thống kê các biến chứng lên mạch máu nhỏ của ĐTĐ: biến chứng võng mạc, biến chứng thần kinh ngọai biên, biến chứng thần kinh thực vật.
e- Biến chứng thận: (1) Phù: tiền căn phù, thời gian phù, mức độ phù, (2) Tiểu đạm: kết quả của xét nghiệm nước tiểu định kỳ gần đây (albumine niệu cơ bản trong những tháng gần đây, sự gia tăng dần của albumine niệu từ vi lượng thành đại lượng, từ tiểu đạm ít, trung bình sang nhiều), (3) Creatinine huyết thanh cơ bản, hoặc trong nhiều năm gần đây (nếu bệnh nhân có xét nghiệm hàng năm)
f- Biến chứng nhiễm trùng, bàn chân đái tháo đường
g- Thuốc đang sử dụng gần đây: thuốc hạ đường huyết (insulin, thuốc hạ đường huyết bằng đường uống), thuốc hạ áp, thuốc hạ lipid máu, thuốc ức chế men chuyển, ức chế thụ thể.
h- Thói quen: hút thuốc lá, uống rượu.
2.2 – Khám lâm sàng: toàn diện tầm soát các biến chứng mạn của ĐTĐ
– Cân nặng, chiều cao: ghi nhận tăng cân nhanh gần đây, phù, tính BMI đánh giá tình trạng dư cân, béo phì
– Khám tim mạch, tăng huyết áp, mạch máu ngọai biên
– Thiếu máu mạn, hội chứng uré máu cao, khi bệnh vào giai đoạn cuối
– Soi đáy mắt: tầm soát tổn thương võng mạc do đái tháo đường
– Tìm dấu yếu liệt chi, tổn thương thần kinh ngọai biên và thần kinh thực vật: tê và dị cảm 2 tay, 2 chân, hạ huyết áp tư thế, vã mồ hôi bất thường, bọng đái thần kinh…
2.3. Cận lâm sàng
a- Xét nghiệm nước tiểu:
– Tổng phân tích nước tiểu: đường niệu, protein niệu, tỷ lệ protein/ creatinine niệu, tỷ lệ albumine/creatinine, cặn lắng nước tiểu
Tần suất tiểu albumine (vi lượng và đại lượng) khoảng 30-35% ở bệnh nhân ĐTĐ type 1 và type 2.
Bảng 1: Giả trị của protein và albumine niệu
| Bình thường | Bất thường | |
| Tỷ lệ albumine/creatinine niệu (ACR) | <30mg/g
<3 mg/mmol |
≥ 30mg/g
≥ 3mg/mmol |
| Albumine niệu 24 giờ | <30 mg/24 giờ | ≥ 30mg/24 giờ |
| Tỷ lệ protein/creatinine niệu (PCR) | <150mg/g
< 15 mg/mmol |
≥ 150mg/g
≥ 15mg/mmol |
| Protein niệu 24giờ | <150mg/ 24giờ | ≥ 150mg/24giờ |
| Protein niệu giấy nhúng | âm tính | Vết đến dương tính |
Bảng 2: Phân loại albumine niệu
| Theo KDIGO 2012 | Bình thường hoặc tiểu albumine nhẹ | Tiểu albumine trung bình | Tiểu Albumine nặng |
| Theo KDOQI 2007 | Không tiểu albumine (normoalbuminuria) | Tiểu albumine vi lượng (microalbuminuria) | Tiểu albumine đại lượng (macroalbuminuria) |
| Tỷ lệ albumine/cr éatinine (mg/g) | <30 | 30-300 | >300 |
| Albumine niệu 24h (mg/24 giờ) | 30 | 30-300 | >300 |
• Đặc trưng của tiểu protein ở bệnh nhân ĐTĐ:
– Tiểu protein chủ yếu là tiểu albumine (tiểu protein do cầu thận)
– Tiểu albumine không kèm tiểu máu
– Tiểu protein hoặc albumine xuất hiện từ từ và nặng dần theo thời gian. Khởi đầu là tiểu albumine vi lượng, kéo dài trong nhiều tháng, nhiều năm, tiến triển thành tiểu albumine đại lượng, rổi tiểu protein mức hội chứng thận hư với tiểu protein không chọn lọc.
– Tiểu protein liên quan với những biến chứng khác: tiểu protein nặng dần tương ứng với sự giảm dần chức năng thận và nặng dần của tổn thương đáy mắt và các biến chứng khác. Cụ thể như bệnh nhân ĐTĐ type 1, khi bệnh nhân có tiểu albumin đại lượng thì 80% kèm tăng huyết áp, 58% kèm bệnh võng mạc do ĐTĐ, trong đó 11% mù, và 50% kèm tổn thương thần kinh.
b- Xét nghiệm máu:
• Đường huyết, HbA 1C, protein máu toàn phần, albumin máu, điện di protein máu nếu bệnh nhân tiểu protein
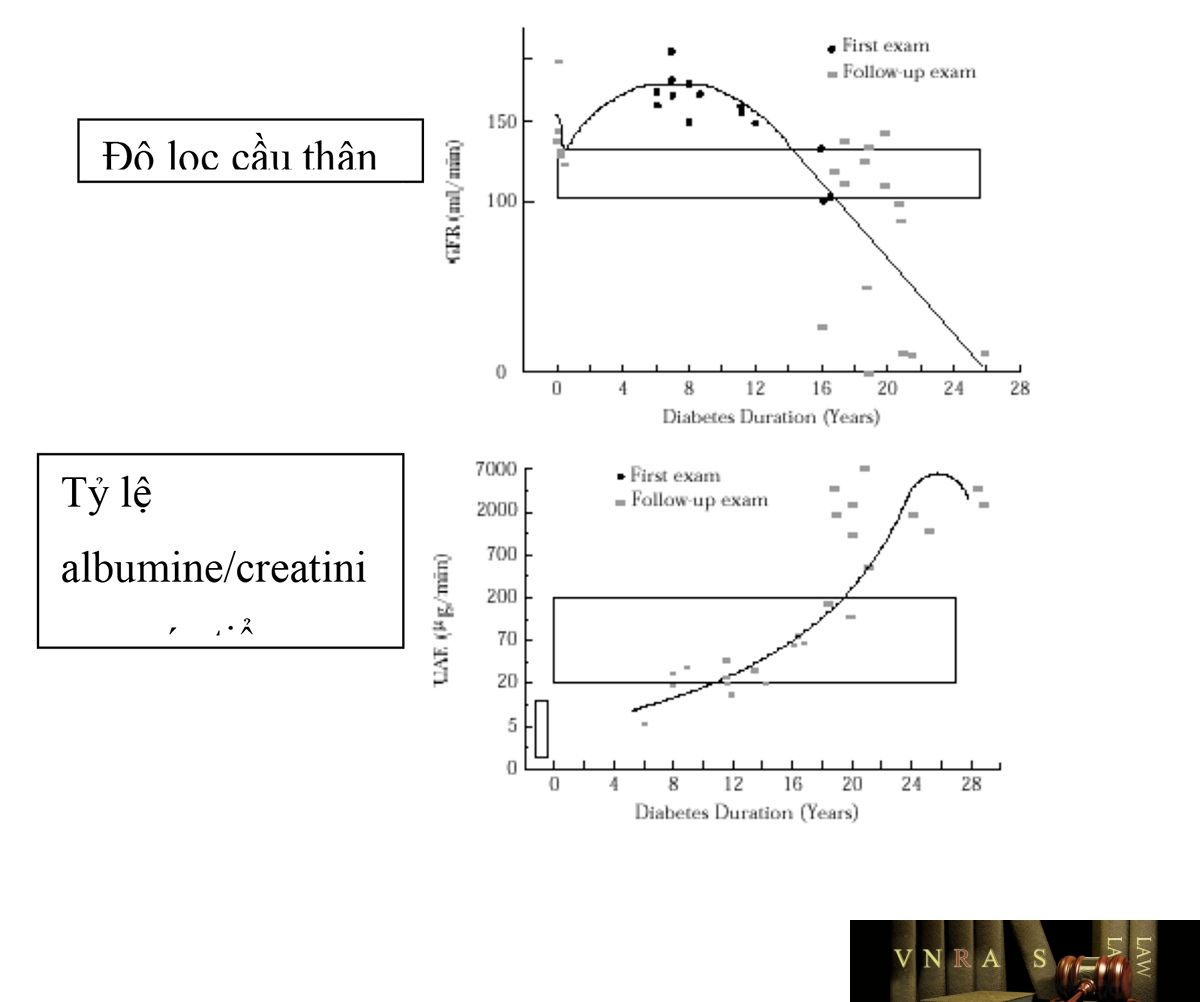
• Creatinine huyết thanh: Protein, albumine niệu càng tăng, creatinine huyết thanh càng tăng hoặc độ lọc cầu thận càng giảm (hình 1)
• Xét nghiệm bộ lipid: HDL, LDL, VLDL- Cholesterol, triglyceride
• Siêu âm bụng: đo kích thước 2 thận, giới hạn vỏ tủy
• ECG, X quang ngực thẳng, siêu âm tim nếu bệnh nhân có biến chứng tim mạch
2.4. Chẩn đoán:
2.4.1. Chẩn đoán xác định:
Theo NKF-KDOQI (National Kidney I Quality Initiate, 2007), bệnh thận ĐTĐ được chẩn đoán nếu:
(1) Bệnh nhân ĐTĐ có tiểu albumin đơn độc (không kèm tiểu máu), tỷ lệ albumin/créatinine > 300mg/g hoặc protein/créatinine > 0,15; kéo dài và tăng dần theo thời gian, Hoặc:
(2) Bệnh nhân đái tháo đường có tiểu albumin vi lượng (albumin/créatinine 30-300mg/g trong 2/3 lần xét nghiệm trong 3 tháng kèm theo:
• Tổn thương võng mạc do ĐTĐ
• thời gian ĐTĐ type 1 kéo dài trên 10 năm
2.4.2. Chẩn đoán phân biệt:
• Tiểu albumine do nguyên nhân khác như nhiễm trùng tiểu, tăng huyết áp, tiểu máu, suy tim, nhiễm trùng cấp… thường chỉ tạm thời và biến mất khi kiểm soát căn nguyên.
• Tiểu albumine do bệnh cầu thận nguyên phát trên bệnh nhân ĐTĐ.
Bệnh cầu thận nguyên phát gặp trong 10-30% bệnh nhân ĐTĐ type 2: đây là những trường hợp cần sinh thiết thận để xác định và định hướng điều trị. Triệu chứng gợi ý cho tiểu protein do bệnh cầu thận nguyên phát là tiểu protein hoặc tiểu albumine xuất hiện đột ngột, tiến triển nhanh đến hội chứng thận hư, kèm hoặc không kèm tiểu máu và không có tổn thương đây mắt tương ứng.
• Suy thận do nguyên nhân khác không phải bệnh thận ĐTĐ: do hẹp động mạch thận, do thuốc…
• Cần nghĩ đến bệnh thận mạn không do ĐTĐ ở những trường hợp sau:
– Bệnh nhân BTM mà không có tổn thương đáy mắt
– Mức lọc cầu thận giảm nhanh hoặc chậm không tương ứng với albumine niệu
– Tiểu albumine hoặc protein tiến triển nhanh
– Tăng huyết áp kháng trị
– Cặn lắng có nhiều trụ hồng cầu, hồng cầu
– Giảm mức lọc cầu thận nhanh >30% sau khi bắt đầu dùng thuốc ức chế men chuyển hoặc ức chế thụ thể angiotensin 2
– Dấu hiệu của bệnh lý hệ thống khác
2. 4.3. Chẩn đoán giai đoạn bệnh thận do ĐTĐ: Dựa vào các đặc điểm lâm sàng, cận lâm sàng và tổn thương bệnh học, H. Parving, chia bệnh thận đái tháo đường thành 5 giai đoạn
– Giai đoạn 1: Chỉ tăng lọc cầu thận, chưa biểu hiện lâm sàng ngoài tăng đường huyết
– Giai đoạn 2: Tăng độ lọc cầu thận, dầy màng đáy, tăng huyết áp
– Giai đoạn 3: Các triệu chứng trên nặng thêm, màng đáy dầy, tăng lắng đọng bào tương của tế bào trung mô, tiểu albumine vi lượng, độ lọc cầu thận giảm dần, tăng huyết áp
– Giai đoạn 4: Bệnh thận do ĐTĐ giai đoạn toàn phát (overt nephropathy) với tiểu albumine đại lượng tăng dần dẫn đến tiểu đạm không chọn lọc và tiểu đạm nhiều mức hội chứng thận hư, phù, tăng huyết áp và mức lọc cầu thận giảm, tổn thương màng đáy, tế bào trung mô nặng hơn kèm xơ hóa cầu thận.
– Giai đoạn 5: protein niệu nhiều mức hội chứng thận hư kèm các biểu hiện của suy thận mạn giai đoạn cuối, tăng huyết áp nặng, xơ hóa cầu thận dạng nốt.
3. ĐIỀU TRỊ
3.1. Mục tiêu điều trị:
– Kiểm soát tốt tình trạng tăng đường huyết, HbA1C khoảng 7%
– Giảm đạm niệu đến < 0,5g/24h
– Giảm huyết áp đạt mục tiêu < 130/80mmHg, ở bệnh nhân GFR > 15ml/ph/1,73m2
– Dùng thuốc ức chế men chuyển hoặc ức chế thụ thể để giảm đạm niệu và bảo tồn chức năng thận
– Theo dõi và điều trị đồng thời các biến chứng mạn tính khác
– Kiểm soát các biến chứng tim mạch: tăng huyết áp, hạ lipid máu
– Bỏ hút thuốc lá
Việc phối hợp kiểm soát tối ưu tất cả các yếu tố trên (điều trị can thiệp đa yếu tố) không chỉ giúp điểu trị bệnh thận ĐTĐ, còn giảm thiểu các biến chứng mạch máu nhỏ và lớn khác ở bệnh nhân ĐTĐ.
3.2. Điều trị cụ thể
a- Điều trị hạ đường huyết
• Mục tiêu điều trị:
– HbA1c khoảng 7% để phòng ngừa và trì hoãn biến chứng mạch máu nhỏ trong đó có biến chứng thận
– HbA1C > 7%: ở những bệnh nhân suy thận, bệnh nhân có nguy cơ cao bị hạ đường huyết, có nhiều bệnh lý đi kèm ảnh hưởng lên đời sống. Cần tránh hạ đường huyết làm tăng nguy cơ tử vong cho bệnh nhân này.
• Thuốc điều trị hạ đường huyết (xem bảng 1)
– Nếu bệnh nhân suy thận (GFR <60ml/ph/1,73 m2 da): cần điều chỉnh liều thuốc hạ đường huyết theo chức năng thận, phương pháp điều trị thay thế thận và tình trạng dinh dưỡng của bệnh nhân. Không dùng Metformin, insulin tác dụng kéo dài (insulin glargine) ở bệnh nhân suy thận.
– Nếu bệnh nhân đang điều trị thay thế thận: Do đường máu được lọc qua màng lọc thận nhân tạo (TNT), nên ngày bệnh nhân chạy TNT, nguy cơ hạ đường huyết sẽ tăng, cần giảm liều insulin kèm hoặc không kèm tăng chế độ dinh dưỡng ở những ngày này. Bệnh nhân thẩm phân phúc mạc, với dịch lọc glucose, cần tăng liều insulin chích hoặc dùng insulin trong dịch lọc. Bệnh nhân ghép thận nếu có dùng tacrolimus, và steroid, đường huyết dễ tăng cao, hoặc bệnh nhân có nguy cơ dễ bị ĐTĐ do thuốc xuất hiện sau ghép thận.
Bảng 1. Chọn lựa thuốc theo độ lọc cầu thận
| MLCT >60ml/ph | MLCT 60- 30ml/ph | MLCT <30 ml/ph | Lọc thận | |
| Metformin | ————– | ———–> | ||
| Acarbose | ————– | ———–> | ||
| Nateglinide | ————– | ————- | ———–> | |
| Glipizide | ————– | ————- | ———–> | |
| Glimepiride | ————– | ———–> | ||
| Gliclazide | ————– | ————- | ———–> | |
| Pioglitazone | ————– | ————- | ———–> | |
| Sitagliptin | ————– | ————- | ————- | ————> |
| Vildaplitin | ————– | ————- | ————- | ————> |
| Saxagliptin | ————– | ————- | ———–> | |
| Linagliptin | ————– | ————- | ————- | ————> |
| Liraglutide | ————> | |||
| Insulin | ————– | ————- | ————- | ————> |
b- Thuốc ức chế hệ renin angiotensin:
1- Chọn lựa thuốc dùng
Thuốc ức chế hệ renin- angiotensin có hiệu quả làm giảm albumine niệu, làm giảm tốc độ tiến triển bệnh thận ĐTĐ khi kèm hoặc không kèm tăng huyết áp.
• Nếu bệnh nhân ĐTĐ không có tiểu albumine và không kèm tăng huyết áp: Không dùng thuốc ức chế men chuyển (UCMC) hoặc ức chế thụ thể angiotensin (UCTT) để phòng ngừa bệnh thận do ĐTĐ
• Nếu bệnh nhân ĐTĐ kèm tiểu albumine (với tỷ lệ albumine/créatinine >30mg/g), không kèm tăng huyết áp, được xem là nhóm có nguy cơ bệnh thận ĐTĐ và có nguy cơ bệnh thận tiến triển: nên dùng thuốc UCMC hoặc UCTT
• Nếu bệnh nhân ĐTĐ type 1 tiểu albumine lượng nhiều (tỷ lệ albumine/creatinine > 300mg/g), ưu tiên chọn thuốc ƯCMC.
• Nếu bệnh nhân ĐTĐ type 2 tiểu albumine lượng nhiều (tỷ lệ albumine/creatiniine >300mg/g), ưu tiên chọn thuốc ƯCTT
Nếu bệnh nhân có tác dụng phụ (như ho) với thuốc ƯCMC, có thể chuyển sang thuốc ƯCTT hoặc ngược lại. Việc phối hợp thuốc UCMC với UCTT làm tăng hiệu quả giảm protein niệu, nhưng không khuyến cáo vì làm gia tăng tác dụng phụ (suy thận cấp, tăng kali máu).
2- Cách dùng:
Do hiệu quả giảm đạm niệu tăng theo liều dùng, nên khởi đầu từ liều thấp, tăng dần liều thuốc. Cần theo dõi đáp ứng bằng đạm niệu, cùng tác dụng phụ của thuốc nhất là trên bệnh nhân có GFR < 60ml/ph/1,73 m2 da: tăng kali máu, suy thận cấp, ho khan, phù mạch
Kiểm soát rối loạn lipid máu:
• Kiểm soát rối loạn lipid máu làm giảm biến chứng xơ mỡ động mạch ở bệnh nhân đái tháo đường biến chứng thận
• Nguyên tắc và biện pháp điều trị tương tự của hướng dẫn ATP-III chung dành cho người trưởng thành.
• Mục tiêu LDL < 100mg/dL, Non-HDL – cholesterol < 130mg/dL
• Thuốc giảm LDL- Cholesterol như statin hoặc statin/ezetimide
Không khởi đầu dùng statin ở bệnh nhân ĐTĐ đã chạy thận nhân tạo. Atorvastatin 10 – 20 mg/ ngày.
• Ở những bệnh nhân protein niệu nhiều gây tăng lipid máu thứ phát, như hội chứng thận hư, cần điều trị giảm protein niệu trước khi dùng thuốc hạ lipid
• Nhóm fibrate cần giảm liều khi MLCT < 60 ml/ph/1,73 m2 và không dùng khi độ MLCT < 15 ml/ph/1,73 m2, ngọai trừ gemfibrozil. Niacin giảm liều khi MLCT < 15 ml/ph/1,73 m2. Nhóm statin cách dùng và liều dùng theo bảng 4.
c- Kiểm soát huyết áp:
• Việc kiểm soát tốt huyết áp làm chậm tiến triển bệnh thận do ĐTĐ
• Huyết áp mục tiêu với GFR > 15ml/ph/1,73 m2: < 130/80mmHg
• Thuốc ưu tiên chọn: mọi bệnh nhân ĐTĐ biến chứng bệnh thận mạn từ giai đoạn 1-4 ( xem bài bệnh thận mạn), đều có chỉ định hạ huyết áp bằng thuốc UCMC hoặc UCTT phối hợp với lợi tiểu.
d- Dùng aspirin 75-125mg/ngày
e- Kiểm soát cân nặng, tránh thừa cân
f- Chế độ dinh dưỡng: hạn chế carbohydrate, giảm mỡ bão hòa, tiết chế đạm nếu suy thận, protein nhập 0,6 – 0,8g/kg/ngày, tiết chế muối nhập NaCl < 6g/ngày
g- Tập vận động mỗi ngày
h- Bỏ hút thuốc lá
4. PHÒNG NGỪA VÀ TÁI KHÁM
• Tầm soát bệnh thận ĐTĐ ở mọi bệnh nhân ĐTĐ type 1 sau 5 năm chẩn đoán ĐTĐ, và vào ngày chẩn đoán với ĐTĐ type 2.
• Xét nghiệm tầm soát bệnh thận do ĐTĐ bao gồm: tỷ lệ albumine/ créatinine nước tiểu với mẫu nước tiểu bất kỳ và creatinine huyết thanh để ước đoán GFR
• Phối hợp đa chuyên khoa trong chẩn đoán, điều trị và theo dõi bệnh nhân: chuyên khoa thận và chuyên khoa nội tiết, tim mạch, thần kinh…
5- PHÁC ĐỒ CHẨN ĐOÁN VÀ ĐIỀU TRỊ

6- KẾT LUẬN:
Cần tầm soát bệnh thận do đái tháo đường ở mọi bệnh nhân đái tháo đường, cùng với tích cực kiểm soát đường huyết và can thiệp điều trị đa yếu tố để phòng ngừa bệnh tiến triển đến suy thận mạn giai đoạn cuối và phòng ngừa tổn thương các cơ quan khác.
Tài liệu tham khảo
1- American Diabetes Association, Diabetes management in correctional Institutions, 2010. Diabetes care, 33, suppl 1, p 75-81
2- National Kidney Foundation-KDOQI clinical practice guidelines and clinical practice recommendations for diabetes and chronic kidney disease, 2007. American Journal of Kidney Disease, 49 (2),suppl. 2, p S 10-S 179
3- National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD, 2012. 2012 update. Am J Kidney Dis. 60(5):850-886
4- Parving HH Mauer M, Ritz E, 2012. Diabetic nephropathy in Brenner &Rector’s the kidney, 9th ed, Vol 1, ch, 38, pp 1411-1454
VIÊM THẬN BỂ THẬN CẤP
1. ĐẠI CƯƠNG:
Viêm thận bể thận cấp (VTBT cấp) là tình trạng nhiễm khuẩn cấp tính các đài thận, bể thận, niệu quản và nhu mô thận hay còn gọi là nhiễm khuẩn đường tiết niệu trên.
Nhiễm khuẩn cấp tính do vi khuẩn gây nên theo đường ngược dòng từ bàng quang lên niệu quản rồi đến đài bể thận, hoặc do đường máu đưa đến khi có nhiễm trùng huyết. Vi khuẩn gây bệnh thường gặp là Gram âm…
* Vi khuẩn gây bệnh:
+ Vi khuẩn Gram (-): thường gặp nhất E. Coli, sau đó là Klebsiella, Proteus mirabilis, Enterobacter…
+ Vi khuẩn Gram (+): ít gặp dưới 10%: Enterococcus, Staphylococcus…
* Yếu tố thuận lợi:
– Nhiễm khuẩn tiết niệu ngược dòng trong trường hợp trào ngược bàng quang – niệu quản, sau khi soi bàng quang – niệu quản, chụp thận ngược dòng (UPR).
– Sau phẫu thuật hệ tiết niệu
– Tắc nghẽn đường tiết niệu do sỏi, khối u, hội chứng chỗ nối, xơ sau phúc mạc, hẹp bể thận niệu quản và có thai…
– Có ổ viêm khu trú: viêm bàng quang, viêm tuyến tiền liệt, viêm trực tràng, viêm ruột thừa, viêm phần phụ…
2. CHẨN ĐOÁN:
Chẩn đoán xác định
– Lâm sàng:
Bệnh thường xuất hiện đột ngột với những biểu hiện sau:
+ Hội chứng nhiễm trùng: sốt cao rét run, có thể thành cơn 39 – 40oC, kèm theo đau đầu và mệt mỏi, môi khô lưỡi bẩn, có thể mất nước do sốt cao. Nếu không phát hiện và điều trị kịp thời sẽ bị sốc nhiễm khuẩn.
+ Hội chứng bàng quang cấp: tiểu buốt, tiểu dắt, tiểu khó, tiểu máu, tiểu đục, tiểu mủ là những dấu hiệu sớm trước khi có biểu hiện VTBT cấp.
+ Đau: Đau hông lưng, mạng sườn nhiều, có cảm ứng khi sờ vào, thường đau một bên, hiếm khi hai bên . Có thể xuất hiện cơn đau quặn thận.
+ Vỗ hông lưng (+): dấu hiệu lâm sàng hay gặp trong VTBT cấp.
+ Chạm thận bập bệnh thận (+/-), có thế sờ thấy thận to.
– Cận lâm sàng:
+ Công thức máu: số lượng bạch cầu tăng rõ rệt, đặc biệt tăng bạch cầu đa nhân trung tính.
+ Cấy máu cấp: nếu sốt cao > 39 – 40oC kèm theo rét run. Khoảng 80% các trường hợp nhiễm trùng tiết niệu do vi khuẩn Gram (-) E. Coli, ít gặp hơn là Enterobacter, Klebsiella, Proteus và Pseudomonas.
+ Protein niệu <1g/24h
+ Tế bào niệu: có tế bào mủ, nhiều tế bào bạch cầu, hồng cầu
+ Cấy VK niệu (+) ≥ 100.000 VK/ml nước tiểu, cũng có khi (-). Trong trường hợp cơn đau không điển hình, cần phải cấy VK niệu để xác định chẩn đoán và có kháng sinh đồ cho điều trị.
+ Siêu âm: dấu hiệu giãn đài bể thận, giãn niệu quản, hình ảnh sỏi thận – tiết niệu, khối u chèn ép… là nguyên nhân gây VTBT cấp sẽ được phát hiện dễ dàng.
+ Chụp bụng không chuẩn bị: nếu nghi ngờ có sỏi thận tiết niệu.
+ UIV: tiến hành sau khi tình trạng sốt nhiễm trùng đã ổn định để tìm kiếm nguyên nhân.
+ Chụp bàng quang: tiến hành sau khi tình trạng nhiễm trùng đã được giải quyết nếu nghi ngờ có trào ngược bàng quang – thận.
3. ĐIỀU TRỊ VIÊM THẬN BỂ THẬN CẤP:
Nguyên tắc điều trị:
Nếu sốt cao rét run cần điều trị nội trú. Các trường hợp nhẹ có thể điều trị và theo dõi ngoại trú. Cần cấy vi khuẩn niệu, máu (nếu có sốt cao) trước khi bắt đầu dùng kháng sinh. Trong khi chờ đợi kết quả cấy vi khuẩn có thể bắt đầu dùng kháng sinh ngay. Nếu sau 3 – 5 ngày điều trị, triệu chứng lâm sàng không đỡ cần điều chỉnh kháng sinh theo kết quả cấy vi khuẩn và kháng sinh đồ.
* Đối với VTBT không biến chứng: KS trong 7 – 14 ngày bằng đường uống nếu triệu chứng không nặng:
+ Amoxicilin + acid clavulanic (ức chế Beta – lactamase): 500 mg x 3 viên/ ngày, chia 3 lần. Nếu tình trạng nặng chuyển đường tiêm TM: 1 g x 2 lọ/ ngày, chia 2 lần.
+ Cephalosporin (thế hệ 2, thế hệ 3): Cefuroxime 250mg x 2 viên/ ngày, chia 2 lần cách nhau 12h.
+ Trimethoprim – sulfamethoxazol: 480 mg x 4 viên chia 2 lần cách nhau 12 h.
+ Fluoroquinolone: nhóm này cần lưu ý không cho phụ nữ có thai và đang cho con bú, không cho trẻ em < 15 tuổi, cần giảm liều ở bệnh nhân suy thận. Thận trọng với bệnh nhân suy gan:
Norfloxacin 400 mg x 2 viên chia 2 lần hoặc
Ofloxacin 200mg x 2 viên chia 2 lần.
– Kết hợp giảm đau chống co thắt: Nospa, Buscopan, Baralgin..
– Uống nhiều nước hoặc truyền dịch đủ để đảm bảo lượng nước tiểu nhiều ≥ 1500 – 2000 ml/24h.
Nếu tình trạng lâm sàng không tiến triển tốt (hội chứng nhiễm trùng rõ, vẫn sốt, tiểu đục, đau, mất nước……) nên chuyển vào điều trị nội trú hoặc lên tuyến trên.
Kháng sinh đường tiêm: khi nặng
+ Amoxy/ hoặc Ampicillin 1 g x 4 lọ/ ngày chia 4 lần tiêm tĩnh mạch x 10 – 14 ngày. Hoặc:
+ Cephalosporin (thế hệ 2, thế hệ 3): 10 – 14 ngày
Cefuroxime 750 mg x 3 lọ chia 3 lần/ngày tiêm TM, hoặc:
Cefotaxime 1g x 3 lần/ ngày chia 3 lần tiêm TM, hoặc:
Ceftriaxone 1g / ngày tiêm TM, hoặc:
Cefoperazone 1-2g x 2 lần/ngày tiêm TM Hoặc:
+ Fluoroquinolone đường uống: trong 3 – 7 ngày, có thể
Norfloxacin 400 mg x 2 viên chia 2 lần/ hoặc
Ofloxacin 200mg x 2 viên chia 2 lần trong .
Có thể truyền 3 ngày, sau đó chuyển sang đường uống tiếp.
Cần lưu ý: thuốc có thể gây ra rối loạn tiêu hóa như nôn, buồn nôn và không được dùng cho phụ nữ có thai, trẻ em dưới 15 tuổi.
+ Kết hợp với 1 thuốc trong các thuốc trên với Aminoglycoside tiêm tĩnh mạch (TM) hoặc tiêm bắp (TB): 4 – 6 mg/kg/24h. Thận trong với người già, cần giảm 1/2 liều ở người suy thận có mức lọc cầu thận dưới 30ml/ph.
+ Nếu cấy nước tiểu có trực khuẩn Gram âm (-): Cephalosporin thế hệ 3 hoặc fluoroquinolone.
+ Nếu cấy nước tiểu có vi khuẩn Gram dương (+): Ampcillin 1g x 6 lần/ mỗi 4 h tiêm TM.
+ Nếu không có biến chứng, hết sốt, từ ngày thứ 10 đến ngày thứ 14 chuyển sang kháng sinh đường uống. Kháng sinh duy trì trong 3 tuần kể cả khi diễn biến lâm sàng đã được cải thiện nhanh chóng. Cần cấy nước tiểu kiểm tra lại sau 1 tuần ngừng thuốc.
+ Nếu vẫn sốt, VK niệu tồn tại 48h đến 72h, hoặc tiếp tục có dấu hiệu nhiễm trùng sau 3 ngày điều trị, cần tìm kiếm tắc nghẽn, ổ nhiễm trùng lan rộng hoặc hình thành ổ áp xe thận. Siêu âm, chụp cắt lớp (CT) thận có thể phát hiện được vị trí tắc nghẽn và ổ áp xe quanh thận để có chỉ định ngoại khoa dẫn lưu.
– Ngoài các thuốc kháng sinh cần phối hợp thêm:
+ Bù đủ dịch bằng đường uống và hoặc đường truyền TM: NaCl 9‰ hoặc Ringer 5%, Glucose 5% đảm bảo lượng nước tiểu > 50 ml/h.
+ Giảm đau, giãn cơ trơn khi đau:
Phloroglucinol hydrate, trimethylphloroglucinol: spasfon viên uống – đặt, ống tiêm x 4 lần/ngày .
Papaverine hydrochloride viên uống, ống tiêm x 2-3 lần/ngày.
Tiemonium metylsulfate: Visceralgine viên uống, ống tiêm x 1 – 3 lần/ngày
* Một số trường hợp không điển hình:
– Cấy VK không mọc: do tắc nghẽn nước tiểu hoàn toàn VK không di chuyển được hoặc đã dùng kháng sinh trước đó. Chỉ định chụp UIV cấp có thể được đặt ra để xác minh chẩn đoán.
– Diễn biến lâm sàng không thuận lợi mặc dù đã điều trị: tình trạng toàn thân không cải thiện hơn, chưa cắt sốt có chỉ định chụp UIV cấp để xem xét điều trị can thiệp ngoại khoa.
* Một số trường hợp cần lưu ý:
– VTBT cấp ở người có thai:
+ Thường gặp ở 3 tháng cuối.
+ Thận trong khi sử dụng thuốc kháng sinh. Có thể dùng nhóm Sulfamide, penicilline (amoxicillin).
+ Không chỉ định chụp X quang,
+ Trường hợp đài bể thận giãn kèm theo không đáp ứng thuốc cần xem xét chụp UIV để tìm nguyên nhân gây tắc nghẽn cơ giới và thận trọng chỉ định ngoại khoa.
+ Mọi thăm dò hình thái khác chỉ tiến hành sau khi đẻ.
– VTBT cấp tái phát nhiều lần:
+ Mỗi lần tái phát sẽ làm biến dạng đài thận, tái phát nhiều lần sẽ gây xơ hóa và teo nhu mô thận.
+ Nên điều trị kháng sinh kéo dài để dự phòng tái phát và tìm nguyên nhân
– VTBT cấp vô niệu:
+ có thể do tắc nghẽn ở thận duy nhất có chức năng hoạt động hoặc do sốc nhiễm khuẩn.
+ Cả hai trường hợp đều rất nặng và tiên lượng tử vong cao.
+ Giải quyết nguyên nhân tắc nghẽn là chỉ định cấp cứu.
* Theo dõi sau giai đoạn điều trị:
– Nếu đáp ứng thuốc tốt và không còn triệu chứng lâm sàng, cấy VK sau 5 ngày ngừng thuốc nếu không mọc coi như đã khỏi.
– Nếu không đáp ứng tốt, sau 2 tuần điều trị cần thiết: X-quang, cấy lại nước tiểu để xét can thiệp sỏi và áp xe quanh thận nếu có.
– Nếu không có bất thường ở hệ tiết niệu: điều trị lại bằng kháng sinh khác phối hợp trong 2 tuần.
– Nếu bệnh nhân tái phát với VK cùng loại: tiếp tục điều trị 6 tuần.
4. ĐIỀU TRỊ DỰ PHÒNG:
– Cần điều trị triệt để khi có nhiễm khuẩn tiết niệu dưới
– Điều trị sớm các nguyên nhân gây nghiễm khuẩn tiết niệu, gây tắc nghẽn đường tiết niệu.
– Uống đủ nước hàng ngày, không nhịn tiểu
Tài liệu tham khảo
1. Canbaz S, Peksen Y, Sunbul M et coll, 2002. Antibiotic prescribing and urinary tract infection. Int J Antimicrob Agents, 20: 407-11
2. Kawashima A, Sandler CM, Goldman SM, 2000. Imaging in acute renal infection. Brit J Urol; 86 Suppl. 1:70-9
3. Krieger JN, 2002. Urinary tract infections: What’s new?. J Urol. 168: 2351-8
4. Pangon B, Chaplain C, 2003. Pyelonephrite aigui: bacteriologie et evolution des resistances. Pathologie Biologie; 51: 503-7
5.Urinary tract infectons, 2006. The Merck Manual eighteenth edition:1968 – 1975 Recommandations.
CHẨN ĐOÁN VÀ ĐIỀU TRỊ NỘI KHOA SỎI THẬN TIẾT NIỆU
1. ĐẠI CƯƠNG
Sỏi thận (Nephrolithiasis) là bệnh lý thường gặp nhất của đường tiết niệu, bệnh lý này gặp ở nam giới nhiều hơn nữ giới.
Tuổi mắc bệnh thường là từ 30 – 55 tuổi, nhưng cũng có thể gặp ở trẻ em (sỏi bàng quang).
Tỷ lệ mắc bệnh sỏi thận tiết niệu chung trên toàn thế giới vào khoảng 3% dân số và khác nhau giữa các quốc gia
Chế độ ăn uống không hợp lý (quá nhiều đạm, Hydrat Carbon, Natri, Oxalat), nhiễm khuẩn tiết niệu, sinh sống ở vùng nóng, vùng nhiệt đới,… là những yếu tố thuận lợi để bệnh sỏi thận tiết niệu dễ phát sinh.
Mã số (theo ICD 10): N20.0
* Sỏi calcium.
Những nguyên nhân làm tăng nồng độ calci trong nước tiểu là:
– Cường tuyến giáp cận giáp.
– Gãy xương lớn và bất động lâu ngày.
– Dùng nhiều Vitamin D và Corticoid.
– Di căn của ung thư qua xương, gây phá hủy xương.
Ngoài ra còn có rất nhiều trường hợp có tăng nồng độ calci trong nước tiểu mà không tìm thấy nguyên nhân (40-60% trường hợp).
* Sỏi oxalat
Chiếm tỷ lệ cao ở các nước nhiệt đới như nước ta, oxalat thường kết hợp với calci để tạo thành sỏi oxalat calci.
* Sỏi phosphat
Loại sỏi phosphat thường gặp là loại amoni-magné-phosphat.Loại sỏi này có kích thước lớn, hình san hô, cản quang, hình thành do nhiễm khuẩn, đặc biệt là do vi khuẩn proteus.
* Sỏi acid uric
Sỏi acid uric dễ xuất hiện khi chuyển hóa chất purine tăng trong cơ thể. Các nguyên nhân có thể làm tăng chuyển hóa purine:
– Sử dụng nhiều thức ăn có chứa nhiều chất purine như lòng heo, lòng bò, thịt cá khô, nấm.
– Bệnh Gút (Goutte).
– Phân hủy các khối ung thư khi dùng thuốc hóa trị liệu.
Lưu ý rằng Acid uric dễ tan trong môi trường kiềm và dễ kết tinh trong môi trường acid, khi pH nước tiểu dưới 6.
* Sỏi Cystin
Được hình thành do sai sót của việc tái hấp thu ở ống thận của chất Cystin, tương đối ít gặp ở nước ta, Sỏi Cystin là sỏi không cản quang.
2. TIẾN TRIỂN CỦA SỎI THẬN TIẾT NIỆU
Sau khi viên sỏi được hình thành, nếu sỏi còn nhỏ, thường viên sỏi đi theo đường nước tiểu và được tổng ra ngoài. Nhưng nếu viên sỏi bị vướng lại ở một vị trí nào đó trên đường tiết niệu, thì sỏi sẽ lớn dần, gây cản trở lưu thông của nước tiểu, đưa đến ứ đọng và dãn phình ở phía trên chỗ tắc và gây ra các biến chứng:
– Tắc nghẽn.
– Nhiễm trùng.
– Phát sinh thêm các viên sỏi khác.
– Phá hủy dần cấu trúc thận.
a) Những nguyên nhân làm cho viên sỏi bị vướng lại
* Hình dạng và kích thước của viên sỏi.
Sỏi lớn, sần sùi thì dễ bám vào niêm mạc và bị vướng lại.
* Trên đường tiết niệu có những chỗ hẹp tự nhiên do cấu trúc giải phẫu
Viên sỏi không qua được các chỗ hẹp, đó là:
– Cổ đài thận
– Cổ bể thận
– Những chỗ hẹp ở niệu quản:
+ Vùng thắt lưng, có các mạch máu sinh dục (mạch máu buồng trứng hoặc tinh hoàn) bắt chéo qua và ở nơi đó niệu quản thường bị gấp khúc, nên viên sỏi có thể bị vướng lại.
+ Vùng chậu hông, niệu quản bắt chéo qua một số động mạch như động mạch chậu, động mạch bàng quang tử cung.
+ Vùng sát bàng quang, niệu quản bắt chéo qua ống dẫn tinh.
+ Phần niệu quản trong nội thành bàng quang.
Vì vậy, viên sỏi niệu quản hay bị vướng lại ở các đoạn sau:Đoạn thắt lưng 1/3 trên của niệu quản, Đoạn trong chậu hông bé, Đoạn nội thành của bàng quang.
– Ở bàng quang: Cổ bàng quang là chỗ hẹp chủ yếu. Ở nam giới, cổ bàng quang có tiền liệt tuyến bao bọc nên sẽ khó qua hơn ở phụ nữ.
– Ở niệu đạo: Nữ giới niệu đạo không có chỗ hẹp và ngắn hơn nên sỏi ít bị vướng lại. Nam giới, niệu đạo có ba chỗ mở rộng ra và viên sỏi hay lọt vào đó. Những nơi đó là: Xoang tiền liệt tuyến, Hành niệu đạo, Hố thuyền ở gần lỗ sáo.
b) Ảnh hưởng của viên sỏi đối với đường tiết niệu.
Khi viên sỏi bị vướng lại ở bên trong đường tiết niệu, nó sẽ ảnh hưởng đến đường tiết niệu qua 3 giai đoạn:
* Giai đoạn chống đối
Đường tiết niệu phía trên viên sỏi sẽ tăng cường sức co bóp để tổng sỏi ra ngoài. Niệu quản và bể thận phía trên viên sỏi chưa bị giãn nở. Có sự tăng áp lực đột ngột ở đài bể thận gây cơn đau quặn thận. Trên lâm sàng ở giai đoạn này bệnh nhân thường biểu hiện bởi những cơn đau quặn thận điển hình.
* Giai đoạn giãn nở
Thông thường sau khoảng 3 tháng nếu sỏi không di chuyển được thì niệu quản, bể thận và đài thận phía trên viên sỏi sẽ bị giãn nở, nhu động của niệu quản bị giảm.
* Giai đoạn biến chứng
Viên sỏi nằm lâu sẽ không di chuyển được vì bị bám dính vào niêm mạc, niệu quản bị xơ dày, có thể bị hẹp lại. Chức năng thận sẽ bị giảm dần, thận ứ nước, ứ mủ nếu có nhiễm trùng, sỏi còn tồn tại trong đường tiết niệu là một yếu tố thuận lợi cho việc nhiễm trùng tái diễn, lâu ngày sẽ gây viêm thận bể thận mạn tính và đưa đến suy thận mạn. Sỏi niệu quản hai bên có thể gây vô niệu do tắc nghẽn.
3. CHẨN ĐOÁN
3.1. LÂM SÀNG
a) Sỏi đường tiết niệu trên.
Gồm sỏi thận, bể thận, niệu quản. Các triệu chứng thường gặp là:
– Cơn đau quặn thận: xuất hiện đột ngột, sau khi gắng sức, khởi phát ở vùng hố thắt lưng một bên, lan ra phía trước, xuống dưới, cường độ đau thường mạnh, không có tư thế giảm đau. Có thể phân biệt hai trường hợp
+ Cơn đau của thận do sự tắc nghẽn bể thận và đài thận: đau ở hố thắt lưng phía dưới xương sườn 12, lan về phía trước hướng về rốn và hố chậu.
+ Cơn đau của niệu quản: xuất phát từ hố của thắt lưng lan dọc theo đường đi của niệu quản, xuống dưới đến hố chậu bộ phận sinh dục và mặt trong đùi.
– Triệu chứng kèm theo cơn đau quặn thận là buồn nôn, nôn mửa, chướng bụng do liệt ruột. Có thể có sốt, rét run nếu có nhiễm trùng kết hợp.
– Khám thấy điểm sườn lưng đau. Các điểm niệu quản ấn đau, có thể thấy thận lớn.
Chú ý rằng không có mối liên quan giữa kích thước hay số lượng sỏi với việc xuất hiện cũng như cường độ đau của cơn đau quặn thận. Một số trường hợp bệnh nhân không có triệu chứng (sỏi thể yên lặng), hoặc chỉ có dấu không rõ ràng như đau ê ẩm vùng thắt lưng một hoặc hai bên.
b) Sỏi đường tiết niệu dưới.
Gồm sỏi bàng quang và sỏi niệu đạo.
– Sỏi bàng quang sẽ kích thích niêm mạc bàng quang gây tiểu buốt, rát, tiểu láu.
– Tiểu tắc giữa dòng.
– Khám ấn điểm bàng quang đau.
– Sỏi niệu đạo sẽ gây bí tiểu, khám lâm sàng thường phát hiện được cầu bàng quang, sờ nắn dọc theo niệu đạo có thể thấy sỏi.
3.2. CẬN LÂM SÀNG
a) Xét nghiệm nước tiểu
* Tìm tế bào và vi trùng: Nước tiểu có nhiều hồng cầu, bạch cầu. Có thể thấy vi trùng khi ly tâm soi và nhuộm Gram khi có biến chứng nhiễm trùng. Cần cấy nước tiểu trong trường hợp nghi ngờ có nhiễm trùng.
* Soi cặn lắng: có thể thấy tinh thể Oxalat, Phosphat, Calci.
* pH nước tiểu: Có nhiễm trùng niệu pH sẽ tăng trên 6,5 vì vi trùng sẽ phân hủy Urea thành Amoniac. Khi pH dưới 5,5 có nhiều khả năng có sỏi Urat.
* Protein niệu: Nhiễm trùng niệu chỉ có ít Protein niệu, nếu Protein niệu nhiều phải thăm dò bệnh lý cầu thận.
b) Siêu âm: Phát hiện sỏi, độ ứ nước của thận và niệu quản, độ dầy mỏng của chủ mô thận. Đây là xét nghiệm thường được chỉ định trước tiên khi nghi ngờ có sỏi hệ tiết niệu vì đơn giản, rẻ tiền, không xâm nhập và có thể lập lại nhiều lần không có hại cho bệnh nhân. Nhiều trường hợp sỏi không triệu chứng được phát hiện tình cờ khi khám siêu âm kiểm tra thường quy hoặc siêu âm bụng vì một lý do khác.
c) X quang bụng không chuẩn bị (ASP): xác định vị trí sỏi cản quang, cho biết kích thước số lượng và hình dáng của sỏi. Rất có giá trị vì hầu hết sỏi hệ tiết niệu ở Việt nam là sỏi cản quang.
d) Chụp hệ tiết niệu qua đường tĩnh mạch (UIV): cho biết
– Hình dáng thận, đài bể thận, niệu quản.
– Vị trí của sỏi trong đường tiết niệu.
– Mức độ giãn nở của đài bể thận, niệu quản.
– Chức năng bài tiết chất cản quang của thận từng bên.
e) Chụp X quang niệu quản thận ngược dòng
– Phát hiện sỏi không cản quang.
– Có giá trị trong trường hợp thận câm trên phim UIV.
f) Chụp X quang niệu quản thận xuôi dòng
g) Soi bàng quang: thường ít dùng để chẩn đoán sỏi, nhưng có thể nội soi can thiệp lấy sỏi.
4. CHẨN ĐOÁN BIẾN CHỨNG
Các biến chứng thường gặp và nguy hiểm:
– Tắc nghẽn:
Là biến chứng cấp tính nặng. Nếu tắc nghẽn hoàn toàn niệu quản, bể thận giãn to và sau 6 tuần nhu mô thận có thể không hồi phục. Hậu quả của ứ nước là hủy hoại về cấu trúc dẫn đến sự hủy hoại về chức năng.
– Suy thận cấp:
Suy thận cấp có thể do tình trạng tắc nghẽn nặng (hoàn toàn hoặc gần hoàn toàn) cả hai bên niệu quản.
Suy thận cấp cũng có thể xảy ra ở bệnh nhân chỉ có sỏi niệu quản một bên nhưng gây phản xạ co mạch cả hai bên gây vô niệu. Biểu hiện lâm sàng là vô niệu, xét nghiệm urê, creatinin, K+ máu tăng nhanh, toan máu chuyển hóa.
– Suy thận mạn:
Do viêm thận bể thận mạn là hậu quả nặng nề nhất của sỏi thận, tiết niệu vì không còn khả năng phục hồi do thận xơ hóa dần.
5. ĐIỀU TRỊ
a) Điều trị nội khoa
* Điều trị cơn đau quặn thận do sỏi
– Giảm lượng nước uống vào khi đang có cơn đau quặn thận
– Giảm đau: Thường các thuốc kháng viêm không Steroid có tác dụng tốt trong trường hợp này, có thể sử dụng Diclofenac (Voltarene ống 75mg) tiêm tĩnh mạch.
– Trong trường hợp không có hiệu quả, cân nhắc việc sử dụng Morphin.
– Giãn cơ trơn: tiêm tĩnh mạch các thuốc Buscopan, Drotaverin,…
– Kháng sinh, nếu có dấu hiệu nhiễm trùng, chú ý chọn những loại kháng sinh có tác dụng trên vi khuẩn gram âm như Cephalosporin thế hệ 3, Quinolone và các Aminoside thường được sử dụng nhiều, cần thay đổi liều lượng theo mức độ suy thận (nếu có) và tránh dùng Aminoside khi suy thận.
– Giải quyết nguyên nhân gây tắc nghẽn niệu quản (sỏi, dị dạng đường niệu gây ứ nước). Một số trường hợp sỏi niệu quản gây cơn đau quặn thận không đáp ứng với điều trị nội khoa thì cần chỉ định can thiệp phẫu thuật sớm để giải quyết tắc nghẽn. Tùy theo cơ địa bệnh nhân, số lượng, kích thước sỏi và tình trạng chức năng thận từng bên để quyết định dẫn lưu tối thiểu bể thận qua da hay có thể can thiệp lấy sỏi bằng mổ cấp cứu.
* Một số lưu ý điều trị sỏi bằng nội khoa.
+ Đối với sỏi nhỏ và trơn láng: Nhờ sự nhu động của niệu quản viên sỏi sẽ di chuyển dần để được tổng ra ngoài, đây là một tiến triển một cách tự nhiên. Tuy nhiên việc tăng dòng nước tiểu (thuốc lợi tiểu,uống nhiều nước) thuốc chống viêm không stéoide làm cho niêm mạc niệu quản không bị phù nề làm cản trở sự di chuyển của sỏi , có thể có tác dụng tốt cho viên sỏi chuyển động dễ dàng.
+ Đối với sỏi acid uric: Là sỏi không cản quang, thường gặp ở các nước phát triển kết tinh ở pH nước tiểu thường rất acid < 6 và sỏi có thể tan khi ta cho kiềm hóa nước tiểu, vì vậy với loại sỏi này hướng dẫn cách điều trị như sau:
– Chế độ ăn: giảm đạm, kiêng rượu, bia, thuốc lá.
– Cho bệnh nhân uống nhiều nước trên 2 lít nước mỗi ngày
– Làm kiềm hóa nước tiểu bằng các loại thuốc
Bicarbonate de Sodium 5 -10g/ ngày
Allopurinol: Là thuốc ức chế purine liều 100- 300mg mỗi ngày, lưu ý có thể gây tác dụng phụ như buồn nôn, tiêu chảy, ngứa, nổi mân ở da, suy chức năng gan. Nên uống thuốc sau khi ăn.
* Điều trị nội khoa sau phẩu thuật mổ lấy sỏi.
Những yếu tố cho sự tái phát sỏi gồm:
– Còn sót sỏi sau phẫu thuật.
– Tồn tại chỗ hẹp trên đường tiết niệu.
– Nhiễm trùng niệu không điều trị dứt điểm: Cần phải điều trị dứt điểm nhiễm trùng niệu, tốt nhất điều trị theo kháng sinh đồ.
b) Điều trị ngoại khoa (tham khảo bài điều trị ngoại khoa sỏi thận)
+ Mổ lấy sỏi
+ Phẩu thuật nội soi lấy sỏi.
+ Lấy sỏi niệu quản qua da
c) Tán sỏi ngoài cơ thể và tán sỏi nội soi
Tham khảo bài tán sỏi ngoài cơ thể và tán sỏi nội soi.
d) Điều trị dự phòng.
Trong tất cả trường hợp sỏi, đều phải đảm bảo lượng nước tiểu > 2 lít/ngày.
– Nếu tăng Calci niệu vô căn: Chế độ ăn có lượng muối bình thường (6 – 9 g NaCl/ngày) lượng Protid bình thường (1,2 g/kg/ngày), Calci bình thường (800 – 1000 mg/ngày).
– Nếu tăng Oxalate niệu vô căn: Allopurinol nếu có tăng Acid Uric niệu phối hợp.
– Sỏi Uric: Kiềm hóa nước tiểu để pH niệu khoảng 6,5 (nhưng không quá 7 vì lại tạo điều kiện cho lắng đọng tinh thể Calci, Phospho) Chế độ ăn giảm cung cấp các chất có chứa nhiều nhân purine). Allopurinol được chỉ định khi Acid Uric niệu trên 4 mmol/ngày và đã áp dụng chế độ ăn hợp lý.
– Sỏi do nhiễm trùng: Điều trị kháng sinh kéo dài (2 – 3 tháng) chọn loại kháng sinh tập trung tốt lên nhu mô thận (Cotrimoxazole, Quinolone) sau khi loại bỏ sỏi.
– Sỏi Cystin: Uống nước nhiều đảm bảo nước tiểu trên 3 lít/ngày. Cần phải đạt được Cystin niệu < 600 – 800 (mol/l và pH niệu từ 7,5 đến 8 (cho uống 8 – 16 gam Natri Bicarbonate mỗi ngày).
Tài liệu tham khảo:
1. Giáo trình Bệnh học Nội khoa, 2008. Bộ Môn Nội – Trường Đại học Y Dược Huế, NXB Y học
2. Bài Giảng Bệnh học Nội khoa, 2003. Các Bộ môn Nội – Trường Đại học Y Hà nội, NXB Y học
3. Néphrologie, 2005. Collège Universitaire Des Enseignants De Néphrologie, nouvelle édition, Ellipses
4. Harrison’s Principles of Internal Medicine,2005. 16th edition.
5. Wolters Kluwer, Lippincott Williams & Wilkins, 2010. The Washington Manual of Medical Therapeutics, 33rd Edition.
Ứ NƯỚC, Ứ MỦ BỂ THẬN
1. ĐẠI CƯƠNG
Hậu quả của tắc nghẽn đường tiết niệu làm cho đài thận rồi bể thận và có thể cả niệu quản giãn dần ra dẫn đến kích thước thận to lên so với bình thường gọi là hiện tượng thận ứ nước. Trong thời gian ứ nước bể thận và niệu quản có thể dẫn đến nhiễm trùng tại thận. Nếu nhiễm trùng nặng có thế dẫn đến tình trạng ứ mủ bể thận.
Tùy theo nguyên nhân thận có thể ứ nước một bên hoặc cả hai bên, tùy theo thời gian và tiến triển của bệnh mà biểu hiện lâm sàng có thể là cấp tính hoặc mạn tính. Trong những trường hợp mạn tính chức năng thận có thể bị suy giảm và không có khả năng hồi phục, thận chí có thể dẫn đến bệnh thận giai đoạn cuối.
2. NGUYÊN NHÂN
Nguyên nhân chủ yếu gặp trong ứ nước, ứ mủ bể thận là do những cản trở cơ học từ bên trong hoặc bên ngoài cũng như những tổn thương chức năng đơn thuần không liên quan đến sự tắc nghẽn cố định trong hệ thống dẫn niệu.
Nghẽn, tắc cơ học có thể gặp ở bất cứ đoạn nào của đường dẫn niệu, bắt đầu từ đài thận đến lỗ ngoài của niệu đạo.
Ở trẻ em các dị tật bẩm sinh chiếm ưu thế bao gồm hẹp khúc nối bể thận niệu quản, niệu quản sau tĩnh mạch chủ, van niệu đạo sau [1].
Ở người lớn, tắc nghẽn đường tiểu chủ yếu do các nguyên nhân mắc phải:
Sỏi thận và sỏi niệu quản là nguyên nhân hay gặp, ngoài ra là các nguyên nhân như hẹp niệu quản, u niệu quản, cục máu đông [2].
Nguyên nhân do do chấn thương niệu quản trong phẫu thuật ở vùng chậu hoặc đại tràng
Nguyên nhân do các khối u bên ngoài chèn ép vào niệu quản như ung thư cổ tử cung hay đại tràng, u lympho sau phúc mạc, viêm nhiễm quanh niệu quản.
Xơ hóa sau phúc mạc chưa rõ nguyên nhân cũng thường gặp ở nam tuổi trung niên và có thể dẫn đến tắc nghẽn niệu quản 2 bên.
3. CHẨN ĐOÁN
3.1. Triệu chứng lâm sàng:
Biểu hiện lâm sàng thận ứ nước, ứ mủ tùy thuộc vào sự tắc nghẽn là cấp tính hay mạn tính, tắc một bên hay hai bên, vị trí tắc thấp hay cao, có nhiễm khuẩn kết hợp hay chỉ ứ nước đơn thuần. Nhiều trường hợp bệnh tiến triển âm thầm chỉ tình cờ phát hiện khi siêu âm hay khám sức khỏe định kì, hoặc bệnh nhân đi khám vì nhiễm khuẩn tiết niệu, suy thận [3].
Triệu chứng hay gặp nhất là đau mỏi, tức hông lưng do đài bể thận, bao thận bị căng giãn. Đau thường khởi phát khu trú ở vùng mạng sườn hay hông lưng rồi lan xuống, ra sau. Có thể đau 2 bên do tắc nghẽn cả 2 bên và đau tăng lên khi có nhiễm trùng.
Sốt rét run từng đợt chỉ xuất hiện khi có nhiễm khuẩn.
Bệnh nhân có thể bị rối loạn tiểu tiện: tiểu buốt, tiểu rắt, tiểu máu, tiểu đục nếu có nhiễm khuẩn.
Thận to là dấu hiệu thường gặp, do giãn đài bể thận làm thận to lên có thể phát hiện được qua khám lâm sàng.
Thay đổi số lượng nước tiểu: Lượng nước tiểu có thể tăng > 2 lít/ ngày do rối loạn chức năng cô đặc nước tiểu, hoặc có khi bệnh nhân bị thiểu niệu, vô niệu do tắc nghẽn niệu quản hoàn toàn cả hai bên.
Tăng huyết áp: Khoảng 1/3 bệnh nhân có biểu hiện tăng huyết áp khi thận bị ứ nước, huyết áp chỉ tăng nhẹ hoặc trung bình do thận tăng tiết renin hoặc có thể do giữ muối giữ nước.
Trong trường hợp bệnh nhân đã có biểu hiện của suy giảm chức năng thận nặng và không hồi phục thì có thể có phù, da xanh, niêm mạc nhợt biểu hiện một tình trạng thiếu máu.
3.2. Triệu chứng cận lâm sàng:
* Chụp hệ tiết niệu không chuẩn bị
Nên là chỉ định đầu tiên để xác định nguyên nhân tắc nghẽn, trên phim X quang chuẩn có thể thấy được bóng thận to, sỏi cản quang ở thận, niệu quản, bàng quang. Nếu có thể nên thụt đại tràng cho bệnh nhân trước khi chụp để tránh các hình ảnh nhầm lẫn do bã thức ăn, bóng hơi của đại tràng.
Kỹ thuật đơn giản nhưng có thể phát hiện tới trên 90% sỏi tiết niệu cản quang gây tắc đường tiết niệu trên.
* Siêu âm hệ thận tiết niệu
Trong thận ứ nước siêu âm cho phép đánh giá kích thước thận, độ dầy của nhu mô, mức độ ứ nước thận, tình trạng dịch ứ đục hay đồng nhất, phát hiện được một số nguyên nhân tắc nghẽn như sỏi, khối u đường tiết niệu hay bên ngoài chèn ép vào, các dị dạng bẩm sinh ở đường tiết niệu. Tuy nhiên, hạn chế của siêu âm: khó đánh giá được toàn bộ niệu quản.
* Chụp cắt lớp vi tính (Computerized Tomogaphy Scan – CT Scan)
Chụp CT Scan có độ nhậy cao 95 – 98% và độ đặc hiệu 96 – 100%. Đặc biệt chính xác trong chẩn đoán ứ nước thận – niệu quản về vị trí giãn, độ dầy của thành niệu quản, vị trí, kích thước sỏi, dấu hiệu của tắc nghẽn có thể được đánh giá mà không cần thuốc cản quang. Chụp CT Scan cho phép chẩn đoán các bệnh lý khác như khối u sau phúc mạc, khối u vùng tiểu khung, xơ hóa sau phúc mạc, hạch di căn, ung thư…
* Phương pháp thăm dò chức năng thận (Chụp xạ hình chức năng thận bằng Tc – 99m – DTPA)
Xạ hình chức năng thận là kỹ thuật chẩn đoán đơn giản, dễ tiến hành, rất có giá trị trong các bệnh lý của thận, không chỉ cung cấp các thông tin về chức năng riêng rẽ của từng thận qua phân tích định lượng và định tính mà còn cho các thông tin về vị trí, kích thước và giải phẫu thận.
Xạ hình cũng rất có ích trong trường hợp bệnh nhân mẫn cảm với thuốc cản quang có iod hoặc chức năng thận suy giảm nhiều mà không thể sử dụng thuốc cản quang đường tĩnh mạch khi chụp CT Scan…
* Xét nghiệm máu và nước tiểu:
Xét nghiệm ure, creatinin huyết thanh…
Xét nghiệm công thức máu, máu lắng… cấy máu nếu cần thiết
Xét nghiệm nước tiểu: tổng phân tích, tế bào niệu, cấy nước tiểu…
3.2. Chẩn đoán xác định
* Lâm sàng:
– Đau vùng hông lưng
– Sốt trong trường hợp có nhiễm trùng
– Rối loạn tiểu tiện
– Biểu hiện triệu chứng suy giảm chức năng thận của bệnh thận cấp hoặc mạn tùy theo giai đoạn bệnh
* Cận lâm sàng: Đóng vai trò quan trọng do nhiều bệnh nhân có rất ít triệu chứng lâm sàng
– Xquang hệ thận – tiết niệu
– Siêu âm thận – tiết niệu
– Chụp cắt lớp vi tính
– Xạ hình thận
– Xét nghiệm nước tiểu có tế bào niệu, cấy vi khuẩn dương tính
– Xét nghiệm máu có thể có biểu hiện triệu chứng suy giảm chức năng thận của bệnh thận cấp hoặc mạn tùy theo giai đoạn bệnh
4. ĐIỀU TRỊ
Tùy thuộc vào tình trạng lâm sàng toàn thận, mức độ ứ nước, ứ mủ ở thận, nguyên nhân gây ứ nước và chức năng thận suy giảm cấp tính hay mạn tính mà có phương pháp điều trị thích hợp cho từng bệnh nhân cụ thể nhưng nguyên tắc chung là loại bỏ yếu tố gây tắc nghẽn.
4.1. Chỉ định dùng thuốc
* Kháng sinh
Nếu bệnh nhân có tình trạng nhiễm khuẩn, tốt nhất sử dụng kháng sinh theo kháng sinh đồ. Trong trường hợp chưa có kết quả kháng sinh đồ có thể dùng thuốc theo kinh nghiệm. Các nhóm thuốc có thể sử dụng là Fluoroquinolon, Cepholosporin và Etarpendem.
* Thuốc huyết áp
Phối hợp các nhóm thuốc hạ huyết áp nếu cần để khống chế huyết áp <130/80 mmHg.
* Điều trị các rối loạn do suy giảm chức năng thận
Điều trị các rối loạn điện giải đặc biệt chú ý tình trạng rối loạn Kali máu và Natri máu.
Nếu có suy giảm chức năng thận thì kiểm soát toan máu, phòng tăng phospho máu, điều trị thiếu máu, điều chỉnh mỡ máu nếu có rối loạn, và chế độ ăn theo các mức độ bệnh thận mạn.
4.2. Dẫn lưu bể thận qua da
Dẫn lưu bể thận qua da là một thủ thuật cơ bản và cần thiết trong điều trị thận ứ nước, ứ mủ do các nguyên nhân khác nhau. Đây là một thủ thuật đơn giản, ít tốn kém, ít tốn thời gian, ít chấn thương và cho kết quả khả quan giúp giảm nhanh áp lực tại thận, giải quyết nhanh tình trạng ứ đọng và nhiễm khuẩn góp phần hồi phục nhu mô và chức năng thận.
Những trường hợp nguyên nhân không thể giải quyết được nhiều bệnh nhân đã lựa chọn việc dẫn lưu tạm thời thành biện pháp lâu dài để duy trì chức năng thận, hoặc để tránh việc phải lọc máu ngắt quãng vì việc lọc máu ngắt quãng quá tốn kém và mất nhiều thời gian [4, 5].
Phần kỹ thuật dẫn lưu bể thận qua da xin đề nghị tham khảo thêm sách về qui trình các kỹ thuật, thủ thuật trong thận – tiết niệu.
4.3. Phẫu thuật giải quyết nguyên nhân tắc nghẽn
4.4. Cắt bỏ thận
Chỉ định khi thất bại trong điều trị bảo tồn và nhu mô thận đã bị phá hủy nhiều dẫn đến mất chức năng hoàn toàn và không có khả năng hồi phục.
4.5. Điều trị thận thay thế
Chỉ định cụ thể theo tình trạng rối loạn điện giải, toan hóa máu và sự suy giảm chức năng thận của bệnh thận cấp hoặc mạn ở từng giai đoạn bệnh.
Tài liệu tham khảo
1. Trần Quán Anh (2007), Hẹp khúc nối bể thận – niệu quản. NXB y học: Tr. 498-504.
2. Etemadian M, Robab Maghsoudi, 1 Pejman Shadpour, Ghasemi H, Shati M (2012), “Outcomes of Tubeless Percutaneous Nephrolithotomy in Patients With Chronic Renal Insufficiency”. Iranian Journal of Kidney Diseases 6 (3): pp.216 – 8.
3. Garne E, Loane M, Wellesley D, Barisic I. Congenital hydronephrosis: prenatal diagnosis and epidemiology in Europe. J Pediatr Urol 2009; 5:47-52.
4. Brian Funaki JA (2006), “Percutaneous nephrostomy”. 23: pp 205 – 8.
5. Ecric Van Sonnenberg GC (1992), “Symptomatic Renal Obstruction or Urosepsis During Pregnancy: Treatment by Sonographically Guide Percutaneous Nephrostomy”. American Roentgen Ray Society 158: pp.91 – 4
TRỊ VIÊM BÀNG QUANG CẤP
Viêm bàng quang cấp là tình trạng nhiễm khuẩn cấp tính tại bàng quang. Biểu hiện lâm sàng thường có hội chứng bàng quang rõ với tiểu buốt, tiểu dắt, có thể có tiểu máu, tiểu mủ ở cuối bãi. Xét nghiệm nước tiểu có bạch cầu niệu và vi khuẩn niệu. Bệnh thường gặp ở nữ với tỷ lệ nữ/nam = 9/1. Chẩn đoán và điều trị phụ thuộc vào các thể lâm sàng: viêm bàng quang cấp thông thường hay viêm bàng quang cấp biến chứng.
1. NGUYÊN NHÂN GÂY BỆNH
1.1. Các loại vi khuẩn thường gặp:
Vi khuẩn gram(-) chiếm khoảng 90%, vi khuẩn gram(+) chiếm khoảng 10%. Thường gặp là:
– Escherichia coli: 70 – 80% người bệnh.
– Proteus mirabilis: 10 – 15% người bệnh.
– Klebsiella: 5 – 10% người bệnh.
– Staphylococus saprophyticus: 5 – 10% người bệnh.
– Pseudomoras aeruginosa: 1 – 2% người bệnh.
– Staphylococus aereus: 1 – 2% người bệnh.
1.2. Nguyên nhân thuận lợi:
– Phì đại lành tính hoặc u tuyến tiền liệt.
– Sỏi, u bàng quang.
– Hẹp niệu đạo, hẹp bao qui đầu.
– Đái tháo đường.
– Có thai.
– Đặt sonde dẫn lưu bàng quang hoặc can thiệp bàng quang, niệu đạo…
2. CHẨN ĐOÁN VÀ ĐIỀU TRỊ
2.1. Chẩn đoán và điều trị viêm bàng quang cấp thông thường ở phụ nữ
2.1.1. Chẩn đoán: Dựa vào lâm sàng và cận lâm sàng.
a) Lâm sàng:
– Có hội chứng bàng quang rõ với tiểu buốt, tiểu dắt, có thể tiểu máu, tiểu mủ cuối bãi.
– Có thể có đau nhẹ vùng trên khớp mu khi bàng quang căng.
– Đôi khi triệu chứng không điển hình, chỉ có nóng rát khi đi tiểu hoặc tiểu dắt.
– Thường không sốt hoặc chỉ sốt nhẹ ( nhiệt độ < 38oC).
b) Cận lâm sàng:
– Xét nghiệm nước tiểu:
+ Bạch cầu niệu dương tính từ (++) đến (+++) (≥ 104 bạch cầu/ml). Tuy nhiên khi trên kính hiển vi soi có nhiều bạch cầu đa nhân thoái hóa ở mẫu nước tiểu tươi thì không cần đến số lượng ≥ 104 bạch cầu/ml nước tiểu vẫn được chẩn đoán.
+ Nitrit niệu (+)
+ Vi khuẩn niệu ≥ 105/ml nước tiểu cấy. Tuy nhiên chỉ cần cấy nước tiểu khi điều trị thông thường không đáp ứng hoặc tái phát.
+ Không có protein niệu trừ khi có tiểu máu, tiểu mủ đại thể.
– Xét nghiệm máu:
+ Thường không cần xét nghiệm.
+ Bạch cầu máu thường không cao.
– Siêu âm: Có thể thấy thành bàng quang dày hơn bình thường.
2.1.2. Điều trị:
Thường điều trị kháng sinh một liệu trình ngắn từ 3-5 ngày, có thể dùng một trong những thuốc sau:
– Trimethoprim sulfamethoxazol: viên 480 mg, uống 1-2 viên/lần, 2 lần/ngày cách nhau 12 giờ trong 3 – 5 ngày.
– Cephalexin: viên 500 mg, uống 1- 2 viên/lần, 2 lần/ngày cách nhau 12 giờ trong 5 ngày.
– Nitrofurantoin: viên 100 mg, uống 1 viên/lần, 2 lần/ngày cách nhau 12 giờ trong 5 ngày.
– Amoxycillin + Clavulanate: viên 625 mg, uống 1 viên/lần, 2 lần/ngày cách nhau 12 giờ trong 5 ngày.
– Nhóm Fluoroquinolones không phải là lựa chọn đầu tay trừ khi điều trị các kháng sinh khác thất bại hoặc đã tái phát. Thuốc thường được chọn là Norfloxacin 400 mg, uống mỗi lần 1 viên cách nhau 12 giờ trong 3 – 5 ngày.
Uống đủ nước, nước tiểu ít nhất > 1,5 lít/24h và không nhịn tiểu quá 6 giờ là một yếu tố quan trọng giúp điều trị và dự phòng nhiễm khuẩn.
2.2. Chẩn đoán và điều trị viêm bàng quang cấp ở phụ nữ có thai:
2.2.1. Chẩn đoán:
Viêm bàng quang cấp ở phụ nữ có thai triệu chứng lâm sàng, cận lâm sàng cũng như viêm bàng quang cấp thông thường. Để tránh viêm thận bể thận cấp dễ gây sảy thai cần điều trị sớm. Nên cấy nước tiểu trước khi dùng kháng sinh. Cần lựa chọn kháng sinh không ảnh hưởng đến thai nhi. Thời gian điều trị cũng nên kéo dài hơn, trung bình là 1 tuần lễ. Khi có vi khuẩn niệu ≥ 105/ml thì dù không có triệu chứng lâm sàng vẫn cần được điều trị. Vì vậy nên chủ động xét nghiệm nước tiểu và cấy nước tiểu khi khám thai định kỳ, đặc biệt là ở những thai phụ đã có tiền sử nhiễm khuẩn tiết niệu để khẳng định có vi khuẩn niệu (+) hay không.
2.2.2. Điều trị:
Có thể dùng một trong những thuốc sau:
– Cephalexin: viên 500 mg, uống 1-2 viên/lần, 2 lần/ngày cách nhau 12 giờ trong 7 ngày.
– Amoxycillin + Clavulanate: viên 625 mg, uống 1 viên/lần, 2 lần/ngày cách nhau 12h trong 7 ngày.
– Nếu cấy có vi khuẩn niệu (+), lựa chọn theo kháng sinh đồ.
– Tránh sử dụng nhóm fluoroquinolones và Trimethoprim-Sulfamethoxazol do các thuốc này có nguy cơ gây quái thai và ảnh hưởng đến thai nhi ngay cả ở những tháng cuối của thai kỳ. Cũng không dùng nitrofurantoin ở 3 tháng cuối thai kỳ vì có nguy cơ tan huyết sơ sinh.
– Uống đủ nước và không nhịn tiểu cũng là rất cần thiết.
2.3. Chẩn đoán và điều trị viêm bàng quang cấp ở nam giới:
2.3.1. Chẩn đoán:
Chẩn đoán viêm bàng quang cấp ở nam giới cũng dựa vào các triệu chứng lâm sàng và cận lâm sàng như viêm bàng quang cấp thông thường ở nữ giới. Điều quan trọng là cần tìm nguyên nhân liên quan như viêm tuyến tiền liệt, viêm tinh hoàn, mào tinh hoàn … để có lựa chọn kháng sinh và thời gian điều trị cho thích hợp. Khi chưa rõ có nguyên nhân liên quan, thời gian dùng thuốc cũng nên kéo dài hơn.
2.3.2. Điều trị:
Nên ưu tiên dùng nhóm quinolone vì thuốc có khả năng thâm nhập vào mô tuyến tiền liệt tốt nhất. Có thể dùng một trong những thuốc sau:
– Trimethoprim – sulfamethoxazol: viên 480 mg, uống 2 viên/lần, 2 lần/ngày trong 7-10 ngày.
– Cephalexin: viên 500 mg, uống 2 viên/lần, 2 lần/ngày trong 7-14 ngày.
– Amoxycillin + Clavulanate: viên 1000 mg, uống 1 viên/lần, 2 lần/ngày trong 7-14 ngày.
– Norfloxacin viên 400 mg, uống 1 viên/lần, 2 lần/ ngày trong 7-14 ngày.
– Uống đủ nước và không nhịn tiểu quá 6 giờ.
– Nếu phát hiện được các nguyên nhân như: viêm tuyến tiền liệt cấp hoặc mạn tính … sẽ có phác đồ điều trị riêng.
2.4. Chẩn đoán và điều trị viêm bàng quang cấp biến chứng:
2.4.1. Chẩn đoán:
Chẩn đoán dựa vào các triệu chứng lâm sàng và cận lâm sàng như viêm bàng quang cấp thông thường.
– Phát hiện được một trong các nguyên nhân thuận lợi thường gặp: tắc nghẽn đường bài niệu (sỏi, u, nước tiểu tồn dư > 100 ml, bàng quang thần kinh, đặt sonde bàng quang hoặc soi bàng quang, can thiệp niệu đạo (vi khuẩn bệnh viện kháng thuốc), đái tháo đường, suy giảm miễn dịch…)
– Cần cấy nước tiểu trước khi dùng kháng sinh. Khi có triệu chứng lâm sàng tiểu buốt, tiểu rắt thì số lượng bạch cầu niệu < 104 bạch cầu/ml và vi khuẩn niệu < 105 vi khuẩn/ml vẫn được chẩn đoán là nhiễm khuẩn tiết niệu, nhất là khi có nguyên nhân thuận lợi hoặc những vi khuẩn ít gặp (tụ cầu vàng, trực khuẩn mủ xanh…).
– Thời gian dùng kháng sinh cũng cần kéo dài hơn.
2.4.2. Điều trị:
Có thể dùng một trong những thuốc sau:
– Các thuốc nhóm quinolon, viên 400 mg, 500 mg, uống 1 viên/lần, 2 lần/ ngày trong 10- 14 ngày.
– Amoxycilline + Clavulanate viên 1 gram, uống 1 viên/lần, 2 lần/ ngày trong 10- 14 ngày.
– Nếu nước tiểu có vi khuẩn niệu (+) sẽ dùng kháng sinh theo kháng sinh đồ.
* Điều trị loại bỏ nguyên nhân thuận lợi nếu có thể loại bỏ được:
– Lấy sỏi, u…
– Rút sonde hoặc thay sonde bàng quang…
* Uống đủ nước và không nhịn tiểu quá 6 giờ.
2.5. Chẩn đoán và điều trị viêm bàng quang cấp hay tái phát
2.5.1. Chẩn đoán
Chẩn đoán viêm bàng quang cấp hay tái phát khi có viêm bàng quang cấp ≥ 4 lần trong năm. Nếu cấy vi khuẩn thì thường gặp cùng một loại vi khuẩn gây bệnh. Khi có viêm bàng quang cấp hay tái phát cũng cần phải tìm kiếm các nguyên nhân thuận lợi đi kèm.
2.5.2. Điều trị
Sau điều trị đợt kháng sinh như viêm bàng quang cấp thông thường, nên xem xét việc tiếp tục điều trị duy trì. Có thể dùng một trong các phác đồ sau:
– Dùng một liều kháng sinh trước hoặc sau quan hệ tình dục. Ví dụ:
+ Trimethoprim- sulfamethoxazol viên 480 mg, uống 1 viên.
+ Noroxin viên 400 mg uống ½ viên
+ Nitrofurantoin viên 100 mg uống 1 viên.
– Dùng kháng sinh liều thấp hàng ngày, vào buổi tối trước khi đi ngủ, kéo dài 3 tháng hoặc hơn.
+ Trimethoprim- sulfamethoxazol viên 480 mg uống ½ viên.
+ Nitrofurantoin viên 50 mg: uống 1 viên
+ Cephalexin viên 250 mg: uống 1 viên.
+ Norfloxacin viên 400 mg uống ½ viên.
+ Ciprofloxacin viên 250 mg uống ½ viên.
Uống nhiều nước để nước tiểu ít nhất > 1,5 lít/ 24h và không nhịn tiểu quá 6 giờ là rất quan trọng.
2.6. Một số tác dụng phụ của thuốc và tương tác thuốc:
– Nhóm fluoroquinolon: Không dùng nhóm quinolon cho phụ nữ có thai, cho con bú, trẻ em dưới 15 tuổi, người có tiền sử co giật và có tiền sử dị ứng với thuốc. Thận trọng dùng Peflacin ở người bệnh có suy gan nặng.
– Nhóm beta-lactam: Thuốc có khả năng gây sốc phản vệ nên chống chỉ định khi có tiền sử dị ứng với penicilin hoặc các thuốc trong nhóm. Giảm liều khi mức lọc cầu thận < 30 ml/1 phút đối với những sản phẩm có acid clavulanic và sulbactam.
– Nhóm sulfamid: Thuốc ít có tác dụng phụ. Đôi khi có phản ứng dị ứng nặng kiểu hội chứng Steven-Johnson, giảm bạch cầu hạt. Chống chỉ định dùng thuốc khi có suy gan, suy thận nặng, phụ nữ có thai, quá mẫn cảm với thuốc.
2.7. Tiên lượng:
– Đối với thể viêm bàng quang cấp thông thường: Có tiên lượng tốt, bệnh thường khỏi hẳn sau một liệu trình kháng sinh ngắn phù hợp. Tuy nhiên vi khuẩn vẫn có khả năng ngược dòng lên niệu quản, bể thận, thận gây viêm thận, bể thận cấp, một tình trạng cấp cứu nội khoa. Bệnh cũng có thể tái phát. Nếu viêm tái phát từ 4 lần trở lên trong 1 năm thì cần có thái độ điều trị dự phòng. Khi viêm kéo dài hoặc hay tái phát để lại nhiều sẹo xơ được chẩn đoán là viêm bàng quang mạn tính.
– Đối với thể viêm bàng quang cấp có nguyên nhân thuận lợi biến chứng thì tiên lượng dè dặt hơn. Bên cạnh việc điều trị kháng sinh chống nhiễm khuẩn, cần điều trị loại bỏ nguyên nhân thuận lợi nếu có thể điều trị được thì mới có tiên lượng tốt. Liệu pháp kháng sinh chống nhiễm khuẩn đòi hỏi dài ngày hơn.
Tài liệu tham khảo:
1. Bệnh học nội khoa tập 1, 2012. Nhà xuất bản Y học.
2. Hướng dẫn điều trị nhiễm khuẩn đường tiết niệu ở Việt Nam, 2013. Hội thận học Việt Nam.
3. Robert B. Taylor, 1997. Manual of Family Practice. First edition. Little, Brown and Company, Boston Massachusetts.
4. Massry & Glassock’s, 2002. Text book of Nephrology. Fourth edition. Lippincott Williams & Wilkins.
5. Therapeutic Guidelines Antibiotic, 2010. Version 14. Therapeutic Guidelines Limited, Melbourne.
6. Grabe M., Bjerklund – Johansen T.E., H Botto et al, 2012. Guidelines on Urological Infections. European Association of Urology.
VIÊM NIỆU ĐẠO CẤP KHÔNG DO LẬU
Viêm niệu đạo cấp có thể do nguyên nhân nhiễm khuẩn, ký sinh trùng, virus hoặc nguyên nhân cơ học.
Viêm niệu đạo cấp có thể là tổn thương đơn độc hoặc phối hợp với viêm bàng quang, viêm thận bể thận, viêm tiền liệt tuyến, viêm tinh hoàn và mào tinh hoàn.
1. NGUYÊN NHÂN:
Nguyên nhân viêm niệu đạo được chia làm hai nhóm: Viêm niệu đạo do lậu và không do lậu.
Các nguyên nhân gây viêm niệu đạo không do lậu thường gặp là:
– Chlamydia trachomatis
– Mycoplasma genitalium
– Trichomonas vaginalis
– Candida albicans
– Herpes simplex virus
– Streptococcus
– Staphylococcus saprophyticus
– Escherichia coli
2. CHẨN ĐOÁN XÁC ĐỊNH:
a) Lâm sàng:
Chẩn đoán xác định có viêm niệu đạo dễ, chủ yếu dựa vào lâm sàng. Soi và cấy dịch niệu đạo để biết loại vi khuẩn, nấm giúp lựa chọn kháng sinh.
– Có tiền sử mới có quan hệ tình dục từ vài ngày đến vài tuần hoặc không.
– Xuất hiện chảy mủ, dịch niệu đạo.
– Tiểu buốt hoặc nóng rát khi đi tiểu.
b) Cận lâm sàng:
– Soi dịch niệu đạo: Nhiều bạch cầu, có thể thấy vi khuẩn, nấm.
– Cấy dịch niệu đạo hoặc nước tiểu đầu bãi: Có vi khuẩn, nấm.
– Đối với Chlamydia: Chẩn đoán xác định có thể dựa vào phản ứng huyết thanh dương tính, vì nuôi cấy khó khăn.
3. ĐIỀU TRỊ:
Tùy từng tác nhân gây bệnh mà vấn đề lựa chọn thuốc điều trị có khác nhau.
a) Điều trị người bệnh nhiễm Chlamydia và Mycoplasma:
Có thể lựa chọn một trong các thuốc sau:
– Azithromycin viên 1 gram, uống liều cao nhất.
– Doxycyclin 100 mg/lần, uống 2 lần/ngày, khoảng cách giữa các lần đưa thuốc 12 giờ, thời gian dùng thuốc 7 ngày.
– Ofloxacin 300 mg/lần, uống 2 lần/ngày, khoảng cách giữa các lần đưa thuốc 12 giờ, thời gian dùng thuốc 7 ngày.
– Erythromycin 500 mg/lần, uống 4 lần/ngày, khoảng cách giữa các lần đưa thuốc 6 giờ, thời gian dùng thuốc 14 ngày.
Điều trị cho cả người cùng quan hệ tình dục và người bệnh. Trong các thuốc điều trị thì Doxycycline và Azithromycin là lựa chọn ưu tiên.
b) Điều trị người bệnh nhiễm Trichomonas:
Thuốc lựa chọn là metronidazol, dùng 1 trong 2 phác đồ sau:
– Metronidazol 500 mg/lần, uống 2 lần/ngày, khoảng cách giữa các lần đưa thuốc 12 giờ, thời gian dùng thuốc 7 ngày.
Điều trị cho cả người cùng quan hệ tình dục và người bệnh.
c) Điều trị người bệnh viêm niệu đạo do nấm:
Nấm Candida albicans rất thường gặp gây viêm âm đạo. Tuy nhiên viêm niệu đạo do nấm ít gặp.
Thuốc điều trị chống nấm có thể lựa chọn là:
– Fluconazol viên 50 mg, 150 mg.
Cách dùng:
+ Uống một liều duy nhất 150 mg.
+ Điều trị cho cả người bệnh và người cùng quan hệ tình dục.
+ Điều trị dự phòng nấm âm đạo tái phát (nguồn lây ): Liều 150 mg uống 1 lần trong tháng, thời gian dự phòng 6 – 12 tháng.
– Itraconazol viên 100 mg, ngày uống 2 viên, 1 lần trong ngày (sau bữa ăn), trong 3 – 5 ngày.
Các thuốc chống nấm hiếm khi gây dị ứng. Tuy nhiên tác dụng độc với gan, thận đã được ghi nhận. Vì vậy cần theo dõi chức năng gan, thận khi dùng thuốc.
d) Điều trị viêm niệu đạo do các vi khuẩn thông thường:
– Lựa chọn điều trị tương tự như điều trị viêm bàng quang cấp. Tốt nhất là điều trị dựa vào kháng sinh đồ. Nếu không có kết quả cấy vi khuẩn: Lựa chọn một trong các thuốc trong nhóm kháng sinh fluoroquinolone, beta-lactam, trimethoprim-sulfamethoxazol với liệu trình ngắn từ 3 – 5 ngày.
– Cần giữ vệ sinh bộ phận sinh dục ngoài và điều trị phối hợp viêm âm đạo.
e) Điều trị viêm niệu đạo cấp phối hợp với viêm tiền liệt tuyến, viêm tinh hoàn…
Những tình trạng viêm phối hợp này thường nặng hơn so với viêm niệu đạo cấp thông thường. Điều trị như điều trị viêm tiền liệt tuyến, viêm tinh hoàn.
4. TIÊN LƯỢNG:
Viêm niệu đạo cấp thường khỏi hẳn nếu được điều trị từ sớm và đúng. Nếu không được điều trị từ sớm có thể dẫn tới viêm bàng quang hoặc viêm thận bể thận.
Tài liệu tham khảo:
1. Bệnh học nội khoa tập 1, 2012. Nhà xuất bản Y học.
2. Hướng dẫn điều trị nhiễm khuẩn đường tiết niệu ở Việt Nam, 2013. Hội thận học Việt Nam.
3. Robert B, Taylor, 1997. Manual of Family Practice. First edition. Little, Brown and Company, Boston Massachusetts.
4. Massry & Glassock’s, 2002. Text book of Nephrology. Fourth edition. Lippincott Williams & Wilkins.
5. Therapeutic Guidelines Antibiotic, 2010. Version 14. Therapeutic Guidelines Limited, Melbourne.
6. Grabe M., Bjerklund – Johansen T.E., H Botto et al, 2012. Guidelines on Urological Infections. European Association of Urology.
VIÊM ỐNG KẼ THẬN CẤP
1. ĐẠI CƯƠNG
Viêm ống kẽ thận cấp là bệnh lý thường gặp gây nên suy thận cấp, còn được gọi là hoại tử ống thận cấp (acute tubular necrosis) hoặc là viêm kẽ thận cấp (acute interstitial nephritis). Tổn thương chủ yếu của bệnh lý này là hoại tử liên bào ống thận, là một bệnh lý nặng và tỷ lệ tử vong còn rất cao nếu không được xử trí một cách kịp thời và có hiệu quả.
Mã số (theo ICD 10): N10
2. NGUYÊN NHÂN
Có rất nhiều nguyên nhân gây nên viêm ống kẽ thận cấp nhưng tập trung có thể chia làm 3 nhóm lớn:
a) Hoại tử ống thận cấp sau thiếu máu.
Tất cả những nguyên nhân nào mà làm cho sự tưới máu thận giảm sút kéo dài đều có thể làm cho thận thiếu máu và gây nên thương tổn dưới dạng hoại tử ống thận.
Nguyên nhân giảm tưới máu thận được chia làm 2 nhóm:
* Nguồn gốc trước thận
– Sốc giảm thể tích máu: sau mổ, sau chấn thương, bỏng, sẩy nạo thai, mất nước, mất muối.
– Sốc nhiễm khuẩn, nhiễm độc.
– Sốc tim.
* Nguồn gốc tại thận
Thường gặp nhất là do những tác dụng ngoại ý của một số thuốc khi sử dụng trên một số cơ địa đặc biệt như thuốc kháng viêm không stéroids, thuốc hạ huyết áp, thuốc ức chế men chuyển khi sử dụng ở người bệnh hẹp động mạch thận hai bên.
b) Hoại tử ống thận cấp do ngộ độc
Có thể trực tiếp lên tế bào ống thận hoặc gián tiếp lên cơ chế mạch máu và từ đó gây thiếu máu thận.
* Thuốc
– Các thuốc kháng sinh, nhất là nhóm Aminosides.
– Các sản phẩm iod cản quang.
– Các thuốc chống U: Ciplastine, Cyclosporine, Interféron.
– Một số thuốc khác như Phenylbutazone các thuốc gây mê (methoxyfluzan).
* Một vài sắc tố nội sinh như huyết sắc tố (Hb), sắc tố cơ (myoglobin)
* Các hóa chất thường dùng như Tétra Cloruacarbon (CCl4), cồn Mêtylic.
* Độc tố của sinh vật:
– Mật cá trắm, cá mè, cá chép.
– Mật cóc.
c) Dị ứng
Còn gọi là viêm thận kẻ cấp dị ứng (NIA immuno-allergique) nguyên nhân do thuốc là thường gặp: Méthicilline, Pénicilline, kháng viêm không Stéroides, thuốc lợi tiểu, Cimétidine.
3. LÂM SÀNG VÀ CẬN LÂM SÀNG
a) Lâm sàng
Lâm sàng của viêm ống kẽ thận cấp biểu hiện là một hội chứng suy thận cấp đôi khi kèm theo với bệnh cảnh của một viêm gan cấp (gặp trong bệnh nguyên ngộ độc).
Tình huống để phát hiện bệnh viêm ống thận cấp rất khác nhau: thường được phát hiện là triệu chứng thiểu, vô niệu, đôi khi được phát hiện qua một biến chứng nặng như ứ dịch ngoại bào (tăng huyết áp, phù phổi) hoặc những rối loạn nước điện giải khác hoặc bệnh cảnh của hội chứng tăng urê máu.
Lâm sàng trải qua 5 giai đoạn:
* Giai đoạn tấn công thận
Thời gian của giai đoạn này tùy thuộc vào nguyên nhân: cấp và đột ngột (sốc, xuất huyết) hoặc chậm và kéo dài (kháng sinh độc với thận).
* Giai đoạn thiểu, vô niệu ban đầu
Xuất hiện trong 24 đến 72 giờ sau đó. Lâm sàng biểu hiện:
– Ứ dịch ngoại bào (tăng cân, phù ngoại biên, khó thở gắng sức)
– Tăng nitơ phi protein: dấu hiệu toàn thân, rối loạn tiêu hóa, đôi khi là những chấm xuất huyết dưới da.
* Giai đoạn thiểu vô niệu thật sự
Thời gian thay đổi từ 7 đến 21 ngày. Lâm sàng của giai đoạn này là hội chứng tăng urê máu cấp điển hình.
* Giai đoạn tiểu nhiều
Thường xuất hiện khoảng tuần thứ ba của vô niệu, có khi sớm hơn, lượng nước tiểu tăng lên dần. Trong giai đoạn này đôi khi còn cần thiết phải lọc máu, nhưng quan trọng hơn là bù lại lượng dịch, điện giải mất.
* Giai đoạn phục hồi chức năng thận.
Urê, créatinine máu trở lại bình thường hoặc trở lại với trị số trước đây chưa có suy thận cấp.
Ngoài ra trên lâm sàng của viêm ống kẽ thận cấp cũng cần lưu ý những thể vẫn có lượng nước tiểu, không thiểu và vô niệu, đặc điểm của thể này là:
– Chẩn đoán thường chậm.
– Thương tổn thận thường ít nặng, tiên lượng thường tốt.
– Đây là thể thường gặp khi sử dụng sớm lợi tiểu Furosémide và hoặc dãn mạch.
– Điều trị lọc máu, dinh dưỡng cũng giống như thể vô niệu.
b) Cận lâm sàng
Ngoài những xét nghiệm tìm nguyên nhân còn có những xét nghiệm để xác định suy thận cấp, bao gồm:
-Tăng urê, créatinin máu.
– Rối loạn nước điện giải: tăng Kali máu, hạ Natri máu, hạ Calci máu, tăng phosphat máu là những rối loạn thường gặp trong suy thận cấp.
– Rối loạn toan kiềm: nhiễm toan.
4. CHẨN ĐOÁN
a) Chẩn đoán xác định dựa vào
– Khởi phát bệnh cấp tính.
– Có yếu tố nguyên nhân của viêm ống kẽ thận cấp.
– Lâm sàng với thiểu, vô niệu lúc khởi đầu và có giai đoạn tiểu nhiều sau đó.
-Xét nghiệm urê, créatinin, kali máu tăng dần.
b) Chẩn đoán phân biệt
Cần chẩn đoán phân biệt với các nguyên nhân gây suy thận cấp khác như viêm cầu thận cấp, sỏi tắc niệu quản.
5. ĐIỀU TRỊ
Bao gồm điều trị triệu chứng, điều trị nguyên nhân và biến chứng của viêm ống kẽ thận cấp (tùy thuộc vào giai đoạn của viêm ống kẽ thận cấp để áp dụng cụ thể).
a) Trong giai đoạn sớm (giai đoạn tấn công thận).
Xử trí ngay các nguyên nhân gây viêm ống thận cấp:
– Loại bỏ chất độc trong nguyên nhân do ngộ độc.
– Bù dịch, bù máu trong hoại tử ống thận cấp sau thiếu máu, bằng cách:
+ Điều chỉnh ngay hạ huyết áp bằng cách truyền các dịch keo (albumin, plasma) hoặc muối đẳng trương.
+ Các thuốc tác dụng vận mạch: dopamin liều 3µg/kg/phút để cải thiện dòng máu thận.
b) Giai đoạn đái ít vô niệu
Mục đích cơ bản trong giai đoạn này là:
– Giữ cân bằng nội môi
– Hạn chế tăng kali máu
– Hạn chế tăng urê máu
* Nước
Ở người bệnh vô niệu đảm bảo cân bằng âm nghĩa là lượng nước vào ít hơn lượng nước ra. Thông thường cho khoảng 500ml nước kể cả ăn lẫn uống. Trong những trường hợp vô niệu do mất nước mất muối thì phải bù dịch.
* Điện giải và toan máu
– Điều trị tăng Kali máu
+ Hạn chế đưa Kali từ ngoài vào: rau quả nhiều kali, thuốc dịch truyền có kali
+ Loại bỏ các ổ hoại hoại tử, chống nhiễm khuẩn.
+ Lợi tiểu: nhằm đào thải nước điện giải, đặc biệt là kali, được chỉ định khi không có bằng chứng có tắc nghẻn sau thận, bắt đầu có thể dò liều bằng Lasix 20mg x 4 ống tiêm tĩnh mạch, có thể cho liều cao 200mg – 500mg/ 24 giờ.Liều rất cao có thể được chỉ định như Furosémide 1000mg/24 giờ bằng truyền chậm qua bơm tiêm điện. Ngoài furosemide có thể sử dụng bumétamide hoặc acide etacrynic.
+ Truyền natribicacbonat
Có thể truyền natribicacbonat 1,4% hoặc 4,2% khi người bệnh còn có nước tiểu. Có thể tiêm, truyền tĩnh mạch natribicacbonat 8,4% trong trường hợp cần hạn chế lượng nước đưa vào cho người bệnh. Bù Natri bicacbonat giúp cải thiện toan máu, từ đó hạn chế việc di chuyển kali từ nội bào ra ngoại bào.
+ Truyền glucose ưu trương kèm insulin tác dụng nhanh nhằm đẩy kali vào khu vực nội bào.
+ Cho Canxi tiêm tĩnh mạch chậm trong các trường hợp tăng kali máu nặng, cấp cứu (nhất là có biểu hiện tim mạch).
+ Résin trao đổi ion như resonium, Kayexalat (30 gam/24 giờ) để thải kali qua đường phân.
+ Nếu kali máu ≥ 6,5 mmol/l thì cần chỉ định lọc máu ngoài thận.
* Điều trị các rối loạn điện giải khác
+ Natri và clo: Natri máu hạ thường là do ứ nước. Tốt nhất là hạn chế nước. Khi Natri máu hạ nhiều cần phải bù Natri.
+ Canxi: Trong viêm ống kẽ thận cấp ít khi có hạ Canxi máu. Nếu có xuất hiện Tétani do hạ Canxi máu có thể cho Canxi clorua hoặc Canxi gluconate.
* Điều trị tăng urê máu
– Chế độ ăn giảm đạm, đủ calo ít nhất là 35 kcalo/kg / 24 giờ, đủ vitamin.
– Các thuốc tăng đồng hóa prôtide như Durabolin 25mg/ngày, Testosteron 25mg/ngày.
– Bổ sung thêm viên ketosteril: 1 viên 600mg cho 5 kg cân nặng/ ngày.
– Loại bỏ các ổ nhiễm khuẩn
– Chỉ định lọc máu: nên chỉ định lọc máu sớm bằng thận nhân tạo hoặc thẩm phân màng bụng. Chỉ định lọc máu khi:
+ Kali máu ≥ 6,5 mmol/
+ Urê máu > 35mmol/l
+ Créatinin máu > 600 µmol/l.
+ Có biểu hiện toan máu.
c) Trong giai đoạn tiểu nhiều
Ở giai đoạn này, tuy tiểu nhiều nhưng chức năng thận chưa hồi phục. Những ngày đầu của giai đoạn tiểu nhiều nồng độ urê, créatinin máu còn tăng nên điều trị tăng urê máu giống như giai đoạn tiểu ít và vô niệu.Trong giai đoạn này, vì tiểu nhiều nên gây mất nước mất điện giải. Điều trị nhằm:
– Tiếp tục hạn chế prôtid trong thức ăn, chỉ tăng prôtid khi urê máu đã giảm ở mức an toàn (10 mmol/l).Cho chế độ ăn uống có kali (hoa quả) khi kali máu bình thường.
– Truyền dịch hoặc uống để chống mất nước, mất điện giải. Trong trường hợp lượng nước tiểu > 3lít/24 giờ cần bù bằng đường truyền tĩnh mạch. Lượng dịch bù tùy theo lượng nước tiểu. Sau 5 – 7 ngày tiểu nhiều có thể hạn chế dần lượng dịch truyền và theo dỏi vì lúc này thận đã bắt đầu hồi phục chức năng cô đặc.
d) Trong giai đoạn hồi phục
– Trung bình sau 4 tuần điều trị thì chức năng thận bắt đầu hồi phục tốt và người bệnh có thể xuất viện.
– Cần theo dõi định kỳ hàng tháng cho đến khi chức năng thận hồi phục hoàn toàn.
– Khi urê máu trở về bình thường thì tăng dần khẩu phần prôtid, đảm đủ calo, vitamin để đảm bảo hồi phục sức khỏe tốt.
e) Điều trị nguyên nhân.
Tùy thuộc vào nguyên nhân gây ra viêm ống kẽ thận cấp.
– Điều trị kháng sinh trong nguyên nhân nhiễm khuẩn.
– Loại bỏ chất độc trong nguyên nhân ngộ độc.
– Ngừng các thuốc kháng viêm không stéroids, thuốc ức chế men chuyển,
Các thuốc kháng sinh, Các sản phẩm iod cản quang, Các thuốc chống U: Ciplastine, Cyclosporine, Interféron, Phenylbutazone… nếu nguyên nhân do thuốc.
– Điều tri sốt rét trong sốt rét tiểu huyết sắc tố….
Tài liệu tham khảo:
1. Giáo trình Bệnh học Nội khoa, 2008. Bộ Môn Nội – Trường Đại học Y Dược Huế, NXB Y học
2. Bài Giảng Bệnh học Nội khoa, 2003. Các Bộ môn Nội- Trường Đại học Y Hà nội, NXB Y học.
3. Néphrologie, 2005. Collège Universitaire Des Enseignants De Néphrologie, nouvelle édition, Ellipses.
4. Harrison’s Principles of Internal Medicine, 2005. 16th edition.
5. Wolters Kluwer, Lippincott Williams & Wilkins, 2010. The Washington Manual of Medical Therapeutics, 33rd Edition.
VIÊM TUYẾN TIỀN LIỆT CẤP
Viêm tuyến tiền liệt cấp tính là một tình trạng nhiễm khuẩn nặng, thường đi kèm với viêm bàng quang cấp tính. Vì vậy triệu chứng lâm sàng cũng giống như viêm bàng quang cấp nhưng thường kèm theo có sốt cao, thậm chí có thể gây nhiễm khuẩn huyết. Vì vậy, viêm tuyến tiền liệt cấp tính cần được điều trị sớm và đúng, đủ liều thuốc và đủ thời gian.
1. NGUYÊN NHÂN
Viêm tuyến tiền liệt cấp tính thường do vi khuẩn gram (-). Các loại vi khuẩn thường gặp là:
+ Escherichia coli
+ Proteus mirabilis
+ Klebsiella
+ Staphylococus saprophyticus
+ Pseudomoras aeruginosa
+ Staphylococus aereus
2. CHẨN ĐOÁN
a) Lâm sàng
– Các triệu chứng lâm sàng gồm có:
+ Tiểu buốt, tiểu dắt, tiểu khó.
+ Có thể có tiểu máu, tiểu mủ hoặc dịch, mủ niệu đạo.
+ Đau vùng niệu đạo, tầng sinh môn.
– Các triệu chứng khác:
+ Thường có sốt cao, kèm theo gai rét.
+ Tuyến tiền liệt: to và đau vì vậy khi khám nên nhẹ nhàng.
b) Cận lâm sàng
– Xét nghiệm nước tiểu:
+ Có bạch cầu niệu dương tính.
+ Cấy nước tiểu hoặc dịch niệu đạo tìm vi khuẩn gây bệnh, nếu kết quả dương tính thì làm kháng sinh đồ.
– Xét nghiệm máu:
+ Bạch cầu máu tăng.
+ Cấy máu khi có sốt cao hoặc nghi có nhiễm khuẩn huyết.
– Siêu âm: Có thể phát hiện thành bàng quang dày, tuyến tiền liệt to hơn bình thường. Trong trường hợp người bệnh > 40 tuổi có phì đại lành tính tiền liệt tuyến thì khó đánh giá.
3. ĐIỀU TRỊ
a) Nguyên tắc
– Điều trị ngay khi có chẩn đoán viêm tuyến tiền liệt cấp tính.
– Nếu người bệnh có sốt cao nên điều trị kháng sinh đường tĩnh mạch và phối hợp 2 loại kháng sinh trong những ngày đầu
– Thời gian dùng kháng sinh tối thiểu là 14 ngày, có thể kéo dài trên 3 tuần nếu cần thiết.
– Nếu có nhiễm khuẩn huyết thì đồng thời việc điều trị kháng sinh cần bù đủ dịch, cho thêm thuốc giảm đau non- steroids nếu cần.
b) Các kháng sinh có thể lựa chọn một trong các nhóm thuốc sau:
– Ưu tiên nhóm quinolon khi chưa có kết quả cấy vi khuẩn.
+ Levofloxacin viên 500 mg, uống 1 viên/lần x 1 lần/ngày 14- 28 ngày,
Hoặc:
+ Nofloxacin viên 400 mg, uống 1 viên/lần, 2 lần/ngày trong 14 – 28 ngày
+ Ofloxacin viên 200 mg, uống 1 viên/lần, 2 lần/ngày trong 14 – 28 ngày.
– Nhóm Trimethoprim Sulfamethoxazol vẫn có thể được lựa chọn.
– Nếu cần phối hợp 2 kháng sinh, có thể phối hợp nhóm quinolon với Cephalosporin thế hệ 3 – 4 hoặc Amoxicilline + clavulanate.
c) Điều trị hỗ trợ
– Đủ nước để nước tiểu đạt khoảng 2 lít/ 24h.
– Giảm đau non – steroid nếu cần
– Chú ý khi có bí tiểu bàng quang căng: Không đặt thông tiểu. Nếu thật cần thiết sẽ mở thông bàng quang trên xương mu để tránh khả năng gây nhiễm khuẩn huyết.
4. TIÊN LƯỢNG
Viêm tiền liệt tuyến cấp tính do vi khuẩn là một tình trạng nhiễm khuẩn nặng. Tuy nhiên nếu được điều trị sớm, đúng, đủ liều và đủ thời gian dùng thuốc thì bệnh vẫn có thể khỏi hoàn toàn. Nếu điều trị không kịp thời, vi khuẩn kháng thuốc… có thể diễn biến thành viêm tuyến tiền liệt mạn tính.
Tài liệu tham khảo
1. Bệnh học nội khoa tập 1, 2012. Nhà xuất bản Y học.
2. Hướng dẫn điều trị nhiễm khuẩn đường tiết niệu ở Việt Nam, 2013. Hội thận học Việt Nam.
3. Taylor RB, 1997. Manual of Family Practice. First edition. Little, Brown and Company, Boston Massachusetts.
3. Massry & Glassock’s, 2002. Text book of Nephrology. Fourth edition. Lippincott Williams & Wilkins.
4. Therapeutic Guidelines Antibiotic-Version 14, 2010. Therapeutic Guidelines Limited, Melbourne.
5. Grabe M., Bjerklund – Johansen TE, Botto H et al., 2012. Guidelines on Urological Infections. European Association of Urology.
NANG ĐƠN THẬN
1. ĐẠI CƯƠNG
Nang đơn thận là một khối dịch bất thường tại thận, có thể xuất hiện ở một hoặc hai bên thận. Nang thận thường tròn, dịch trong và không thông với đài bể thận.
Nang đơn thận khác với các nang thận ở bệnh thận đa nang, nguyên nhân do rối loạn về di truyền. Nang đơn thận không phát triển ở toàn bộ thận, thay thế cấu trúc bình thường của thận, không phải là nguyên nhân làm giảm chức năng thận như ở những người bị thận đa nang.
Nang đơn thận thường gặp ở người có tuổi. Khoảng 25% người trên 40 tuổi và 50% người trên 50 tuổi có nang đơn thận và tới trên 90 % ở những người trên 70 tuổi.
2. NGUYÊN NHÂN
Các nang thận có thể xuất hiện tại vùng vỏ thận, vùng tủy thận nhu mô thận. Nguyên nhân của nang đơn thận đến nay vẫn chưa được biết rõ. Có sự phá hủy cấu trúc của các ống thận hoặc thiếu máu cung cấp cho thận có thể là nguyên nhân gây nang thận . Túi thừa từ ống thận có thể tách ra tạo thành nang thận. Không thấy vai trò của gen trong hình thành và phát triển nang đơn thận.
3. CHẨN ĐOÁN
a) Lâm sàng
– Nang đơn thận thường không có triệu chứng hoặc gây ảnh hưởng tới thận.
– Tuy nhiên, trong một số trường hợp có thể có đau vùng sườn hoặc hông nếu nang lớn và đè ép vào các cơ quan khác.
– Khi có nhiễm trùng nang hoặc chảy máu nang sẽ gây sốt, đau và rét run. Cơn đau có thể dữ dội giống như cơn đau quặn thận sỏi thận hoặc tắc nghẽn đài bể thận.
– Nang đơn thận không gây ảnh hưởng đến chức năng thận, nhưng một nghiên cứu đã cho thấy có sự phối hợp giữa nang thận và giảm chức năng thận ở người dưới 60 tuổi.
– Có thể có tăng huyết áp: nếu có đè ép vào động mạch thận.
b) Cận lâm sàng
Cần tiến hành một số xét nghiệm và thăm dò chức năng sau:
– Các xét nghiệm đánh giá chức năng thận: ure, creatinin, acid uric
– Tổng phân tích nước tiểu và tế bào nước tiểu: phát hiện bạch cầu niệu hoặc hồng cầu niệu khi có nhiễm trùng nang thận.
– Protein niệu: không có hoặc rất ít
– Hồng cầu niệu: có thể có tiểu máu vi thể hoặc đại thể do chấn thương, nhiễm trùng nang.
– Siêu âm: Xác định số lượng nang, kích thước và thành nang thận.
+ Nang thận trên siêu âm có hình tròn hoặc bầu dục, bờ đều, dịch trong, là khối trống âm, không có bóng cản phía sau, không thông với đài bể thận.
+ Nang thận có đậm độ echo không đồng nhất hoặc đặc echo báo hiệu có dấu hiệu của tổn thương các tính.
– Chụp thận có thuốc cản quang: Cho thấy sự đè đẩy vào nhu mô thận nếu nguyên nhân do nang thận, phân biệt với nguyên nhân gây ứ nước thận.
c) Chẩn đoán xác định
– Hầu hết các nang đơn thận được phát hiện khi làm siêu âm để chẩn đoán và thăm dò một số nguyên nhân khác. Khi phát hiện nang thận thì cần theo dõi bằng siêu âm để xác định là nang đơn thận hay một bệnh lý khác. Nang thận thường có hình tròn hoặc bầu dục, dịch trong, trống âm và có bờ rõ.
– Khi cần thiết có thể cho người bệnh chụp CT scan hoặc cộng hưởng từ để chẩn đoán phân biệt nang thận với u thận.
d) Chẩn đoán phân biệt
Cần chẩn đoán phân biệt nang đơn thận với một số bệnh lý khác sau đây:
– U thận lành hoặc ác tính
– Khối máu tụ (do chấn thương hoặc không)
– Áp xe thận
– U nang bào sán
– Bệnh nang thận thứ phát (ở các người bệnh có bệnh thận từ trước và có suy thận).
– Giả nang (u nang nước tiểu).
4. ĐIỀU TRỊ
a) Nếu nang thận dưới 3 cm và không có triệu chứng thì không cần điều trị. Cần theo dõi định kỳ nang đơn thận bằng siêu âm, xét nghiệm nước tiểu và chức năng thận định kỳ và tránh các va chạm mạnh .
b) Nang đơn thận > 6 cm hoặc gây nên triệu chứng và là nguyên nhân gây chèn ép đài bể thận và niệu quản thì có thể điều trị bằng liệu pháp gây xơ hóa: Nang thận cần được dẫn lưu hết dịch bằng kim chọc qua da dưới hướng dẫn của siêu âm sau đó bơm vào một lượng cồn tuyết đối gây xơ hóa tổ chức. Không nên chọc hút các nang ở vị trí quanh rốn thận.
c) Nếu nang thận lớn: cần phải mổ. Thường áp dụng phương pháp mổ nội soi để dẫn lưu dịch nang thận hoặc cắt bỏ.
d) Điều trị biến chứng:
+ Chảy máu:
– Nằm nghỉ
– Thuốc cầm máu (nếu cần)
– Uống đủ nước
– Nếu chảy máu nặng thì truyền máu và xem xét ngoại khoa
+ Nhiễm trùng: dùng kháng sinh (như bài viêm thận bể thận cấp).
Tài liệu tham khảo
1. Anna .M.N. and Ritz.F. “The simple renal cyst”. Nephrology Dialysis Transplantation. Vo 15 (10), pp 1702-1704.
2. CanguvenO. and all, 2009. “A New Technique for Simple Renal Cyst: Cystoretroperitoneal Shunt”. Advances in Urology, Vo 2009, Jan(1).
3. Eknoyan G, 2009. “ A clinical view of simple and complex renal cysts”. Journal Americal Society Nephrology, Sep 20 (9), pp 1874 -1876.
4. Israel, G. M. and Bosniak, M. A, 2005. “An update of the Bosniak renal cyst classification system”. Urology ,Vo 66, pp 484-488.
5. Lee CT., Yang YC., Wu JS. and all, 2013. “Multiple and large simple renal cysts are associated with prehypertension and hypertension”. Kidney International, May 83(5), pp 924 – 930.
6. Paananen I, Hellström P. and all, Jan 2001. “ Treatment of renal cysts with single-session percutaneous drainage and ethanol sclerotherapy: long-term outcome” .Urology. 57(1):30-3.
BỆNH THẬN ĐA NANG
1. ĐẠI CƯƠNG
Bệnh được đặc trưng bởi xuất hiện nhiều nang ở cả hai thận. Bệnh thận đa nang là bệnh di truyền phần lớn theo gen trội, chỉ có một tỉ lệ nhỏ theo gen lặn. Gen bệnh lý nằm ở đầu xa, nhánh ngắn của nhiễm sắc thể thứ 16. Có khoảng 10-15% bệnh nhân, rối loạn gen nằm ở nhiễm sắc thể thứ 4. Có thể còn một gen thứ 3 chưa được xác định, di truyền tính trội.
Bệnh thận nang có thể kết hợp với nang gan và các bất thường tim mạch. Bệnh thường dẫn tới suy thận giai đoạn cuối.
Sự phát sinh và phát triển nang thận phụ thuộc vào gen, môi trường. Nhiều chất hóa học hoặc thuốc có thể gây ra nang thận, bao gồm các chất chống oxy hóa (như diphenyl-thiazole và nordihydro guaiaretic acid), alloxan và steptozotoxin, lithium cloride và cis-platinium.
Có ba cơ chế chính hình thành nang thận:
+ Tắc nghẽn trong lòng ống thận.
+ Tăng sinh tế bào biểu mô ống thận.
+ Biến đổi màng đáy của ống thận.
2. TRIỆU CHỨNG
2.1. Triệu chứng
Ban đầu thường không có triệu chứng, bệnh nhân phát hiện được bệnh thường do khám sức khỏe thường kỳ, hoặc siêu âm ổ bụng vì các lý do ngoài thận. Bệnh thường được phát hiện ở tuổi trung niên.
Đau bụng hoặc đau hông lưng: khoảng 20-30% số bệnh nhân, thường tăng lên theo tuổi và kích cỡ của nang. Nếu đau cấp tính, có thể là do chảy máu trong nang, nhiễm khuẩn nang, tắc nghẽn đường tiết niệu do cục máu, sỏi.
Đau dưới hạ sườn phải có thể gặp do nang gan phối hợp.
2.2. Xét nghiệm
– Siêu âm là xét nghiệm đơn giản và dễ thực hiện đê chẩn đoán xác định, theo dõi đánh giá tình trạng nang thận và các biến chứng.
– XQ hệ tiết niệu, chup CT đánh giá các tổn thương, biến chứng của bệnh đa nang
– Xét nghiệm sinh hóa máu, nước tiểu xác định các biến chứng suy thận, nhiễm trùng, tiểu máu.
3. Các biểu hiện ngoài thận
– Biểu hiện bệnh ở gan: Có khoảng 50% bệnh nhân bị bệnh thận đa nang có nang ở gan.
– Phình mạch trong sọ: Chụp động mạch não phát hiện khoảng 10-30% bệnh nhân có phình mạch trong sọ. Tỉ lệ gặp chảy máu trong sọ gặp khoảng 2% số bệnh nhân, do vỡ phình mạch.
– Bất thường van tim: Có thể thấy bất thường ở một hoặc nhiều hơn các van tim ở 18% bệnh nhân. Van tim thấy thoái hóa tổ chức cơ, mạch máu, và collagen. Sa van hai lá, rối loạn nhịp tim, viêm màng trong tim nhiễm khuẩn, huyết khối nhĩ trái.
– Biểu hiện bệnh ở các cơ quan khác: Nang có thể thấy ở tụy và lách, tỉ lệ gặp là 10% và 5%. Đôi khi còn phát hiện nang ở thực quản, ở niệu quản, ở buồng trứng, ở não.
4. Biến chứng
– Chảy máu trong nang gây tiểu máu đại thể gặp 15-20% số bệnh nhân. Tiểu máu đại thể thường xảy ra sau các chấn thương. Chảy máu quanh thận hiếm khi xảy ra, nếu có thường do chấn thương làm vỡ nang.
– Nhiễm khuẩn: đây là lý do chionhs khiến bệnh nhân phải nhập viện. Vi khuẩn tới thận theo đường ngược dòng. Nếu nhiễm khuẩn nang, làm nang to lên và đau. Khám có thận to, ấn đau.
– Sỏi thận: tỉ lệ gặp sỏi thận 11-34% số bệnh nhân thận đa nang. Chú ý những trường hợp sỏi nhỏ trong thận thường khó chẩn đoán được và bị bỏ qua.
– Ung thư thận: Gần 50% số ca ung thư thận xảy ra ở bệnh nhân bị bệnh thận đa nang. Chủ yếu là ung thư tế bào thận, một số ít ung thư nhú thận. Chẩn đoán được ung thư thận dựa vào các triệu chứng: hồng cầu niệu, đau thắt lưng, thận to, chảy máu trong nang. Chụp CTscan, MRI, sinh thiết và xét nghiệm giải phẫu bệnh giúp cho chẩn đoán xác định.
– Tăng huyết áp: Tăng huyết áp có thể xảy ra sớm, gặp với tỉ lệ 13-20% số bệnh nhân ngay cả khi chưa có suy thận.
– Suy thận: Tiến triển đến suy thận là biến chứng thường gặp nhất ở bệnh nhân bị bênh thận đa nang.
– Giảm khả năng cô đặc nước tiểu: xảy ra sớm, mức độ giảm khả năng cô đặc nước tiểu phụ thuộc vào thể tích nang và số lượng nang. Nồng độ natri máu thường giảm nhẹ.
– Thiếu máu hay gặp ở bệnh nhân suy thận giai đoạn nặng. Tuy nhiên mức độ ít trầm trọng hơn so với bệnh nhân suy thận giai đoạn cuối do các nguyên nhân khác.
– Tăng acid uric máu do rối loạn tái hấp thu và bài tiết acid uric của ống thận.
5. Chẩn đoán xác định
Chẩn đoán bệnh thận đa nang dựa vào:
– Tiền sử gia đình
– Siêu âm thấy hai thận to, có nhiều nang kích cỡ khác nhau ở cả vùng vỏ và vùng tủy thận.
– Có nang ở gan.
– Chụp cắt lớp thận CTscan
– Kỹ thuật gen xác định bất thường ở đầu xa nhánh ngắn của nhiễm sắc thể 16.
6. Điều trị
– Nguyên tắc chung là điều trị triệu chứng và biến chứng.
– Nhiễm khuẩn thận điều trị bằng kháng sinh phù hợp
– Tăng huyết áp điều trị bằng các nhóm thuốc hạ áp
– Cắt thận nếu nang thận quá to, biến chứng tiểu máu, nhiễm trùng tái phát
– Suy thận, điều trị bảo tồn và thay thế khi suy thận giai đoạn cuối bằng lọc máu và ghép thận.
– Với những trường hợp nang không quá lớn: có thể lọc màng bụng,…
Tài liệu tham khảo
1. Hateboer N, van Dijk MA, Bogdanova N et al, 1999. “Comparison of phenotypes of polycystic kidney disease types 1 and 2” , Lancet, 353, pp.103-107
2. E Higashihara, K Nutahara and M Kojima et al, 1998. “Prevalence and renal prognosis of diagnosed autosomal dominant polycystic kidney disease in Japan”, Nephron 80, pp. 421-427
3. Amaout MA, 2011. “Cystic kidney diseases”, Cecil Medicine. 24th ed. Philadelphia, Saunders Elsevier; chap 128.
4. Porter CC, Avner Ed, 2011. “Anatomic abnormalities associated with hematuria”, Nelson Textbook of Pediatrics. 19th ed. Philadelphia, Saunders Elsevier, chap 515.
5. Torres VE, Grantham JJ, 2007. “Cystic diseases of the kidney”, Brenner and Rector’s the Kidney. 8th ed. Philadelphia, Saunders Elsevier, chap 41.
TĂNG KALI MÁU TRONG BỆNH THẬN
1. ĐẠI CƯƠNG
Kali là một ion dương nằm chủ yếu trong tế bào và có vai trò quan trọng duy trì tế bào hoạt động bình thường. Ở người bình thường kali trong tế bào chiếm 98-99% tổng lượng kali cơ thể. Sự thay đổi kali trong máu phụ thuộc vào thể tích dịch nội – ngoại bào, cân bằng acid bazo. Ngoài ra còn phụ thuộc vào quá trình chuyển hóa protit, quá trình phân bào, yếu tố tăng trưởng. Để duy trì hoạt động bình thường kali ngoài tế bào là 3,5-5 mmol/l, trong tế bào là 120-140mmol/l.
Tăng kali máu là khi nồng độ kali trong máu vượt quá 5,0 mmol/l
Điều trị tăng kali máu là một cấp cứu tích cực do nguy cơ rối loạn nhịp tim, ngừng tim gây tử vong.
2. NGUYÊN NHÂN GÂY TĂNG KALI MÁU
Một số nguyên nhân gây tăng Kali máu: do sự chuyển dịch từ nội bào ra ngoại bào, giảm bài tiết Kali do bệnh lý ở thận, do bệnh tuyến thượng thận, do thức ăn có chứa nhiều kali, do một số thuốc …
Kali từ nội bào ra ngoại bào
Kali từ nội bào ra ngoại bào làm tăng nồng độ Kali máu. Thường gặp ở những bệnh nhân nhiễm toan ceton trong bệnh tiểu đường, do sử dụng các thuốc lợi tiểu giữ Kali, digoxin, thuốc chẹn beta, và suxamethonium…
Nguyên nhân tại thận
Nguyên nhân thận bao gồm suy thận cấp hoặc mạn tính, tình trạng nhiễm toan ống thận, thận mất khả năng bài xuất Kali. Tình trạng thiếu hormon như bệnh Addison.
Nguyên nhân khác
Tăng Kali máu cũng có thể do bổ sung quá nhiều kali do thức ăn như chuối, nho, sô cô la … hoặc do truyền máu, hoặc do sử dụng thuốc ức chế men chuyển, lợi tiểu giữ kali. Các nguyên nhân nội sinh như chấn thương, tiêu cơ vân, tan máu, bỏng, hội chứng ly giải khối u.
Giả tăng Kali máu
Giả tăng kali máu là tình trạng tăng kali máu do những nguyên nhân kỹ thuật như garo quá lâu khi lấy máu (>2 phút có thể gây ra tan máu), hoặc mẫu máu lưu trữ quá lâu trước khi mang đi xét nghiệm, cũng có thể thấy ở những bệnh nhân có bệnh lý tăng bạch cầu hoặc tiểu cầu.
3. CHẨN ĐOÁN TĂNG KALI MÁU
3.1. Lâm sàng
Tăng kali máu thường không có triệu chứng. Trong một số trường hợp có thể có biểu hiện một số triệu chứng về thần kinh cơ như mệt mỏi, suy nhược, đánh trống ngực, liệt, và dị cảm. Đau ngực cũng có thể gặp, nguyên nhân do giảm tưới máu cơ tim hoặc nhịp tim nhanh, có thể tiến triển đến ngừng tim.
3.2. Cận lâm sàng
– Tăng kali máu được chẩn đoán bằng xét nghiệm điện giải đồ. Tăng kali máu được định nghĩa khi nồng độ kali máu trên 5,0 mmol/L. Tuy nhiên, trong thực tế, nồng độ kali nên được xét cùng với chức năng thận của bệnh nhân, những người suy thận mãn tính có khả năng dung nạp kali cao hơn.
– Điện tim (ECG) khi có tăng Kali máu để đánh giá nguy cơ của bệnh nhân. Các dấu hiệu chính của điện tim trong tăng kali máu:
+ Giai đoạn sớm: thường gặp là sóng T cao, nhọn (đặc biệt ở các chuyển đạo trước ngực), nhưng cũng có thể biểu hiện tăng kali máu trên điện tâm đồ đầu tiên là nhịp nhanh thất.
+ Giai đoạn muộn:
– Kéo dài khoảng PR.
– Phức hợp QRS dãn rộng.
– Nhịp nhanh thất, cuồng nhĩ, rung nhĩ.
– Vô tâm thu.
Lưu ý nếu điện tim bình thường cũng không loại trừ được sự thay đổi ở tim, phải theo dõi điện tim liên tục để phát hiện mọi biến loạn, đặt biệt nếu có kèm theo tình trạng hạ calci máu và nhiễm acid.
3.3. Những dấu hiệu cần phải cấp cứu ngay
– Điện tâm đồ: Sóng T cao nhọn, mất sóng P hoặc sóng P dẹt
– Kali > 7,0 mmol / L
– Tăng kali máu nhẹ nhưng có kèm theo các triệu chứng (đánh trống ngực, liệt, yếu cơ)
4. ĐIỀU TRỊ
4.1. Nguyên tắc chung
– Đảm bảo 3 bước ACB trong cấp cứu nói chung. Theo dõi điện tâm đồ, huyết áp và SpO2. Xét nghiệm ure, creatinin và điện giải đồ, tình trạng nhiễm acid chuyển hóa.
– Ngừng cung cấp kali dưới mọi hình thức (chế độ ăn, kali đường uống, dung dịch tĩnh mạch, nuôi dưỡng ngoài đường tiêu hóa).
– Ngừng và tránh các thuốc có chứa kali (penicillin K).
– Ngừng và tránh các thuốc giữ kali (lợi tiểu giữ kali, ức chế men chuyển angiotensin), hoặc thuốc gây tái phân phối kali (succinykholine).
– Điều trị các yếu tố làm chuyển kali ra ngoài tế bào (toan hóa máu, thiếu insulin, tăng áp lực thẩm thấu).
– Theo dõi kali huyết thanh một cách thường quy, xét nghiệm mỗi 2 giờ trong những trường hợp nặng.
– Điều trị nguyên nhân.
4.2. Điều trị cụ thể
• Điều trị cấp cứu tăng Kali máu nặng
– Thiết lập đường truyền tĩnh mạch.
– Nếu có sự thay đổi trên ECG hoặc Kali máu > 6,5 mmol/l thì cho ngay 10ml Canxi gluconate 10% đường tĩnh mạch trong 2 phút. Lập lại sau mỗi 15 phút, nhiều nhất là 5 lần cho đến khi ECG trở về bình thường (tối đa là 50ml)
– Sử dụng 10 đơn vị Insulin nhanh pha trong 50ml glucose 30% tiêm tĩnh mạch trong 10 phút.
• Điều trị phối hợp
– Trong trường hợp không đáp ứng calci, tiểu đường không thể sử dụng glucose, chỉ định Khí dung 10 mg Salbutamol, sau đó hai giờ có thể cho thêm một liều thứ hai 20 mg.
– Lợi tiểu Furocemide tiêm tĩnh mạch.
– Bù dịch nếu mất dịch, truyền Natri bicarbonate được chỉ định để điều trị tăng kali máu trong suy thận mạn tính, toan hóa máu.
– Lọc máu chỉ định khi hình ảnh điện tâm đồ bệnh lý không biến mất mặc dù đã điều trị, bệnh nhân bị tiêu cơ vân, ngộ độc digoxin, suy thận cấp, đợt cấp suy thận mạn, chấn thương, và thiểu niệu. Áp dụng ở các đơn vị y tế có phương tiện thiết bị. Chỉ định điều trị lâu dài cho mọi nguyên nhân tăng kali máu.
• Điều trị tăng kali máu mức độ nhẹ và vừa:
+ Hạt tranh chấp kali như Kayexalate, resonium A 20-30g uống mỗi 4 – 6h cùng với thuốc nhuận tràng.
+ Canxi resonium có tác dụng trao đổi canxi với kali qua thành ruột.
+ Lợi tiểu
Tài liệu tham khảo
1. Đỗ Thị Liệu, 2004. “Suy thận cấp tính”, Bệnh thận nội khoa, Nhà xuất bản y học, tr. 273 – 284.
2. Nyirenda MJ, Tang JI, Padfield PL, Seckl JR, 2009. “Hyperkalaemia”, BMJ, 339, pp. 4114
3. Slovis C, Jenkins R, 2002. “ABC of clinical electrocardiography: conditions not primarily affecting the heart”, BMJ, 324, pp.1320-3
4. B A Mahoney, W A D Smith, D S Lo, K Tsoi, M Tonelli, C M Clase, 2005. “Emergency interventions for hyperkalaemia”, Cochrane database of systematic reviews), 2, CD003235
5. A Greenberg, 1998. “Hyperkalemia: treatment option”, Seminars in nephrology, vol. 18(1), pp. 46-57
TĂNG HUYẾT ÁP TRONG BỆNH THẬN MẠN
1. MỘT SỐ ĐỊNH NGHĨA:
a) Bệnh thận mạn (BTM): khi có sự hiện diện của
– Tổn thương thận ít nhất 3 tháng bao gồm bất thường về cấu trúc hoặc chức năng thận, có thể đi kèm hoặc không với giảm mức lọc cầu thận biểu hiện bởi một trong những tiêu chuẩn sau:
+ Tổn thương mô bệnh học
+ Các dấu ấn của tổn thương thận, bao gồm những bất thường trên xét nghiệm máu hoặc nước tiểu, hoặc trên hình ảnh học
– GFR < 60ml/ph/1,73m2 trong ít nhất 3 tháng, kèm hoặc không kèm với tổn thương thận.
b) Tăng huyết áp (THA): khi HA tâm thu ≥ 140mmHg và/ hoặc HA tâm trương ≥ 90mmHg ( JNC 7)
2. ĐÁNH GIÁ:
Đánh giá người bệnh: bệnh thận mạn hay tăng huyết áp.
a) Thận trọng khi đánh giá ban đầu tình trạng người bệnh và thường xuyên tái đánh giá người bệnh rất cần thiết để điều trị hiệu quả hạ áp và sử dụng các tác nhân hạ áp ở người bệnh có bệnh thận mạn. Bởi vì bệnh thận mạn và tăng huyết áp thường xuất hiện chung và thường là không có triệu chứng.
b) Cơ chế THA ở bệnh thận mạn
– Tăng hoạt động hệ Renin angiotensin aldosterone
– Giảm khả năng bài xuất natri.
– Tăng hoạt động hệ giao cảm.
– Suy yếu khả năng dãn mạch qua trung gian tế bào nội mạc và tổng hợp nitric oxide.
3. CHẨN ĐOÁN
Hướng dẫn tiêu chuẩn đánh giá người bệnh với các điều kiện:
a) Huyết áp nên được đo ở mỗi lần khám (A).
b) Đánh giá ban đầu người bệnh nên bao gồm các yếu tố sau:
– Tình trạng bệnh thận mạn
– Phân loại, mức mức lọc cầu thận (GFR) và mức độ tiểu đạm (A)
Bảng 1: Các chỉ số cận lâm sàng để chẩn đoán bệnh thận mạn
| Tất cả người bệnh có gia tăng yếu tố nguy cơ bệnh thận mạn:
√ Creatinin huyết thanh để ước lượng mức lọc cầu thận; √ Tỉ số albumin/creatinin hay tỉ số protein/creatinin trong mẫu nước tiểu sáng sớm hay nước tiểu ngẫu nhiên. √ Xét nghiệm cặn lắng nước tiểu hay que thử nước tiểu tìm tế bào hồng cầu và bạch cầu. |
| Ở người bệnh phát hiện bệnh thận mạn:
√ Hình ảnh học thận , thường là siêu âm; √ Điện giải đồ huyết thanh (Natri, Kali, Chlor và Bicarbonat) |
– Biến chứng của giảm tốc mức lọc cầu thận (A)
– Yếu tố nguy cơ khi bệnh thận mạn tiến triển.
– Sự hiện diện của bệnh tim trên lâm sàng và các yếu tố nguy cơ tim mạch
Bảng 2: Các chỉ số giúp xác định bệnh lý tim mạch và các yếu tố nguy cơ tim mạch Ở người bệnh có bệnh thận mạn.
| √ ECG 12 chuyển đạo
√ Glucose huyết thanh √ Bilan mỡ máu √ Chiều cao và cân nặng để tính BMI |
c) Phân loại THA và phân tầng nguy cơ:
Bảng 3: Phân loại THA theo JNC VII
|
Huyết áp Phân loại |
Tâm thu (mmHg) |
Tâm trương (mmHg) |
|
| Bình thường |
<120 |
và <80 |
|
| Tiền THA |
120 – 139 |
hay 80 – 89 |
|
| THA | Giai đoạn 1 |
140 – 159 |
hay 90 – 99 |
| Giai đoạn 2 |
≥ 160 |
hay ≥ 100 |
|
Bảng 4: Phân loại HA theo ESC/ESH 2013
|
Phân loại Huyết áp |
Bình thường cao |
THA độ 1 |
THA độ 2 |
THA độ 3 |
| Tâm thu (mmHg) |
130 – 139 |
140 – 159 |
160 – 179 |
SBP ≥ 180 |
| Tâm trương (mmHg) |
Hay 85 – 89 |
hay 90 – 99 |
Hay 100 – 109 |
hay ≥110 |
Bảng 5: Phân tầng nguy cơ (NC) theo ESC/ESH 2013
|
Loại HA YTNC |
Bình thường cao |
THA độ 1 |
THA độ 2 |
THA độ 3 |
| Không YTNC |
|
NC thấp |
NC TB |
NC cao |
| 1-2 YTNC |
NC thấp |
NC TB |
NC TB – cao |
NC cao |
| ≥3 YTNC |
NC thấp – TB |
NC TB – cao |
NC cao |
NC cao |
| Tổn thương cơ quan đích, BTM giai đoạn 3 hay ĐTĐ |
NC TB – cao |
NC cao |
NC cao |
NC cao – rất cao |
| Bệnh tim mạch không triệu chứng, BTM giai đoạn ≥4 hay ĐTĐ có nhiều YTNC |
NC rất cao |
NC rất cao |
NC rất cao |
NC rất cao |
OD: tổn thương cơ quan đích; CVD: Bệnh tim mạch; CKD: bệnh thận mạn;
ĐTĐ: đái tháo đường; NC: nguy cơ; YTNC: yếu tố nguy cơ.
Bảng 6: Phân tầng nguy cơ dựa trên mức lọc cầu thận và mức độ albumin/niệu
|
Mức độ hiện diện Mức lọc cầu thận |
Bình thường – nhẹ |
Trung bình |
Nặng |
|
< 30mg/g |
30 – 300mg/g |
>300mg/g |
|
|
≥ 90 |
NC thấp |
NCTB |
NC cao |
|
60 – 89 |
NC thấp |
NCTB |
NC cao |
|
45 – 59 |
NCTB |
NC cao |
NC rất cao |
|
30 – 44 |
NC cao |
NC rất cao |
NC rất cao |
|
15 – 29 |
NC rất cao |
NC rất cao |
NC rất cao |
|
<15 |
NC rất cao |
NC rất cao |
NC rất cao |
4. ĐIỀU TRỊ
a) Mục tiêu điều trị tăng huyết áp trong BTM:
– Hạ huyết áp (A)
– Giảm yếu tố nguy cơ tim mạch ở người bệnh có hoặc không THA (B)
– Làm chậm tiến triển bệnh thận mạn ở người bệnh có hoặc không THA (A)
– Điều chỉnh thuốc hạ áp phải xem xét dựa trên mức độ protein niệu (C)
– Điều trị THA phải phối hợp với các điều trị khác của bệnh thận mạn theo chiến lược điều trị đa yếu tố (A)
– Nếu có mâu thuẫn giữa làm chậm tiến triển bệnh thận mạn và giảm yếu tố nguy cơ tim mạch, thì phải xem xét từng trường hợp dựa trên phân tầng nguy cơ (C).
– Mục tiêu điều trị THA trong bệnh thận mạn:
Bảng 7: Mục tiêu điều trị THA trong bệnh thận mạn theo các khuyến cáo
|
Khuyến cáo Mục tiêu |
JNC 7 |
ADA 2003 |
NKF – KDOQI |
| HA |
<130/80 mmHg |
<130/80 mmHg |
< 130/80 mmHg, xem xét hạ thêm HA tâm thu hơn ở người có tỷ lệ protein/ creatinin niệu ≥ 500 – 1000mg/g |
| Protein niệu |
|
|
tỷ lệ protein/ creatinin niệu < 500- 1000mg/g |
| Các yếu tố nguy cơ bệnh tim mạch | Thích hợp cho giảm nguy cơ bệnh tim mạch ở nhóm nguy cơ cao nhất | Thích hợp cho giảm nguy cơ bệnh tim mạch ở nhóm nguy cơ cao nhất | Thích hợp cho giảm nguy cơ bệnh tim mạch ở nhóm nguy cơ cao nhất |
b) Đánh giá ban đầu trước khi điều trị THA:
– Chỉ số HA
– Bệnh thận mạn: nguyên nhân , mức lọc cầu thận, protein niệu, biến chứng và nguy cơ tiến triển BTM
– Biểu hiện lâm sàng của bệnh tim mạch và các yếu tố nguy cơ bệnh tim mạch
– Các tình trạng bệnh lý đi kèm
– Các khó khăn trong điều trị
– Các biến chứng của việc sử dụng thuốc
– Kế hoạch điều trị dựa trên giai đoạn của bệnh thận mạn.
c) Điều trị cụ thể:
* Chế độ ăn và thay đổi lối sống là một yếu tố quan trọng trong chiến lược điều trị hạ áp và giảm YTNC tim mạch
– Hạn chế muối < 2,4g/ ngày = “không nêm, không chấm” (A)
– Chế độ ăn kiêng thay đổi theo giai đoạn BTM (B)
– Điều chỉnh lối sống, giảm YTNC tim mạch ( B )
– Giới thiệu đến chuyên viên dinh dưỡng trong trường hợp cần thiết (C)
Một số bệnh lý ống thận mô kẽ, khiếm khuyết tái hấp thu muối ở ống thận dẫn đến giảm thể tích dịch ngoại bào (bệnh thận mất muối) không nên ăn nhạt.
Các thành phần dinh dưỡng và chất khoáng trong chế độ ăn DASH theo JNC 7 và điều chỉnh theo giai đoạn BTM:
|
Dinh dưỡng |
Giai đoạn BTM 1 – 4 |
||
| Muối | (g/ngày )* |
< 2,4 |
|
| Mỡ toàn bộ | (% calories) |
< 30 |
|
| Mỡ bão hòa | (% calories) |
< 10 |
|
| Cholesterol | (mg/ngày) |
< 200 |
|
| Carbonhydrate | (% calories)** |
50 – 60 |
|
|
Giai đoạn 1 – 2 |
giai đoạn 3 – 4 |
||
| Protein | (g/kg/ngày , % calory) |
1,4 |
0,6 – 0,8 |
| Phospho | (g/ngày) |
1,7 |
0,8 – 1 |
| Potassium | (g/ ngày) |
> 4 |
2 – 4 |
| * Không khuyến cáo cho người bệnh bị bệnh thận mất muối
** Điều chỉnh với tổng số calory từ protein, mỡ và carbonhydrate |
|||
Bảng 8: Các biện pháp thay đổi lối sống và ảnh hưởng đến HA
|
Biện pháp thay đổi lối sống |
Lời khuyên |
Khả năng giảm HA (mmHg) |
| Giảm cân |
Duy trì BMI = 18.5-24.9 |
5-10 |
| Thay đổi thành phần thức ăn |
Chế độ ăn giàu trái cây, rau, ít chất béo |
8-14 |
| Chế độ ăn giảm muối |
Lượng muối <6g/ngày |
2-8 |
| Hoạt động thể lực |
Đi bộ tối thiểu 30ph/ngày |
4-9 |
| Tiết chế rượu |
– Rượu trắng< 30ml; Rượu whiskey<90ml – Rượu vang <300ml; Bia <720ml |
2-4 |
* Chế độ dùng thuốc
Nguyên tắc dùng thuốc hạ áp:
– Nên dùng những thuốc “ưu tiên” trước tiên.
– Thường phối hợp lợi tiểu trong chế độ điều trị.
– Chọn thuốc phối hợp tùy thuộc nguyên nhân BTM, bệnh tim mạch và các bệnh phối hợp khác, tránh tác dụng phụ và tương tác thuốc.
– Chế độ dùng thuốc càng đơn giản càng tốt: tác dụng kéo dài, viên phối hợp
Bảng 9: Thuốc ưu tiên (là thuốc có thể làm giảm YTNC tim mạch và chậm tiến triển bệnh thận ngoài cơ chế hạ HA)
|
Thuốc Bệnh tim mạch |
Lợi tiểu thiazide hay lợi tiểu quai |
ACE hay ARB |
BB |
CCB |
Đối kháng aldosterone |
| Suy tim có RLCN tâm thu |
X |
x |
x |
|
x |
| Tiền sử NMCT có |
|
x |
x |
|
x |
| RLCN tâm thu |
|
|
|
|
|
| Tiền sử NMCT |
|
|
x |
|
|
| ĐTN ổn định |
|
|
x |
x |
|
| Nguy cơ cao bệnh ĐMV |
X |
x |
x |
x |
|
| Phòng ngừa đột quỵ tái hát |
X |
x |
x |
x |
|
| Nhịp nhanh trên thất |
|
|
x |
x |
|
+ Thuốc ACEI hoặc ARB:
– Người bệnh bệnh thận do Đái tháo đường nên được điều trị bằng ACEI hoặc ARB dù có THA hay không.
– ACEI và ARB hiệu quả trong việc làm chậm tiến triển bệnh thận có vi đạm niệu do ĐTĐ type 1 hoặc type 2.
– ACEI và ARB nên được sử dụng liều trung bình đến cao (A)
– ACEI và ARB có thể phối hợp để làm giảm HA và đạm niệu (C)
– Người bệnh nên được theo dõi tụt HA, giảm GFR và tăng Kali máu (A)
– ACEI và ARB phải “ngưng” nếu: GFR giảm > 30% so với giá trị cơ bản trong 4 tháng ( B) hoặc Kali máu ≥ 5,5 mmol/l
– Một số điều cần lưu ý khi sử dụng ACEI hoặc ARB
|
|
Không sử dụng |
Thận trọng |
| ACEI | Có thai (A)
Tiền sử phù mạch (A) Ho do ACEI (A) Dị ứng với ACEI hoặc ARB |
Phụ nữ không áp dụng biện pháp tránh thai (A)
Hẹp ĐM thận hai bên (A) Thuốc gây tăng Kali máu (A) |
| ARB | Dị ứng với ARB (A)
Có thai (C) Ho do ARB (C) |
Hẹp ĐM thận hai bên (A)
Thuốc gây tăng Kali máu (A) Phụ nữ không áp dụng biện pháp tránh thai (C) Phù mạch do ACEI (C) |
+ Thuốc lợi tiểu ở người bệnh BTM:
– Hầu hết người bệnh BTM nên được điều trị bằng thuốc lợi tiểu (A)
– Thiazides 1 lần / ngày nên sử dụng ở NGƯỜI BỆNH có GFR ≥ 30 ml/ph (BTM giai đoạn 1 – 3 ) (A)
– Lợi tiểu quai nên dành cho NGƯỜI BỆNH có GFR < 30 ml/ph (BTM giai đoạn 4 – 5) (A)
– Lợi tiểu quai kết hợp với Thiazides có thể sử dụng cho NGƯỜI BỆNH quá tải và phù (A)
– Lợi tiểu giữ Kali nên được sử dụng thận trọng ở NGƯỜI BỆNH có GFR < 30 ml/ph (A), dùng đồng thời ACEI hoặc ARB , ở NGƯỜI BỆNH có nguy cơ tăng Kali máu
– Nên theo dõi dấu hiệu giảm thể tích tuần hoàn, biểu hiện bởi tụt HA hoặc giảm GFR (A)
– Theo dõi tình trạng tăng Kali máu (B)
– Phối hợp thuốc lợi tiểu cới các thuốc hạ áp khác nên được cân nhắc để tăng tuân thủ điều trị của người bệnh
+ Thuốc chẹn kênh Canxi ở người bệnh BTM:
– Nhóm DHP (Amlodipine, Nifedipine) và non DHP (Verapamil, Diltiazem) hiệu quả trong hạ áp và giảm nguy cơ tim mạch
– Nhóm Non DHP có hiệu quả trong giảm đạm niệu
– Nhóm DHP tuy không có hiệu quả giảm đạm niệu khi sử dụng một mình nhưng khi phối hợp với ACEI hoặc ARB có tác dụng làm chậm tiến triển bệnh thận.
+ Thuốc chẹn Beta ở người bệnh BTM:
– Thế hệ 1: Atenolol, Metoprolol …làm hạ áp và giảm nguy cơ bệnh tim mạch. Tuy nhiên thuốc gây ra các rối loạn chuyển hóa lipid và đề kháng insulin
– NGƯỜI BỆNH suy thận tiến triển thường tăng hoạt hệ giao cảm và tăng tần suất biến cố tim mạch
– Các thuốc thế hệ mới như Nebivolol và carvedilol ít gây rối loạn chuyển hóa và chậm nhịp
+ Các thuốc hạ áp khác:
– Ức chế thụ thể alpha trung ương gồm Clonidine, methyl dopa, và ức chế chọn lọc thụ thể Alpha1 (Doxazosin) có tác dụng hạ áp nhanh, mạnh và có tác dụng có lợi trên chuyển hóa lipid và cải thiện độ nhạy insulin, tuy nhiên có nhiều tác dụng phụ
– Thuốc dãn mạch trực tiếp như hydralazine có thể hạ áp mạnh nhưng gây phù chi dưới và nhịp nhanh.
4. TIẾN TRIỂN – THEO DÕI:
Bảng 10: Các khuyến cáo chuyển bệnh đến chuyên khoa để có lời khuyên hoặc cùng điều trị bệnh nhân bệnh thận mãn.
|
Chỉ định |
Chuyên khoa |
| Đánh giá và điều trị bệnh thận mãn theo tiêu chuẩn K/DOQI | Chuyên khoa bệnh học thận (C)
Các chuyên khoa thích hợp (C) |
| GFR < 30 ml/ph/1,73 m2 | Chuyên khoa bệnh học thận (B) |
| Tỉ số total protein/creatinin > 500-1000 mg/g mẫu nước tiểu | Chuyên khoa bệnh học thận (C) |
| Gia tăng các yếu tố nguy cơ tiến triển bệnh thận | Chuyên khoa bệnh học thận (C) |
| GFR giảm trên 30% trong vòng 4 tháng mà không có lý do | Chuyên khoa bệnh học thận (C) |
| Tăng Kali huyết thanh > 5,5 mEq/l mà không do điều trị | Chuyên khoa bệnh học thận (C) |
| Cao huyết áp kháng trị | Chuyên khoa bệnh học thận hay huyết áp (C) |
| Tác dụng phụ của thuốc khó kiểm soát | Chuyên khoa bệnh học thận hay huyết áp (C) |
| Xuất hiện cấp tính bệnh tim mạch | Chuyên khoa tim mạch |
| Bệnh lý tim mạch có biến chứng nặng hay phức tạp | Chuyên khoa tim mạch |
| Tuổi < 16 tuổi | Chuyên khoa thận học nhi |
Tài liệu tham khảo:
1. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease 2012.
2. Phác đồ điều trị Nội khoa, 2008. Bệnh viện Nhân dân 115, 87-92
TỔN THƯƠNG THẬN CẤP
1. ĐẠI CƯƠNG
Tổn thương thận cấp tính (Acute kidney injury-AKI) khá thường gặp trong lâm sàng. Tùy thuộc vào định nghĩa được sử dụng và quần thể được tiến hành nghiên cứu mà tỷ lệ mắc trong những người bệnh bị bệnh nặng nhập viện là khoảng 1-25%. Có trên 35 định nghĩa về tổn thương thận cấp và nếu không có định nghĩa đồng thuận thì sẽ gây trở ngại cho sự tiến bộ của những nghiên cứu lâm sàng cũng như nghiên cứu cơ bản trong lĩnh vực này. Vì vậy định nghĩa chuẩn hóa được đồng thuận trong thời gian gần đây là căn cứ vào tiêu chuẩn RIFLE, tiêu chuẩn này dựa trên sự phân loại mức độ tăng nặng của yếu tố nguy cơ, tổn thương và suy thận cùng với hai hậu quả là suy giảm một phần chức năng thận và bệnh thận giai đoạn cuối (the increasing severity classes Risk, Injury, and Failure, and the two outcome classes Loss and End Stage Kidney Disease- RIFLE) [1].
2. NGUYÊN NHÂN
Tổn thương thận cấp và sự phục hồi của thận sau tổn thương có cơ chế rất phức tạp và mỗi nhóm nguyên nhân có những đặc trưng riêng biệt. Một số yếu tố trọng tâm gây rối loạn chức năng thận cấp là do sự thiếu máu thận cục bộ và sự sản sinh của các chất độc với thận do hậu quả của sự co mạch, tổn thương nội mô và kích hoạt quá trình viêm. Tính nhạy cảm xuất phát từ mối liên quan của cấu trúc mạch máu và ống thận trong tủy thận dẫn đến tăng cường tính nhạy cảm để khắc phục lưu lượng máu đến thận. Thêm vào đó, vì ống thận cũng tập trung nhiều chất được tái hấp thu từ ống lumen, nồng độ của các chất này có thể đạt ngưỡng độc tính với tế bào biểu mô xung quanh. Chính sự tổn thương thận cấp thường xuyên có thể tích tụ tổn thương dẫn đến tiến triển thành bệnh thận mạn giai đoạn cuối.
Tương tác giữa tổn thương cấp và mạn tính trong bệnh thận cũng góp phần bởi cơ chế tự hồi phục mạnh mẽ của thận nhưng thường khả năng này không không giống nhau ở tất cả các người bệnh. Đã có nhiều nghiên cứu nhằm tìm hiểu rõ hơn về cách tạo điều kiện phục hồi cho tổn thương thận cấp được tiến hành nhằm tìm ra được làm cách nào để giúp cho thận thực hiện quá trình phục hồi tổn thương có hiệu quả nhất. Thực hiện điều này chính là nền tảng đã dẫn đến rất nhiều hứng thú trong lĩnh vực sinh học tế bào gốc liên quan đến việc giúp cho hồi phục những tổn thương thận cấp và mạn tính cho người bệnh[2].
3. CHẨN ĐOÁN
a) Triệu chứng lâm sàng và cận lâm sàng
* Triệu chứng lâm sàng:
Triệu chứng lâm sàng cơ bản của tổn thương thận cấp là sự giảm số lượng nước tiểu do suy giảm mức lọc cầu thận.
Ngoài ra người bệnh có các triệu chứng lâm sàng khác nhau tùy thuộc vào các nguyên nhân gây suy thận cấp do đó đòi hỏi phải khai thác tiền sử và khám lâm sàng để có chẩn đoán nguyên nhân gây ra tình trạng tổn thương thận cấp. Ví dụ:
– Nhiễm khuẩn huyết: Người bệnh có thể đã tiến hành các thủ thuật xâm lấn trước đó, có dấu hiệu của các nhiễm trùng cục bộ là đường vào của nhiễm khuẩn huyết. Biểu hiện sốt cao rét run…
– Giảm thể tích tuần hoàn hiệu dụng: Biểu hiện bệnh tiêu hóa như xuất huyết, thận, tổn thương da như bỏng, sau phẫu thuật trong thời gian gần đây, nhiễm trùng huyết, sau chấn thương…
– Tắc nghẽn đường niệu gây ứ nước bể thận niệu quản: Người bệnh có thể có tiền sử bệnh tiết niệu, sinh dục hoặc ung thư vùng chậu
– Ngộ độc thuốc hoặc các chất khác:
– Suy tim, suy gan, ung thư, bệnh mạch máu…
* Triệu chứng cận lâm sàng:
– Xét nghiệm nước tiểu: nên được làm thường qui ở tất cả các người bệnh tổn thương thận cấp.
– Xét nghiệm huyết học như công thức máu, tỷ lệ Prothrombin, IRN… rất cần thiết trong tình trạng đánh giá tổn thương thận cấp có liên quan đến thiếu máu do xuất huyết hay tan huyết, các trường hợp xuất huyết do giảm tiểu cầu, huyết khối, viêm tắc mạch…
– Xét nghiệm điện giải đồ trong đó đặc biệt chú ý tình trạng tăng Kali máu để có chỉ định điều trị kịp thời.
– Xét nghiệm các chỉ số amylase, b2-microglobulin… là những chỉ số theo dõi cho sự bài tiết nước tiểu của protein trọng lượng phân tử nhỏ mà có thể dễ dàng lọc bởi cầu thận và tái hấp thu của ống bình thường. Tăng bài tiết nước tiểu của các protein này có thể phản ánh tình trạng rối loạn chức năng ống thận và có thể là một dấu hiệu của tổn thương thận cấp [3].
– Xét nghiệm hỗ trợ tiếp theo cho chẩn đoán tổn thương thận cấp được sử dụng rộng rãi là đo nồng độ natri hoặc sự bài tiết của natri trong nước tiểu.
– Xét nghiệm ure, creatinin… có biểu hiện triệu chứng suy giảm chức năng thận tùy theo giai đoạn bệnh.
b) Chẩn đoán xác định
Chẩn đoán theo mức độ tăng nặng: nguy cơ, tổn thương và suy chức năng dẫn đến hai hậu quả là mất chức năng thận và bệnh thận giai đoạn cuối; tiêu chuẩn RIFLE (the increasing severity classes Risk, Injury, and Failure, and the two outcome classes Loss and End Stage Kidney Disease-RIFLE). ( (Xin xem biểu đồ chẩn đoán theo tiêu chuẩn RIFLE trình bày ở dưới).
Các xét nghiệm cận lâm sàng được chỉ định tùy theo nguyên nhân gây tổn thương thận cấp và giai đoạn bệnh.
Biểu đồ chẩn đoán theo tiêu chuẩn RIFLE:
4. ĐIỀU TRỊ
a) Đảm bảo thể tích tuần hoàn
Đặt catheter tĩnh mạch trung tâm để theo dõi việc đảm bảo đủ thể tích tuần hoàn. Sự thiếu hoặc thừa thể tích đều không có lợi cho thận. Xác định lượng cụ thể số lượng dịch cần bù và theo nguyên tắc bù những lượng dịch nhỏ của nhiều loại dịch khác nhau, không dùng duy nhất một loại dịch. Sử dụng lợi tiểu chỉ nên bắt đầu khi đã bù đủ thể tích tuần hoàn [4].
b) Điều trị rối loạn điện giải
Rối loạn điện giải rất thường xuyên gặp và quan trọng nhất của sự mất cân bằng bao gồm rối loạn natri, kali, canxi và phốt pho.
Hạ natri máu và tăng kali máu là phổ biến nhất và những rối loạn này luôn cần được chẩn đoán nhanh chóng và điều chỉnh về mức an toàn cho người bệnh trước khi chẩn đoán xác định được các bệnh cơ bản.
Sự nhấn mạnh về điều chỉnh điện giải là do những rối loạn ở người bệnh với hạ natri máu có nguy cơ cao gây phù não, và tăng kali máu có thể dẫn đến đe dọa tính mạng người bệnh do ảnh hưởng của rối loạn nhịp tim. Việc chẩn đoán nhanh chóng và xử trí hiệu quả những rối loạn này sẽ hạn chế nguy cơ đe dọa tính mạng người bệnh [5].
c) Sử dụng thuốc lợi tiểu
Thuốc lợi tiểu chỉ nên bắt đầu khi đã bù đủ thể tích tuần hoàn. Tổng quan phân tích gộp sáu nghiên cứu được sử dụng furosemide để điều trị tổn thương thận cấp với liều lượng khác nhau từ 600-3400mg/ngày không giảm đáng kể là về tử vong trong bệnh viện. Nghiên cứu nghiên cứu đơn lớn nhất về sử dụng furosemide trong điều trị tổn thương thận cấp được thực hiện bởi Cantarovich và cộng sự, người bệnh đã được chỉ định lọc máu được dùng ngẫu nhiên một trong 2 phác đồ sử dụng furosemide (25 mg/kg/ngày tiêm tĩnh mạch hoặc 35 mg/kg/ngày đường uống) hoặc giả dược. Mặc dù thời gian để đạt 2 lít/ngày của lợi tiểu furosemide ngắn hơn (5,7 ngày) so với giả dược (7,8 ngày) với p= 0,004. Tuy nhiên không có sự khác biệt cho thấy furosemide có thể giảm tỷ lệ tử vong ở người bệnh tổn thương thận cấp [6].
d) Điều trị bệnh chính gây tình trạng tổn thương thận cấp
e) Chỉ định điều trị thay thế thận
Chỉ định điều trị thay thế khi trong những trường hợp rối loạn điện giải nặng, toan hóa và suy giảm chức năng thận nặng. Nên sử dụng màng lọc sinh học tương thích cho lọc máu liên tục hoặc ngắt quãng (Intermittent hemodialysis-IHD và Continuous renal replacement therapy-CRRT) [6].
Tài liệu tham khảo
1. Achim Jörres, Claudio Ronco, John A. Kellum (Eds.), 2010. Management of Acute Kidney Problems. Springer-Verlag Berlin Heidelberg. ISNGƯỜI BỆNH: 978-3-540-69413-7 e-ISNGƯỜI BỆNH: 978-3-540-69441-0. DOI: 10.1007/978-3-540-69441-0.
2. Joseph V. Bonventre, 2010. Mechanisms of Acute Kidney Injury and Repair. Management of Acute Kidney Problems. PP: 13-31.
3. Robert J. Anderson, 2010. Clinical and Laboratory Evaluation. Management of Acute Kidney Problems. PP: 83-93.
4. Jean-Louis Vincent and Barbara Ceradini, 2010. Volume Resuscitation and Management. Management of Acute Kidney Problems. PP: 125-130.
5. Michael Oppert, 2010. Management of Electrolyte Disorders. Management of Acute Kidney Problems. PP: 131-138.
6. http://www.kidney-international.org. KDIGO Clinical Practice Guideline for Acute Kidney Injury. VOL 2 | SUPPLEMENT 1 | MARCH 2012
SUY THẬN CẤP
1. ĐỊNH NGHĨA
Suy thận cấp là hội chứng gây ra bởi nhiều nguyên nhân, có thể là nguyên nhân ngoài thận hoặc tại thận, làm suy sụp và mất chức năng tạm thời, cấp tính của cả hai thận, do ngừng hoặc suy giảm nhanh chóng mức lọc cầu thận. Biểu hiện lâm sàng là thiểu niệu hoặc vô niệu xảy ra cấp tính, tiếp theo là tăng nitơ phiprotein trong máu, rối loạn cân bằng nước điện giải, rối loạn cân bằng kiềm toan, phù và tăng huyết áp. Suy thận cấp có tỉ lệ từ vong cao, nhưng nếu được chẩn đoán và điều trị kịp thời thì chức năng thận có thể hồi phục hoàn toàn hoặc gần hoàn toàn.
2. NGUYÊN NHÂN
Có nhiều cách phân loại nguyên nhân gây ra suy thận cấp, nhưng người ta thường phân ra ba nhóm nguyên nhân dựa trên sự khác nhau về cơ chế bệnh sinh.
a. Nguyên nhân trước thận
Nguyên nhân trước thận bao gồm mọi nguyên nhân gây giảm dòng máu hiệu dụng tới thận, dẫn tới giảm áp lực lọc cầu thận và gây ra thiểu niệu hoặc vô niệu.
– Gồm các nguyên nhân gây sốc: sốc giảm thể tích (mất nước, mất máu), sốc tim, sốc nhiễm khuẩn, sốc quá mẫn, …
– Các nguyên nhân gây giảm khối lượng tuần hoàn khác: giảm áp lực keo trong hội chứng thận hư, xơ gan mất bù, thiểu dưỡng.
b. Nguyên nhân tại thận
Các nguyên nhân tại thận bao gồm các tổn thương thực thể tại thận, gặp trong các bệnh thận:
– Bệnh cầu thận và bệnh của các mạch máu nhỏ trong thận: viêm cầu thận tiến triển nhanh, viêm màng trong tim nhiễm khuẩn bán cấp gây viêm các mạch máu trong thận, viêm cầu thận cấp sau nhiễm liên cầu khuẩn, viêm mạch máu thận trong các bệnh mạch máu hệ thống, xơ cứng bì, tăng huyết áp ác tính, hội chứng tan máu tăng ure máu, nhiễm độc thai nghén, đông máu rải rác trong lòng mạch.
– Bệnh mô kẽ thận: viêm thận kẽ do nhiễm khuẩn, viêm thận kẽ do thuốc, xâm nhập tế bào ác tính vào mô kẽ thận (u lympho, bệnh bạch cầu, ung thư mô liên kết).
– Bệnh ống thận: hoại từ thận sau thiếu máu, nhiễm độc thận (do thuốc, chất cản quang đường tĩnh mạch, thuốc gây mê, kim loại nặng, dung môi hữu cơ, nọc độc của rắn, mật cá lớn hoặc mật động vật, nấm độc, nọc ong, thuốc thảo mộc), bệnh thận chuỗi nhẹ, tăng calci máu.
c. Nguyên nhân sau thận
Các nguyên nhân gây tắc đường dẫn nước tiểu của thận, bao gồm:
– Tắc đường tiết niệu cao: sỏi đường tiết niệu, cục máu đông, mẩu nhú thận hoại tử, khối u, xơ hóa phúc mạc thành sau, phẫu thuật thắt nhầm niệu quản.
– Tác đường tiết niệu thấp: tắc niệu đạo, tắc ở cổ bàng quang (phì đại tuyến tiền liệt, ung thư tuyến tiền liệt), hội chứng bàng quang do thần kinh.
3. CHẨN ĐOÁN
a. Chẩn đoán xác định
Chẩn đoán xác định suy thận cấp căn cứ vào các yếu tố sau:
– Có nguyên nhân có thể gây suy thận cấp (tuy nhiên đôi khi không tìm được nguyên nhân).
– Vô niệu hoặc thiểu niệu xảy ra cấp tính.
– Tốc độ gia tăng creatinin huyết thanh > 42,5µmol trong vòng 24 giờ – 48 giờ so với creatinin nền nếu creatinin nền của người bệnh < 221 µmol/l
hoặc: Tốc độ gia tăng creatinin huyết thanh > 20% trong vòng 24giờ đến 48 giờ so với creatinin nền nếu creatinin nề của người bệnh > 221 µmol/l.
– Mức lọc cầu thận giảm < 60 ml/ph, xảy ra sau vô niệu
– Kali máu thường tăng.
– Có thể có toan máu chuyển hóa.
– Diễn biến qua 4 giai đoạn.
b. Chẩn đoán thể lâm sàng
Thể vô niệu dễ chẩn đoán, dựa vào các yếu tố trên.
Thể có bảo tồn nước tiểu, chẩn đoán dựa vào nồng độ ure và creatinin trong máu tăng, mức lọc cầu thận giảm, xảy ra đột ngột sau khi có nguyên nhân bệnh tác động mà trước đó các thông số này vẫn trong giới hạn bình thường.
c. Chẩn đoán phân biệt
– Một số trường hợp có tăng creatinin hoặc urê máu mà không có suy thận cấp
+ Tăng ure do:
• Tăng quá nhiều lượng protein vào cơ thể: qua ăn, uống, truyền nhiều acid amin.
• Xuất huyết đường tiêu hóa.
• Tăng quá trình giáng hóa.
• Đang dung corticoids.
• Đang dung tetracycline
+ Tăng nồng độ creatinin máu do:
• Tăng giải phóng từ cơ.
• Giảm bài tiết ở ống lượn gần do dung cimetidin, trimethoprim.
– Đợt tiến triển nặng của suy thận mạn
Nếu chỉ dựa vào lâm sàng mà không có sinh thiết thận, thì chẩn đoán phân biệt suy thận cấp với đợt tiến triển nặng của suy thận mạn có vô niệu, nhiều khi rất khó khăn. Nhiều người bệnh không được phát hiện có bệnh thận cho đến khi đột ngột bị vô niệu, những người bệnh này có thể được chẩn đoán nhầm là suy thận cấp.
+ Trong suy thận mạn:
• Tiền sử có bệnh thận – tiết niệu.
• Creatinin và urê huyết thanh tăng từ trước nếu đã được chẩn đoán và theo dõi.
• Thiếu máu tương ứng với mức độ suy thận.
• Tăng huyết áp, suy tim: thường nặng hơn trên người bệnh suy thận mạn.
• Siêu âm có thể thấy hai thận teo nhỏ, nhu mô thận tăng độ cản âm (phản ánh mức độ xơ của nhu mô thận) nếu do viêm cầu thận mạn, hoặc thấy các nguyên nhân gây suy thận mạn khác như: thận đa nang, sỏi thận…
+ Đợt cấp của suy thận mạn:
• Có các nguyên nhân làm nặng them mức độ suy thận như: dùng các thuốc độc cho thận, dung thuốc nam không rõ nguồn gốc hoạt chất, mất nước do nôn, ỉa chảy, nhiễm trùng toàn thân hoặc các ổ nhiễm trùng tại thận, tắc nghẽn sau thận đột ngột.
• Suy thận nặng nhưng thiếu máu không nặng nếu nguyên nhân gây suy thận cấp không do mất máu và người bệnh không dung thuốc kích thích tăng sinh hồng cầu trước đó.
• Trên siêu âm: Kích thước và tính chất nhu mô thận không tương xứng với mức độ suy thận, suy thận nặng nhưng thận không teo và cản âm nhiều nếu nguyên nhân gây suy thận mạn là viêm cầu thận mạn.
• Loại trừ các nguyên nhân thuận lợi gây suy giảm chức năng thận thì mức độ suy thận sẽ giảm đi nhưng không bao giờ trở về bình thường.
– Chẩn đoán phân biệt suy thận cấp chức năng với suy thận cấp thực tổn
Chẩn đoán phân biệt suy thận cấp chức năng với suy thận cấp thực tổn được đạt ra với các suy thận cấp do nguyên nhân trước thận. Nếu suy thận cấp mới chỉ ở mức suy chức năng, nghĩa là do không cung cấp đủ máu cho thận đảm bảo chức năng, thì các chức năng của ống thận vẫn còn tốt, khả năng tái hấp thu natri và cô đặc nước tiểu của thận còn tốt. Khi ống thận bị tổn thương thực thể, thì các chức năng ống thận bị suy giảm. Vì vậy, phân tích sinh hóa máu và nước tiểu sẽ giúp ích cho nhận định suy thận cấp là suy chức năng hay suy thực tổn.
Bảng 1. Chẩn đoán phân biệt suy thận cấp chức năng và suy thận cấp thực tổn (Dieter Kleinknecht 1992)
| Thông số | STC chức năng | STC thực tổn |
| 1. Uosm sáng sớm (mOsm/kg H2O) | >500 | <350 |
| 2. Uosm/Posm | >1,5 | <1,1 |
| 3. CH2O (ml/ph) | Âm tính | Tiến tới 0 |
| 4. UNa (mmol/l) | <20 | >40 |
| 5. FENa (%) | <1 | >1 |
| 6. Ucre/Pcre | >40 | <20 |
| 7. Uure/Pure | >8 | <3 |
Trong đó: Uosm sáng sớm là độ thẩm thấu nước tiểu mẫu sáng sớm; Uosm/Posm là tỉ số độ thẩm thấu nước tiểu và độ thẩm thấu máu; CH2O là hệ số thanh thải nước tự do. Ba thông số này cho phép nhận định khả năng cô đặc nước tiểu của ống thận còn tốt hay đã bị suy giảm. Nếu suy thận là suy chức năng, thì khả năng cô đặc nước tiểu của thận còn tốt, trái lại nếu ống thận đã bị tổn thương thì khả năng cô đặc nước tiểu của thận giảm; UNa là nồng độ natri trong nước tiểu; FENb là phân số thải natri của thận, được tính theo công thức FENa=(UNa/PNa)x100/(Ucre/Pcre).
Hai thông số này cho phép nhận định khả năng tái hấp thu natri của ống thận còn tốt hay đã bị suy giảm. Nếu suy thận là suy chức năng thì khả năng tái hấp thu natri của ống thận còn tốt (khả năng bảo tồn natri của thận còn tốt), nếu ống thận đã bị tổn thương thì khả năng tái hấp thu natri của thận giảm. Ống thận để mất natri qua nước tiểu. Các thông số Ucre/Pcre là tỉ số giữa nồng độ creatinin nước tiểu và nồng độ creatinin máu; Uure/Pure là tỉ số giữa nồng độ ure trong nước tiểu và nồng độ ure máu. Hai thông số này phản ánh khả năng bài xuất nitơ phiprotein của thận. Nếu suy thận là suy chức năng thì khả năng bài xuất ure và creatinin của thận giảm.
4. ĐIỀU TRỊ
a. Nguyên tắc chung
– Nhanh chóng loại bỏ nguyên nhân gây suy thận cấp nếu có thể ( tùy từng nhóm nguyên nhân trước thận, tại thận hay sau thận mà có biện pháp điều trị phù hợp).
– Điều chỉnh các rối loạn tuần hoàn, trong đó quan trọng là phục hồi lại lượng máu và dịch, duy trì huyết áp tâm thu 100-120 mmHg.
– Phục hồi lại dòng nước tiểu
– Điều chỉnh các rối loạn nội môi do suy thận cấp gây ra
– Điều trị triệu chứng phù hợp với tưng giai đoạn của bệnh.
– Chỉ định lọc máu ngoài thận khi cần thiết.
– Chú ý chế độ dinh dưỡng, cân bằng nước điện giải phù hợp với từng giai đoạn của bệnh
b. Điều trị theo giai đoạn bệnh
– Giai đoạn tấn công của tác nhân gây bệnh
+ Cố gắng điều trị loại bỏ nguyên nhân gây bệnh: bù đủ nước khi có mất nước, loại bỏ tắc nghẽn đường tiểu, rửa dạ dày khi uống mật cá trắm trong 6 giờ đầu,….
+ Theo dõi sát tình trạng thiểu niệu, vô niệu để có chẩn đoán suy thận cấp sớm
– Giai đoạn thiểu niệu, vô niệu
+ Giữ cân bằng nước, điện giải:
• Nước ở người bệnh vô niệu hoặc thiểu niệu đã có phù, đảm bảo cân bằng (-): nước vào ít hơn nước ra.
• Lợi tiều: dung lợi tiểu quai Furosemid dò liều. Liều khởi đầu có thể 40 – 80 mg. Liều tối đa 1000 mg. Khi thấy người bệnh có thể đã tiểu được không do thuốc, phải dừng ngay lợi tiểu vì sau đó người bệnh có thể tiểu rất nhiều (> 10 lít). Thời gian tác dụng của Furosemid đường tiêm kéo dài 4 giờ. Không dung lợi tiểu nếu suy thận cấp sau thận.
• Trường hợp suy thận cấp trước thận: Bù đủ thể tích tuần hoàn càng sớm càng tốt, không dùng lợi tiểu nếu chưa bù đủ khối lượng tuần hoàn.
+ Điều trị tăng Kali máu:
Hạn chế đưa K+ vào: rau quả nhiều K+, thuốc, dịch truyền có K+.
Loại bỏ các ổ hoại tử, chống nhiễm khuẩn.
Thuốc:
• Calcigluconat hoặc Clorua: cần tiêm tĩnh mạch ngay khi K+ máu cao ≥ 6,5 mmol/l hoặc khi có những biểu hiện tim mạch rõ ( mạch chậm,loạn nhịp, QRs giãn rộng), liều trung bình 1 g, tiêm tĩnh mạch chậm trong ít nhất 5 phút. Nhắc lại liều sau 30 phút khi cần.
• Glucoza kết hợp Insulin dẫn Kali vào trong tế bào, bắt đầu tác dụng sau khoảng 30 phút. Lượng đưa vào khoảng 200 – 250 ml dung dịch glucose 20% có thể giảm được 0,5 mmol/l Kali. Liều insulin sử dụng: 1 UI insulin actrapid/25ml Glucose 20%
• Truyền hoặc tiêm tĩnh mạch chậm Natribicarbonat khi có toan máu để hạn chế Kali đi từ trong tế bào ra ngoài tế bào.
• Resin trao đổi ion qua niêm mạc ruột: Resincalcio, Resinsodio, Kayexalat cứ mỗi 15 g uống phối hợp với sorbitol có thể giảm 0,5 mmol/l. Thuốc phát huy tác dụng sau 1 giờ. Nếu người bệnh không uống được có thể thụt thuốc qua hậu môn (100ml dịch đẳng trương).
• Lợi tiểu thải nước và Kali.
• Lọc máu cấp: khi điều trị tăng kali máu bằng nội khoa không kết quả và K+ ≥ 6,5 mmol/l.
+ Điều trị các rối loạn điện giải khác nếu có.
+ Hạn chế tăng Nitơphiprotein máu:
• Chế độ ăn giảm đạm.
• Loại bỏ ổ nhiễm khuẩn.
+ Điều trị chống toan máu nếu có.
+ Điều trị các triệu chứng và biến chứng khác nếu có: tăng huyết áp, suy tim.
+ Chỉ định lọc máu cấp:
• Chỉ định lọc máu cấp cứu nếu không đáp ứng các biện pháp điều trị nội khoa tăng kali máu (K+ máu > 6,5 mmol/l).
• Khi có biểu hiện toan máu chuyển hóa rõ pH< 7,2 ( thường khi ure > 30 mmol/l, creatinin > 600 µmol/l).
• Thừa dịch nặng gây phù phổi cấp hoặc doạ phù phổi cấp.
– Giai đoạn đái trở lại
Chủ yếu là cân bằng nước điện giải. Cần đo chính xác lượng nước tiểu 24h và theo dõi sát điện giải máu để kịp thời điều chỉnh.
+ Khi tiểu > 3 lít/24h nên bù dịch bằng đường truyền tĩnh mạch, lượng dịch bù tùy thuộc vào lượng nước tiểu. chú ý bù đủ cả điện giải.
+ Khi tiểu < 3 lít/24h, không có rối loạn điện giải nặng: cho uống Orezol.
+ Sau khoảng 5 ngày nếu người bệnh vẫn tiểu nhiều cũng hạn chế lượng dịch truyền và uống vì thận đã bắt đầu phục hồi chức năng cô đặc. Theo dõi sát nước tiểu 24h để có thái độ bù dịch thích hợp
– Giai đoạn phục hồi chức năng:
+ Vẫn cần chú ý công tác điều dưỡng: chế độ ăn cần tăng đạm khi ure máu đã về mức bình thường.
+ Theo dõi định kỳ theo chỉ dẫn thầy thuốc.
+ Tiếp tục điều trị nguyên nhân nếu có. Chú ý các nguyên nhân có thể dẫn đến suy thận mạn tính (bệnh lý cầu thận, bệnh lý kẽ thận, …)
5. DỰ PHÒNG VÀ ĐIỀU TRỊ CÁC BIẾN CHỨNG
Khi xảy ra các biến chứng trong suy thận cấp sẽ làm tiên lượng người bệnh xấu đi nhiều. Theo báo cáo của Hội Lọc máu và Ghép thận Châu Âu (EDTA) thì tỉ lệ tử vong chỉ 8% nếu chỉ tổn thương thận đơn độc, nhưng tỉ lệ tử vong tăng lên 65-76% nếu thêm một hoặc hơn các cơ quan khác bị tổn thương (Bullock và Kindle 1985) đặc biệt là tổn thương phổi, người bệnh phải hô hấp bằng máy, biến chứng tim mạch, biến chứng nhiễm khuẩn huyết.
a. Chống nhiễm khuẩn, chống loét
Tỉ lệ nhiễm khuẩn đường tiết niệu thứ phát sau vô niệu rất cao, theo Hamburger gặp trên 50% số người bệnh, vi khuẩn chủ yếu là E. Coli, Enterococci, ít gặp hơn là Staphilococci, Bacillus pyocyaneus. cần cho kháng sinh để dự phòng nhiễm khuẩn, chú ý tránh dùng các kháng sinh độc với thận.
b. Tăng kali máu gây rung thất và ngừng tim
Tăng kali máu luôn là nguy cơ đe dọa tính mạng người bệnh suy thận cấp, ngay cả hiện nay đã có thận nhân tạo. Vì vậy, dự phòng tăng kali máu luôn là vấn đề phải đặt ra. Cần thực hiện sớm ngay từ giai đoạn đầu và suốt thời gian vô niệu việc hạn chế lượng kali ngoại sinh đưa vào cơ thể, và loại trừ sớm lượng kali nội sinh. Theo dõi điện tim để phát hiện kịp thời và sử trí sớm tăng kali máu, điện tim có độ nhạy cao và rất hữu ích để phát hiện tăng kali máu, và theo dõi biến dổi kali máu trong quá trình điều trị, không nên chờ xét nghiệm điện giải hoặc biểu hiện lâm sàng của tăng kali máu, mà cần sử trí để hạ kali máu ngay khi có các dấu hiệu tăng kali máu trên điện tim.
c. Phù phổi cấp
Mặc dù thận nhân tạo đã làm giảm đáng kể biến chứng phù phổi cấp do suy thận cấp, nhưng phù phổi cấp vẫn là một trong những nguyên nhân quan trọng gây tử vong ở người bệnh suy thận cấp cần được dự phòng và sử trí sớm. Điều chỉnh cân bằng nước và natri bằng tiết chế cần được chú ý trong suốt thời gian vô niệu, gây bài niệu tích cực cũng là biện pháp hữu hiệu để dự phòng biến chứng này. Cần đánh giá và theo dõi huyết áp và tình trạng quá tải dịch thường xuyên để điều chỉnh và chỉ định lọc máu ngoài thận kịp thời. Đặc biệt chú ý những người bệnh đã có bệnh lý tim mạch hoặc bệnh lý phổi từ trước khi bị suy thận cấp, những người bệnh bị nhiễm độc qua dường hô hấp, bỏng đường hô hấp, là những người bệnh có tỉ lệ phù phổi cấp cao.
d. Hôn mê và tử vong do ure máu cao
Từ khi có thận nhân tạo biến chứng này ít gặp, tuy nhiên vẫn có nguy cơ cao xảy ra khi chế độ ăn uống không đúng. Vì vậy, trong suốt thời gian vô niệu cần chú ý tiết chế đúng.
Tài liệu tham khảo
1. Đỗ Thị Liệu, 2004. Suy thận cấp tính. Bệnh thận nội khoa. Nhà xuất bản y học. tr 273 – 284.
2. Đỗ Gia Tuyển, 2012. Suy thận cấp. Bệnh học nội khoa tập I. Nhà xuất bản y học. tr 380 – 397.
3. Mitch WE, 1996. Acute renal failure. Cecil textbook of medicine. 20th edition. W.B. Saunders company.
4. Richard J. Glassock, Shaul G. Massry, and David Humes, 2002. Acute renal failure Including Cortical Necrosis. Textbook of nephrology. 14th edition. p 968-977.
5. Collège national des enseignants de réanimation médicale, 2006. Insuffisance rénale aigue. Réanimation et Urgences. 2e édition. p 223 – 234.
BỆNH THẬN MẠN
1- ĐẠI CƯƠNG
1.1. Định nghĩa bệnh thận mạn theo KDIGO 2012 (Kidney Disease Improving Global Outcomes)
Bệnh thận mạn (chronic kidney disease) là những bất thường về cấu trúc hoặc chức năng thận, kéo dài trên 3 tháng và ảnh hưởng lên sức khỏe người bệnh
Tiêu chuẩn chẩn đoán bệnh thận mạn (BTM): dựa vào 1 trong 2 tiêu chuẩn sau:
a- Triệu chứng tổn thương thận (có biểu hiện 1 hoặc nhiều)
• Có Albumine nước tiểu (tỷ lệ albumin creatinine nước tiểu> 30mg/g hoặc albumine nước tiểu 24 giờ >30mg/24giờ)
• Bất thường nước tiểu
• Bất thường điện giải hoặc các bất thường khác do rối loạn chức năng ống thận
• Bất thường về mô bệnh học thận
• Xét nghiệm hình ảnh học phát hiện thận tiết niệu bất thường
• Ghép thận
b- Giảm mức lọc cầu thận (Glomerular filtration rate: GFR) < 60ml/ph/1,73 m2 (xếp loại G3a-G5)
Với mức lọc cầu thận được đánh giá dựa vào độ thanh lọc créatinine ước tính theo công thức Cockcroft Gault hoặc dựa vào độ loc cầu thận ước tính (estimated GFR, eGFR) dựa vào công thức MDRD.
• Công thức Cockcroft Gault ước đoán ĐTL creatinin từ creatinin huyết thanh
• Công thức MDRD (Modification of Diet in Renal Disease Study) ước đoán mức lọc cầu thận (estimated GFR, eGFR) từ creatinin huyết thanh
• Công thức tính mức lọc cầu thận theo creatinin nội sinh
1.2. Phân giai đoạn bệnh thận mạn:
Năm 2002, NKF- KDOQI (National Kidney Foundation-Kidney Disease Outcomes Quality Initiatives) phân bệnh thận mạn thành 5 giai đoạn dựa vào GFR
Bảng 1. Các giai đoạn của bệnh thận mạn
|
Giai đoạn |
Mô tả | Mức lọc cầu thận (ml/ph/1,73 m2 da) |
|
1 |
Tổn thương thận với MLCT bình thường hoặc tăng | ≥ 90 |
|
2 |
Tổn thương thận với MLCT giảm nhẹ | 60-89 |
|
3 |
Giảm MLCT trung bình | 30-59 |
|
4 |
Giảm MLCT nặng | 15-29 |
|
5 |
Bệnh thận mạn giai đoạn cuối | <15 hoặc phải điều trị thận nhân tạo |
Năm 2012, KDIGO (Kidney Disease Improving Global Outcomes) của Hội Thận học Quốc Tế, giai đoạn 3 được tách thành 3a và 3b, kèm theo bổ sung albumine niệu vào trong bảng phân giai đoạn (hình 1) hỗ trợ cho việc đánh giá tiên lượng và tiến triển của BTM
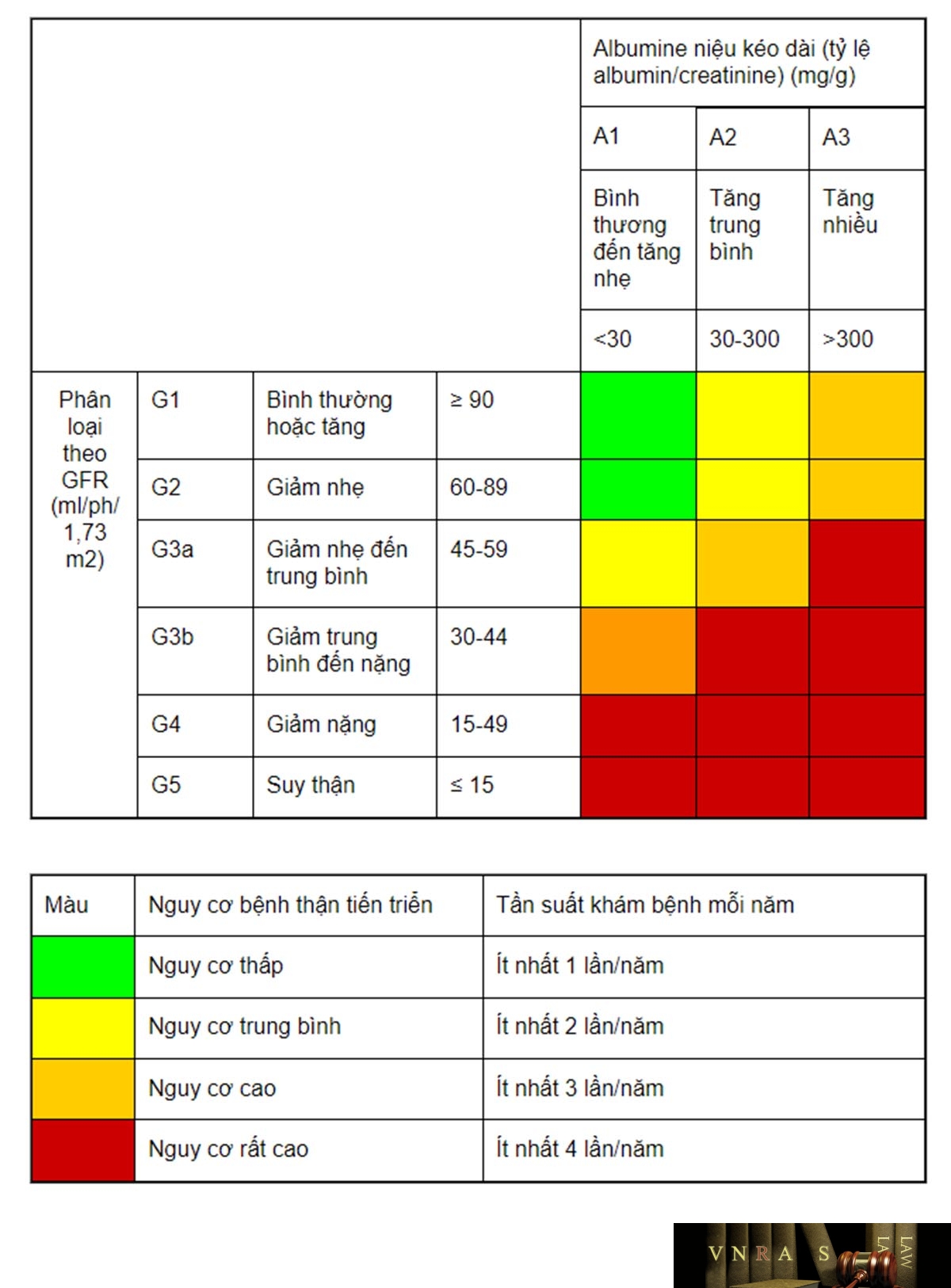
Cần lưu ý mức lọc cầu thận chỉ phản ảnh chính xác giai đoạn BTM khi chức năng thận ổn định (không thay đổi trong 3 tháng xét nghiệm lặp lại) và sau khi đã loại bỏ các yếu tố làm nặng thêm tạm thời tình trạng suy thận.
2- NGUYÊN NHÂN:
Dựa vào lâm sàng, tiền sử cá nhân, gia đình, hoàn cảnh xã hội, yếu tố môi trường, thuốc dùng, khám lâm sàng, xét nghiệm sinh hóa, hình ảnh học, và thậm chí sinh thiết thận để chẩn đoán nguyên nhân bệnh thận mạn.
Theo Hội Thận học Quốc Tế KDIGO năm 2012, nguyên nhân bệnh thận mạn được phân dựa vào vị trí tổn thương giải phẫu học và bệnh căn nguyên chủ yếu tại thận, hoặc thứ phát sau các bệnh lý toàn thân (bảng 2)
Bảng 2: Phân loại nguyên nhân bệnh thận mạn (theo KDIGO 2012)
| Nguyên nhân | Bệnh thận nguyên phát | Bệnh thận thứ phát sau bệnh toàn thân |
| Bệnh cầu thận | Bệnh cầu thận tổn thương tối thiểu, bệnh cầu thận màng… | Đái tháo đường, thuốc, bệnh ác tính, bệnh tự miễn |
| Bệnh ống thận mô kẽ | Nhiễm trùng tiểu, bệnh thận tắc nghẽn, sỏi niệu | Bệnh tự miễn, bệnh thận do thuốc, đa u tủy |
| Bệnh mạch máu thận | Viêm mạch máu do ANCA, loạn dưỡng xơ cơ | Xơ vữa động mạch, tăng huyết áp, thuyên tắc do cholesterol |
| Bệnh nang thận và bệnh thận bẩm sinh | Thiểu sản thận, nang tủy thận | Bệnh thận đa nang, hội chứng Alport |
3- CHẨN ĐOÁN BỆNH THẬN MẠN
3.1- Chẩn đoán xác định
Chẩn đoán bệnh thận mạn dựa vào
a- Lâm sàng có thể có hoặc không có biểu hiện lâm sàng của bệnh thận biểu hiện bệnh thận như phù toàn thân, tiểu máu…
b- Cận lâm sàng tầm soát:
• Xét nghiệm định lượng créatinine huyết thanh: Tử créatinine huyết thanh ước đoán độ thanh lọc créatinine theo công thức Cockcroft Gault, hoặc ước đoán mức lọc cầu thận theo công thức của MDRD (Modification of Diet in Renal Disease)
• Xét nghiệm nước tiểu tìm protein hoặc albumine trong nước tiểu: với mẩu nước tiểu bất kỳ, tốt nhất là mẫu nước tiểu đầu tiên buổi sáng sau ngủ dậy.
Bảng 2: Kết quả xét nghiệm albumine và protein trong nước tiểu
| Bình thường | Bất thường | |
| Tỷ lệ albumine/creatinine niệu (ACR) | <30mg/g
<3 mg/mmol |
≥ 30mg/g
≥ 3mg/mmol |
| Albumine niệu 24 giờ | <30 mg/24 giờ | ≥ 30mg/24 giờ |
| Tỷ lệ protein/creatinine niệu (PCR) | <150mg/g
< 15 mg/mmol |
≥ 150mg/g
≥ 15mg/mmol |
| Protein niệu 24giờ | <150mg/ 24giờ | ≥ 150mg/24giờ |
| Protein niệu giấy nhúng | âm tính | Vết đến dương tính |
• Xét nghiệm khảo sát cặn lắng nước tiểu (tìm cặn lắng bất thường như hồng cầu, bạch cầu, các trụ niệu), xét nghiệm điện giải đồ, và sinh thiết thận
• Xét nghiệm hình ảnh: siêu âm thận và hệ niệu (tìm sỏi, nang thận, kích thước thận), niệu ký nội tĩnh mạch.
Chẩn đoán xác định bệnh thận mạn, khi các xét nghiệm vẫn bất thường trong những lần xét nghiệm lập lại sau trong vòng 3 tháng.
3.2. Chẩn đoán phân biệt với tổn thương thận cấp
Trước mọi người bệnh có tăng creatinin huyết thanh, cần phân biệt bệnh thận mạn với tổn thương thận cấp vì tổn thương thận cấp có khả năng hồi phục chức năng thận nếu được chẩn đoán sớm và can thiệp kịp thời
a-Dựa vào creatinin huyết thanh nền trước đây
• Nếu creatinin huyết thanh nền trong vòng 3 tháng trước đây, nếu ở mức bình thường thì có thể nghĩ đến tổn thương thận cấp.
• Nếu creatinin huyết thanh nền trước đây đã tăng mạn tính trên 3 tháng, sẽ là bằng chứng quan trọng của bệnh thận mạn.
• Nếu không biết créatinine huyết thanh nền trước đây, vẫn có thể cả 2 bệnh lý trên kết hợp gây tổn thương thận cấp trên nền bệnh thận mạn. Trong trường hợp này, cần theo dõi creatinin huyết thanh trong nhiều ngày liên tiếp kết hợp với các bằng chứng cận lâm sàng khác sẽ giúp chẩn đoán phân biệt.
b-Dựa vào siêu âm đo kích thước 2 thận: người bệnh tổn thương thận cấp, hai thận có kích thước bình thường hoặc to.
c-Sinh thiết thận: Cần cân nhắc kỹ khi chưa chẩn đoán phân biệt được với tổn thương thận cấp
3.3. Chẩn đoán các yếu tố làm nặng thêm tình trạng suy thận
Trước mọi trường hợp tăng đột ngột creatinin ở người bệnh bệnh thận mạn, hoặc trước mọi trường hợp người bệnh có créatinine huyết thanh tăng lúc nhập viện mà không biết créatinine huyết thanh cơ bản, cần tầm soát các yếu tố làm năng thêm hoặc đang thúc đẩy tình trạng suy thận
• Giảm thể tích máu lưu thông: mất dịch, mất máu, suy tim sung huyết.
• Thay đổi huyết áp như tăng hặc hạ huyết áp (thường do thuốc hạ áp).
• Nhiễm trùng.
• Tắc nghẽn đường tiểu.
• Thuốc độc cho thận: aminoglycoside, kháng viêm non steroid, thuốc cản quang
• Biến chứng mạch máu thận: tắc động mạch thận do huyết khối, hẹp động mạch thận, thuyên tắc động mạch thận do cholesterol…
3.4. Chẩn đoán biến chứng của bệnh thận mạn
Khi chức năng thận ổn định, ở mọi người bệnh bệnh thận mạn có mức lọc cầu thận ≤ 60 ml/ph/1,73 m2 da, cần đánh giá các biến chứng của BTM như:
• Tăng huyết áp: Tăng huyết áp làm tăng nguy cơ bệnh lý tim mạch
• Thiếu máu mạn: Theo WHO, thiếu máu khi Hb <13 g/L ở nam và <12 g/L ở nữ.
• Tình trạng suy dinh dưỡng: dựa vào giảm albumin huyết thanh, cân nặng, bảng điểm đánh giá dinh dưỡng toàn diện chủ quan (Subjective Global Assessment, SGA), chế độ dinh dưỡng.
• Rối loạn chuyển hóa calcium và phospho: giảm calcium, tăng phospho, tăng PTH huyết thanh gây cường tuyến phó giáp thứ phát, giảm vitamine D, tổn thương xương.
• Bệnh lý thần kinh: ngoại biên, trung ương, hệ thần kinh thực vật.
• Biến chứng tim mạch.
4- TIẾN TRIỂN VÀ BIẾN CHỨNG CỦA BỆNH THẬN MẠN
4.1. Tiến triển của bệnh thận mạn
Bệnh thận mạn có tiến triển suy giảm chức năng thận chậm trong nhiều năm, và không hồi phục đến giai đoạn cuối. Nếu người bình thường không bệnh thận, sau 30 tuổi, mỗi năm theo sinh lý, mức lọc cầu thận giảm trung bình 1ml/ph/1,73 m2 thì bệnh thận mạn được gọi là tiến triển nhanh khi mỗi năm mất ≥ 5 ml/ph (theo KDIGO 2012).
4.2. Các yếu tố ảnh hưởng lên tiển triển của bệnh thận mạn: 2 nhóm
a-Nhóm yếu tố không thay đổi được
• Tuổi: người lớn tuổi tiến triển bệnh nhanh hơn người trẻ
• Giới tính: nam tiến triển bệnh thận nhanh hơn nữ.
• Chủng tộc: da đen mắc bệnh đái tháo đường nguy cơ suy thận mạn giai đoạn cuối tăng gấp 2-3 lần nhiều hơn người da trắng.
• Yếu tố di truyền: Thận của trẻ sanh nhẹ cân (dưới 2500 g), sanh thiếu tháng, thận của trẻ có mẹ bị bệnh hoặc dùng thuốc độc thận trong thai kỳ nhạy cảm với tổn thương hơn trẻ khác.
• Chức năng thận nền lúc phát hiện bệnh đã giảm
b-Nhóm yếu tố có thể thay đổi được
• Mức độ protein niệu: protein niệu càng nhiều thì tốc độ suy thận càng nhanh.
• Bệnh thận căn nguyên: đái tháo đường, bệnh cầu thận có tiến triển suy thận nhanh hơn tăng huyết áp, bệnh ống thận mô kẽ.
• Mức độ tổn thương ống thận mô kẽ trên sinh thiết thận càng nhiều thì suy thận càng nhanh
• Tăng lipid máu
• Hút thuốc lá làm thúc đẩy quá trình xơ hóa cầu thận, ống thận và mạch máu
5- ĐIỀU TRỊ BỆNH THẬN MẠN
5.1. Mục tiêu điều trị bệnh thận mạn
• Điều trị bệnh thận căn nguyên
• Điều trị nguyên nhân gây giảm GFR cấp tính có thể hồi phục được
• Điều trị làm chậm tiến triển của bệnh thận mạn
• Điều trị các biến chứng tim mạch, và các yếu tố nguy cơ tim mạch
• Chuẩn bi điều trị thay thế thận khi thận suy nặng
5.2. Nguyên tắc điều trị bệnh thận mạn:
Theo KDOQI 2002, chiến lược chung điều trị bệnh thận mạn được phân theo giai đoạn của phân độ bệnh thận mạn
Bảng 3: Chiến lược điều trị bệnh thận mạn theo giai đoạn của BTM
| Giai đoạn | Mức lọc cầu thận (ml/ph/1,73 m2) | Việc cần làm (*) |
| 1 | ≥90 | Chẩn đoán và điều trị bệnh căn nguyên, giới hạn yếu tố nguy cơ gây suy thận cấp, làm chậm tiến triển bệnh thận, điều trị yếu tố nguy cơ tim mạch |
| 2 | 60-89 | + Ước đoán tốc độ tiến triển bệnh thận |
| 3 | 30-59 | +Đánh giá và điều trị biến chứng |
| 4 | 15-29 | + Chuẩn bị điều trị thay thế thận |
| 5 | ≤ 15 | Điều trị thay thế thận nếu có hội chứng uré huyết |
(*) giai đoạn sau tiếp tục việc của giai đoạn trước
5.3. Điều trị bệnh thận căn nguyên: giữ vai trò quan trọng nhất trong bảo vệ thận và làm chậm tiến triển bệnh thận. Khi thận đã suy nặng (giai đoạn 4, 5), do việc chẩn đoán bệnh căn nguyên trở nên khó khăn, và việc điều trị trở nên kém hiệu quả, nêncân nhắc giữa lợi ích và tác hại của thuốc điều trị căn nguyên ở nhóm người bệnh này.
5.4- Điều trị làm chậm tiến triển của BTM đến giai đoạn cuối (bảng 5)
Bảng 4: Các biện pháp bảo vệ thận tối ưu
| STT | Yếu tố cần can thiệp | Mục tiêu | Biện pháp |
| 1 | Giảm protein niệu, tiểu albumin | Protein/creatinine <0,5mg/g
Albumine/creatinine niệu < 30mg/g |
– Kiểm soát huyết áp
– Điều trị bệnh căn nguyên – Tiết chế protein trong khẫu phần – Dùng UCMC hoặc UCTT |
| 2 | Kiểm soát huyết áp | – Nếu người bệnh ACR< 30mg/g, HA mục tiêu ≤ 140/90 mmHg
– Nếu ACR≥ 30mg/g, HA mục tiêu ≤ 130/80mmHg |
Ức chế men chuyển và ức chế thụ thể angiotensin II: ưu tiên chọn, nhất là ở người bệnh có tiểu albumin |
| 3 | Ăn nhạt | Sodium < 2g /ngày (hoặc NaCl < 5g/ngày | Tự nấu ăn, không ăn thức ăn chế biến sẵn, không chấm thêm |
| 4 | Giảm protein trong khẩu phần | Áp dụng ở người bệnh GFR<30ml/ph/1,73, lượng protein nhập < 0,8g/Kg/ngày, | Giảm protein, chọn các loại đạm có giá trị sinh học cao (tư vấn chuyên gia dinh dưỡng) |
| 5 | Kiểm soát đường huyết | HbA 1C ≈ 7%
HbA 1C > 7%, ở người bệnh có nguy cơ hạ đường huyết cao |
Không dùng metformin khi GFR<60 ml/ph/1,73. |
| 6 | Thay đổi lối sống. | Đạt cân nặng lý tưởng, tránh béo phì, Bỏ hút thuốc lá | Tập thể lực tùy theo tình trạng tim mạch và khả năng dung nạp (ít nhất 30 ph/lần/ngày x 5 lần/tuần) |
| 7 | Điều trị thiếu máu | Hb 11-12g/dL | Erythropoietin, sắt, acid folic… |
| 8 | Kiểm soát rối loạn lipid máu | LDL- cholesterol <100 mg/dL, HDL- cholesterol> 40 mg/dL, triglyceride < 200mg/dL. | Statin, gemfibrozil
Fibrate giảm liều khi GFR<60, và không dung khi GFR<15 |
| 9 | Dùng thuốc ức chế men chuyển hoặc ứ chế thụ thể angiotensin II | Dùng lìều tối ưu để giảm protein niệu, và kiểm soát huyết áp | Phòng ngừa, và theo dõi các tác dụng phụ: suy thận cấp và tăng kali, hay xảy ra ở người bệnh GFR giảm |
6- DỰ PHÒNG
Do bệnh thận mạn thường tiến triển âm thầm, không triệu chứng đến giai đoạn cuối, nên mục tiêu quan trọng là phát hiện bệnh sớm ở 3 đối tượng nguy cơ cao là người bệnh đái tháo đường, tăng huyết áp, và gia đình có người bệnh thận. Các đối tượng này cần được làm xét nghiệm tầm soát định kỳ hằng năm và tích cực điều trị sớm tránh bệnh thận tiến triển đến giai đoạn cuối
Tài liệu tham khảo
1. Brenner B.M, 2012. The Kidney, 9th ed, Vol 1.
2. Braunward, Fauci et al, 2007. Harrison’s Principles of Internal Medicine, 15th ed.
3. Greenberg A, 2009. Primer on Kidney diseases,
4. K DOQI guideline- Chronic Kidney Disease, 2002. National Kidney Foudation, American Journal of Kidney Disease, 39 (2), Supp 1, p 1-242.
5-KDIGO guidelines 2012. The clinical practice guidelines for evaluation and management of Chronic kidney disease. Kidney International (2012), 3, 1-150
BỆNH THẬN MẠN GIAI ĐOẠN CUỐI
1- ĐẠI CƯƠNG VÀ ĐỊNH NGHĨA BỆNH THẬN MẠN GIAI ĐOẠN CUỐI
1.1. Các định nghĩa
• Bệnh thận mạn giai đoạn cuối (end stage renal disease, ESRD) là bênh thận mạn giai đoạn 5 (xem bài “hướng dẫn chẩn đoán và điều trị bệnh thận mạn). Đây là giai đoạn nặng nhất của bệnh thận mạn (BTM) với mức lọc cầu thận (GFR) < 15mL/ph/1,73 m2, biểu hiện bằng hội chứng urê máu, và tình trạng này sẽ gây tử vong nếu không được điều trị thay thế thận.
• Hội chứng urê máu (uremic syndrome) là một hội chứng lâm sàng và cận lâm sàng, gây ra không chỉ do sự gia tăng của urê huyết thanh, mà còn tăng hơn 100 sản phẩm có nguồn gốc nitơ khác trong máu như peptide, aminoacid, creatinin, …khi người bệnh bị suy thận (cấp hoặc mạn). Thuật ngữ chính xác hơn là “hội chứng tăng azote máu”. Do không phải chất nào cũng đo đạt được, nên cho đến nay, urê và créatinine tăng đồng nghĩa với sự tăng các sản phẫm azote khác.
• Tăng azote máu (azotemia) là sự gia tăng nồng độ các sản phẩm có nguồn gốc nitơ trong máu như protein, peptide, aminoacid, creatinin, urê, uric acid, ammoniac, hippurates, sản phẩm thoái hóa của acid nhân, polyamine, myoinositol, phenols, benzoates, và indoles.
1.2. Dịch tễ học của bệnh thận mạn giai đoạn cuối
Tần suất bệnh thận mạn (BTM) trong cộng đồng theo nghiên cứu NHANES III (Third National Health and Nutrition Examination Survey) tiến hành trên 15.625 người trưởng thành trên 20 tuổi, công bố năm 2007 là 13%. Cứ mỗi người bệnh BTM giai đoạn cuối đến điều trị thay thế thận, tương ứng với ngoài cộng đồng có khoảng 100 người đang bị bệnh thận ở những giai đoạn khác nhau.
Hiện nay trên thế giới có khoảng trên 1,5 triệu người BTM giai đoạn cuối đang được điều trị thay thế thận và số lượng người này ước đoán sẽ tăng gấp đôi vào năm 2020. Trên thực tế, do chi phí cao của các biện pháp điều trị thay thế thận nên điều trị thay thế thận chỉ áp dụng chủ yếu (80%) cho người bệnh tại các nước đã phát triển. Tại các nước đang phát triển chỉ 10-20% người bệnh BTM giai đoạn cuối được điều trị thay thế thận và thậm chí không có điều trị thay thế thận, và người bệnh sẽ tử vong khi vào BTM giai đoạn cuối.
2- NGUYÊN NHÂN
Ba nhóm nguyên nhân hằng đầu gây BTM giai đoạn cuối trên thế giới là (1) đái tháo đường, (2) tăng huyết áp, (3) bệnh cầu thận. Nếu tại các nước đã phát triển, đái tháo đường vẫn chiếm ưu thế trong khi tại các nước đang phát triển, nguyên nhân hằng đầu vẫn là bệnh cầu thận (30-48%).
3- TRIỆU CHỨNG LÂM SÀNG VÀ CẬN LÂM SÀNG:
Bệnh thận mạn giai đoạn cuối có biểu hiện của hội chứng urê huyết bao gồm ba rối loạn chính là:
(1) Rối loạn gây ra do sự tích tụ các chất thải, và độc chất trong cơ thể, quan trọng nhất là sản phẩm biến dưỡng của protein.
(2) Rối loạn là hậu quả của sự mất dần các chức năng khác của thận như điều hòa thăng bằng nội môi, nước điện giải, nội tiết tố
(3) Rối loạn là hậu quả của phản ứng viêm tiến triển gây ra ảnh hưởng lên mạch máu và dinh dưỡng.
3-1-Rối loạn chuyển hóa natri
Có thể tăng hoặc giảm natri máu
3.2. Rối loạn bài tiết nước
Tiểu đêm là triệu chứng của tình trạng thải nước tiểu và sodium với mức độ thẩm thấu cố định. Người bệnh dễ bị thiếu nước và muối, nếu tiết chế quá mức, và dễ giảm natri huyết thanh, nếu uống quá nhiều nước.
3.3. Rối loạn chuyển hóa kali
• Người bệnh suy thận mạn, thận tăng tiết aldosteron làm tăng thải kali tại ống thận xa, và tăng thải kali qua đường tiêu hóa. Do vậy, kali máu chỉ tăng ở BTM giai đoạn cuối. Cần tìm nguyên nhân khác nếu tăng kali xuất hiện trước giai đoạn cuối
• Giảm kali ít gặp hơn ở người bệnh BTM, chủ yếu do tiết chế nguồn nhập kali, kèm với việc dùng lợi tiểu quá liều, hoặc do tăng mất kali qua đường tiêu hóa.
3.4. Toan chuyển hóa
Suy thận mạn: lượng acid bài tiết bị khống chế trong khoảng hẹp từ 30-40 mmol/ngày, nên dễ bị toan chuyển hóa.
3.5. Rối loạn chuyển hóa calcium và phosphor
Suy thận mạn: thận giảm bài tiết phospho và calci, gây tăng phospho trong máu. Để duy trì tích số phospho và calci ổn định trong máu, calci máu giảm khi phospho tăng, kích thích tuyến cận giáp tiết PTH, làm tăng huy động calci từ xương vào máu, phức hợp calci – phospho tăng lắng đọng tại mô, gây rối loạn chu chuyển xương, tăng bài tiết phospho tại ống thận.
3.6. Rối loạn về tim mạch
Bệnh lý tim mạch là nguyên nhân hàng đầu gây bệnh và tử vong ở mọi giai đoạn của bệnh thận mạn, nhất là khi người bệnh đến giai đoạn cuối.
– Tăng huyết áp và dày thất trái
– Suy tim sung huyết
– Viêm màng ngoài tim
– d-Bệnh mạch máu
3.7. Rối loạn về huyết học
a- Thiếu máu ở người bệnh BTM
b- Rối loạn đông máu ở người bệnh BTM
Rối loạn đông máu bao gồm kéo dài thời gian máu đông, giảm hoạt tính của yếu tố III tiểu cầu, giảm độ tập trung tiểu cầu và giảm prothrombin.
c- Rối loạn chức năng bạch cầu
Rối loạn chức năng bạch cầu như giảm sản xuất bạch cầu, giảm chức năng bạch cầu do suy dinh dưỡng, toan chuyển hóa, môi trường tăng urê máu, và do teo hạch lympho.
3.8. Rối loạn tiêu hóa và dinh dưỡng
Buồn nôn và nôn
Ăn giảm đạm sẽ giúp giảm buồn nôn và nôn, tuy nhiên sẽ tăng nguy cơ suy dinh dưỡng.
3.9. Rối loạn thần kinh cơ
– Triệu chứng thần kinh cơ bắt đầu xuất hiện từ BTM giai đoạn 3 như giảm trí nhớ, kém tập trung, rối loạn giấc ngủ. Sau đó, tiến triển thành thần kinh kích thích như nấc cục, chuột rút, đau xoắn vặn cơ, nặng hơn trong giai đoạn suy thận nặng là rung vẫy, clonus cơ, co giật và hôn mê.
– Triệu chứng thần kinh ngọai biên xuất hiện từ BTM giai đoạn 4
– Triệu chứng rối loạn thần kinh cảm giác người bệnh BTM giai đoạn cuối là chỉ điểm người bệnh cần lọc máu.
– Bệnh thần kinh ngoại biên ở người bệnh BTM là chỉ định của điều trị thay thế thận, ngoại trừ tổn thương thần kinh trên người bệnh đái tháo đường.
3.10. Rối loạn nội tiết và chuyển hóa
• Hormone sinh dục: Ở người bệnh nữ, giảm estrogen gây rối loạn kinh nguyệt, giảm khả năng thụ thai và dễ sảy thai, nhất là khi mức lọc cầu thận giảm còn 40 ml/ph, chỉ có 20% sản phụ của thể sanh được con còn sống và ngược lại, thai kỳ sẽ đẩy nhanh tiến triển của suy thận. Ở người bệnh nam, giảm nồng độ testosteron, rối loạn tình dục, và thiểu sản tinh trùng.
• Các rối loạn nội tiết này sẽ cải thiện sau điều trị lọc máu tích cực hoặc sau ghép thận thành công.
3.11. Tổn thương da
Tổn thương da trên BTM đang tiến triển đa dạng như
• Da vàng xanh do thiếu máu, có thể giảm sau điều trị erythropoietin
• Xuất huyết da niêm, mảng bầm trên da do rối loạn đông cầm máu
• Da tăng sắc tố do tăng lắng đọng các sản phẩm biến dưỡng tăng sắc tố, hoặc urochrome, triệu chứng này có thể vẫn tồn tại và gia tăng sau lọc máu
• Ngứa là triệu chứng thường gặp ở người bệnh suy thận mạn và có thể kéo dài ngay sau khi đã được lọc máu.
• Bệnh da xơ do thận (nephrogenic fibrosing dermopathy) biểu hiện bằng tổn thương xơ tiến triển vùng mô dưới da vùng cánh tay và chân tương tự tổn thương da do phù niêm xơ hóa, xuất hiện ở người bệnh suy thận mạn, thường ở người bệnh đang lọc máu, có kèm dùng gadolinium trong chụp cộng hưởng từ (MRI) là một trong các nguyên nhân gây bệnh.
4- ĐIỀU TRỊ BỆNH THẬN MẠN GIAI ĐOẠN CUỐI (xem thêm bài “hướng dẫn chẩn đoán và điều trị bệnh thận mạn)
4.1. Mục tiêu của điều trị người bệnh BTM giai đoạn cuối là
– Chuẩn bị điều trị thay thế thận khi thận suy nặng
– Điều chỉnh liều thuốc ở người bệnh suy thận
– Điều trị các biến chứng của hội chứng urê huyết cao như thiếu máu, suy dinh dưỡng, tăng huyết áp, rối loạn chuyển hóa canxi – phospho, rối loạn nước điện giải.
– Điều trị các biến chứng tim mạch, và các yếu tố nguy cơ.
4.2. Điều trị triệu chứng
Tùy theo bệnh nhân có triệu chứng bất thường nào thì chọn phương pháp điều trị phù hợp
4.3. Chỉ định điều trị thay thế thận
Trừ phi người bệnh từ chối, mọi người bệnh BTM giai đoạn cuối, với lâm sàng của hội chứng urê huyết cao (thường xảy ra khi độ thanh thải creatinin dưới 15 ml/phút, hoặc sớm hơn ở người bệnh đái tháo đường) đều có chỉ định điều trị thay thế thận.
Các chỉ đinh điều trị thay thế thận:
– Tăng kali máu không đáp ứng với điều trị nội khoa
– Toan chuyển hóa nặng (khi việc dùng HCO3 có thể sẽ gây quá tải tuần hoàn).
– Quá tải tuẩn hoàn, phù phổi cấp không đáp ứng với điều trị lợi tiểu.
– Suy dinh dưỡng tiến triển không đáp ứng với can thiệp khẩu phần
– Mức lọc cầu thận từ 5-10ml/ph/1,73 m2 (hoặc BUN > 100mg/dL, créatinine huyết thanh > 10mg/dL)
Lựa chọn hình thức điều trị thay thế thận
Có ba hình thức điều trị thay thế thận bao gồm:
(1) Thận nhân tạo (hoặc thẩm tách máu, hemodialysis, HD)
(2) Thẩm phân phúc mạc (peritoneal dialysis, PD)
(3) Ghép thận.
Có thể lựa chọn một trong ba phương pháp, tùy vào từng trường hợp cụ thể của người bệnh
Bảng 1. Chống chỉ định chạy thận nhân tạo và thẩm phân phúc mạc, ghép thận
| Tuyệt đối |
Tương đối |
| Thận nhân tạo (HD) | |
| Không có đường lấy máu thích hợp | + Sợ kim chích
+ Suy tim + Rối loạn đông máu |
| Thẩm phân phúc mạc (PD) | |
| Mất hoàn toàn chức năng của màng bụng. | + Mới mổ ghép động mạch chủ bụng. |
| Sẹo dính trong phúc mạc làm ngăn cản dịch lọc dẫn lưu. | + Có shunt não thất – ổ bụng (trong não úng thủy). |
| Dịch lọc dò lên cơ hoành. | + Không dung nạp với chứa dịch trong ổ bụng. |
| Không có người giúp thay dịch lọc. | + Suy dinh dưỡng nặng.
+ Nhiễm trùng da. + Bệnh đường ruột (viêm ruột, viêm túi thừa). + Béo phì. |
| Ghép thận | |
| Không có chống chỉ định tuyệt đối | + Người nhận có nguy cơ thải ghép cao: phản ứng đọ chéo (cross-match) người nhận-người cho dương tính
+ Sức khỏe người nhận không cho phép thực hiện cuộc mổ. + Nhiễm cytomegalovirus (CMV), viêm gan virus C, nhiễm khuẩn đường mật, lao… + Bệnh nhân ung thư giai đoạn cuối, xơ gan mất bù, suy tim nặng… |
Tài liệu tham khảo
1. Brenner B.M, 2012. The Kidney, 9th ed, Vol 1.
2. Braunward, Fauci et al, 2007. Harrison’s Principles of Internal Medicine, 15th ed.
3. Greenberg A, 2009. Primer on Kidney diseases.
4. K DOQI guideline – Chronic Kidney Disease, 2002. National Kidney Foudation, American Journal of Kidney Disease, 39 (2), Supp 1, p 1-242.
5-KDIGO guidelines 2012. The clinical practice guidelines for evaluation and management of Chronic kidney disease. Kidney International (2012), 3, 1-150
THIẾU MÁU Ở BỆNH THẬN MẠN
1. ĐẠI CƯƠNG:
Thiếu máu ở người bệnh bệnh thận mạn (bao gồm cả bệnh thận giai đoạn cuối và ghép thận) là một tình trạng liên quan đến chức năng thận suy giảm và nhiều rối loạn khác như huyết học, dạ dày ruột, hocmon…Thiếu máu gặp ở 43% và 57% số người bệnh bệnh thận mạn tương ứng giai đoạn 1-2 và 3-5[3]. Nồng độ Hemoglobin(Hb) máu phụ thuộc vào độ tuổi, giới tính, chủng tộc, nhiễm trùng, viêm, các tình trạng bệnh tật đồng thời, việc lọc máu đầy đủ, chất lượng nước…[5]. Thiếu máu gây tăng tỷ lệ tử vong, tăng phì đại thất trái và suy tim xung huyết, tăng tốc độ tiến triển đến suy thận giai đoạn cuối[6]. Kết quả một nghiên cứu cho thấy, nguy cơ tử vong tăng lên 3 lần với mỗi 10g/l Hb giảm đi (trong khoảng 90-130g/l)[7].
2. CƠ CHẾ CỦA THIẾU MÁU Ở NGƯỜI BỆNH BỆNH THẬN MẠN
2.1.Thiếu Erythropoietin( EPO): (Là cơ chế chủ yếu). Bình thường, nồng độ Erythropoietin(EPO) từ 3-30 mU/ml, tăng lên 100 lần khi Hb giảm xuống. Mối liên quan nghịch này giảm hoặc mất đi khi mức lọc cầu thận <30 -40 ml/p. Một số cơ chế gây ra tình trạng thiếu EPO tương đối (1): thích nghi của thận giảm làm giảm tiêu thụ oxy, cải thiện sự oxy hóa ở phần tủy thận ngoài, giảm kích thích sản xuất EPO; (2): EPO được trung hòa bởi các receptor EPO hòa tan (tăng sản xuất khi có mặt các chất trung gian; (3): EPO bị bất hoạt bởi các proteinase( hoạt động tăng lên trong môi trường ure máu cao) ;(4): thậm chí nếu EPO với một lượng đầy đủ đến được một tủy xương nguyên vẹn, hoạt động của nó vẫn có thể bị suy yếu bởi sự vắng mặt của các yếu tố cho phép( IL-3, calcitriol,..) và sự có mặt của các yếu tố ngăn cản (PTH..).
2.2. Thiếu sắt: Bao gồm thiếu sắt tuyệt đối và tương đối
– Thiếu sắt tuyệt đối do một số nguyên nhân như mất máu, loạn sản mạch máu ruột, chảy máu do ure máu cao. Người bệnh thận nhân tạo mất sắt trung bình 1-3g/năm.
– Thiếu sắt tương đối( thiếu sắt chức năng) xảy ra khi cơ thể không thể huy động được đủ sắt từ nguồn dự trữ cung cấp cho quá trình sinh sản hồng cầu.
2.3. Tan máu: Ở người bệnh mắc bệnh thận mạn, tế bào hồng cầu bị tăng phá hủy. Hồng cầu có tính chất nhược sắc, ít sắt, sớm bị vỡ và bị thực bào. Màng tế bào hồng cầu giảm khả năng biến dạng. Tan máu có thể xảy ra trong thận nhân tạo do hiện tượng ly giải cơ học và tiếp xúc với chất gây ô nhiễm nguồn nước (chloramines, arsenic, kẽm…).
2.4. Thiếu dinh dưỡng: Đây là một trong những yếu tố dễ bị bỏ qua. Các Vitamin nhóm B (đặc biệt B6, B9 (acid folic), B12) là các đồng yếu tố thiết yếu trong sinh sản hồng cầu. L-carnitin giảm khi mức lọc cầu thận giảm và bổ sung L-Cartinine có thể chống lại sự chết tế bào. Giảm phosphate máu làm cạn kiệt ATP, giảm sự biến dạng màng tế bào hồng cầu, dẫn tới lão hóa sớm hoặc thậm chí là thiếu máu tan máu cấp.
3. CHẨN ĐOÁN
3.1. Chẩn đoán xác định:[1] [2]. Chẩn đoán thiếu máu ở người bệnh mắc bệnh thận mạn
+ > 15 tuổi: khi Hb<130g/l ở nam và <120g/l ở nữ
+ 12-15 tuổi: khi Hb <120g/l
+ 5-12 tuổi: khi Hb<115g/l
+ 6 tháng-5 tuổi: <110g/l
Kết quả Hb có thể dao động tới 5g/l trong một mẫu máu[4]. Ở người bệnh thận nhân tạo, nồng độ Hb khác nhau giữa các thời điểm. Mỗi lít siêu lọc làm tăng Hb đến 0,4g/dl. Vì vậy, nên xét nghiệm Hb vào buổi lọc máu giữa tuần, giá trị này thường xấp xỉ với Hb trung bình của cả tuần.
3.2. Tần suất đánh giá thiếu máu (đo lường nồng độ Hb máu)[2]
– Với người bệnh không thiếu máu
+ Ít nhất hàng năm với CKD giai đoạn 3
+ Ít nhất 2 lần/năm với CKD giai đoạn 4-5
+ Ít nhất mỗi 3 tháng với người bệnh thận nhân tạo hoặc lọc màng bụng.
– Với người bệnh thiếu máu không điều trị bằng ESA
+ Ít nhất mỗi 3 tháng với người bệnh mắc bệnh thận mạn không do đái tháo đường và người bệnh lọc màng bụng
+Ít nhất hàng tháng với người bệnh thận nhân tạo[2]
3.3. Đánh giá các tình trạng liên quan: Đánh giá sơ bộ bao gồm [2]
-Tế bào máu ngoại vi
– Đếm tế bào hồng cầu lưới tuyệt đối
– Ferritin máu
– Độ bão hòa transferin(TSAT)
– Nồng độ vitamin B12 và acid folic
Cần loại trừ thiếu máu do không tái tạo (bất sản) và các rối loạn tủy xương khác. Đo lường nồng độ EPO ít có giá trị và không được khuyến cáo.
Thiếu sắt có thể thực sự tồn tại kể cả khi chưa có thiếu máu. Thông số tốt nhất đánh giá dự trữ sắt là khó xác định. Một số chỉ số như MCH hoặc MCV gợi ý thiếu sắt nhưng không đặc hiệu. Trên lâm sàng, Ferritin máu thường được sử dụng. Bình thường, 1ng/ml ferritin tương ứng với 8 mg sắt dự trữ. Khi có tình trạng viêm mạn tính, Ferritin máu phản ánh không đúng tình trạng Ferritin ở mô. Ferritin máu cũng không quá liên quan đến tình trạng sắt ở tủy xương. Độ bão hòa transferring đại diện cho khả năng sẵn có của sắt cung cấp cho sinh sản hồng cầu nhưng giá trị thường dao động tại các thời điểm khác nhau. Một số chỉ số khác như lượng Hb trong hồng cầu lưới, tỷ lệ hồng cầu nhược sắc, TfR hòa tan( bài tiết bởi các hc trong tủy đang thiếu sắt )…đều không đặc hiệu. Nồng độ hepcidin máu và protoporphyrin hồng cầu được xem là có giá trị, tuy nhiên đo lường chính xác hepcidin máu hiện nay là bất khả thi trên lâm sàng.
4. ĐIỀU TRỊ:
4.1. ESAs(Erythropoiesis Stimulating Agents): vẫn là yếu tố quan trọng nhất (được trình bày ở một bài riêng, bài này chỉ đề cập đến một vài điểm chính)[2]
4.1.1. Thời điểm: Nên bắt đầu dùng ESAs cho người bệnh CKD có mức Hb 90-100g/l. Trước khi dùng, nên chẩn đoán và điều trị các nguyên nhân có thể gây thiếu máu khác, cân nhắc lợi ích và tác hại của thuốc đối với từng người bệnh cụ thể.
4.1.2. Mục tiêu: Nồng độ Hb mục tiêu là 115g/l. Ngừng liệu pháp ESAs nếu Hb>130g/l.
4.1.2. Liều:
– Liều khởi đầu: dựa vào Hb, cân nặng và tình trạng lâm sàng của người bệnh.
+ Với Epoetin alfa hoặc Epoetin beta là 20-50UI/kg x 3 lần mỗi tuần.
+ Với Darbeopetin-alfa là 0,45mg/kg x 1lần mỗi tuần tiêm dưới da hoặc tĩnh mạch, hoặc 0,75mg/kg x 1lần mỗi 2 tuần tiêm dưới da.
+ Với CERA là 0,6mg/kg x1 lần mỗi 2 tuần tiêm dưới da hoặc tĩnh mạch, hoặc 1,2mg/kg x1lần mỗi 4 tuần tiêm dưới da.
– Việc điều chỉnh liều nên dựa vào nồng độ Hb và sự thay đổi của nó, liều ESAs hiện dùng và tình trạng lâm sàng của người bệnh.
4.1.3. Đường dùng:
– Với người bệnh thận nhân tạo, nên tiêm ESAs dưới da hoặc tĩnh mạch
– Với người bệnh CKD và người bệnh lọc màng bụng, nên tiêm ESAs dưới da.
4.2. Bổ sung sắt:
4.2.1. Lợi ích: Bổ sung sắt luôn được nhấn mạnh như là một trong những điểm mấu chốt của điều trị thiếu máu ở người bệnh CKD. Hơn nữa, bổ sung sắt có thể có những lợi ích ngoài khía cạnh huyết học, bao gồm cải thiện các chức năng nhận thức, miễn dịch, điều nhiệt, thích nghi với luyện tập thể lực.
4.2.2. Các chế phẩm
– Sắt uống: thường đáp ứng hơn kém hơn sắt tĩnh mạch. Tuy vậy, do giá thành thấp và dễ sử dụng, sắt uống vẫn được sử dụng trước sắt tĩnh mạch. Đáp ứng kém được cho là (1): mất một lượng sắt qua thận nhân tạo trong khi sắt hấp thu qua ruột không kịp bù, (2) sự kết hợp tối đa của sắt và tế bào hồng cầu xảy ra muộn( 33 ngày so với 8,6 ngày nếu tiêm tĩnh mạch); (3): nồng độ hepcidin (tăng lên trong suy thận) cao gây ức chế hấp thu sắt uống từ tá tràng.
– Sắt tĩnh mạch: Nhiều dạng sắt tĩnh mạch sẵn có trên thị trường. Sắt dextrans có 2 loại cấu tạo: phân tử lượng cao (ít sử dụng do liên quan đến các phản ứng phản vệ) và phân tử lượng thấp. Sắt sucrose được dùng với liều ≤200-300 mg trong 2 giờ, liều 400-500 mg có thể gây hạ HA và co thắt động mạch vành . Sắt gluconate được dùng với liều 125-250 mg trong 1-4 giờ, liều cao hơn cũng thường gây hạ HA. Có nhiều lo ngại khi sử dụng sắt tĩnh mạch, bất kể chế phẩm nào. Nguy cơ của quá tải sắt khi tổng lượng sắt trong cơ thể >5g (vượt quá khả năng của hệ liên võng nội mô), ít gặp khi Ferritin máu <2000 ng/ml.
– Những thuốc sắt mới hoặc đang thực nghiệm:
+ Sắt uống: Các loại sắt heme được hấp thu qua dạ dày ruột hiệu quả 10 lần hơn sắt không heme.
+ Sắt tĩnh mạch: Ferurnoxytol(Feraheme), không có chứa sắt tự do, có thể dùng liều 510 mg trong 17 giây mà không tác dụng nặng nề nào. Sắt carboxymaltose (Ferinject), chứa một chút sắt tự do và có thể dùng liều 1g trong 15 phút. Sắt Isomaltoside 1000 mg (Monofer), là dạng sắt tĩnh mạch mới nhất, tương đối tinh khiết và có nhiều ưu điểm vượt trội.
4.2.3. Phác đồ bổ sung sắt[2]
– Nên cân nhắc lợi ích và những nguy cơ tiềm tàng (sốc phản vệ, các phản ứng dị cấp tính hoặc các nguy cơ lâu dài chưa được biết) trước khi kê toa.
– Người bệnh thiếu máu chưa sử dụng ESAs hoặc sắt, có thể dùng sắt tĩnh mạch (hoặc ở người bệnh mắc bệnh thận mạn không do đái tháo đường, có thể dùng sắt uống trong 1-3 tháng) nếu:
+ Nồng độ Hemoglobin tăng lên mà không cần phải bắt đầu sử dụng ESA và
+ TSAT ≤30% và ferrtin≤500 ng/ml
– Với người bệnh đang dùng ESAs không kèm bổ sung sắt, có thể dùng sắt tĩnh mạch (hoặc ở người bệnh mắc bệnh thận mạn không do đái tháo đường, có thể dùng sắt uống trong 1-3 tháng) nếu:
+ Nồng độ Hemoglobin tăng lên hoặc giảm được liều ESA và
+ TSAT ≤30% và ferritin≤500ng/ml
– Lựa chọn đường dùng dựa trên mức độ thiếu sắt, sự sẵn có một đường vào tĩnh mạch, đáp ứng với sắt uống trước đó, tác dụng phụ với sắt uống hoặc sắt tĩnh mạch trước đó, giá cả, sự chấp thuận của người bệnh.
– Hướng dẫn đường dùng sắt tiếp theo dựa trên đáp ứng cải thiện nồng độ Hb với liệu pháp bổ sung sắt gần đây, cũng như tình trạng mất máu tiếp diễn, các xét nghiệm đánh giá dự trữ sắt (TSAT, Ferritin), nồng độ Hb, đáp ứng với ESA và liều ESA, diễn biến của mỗi thông số và tình trạng lâm sàng của người bệnh.
– Với người bệnh trẻ em có thiếu máu nhưng hiện tại không sử dụng ESA hoặc bổ sung sắt, có thể dùng sắt uống (hoặc sắt tĩnh mạch ở người bệnh thận nhân tạo) khi TSAT≤20% và Ferritin ≤ 100ng/ml(≤100µg/l)
– Với người bệnh trẻ em đang điều trị bằng ESA nhưng không bổ sung sắt, có thể dùng sắt uống (hoặc sắt tĩnh mạch cho người bệnh thận nhân tạo) để duy trì TSAT>20% và Ferritin >100ng/ml(>100µg/l)
4.2.4. Đánh giá tình trạng sắt
– Đánh giá tình trạng sắt (TSAT và Ferritin) ít nhất 3 tháng trong quá trình điều trị bằng ESA, trước khi quyết định bắt đầu hoặc tiếp tục liệu pháp.
– Xét nghiệm tình trạng sắt (TSAT và Ferritin) thường xuyên hơn khi bắt đầu điều trị hoặc khi tăng liều ESA, khi có mất máu, khi theo dõi đáp ứng sau một đợt truyền sắt tĩnh mạch, và trong các hoàn cảnh khác khi có giảm dự trữ sắt.
4.2.5. Các cảnh báo khi bổ sung sắt
– Khi truyền sắt, nên theo dõi người bệnh 60 phút sau khi bắt đầu và nên chuẩn bị sẵn sàng các phương tiện hồi sức (bao gồm thuốc) cũng như đội ngũ y tế được đào tạo để xử trí các trường hợp phản ứng nghiêm trọng.
– Tránh sử dụng sắt tĩnh mạch ở người bệnh đang có nhiễm trùng toàn thân.
4.3. Truyền khối hồng cầu[2]
– Nên tránh truyền khối hồng cầu nếu có thể, để tối thiểu hóa những nguy cơ liên quan đến liệu pháp này.
– Ở người bệnh chờ ghép thận, đặc biệt nên tránh truyền khối hồng cầu để tối thiểu hóa nguy cơ mẫn cảm thận ghép.
– Tuy nhiên, truyền khối hồng cầu vẫn là cần thiết nếu:
+ Liệu pháp ESAs không hiệu quả (ví dụ bệnh Hemoglobin, suy tủy xương, kháng ESAs).
+ Nguy cơ của liệu pháp ESAs có thể lớn hơn lợi ích của nó (ung thư trước đó hoặc hiện tại, đột quỵ trước đó)
– Quyết định truyền khối hồng cầu khi không có mất máu cấp không nên dựa trên bất cứ ngưỡng Hemoglobin tùy ý nào, mà nên dựa trên sự hiện diện của các triệu chứng thiếu máu.
– Truyền khối hồng cầu cấp: Trong các tình huống cấp cứu, nên truyền khối hồng cầu khi lợi ích của nó nhiều hơn nguy cơ, bao gồm:
+ Cần điều trị thiếu máu nhanh chóng để ổn định tình trạng người bệnh (ví dụ chảy máu, bệnh động mạch vành không ổn định)
+ Cần điều trị thiếu máu nhanh chóng trước phẫu thuật
5. KẾT LUẬN
Thiếu máu thường gặp ở người bệnh CKD và gây tăng tỷ lệ bệnh tật và tử vong. Nguyên nhân là kết quả sự giao thoa các tình trạng sinh học-bệnh lý, bao gồm tình trạng thiếu sắt và thiếu EPO tương đối. Việc làm sáng tỏ hơn nữa nguyên nhân cũng như các đặc điểm chẩn đoán vẫn còn nhiều thách thức. Trong kỷ nguyên y học hiện đại, điều trị thiếu máu ở người bệnh mắc bệnh thận mạn đã tiến triển từ giai đoạn sơ khai (chủ yếu liên quan đến truyền máu), cho đến giai đoạn tiến bộ hiện nay (bao gồm điều trị bằng ESAs và bổ sung sắt), và tiếp tục phát triển với nỗ lực phát hiện những cơ chế và thuốc điều trị mới.
Tài liệu tham khảo
1. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease, 2006. Am J Kidney Dis.;47:S11
2. Kidney International Supplements (2012) 2, 283-330
3. Collins AJ et al, 2011. US Renal Data System 2010 Annual Data Report. Am J Kidney Dis. 57:A8
4. Kalantar et al, 2009. Hemoglobin variability in anemia of chronic kidney disease. J Am Soc Nephrol. 20:479
5. Ebben JP et al, 2006. Hemoblobin level variability: associations with comorbidity, intercurrent events, and hospitalizations. Clin J Am Soc Nephrol.1:1205
6. Astor BC et al, 2006. Kidney function and anemia as risk factors for coronary heart disease and mortality: the Atherosclerosis Risk in Communities Study. Am Heart J. 151:492
7. Macdougall IC et al, 2010. Relative risk of death in UK haemodialysis patients in relation to achieved haemoglobin from 1999 to 2005: an observational study using UK Renal Registry data incorporating 30.040 patient-years of follow-up. Nephrol Dial Transplant. 25:914
ĐIỀU TRỊ THIẾU MÁU BẰNG ERYTHROPOIETIN Ở BỆNH THẬN MẠN
1. ĐẠI CƯƠNG:
Thiếu máu là một trong các biến chứng thường gặp ở người bệnh suy thận mạn. Khi suy thận càng nặng thì tình trạng thiếu máu càng trầm trọng do thận giảm sản xuất Erythopoietin. Đây là chất cần thiết trong quá trình biệt hóa hồng cầu tại tủy xương.
Thiếu máu ở người bệnh suy thận mạn dẫn đến gia tăng nguy cơ bệnh tật và tử vong. Điều trị thiếu máu ở người bệnh suy thận mạn là một trong những mục tiêu quan trọng trong điều trị bảo tồn và điều trị thay thế. Tất cả các người bệnh bị thiếu máu mạn tính có liên quan đến bệnh thận mạn tính đều được xem xét chỉ định điều trị, tùy vào mức độ thiếu máu.
2. NGUYÊN NHÂN
Ở người bệnh suy thận mạn thiếu hụt Erythropoietin là nguyên nhân chính gây nên tình trạng thiếu máu, tuy nhiên một số nguyên nhân khác có thể thúc đẩy tình trạng thiếu máu nặng hơn như: thiếu sắt, suy dinh dưỡng, mất máu mạn tính trong thận nhân tạo chu kỳ, bệnh đường tiêu hóa mạn tính, tình trạng viêm mạn tính…
3. CHẨN ĐOÁN:
3.1. Chẩn đoán xác định:
Dựa vào nồng độ Hemoglobin để chẩn đoán xác định thiếu máu ở người bệnh suy thận mạn:
Ở người trưởng thành:
– Thiếu máu ở giới nữ khi Hb < 11,5 g/dl
– Thiếu máu ở giới nam khi Hb < 13,5 g/dl
2.1.1. Triệu chứng lâm sàng:
* Triệu chứng thiếu máu:
Mệt mỏi, da xanh niêm mạc nhợt, mất ngủ, nhịp tim nhanh, suy tim, suy giảm nhận thức, suy giảm chất lượng cuộc sống…
* Triệu chứng suy thận:
Mệt mỏi, phù, tiểu ít, tăng huyết áp, các dấu hiệu của hội chứng ure máu cao (chán ăn, nôn, buồn nôn…).
2.1.2. Cận lâm sàng:
* Công thức máu: thiếu máu khi có Hb giảm dưới 95% của người bình thường cùng giới, cùng độ tuổi:
– Hb<115g/L với phụ nữ trưởng thành.
– Hb<135g/L với nam giới trưởng thành.
* Chức năng thận:
– Ure, creatinin máu tăng
– Mức lọc cầu thận giảm,
– Điện giải đồ máu có thay đổi (Kali thường cao, canxi có thể giảm hoặc tăng tùy theo giai đoạn bệnh…)
* Xét nghiệm nước tiểu:
– Có protein niệu,
– Có hồng cầu niệu
– Có thể có bạch cầu niệu
* Siêu âm: hình ảnh thận tùy thuộc vào loại bệnh lý thận, giai đoạn bệnh thận mạn cụ thể
2.2. Chẩn đoán phân biệt
Cần phân biệt với tình trạng thiếu máu do các nguyên nhân khác gây ra:
– Thiếu máu do mất máu: xuất huyết tiêu hóa, ho ra máu, rong kinh, chấn thương…
– Thiếu máu do tạo máu không đủ: suy tủy xương, leucemia, thiếu nguyên liệu tạo máu…
– Thiếu máu do tan máu: tan máu tự miễn, tan máu do thuốc, Lupus…
2.3. Nguyên nhân thiếu máu ở người bệnh suy thận mạn
– Thiếu hụt Erythropoietin (quan trọng nhất).
– Do giảm đời sống hồng cầu.
– Do thiếu hụt các yếu tố tạo máu (sắt, vitamin B12, Acid Folic, protein…)
– Mất máu trường diễn…
4. ĐIỀU TRỊ THIẾU MÁU Ở NGƯỜI BỆNH SUY THẬN MẠN TÍNH
4.1. Chỉ định điều trị:
Có chỉ định điều trị thiếu máu ở người lớn khi nồng độ Hb <100g/L
4.2. Mục tiêu điều trị:
– Duy trì Hb 11g/dL – 12g/dL (Hct 33% – 36%) đạt được trong vòng 4 tháng kể từ khi bắt đầu điều trị bằng EPO (Erythropoietin người tái tổ hợp).
– Hb mục tiêu trên đây không áp dụng cho liệu pháp truyền máu.
4.3. Đánh giá một số yếu tố ảnh hưởng đến thiếu máu ở người bệnh suy thận mạn
– Cần đánh giá tình trạng dự trữ sắt thường xuyên để bổ sung sắt đầy đủ (đường tĩnh mạch hoặc đường uống) cho đến khi đặt mức Hb mục tiêu. Lưu ý cần ngừng truyền sắt tĩnh mạch 1 tuần trước khi xét nghiệm tình trạng sắt.
– Đánh giá số lượng hồng cầu lưới
– Đánh giá tình trạng viêm
– Đánh giá tình trạng dinh dưỡng
– Đánh giá tình trạng lọc máu đầy đủ
– Đánh giá tình trạng mất máu mạn tính
4.4. Điều trị bằng Erythropoietin (rHuEPO).
4.4.1. Loại EPO:
– EpoietinAlfa: Eperex, Epogen, Epokin, Epotiv…
– EpoietinBeta: NeoRecormon, Betapoietin…
– Darbepoetin alfa: Aranesp
– Methoxyl polyethylene glycol – epoetin beta: Mircera
4.4.2. Đường dùng:
Đường dùng có thể được lựa chọn tùy thuộc vào từng trường hợp cụ thể: tiêm tĩnh mạch hoặc tiêm dưới da.
– Đối với người bệnh suy thận mạn giai đoạn điều trị bảo tồn: có thể lựa chọn một trong các nhóm thuốc EPO nói trên, nên tiêm dưới da.
– Đối với người bệnh thận nhân tạo chu kỳ: nên tiêm tĩnh mạch EPO vào các buổi lọc máu. Tuy nhiên tiêm dưới da có thể giảm được liều EPO.
– Đối với người bệnh lọc màng bụng chu kỳ: EPO nên tiêm dưới da
– Có thể tiêm 1 lần/ tháng tùy theo đáp ứng điều trị đối với loại EPO thế hệ mới như Micera
4.4.3. Phác đồ điều trị:
Tấn công: với mục tiêu điều trị đạt mức Hb 11 – 12g/dl (KDOQI 2007 và KDIGO 2012 điều trị thiếu máu trong bệnh thận mạn))
Liều tấn công của EPO phụ thuộc vào nhiều yếu tố như mức độ thiếu máu và nguyên nhân cơ bản của thiếu máu.
+ EPO alfa và beta tiêm dưới da: 20 UI/kg x 3 làn/tuần hoặc 60 UI/kg x 1 lần/ tuần
+ EPO alfa và beta tiêm tĩnh mạch: 40 UI/kg x 3 lần/ tuần hoặc 120 UI/kg x 1 lần/tuần. Trẻ em dưới 5 tuổi liều 300 UI/kg/tuần.
+ Darbepoietin: 0,45 mcg/kg/tuần tiêm dưới da hoặc tĩnh mạch
Lưu ý cần kiểm tra Hb thường xuyên 2- 4 tuần/lần:
+ Nếu Hb tăng từ 1- 2 g/dl/tháng là hợp lý.
+ Nếu Hb tăng < 1g/dl/tháng thì cần tăng 25% liều mỗi tuần, hoặc
+ Nếu Hb tăng > 2g/dl/ tháng thì cần giảm 25-50% liều mỗi tuần.
Duy trì: khi đạt được mục tiêu điều trị với Hb 11 – 12g/dl ở người bệnh suy thận mạn
Liều duy trì thường thấp hơn từ trên 30% liều tấn công. Trong giai đoạn duy trì nên kiểm tra Hb mỗi 2 – 3 tháng.
– Không khuyến cáo Hb>13g /dl vì tăng nguy cơ tử vong do bệnh tim mạch
4.4.4. Một số nguyên nhân gây đáp ứng kém với thuốc EPO.
+ Thiếu sắt.
+ Nhiễm trùng/viêm (nhiễm trùng, phẫu thuật, AIDS, SLE..).
+ Mất máu mạn tính.
+ Cường cận giáp.
+ Viêm xơ xương, nhiễm độc nhôm.
+ Bệnh bất thường Hb (di truyền: Thalassem ias, bệnh hồng cầu hình liềm..).
+ Thiếu Vitamin B12 hoặc Folate.
+ Đa u tủy xương, suy dinh dưỡng, tan máu…..
Nếu những yếu tố trên đã được loại trừ, cần xem xét khả năng bị kháng với EPO (bất sản nguyên hồng cầu).
Trong một số trường hợp đáp ứng kém với điều trị có thể phối hợp thêm với truyền máu.
4.4.5. Tác dụng phụ của EPO.
Có thể gặp một số biểu hiện trên lâm sàng khi điều trị EPO, được coi như tác dụng không mong muốn của thuốc như:
– Hội chứng giả cúm.
– Đau đầu
– Tăng HA.
– Ngứa
– Nổi mẩn
– Huyết khối.
– Bất sản nguyên hồng cầu…
Cần theo dõi và xử trí kịp thời, tùy thuộc vào mức độ của các biểu hiện trên để xét tiếp tục điều trị hay ngừng điều trị.
Tài liệu tham khảo:
1. Nephrol Dial Transplant Vol.19 Suppl2, 2004
2.K/DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease, 2000
3. Am J Kidney Dialysis 2001; 37( Suppl 1): 182-235
4. European Best Practice Guidelines for the Management of Anaemia in Patients with Chronic Renal Failure
5. K/DOQI Clinical Practice Guideline and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease: 2007
6. KDIGO 2012 Clinical Practice Guideline for Anemia in Chronic Kidney Disease
7. Hướng dẫn điều trị thiếu máu của Hội Tiết niệu Thận học 2013
CHẨN ĐOÁN VÀ ĐIỀU TRỊ NỘI KHOA CƯỜNG CẬN GIÁP THỨ PHÁT Ở BỆNH NHÂN BỆNH THẬN MẠN TÍNH
I. ĐỊNH NGHĨA
– Cường cận giáp trạng thứ phát (Secondary hyperparathyroidism) là một rối loạn mắc phải, xảy ra thứ phát sau những rối loạn nguyên phát khác nhau, thường thấy ở bệnh nhân mắc bệnh thận mạn tính (chronic disease – CKD), đặc biệt là bệnh nhân suy thận mạn (STM) giai đoạn cuối dù bệnh nhân đã được điều trị thay thế.
– Đặc trưng của cường cận giáp thứ phát (CCGTP) do STM là tình trạng tăng chức năng của tuyến cận giáp để đáp ứng với tình trạng mất cân bằng calci – phospho do suy giảm chức năng thận gây ra.
II. GIẢI PHẪU VÀ SINH LÝ CHỨC NĂNG TUYẾN CẬN GIÁP
– Tuyến cận giáp (TCG) là những tuyến nội tiết có kích thước rất nhỏ nằm phía sau tuyến giáp. Tổng số lượng là 4 tuyến, bao gồm 2 TCG trên và 2 TCG dưới. Đôi khi có người có 5 – 6 TCG (chiếm khoảng 2,5% dân số), thậm chí 7 – 8 tuyến (hiếm gặp). Kích thước mỗi tuyến chỉ khoảng 6 x 3 x 2 mm.
– Tuyến cận giáp được cấu tạo gồm hai loại tế bào là tế bào chính và tế bào ưa oxy. Tế bào chính là thành phần cấu tạo chủ yếu của TCG, có chức năng bài tiết ra hormon TCG (parathyroide hormon hay parathormon – PTH). Tế bào ưa oxy chỉ bài tiết ra PTH trong các trường hợp bệnh lý.
– PTH được tổng hợp tại tế bào chính và được chứa trong các hạt dự trữ trong bào tương tế bào TCG. PTH toàn phần (intact PTH) sau khi được giải phóng vào máu có thời gian bán hủy rất ngắn khoảng 2 – 4 phút.Thận là nơi thoái hóa chủ yếu của PTH.
Tác dụng sinh học của PTH:
– Trên xương: PTH làm tăng hình thành hủy cốt bào ở xương và tăng hoạt hóa các tế bào này làm gia tăng quá trình hủy xương, vì vậy làm tăng huy động calci từ xương vào máu, làm tăng nồng độ calci máu.
– Trên thận: Làm giảm bài xuất ion calci tại thận do làm tăng tái hấp thu calci tại ống thận, đặc biệt là ống lượn xa và ống góp, và làm giảm tái hấp thu phospho tại ống lượn gần làm tăng đào thải phospho ra nước tiểu.
– Trên ruột: Tại thận, do PTH làm hoạt hóa quá trình tạo 1,25 dihydroxycholecalciferol từ vitamin D3 (cholecalciferol), làm tăng tái hấp thu ion calci từ ruột vào máu.
Như vậy PTH có tác dụng làm tăng nồng độ ion calci và ngược lại làm giảm nồng độ phospho trong máu.
III. SINH LÝ BỆNH CƯỜNG CẬN GIÁP THỨ PHÁT:
Cường cận giáp thứ phát là hậu quả của sự phối hợp các rối loạn do STM gây ra bao gồm sự tăng nồng độ phospho máu, sự giảm nồng độ calci máu, giảm tổng hợp calcitriol và một số rối loạn khác.
Vai trò của ion calci: Calci huyết thanh là cơ chế chủ yếu tham gia vào quá trình tổng hợp và bài tiết PTH. Nồng độ calci trong máu còn có tác động kích thích làm gia tăng nồng độ calcitriol và ức chế hoạt động của gen PTH.
Vai trò của tăng nồng độ phospho trong máu: Bệnh nhân STM luôn luôn có xu hướng dư thừa phospho máu do mức lọc cầu thận (MLCT) giảm gây giảm lọc và giảm bài tiết phospho tại thận. Tăng phospho máu gây kích thích làm tăng tiết PTH.
Vai trò calcitriol: Bệnh nhân STM có tình trạng giảm tổng hợp calcitriol tại thận. Giảm calcitriol huyết tương dẫn đến CCGTP thông qua ba cơ chế: Gây rối loạn điều hoà trực tiếp sự sản xuất PTH của TCG; làm giảm calci máu; sự đề kháng của xương đối với tác dụng tăng calci của PTH.
Sự đề kháng của xương với tác dụng của PTH: Bệnh nhân STM, đặc biệt là STM giai đoạn cuối có tình trạng đề kháng của xương với tác dụng của PTH. Như vậy, để duy trì chu chuyển xương bình thường thì đòi hỏi nồng độ PTH phải cao hơn bình thường.
Vai trò của FGF-23 (fibroblasts growth factor): Gần đây, các nghiên cứu cho thấy vai trò của FGF-23 trong chuyển hóa phospho. Bệnh nhân STM có hiện tượng tăng FGF – 23 huyết thanh.
Vai trò của toan máu: Toan chuyển hóa trong STM cũng tham gia vào quá trình gây CCGTP do làm thuận lợi hơn cho sự tăng phospho máu, bilan calci âm và gây ảnh hưởng tới quá trình tổng hợp calcitriol.
Giả thuyết về sự “thương lượng” (“trade-off”): Giả thuyết “trade-off” được đề cập bởi Bricker và các cộng sự. Ở bệnh nhân STM, nhằm thiết lập một tình trạng cân bằng về calci – phospho và duy trì chu chuyển xương bình thường đòi hỏi một sự trả giá là TCG phải tăng sản xuất và tăng bài tiết PTH, làm cho nồng độ PTH máu tăng cao. Sự “thương lượng” này diễn ra liên tục khi MLCT giảm dần đến khi xuất hiện tình trạng CCGTP.
Phì đại tuyến cận giáp: – Một trong những biến đổi đầu tiên của TCG khi STM là quá sản tế bào. Các rối loạn này diễn ra liên tục làm tăng nồng độ PTH máu , tăng PTH còn làm tăng sản phẩm Ca x P, làm tăng nguy cơ lắng đọng calci tại các tổ chức, trong đó có tim và mạch máu, làm tăng nguy cơ tử vong liên quan đến tim mạch.
IV. TRIỆU CHỨNG VÀ CHẨN ĐOÁN
1. Lâm sàng:
Triệu chứng lâm sàng của CCGTP do STM thường khởi phát từ từ, âm ỉ và không có triệu chứng rõ ràng. Khi đã có các triệu chứng thì nồng độ PTH huyết thanh thường đã tăng rất cao, gây các rối loạn chuyển hóa xương, đặc trưng là tình trạng loạn dưỡng xương do thận. Các triệu chứng thường gặp là:
– Đau xương: Mức độ có thể từ đau rất nhẹ cho đến rất nặng, không cử động được. Cảm giác đau thường mơ hồ, cảm giác đau sâu vùng thắt lưng cùng, khớp háng, gối và hai bên cẳng chân. Có thể gẫy xương bệnh lý, thường gặp ở cổ xương đùi và xẹp đốt sống.
– Yếu cơ: Yếu cơ, đặc biệt là các cơ gốc chi có thể làm bệnh nhân giảm khả năng vận động.
– Ngứa: Ngứa là do lắng đọng calci trong da, rất thường gặp ở bệnh nhân CCGTP nặng. Ngứa có thể tồn tại lâu dài, gây mất ngủ, ảnh hưởng đến sinh hoạt của bệnh nhân.
– Hoại tử da do calci: Hoại tử da có thể gặp do thiếu máu cục bộ ngoại biên hoặc do calci hóa các tiểu động mạch gây loét da.Tổn thương da đặc trưng là những vùng nhạt màu, hay gặp ở đầu ngón chân, ngón tay, mắt cá, đùi kèm theo đau tại chỗ. Nặng hơn, tổn thương có thể tiến triển dẫn đến xuất huyết và thiếu máu cục bộ gây hoại tử khô.
– Viêm quanh khớp: Bệnh nhân đau dữ dội kèm sưng, nóng đỏ xung quang một hoặc nhiều khớp. Đau có thể ở mắt cá chân hoặc ở bàn chân mà không có dấu hiệu viêm tại chỗ.
– Đứt gân tự phát: Thường xảy ra ở gân cơ tứ đầu, tam đầu, các gân duỗi các ngón tay.
– Biến dạng xương: Uốn cong xương chày, xương đùi, biến dạng các đầu xương, hay gặp đầu xương dài phình ra ở tuổi thiếu niên.
– Calci hóa ngoài xương: Calci hóa các động mạch kích thước trung bình; calci hóa cạnh khớp và khối u calci; calci hóa nội tạng: tim, phổi, thận…
– Chậm phát triển: Gặp ở trẻ em bị suy thận mạn.
– Các triệu chứng khác: Đau bụng, buồn nôn, nôn, chán ăn; viêm tuỵ; loét dạ dày (do nồng độ calci máu cao kích thích dạ dày tiết nhiều dịch vị acid); lú lẫn, suy giảm trí nhớ; bệnh lý thần kinh ngoại biên; thiếu máu, giảm bạch cầu (do phá hủy tủy xương), giảm chức năng tiểu cầu; tăng huyết áp, bệnh lý cơ tim (phì đại thất trái).
2. Triệu chứng cận lâm sàng:
2.1. Xét nghiệm sinh hóa máu:
– Nồng độ calci máu thường hạ trong giai đoạn đầu, giai đoạn sau có calci máu tăng.
– Phospho máu luôn tăng trong cường cận giáp thứ phát.
– Magie máu thường tăng.
– Phosphatase kiềm giảm.
– Nồng độ PTH máu tăng trên 5 lần giá trị bình thường (trên 300 pg/ml hoặc trên 33 pmol/l) ở bệnh nhân STM hay bệnh nhân lọc máu chu kỳ.
2.2. Chẩn đoán hình ảnh:
a. X-quang: Cường cận giáp trạng dẫn đến loạn dưỡng xương. Thay đổi sớm nhất của xương là sự hủy xương dưới màng xương. Giai đoạn muộn có loãng xương toàn thân, hủy xương, hình ảnh các hốc xương và gây biến dạng xương.
b. Đo mật độ xương: Có nhiều phương pháp đo, tuy nhiên đo mật độ xương bằng phương pháp hấp thụ tia X năng lượng kép (Dual – Energy X-ray Absorptiometry – DEXA) được coi là kỹ thuật chuẩn trong đánh giá mật độ xương và chẩn đoán loãng xương. Kết quả đo mật độ xương có thể cho thấy có giảm mật độ xương hoặc loãng xương.
c. Siêu âm: Siêu âm 2D hoặc siêu âm Doppler cho thấy hình ảnh khối giảm âm, nhiều mạch máu nuôi, nằm gần các cực của tuyến giáp, hay gặp nhiều ở một tuyến và ở cực dưới. Hạn chế của siêu âm là khó xác định TCG lạc chỗ và có thể nhầm lẫn giữa phì đại TCG với nhân tuyến giáp hoặc hạch bạch huyết.
d. Chụp CT scan và MRI: Hình ảnh khối choán chỗ cạnh các cực của tuyến giáp. Rất có ý nghĩa trong trường hợp TCG lạc chỗ trong lồng ngực cạnh tuyến ức hoặc ở những vị trí khác.
e. Xạ hình tuyến cận giáp (Scintigraphy): Xạ hình TCG bằng đồng vị phóng xạ Iodine-123, Thallium-201 hoặc 99mTechnetium-methoxyisobutylisonitrile (99mTc-MIBI) giúp đánh giá vị trí, hình dáng, kích thước, chức năng của TCG.
Kỹ thuật xạ hình bằng 99mTc-MIBI bắt đầu được sử dụng từ năm 1989 và hiện nay dần trở nên phổ biến trong thăm dò TCG. Độ nhạy của xạ hình với 99mTc-MIBI cho việc phát hiện phì đại TCG kém hơn so với adenom TCG. Đôi khi xảy ra âm tính giả (TCG tổn thương không bắt MIBI) hoặc dương tính giả (hạch lympho ở vùng cổ, tuyến giáp bị tổn thương có thể giữ lại MIBI). Để khắc phục hiện tượng này người ta có thể dùng kỹ thuật xóa nền các hình ảnh của tuyến giáp.
f. Sinh thiết xương: Kết quả mô bệnh học xương giúp chẩn đoán chính xác bệnh xương do cường cận giáp, bệnh xương hỗn hợp hay nhuyễn xương.
V. ĐIỀU TRỊ CƯỜNG GIÁP TRẠNG THỨ PHÁT DO SUY THẬN MẠN
1. Điều trị nội khoa:
1.1. Kiểm soát phospho máu:
a. Mục tiêu: Theo NKF-K/DOQI (2003):
+ CKD giai đoạn 3-4: Nồng độ phospho máu nên duy trì trong khoảng 2,7 mg/dl (0,87mmol/l) – 4,6 mg/dl (1,49 mmol/l). Cần định lượng calci và phospho mỗi 12 tháng/lần với CKD giai đoạn 3 và mỗi 3 tháng/lần với CKD giai đoạn 4.
+ CKD giai đoạn 5, lọc máu chu kỳ hoặc lọc màng bụng: Nồng độ phospho máu nên duy trì trong khoảng 3,5 mg/dl (1,13 mmol/l) – 5,5 mg/dl (1,78 mmol/l). Định lượng calci và phospho máu hàng tháng để theo dõi.
b. Chế độ điều trị:
– Chế độ ăn kiêng nghèo phospho 800-1000 mg/ngày (điều chỉnh theo chế độ ăn giảm đạm). Hạn chế các thức ăn giàu phospho: sữa và các chế phẩm từ sữa, đậu đỗ, hạt dẻ, bánh mì, gan, thịt… Khi MLCT < 20-30 ml/ph, tình trạng tăng phosphat máu ngày càng nặng thì việc sử dụng các chất gắp phospho ở ruột là cần thiết.
– Các thuốc gắp phospho:
+ Trước kia thường sử dụng các chất gắp phospho có chứa nhôm, ngày nay ít sử dụng do nguy cơ ngộ độc nhôm. Hiện nay các chất gắp phospho có chứa calci được sử dụng rộng rãi hơn. Thuốc được sử dụng cùng với bữa ăn có chứa phospho nhằm làm hạn chế hấp thu phospho và tăng hấp thu calcium ở đường tiêu hóa. Tuy nhiên cần điều chỉnh liều lượng tùy theo các xét nghiệm về calci, phospho và nồng độ PTH để tránh nguy cơ tăng calci máu.
+ Bệnh nhân CKD giai đoạn 3-4 thường được sử dụng thuốc gắp phospho có chứa calci (calci carbonate, calci acetat). CKD giai đoạn 5 có thể sử dụng thuốc gắp phospho có chứa calci và/hoặc thuốc gắp phospho không chứa calci (Sevelamer hydrochlorid (RenaGel®). Tỉ lệ tăng calci máu ở bệnh nhân thận nhân tạo sử dụng Sevelamer hydrochlorid thấp hơn so với sử dụng calcium acetat.
+ Tổng liều calci nguyên tố từ thuốc gắp phospho có chứa calci không vượt quá 1500 mg/ngày. Nên chỉ định thuốc gắp phospho không chứa calci cho bệnh nhân lọc máu có tăng calci huyết hoặc có PTH < 16,5 pmol/l ở 2 lần xét nghiệm kế tiếp hoặc có calci hóa ngoài xương nặng. Khi sử dụng chất gắp phospho có chứa calci có nguy cơ làm nặng thêm tăng tình trạng calci máu, khi đó cần giảm nồng độ calci trong dịch lọc xuống dưới 2.5 mEq/l.
1.2. Kiểm soát calci:
Khi MLCT < 50 ml/ph thì hấp thu calci ở hệ tiêu hóa giảm do giảm tổng hợp calcitriol ở thận. Việc cung cấp đủ lượng calci để gắp phospho có thể giúp đảo ngược cân bằng âm của calci. Nếu bệnh nhân điều chỉnh tốt nồng độ phopsho mà có nồng độ calci máu thấp vẫn cần bổ sung calci.
a. Mục tiêu điều trị: Theo khuyến cáo của NKF – K/DOQI.
– CKD giai đoạn 3-4: Kiểm soát calci ở giới hạn bình thường.
– CKD giai đoạn 5: Giữ nồng độ calci máu 2,1 – 2,37 mmol/l.
– Sản phẩm Ca x P < 55 mg2/dl2.
b. Điều trị:
– Bổ sung muối calci. Tổng lượng calci nguyên tố (bao gồm cả thuốc và thức ăn) đưa vào cơ thể không quá 2000 mg/ngày. Nếu bệnh nhân có nồng độ calci máu < 2,1 mmol/l kèm các triệu chứng của hạ calci, nồng độ PTH trên giới hạn cho phép phải điều trị bằng Calci carbonate và/hoặc vitamin D đường uống.
– Khi có tăng calci máu > 2,54 mmol/l cần giảm liều thuốc gắp phospho có chứa calci hoặc chuyển sang thuốc gắp phospho không chứa calci, nên giảm liều hoặc tạm ngưng điều trị vitamin D. Bệnh nhân thận nhân tạo nên sử dụng dịch lọc có nồng độ calci thấp (1,5-2,0 mEq/l) trong 3-4 tuần.
1.3. Kiểm soát PTH:
a. Mục tiêu:
– CKD giai đoạn 3: giữ PTH ở mức 35 – 70 pg/ml hay 3,85 – 7,7 pmol/l. Định lượng PTH huyết thanh mỗi 12 tháng/lần.
– CKD giai đoạn 4: giữ PTH ở mức 70 – 110 pg/ml hay 7,7 – 12,1 pmol/l. Định lượng PTH huyết thanh mỗi 3 tháng/lần.
– CKD giai đoạn 5 hay lọc máu chu kỳ: giữ PTH ở mức 150 – 300 pg/ml hay 16,5 – 33 pmol/l. Định lượng PTH huyết thanh mỗi 3 tháng/lần.
b. Điều trị:
– Do nồng độ calcitriol máu giảm đóng vai trò quan trọng trong bệnh học của CCGTP do STM nên sử dụng calcitriol có vai trò quan trọng trong điều trị CCGTP. Có thể bổ sung vitamin D (calcitriol) hoặc các chất tương tự vitamin D (doxercalciferol, alfacalcidol, paricalcitol). Cung cấp calcitriol có ích trong giảm nồng độ PTH và cải thiện đáng kể các triệu chứng trên tế bào học xương.
– Sử dụng calcitriol tùy theo mức độ của STM và mức độ cường cận giáp. Ở giai đoạn sớm của STM, sử dụng liều thấp calcitriol có thể đã đủ để hạn chế cường cận giáp. Cần theo dõi sát calci máu và calci niệu để tránh tăng calci máu và làm tổn hại thêm chức năng thận. Ở bệnh nhân STM giai đoạn cuối có thể sử dụng liều cao calcitriol. Khi CCGTP mức độ rất nặng (PTH > 2000 pg/ml), giảm PTH bằng điều trị calcitriol sẽ không hiệu quả. Vì vậy việc cung cấp calcitriol hoặc tăng nồng độ calci máu sẽ ít có hiệu quả làm giảm tổng hợp PTH. Những TCG phì đại như vậy cần phải phẫu thuật.
2. Can thiệp tuyến cận giáp
Khi điều trị nội khoa không điều chỉnh được các rối loạn của CCGTP thì cần tiến hành can thiệp TCG. Các biện pháp can thiệp bao gồm tiêm ethanol vào TCG dưới hướng dẫn siêu âm, điều trị bằng siêu âm cường độ cao tập trung và phẫu thuật cắt tuyến cận giáp.
2.1. Tiêm tuyến cận giáp bằng ethanol:
Là phương pháp được phát hiện lần đầu bởi Luigi Solbiati năm 1980 và phát triển ở Nhật những năm đầu thập kỷ 90.
a. Chỉ định:
– Nồng độ PTH toàn phần ≥ 400 pg/ml.
– Bằng chứng của viêm xơ xương hoặc bệnh xương trên X-quang và các marker chuyển hóa xương.
– Phì đại tuyến cận giáp trên siêu âm.
– Điều trị thuốc không hiệu quả.
– Bệnh nhân đồng ý làm thủ thuật.
b. Chống chỉ định:
– Phì đại tuyến ở vị trí xác định trên siêu âm là không thể chọc kim vào được.
– Liệt dây thần kinh thanh quản bên đối diện.
– Dự định phẫu thuật vùng cổ do nhiều nguyên nhân (carcinoma tuyến giáp…)
– Không có phẫu thuật viên có kinh nghiệm hoặc các phương tiện cần thiết.
– Khi có trên 3 tuyến phì đại thì cân nhắc kỹ vì thủ thuật có thể không có hiệu quả.
2.2. Điều trị bằng siêu âm cường độ cao tập trung (HIFU)
– Siêu âm cường độ cao tập trung (HIFU) là một biện pháp không xâm nhập dựa trên sóng siêu âm ngoài cơ thể tập trung lên mô đích là TCG. Năng lượng xuyên qua da nhưng không làm tổn thương da đến tận điểm tập trung – nơi mà nhiệt độ sẽ tăng lên.
a. Chỉ định:
– Bệnh thận mạn giai đoạn 5 có PTH toàn phần > 800 pg/ml.
– Phì đại TCG dạng nhân hoặc phì đại lan tỏa dựa trên chẩn đoán hình ảnh.
– Điều trị thuốc cũng như tiêm ethanol vào TCG không hiệu quả.
– Bệnh nhân không thể phẫu thuật TCG.
b. Chống chỉ định:
– Đã phẫu thuật TCG và không có phì đại tuyến.
– Tiền sử u vùng cổ hoặc đã tia xạ vùng cổ
– Phụ nữ có thai hoặc cho con bú.
2.3. Phẫu thuật cắt tuyến cận giáp:
a. Chỉ định:
– Cường cận giáp nặng với sự tồn tại dai dẳng của PTH toàn phần > 800 pg/ml (> 88 pmol/l) mặc dù đã điều trị tối ưu.
– PTH toàn phần > 50 pmol/l dù đã điều trị tối ưu kết hợp với một trong các dấu hiệu sau:
+ Tăng calci máu (nồng độ calci > 2.4 mmol/l).
+ Nồng độ phospho > 1.6 mmol/l.
+ Sản phẩm Ca x P > 4 mmol2/l2.
+ Có hoại tử da.
+ Tiến triển của mất mật độ khoáng ở xương cột sống thắt lưng hoặc xương chậu mặc dù đã điều trị tối ưu.
– Khi bệnh nhân phải chịu đựng lâu dài những triệu chứng như đau xương khớp, yếu cơ, thiếu máu kháng erythropoietin, bệnh cơ tim thì cũng cân nhắc phẫu thuật TCG.
b. Chống chỉ định (tương đối):
– Bệnh nhân đã phẫu thuật hoặc tia xạ vùng đầu cổ.
c. Kỹ thuật:
– Nguyên tắc là phải tìm tất cả các TCG (thường là 4 tuyến).
– Ba kỹ thuật chính của phẫu thuật TCG là cắt TCG bán phần, cắt TCG toàn bộ và ghép TCG tự thân ngay sau khi cắt TCG toàn bộ.
d. Biến chứng:
– Hạ calci máu nặng.
– Suy tuyến cận giáp.
– Tổn thương dây thần kinh quặt ngược.
– Tái phát CCGTP sau một thời gian dài là do tình trạng STM vẫn tồn tại. Tuy nhiên nếu tái phát CCG quá nhanh thì phải nghĩ tới do phần tuyến để lại quá lớn.
– Hoại tử một phần hoặc toàn bộ phần TCG để lại hoặc phần TCG ghép vào cẳng tay.
Tài liệu tham khảo:
1. Phạm Thị Minh Đức. “Sinh lý nội tiết”, Sinh lý học, tập II. Nhà xuất bản Y học, Hà Nội, 2005, tr. 109-113.
1. Pablo Ureña. Use of calcimimetics in uremic patients with secondary hyperparathyroidism: Review. Artif Organs, Vol. 27, No. 9, 2003.
2. Wajeh Y. Qunibi (2009). “Renal Osteodystrophy”, Principle and Practice of Dialysis, 4th, Lippincott Williams & Wilkins, p. 428-444.
3. “K/DOQI Clinical Practice guidelines for bone Metabolism and Disease in Chronic Kidney Diseases”, American Journal of Kidney Diseases, Vol 42, No4, Suppl3 (Oct).
4. Stephen J. McPhee, Maxine A. Papadakis, Lawrence M. Tierney (2008). “Chronic Kidney Disease”, Current Medical Diagnosis & Treatment.
5. Wissam Saliba, Boutros El-Haddad (2009). “Secondary Hyperparathyroidism: Pathophysiology and Treatment”, J Am Board Fam Med, 22(5):574-581.
CHẨN ĐOÁN NGUYÊN NHÂN VÀ XỬ TRÍ MỘT SỐ BIẾN CHỨNG THƯỜNG GẶP TRONG QUÁ TRÌNH LỌC MÁU
Có các biến chứng thường gặp: hạ huyết áp; vọp bẻ (chuột rút); buồn nôn – nôn; nhức đầu; đau ngực; đau thắt lưng; ngứa; sốt.
Các biến chứng ít gặp nhưng nghiêm trọng: hội chứng mất quân bình; phản ứng với màng lọc; rối loạn nhịp; chảy máu trong sọ; động kinh; tán huyết; thuyên tắc khí.
I. BIẾN CHỨNG THƯỜNG GẶP
1. HẠ HUYẾT ÁP (xem trong “Hướng dẫn chẩn đoán nguyên nhân và xử trí hạ huyết áp trong quá trình lọc máu”)
2. VỌP BẺ (CHUỘT RÚT): Tỷ lệ: 5 – 20%
a) Nguyên nhân:
– Hạ huyết áp
– Giảm thể tích máu tuần hoàn (Người bệnh dưới trọng lượng khô)
– Siêu lọc cao (tăng cân nhiều)
– Nồng độ Na+ trong dịch lọc thấp.
– Tình trạng Mg++, Ca++, K+ trong máu thấp, trước khi lọc máu (chạy thận nhân tạo = CTNT).
b) Xử trí: tương tự như trong các trường hợp hạ huyết áp
3. BUỒN NÔN – NÔN: Tỷ lệ: 5-15%
a) Nguyên nhân:
– Hạ huyết áp
– Biểu hiện sớm của hội chứng mất quân bình
– Phản ứng với màng lọc: type A , type B (coi phần “phản ứng màng lọc” )
– Liệt ruột ở người bệnh đái tháo đường
b) Xử trí: như trường hợp hạ huyết áp
– Lưu ý ở người bệnh hạ huyết áp kèm theo mất ý thức có nguy cơ hít phải chất nôn.
– Thuốc chống nôn: Metoclopamide
c) Phòng ngừa
– Phòng ngừa hạ huyết áp
– Nếu nôn ói không phải do hạ huyết áp, dùng thuốc: Metoclopamide
4. NHỨC ĐẦU
a. Nguyên nhân: không rõ, có thể là biểu hiện của hội chứng mất quân bình (coi thêm “Hội chứng mất quân bình”)
b. Triệu chứng: dữ dội, không điển hình, lưu ý nguyên nhân thần kinh trung ương.
c. Xử trí: acétaminophen
5. ĐAU LƯNG – ĐAU NGỰC: Tỷ lệ: 1 – 4%
a. Nguyên nhân: không rõ
b. Không có điều trị, phòng ngừa đặc hiệu
c. Một số trường hợp: do thay đổi chủng loại màng lọc
LƯU Ý: đây là triệu chứng của: tán huyết, thuyên tắc khí, viêm màng ngoài tim …
6. NGỨA: Là triệu chứng của người bệnh CTNT. Tăng mức độ khi CTNT. Ngứa chỉ xảy ra khi CTNT kèm theo trịêu chứng dị ứng khác.
a. Nguyên nhân:
– Dị ứng với màng lọc hay dây máu.
– Viêm gan do thuốc hay do nhiễm virus
– Lắng đọng trên da các tinh thể: Mg++, Ca++, Phospho…
– Hay do cường phó giáp trạng thứ phát
b. Xử trí:
– Kháng histamine
– Châm cứu hoặc chiếu tia cực tím (Ultraviolet therapy)
– Làm ẩm, trơn da.
– Điều chỉnh: Ca , Phospho , PTH máu về mức bình thường
– CTNT đủ liều, dùng màng lọc High flux
7. SỐT LẠNH RUN
a. Nguyên nhân: Nhiễm trùng, đặc biệt khi để catheter lâu ngày.
– Vệ sinh kém.
– Nguồn nước không đảm bảo.
– Dị ứng hóa chất tiệt trùng màng lọc.
b. Xử trí: Sử dụng kháng sinh nếu nghi ngờ có nhiễm khuẩn
c. Phòng ngừa:
– Đảm bảo vô trùng khi thao tác kỹ thuật.
– Giữ vệ sinh nơi đặt catheter, không để catheter lâu ngày
– Rửa sạch màng lọc với nhiều nước.
8. TẠO CỤC MÁU ĐÔNG
a. Nguyên nhân:
– Vị trí kim tiêm fistule
– Catheter tĩnh mạch trung tâm có vấn đề
b. Triệu chứng:
– Tăng áp lực tĩnh mạch, máy báo TMP
– Máu đỏ sẫm trong dây máu hoặc trong bầu nhỏ giọt.
– fibrin xuất hiện trong bầu nhỏ giọt (dạng “sợi”)
– Có thể thấy cục máu đông hoặc máu đen vón cục trong bầu nhỏ giọt hoặc quả lọc.
c. Xử trí:
– Kháng đông
9. RÒ RỈ MÁU SANG NGĂN DỊCH LỌC
a. Nguyên nhân:
Màng lọc vỡ khiến máu rò rỉ sang ngăn dịch lọc.
b. Triệu chứng:
– Máy báo rò rỉ máu
– Test máu trong dịch lọc (+)
c. Xử trí:
– Kiểm tra rò rỉ máu trong dịch lọc thải ra
– Nếu dương tính, dừng điều trị, Không trả máu.
– Nếu âm tính, có thể cần phải đổi máy khác.
II. BIẾN CHỨNG ÍT GẶP NHƯNG NGHIÊM TRỌNG
1. HỘI CHỨNG MẤT QUÂN BÌNH
a. Nguyên nhân: hay gặp ở người bệnh:
– BUN cao nhiều khi bắt đầu CTNT.
– Người bệnh lớn tuổi.
– Người bệnh có tổn thương não trước đó.
– Nhiễm toan chuyển hóa nặng.
b. Lâm sàng:
– Thể trung bình: nhức đầu, buồn nôn.
– Thể nặng: người bệnh bứt rứt, không yên, huyết áp tăng cao, mất định hướng, động kinh, hôn mê, có thể tử vong.
*. Sinh lý bệnh:
– Phù não
– Dịch não tủy bị toan hóa
c. Xử trí:
– Nhẹ: không điều trị đặc hiệu.
– Nặng ( động kinh, hôn mê):
+ Ngưng CTNT
+ Chống động kinh: diazépam
+ Săn sóc người bệnh hôn mê, giữ thông đường thở, có thể thở máy
2. TÁN HUYẾT
a. Nguyên nhân: thường có liên quan đến kỹ thuật
– Đường dây máu ngoài cơ thể bị vặn, xoắn, gấp…
– Bơm máu được cân chỉnh không chính xác hoặc hoạt động kém.
– Áp lực âm quá mạnh trong hệ thống dây máu
– Tắc nghẽn trong bơm máu
– Vấn đề dịch lọc:
+ Dịch lọc quá nóng, > 42°C
+ Dịch lọc nhược trương
+ Dịch lọc có chứa các chất như: formaldéhyde, chất tẩy, chloramine, chất đồng, fluorite nitrate…
b. Triệu chứng:
– Đau lưng, nặng ngực, thở nông, mệt, buồn nôn, nhức đầu, hạ huyết áp, thiếu máu cấp, tăng kali máu.
– Máu trở về có màu nâu lợt. Huyết tương ly tâm có màu hồng
c. Xử trí:
– Ngưng CTNT. Không truyền trả phần máu còn ngoài cơ thể
– Xét nghiệm kiểm tra: ion đồ, toan kiềm, Hct …
– Hoãn CTNT, điều trị triệu chứng
– Nếu có tăng kali máu cần CTNT lại, hoặc dùng kayexalate
– Kiểm tra toàn bộ quy trình
d. Phòng ngừa:
– Theo dõi sát quá trình CTNT
– Định kỳ kiểm tra chất lượng nước
3. THUYÊN TẮC KHÍ: Là biến chứng nghiêm trọng, có thể gây tử vong, nếu không được phát hiện và điều trị nhanh chóng.
a) Nguyên nhân: Khí vào máu theo đường máu về, hoặc catheter trung tâm.
– Các thao tác an toàn kiểm tra không được thực hiện: Hết túi/ chai dịch truyền, các khớp kết nối không chặt, đứt dây máu, rò khí vào dây máu
– Không trang bị cảm biến phát hiện khí
– Người bệnh hít vào khi CVC đang mở ra không khí
b) Triệu chứng: (tùy theo tư thế)
– Tư thế ngồi: Khí → máu → hệ thống TM → TM máu não → nghẽn lượng máu đỗ về tim → mất ý thức, hôn mê, co giật → tử vong .
– Tư thế nằm: Khí → tim → thất phải → phổi: gây khó thở, nặng ngực, ho, rối loạn nhịp tim. Hoặc khí di chuyển xa hơn, qua mao quản phổi → thất trái → thuyên tắc khí ở tim, não cấp.
– Triệu chứng:
+ Đau, nặng ngực, ho, tím tái, thở dốc
+ Tim nhanh
+ Tĩnh mạch cổ nổi
+ Rối loạn tri giác, co giật, hôn mê, co giật nhẹ một bên người (não)
+ Có thể ngưng hô hấp tuần hoàn
c) Xử trí:
– Kẹp dây máu và dừng bơm máu.
– Người bệnh nằm tư thế Trendelenburg, nghiêng trái để giữ bọt khí ở thất phải.
– Điều trị nâng đỡ hô hấp tuần hoàn.
– Có thể thở máy với Oxy 100% hoặc Oxy cao áp.
4. PHẢN ỨNG MÀNG LỌC
a) Nguyên nhân:
– Hội chứng “sử dụng màng lọc lần đầu”
– Tăng nhạy cảm với màng lọc
b) Triệu chứng:
– Hội chứng “sử dụng màng lọc lần đầu”:
+ Đau lưng
+ Đau ngực
+ Hạ huyết áp
+ Ngứa
+ Buồn nôn, cảm giác khó chịu không rõ, mơ hồ
– Tăng nhạy cảm với màng lọc:
+ Lo lắng
+ Nổi mẩn ngứa
+ Nặng ngực, khó thở, khò khè
+ Có thể ngưng tim
c) Chẩn đoán:
* Phản ứng type A: Hiếm gặp, biểu hiện nhanh và nặng nề, biểu hiện của sốc phản vệ, kèm theo cảm giác nóng nơi tiêm chích fistule, nhanh chóng ngưng tim thở và tử vong
– Nguyên nhân: sử dụng Ethylene oxide để tiệt trùng quả lọc và sử dụng màng Polyacrylonitrite (PAN) đặc biệt là AN69 ở Người bệnh đang dùng ức chế men chuyển (ƯCMC)
– Có 3 tiêu chuẩn chính hoặc 2 tiêu chuẩn chính và 01 tiêu chuẩn phụ:
√ Tiêu chuẩn chính:
+ Biểu hiện trong vòng 20 phút khi bắt đầu lọc máu
+ Khó thở
+ Cảm giác nóng/ bỏng rát ở vị trí đường mạch máu hoặc khắp cơ thể
+ Phù mạch
√ Tiêu chuẩn phụ:
+ Triệu chứng lặp lại ở những lầm lọc máu sau đó khi sử dụng cùng một loại hay một nhãn hiệu quả lọc nhất định
+ Nổi hồng ban dạng mề đay
+ Chảy mũi hoặc chảy nước mắt
+ Co thắt cơ bụng
* Phản ứng type B:
– Xảy ra 20-40 phút sau khi bắt đầu lọc máu
– Triệu chứng chính là đau ngực và lưng, triệu chứng mất hẳn hoặc thuyên giảm ngoạn mục trong những giờ sau đó của buổi lọc máu
– Sinh bệnh học chưa rõ
– Có thể liên quan đến tình trạng hoạt hóa bổ thể
– Các dữ liệu hiện nay không ủng hộ sử dụng màng lọc tương hợp sinh học ở những người bệnh có những phản ứng type B.
d) Xử trí:
– Điều trị triệu chứng và nâng đỡ
– Ngưng CTNT và trả máu, thở oxy, kháng histamine, epinephrine, corticosteroid
– Có thể lọc máu trở lại sau khi ổn định các triệu chứng và sử dụng các màng lọc có tương hợp sinh học cao hơn và quả lọc tiệt trùng không sử dụng ETO (Ethylene Oxideb).
e) Phòng ngừa: rửa màng lọc với nhiều nước
Tài liệu tham khảo:
1. Richard A.Sherman, John T, 2007. Daugirdasand Todd S.Ing. Complication duringhemodialysis. In: Handbook of Dialysis, Lippicott, William & Wilkins, Philadelphia; 170-191
2. “Lọc máu liên tục”, 2013. tài liệu hướng dẫn về lọc máu ngoài cơ thể, Bệnh viện Nhân dân 115, Nhà xuất bản Y học; 214-224
CHẨN ĐOÁN NGUYÊN NHÂN VÀ SỬ TRÍ HẠ HUYẾT ÁP TRONG THẬN NHÂN TẠO
I. ĐẠI CƯƠNG.
Hạ huyết áp (HA) trong khi lọc máu (Thận nhân tạo) là một biến chứng thường gặp trên lâm sàng. Người bệnh được cho là hạ huyết áp khi HA < 90/60 mm Hg.
Tần xuất hạ huyết áp gặp vào khoảng 20-30 % tổng số lần lọc máu nói chung.
II. CHẨN ĐOÁN
– Các dấu hiệu gợi ý: Xuất hiện chóng mặt, đau đầu nhẹ hoặc nôn, trong một số trường hợp có thể thấy dấu hiệu co rút các cơ. Một số trường hợp có thể không có dấu hiệu lâm sàng rõ rệt , mà chỉ có biểu hiện rõ khi HA đã xuống quá thấp.
– Đo HA cho chẩn đoán xác định khi HA <90/60 mmHg.
– Cần theo dõi huyết áp thường xuyên trong suốt quá trình lọc máu, nhất là đối với các người bệnh có xu hướng hạ HA trong lọc máu.
III. XỬ TRÍ BAN ĐẦU
Tùy theo nguyên nhân cụ thể gây hạ HA mà sử trí khác nhau. Cần nhớ rằng hạ HA trong lọc máu cần phải xử trí nhanh và chính xác.
Các việc cần làm ngay:
1. Để người bệnh nằm tư thế đầu thấp nếu tình trạng hô hấp cho phép.
2. Cho thở oxy giúp cải thiện tình trạng tim mạch
3. Truyền nhanh 100 ml hoặc nhiều hơn dung dịch Natriclorua 0.9% qua đường máu về người bệnh. Có thể dùng dung dịch Natriclorua ưu trương, dung dịch glucose ưu trương, mannitol hoặc albumin.
4. Giảm siêu lọc xuống 0 hoặc gần 0 nếu có thể bởi một số loại máy không cho phép đưa siêu lọc về 0. Có thể tiếp tục đưa siêu lọc về theo chỉ định ban đầu nếu như tình trang HA được cải thiện.
5. Điều chỉnh tốc độ dòng máu chậm lại
II. CHẨN ĐOÁN NGUYÊN NHÂN VÀ XỬ TRÍ.
2.1. Những nguyên nhân thường gặp.
2.1.1. Do rút cân nhiều hoặc do tốc độ siêu lọc nhanh.
Do giảm thể tích tuần hoàn dẫn đến giảm cung lượng tim và gây hạ HA.
Các nguyên nhân có thể:
a) Do sử dụng bộ phận điều khiển siêu lọc không phù hợp hoặc máy không có bộ phận này.
Xử trí: – Sử dụng máy TNT có bộ phận điều khiển hệ số siêu lọc, trong trường hợp không có thiết bị này có thể sử dụng loại màng lọc có tính thấm với nước thấp.
b) Do tăng cân quá nhiều giữa 2 lần lọc máu hoặc thời gian của buổi lọc máu ngắn.
Trong trường hợp này tổng thể tích dịch cần loại bỏ sẽ rất lớn trong khi đó thời gian của buổi lọc không tăng sẽ dẫn đến tăng.
Xử trí: – Không để cho bênh nhân tăng cân nhiều giữa 2 lần lọc máu, nên duy trì mức độ tăng <1 kg/ngày.
c) Rút quá nhiều nước gây trọng lượng của người bệnh giảm dưới trong lượng khô.
Xử trí: -Không nên rút cân dưới mức cân nặng lý tưởng đó.
d) Dùng dịch lọc có nồng độ Natri thấp:
Khi nồng độ Na dịch lọc thấp hơn trong huyết tương sẽ dẫn đến tình trạng dòng máu sau khi qua quả lọc trở về cơ thể sẽ nhược trương hơn so với các mô xung quanh nước sẽ thoát khỏi lòng mạch vào các mô xung quanh gây nên tình trạng giảm khối lượng tuần hoàn, hiện tượng này thường gặp ở giai đoạn đầu của ca lọc máu.
Xử trí: Dùng dịch lọc có nồng độ Na tương đượng như Na trong máu, trong một số trường hợp cần thiết mà phải dùng Na dịch lọc thấp hơn Na máu >4 mmol/l, khi đó để tránh hạ HA, cần phải giảm siêu lọc xuống thấp trong thời gian đầu của ca lọc máu.
2.1.2. Hạ huyết áp có liên quan đến giảm trương lực mạch máu.
Tất cả những yếu tố dù nhỏ nhất gây giảm sức cản mạch máu ngoại vi hoặc làm giảm thể tích đổ đầy của tim đều có thể gây nên tình trạng hạ huyết áp.
Trên 80% thể tích máu trong cơ thể lưu thông trong hệ tĩnh mạch, do đó khi có sự thay đổi về tình trạng chứa máu ở hệ tĩnh mạch sẽ gây nên giảm thể tích đổ đầy của tim và gây nên hạ HA.
Một số nguyên nhân gây nên tình trạng trên có thể là:
2.1.3. Sử dụng dịch lọc acetate:
Acetate được coi là một yếu tố gây giãn mạch, nồng độ acetate huyết tương trong quá trình lọc thường duy trì trong khoảng từ 3-10 mmol. Một số người bệnh hay gặp tình trạng hạ HA trong lọc máu khi dùng dịch lọc này (đặc biệt ở người bệnh nữ hoặc người bệnh tiểu đường).
Dùng dịch lọc acetate cũng có thể là nguyên nhân gây hạ huyết áp ở những người bệnh lọc máu dùng quả lọc có độ siêu lọc cao. Tuy nhiên không ít những người bệnh không có biểu hiện hạ HA khi dùng loại dịch này kể cả những người bệnh có huyết áp nền thường thấp.
Xử trí: -Thay bằng dịch lọc Bicacbonate.
2.1.4. Dịch lọc được điều chỉnh ở nhiệt độ thường.
Thông thường dịch lọc được duy trì ở mức 38 độ C, người bệnh lọc máu thường ở trong tình trạng có giảm nhiệt độ mức độ nhẹ. Trong quá trình lọc máu nhiệt độ cơ thể thường tăng một chút. Nhiệt độ của dịch lọc tăng sẽ dẫn đến tình trạng giãn cả tĩnh mạch và động mạch.
Xử trí: Dùng bộ phận làm giảm nhiệt độ của dịch lọc hoặc điều chỉnh nhiệt độ dịch lọc ở mức 34-36 độ C. Chú ý khi dùng dịch lọc có nhiệt độ thấp như vậy người bệnh có thể có cảm giác khó chịu như ớn lạnh.
2.1.5. Quá trình tiêu hóa thức ăn khi lọc máu.
Quá trình tiêu hóa tích cực trong quá trình lọc máu có thể gây nên hạ HA. Quá trình này gây nên giảm sức cản thành mạch nhất là các mạch máu nội tạng. Đặc biệt gây nên tình trạng làm tăng thể tích tĩnh mạch và gây nên tình trạng hạ huyết áp.
Xử trí: Khuyên người bệnh không nên ăn ngay trước lọc máu hoặc trong thời gian lọc máu vì hiệu ứng này thường kéo dài trong vòng 2 h kể từ khi bắt đầu ăn.
2.1.6. Nguyên nhân thiếu máu
Tất cả các trường hợp gây nên tình trạng hạ HA đều gây nên thiếu máu tỏ chức, mặt khác khi thiếu máu tổ chức sẽ dẫn đến tình trạng giải phóng adenosine, khi đó adenosine sẽ ngăn cản quá trình giải phóng Norepinephrine từ hệ thống thần kinh giao cảm và thường gây nên hiện tượng giãn mạch. Chính vì vậy tình trạng hạ HA sẽ càng thêm trầm trọng. Trên lâm sàng tình trạng trên thường xảy ra ở những người bệnh có nồng độ Ht <20-25 %.
Xử trí: Điều chỉnh thiếu máu, cần dùng Epo và các yếu tố cần thiết cho quá trình tạo máu, trong những trường hợp lọc máu cấp cần truyền máu bổ sung khi tiến hành lọc máu để làm tránh hạ HA.
2.1.7. Tổn thương thần kinh tự động.
Đặc biệt hay gặp ở những người bệnh đái tháo đường. Ở những người bệnh này phản ứng co mạch nhất là động mạch khi đối phó với tình trạng giảm khối lượng tuần hoàn bị giảm đi đáng kể, do đó khi cung lượng tim giảm khả năng duy trì huyết áp qua con đường co mạch gần như không còn giá trị.
Xử trí: Dùng một số tác nhân co mạch, tuy nhiên hiệu quả còn thấp.
2.1.8. Do dùng thuốc hạ huyết áp.
Cần chọn thuốc hạ huyết áp phù hợp cũng như thời gian dùng thuốc, nên tránh dùng thuốc hạ áp trước lọc máu ở những người bệnh có xu hướng hạ HA khi lọc. Tuy nhiên thời gian dùng, khoảng cách dùng, phụ thuộc vào dược động học của từng loại thuốc và khả năng dung nạp.
2.1.9. Hạ huyết áp do tim.
a) Do rối loan chức năng tâm trương:
Tình trạng phì đại của cơ tim sẽ dẫn đến giảm cung lượng tim khi phản ứng với tình trạng giảm áp lực đổ đầy. Phì đại tâm thất phải và rối loạn chức năng tâm trương là những biểu hiện thường gặp ở người bệnh lọc máu. Điều trị cần dùng các thuốc trợ tim làm tăng sức co bóp của cơ tim, chú ý tình trạng điện giải…nhịp tim chậm.
b) Do rối loạn nhịp tim và khả năng co bóp.
Cung lượng tim không phải chỉ ảnh hưởng bởi khả năng đổ đầy mà còn bị ảnh hưởng bởi nhịp tim và khả năng co bóp. Mặc dù hầu hết hạ HA trong lọc máu là có liên quan đến tình trạng giảm thể tích đổ đầy, tuy nhiên không phải là trong mọi trường hợp.
Xử trí: Dùng các tác nhân tăng nhịp tim nếu nhịp chậm, điều trị nguyên nhân của rối loạn nhịp tim… tăng khả năng co bóp có thể làm giảm tình trạng hạ HA.
2.2. Những nguyên nhân hiếm gặp
Hạ HA trong lọc máu có thể là biểu hiện của một số bệnh lý khác không liên quan đến quá trình lọc máu như: Tràn dịch màng ngoài tim, nhồi máu cơ tim, chảy máu trong, nhiễm khuẩn huyết, rối loạn nhịp tim, phản ứng của cơ thể với màng lọc, tan máu, tắc mạch khí…
– Xử trí theo nguyên nhân cụ thể
2.3. Hạ HA có liên quan đến màng lọc:
Sử dụng màng lọc cellulo có thể gây nên tình trạng hạ HA , cơ chế được cho là do quá trình hoạt hóa bổ thể và các cytokines. Phản ứng dạng này thường xảy ra khi người bệnh được dung quả lọc lần đầu tiên. Tuy nhiên vấn đề này vẫn còn cần nhiều nghiên cứu thêm để khẳng định.
Xử trí: nếu nghi ngờ hạ HA do màng lọc cần: Dừng ngay quá trình lọc, bỏ hoàn toàn quả lọc và dây lọc, cấp cứu như trường hợp hạ HA do sốc phản vệ.
Tài liệu tham khảo
1. JohnT, Daugirdas, Tod S .Ing: Handbook of Dialysis fourth edition 2006
2. Nisensonn, Fine, 2005. Clinical Dialysis fourth edition
BIẾN CHỨNG THƯỜNG GẶP Ở NGƯỜI BỆNH LỌC MÀNG BỤNG LIÊN TỤC NGOẠI TRÚ
Người bệnh lọc màng bụng có thể gặp nhiều biến chứng, bao gồm những biến chứng nhiễm trùng và biến chứng không nhiễm trùng.
1. Biến chứng nhiễm trùng: Đây vẫn là một thách thức lớn và là nguyên nhân của phần lớn các trường hợp phải rút catheter. Trong số biến chứng nhiễm trùng thường gặp trong lọc màng bụng chu kỳ phải kể đến nhiễm trùng chân ống – đường hầm và viêm phúc mạc.
1.1. Viêm phúc mạc: viêm phúc mạc là nguyên nhân chính gây nhập viện. Viêm phúc mạc đôi khi gây tử vong, trực tiếp do nhiễm khuẩn huyết hoặc gián tiếp do những biến chứng của nhiễm khuẩn.
1.1.1. Chẩn đoán viêm phúc mạc: Khi có 2 trong 3 tiêu chuẩn sau đây
– Sự hiện diện của vi khuẩn trong nuôi cấy hoặc nhuộm Gram
– Dịch đục (số lượng bạch ≥ 100/mm; ≥ 50% là bc đa nhân trung tính)
– Có các triệu chứng của VPM: đau bụng, cảm ứng phúc mạc..
1.1.2. Điều trị viêm phúc mạc: Điều trị ban đầu của VPM dựa vào kinh nghiệm và thường dùng kháng sinh phổ rộng cho cả vi khuẩn gram âm và dương. Kết quả nuôi cấy tìm vi khuẩn trong dịch lọc màng bụng sẽ quyết định điều trị viêm phúc mạc theo phác đồ nào. Thời gian điều trị phụ thuộc vào vi khuẩn và độ nặng của viêm phúc mạc, ví dụ với nhiễm trùng tụ cầu dịch tễ là 14 ngày và hầu hết các nhiễm trùng khác là 3 tuần.
1.2. Nhiễm trùng liên quan đến Catheter
Nhiễm trùng exit site được định nghĩa khi có mủ, có hoặc không có tấy đỏ ở vị trí exit site.
Nhiễm trùng của catheter dưới da (đường hầm) có biểu hiện đau, sưng tấy, đỏ, cứng lên ở vùng đường hầm.
Xử trí: cấy dịch mủ, dịch viêm tìm vi khuẩn. Dựa vào kinh nghiệm điều trị viêm tại chỗ và kháng sinh đường uống, chờ kết quả cấy vi khuẩn để lựa chọn kháng sinh phù hợp. Theo dõi và đánh giá tình trạng viêm, có thể siêu âm để đánh giá mức độ ứ dịch và ú mủ ở đường hầm. Nên thay băng 3h/lần hoặc nhiều hơn.
Tụ cầu vàng là nguyên nhân thường gặp cho nhiễm trùng exit site và khó điều trị, với tiến triển thường gặp là nhiễm trùng đường hầm và viêm phúc mạc, trong đó việc rút Catheter là cần thiết. Nhiễm trùng Catheter do trực khuẩn mủ xanh cũng khó điều trị, nên rút Catheter trong những trường hợp nặng.
2. Các biến chứng không nhiễm trùng
2.1. Biến chứng liên quan đến Catheter
– Biến chứng sau mổ: bao gồm chấn thương đến các cơ quan trong ổ bụng (ruột, bàng quang) hoặc mạch máu, chảy máu hoặc nhiễm trùng.
– Dò dịch: Dò dịch xảy ra ở 7% bn trong năm đầu tiên. Nguy cơ dò tăng lên nếu thời gian nghỉ ngơi sau mổ ngắn. Dò dịch liên quan đến kỹ thuật đặt Catheter, chấn thương, hoặc bất thường giải phẫu của người bệnh. Hầu hết các trường hợp đều tự liền. Ngừng lọc càng lâu, cơ hội liền càng lớn. Nếu dò dịch tồn tại dai dẳng cần rút Catheter và đặt lại vào vị trí khác.
– Dịch ra kém: Dịch ra kém thường được phát hiện khi thể tích dịch ra ít hơn đáng kể thể tích dịch vào và không có bằng chứng của dò quanh Catheter. Thường xảy ra sớm sau phẫu thuật, trong hoặc sớm sau đợt viêm phúc mạc hoặc bất cứ giai đoạn nào. Các yếu tố trong lòng ống (cục máu đông, fibrin) hoặc ngoài lòng ống (táo bón, bít các lỗ của Catheter bởi các tạng lân cận hoặc mạc nối bao quanh, đầu Catheter lạc chỗ ra khỏi hố chậu, đặt Catheter không chính xác) là những nguyên nhân thường gặp nhất.
Điều trị: Tùy vào từng nguyên nhân
+ Kiểm tra xem Catheter có bị xoắn vặn không: nếu có, thường cần phẫu thuật đặt lại Catheter hoặc loại bỏ cuff ở bề mặt
+ Điều trị táo bón: một trong các bước nên làm trước tiên ở người bệnh tắc nghẽn dòng dịch ra là dùng thuốc nhuận tràng. Điều trị táo bón giải quyết được gần 50% các trường hợp tắc nghẽn dòng dịch ra do Catheter.
+ Heparin: thêm Heparin vào dịch lọc màng bụng (250-500 UI/lít) bất cứ khi nào quan sát thấy fibrin ở dòng dịch ra. Tuy nhiên, heparin có tác dụng dự phòng hơn là điều trị và thường ít thành công trong trường hợp có tắc nghẽn.
+ Các thuốc tiêu sợi huyết: nếu Heparin không có hiệu quả, cần dùng thuốc tiêu sợi huyết (streptokinase, Urokinase, các chất hoạt hóa plasminogen mô)
+ Sửa lại vị trí Catheter: Nếu tắc nghẽn không giảm khi áp dụng các biện pháp trên, nguyên nhân có thể do mạc nối hoặc các mô khác làm bít đầu Catheter. Trong trường hợp này, cần giải phóng Catheter ra khỏi chỗ bao bọc mạc nối và đặt lại ở vị trí khác trong ổ bụng.
+ Đặt lại Catheter: Nếu các biện pháp trên thất bại, cần đặt lại Catheter khác.
– Dịch vào kém: truyền 2 lít vào ổ bụng thường mất 15 phút. Thời gian này có thể dài hơn hoặc dịch hoàn toàn không vào được. Cần làm những biện pháp sau
+ Kiểm tra xem có xoắn vặn: nếu có, cần đặt lại Catheter hoặc bỏ cuff bề mặt
+ Bơm mạnh 20 ml muối pha heparin
+ Nếu catheter vẫn bị tắc, kiểm tra XQ thấy Catheter nằm sai vị trí cần sửa lại vị trí Catheter
+ Nếu Catheter ở đúng vị trí, truyền urokinase (25 000 đơn vị trong 2 ml muối) vào lòng ống và giữ tại chỗ trong 2-4 h
– Mòn cuff: Cuff bề mặt có thể gặm vào da vì nhiễm trùng exit site hoặc do lúc đầu đặt quá gần da vùng exit site hoặc cuff sâu tách khỏi lớp cơ thành bụng. Cần cắt bỏ cuff bề mặt.
– Đau khi truyền dịch vào: liên quan đến dịch lọc có pH thấp, nhiệt độ dịch lọc cao bất thường, mạc nối bao bọc catheter, hoặc áp lực được tạo ra bởi các cấu trúc lân cận (ruột, âm đạo, thừng tinh) trong thời gian cho dịch vào. Mạc nối bao bọc và áp lực tăng trong các tạng lân cận thường gặp nhất và được điều trị bằng cách sửa lại vị trí Catheter. Thêm Natri hydroxide hoặc Natri bicarbonate vào dịch lọc hoặc sử dụng dịch bicarbonate có thể giảm cảm giác đau
– Đau khi xả dịch ra: điều này thường xảy ra khi viêm phúc mạc hoặc vài tuần đầu tiên sau khi bắt đầu lọc màng bụng. Chuyển sang chế độ lọc màng bụng bằng máy kiểu thủy triều thường giúp giảm cảm giác này.
2.2. Các biến chứng cơ học của LMB:
Hai yếu tố góp phần gây tăng áp lực trong ổ bụng là lượng dịch vào truyền vào trong ổ bụng và tư thế của người bệnh trong thời gian ngâm dịch
– Thoát vị: Khoảng 10-20% bn có biểu hiện thoát vị tại thời điểm nào đó. Những yếu tố nguy cơ bao gồm thể tích dịch lọc lớn, các thiếu sót của thành bụng bẩm sinh. Vị trí thường gặp nhất là thoát vị chỗ đặt Catheter, rốn, bẹn. Thoát vị đáng kể nên được điều trị ngoại khoa, sau đó giữ áp lực thấp trong ổ bụng để tạo điều kiện cho liền vị trí thoát vị.
– Phù sinh dục: Dịch lọc có thể chảy đến vùng sinh dục bằng 2 đường: một là đi qua đường thông với âm đạo gây ra ổ tụ dịch (hydrocele) và thứ hai là dịch từ vị trí yếu của thành bụng chảy xuống gây phù ở bao quy đầu và bìu. Nếu do con đường thứ nhất có thể sửa chữa bằng phẫu thuật, nếu do con đường thứ hai có thể đặt lại Catheter. Để có thời gian liền, chuyển tạm thời sang TNT hoặc LMB liên tục bằng máy (CCPD) với thể tích dịch ít.
– Tràn dịch màng phổi: Do áp lực ổ bụng tăng, dịch lọc có thể từ khoang màng bụng di chuyển lên khoang màng phổi thông qua vị trí yếu của cơ hoành. Hầu hết xảy ra ở màng phổi phải. Điều trị triệu chứng bằng cách ngừng lọc và chọc tháo nếu cần. Điều trị nguyên nhân bằng phẫu thuật sửa cơ hoành hoặc gây dính khoang màng phổi.
– Đau lưng: Áp lực ổ bụng tăng và trung tâm trọng lực chuyển ra phía trước, khiến cột sống có xu hướng ưỡn ra. Người bệnh thường bị đau lưng và đau thần kinh tọa. Để khắc phục, có thể thay dịch nhiều lần và mỗi lần ít dịch hoặc tiến hành lọc màng bụng bằng máy với lượng dịch ngâm ban ngày ít.
2.3. Các biến chứng chuyển hóa
– Hấp thu Glucose và đái tháo đường: Một số lớn người bệnh đái tháo đường cần insulin khi lọc màng bụng, thậm chí nếu trước đó họ không cần insulin. Điều này một phần do glucose được hấp thu từ dịch lọc vào máu kết hợp với hiện tượng tăng cân. Khoảng 60-80% glucose trong dịch lọc được hấp thu trong mỗi lần thay dịch, có thể đạt tới 100-150 g/ngày. Nó có thể gây tăng insulin và triglyceride trong máu. Để giảm thiểu tình trạng hấp thu glucose, người bệnh nên hạn chế muối nước để loại bỏ nhu cầu dùng loại dịch ưu trương, đồng thời có thể lựa chọn các loại dịch khác như polyglucose hoặc amino acids
– Rối loạn lipid máu: Người bệnh lọc màng bụng thường có cholesterol toàn phần và LDL cholesterol cao, HDL cholesterol thấp, apoB cao, apoA-1 thấp, triglyceride cao, lipoprotein alpha cao. Rối loạn chuyển hóa lipid là nguy cơ đáng kể gây xơ vữa đm. Người bệnh nên được điều trị bằng statin, fibrate, tránh rượu và thuốc gây tăng lipid máu, giảm thiểu nhu cầu sử dụng dịch ưu trương.
– Mất protein: Mỗi lần dẫn lưu dịch, người bệnh mất lượng protein khoảng ≥0,5g/lít, tương đương khoảng 10-20 g/ngày, đặc biệt ở người bệnh có màng vận chuyển cao hoặc trung bình cao, hoặc trong đợt VPM. Khắc phục bằng chế độ ăn để bù vào lượng protein bị mất đi.
– Rối loạn điện giải và kiềm toan: tăng/giảm natri máu, tăng/giảm kali máu, tăng/giảm calci máu, tăng lactate máu. Điều trị bằng điều chỉnh chế độ ăn, lọc bằng dịch lọc bicarbonate…
2.4. Các biến chứng khác
– Suy dinh dưỡng: Suy dinh dưỡng nhẹ-trung bình gặp ở khoảng 40% và suy dinh dưỡng trầm trọng gặp ở 8-10% người bệnh. Điều trị bằng dùng dịch lọc amino acid hoặc sử dụng một số thuốc như thuốc thúc đẩy tăng trưởng (Domperidone) hoặc steroid tăng đồng hóa (Nadrolone).
– Biến chứng tim mạch: Tử vong do tim mạch ở nhóm người bệnh này vẫn rất cao. Nguyên nhân bao gồm rất nhiều yếu tố. Một vài yếu tố liên quan đến bản thân phương pháp, với sự tiến triển của màng tăng vận chuyển, sự xuất hiện viêm trong môi trường suy dinh dưỡng và xơ vữa động mạch, rối loạn chuyển hóa calci phospho và calci hóa mạch máu.
– Lọc máu không đầy đủ: Mất chức năng thận tồn dư là yếu tố quan trọng nhất gây ra lọc máu không đầy đủ. Có thể cải thiện chất lượng lọc máu bằng việc tăng số lần thay dịch hàng ngày, tăng thể tích ngâm dịch và tăng độ ưu trương của dịch lọc.
– Suy siêu lọc: màng bụng phản ứng với những thay đổi để đáp ứng với môi trường mới bằng cách dày lên và tăng sinh màng đáy cả trung biểu mô cũng như mao mạch. Những thay đổi này xảy ra thứ phát do màng bụng tiếp xúc với những chất không sinh lý của dịch lọc, đồng thời cũng là hoạt động trực tiếp của glucose và các chất giáng hóa của glucose bao gồm các sản phẩm glycosyl hóa cuối cùng lên màng bụng. Điều trị tốt nhất là giảm thời gian ngâm dịch, thay dịch ban đêm bằng máy kết hợp với sử dụng dịch icodextrin ban ngày.
Tài liệu tham khảo
1. Simon J. Daies, Louise Phillips, Anne M.Griffiths et al, 1998. What really happens to people on long-term peritoneal dialysis. Kidney Int, Vol.54, pp.2207-2217
2. S K Mandal, Sanjiv Jasuja et al, 2009. Non infectious complicantions of peritoneal dialysis. Apollo medicine. Vol 6, No.2
3. Plum J, Sudkamp S, Grabensee B, 1994. Results of ultrasound-assisted diagnosis of tunnel infections in continuous ambulatory peritoneal dialysis. Am J Kidney Dis.; 23(1):99-104.
CHẨN ĐOÁN VÀ XỬ TRÍ BAN ĐẦU VIÊM PHÚC MẠC Ở NGƯỜI BỆNH LỌC MÀNG BỤNG LIÊN TỤC NGOẠI TRÚ
1. ĐẠI CƯƠNG
Lọc màng bụng liên tục ngoại trú (CAPD): là một trong những phương pháp điều trị thay thế cho những người bệnh suy thận giai đoạn cuối. Sau khi thực hiện các kỹ thuật ban đầu tại bệnh viện, đặt ống Catheter trong khoang ổ bụng người bệnh, người bệnh có thể tự lọc máu tại nhà riêng, thay vì một tuần phải đến bệnh viện để chạy thận nhân tạo, hàng tháng người bệnh chỉ cần đến bệnh viện để kiểm tra định kỳ một lần. Mỗi ngày người bệnh thực hiện bốn lần lọc màng bụng, đưa hai lít dịch lọc vào ổ bụng mỗi lần. Mỗi lần thực hiện chỉ mất 30 phút. Phương pháp điều trị này có hiệu quả tương đương với chạy thận nhân tạo chu kỳ.
Viêm phúc mạc: là phản ứng viêm cấp tính của lá phúc mạc với tác nhân vi khuẩn hay hóa học. Viêm phúc mạc là một trong các biến chứng hay gặp ở người bệnh lọc màng bụng liên tục ngoại trú. Nếu bệnh được chẩn đoán sớm và điều trị kịp thời thì người bệnh nhanh chóng qua khỏi và tiếp tục thực hiện được phương pháp lọc màng bụng.
2. CHẨN ĐOÁN
2.1. Chẩn đoán xác định
a. Lâm sàng:
– Đau bụng: có khi đau hoặc không, đôi khi đau nhiều.
– Dấu hiệu ở thành bụng: Co cứng thành bụng, cảm ứng phúc mạc gặp trong trường hợp người bệnh đến quá muộn.
– Sốt: có khi sốt hoặc không.
– Dịch lọc màng bụng: dịch đục
b. Cận lâm sàng:
– Xét nghiệm tế bào dịch: có nhiều bạch cầu đa nhân trung tính (> 100 BC/mm3 trong đó có > 50% là bạch cầu đa nhân trung tính)
– Xét nghiệm vi sinh: nuôi cấy dịch lọc màng bụng có thể thấy vi khuẩn E.coli hoặc trực khuẩn mủ xanh, tụ cầu, nấm…
– Nhuộm tìm trực trùng kháng alcol-acid, PCR lao để tìm vi trùng lao
– Cấy máu cũng có thể thấy vi khuẩn gây bệnh
2.2. Chẩn đoán nguyên nhân
– Nguyên nhân gây viêm phúc mạc: nguyên nhân thường gặp là do người bệnh không tuân thủ chế độ vô trùng trong thực hiện thay túi dịch. Cũng có thể gặp do nhiễm trùng từ chân catheter di chuyển vào đường hầm catheter và vào khoang phúc mạc.
– Cấy máu, cấy nước dịch lọc ổ bụng thường tìm được loại vi khuẩn gây viêm phúc mạc. Một số vi khuẩn có thể gặp: Staphyloccocus aureus, Enterococus, Streptococcus, Pseudomonas, E.coli,…
2.3. Chẩn đoán phân biệt
– Viêm phúc mạc không tìm thấy vi khuẩn khi nuôi cấy:
+ Do kỹ thuật lấy bệnh phẩm hoặc kỹ thuật nuôi cấy chưa đúng phương pháp.
+ Do người bệnh đã sử dụng kháng sinh trước đó.
– Viêm phúc mạc không do đường vào từ dịch lọc hoặc đường hầm catheter: viêm phúc mạc ruột thừa, thủng tạng rỗng,…
– Dịch lọc màng bụng màu đục do dưỡng chấp: tìm thấy dưỡng chấp trong dịch lọc màng bụng.
3. ĐIỀU TRỊ: Sau đây là một phác đồ hay được sử dụng trong xử trí ban đầu viêm phúc mạc ở người bệnh lọc màng bụng liên tục ngoại trú:
Áp dụng cho đa số các trường hợp được chẩn đoán viêm phúc mạc ở người bệnh lọc màng bụng liên tục ngoại trú khi mới nhập viện chưa có kết quả nuôi cấy vi khuẩn và kháng sinh đồ.
+ Kháng sinh toàn thân: có thể dùng một trong các nhóm thuốc sau:
– Nhóm Cephalosporin thế hệ 3: Cefoperazone, Ceftazidime,
– Nhóm Beta lactam
Liều thuốc tùy thuộc vào từng loại kháng sinh áp dụng đối với người bệnh suy thận giai đoạn cuối đang lọc màng bụng (thẩm phân phúc mạc)
Thời gian điều trị: 14 – 21 ngày.
+ Kháng sinh tại chỗ: thời gian điều trị 14 – 21 ngày
| Lần thay dịch | Chỉ định |
| Lần 1 | Rửa ổ bụng liên tiếp 3 túi dịch lọc nồng độ1.5, mỗi túi pha 1000 đơn vị Heparine |
| Lần 2
(ngâm 6 giờ) |
Ngâm trong ổ bụng 2 lít dịch lọc 1.5 có pha:
– Cephazoline 1 g x 1 lọ – Gentamycine 40mg x 1 lọ – Heparine 1000 đơn vị |
| Lần 3
(ngâm 4 giờ) |
Ngâm trong ổ bụng 2 lít dịch lọc1.5 có pha:
– Cephazolin 250mg (1g x 1/4 lọ) – Heparine 1000 đơn vị |
| Lần 4
(ngâm 4 giờ) |
Ngâm trong ổ bụng 2 lít dịch lọc 1.5 có pha:
– Cephazoline 250 mg (1g x 1/4 lọ) – Heparine 1000 đơn vị |
| Lần 5
(ngâm qua đêm) |
Ngâm trong ổ bụng 2 lít dịch lọc 1.5 có pha:
– Cephazoline 1g x 1 lọ – Gentamycine 40mg x 1 lọ – Heparine 1000 đơn vị |
Khi có kết quả nuôi cấy và kháng sinh đồ:
– Nếu vi khuẩn nhạy cảm với các thuốc kháng sinh trên thì tiếp tục dùng cho đủ thời gian là 14 ngày.
– Nếu vi khuẩn kháng với một trong các thuốc kháng sinh trên thì nên chuyển người bệnh đến tuyến chuyên khoa có kinh nghiệm điều trị.
4. PHÒNG BỆNH
– Vệ sinh sạch sẽ đảm bảo vô trùng trong thao tác thay dịch: rửa tay bằng xà phòng, đeo khẩu trang, dùng nguồn nước sạch để vệ sinh,..
– Thay dịch trong phòng đã được vệ sinh sạch sẽ, tẩy trùng thường xuyên.
Ghi chú: Bài xử trí viêm phúc mạc đầy đủ theo Hiệp hội thẩm phân phúc mạc quốc tế năm 2010 được trình bày rất kỹ và đầy đủ xin tham khảo ở tài liệu trích dẫn thứ 3 dưới đây.
Tài liệu tham khảo
1. Salim Mujai MD, John H. Crabtree MD et al.(2006). Care of the adult patient on peritoneal dialysis: 30 – 43.
2. Christian Verger, Société de Néphrologie, Tours 21-23 juin 2000: La Péritonite de l’an 2000.
3. Philip kam-Tao Li, Cheuk Chun Szeto et al, 2010. Peritoneal Dialysis- Related Infections Recommendations: 2010 Update. ISPD GUIDELINES/ RECOMMENDATIONS. Vol 30, NO 4.
THẢI GHÉP CẤP TRONG GHÉP THẬN
Nhiều hình thức thải ghép cấp khác nhau có thể xảy ra sau ghép thận, đặc biệt trong 3 tháng đầu sau ghép. Miễn dịch tế bào trong 1 thời gian dài được xem là cơ chế chính gây thải ghép mà hậu quả là các chiến lược ức chế miễn dịch (UCMD) tập trung chủ yếu chống lại tế bào lympho T. Gần đây, miễn dịch thể dịch hay miễn dịch qua trung gian tế bào được chứng minh là nguyên nhân gây ra 1 số thải ghép cấp sớm và nặng, mặc dù phản ứng chéo âm tính trước ghép.
1. THẢI GHÉP TỐI CẤP (hyperacure rejection)
1.1. Nguyên nhân:
– Do hiện diện kháng thể độc tế bào với nồng độ cao trong huyết thanh của người nhận, chống lại các kháng nguyên của người cho (quan trọng nhất là các kháng nguyên HLA) thường biểu hiện trên tế bào nội mô mạch máu thận ghép.
– Thải ghép tối cấp về bản chất là thải ghép thể dịch nặng và tức thì, xảy ra do hiện diện:
+ Kháng thể kháng HLA ở người nhận, xuất hiện sau những lần truyền máu, có thai, hoặc ghép tạng trước đó.
+ Kháng thể kháng ABO khi ghép bất tương hợp nhóm máu.
+ Kháng thể kháng các kháng nguyên không phải HLA, chẳng hạn MICA hay các kháng nguyên khác, hiện diện trên tế bào nội mô.
1.2. Chẩn đoán:
a. Lâm sàng: Xảy ra tức thì trong những phút hay giờ đầu tiên sau tái tưới máu thận. Biểu hiện: thận mất chức năng nguyên phát hay ngưng đột ngột nước tiểu.
b. Cận lâm sàng:
– Siêu âm Doppler thận ghép tại phòng mổ hoặc sau mổ đánh giá tưới máu nhu mô thận và loại trừ huyết khối động hoặc tĩnh mạch thận.
– Giải phẫu bệnh học thận ghép: Đại thể thận tím, phù nề và xuất huyết. Vi thể: tế bào nội mô hoại tử, bong khỏi lớp màng đáy kèm hoạt hóa hệ thống đông máu có thể dẫn tới đông máu thứ phát. Nếu mô thận chưa hoại tử hoàn toàn, có thể thấy C4d dương tính ở mao mạch và động mạch, xác nhận nguồn gốc thể dịch của thải ghép (do hoạt hóa bổ thể theo con đường cổ điển bởi kháng thể kháng người cho) và giúp chẩn đoán phân biệt với huyết khối động hoặc tĩnh mạch thận nguyên phát.
c. Tiên lượng xấu vì thường phải cắt bỏ thận ghép.
1.3. Điều trị:
– Giải pháp duy nhất là cắt bỏ thận ghép vì nguy cơ hoạt hóa đông máu thứ phát dẫn tới đông máu nội mạch lan tỏa, cơ địa chảy máu và vỡ thận ghép.
1.4. Dự phòng:
– Thực hiện thường qui phản ứng chéo trước ghép giữa huyết thanh người nhận và lympho T và B của người cho (bằng kỹ thuật độc tế bào lệ thuộc bổ thể và hoặc flow cytometry).
– Các kỹ thuật tầm soát kháng thể mới (Luminex) giúp thải ghép tối cấp rất hiếm xảy ra. Tuy nhiên, ghép thận với nguy cơ miễn dịch cao như: ghép thận lại, ghép thận với phản ứng chéo dương tính, ghép thận bất tương hợp nhóm máu ABO… thì tỷ lệ thải ghép cấp thể dịch nặng, kể cả thải ghép tối cấp, tăng lên đáng kể sau ghép, dù đã thực hiện các biện pháp dự phòng chuyên biệt như hấp phụ miễn dịch, IV Ig, rituximab hoặc cắt lách.
2. THẢI GHÉP CẤP TẾ BÀO (acute T-cell mediated rejection)
2.1. Chẩn đoán:
a. Lâm sàng: Đây là hình thức thải ghép thường gặp nhất, thường xảy ra giữa ngày thứ 10 và tháng thứ 3 sau ghép.
+ Triệu chứng mệt mỏi toàn thân, sốt, đau thận ghép (do phản ứng viêm của phúc mạc quanh thận ghép), tăng huyết áp, có hoặc không thiểu niệu.
+ Ở giai đoạn sớm sau ghép, có thể biểu hiện: ngưng trệ trị số creatinine huyết thanh ở mức tương đối cao, dù trước đó chức năng thận đang cải thiện.
b. Cận lâm sàng:
+ Creatinine huyết thanh tăng >20% trị số cơ bản trước đó)
+ Natri niệu có thể giảm hoặc không.
+ Các xét nghiệm hình ảnh học (siêu âm Doppler thận ghép, xạ hình thận, chụp cắt lớp ổ bụng) giúp loại trừ các biến chứng mạch máu hay đường niệu là nguyên nhân của rối loạn chức năng thận.
c. Chẩn đoán xác định:
+ Sinh thiết được chỉ định khi đã loại trừ các nguyên nhân khác.
+ Về phương diện giải phẫu bệnh học, thải ghép cấp tế bào gồm 2 thành phần, ống thận-mô kẽ (viêm ống thận và thâm nhiễm viêm mô kẽ) và hoặc mạch máu (viêm nội mô mạch máu). Hình thức và độ nặng của các tổn thương mô học theo phân loại Banff năm 2009 (Bảng 1) quyết định đáp ứng với điều trị và tiên lượng.
d. Tiên lượng: Thải ghép cấp làm suy giảm khả năng sống còn của thận ghép trung hạn và dài hạn, đặc biệt khi thải ghép cấp muộn và creatinine huyết thanh không hồi phục về trị số cơ bản ban đầu.
e. Một số hình thức thải ghép cấp đặc biệt:
+ Thải ghép cấp tế bào gia tốc (accelerated acute T-cell mediated rejection): xảy ra ở tuần đầu sau ghép, nghĩa là trước thời điểm thông thường của thải ghép cấp tế bào, thường gặp ở bệnh nhân đã được mẫn cảm trước đó với các kháng nguyên của thận ghép, vì thế phản ứng miễn dịch nhớ lại, huy động các lympho T và B nhớ. Cơ chế sinh bệnh học: thông thường là thải ghép cấp hỗn hợp với thành phần tế bào và thể dịch cùng tồn tại; nhưng 1 số thải ghép cấp gia tốc thuần túy chỉ gồm thành phần tế bào, không có sự hiện diện của kháng thể kháng người cho, do đó C4d âm tính trên các mẫu sinh thiết. Do đó bên cạnh việc đánh giá miễn dịch thể dịch trước ghép, cần đánh giá miễn dịch tế bào của người nhận chống lại người cho bằng kỹ thuật ELIPOT để giúp hướng dẫn cách thức điều trị dẫn nhập. Các lympho nhớ chịu trách nhiệm trong hình thức thải ghép này ít nhạy cảm với các thuốc UCMD, do đó dự phòng thải ghép cấp gia tốc là biện pháp hữu hiệu nhất.
+ Thải ghép dưới mức lâm sàng (subclinical rejection): Phát hiện khi sinh thiết thận thường qui với chức năng thận bình thường hoặc ổn định. Tần suất và ý nghĩa lâm sàng của các trường hợp này tùy thuộc phác đồ UCMD (cyclosporin hay tacrolimus), cách thức điều trị dẫn nhập (kháng thể đơn dòng hay đa dòng) và nguy cơ miễn dịch trước ghép (số bất tương hợp HLA, tình trạng mẫn cảm trước ghép và bệnh sử thải ghép cấp trước đó).
+ Thải ghép cấp và cytomegalovirus (CMV): Do phản ứng chéo giữa kháng nguyên virus và kháng nguyên HLA của thận ghép được nhận diện bởi các lympho T đặc hiệu, mối liên hệ này diễn ra theo 2 chiều: một mặt, điều trị thải ghép cấp, nhất là khi sử dụng kháng thể đa dòng hay đơn dòng độc lympho bào, có thể tạo điều kiện xuất hiện nhiễm trùng CMV (sơ nhiễm từ người cho hoặc tái hoạt virus); mặt khác, nhiễm trùng CMV với các đặc tính điều hòa miễn dịch cũng có thể tạo điều kiện xuất hiện thải ghép cấp. Dự phòng hữu hiệu CMV với valganciclovir đường uống từ 3 đến 6 tháng, ngoài tác dụng kháng CMV, còn giúp ngăn ngừa thải ghép cấp, có thể góp phần cải thiện sống còn lâu dài của thận ghép và bệnh nhân.
2.2. Điều trị:
– Kết hợp các thuốc UCMD là nguyên tắc căn bản trong điều trị bệnh nhân ghép thận. Nguy cơ thải ghép cấp thay đổi theo các phác đồ UCMD, trong đó kết hợp tacrolimus, mycophenolate mofetil và corticosteroid có tỷ lệ thải ghép cấp thấp nhất (10-15%).
– Khi thải ghép cấp vẫn xảy ra cần tăng cường UCMD ngay. Khi bệnh cảnh lâm sàng rõ ràng, nghĩa là không có nguyên nhân nào khác giải thích rối loạn chức năng thận, hoặc có chống chỉ định sinh thiết thận, bắt đầu ngay corticosteroid liều tấn công (methylprednisolone 250-500 mg/ngày, 3 ngày liên tiếp). Nếu diễn tiến lâm sàng không thuận lợi sau điều trị ban đầu này, cần thiết sinh thiết thận để có chẩn đoán chính xác và hướng dẫn điều trị tiếp theo.
– Nếu sinh thiết thận được, điều trị chống thải ghép có thể dựa trên phân loại Banff. Đa số thải ghép ống thận-mô kẽ (Banff độ1) nhạy cảm với corticosteroid, do đó, điều trị bước đầu là corticosteroid tĩnh mạch, liều tấn công mỗi ngày, 3-5 ngày. Ngược lại, thải ghép với thành phần mạch máu (Banff độ 2 và 3) có thể kháng corticosteroid, cần điều trị với kháng thể độc lympho bào, như thymoglobulin, ATG (antithymocyte globulin), hoặc OKT3. Đôi khi, các điều trị này được dùng ngay từ đầu. Vd: ATG (Thymogam): 10-15mg/kg/ngày (tối đa 700mg/ngày) trong 14 ngày, sau đó cách ngày thêm 14 ngày nữa , tổng liều 21 mũi trong 28 ngày.
3. THẢI GHÉP CẤP THỂ DỊCH
3.1. Chẩn đoán:
– Lâm sàng của thải ghép cấp thể dịch thường là tình trạng rối loạn chức năng thận nặng, gặp trong 2 tình huống: (i) thận ghép trì hoãn phục hồi chức năng có sự hiện diện kháng thể lưu hành đặc hiệu chống lại người cho ở thời điểm ghép (dù hiệu giá kháng thể thấp), và (ii) thải ghép cấp sớm và nặng (hay thải ghép cấp gia tốc). Tuy nhiên, các đợt thải ghép cấp thể dịch có thể xảy ra ở các tình huống lâm sàng khác nhau, vào các thời điểm khác nhau, đôi khi muộn sau ghép, do không tuân thủ điều trị UCMD, trong quá trình giảm liều thuốc UCMD, hoặc khi điều trị với interferon- α ở bệnh nhiễm virus viêm gan C. Vì thế, cần nghĩ tới thải ghép cấp thể dịch trong những trường hợp rối loạn chức năng thận ghép cấp ở bất kỳ thời điểm nào sau ghép, đặc biệt khi rối loạn chức năng thận ghép nặng.
– Chẩn đoán thải ghép cấp thể dịch dựa trên các yếu tố sau:
+ Rối loạn chức năng thận ghép
+ Hiện diện kháng thể lưu hành đặc hiệu chống lại người cho, thường là chống lại kháng nguyên HLA của người cho
+ Hiện diện tổn thương mô học chuyên biệt ở mẫu sinh thiết thận (Bảng 1)
+ Lắng đọng lan tỏa C4d ở mao mạch quanh ống thận
3.2. Điều trị:
– Thải ghép cấp thể dịch không đáp ứng với điều trị corticosteroid và huyết thanh kháng bạch cầu lympho. Các chiến lược điều trị mới bao gồm việc kết hợp trao đổi huyết tương (hoặc dùng huyết tương tinh chế hoặc hấp phụ miễn dịch), globulin miễn dịch đường tĩnh mạch (IV Ig) và rituximab, nhằm mục đích:
+ Ngăn ngừa tổn thương mô gây ra do các chất trung gian thể dịch (kháng thể, bổ thể)
+ Ngăn ngừa sự hình thành kháng thể chống lại thận ghép
+ Ức chế ngắn hạn và dài hạn các đáp ứng miễn dịch thể dịch và tế bào
– Trao đổi huyết tương, dùng huyết tương tinh chế hoặc hấp phụ miễn dịch:
+ Các kỹ thuật tinh lọc huyết tương ngoài cơ thể hiệu quả trong việc loại bỏ kháng thể và 1 số chất trung gian viêm. Trao đổi huyết tương được thực hiện mỗi ngày hay cách ngày, và số lần trao đổi tùy thuộc đáp ứng lâm sàng của từng bệnh nhân (5-10 lần nếu diễn tiến lâm sàng thuận lợi). Thể tích mỗi lần trao đổi dao động từ 1 đến 1.5 lít và dung dịch thay thế là albumin 5%, dung dịch tinh thể hoặc dung dịch muối sinh lý (NaCl 9‰). Sử dụng IV Ig, ở cuối liệu trình trao đổi huyết tương, liều 0,4-2 g/kg, hoặc ở cuối mỗi lần trao đổi huyết tương.
+ Các thuốc UCMD khác được tiếp tục sử dụng trong liệu trình trao đổi huyết tương, cân nhắc dùng tacrolimus để thay thế cho cyclosporin. Các huyết thanh đa dòng kháng bạch cầu lympho được sử dụng ở bệnh nhân có thành phần thải ghép tế bào đi kèm với thải ghép thể dịch. Rituximab cũng được sử dụng trong chỉ định này, bằng cách kết hợp với trao đổi huyết tương và/hoặc IV Ig.
+ Trao đổi huyết tương tương đối an toàn, ít biến chứng, nhất là biến chứng nhiễm trùng.
– IV Ig:
+ IV Ig kết hợp với các kháng thể kháng HLA ngăn ngừa sự gắn kết của các kháng thể này trên các phân tử HLA ở bề mặt tế bào, giúp điều trị thải ghép cấp thể dịch. IV Ig cũng cố định trên các immunoglobulin ở bề mặt lympho B làm giảm tổng hợp immunoglobulin bởi lympho B, và thúc đẩy quá trình chết lập trình của các tế bào này. Các cơ chế này giải thích lợi ích của IV Ig trong các phác đồ khử mẫn cảm trước ghép, cũng như không có hiện tượng tăng trở lại nồng độ kháng thể sau các đợt trao đổi huyết tương đi kèm với sử dụng IV Ig.
+ IV Ig dùng đơn thuần liều cao có hiệu quả trong việc dự phòng và đảo ngược các đợt thải ghép cấp thể dịch, kết hợp trao đổi huyết tương và IV Ig hiệu quả hơn. Trao đổi huyết tương oại bỏ kháng thể đặc hiệu chống lại người cho giảm nồng độ kháng thể nhanh hơn và dễ kiểm soát hơn so với IV Ig đơn thuần liều cao.
+ Tác dụng phụ của IV Ig chủ yếu ở bệnh nhân mẫn cảm cao trong các phác đồ khử mẫn cảm trước ghép. Đa số là các triệu chứng nhẹ (nhức đầu, lạnh run, buồn nôn, đau khớp, đau lưng, tăng huyết áp), xảy ra ở 30 phút đầu tiên truyền tĩnh mạch, biến mất khi ngưng truyền tạm thời hoặc giảm tốc độ truyền. Viêm màng não bạch cầu xảy ra sau vài ngày dùng IV Ig, tự khỏi, hiếm gặp. Các phản ứng phản vệ có thể xảy ra, cơ chế có thể do sự hiện diện của các kháng thể IgG kháng IgA có trong huyết thanh người nhận IV Ig. 4 tác dụng phụ nặng cần được lưu ý: lây nhiễm các tác nhân gây bệnh, tán huyết cấp, suy thận cấp và huyết khối cấp tính.
– Rituximab là kháng thể đơn dòng kháng CD20, làm giảm số lượng lympho B CD19 và CD20 lưu hành, do đó, ngăn ngừa sự tổng hợp kháng thể, dự phòng và điều trị thải ghép cấp thể dịch. Sử dụng rituximab đi kèm với nguy cơ nhiễm trùng.
Bảng 1. Phân loại giải phẫu bệnh học thận ghép Banff 97 – Cập nhật Banff 09.
| 1. Bình thường |
| 2. Các thay đổi mô học thận ghép qua trung gian kháng thể Do hiện diện kháng thể đặc hiệu chống lại người cho, C4d +, và tổn thương mô học thận ghépC4d+ không kèm tổn thương mô học của thải ghép cấp: C4d+, hiện diện kháng thể đặc hiệu chống lại người cho, không có dấu hiệu của thải ghép tế bào hoặc thể dịch cấp hoặc mạn tính (nghĩa là g0, cg0, ptc0, không có hình ảnh nhiều lớp ở màng đáy mao mạch quanh ống thận, không có hình ảnh viêm tối thiểu tương tự như hoại tử ống thận cấp). Trường hợp có các thay đổi giáp biên đi kèm được xem là ‘chưa rõ ý nghĩa’. Thải ghép cấp thể dịch: C4d+, hiện diện kháng thể đặc hiệu chống lại người cho, tổn thương mô học cấp tính Độ 1: hình ảnh viêm tối thiểu tương tự như hoại tử ống thận cấp Độ 2: viêm mao mạch quanh ống thận và hoặc viêm mao mạch cầu thận (ptc/g >0) và hoặchuyết khối Độ 3: Viêm hoặc hoại tử tơ huyết xuyên thành động mạch (v3) Thải ghép mạn thể dịch hoạt động: C4d+, hiện diện kháng thể đặc hiệu chống lại người cho, tổn thương mô học mạn tính (đường viền đôi ở màng đáy cầu thận, và/hoặc hình ảnh nhiều lớp ở màng đáy mao mạch quanh ống thận, và/hoặc xơ hóa mô kẽ/teo ống thận, và/hoặc dày xơ hóa lớp nội mô động mạch) |
| 3. Các thay đổi giáp biên (nghi ngờ có thải ghép cấp tế bào): không có viêm nội mạc động mạch, nhưng hiện diện viêm ống thận (t1, t2 hoặc t3) và thâm nhiễm viêm mô kẽ tối thiểu (i0 hoặc i1) hoặc thâm nhiễm viêm mô kẽ (i2 hoặc i3) và viêm ống thận nhẹ (t1). |
| 4. Thải ghép qua trung gian tế bào:
Thải ghép cấp tế bào: Độ 1A: thâm nhiễm viêm mô kẽ trung bình hoặc nặng (i2 hoặc i3) và viêm ống thận trung bình (t2) 1B: thâm nhiễm viêm mô kẽ trung bình hoặc nặng (i2 hoặc i3) và viêm ống thận nặng (t3) Độ 2A: viêm nội mạc động mạch nhẹ hoặc trung bình (v1) 2B: viêm nội mạc động mạch nặng (v2) Độ 3: viêm động mạch xuyên thành và/hoặc hoại tử tơ huyết của lớp áo giữa thành động mạch kèm thâm nhiễm lympho bào (v3) Thải ghép mạn tế bào hoạt động: Bệnh lý động mạch thận ghép mạn tính (lớp nội mô động mạch dày, xơ hóa kèm thâm nhiễm lympho bào) |
| 5. Xơ hóa mô kẽ và teo ống thận, không kèm biểu hiện mô học của nguyên nhân chuyên biệt
Độ 1: xơ hóa mô kẽ và teo ống thận nhẹ (<25% diện tích vỏ thận) Độ 2: xơ hóa mô kẽ và teo ống thận nhẹ (26-50% diện tích vỏ thận) Độ 3: xơ hóa mô kẽ và teo ống thận nhẹ (>50% diện tích vỏ thận) |
| 6. Khác: các thay đổi mô học không được xem là do thải ghép cấp và/hoặc mạn tính |
Tài liệu tham khảo
1. Cornell LD, Smith RN, Colvin RB, 2008. Kidney transplantation: mechanisms of rejection and acceptance. Annu Rev Pathol 3:189-220
2. El-Amm JM, Gruber SA, 2009. The significance of subclinical rejection. Clin Transplant 23(2):150-156.
3. Venetz JP, Pascủal M, 2012. Rejets aigus. In: Legendre, C. ed. La Transplantation Rénale. Paris: Médecine Sciences Publications Lavoisier: 449-464.
4. Sis B, Mengel M, Haas M, Colvin RB, Halloran PF, Racusen LC, et al, 2010. Banff ’09 meeting report: antibody mediated graft deterioration and implementation of Banff working groups. Am J Transplant 10(3):464-471.
5. Glotz D, Antoine C, Julia P, Pegaz-Fiornet B, Duboust A, Boudjeltia S, et al, 2004. Intravenous immunoglobulins and transplantation for patients with anti-HLA antibodies. Transpl Int 17(1):1-8.
6. Glotz D, 2012. Immunoglobulines polyvalentes intraveineuses. In: Legendre, C., ed. La Transplantation Rénale. Paris: Médecine Sciences Publications Lavoisier: 412-420.
7. Nishio-Lucar A, Balogun RA, Sanoff S, 2013. Therapeutic apheresis in kidney transplantation: a review of renal transplant immunobiology and current interventions with apheresis medicine. J Clin Apher 28(1):56-63.
8. Kaplan AA, 2013. Therapeutic plasma exchange: a technical and operational review. J Clin Apher 28(1):3-10.
9. Kỷ Yếu Công Trình Ghép Thận Bệnh Viện Chợ Rẫy 1992-2010, Nhà xuất bản Y Học, chi nhánh thành phố Hồ Chí minh, 2010


































