Có tới 50% bệnh nhân ICU được truyền hồng cầu (1) và trong phần lớn các trường hợp (90%), số lần truyền này được sử dụng để tăng nồng độ hemoglobin ở những bệnh nhân không chảy máu (2). Thực hành truyền hồng cầu (RBC) dựa trên nồng độ hemoglobin đặt ra câu hỏi về mối tương quan giữa nồng độ hemoglobin trong máu và mức độ oxy hóa mô đầy đủ (vì mục Tiêu của truyền RBC là thúc đẩy oxy hóa mô). Đây là một vấn đề có liên quan vì có những rủi ro đáng kể do truyền RBC và có lo ngại rằng những rủi ro này có thể lớn hơn rủi ro thiếu máu mà chúng vốn nhằm mục đích điều chỉnh (3).
Chương này tập trung vào ảnh hưởng của tình trạng thiếu máu và truyền RBC đối với oxy hóa mô. Chương này bắt đầu bằng cách mô tả nguyên nhân và hậu quả của tình trạng thiếu máu ở những người bệnh nặng, sau đó trình bày các chỉ định, tác động sinh lý và hậu quả bất lợi liên quan đến truyền RBC. Các thực hành hiện tại thiếu cơ sở hợp lý hoặc khoa học được nêu bật để giải quyết nhu cầu sử dụng truyền RBC một cách thận trọng hơn.
THIẾU MÁU TRONG ICU
Thiếu máu gần như là tình trạng phổ biến ở ICU; tức là, tình trạng này xuất hiện khi nhập viện ở hai phần ba bệnh nhân và tỷ lệ mắc tăng lên 97% sau một tuần ở ICU (4). Tuy nhiên, định nghĩa chuẩn về thiếu máu có thể gây ra vấn đề ở bệnh nhân ICU, như được giải thích tiếp theo.
Định nghĩa thiếu máu
| BẢNG 12.1 Phạm vi tham chiếu cho các thông số hồng cầu ở người lớn | |
| Hemoglobin (Hb) Nam: 13.5–18 g/dL Nữ : 12–16 g/dL* |
Thể tích trung bình hồng cầu Nam: 80–100 x 10–15/L Nữ: như trên |
| Hematocrit (Hct) Nam: 40–54% Nữ: 38–47% |
Số lượng hồng cầu Nam: 4.6–6.2 x 1012/L Nữ: 4.2–5.4 x 1012/L |
| Khối hồng cầu Nam: 26 mL/kg Nữ: 24 mL/kg |
Số lượng hồng cầu lưới Nam: 25–75 x 109/L |
*Phạm vi bình thường là thấp hơn 1 g/dL sau tam cá nguyệt đầu tiên của thai kỳ. Nguồn: (1) Walker RH (biên tập). Sổ tay kỹ thuật của Hiệp hội Ngân hàng máu Hoa Kỳ. Ấn bản lần thứ 10. Arlington, VA: Hiệp hội Ngân hàng máu Hoa Kỳ, 1990:649–650; (2) Hillman RS, Finch CA. Sổ tay hồng cầu. Ấn bản lần thứ 6. Philadelphia: FA Davis, 1994;46
Thiếu máu được định nghĩa là tình trạng giảm khả năng vận chuyển oxy của máu. Đo lường chính xác nhất khả năng vận chuyển O2 của máu là khối lượng hồng cầu, tức là thể tích của các tế bào hồng cầu lưu thông và được đo bằng hồng cầu gắn crom. Phép đo này thường không được sử dụng trong các điều kiện lâm sàng; thay vào đó, nồng độ hematocrit (Hct) và hemoglobin được sử dụng làm các phép đo lâm sàng về khả năng vận chuyển O2. (Phạm vi tham chiếu cho các thông số hồng cầu này được thể hiện trong Bảng 12.1) Định nghĩa lâm sàng về thiếu máu là nồng độ hemoglobin (Hb) <13 g/dL (Hct <40%) ở nam giới và <12 g/dL (Hct <38%) ở nữ giới (4). Vì định nghĩa này dựa trên nồng độ nên nó sẽ bị ảnh hưởng bởi thể tích huyết tương.
Ảnh hưởng của thể tích huyết tương
Ảnh hưởng gây nhiễu của thể tích huyết tương lên phép đo lâm sàng về khả năng vận chuyển O2 (Hct) được chứng minh trong Hình 12.1. Bảng bên trái cho thấy những thay đổi về tư thế trong Hct ở một nhóm người lớn khỏe mạnh (5). Lưu ý rằng có 4,1% giảm tuyệt đối trong Hct ở tư thế nằm ngửa. Đây là kết quả của việc giảm áp suất thủy tĩnh trong các mao mạch ở chân (do mất hiệu ứng trọng lực), thúc đẩy sự di chuyển của dịch kẽ vào máu và làm tăng thể tích huyết tương (420 mL trong nghiên cứu này). Bảng bên phải cho thấy tác động của truyền bolus dung dịch muối đẳng trương (20 mL/kg), gây ra sự giảm tương tự (4,2%) trong Hct (6). Trong cả hai trường hợp, sự giảm Hct tương đương với sự thay đổi do mất một đơn vị hồng cầu.
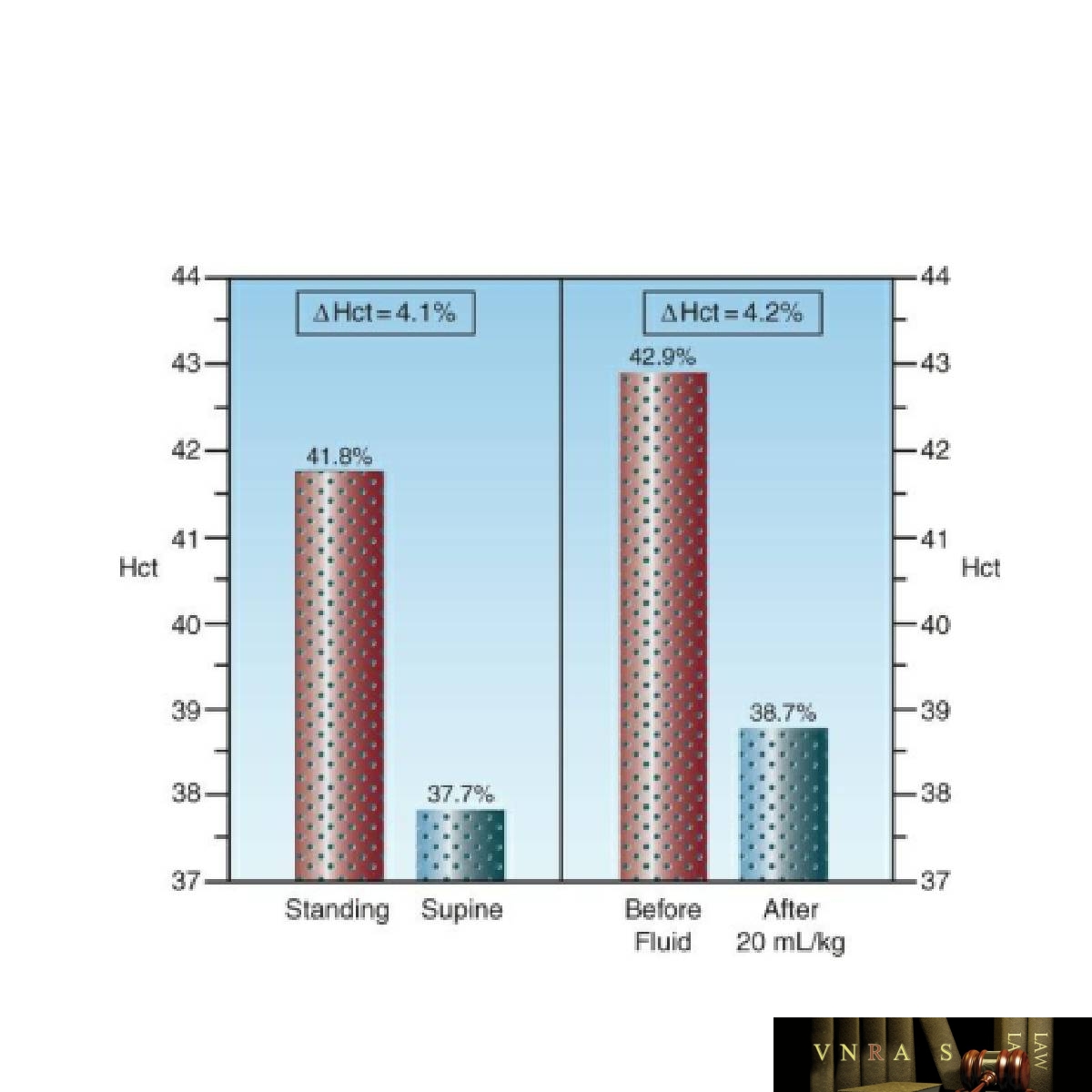
Tăng thể tích huyết tương là phổ biến ở những bệnh nhân bệnh nặng, như đã nhấn mạnh trong Chương 11 (xem Hình 11.3), và điều này có nghĩa là nồng độ Hct và Hb sẽ ước tính quá cao tỷ lệ mắc bệnh và mức độ nghiêm trọng của tình trạng thiếu máu ở những bệnh nhân ICU. Các nghiên cứu lâm sàng đã xác nhận rằng nồng độ Hct và Hb là những biện pháp không đáng tin cậy để đánh giá tình trạng thiếu máu ở những bệnh nhân bệnh nặng (7,8). Thật không may, đây là những biện pháp được sử dụng trong tất cả các nghiên cứu lâm sàng đánh giá tình trạng thiếu máu và truyền hồng cầu ở những bệnh nhân bệnh nặng.
Thiếu máu liên quan ICU
Hai tình trạng có thể làm tăng tỷ lệ mắc bệnh và mức độ nghiêm trọng của bệnh thiếu máu trong thời gian nằm viện tại ICU: tình trạng viêm toàn thân và việc lấy máu nhiều lần để xét nghiệm.
Tình trạng Viêm
Viêm toàn thân đi kèm với tình trạng cô lập sắt trong đại thực bào mô, được cho là do tác động của cytokine, và cũng do giải phóng hepcidin ở gan (9), một peptide nhỏ làm giảm nồng độ sắt trong huyết tương bằng cách thúc đẩy quá trình cô lập sắt trong đại thực bào mô (9). Sắt bị cô lập không thể được chuyển đến các tế bào hồng cầu đang phát triển và điều này dẫn đến tình trạng thiếu máu hồng cầu nhỏ nhược sắc giống với tình trạng thiếu máu do thiếu sắt. (Đây là cơ chế tương tự đối với “thiếu máu do bệnh mãn tính”). Bilan sắt trong huyết tương trong tình trạng thiếu máu do viêm bao gồm giảm sắt trong huyết tương, khả năng liên kết sắt toàn phần và nồng độ transferrin, có thể không phân biệt được với tình trạng thiếu sắt, nhưng có sự gia tăng nồng độ ferritin trong huyết tương.
FERRITIN TRONG HUYẾT TƯƠNG: Nồng độ ferritin trong huyết tương được sử dụng để đánh giá lượng dự trữ sắt trong mô và do đó có thể phân biệt giữa tình trạng thiếu máu do thiếu sắt (ferritin trong huyết tương <30 μg/L) và tình trạng thiếu máu do viêm (ferritin trong huyết tương >100 μg/L) (9).
Trích máu xét nghiệm
Trung bình 40–70 mL máu được rút ra hàng ngày ở bệnh nhân ICU để thực hiện các xét nghiệm cho khoa cận lâm sàng (4,10) và lượng máu mất tích lũy có thể lên tới 500 mL (một đơn vị máu toàn phần) sau một tuần.
Thể tích lấy máu tĩnh mạch hàng ngày có thể được giảm bằng cách truyền lại mẫu ban đầu khi lấy máu; tức là, khi máu được rút qua catheter mạch máu để xét nghiệm, dịch hút ban đầu sẽ được loại bỏ để loại bỏ sự can thiệp từ dịch truyền tĩnh mạch trong lòng catheter. Thể tích máu bị loại bỏ thường là khoảng 5 mL cho mỗi lần lấy máu và việc đưa máu này trở lại bệnh nhân có thể làm giảm 50% thể tích lấy máu tĩnh mạch hàng ngày (11).
Sinh lý học của Thiếu máu
Thiếu máu gây ra hai phản ứng giúp duy trì oxy hóa mô: (1) tăng cung lượng tim (kết quả của việc giảm độ nhớt của máu) và (2) tăng lượng O2 chiết xuất từ máu mao mạch.
Độ nhớt của máu
| BẢNG 12.2 Mối quan hệ giữa Hematocrit và Độ nhớt máu | ||
| Hematocrit (%) | Độ nhớt tương đối (nước = 1) | Độ nhớt tuyệt đối |
| 0 | 1.4 | — |
| 10 | 1.8 | 1.2 |
| 20 | 2.1 | 1.5 |
| 30 | 2.8 | 1.8 |
| 40 | 3.7 | 2.3 |
| 50 | 4.8 | 2.9 |
| 60 | 5.8 | 3.8 |
Từ Documenta Geigy Scientific Tables. Ấn bản lần thứ 7. Basel: Documenta Geigy, 1966:557–8 Độ nhớt được định nghĩa là sức cản của chất lỏng đối với những thay đổi về tốc độ dòng chảy (12), và cũng được mô tả là “độ nhầy” của chất lỏng (13). Độ nhớt của máu là kết quả của sự liên kết chéo của hồng cầu bởi fibrinogen huyết tương, và yếu tố chính quyết định độ nhớt của toàn bộ máu là nồng độ hồng cầu (hematocrit). Ảnh hưởng của hematocrit đến độ nhớt của máu được thể hiện trong Bảng 12.2. Lưu ý rằng độ nhớt của máu có thể được biểu thị theo giá trị tuyệt đối hoặc tương đối (so với nước). Độ nhớt của huyết tương (hematocrit bằng 0) chỉ cao hơn một chút so với nước, trong khi độ nhớt của toàn bộ máu ở hematocrit bình thường (45%) lớn hơn huyết tương khoảng 3 lần và lớn hơn nước khoảng 4 lần. Do đó, máu thiếu máu chảy dễ dàng hơn nhiều so với máu bình thường.
SỰ CHỐNG LẠI DÒNG CHẢY: Ảnh hưởng của độ nhớt máu đến dòng máu ngoại vi có thể được mô tả bằng phương trình Hagen-Poiseuille được trình bày bên dưới (14), phương trình này cũng được sử dụng trong Chương 1 để mô tả dòng chảy qua catheter mạch máu.
Q = ∆P × (π r4 / 8µL)
Phương trình này nêu rằng dòng chảy (Q) qua mạch máu có liên quan trực tiếp đến độ chênh áp suất dọc theo mạch (∆P) và lũy thừa bậc bốn của bán kính (r) của mạch, và liên quan nghịch
đảo với chiều dài (L) của mạch và độ nhớt (µ) của chất lỏng. Số hạng cuối cùng trong phương trình là nghịch đảo của sức cản (1/R), do đó sức cản dòng chảy có thể được mô tả như sau:
R = 8µL / π r4
Phương trình này chỉ ra rằng sức cản dòng chảy trong tuần hoàn ngoại vi có liên quan trực tiếp đến độ nhớt của máu.
Cung lượng tim
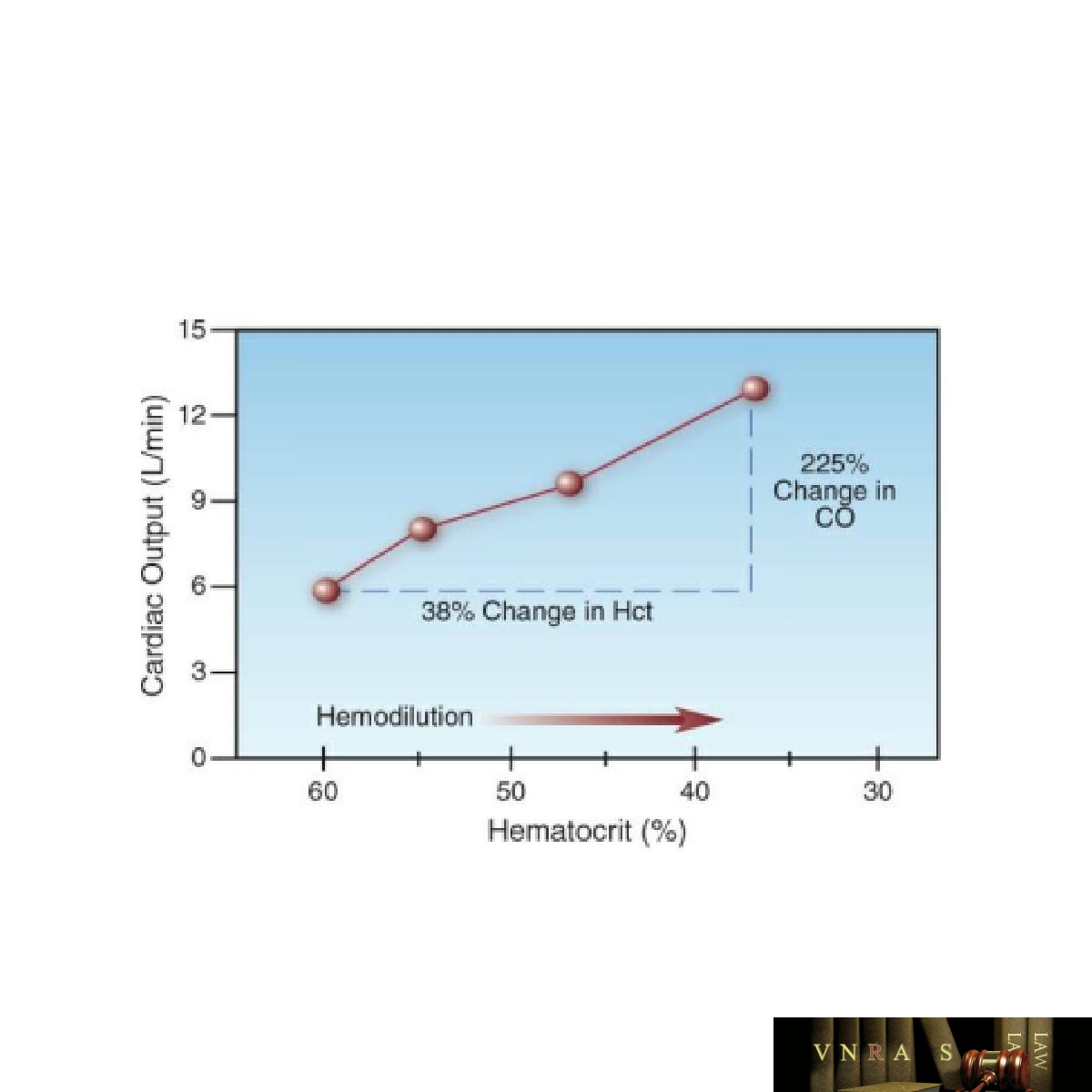
Tác động của tình trạng thiếu máu lên độ nhớt của máu là nguyên nhân gây ra sự gia tăng cung lượng tim như thể hiện trong Hình 12.2 (15). Lưu ý rằng sự gia tăng cung lượng tim lớn hơn tỷ lệ thuận với sự giảm hematocrit. Điều này là do máu là chất lỏng phi Newton, có nghĩa là độ nhớt chịu ảnh hưởng của lưu lượng máu; tức là, lưu lượng máu tăng sẽ làm giảm độ nhớt.
(Theo nghĩa mục đích luận, đặc tính này sẽ có lợi trong việc giúp giảm mất máu qua mạch máu bị thủng; tức là, mất máu qua vết thủng sẽ dẫn đến giảm lưu lượng máu tại chỗ, sau đó sẽ “làm đặc” máu và giảm xu hướng mất máu thêm.) Sự gia tăng cung lượng tim giúp duy trì vận chuyển O2 toàn thân khi hematocrit giảm.
Oxi hóa hệ thống
Ảnh hưởng của tình trạng thiếu máu tiến triển đến các biện pháp oxy hóa toàn thân được thể hiện trong Hình 12.3 (16). Các phát hiện chính được giải thích bằng cách sử dụng các mối quan hệ sau đây giữa hấp (tiêu) thụ O2 (VO2), cung cấp O2 (DO2) và chiết xuất O2:
VO2 = DO2 × O2 mức chiết xuất
Bảng trên trong Hình 12.3 cho thấy rằng, mặc dù cung lượng tim tăng trong tình trạng thiếu máu, nhưng sự giảm hemoglobin dẫn đến sự giảm tổng thể trong việc cung cấp O2 toàn thân. Tuy nhiên, có sự gia tăng bù trừ trong việc chiết xuất O2 và điều này duy trì sự hấp thụ O2 không đổi (hiển thị ở bảng dưới). Tuy nhiên, khi hematocrit giảm xuống dưới 10%, sự gia tăng chiết xuất O2 không còn có thể bù đắp hoàn toàn cho sự giảm trong việc cung cấp O2 và sau đó sự hấp thụ O2 bắt đầu giảm. Khi điều này xảy ra, mức lactat bắt đầu tăng, cho thấy oxy hóa mô không đủ. Lưu ý rằng việc chiết xuất O2 tối đa là khoảng 50% và đây là ngưỡng cho thấy oxy hóa mô bị suy yếu.
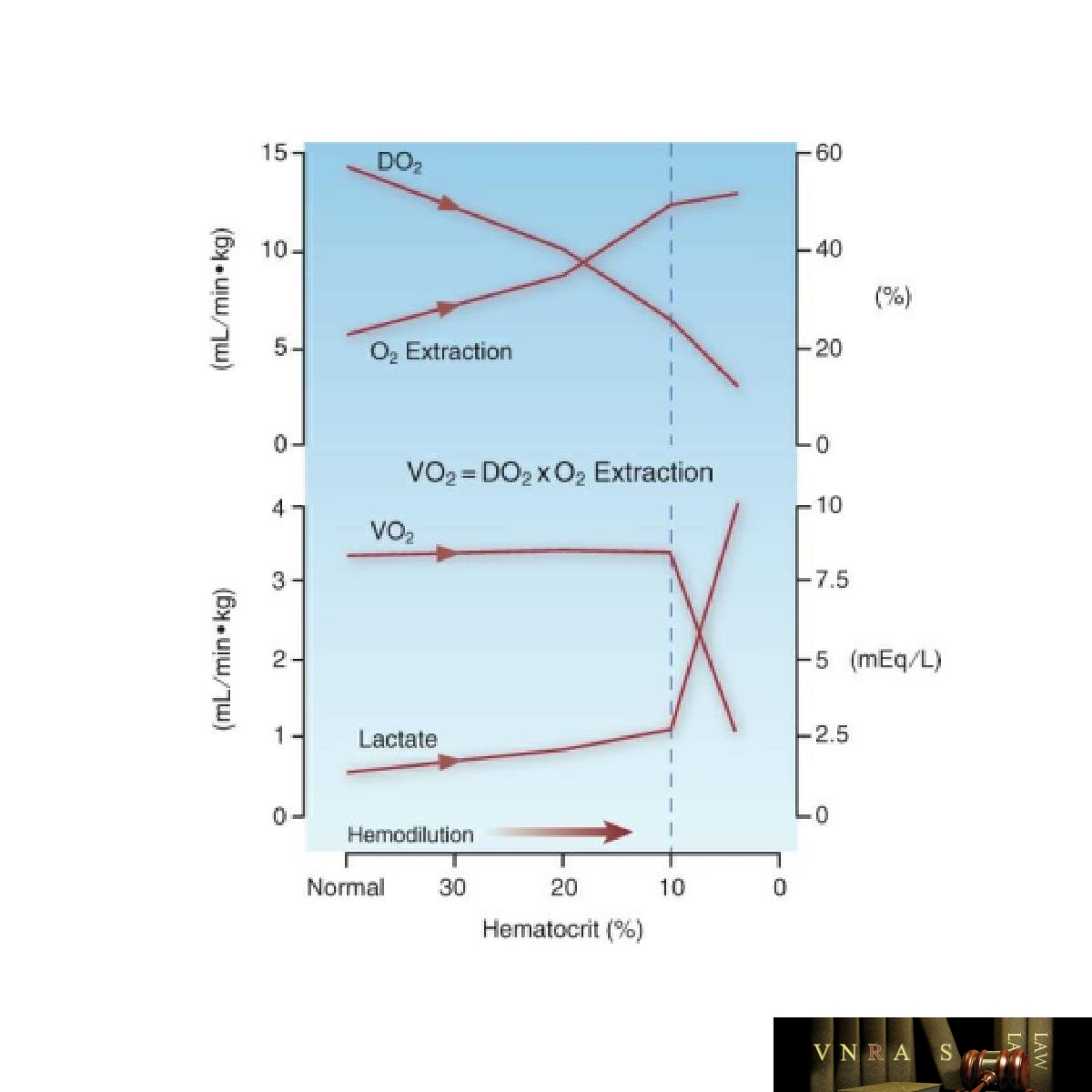
Có hai đặc điểm trong Hình 12.3 đáng được nhấn mạnh:
• Thiếu máu không làm suy yếu quá trình oxy hóa mô cho đến khi hematocrit giảm xuống 10% (tương đương với nồng độ Hb là 3 g/dL), cho thấy ngay cả những tình trạng thiếu máu nghiêm trọng nhất cũng được dung nạp (nhờ sự gia tăng bù trừ trong quá trình chiết xuất O2).
• Chiết xuất O2 tăng lên 50% đánh dấu điểm mà quá trình oxy hóa mô bị đe dọa và điểm này có thể đóng vai trò là chỉ định truyền RBC. (Sẽ nói thêm về điều này sau)
SỰ DUNG NẠP VỚI THIẾU MÁU NẶNG: Các nghiên cứu trên động vật đã chỉ ra rằng, khi thể tích nội mạch được duy trì, hematocrit thấp tới 5 đến 10% (Hb = 1,5 đến 3 g/dL) không ảnh hưởng xấu đến quá trình oxy hóa mô (16–18), ngay cả ở những động vật tỉnh táo hít thở không khí trong phòng (18). Các nghiên cứu trên người về hematocrit hoặc hemoglobin thấp nhất có thể dung nạp chủ yếu liên quan đến bệnh nhân Nhân chứng Giê-hô-va (JW). Trong một nghiên cứu lớn bao gồm 300 bệnh nhân JW sau phẫu thuật, 50% bệnh nhân sống sót với mức Hb là 2–3 g/dL và 75% bệnh nhân sống sót với mức Hb là 3–4 g/dL (19). Một nghiên cứu khác về tình trạng pha loãng máu tiến triển ở người lớn khỏe mạnh cho thấy mức Hb là 5 g/dL không gây hại rõ ràng (20). Do đó, các nghiên cứu hiện có cho thấy mức Hb xuống tới 5,0 là an toàn và từng bệnh nhân có thể dung nạp mức Hb thấp tới 2–3 g/dL!
KÍCH HOẠT TRUYỀN MÁU
Năm 1942, mức hemoglobin (Hb) ≤10 g/dL được khuyến cáo là chỉ định truyền RBC (21), và đây là yếu tố kích hoạt truyền máu tiêu chuẩn trong 60 năm tiếp theo, cho đến khi mối lo ngại về những rủi ro liên quan đến truyền RBC thúc đẩy các nghiên cứu cho thấy rằng kết quả không bị ảnh hưởng xấu nếu mức Hb được phép giảm xuống 7 g/dL (22,23). Đánh giá gần đây về 48 nghiên cứu lâm sàng đã xác nhận rằng kết quả tương tự (bao gồm các biến cố tim mạch) khi mức Hb được duy trì ở mức 7–8 g/dL thay vì 9–10 g/dL, và ngưỡng Hb thấp hơn để truyền máu dẫn đến giảm 41% lượng tiêu thụ các sản phẩm RBC (24).
Các Guideline
Có 21 hướng dẫn thực hành lâm sàng về truyền RBC cho bệnh nhân bệnh nặng không đang chảy máu (để biết khuyến nghị của từng hướng dẫn, hãy xem Tài liệu tham khảo 25) và phần lớn các khuyến nghị nêu rõ như sau:
• Ngưỡng truyền RBC là Hb <7 g/dL đối với bệnh nhân bệnh nặng có huyết động ổn định và không mắc bệnh động mạch vành. Điều này bao gồm bệnh nhân sau phẫu thuật tim và bệnh nhân bị sốc nhiễm trùng.
• Ngưỡng truyền máu phải là Hb <8 g/dL đối với bệnh nhân mắc bệnh động mạch vành và bệnh nhân phẫu thuật tim hoặc phẫu thuật chỉnh hình.
Việc tuân thủ các hướng dẫn này còn kém; ví dụ, một cuộc khảo sát gần 5.000 ca truyền RBC cho thấy 60% ca truyền máu không tuân thủ các khuyến nghị của hướng dẫn (26).
Có gì sai?
Có hai vấn đề với việc sử dụng nồng độ Hb làm yếu tố kích hoạt truyền máu:
• Nồng độ Hb không cung cấp thông tin về mức độ oxy hóa mô đầy đủ và vì mục tiêu của truyền RBC là thúc đẩy oxy hóa mô nên việc truyền máu dựa trên nồng độ Hb được thực hiện mà không có bằng chứng về nhu cầu hoặc lợi ích.
• Giảm nồng độ Hb cấp tính có thể gây ra do tác dụng pha loãng và điều này có thể dẫn đến truyền RBC không phù hợp.
Một số hướng dẫn thực hành lâm sàng đã khuyến cáo từ bỏ mức Hb làm yếu tố kích hoạt truyền máu và áp dụng các biện pháp sinh lý hơn về oxy hóa mô (27), như các biện pháp được mô tả tiếp theo (27).
Sự chiết xuất oxi
Như đã mô tả trước đó (và thể hiện trong Hình 12.3), tình trạng thiếu máu gây ra sự gia tăng bù trừ trong việc chiết xuất O2, giúp duy trì tốc độ hấp thụ O2 không đổi vào các mô. Tuy nhiên, việc chiết xuất O2 đạt mức tối đa khoảng 50% và sau điểm này, việc giảm thêm Hb sẽ dẫn đến việc giảm hấp thụ O2, đây là dấu hiệu của tình trạng oxy hóa mô bị suy giảm. Do đó, việc chiết xuất O2 ở mức 50% có thể được sử dụng làm yếu tố kích hoạt truyền máu vì nó xác định ngưỡng oxy hóa mô bị suy giảm (28). Việc chiết xuất O2 gần tương đương với sự khác biệt giữa độ bão hòa O2 động mạch và tĩnh mạch trung tâm (SaO2–ScvO2) và điều này có thể được theo dõi liên tục bằng cách sử dụng phương pháp đo oxy xung (đối với SaO2) và catheter “đo oxy” tĩnh mạch trung tâm (đối với ScvO2).
Khi SaO2 gần 100%, ScvO2 có thể được sử dụng riêng lẻ làm yếu tố kích hoạt truyền máu; ví dụ, ScvO2 <70% đã được đề xuất như một tác nhân kích hoạt truyền máu (29).
Thật không may, mặc dù có những lợi thế về mặt sinh lý của các phương pháp tiếp cận này, chúng vẫn nhận được ít sự chú ý.
TRUYỀN KHỐI HỒNG CẦU
Máu toàn phần chỉ được lưu trữ theo yêu cầu và được tách thành các thành phần khác; tức là hồng cầu (RBC), tiểu cầu, huyết tương và kết tủa lạnh. Thực hành này cho phép mỗi đơn vị máu được cho phục vụ nhiều nhu cầu truyền máu.
Các chế phẩm hồng cầu
Các chế phẩm RBC có sẵn để truyền máu được thể hiện trong Bảng 12.3
Túi hồng cầu lắng
Phần hồng cầu của máu cho được đặt trong dung dịch bảo quản và được lưu trữ ở nhiệt độ từ 1 đến 6° C. Các dung dịch bảo quản mới hơn có chứa adenine, giúp duy trì mức ATP trong hồng cầu được lưu trữ và cho phép lưu trữ hồng cầu của người cho trong tối đa 42 ngày (30).
Mỗi đơn vị hồng cầu cô đặc, được gọi là hồng cầu đóng túi (RBC đóng túi ), có hematocrit khoảng 60% và thể tích khoảng 350 mL, bao gồm khoảng 30 – 50 mL huyết tương còn lại và một số lượng đáng kể bạch cầu (30).
Túi hồng cầu được làm giảm bạch cầu
Các tế bào bạch cầu trong hồng cầu đóng túi có thể kích hoạt phản ứng kháng thể ở người nhận sau nhiều lần truyền máu, và đây là nguyên nhân gây ra phản ứng truyền máu không tan máu gây sốt (xem phần sau). Để giảm nguy cơ xảy ra phản ứng này, hồng cầu của người cho được truyền qua các bộ lọc chuyên dụng để loại bỏ hầu hết các tế bào bạch cầu. Điều này được thực hiện thường quy tại nhiều ngân hàng máu, nhưng việc giảm bạch cầu phổ biến vẫn chưa được áp dụng tại Hoa Kỳ. Các túi hồng cầu giảm bạch cầu được khuyến nghị cho những bệnh nhân có phản ứng truyền máu không tan máu gây sốt trước đó (30).
| BẢNG 12.3 Các chế phẩm hồng cầu | |
| Chế phẩm | Các đặc tính |
| Túi hồng cầu lắng | 1. Mỗi đơn vị có thể tích 350 mL và hematocrit khoảng 60%. 2. Chứa bạch cầu và huyết tương còn lại (15–30 mL mỗi đơn vị) 3. Có thể bảo quản trong 42 ngày với các chất phụ gia thích hợp |
| Túi hồng cầu lắng ít bạch cầu |
1. Các túi hồng cầu của người cho được truyền qua các bộ lọc chuyên dụng để loại bỏ hầu hết các tế bào bạch cầu. Điều này làm giảm nguy cơ phản ứng sốt không tan máu. 2. Chỉ định cho những bệnh nhân có tiền sử phản ứng sốt truyền máu (không tan máu) |
| Túi hồng cầu rửa | 1. Các túi hồng cầu được rửa bằng nước muối để loại bỏ huyết tương còn sót lại, giúp giảm nguy cơ phản ứng quá mẫn. 2. Chỉ định cho những bệnh nhân có tiền sử phản ứng dị ứng liên quan đến truyền máu và ở những bệnh nhân bị thiếu hụt IgA, những người có nguy cơ bị phản vệ liên quan đến truyền má |
Túi hồng cầu rửa
Có thể rửa hồng cầu của người cho bằng dung dịch muối đẳng trương để loại bỏ huyết tương còn sót lại. Điều này làm giảm nguy cơ phản ứng quá mẫn do nhạy cảm trước đó với protein huyết tương trong máu của người cho . Các chế phẩm hồng cầu đã rửa được khuyến cáo cho
những bệnh nhân có tiền sử phản ứng quá mẫn với truyền máu và cho những bệnh nhân bị thiếu hụt immunoglobulin A, những người có nguy cơ phản vệ liên quan đến truyền máu cao hơn (30). Rửa bằng nước muối không loại bỏ tác động bạch cầu.
Truyền hồng cầu đóng túi (PRBC)
| BẢNG 12.4 Truyền hồng cầu đóng túi theo trọng lực | |||
| Thể tích | Thời gian truyền | ||
| 20-G Catheter* | 18-G Catheter | ||
| 1 Unit không pha loãng | 350 mL | 117 phút | 70 phút |
| 1 Unit + 100 mL NS | 450 ml | 19 | 12 |
* G = kích thước gauge. Chiều dài catheter 1,2 inch cho tất cả các lần truyền dịch. Từ Tài liệu tham khảo 31.
Hồng cầu đóng túi (PRBC) có độ nhớt cao (do Hct là 60%) và do đó có tốc độ chảy chậm. Do đó, nước muối thường được thêm vào truyền PRBC để tăng tốc độ chảy và giảm thời gian truyền. Dữ liệu trong Bảng 12.4 cho thấy thời gian truyền cho một đơn vị PRBC qua catheter ngoại vi cỡ 18 và 20, và ảnh hưởng của việc pha loãng với 100 mL nước muối đẳng trương (31). Lưu ý rằng thời gian truyền là gần 2 giờ khi hồng cầu chưa pha loãng được truyền qua catheter cỡ 20, và thời gian truyền được giảm xuống còn gần một giờ với catheter cỡ 18. Cũng lưu ý rằng hồng cầu truyền nhanh hơn sáu lần khi được pha loãng bằng nước muối. Thời gian truyền được khuyến cáo thường là 2 giờ cho mỗi đơn vị hồng cầu đóng túi đối với những bệnh nhân ổn định về mặt huyết động (30), do đó, việc pha loãng nước muối có thể không cần thiết khi truyền PRBC để điều chỉnh tình trạng thiếu máu.
Các bộ lộc máu
Bộ lọc máu tiêu chuẩn (kích thước lỗ từ 170 đến 260 micron) là bắt buộc đối với việc truyền tất cả các sản phẩm máu (30). Các bộ lọc này giữ lại cục máu đông và các mảnh vụn khác, nhưng chúng không giữ lại bạch cầu và không hiệu quả trong việc giảm bạch cầu (30). Các bộ lọc này có thể trở thành vật cản dòng chảy khi chúng thu thập các mảnh vụn bị mắc kẹt và tốc độ truyền chậm là dấu hiệu cần thay bộ lọc.
Tác động lên oxy hóa toàn thân
Ở người lớn có kích thước trung bình, một đơn vị hồng cầu túi dự kiến sẽ làm tăng nồng độ hemoglobin và hematocrit lần lượt là 1 g/dL và 3% (30). Tác động của truyền RBC lên các biện pháp oxy hóa toàn thân được thể hiện ở Hình 12.4. Dữ liệu trong hình này lấy từ một nhóm bệnh nhân sau phẫu thuật bị thiếu máu đẳng thể tích nghiêm trọng (Hb <7 g/dL) được truyền 1 – 2 đơn vị hồng cầu đóng túi để nâng Hb lên trên 7 g/dL. Truyền RBC làm tăng nồng độ Hb trung bình từ 6,4 lên 8 g/dL (tăng 25%) và có sự gia tăng tương tự trong cung cấp O2 (DO2). Tuy nhiên, lượng O2 hấp thụ toàn thân (VO2) không thay đổi. VO2 không đổi khi DO2 tăng cho thấy việc chiết xuất O2 đã giảm do truyền RBC, như dự đoán của Phương trình 12.3. Những thay đổi trong quá trình chiết xuất DO2 và O2 này ngược lại với những thay đổi do thiếu máu gây ra, như thể hiện trong Hình 12.3.
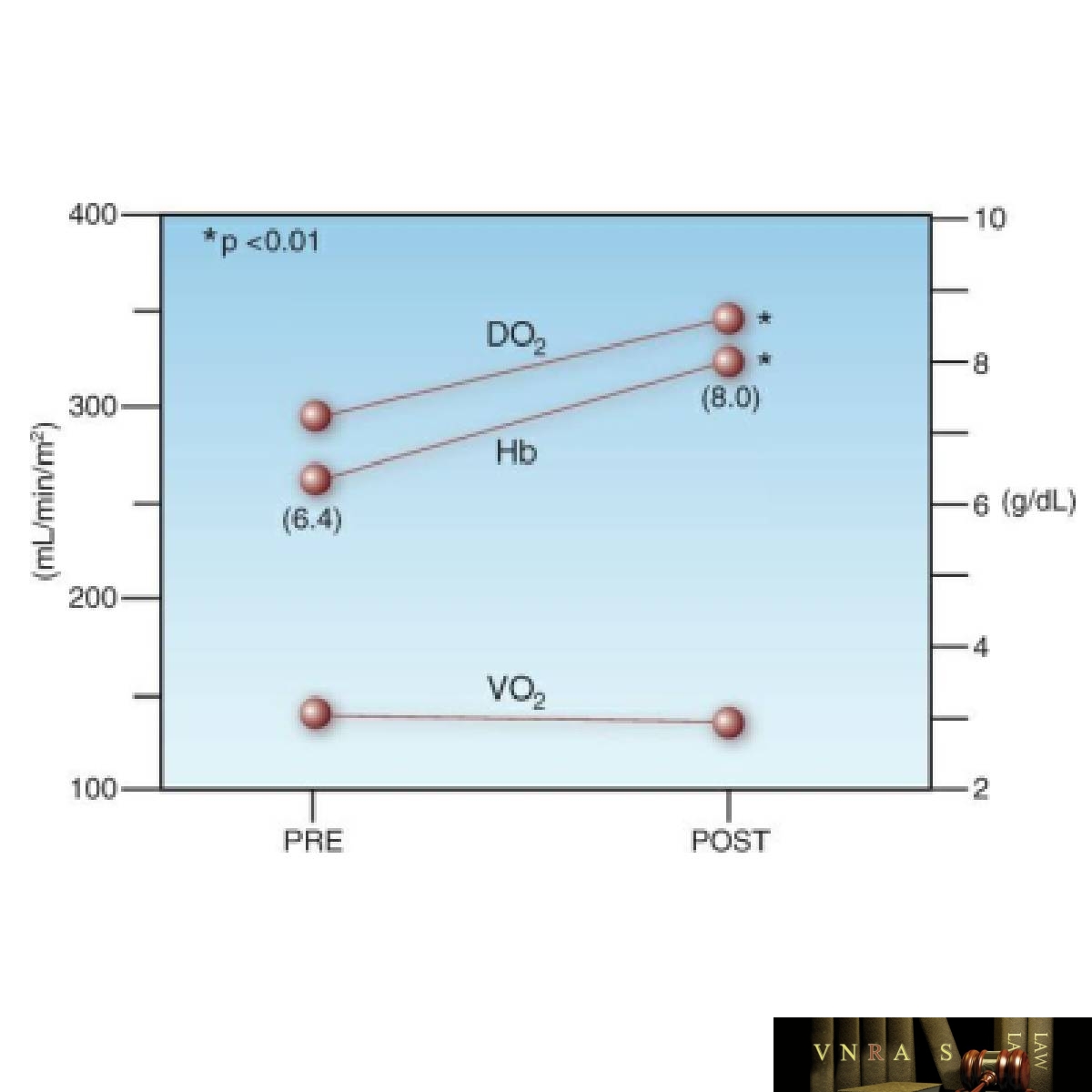
điểm dữ liệu biểu thị giá trị trung bình cho từng thông số. Các số trong ngoặc đơn biểu thị nồng độ hemoglobin trung bình trước và sau khi truyền.
Không cải thiện oxy hóa mô
Việc không có tác dụng lên VO2 trong Hình 12.4 cho thấy truyền RBC không làm tăng oxy hóa mô. Điều này đã được xác nhận trong một số nghiên cứu lâm sàng (32–35) và việc lưu trữ RBC trong thời gian dài thực sự có thể làm suy yếu oxy hóa mô sau khi truyền (36). Các nghiên cứu này đã thúc đẩy tuyên bố sau trong hướng dẫn thực hành lâm sàng về truyền hồng cầu (27):
“Truyền RBC không nên được coi là phương pháp tuyệt đối để cải thiện oxy hóa mô ở những bệnh nhân bệnh nặng”.
BÌNH LUẬN: Việc truyền RBC không thể tăng cường oxy hóa mô đặt ra những câu hỏi nghiêm túc về việc truyền RBC chỉ để tăng mức Hb. Mối quan tâm này đặc biệt có liên quan khi xét đến nhiều rủi ro liên quan đến truyền RBC, được mô tả trong phần tiếp theo.
CÁC NGUY CƠ CỦA TRUYỀN MÁU
Phổ các biến cố bất lợi liên quan đến truyền RBC được thể hiện trong Bảng 12.5, cùng với rủi ro của từng biến cố trên mỗi đơn vị RBC được truyền (37–42). Lưu ý rằng lỗi truyền máu thường xuyên hơn nhiều so với việc truyền các tác nhân truyền nhiễm đáng sợ. Sau đây là mô tả ngắn gọn về các phản ứng truyền máu chính.
| BẢNG 12.5 Các biến cố bất lợi liên quan truyền RBC (trên mỗi đơn vị truyền máu) | |
| Liên quan đến miễn dịch | Các vấn đề khác |
| Sốt không tan máu (1:60) Phản ứng quá mẫn: • Mày đay (1:100) • Phản vệ (1:1.000) • Sốc phản vệ (1:50.000) Tổn thương phổi cấp tính (1:12.000) Nhiễm trùng bệnh viện (?) Tan máu cấp tính (1:35.000) Tan máu tử vong (1:1,9 triệu) |
Quá tải tuần hoàn (1:100)† Nhiễm trùng lây truyền: • Vi khuẩn (1:500.000) • Virus viêm gan B (1:1,2 triệu) • Virus viêm gan C (1:1,5 triệu) • HIV (1:1,5 triệu) Lỗi truyền máu: • Truyền nhầm người (1:15.000) • Truyền máu không tương thích (1:33.000) |
Các phản ứng tan máu cấp
Phản ứng tan máu cấp tính xảy ra do truyền hồng cầu không tương thích nhóm máu ABO với người nhận. Khi điều này xảy ra, kháng thể trong máu người nhận sẽ liên kết với kháng nguyên nhóm máu ABO trên hồng cầu của người cho và quá trình tan máu sau đó của hồng cầu của người cho sẽ kích hoạt phản ứng viêm toàn thân có thể kèm theo hạ huyết áp và suy đa cơ quan. Những phản ứng này thường là kết quả của lỗi của con người (43).
Đặc điểm lâm sàng
Đặc điểm của phản ứng tan máu cấp tính là sốt đột ngột, khó thở, đau ngực, đau lưng dưới và hạ huyết áp trong vòng vài phút sau khi bắt đầu truyền máu. Phản ứng nghiêm trọng kèm theo bệnh lý đông máu tiêu thụ và rối loạn chức năng đa cơ quan tiến triển.
Quản lý điều trị
• Nếu nghi ngờ có phản ứng tan máu, hãy NGỪNG truyền máu ngay lập tức và xác minh rằng đã truyền đúng máu cho đúng bệnh nhân. Điều bắt buộc là phải ngừng truyền máu càng sớm càng tốt vì mức độ nghiêm trọng của phản ứng tan máu phụ thuộc vào thể tích máu được truyền (39).
• Nếu máu của người cho phù hợp chính xác với bệnh nhân, thì phản ứng tan máu cấp tính không có khả năng xảy ra. Tuy nhiên, ngân hàng máu phải được thông báo và họ sẽ yêu cầu mẫu máu để thực hiện xét nghiệm hemoglobin tự do trong huyết tương (để tìm bằng chứng về tan máu nội mạch) và xét nghiệm Coomb trực tiếp (để tìm bằng chứng về kháng thể anti-ABO).
• Nếu phản ứng tan máu cấp tính được xác nhận, việc xử trí là chăm sóc hỗ trợ chung, với hỗ trợ thể tích và thuốc co mạch để nâng huyết áp, và hỗ trợ thở máy nếu suy hô hấp. Những phản ứng này hiếm khi gây tử vong (xem Bảng 12.5).
Các phản ứng sốt không do tan máu
Phản ứng sốt không liên quan đến tan máu là phản ứng có hại phổ biến nhất đối với truyền RBC (xem Bảng 12.5). Các phản ứng này được đặc trưng bởi nhiệt độ tăng >1 °C (1,8 °F) xảy ra trong hoặc lên đến 6 giờ sau khi truyền máu và không có nguyên nhân rõ ràng nào khác (ví dụ: phản ứng tan máu cấp tính) (40). Thủ phạm là sự hiện diện của kháng thể kháng bạch cầu trong máu người nhận phản ứng với các kháng nguyên trên bạch cầu trong máu của người cho . Điều này kích hoạt giải phóng các chất gây sốt nội sinh từ các tế bào thực bào, đây là nguồn gây sốt. Phản ứng này thường xảy ra ở những bệnh nhân đã được truyền máu trước đó và ở những phụ nữ đã sinh nhiều con. Truyền RBC đã được làm giảm bạch cầu làm giảm, nhưng không loại bỏ, nguy cơ xảy ra phản ứng này (40).
Đặc điểm lâm sàng
Sốt thường không xuất hiện trong giờ đầu tiên sau khi bắt đầu truyền máu (không giống như sốt liên quan đến phản ứng tan máu cấp tính), nhưng có thể kèm theo rét run và ớn lạnh.
Quản lý điều trị
• Cách tiếp cận ban đầu đối với sốt liên quan đến truyền máu giống như đã mô tả đối với phản ứng truyền máu tan máu, mặc dù sốt có thể không xuất hiện cho đến khi truyền xong. Chẩn đoán được xác nhận bằng cách loại trừ sự hiện diện của tan máu bằng các xét nghiệm đã mô tả trước đó.
• Ngân hàng máu sẽ thực hiện nhuộm Gram trên máu của người cho và có thể yêu cầu cấy máu từ người nhận.
• Hơn 75% số cơn sốt không tan máu sẽ không tái phát trong các lần truyền máu tiếp theo (44). Do đó, không cần biện pháp phòng ngừa đặc biệt nào cho các lần truyền máu trong tương lai. Nếu xảy ra phản ứng sốt thứ hai, nên sử dụng hồng cầu túi được làm giảm giảm bạch cầu cho tất cả các lần truyền máu tiếp theo.
Phản ứng quá mẫn
Phản ứng quá mẫn là kết quả của quá trình nhạy cảm với protein huyết tương trong máu của người cho từ những lần truyền máu trước đó. Bệnh nhân thiếu IgA dễ bị phản ứng quá mẫn khi truyền máu và không cần phải tiếp xúc trước với các sản phẩm huyết tương. Phản ứng quá mẫn phổ biến nhất là mày đay, được báo cáo ở một trong mỗi 100 đơn vị được truyền (41). Các phản ứng phản vệ nghiêm trọng hơn (ví dụ như co thắt phế quản) ít phổ biến hơn nhiều và sốc phản vệ rất hiếm gặp.
Đặc điểm lâm sàng
Biểu hiện thường gặp là mày đay nhẹ xuất hiện trong quá trình truyền máu và không kèm theo sốt. Khó thở và thở khò khè đột ngột trong quá trình truyền máu có thể là dấu hiệu của phản ứng phản vệ và hạ huyết áp do sốc phản vệ có thể bị nhầm là phản ứng tan máu cấp tính.
Quản lý điều trị
• Mày đay nhẹ không sốt không cần phải ngừng truyền máu. Tuy nhiên, phương pháp phổ biến là tạm thời dừng truyền máu và dùng thuốc kháng histamin để giảm triệu
chứng (ví dụ: diphenhydramine, 25–50 mg uống, tiêm bắp hoặc tiêm tĩnh mạch).
• Các phản ứng phản vệ nghiêm trọng nên được xử trí như mô tả trong Chương 17. Cần ngừng truyền máu ngay lập tức nếu nghi ngờ bị phản vệ nghiêm trọng.
• Đối với những bệnh nhân bị phản ứng dị ứng, nên sử dụng hồng cầu đã rửa cho tất cả các lần truyền máu trong tương lai và đối với những bệnh nhân bị phản ứng phản vệ, nên tránh truyền máu trong tương lai trừ khi thực sự cần thiết.
• Những bệnh nhân bị phản ứng quá mẫn nên được xét nghiệm xem có thiếu hụt IgA tiềm ẩn hay không.
Tổn thương phổi cấp
Tình trạng được gọi là tổn thương phổi cấp tính liên quan đến truyền máu (TRALI) là tổn thương phổi do viêm giống với hội chứng suy hô hấp cấp tính (ARDS) và liên quan đến truyền RBC và tiểu cầu. Tình trạng này không phổ biến (một trường hợp trên 12.000 lần truyền RBC), nhưng được coi là nguyên nhân hàng đầu gây tử vong liên quan đến truyền máu và có tỷ lệ tử vong lên tới 50% (45).
Trong 80% trường hợp, TRALI là kết quả của kháng thể trong máu của người cho liên kết với các kháng nguyên trên bạch cầu trung tính lưu hành ở người nhận (45). Điều này kích hoạt hoạt hóa bạch cầu trung tính và các bạch cầu trung tính được kích hoạt sẽ bị cô lập trong các mao mạch phổi và di chuyển vào phổi để gây ra tổn thương do viêm. Kháng thể không liên quan đến khoảng 20% các trường hợp, nhưng tác nhân gây bệnh vẫn chưa được xác định.
Đặc điểm lâm sàng
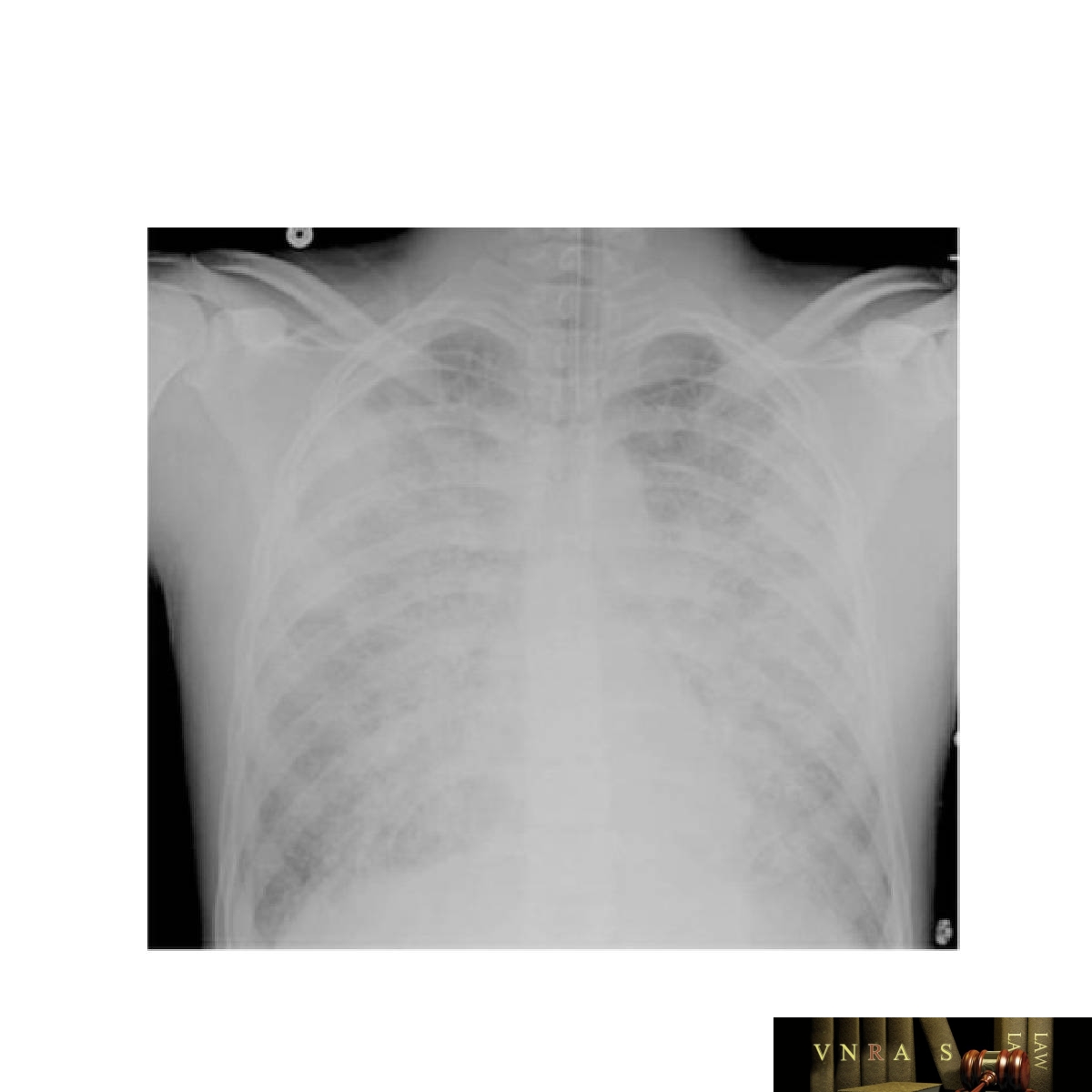
TRALI biểu hiện bằng suy hô hấp thiếu oxy cấp tính thường xuất hiện trong giờ đầu tiên sau khi bắt đầu truyền máu, nhưng có thể xuất hiện bất cứ lúc nào trong 6 giờ đầu tiên sau khi bắt đầu truyền máu (46), Sốt là phổ biến và chụp X-quang ngực cuối cùng có thể trông giống như trong Hình 12.5, với thâm nhiễm trải rộng ở cả hai phổi không thể phân biệt được với ARDS (được mô tả trong Chương 24). Suy hô hấp có thể nghiêm trọng ngay từ đầu và thường phải thở máy.
TRALI có thể khó phân biệt với phù phổi thủy tĩnh trong tình trạng quá tải tuần hoàn liên quan đến truyền máu (được mô tả tiếp theo), có thể xuất hiện trong cùng khung thời gian sau khi bắt đầu truyền máu và thậm chí có thể kèm theo sốt (45). Bằng chứng về tình trạng viêm toàn thân (protein C phản ứng tăng cao) sẽ hỗ trợ chẩn đoán TRALI, cùng với việc không có suy tim hoặc quá tải dịch (45).
Quản lý điều trị
• Nếu không hoàn thành việc truyền máu, cần dừng truyền máu ngay khi có những dấu hiệu đầu tiên của khó thở. Cần thông báo cho ngân hàng máu về tất cả các trường hợp nghi ngờ TRALI. (Có các xét nghiệm kháng thể kháng bạch cầu, nhưng không được sử dụng thường xuyên).
• Việc quản lý TRALI mang tính hỗ trợ và tương tự như việc quản lý ARDS được mô tả trong Chương 24.
• Không có khuyến nghị chắc chắn nào về việc truyền máu trong tương lai ở những bệnh nhân phát triển TRALI. Một số khuyến nghị sử dụng RBC đã rửa để loại bỏ kháng thể khỏi máu của người cho , nhưng hiệu quả của biện pháp này vẫn chưa được biết.
Phù phổi do tăng áp lực thủy tĩnh
Biến chứng phổi phổ biến nhất của truyền hồng cầu là tình trạng quá tải tuần hoàn liên quan đến truyền máu (TACO), có tỷ lệ mắc bệnh được báo cáo là 1% (45,46). Dấu hiệu đặc trưng của tình trạng này là phù phổi thủy tĩnh cấp tính xuất hiện trong 6 giờ đầu sau khi bắt đầu truyền máu. Suy hô hấp thiếu oxy cấp tính do đó thường đòi hỏi phải thở máy và tỷ lệ tử vong được báo cáo là 20% (46).
Nguyên nhân
Không có mối tương quan giữa số lượng đơn vị truyền máu và sự xuất hiện của TACO (46), nhưng tình trạng này xuất hiện thường xuyên hơn ở những bệnh nhân bị suy tim và suy thận từ trước, những người dễ bị quá tải dịch (45,46). Cũng có thể các yếu tố khác ngoài thể tích truyền dịch có tác dụng trong tình trạng này.
Biểu hiện lâm sàng
Biểu hiện lâm sàng có thể không phân biệt được với TRALI, với sự khởi phát cấp tính của suy hô hấp thiếu oxy trong 6 giờ đầu sau khi bắt đầu truyền máu và chụp X-quang ngực cho thấy phù phổi. Bệnh nhân sốt ở 30% trường hợp (45) và cần thở máy ở ba phần tư số bệnh nhân (46). Các tình trạng có lợi cho chẩn đoán TACO bao gồm suy tim từ trước, bằng chứng quá tải dịch hoặc suy thận tiềm ẩn.
Quản lý điều trị
• Cần dừng truyền máu nếu không hoàn thành và cần thông báo cho ngân hàng máu.
• Thuốc lợi tiểu quai tĩnh mạch là phù hợp. Nếu không, cần chăm sóc hỗ trợ (ví dụ, thở máy nếu cần), tương tự như cách quản lý TRALI.
• Không có khuyến cáo nào liên quan đến việc truyền máu trong tương lai, mặc dù nên xác định và điều chỉnh cân bằng dịch dương (bằng thuốc lợi tiểu) trước khi truyền máu.
Các nhiễm khuẩn bệnh viện
Tác dụng ức chế miễn dịch của truyền máu trở nên rõ ràng với phát hiện (vào đầu những năm 1970) rằng truyền máu trước khi ghép giúp cải thiện tỷ lệ sống sót của ghép thận (47). Kể từ đó, vô số nghiên cứu lâm sàng đã chỉ ra rằng những bệnh nhân được truyền máu có tỷ lệ nhiễm trùng bệnh viện cao hơn (42,48,49). Nguy cơ nhiễm trùng tăng theo thể tích máu được truyền và thời gian lưu trữ máu của người cho (49). Có khả năng những bệnh nhân được truyền máu sẽ bệnh nặng hơn và do đó dễ bị nhiễm trùng hơn, nhưng ít nhất 22 nghiên cứu đã chỉ ra rằng truyền máu là một yếu tố nguy cơ độc lập đối với nhiễm trùng bệnh viện (49).
Tệ hơn nữa – Thiếu máu hay truyền hồng cầu?
Một đánh giá về 45 nghiên cứu lâm sàng liên quan đến truyền RBC để điều trị tình trạng thiếu máu ở những bệnh nhân nguy kịch, bao gồm 272.596 bệnh nhân, đã tiết lộ những điều sau (50):
• Trong 42 trong số 45 nghiên cứu, rủi ro của truyền RBC lớn hơn lợi ích và chỉ có một nghiên cứu cho thấy lợi ích của truyền RBC lớn hơn rủi ro.
• Mười tám nghiên cứu đã đánh giá tác động của truyền RBC đối với khả năng sống sót và 17 trong số 18 nghiên cứu cho thấy truyền RBC là một yếu tố rủi ro độc lập dẫn đến tử vong. Không một báo cáo tốt về việc sử dụng truyền RBC để tăng nồng độ hemoglobin. Liệu lợi tiểu có tác dụng tương tự không?
LỜI KẾT
Thể tích máu so với tế bào máu
Thực hành tăng nồng độ hemoglobin ở những bệnh nhân bệnh nặng bắt nguồn từ niềm tin rằng thiếu máu là mối đe dọa đáng kể đối với quá trình oxy hóa mô. Tuy nhiên, có vẻ như ngay cả khi giảm hemoglobin hoặc hematocrit cực độ cũng không làm suy yếu quá trình oxy hóa mô khi thể tích nội mạch được duy trì (cho phép cung lượng tim tăng lên để đáp ứng với tình trạng thiếu máu). Thể tích máu có thể vượt trội hơn hemoglobin và hematocrit trong việc hỗ trợ oxy hóa mô, vì giảm thể tích máu là nguyên nhân gây sốc được công nhận (tình trạng oxy hóa mô bị suy yếu), nhưng thiếu máu thì không.
Tầm quan trọng của thể tích máu thường bị bỏ qua trong các cuộc thảo luận về tình trạng thiếu máu và truyền hồng cầu, ngay cả Hội Chữ thập đỏ Hoa Kỳ, với khẩu hiệu phổ biến là máu cứu sống, xứng đáng được nâng cấp chính xác hơn, như thể hiện trong Hình 12.6.

Tài liệu tham khảo
1. Rygård SL, Holst LB, Perner A. Blood product administration in the critical care and perioperative settings. Crit Care Clin 2018; 34:299–311.
2. Corwin HL, Gettinger A, Pearl R, et al. The CRIT study: anemia and blood transfusion in the critically ill–Current clinical practice in the United States. Crit Care Med 2004; 32:39–52.
3. Shander A, Javidroozi M, Ozawa S, Hare GMT. What is really dangerous: anemia or
transfusion. Br J Anaesth 2011; 51:141–159. Anemia in the ICU
4. Rawal G, Kumar R, Yadav S, Singh A. Anemia in intensive care: A review of current concepts. J Crit Care Med 2016; 2:109–114.
5. Jacob G, Raj SR, Ketch T, et al. Postural pseudoanemia: posture-dependent change in
hematocrit. Mayo Clin Proc 2005; 80:611–614.
6. Stamler K. Effect of crystalloid infusion on hematocrit in nonbleeding patients, with
applications in clinical traumatology. Ann Emerg Med 1989; 18:747–749.
7. Jones JG, Holland BM, Wardrop CAJ. Total circulating red cells versus hematocrit as a primary descriptor of oxygen transport by the blood. Br J Hematol 1990; 76:228–232.
8. Cordts PR, LaMorte WW, Fisher JB, et al. Poor predictive value of hematocrit and
hemodynamic parameters for erythrocyte deficits after extensive elective vascular operations. Surg Gynecol Obstet 1992; 175:243–248.
9. Lasocki S, Longrois D, Montravers P, Beaumont C. Hepcidin and anemia of the critically ill
patient: bench to bedside. Anesthesiology. 2011; 114:688–94.
10. Smoller BR, Kruskall MS. Phlebotomy for diagnostic laboratory tests in adults: Pattern of use and effect on transfusion requirements. N Engl J Med 1986; 314:1233–1235.
11. Silver MJ, Li Y-H, Gragg LA, et al. Reduction of blood loss from diagnostic sampling in
critically ill patients using a bloodconserving arterial line system. Chest 1993; 104:1711–1715.
12. Merrill EW. Rheology of blood. Physiol Rev 1969; 49:863–888.
13. Vogel S. Life in Moving Fluids. Princeton, NJ: Princeton University Press, 1981: 11–24.
14.Chien S, Usami S, Skalak R. Blood flow in small tubes. In: Renkin EM, Michel CC (eds).
Handbook of Physiology. Section 2: The cardiovascular system. Volume IV. The
microcirculation. Bethesda, MD: American Physiological Society, 1984; 217–249.
15. LeVeen HH, Ahmed N, Mascardo T, et al. Lowering blood viscosity to overcome vascular
resistance. Surg Gynecol Obstet 1980; 150:139–149.
16. Wilkerson DK, Rosen AL, Gould SA, et al. Oxygen extraction ratio: a valid indicator of
myocardial metabolism in anemia. J Surg Res 1987; 42:629–634.
17. Levine E, Rosen A, Sehgal L, et al. Physiologic effects of acute anemia: implications for a reduced transfusion trigger. Transfusion 1990; 30:11–14.
18. Nielsen VG, Baird MS, Brix A, Matalon S. Extreme, progressive isovolemic hemodilution with 5% albumin, PentaLyte, or hextend does not cause hepatic ischemia or histologic injury in rabbits. Anesthesiology 1999; 90:1428–1435.
19. Carson JL, Noveck H, Berlin J, Gould SA. Mortality and morbidity in patients with very low postoperative Hb levels who decline blood transfusion. Transfusion 2002; 42:812–818.
20. Weiskopf RB, Viele M, Feiner J, et al. Human cardiovascular and metabolic response to acute, severe, isovolemic anemia. JAMA 1998; 279:217–221. The Transfusion Trigger
21. Adam RC, Lundy JS. Anesthesia in cases of poor risk: Some suggestions for decreasing the risk. Surg Gynecol Obstet 1942; 74:1011–1101.
22. Hebert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999; 340:409–417.
23. Holst LB, Haase H, Wetterslev J, et al. Lower versus higher hemoglobin threshold for
transfusion in septic shock. N Engl J Med 2014; 371:1381–1391.
24. Carson JL, Stanworth SJ, Dennis JA, et al. Transfusion thresholds for guiding red blood cell transfusion. Cochrane Database Syst Rev 2021; 12: CD002042
25. Franchini M, Marano G, Mengoli C, et al. Red blood cell transfusion policy: a critical literature review. Blood Transfus 2017; 15:307–317.
26. Soril LJJ, Noseworthy TW, Stelfox HT, et al. A retrospective observational analysis of red blood cell transfusion practices in stable, non-bleeding adult patients admitted to medical-surgical intensive care units. J Intensive Care 2019; 7:19.
27. Napolitano LM, Kurek S, Luchette FA, et al. Clinical practice guideline: Red blood cell
transfusion in adult trauma and critical care. Crit Care Med 2009; 37:3124–3157.
28. Levy PS, Chavez RP, Crystal GJ, et al. Oxygen extraction ratio: a valid indicator of transfusion need in limited coronary vascular reserve? J Trauma 1992; 32:769–774.
29. Vallet B, Robin E, Lebuffe G. Venous oxygen saturation as a physiologic transfusion trigger. Crit Care 2010; 14:213–217. Red Blood Cell Transfusions
30. King KE (ed). Blood Transfusion Therapy: A Physician’s Handbook. 9th ed. Bethesda, MD: American Association of Blood Banks, 2008; 1–18, 91–95.
31. de la Roche MRP, Gauthier L. Rapid transfusion of packed red blood cells: effects of dilution, pressure, and catheter size. Ann Emerg Med 1993; 22:1551–1555.
32. Conrad SA, Dietrich KA, Hebert CA, Romero MD. Effects of red cell transfusion on oxygen consumption following fluid resuscitation in septic shock. Circ Shock 1990; 31:419–429.
33. Dietrich KA, Conrad SA, Hebert CA, et al. Cardiovascular and metabolic response to red blood cell transfusion in critically ill volume-resuscitated nonsurgical patients. Crit Care Med 1990; 18:940–944.
34. Marik PE, Sibbald W. Effect of stored blood transfusion on oxygen delivery in patients with sepsis. JAMA 1993; 269:3024– 3029.
35. Fuller BM, Gajera M, Schorr C, et al. Transfusion of packed red blood cells is not associated with improved central venous oxygen saturation or organ function in patients with septic shock. J Emerg Med 2012; 43:593–598.
36. Kiraly LN, Underwood S, Differding JA, Schreiber MA. Transfusion of aged packed red blood cells results in decreased tissue oxygenation in critically ill trauma patients. J Trauma 2009; 67:29–32. Transfusion Risks
37. Carson JL, Guyatt G, Heddle NM, et al. Clinical practice guidelines from the AABB. Red blood cell transfusion thresholds and storage. JAMA 2016; 316:2025–2035.
38. Carson JL, Triulzi DJ, Ness PM. Indications for and adverse effects of red-cell transfusions. N Engl J Med 2017; 377:1261–1272.
39. Kuriyan M, Carson JL. Blood transfusion risks in the intensive care unit. Crit Care Clin 2004; 237–253.
40. King KE (ed). Acute transfusion reactions. In: Blood Transfusion Therapy: A Physician’s
Handbook, 9th ed. Bethesda, MD: American Association of Blood Banks, 2008; 148–173.
41. Greenberger PA. Plasma anaphylaxis and immediate-type reactions. In: Rossi EC, Simon TL, Moss GS (eds). Principles of transfusion medicine. Philadelphia: Williams & Wilkins, 1991; 635–639.
42. Rohde JM, Dimcheff DE, Blumberg N, et al. Health Care-associated infection after red blood cell transfusion. A systematic review and meta-analysis. JAMA 2014; 311:1317–1326.
43. Panch SR, Montemayor-Garcia C, Klein HG. Hemolytic transfusion reactions. N Engl J Med 2019; 381:150–162.
44. Goodnough LT. Risks of blood transfusion. Crit Care Med 2003; 31:S678–S686.
45. Semple JW, Rebetz J, Kapur R. Transfusion-associated circulatory overload and transfusionrelated acute lung injury. Blood 2019; 133:1840–1852.
46. Roubinian NH, Hendrickson JE, Triulzi DJ, et al. Contemporary risk factors and outcomes of transfusion-associated circulatory overload. Crit Care Med 2018; 46:577–585.
47. Vamvakas EC, Blajchman MA. Transfusion-related immunomodulation (TRIM): an update. Blood Rev 2007; 21:327–348.
48. Taylor RW, O’Brien J, Trottier SJ, et al. Red blood cell transfusions and nosocomial infections in critically ill patients. Crit Care Med 2006; 34:2302–2308.
49. Juffermans NP, Prins DJ, Viaar AP, et al. Transfusion-related risk of secondary bacterial
infections in sepsis patients: a retrospective cohort study. Shock 2011; 35:355–359.
50. Marik PE, Corwin HL. Efficacy of red blood cell transfusion in the critically ill: A systematic review of the literature. Crit Care Med 2008; 36:2667–2674.
TẢI FILE PDF TÀI LIỆU TẠI ĐÂY.































