| BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập – Tự do – Hạnh phúc |
| Số: 488/QĐ-QLD |
Hà Nội, ngày 09 tháng 11 năm 2017 |
QUYẾT ĐỊNH
về việc ban hành danh mục 01 vắc xin được cấp số đăng ký lưu hành tại
Việt Nam – Đợt 34 bổ sung (Số đăng ký có hiệu lực 05 năm)
CỤC TRƯỞNG CỤC QUẢN LÝ DƯỢC
Căn cứ Luật Dược ngày 06 tháng 4 năm 2016;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Căn cứ Quyết định số 3861/2013/QĐ-BYT ngày 30/9/2013 của Bộ trưởng Bộ Y tế quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý Dược thuộc Bộ Y tế;
Căn cứ Thông tư số 44/2014/TT-BYT ngày 25/11/2014 của Bộ trưởng Bộ Y tế quy định việc đăng ký thuốc;
Căn cứ ý kiến của Hội đồng tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc;
Xét đề nghị của Trưởng phòng Đăng ký thuốc – Cục Quản lý Dược,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này danh mục 01 vắc xin được cấp số đăng ký lưu hành tại Việt Nam – Đợt 34 bổ sung.
Điều 2. Cơ sở đăng ký và sản xuất có vắc xin được phép lưu hành tại Việt Nam qui định tại Điều 1 phải in số đăng ký được Bộ Y tế Việt Nam cấp lên nhãn và phải chấp hành đúng các quy định của pháp luật Việt Nam về sản xuất và kinh doanh thuốc, số đăng ký có ký hiệu QLVX-…-17 có giá trị 05 năm kể từ ngày cấp.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký ban hành.
Điều 4. Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương và Giám đốc cơ sở đăng ký và sản xuất có vắc xin nêu tại Điều 1 chịu trách nhiệm thi hành quyết định này./.
DANH MỤC:
- Cơ sở đăng ký: Sanofi Pasteur S.A. (Địa chỉ: 2 Avenue Pont Pasteur, 69007 Lyon, France)
1.1. Cơ sở sản xuất: Sanofi Pasteur S.A. (Địa chỉ: Parc Industriel d’Incarville 27100 Val de Reuil – France)
| STT | Tên thuốc | Hoạt chất chính – Hàm lượng | Dạng bào chế | Tuổi thọ | Tiêu chuẩn | Quy cách đóng gói | Số đăng ký |
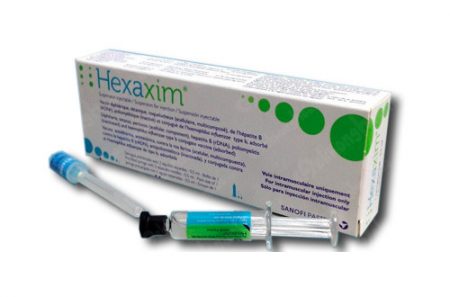
| 1. | Hexaxim | Mỗi liều 0,5ml chứa:
* Giải độc tố bạch hầu: không dưới 20IU; * Giải độc tố uốn ván: không dưới 40 IU; * Kháng nguyên Bordetella pertussis: Giải độc tố ho gà (PT): 25mcg, Ngưng kết tố hồng cầu dạng sợi (FHA): 25mcg; * Virus bại liệt (bất hoạt): – Týp 1 (Mahoney): 40 đơn vị Kháng nguyên D, – Týp 2 (MEF-1): 8 đơn vị Kháng nguyên D, – Týp 3 (Saukett): 32 đơn vị Kháng nguyên D, * Kháng nguyên bề mặt viêm gan B: lOmcg; * Polysaccharide của Haemophilus influenzae týp b (Polyribosylribitol Phosphate): 12mcg cộng hợp với protein uốn ván 22-36mcg |
Hỗn
dịch tiêm |
36 tháng kể từ ngày sản xuất bán thành phẩm cuối | NSX | Hộp 1 bơm tiêm nạp sẵn 1 liều (0,5ml) và 02 kim tiêm; hộp 10 bơm tiêm nạp sẵn 1 liều (0,5ml) và 20 kim tiêm; hộp 10 lọ, lọ 1 liều (0,5ml) | QLVX-1076-17 |
Quyết định 488/QĐ-QLD ban hành danh mục 01 vắc xin được đăng ký lưu hành tại Việt Nam – Đợt 34 bổ sung
DOWNLOAD VĂN BẢN DƯỚI ĐÂY
COPY VUI LÒNG GHI NGUỒN VNRAS.COM

































