Văn bản pháp chế Dược Việt Nam cập nhật tháng 8 năm 2021 (Vietnam Pharmacy Regulation update August 2021)
Phiên bản update liên tục, hệ thống toàn bộ các văn bản liên quan đến công tác đăng ký, hỗ trợ các bạn làm RA tra cứu thuận tiện hơn. Mọi góp ý, sửa đổi vui lòng gửi email cho Quản trị VNRAS (vnras.com@gmail.com)
VNRAS will update pharmacy law regulations every month supporting RA Members. Please send your input to vnras.com@gmail.
Guideline for searching on excel file will be updated in https://vnras.com/contact/
| No. | Regulation type | Regulation No. | Regulation name (EN) | Regulation name (VN) |
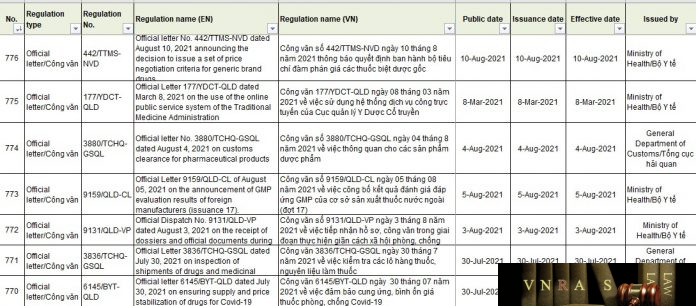
| 776 | Official letter/Công văn | 442/TTMS-NVD | Official letter No. 442/TTMS-NVD dated August 10, 2021 announcing the decision to issue a set of price negotiation criteria for generic brand drugs | Công văn số 442/TTMS-NVD ngày 10 tháng 8 năm 2021 thông báo quyết định ban hành bộ tiêu chí đàm phán giá các thuốc biệt dược gốc |
| 775 | Official letter/Công văn | 177/YDCT-QLD | Official Letter 177/YDCT-QLD dated March 8, 2021 on the use of the online public service system of the Traditional Medicine Administration | Công văn 177/YDCT-QLD ngày 08 tháng 03 năm 2021 về việc sử dụng hệ thống dịch vụ công trực tuyến của Cục quản lý Y Dược Cổ truyền |
| 774 | Official letter/Công văn | 3880/TCHQ-GSQL | Official letter No. 3880/TCHQ-GSQL dated August 4, 2021 on customs clearance for pharmaceutical products | Công văn số 3880/TCHQ-GSQL ngày 04 tháng 8 năm 2021 về việc thông quan cho các sản phẩm dược phẩm |
| 773 | Official letter/Công văn | 9159/QLD-CL | Official Letter 9159/QLD-CL of August 05, 2021 on the announcement of GMP evaluation results of foreign manufacturers (issuance 17). | Công văn số 9159/QLD-CL ngày 05 tháng 08 năm 2021 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất thuốc nước ngoài (đợt 17) |
| 772 | Official letter/Công văn | 9131/QLD-VP | Official Dispatch No. 9131/QLD-VP dated August 3, 2021 on the receipt of dossiers and official documents during the period of implementing social distancing to prevent and control the COVID-19 epidemic | Công văn số 9131/QLD-VP ngày 3 tháng 8 năm 2021 về việc tiếp nhận hồ sơ, công văn trong giai đoạn thực hiện giãn cách xã hội phòng, chống dịch COVID-19 |
| 771 | Official letter/Công văn | 3836/TCHQ-GSQL | Official Letter 3836/TCHQ-GSQL dated July 30, 2021 on inspection of shipments of drugs and medicinal ingredients | Công văn 3836/TCHQ-GSQL ngày 30 tháng 7 năm 2021 về việc kiểm tra các lô hàng thuốc, nguyên liệu làm thuốc |
| 770 | Official letter/Công văn | 6145/BYT-QLD | Official letter 6145/BYT-QLD dated July 30, 2021 on ensuring supply and price stabilization of drugs for Covid-19 prevention and control | Công văn 6145/BYT-QLD ngày 30 tháng 07 năm 2021 về việc đảm bảo cung ứng, bình ổn giá thuốc phòng, chống Covid-19 |
| 769 | Official letter/Công văn | 3794/TCHQ-GSQL | Official Letter 3794/TCHQ-GSQL dated July 29, 2021 on facilitating fast clearance of aid shipments for the prevention and control of covid-19 epidemic | Công văn 3794/TCHQ-GSQL ngày 29 tháng 7 năm 2021 về việc tạo điều kiện thông quan nhanh các lô hàng viện trợ phục vụ phòng, chống dịch covid-19 |
| 768 | Other documents/Văn bản khác | QT.ĐK.08.07 | Process of handling dossiers of change/addition of drugs and medicinal ingredients during circulation | Quy trình giải quyết hồ sơ thay đổi/bổ sung thuốc, nguyên liệu làm thuốc trong quá trình lưu hành |
| 767 | Official letter/Công văn | 8850/QLD-KD | Official letter 8850/QLD-DK dated July 26, 2021 to ensure supply and stabilize drug prices for the prevention and control of Covid-19. | Công văn 8850/QLD-KD ngày 26 tháng 07 năm 2021 về việc đảm bảo cung ứng, bình ổn giá thuốc phòng, chống Covid -19 |
| 764 | Official letter/Công văn | 5787/BYT-TB-CT | Official letter 5787/BYT-TB-CT dated July 20, 2021 on the list of biologicals/in-vitro diagnostic medical devices for testing SARS-CoV-2 issued with registration numbers, import licenses and supply capacity and selling prices quoted by suppliers (5th update) | Công văn 5787/BYT-TB-CT ngày 20 tháng 7 năm 2021 về danh sách các sinh phẩm/trang thiết bị y tế chẩn đoán in vitro xét nghiệm SARS-CoV-2 đã được cấp số đăng ký, GPNK kèm thông tin hiệu năng và khả năng cung ứng và giá bán do đơn vị cung ứng công bố (cập nhật lần 5) |
| 763 | Decision/Quyết định | 3518/QĐ-BYT | Decision 3518/QĐ-BYT dated July 07, 2021 on safety criteria of Covid-19 immunization facilities | Quyết định 3518/QĐ-BYT ngày 20 tháng 07 năm 2021 về Tiêu chí cơ sở an toàn tiêm chủng vắc-xin phòng COVID-19 do Bộ trưởng Bộ Y tế ban hành |
| 762 | Official letter/Công văn | 3639/TCHQ-GSQL | Official Letter 3639/TCHQ-GSQL dated July 19, 2021 on physical inspection of imported goods with special preservation conditions issued by the General Department of Customs | Công văn 3639/TCHQ-GSQL ngày 19 tháng 7 năm 2021 về kiểm tra thực tế đối với hàng hóa nhập khẩu có điều kiện bảo quản đặc biệt do Tổng cục Hải quan ban hành |
| 761 | Official letter/Công văn | 8419/QLD-KD | Official Letter 8419/QLD-KD July 17, 2021 on ensuring the supply of drugs to prevent Covid-19 | Công văn 8419/QLD-KD 17 tháng 07 năm 2021 về đảm bảo cung ứng thuốc phòng chống dịch Covid-19 |
| 760 | Decision/Quyết định | 3485/QD-BYT | Decision 3485/QD-BYT dated July 16, 2021 on the list of circulation numbers of non in vitro diagnostic medical equipment issued in Vietnam (Issuance 14/2021) issued by the Minister of Health | Quyết định 3485/QĐ-BYT ngày 16 tháng 7 năm 2021 về danh mục số lưu hành trang thiết bị y tế không phải là trang thiết bị y tế chẩn đoán in vitro được cấp tại Việt Nam (Đợt 14/2021) do Bộ trưởng Bộ Y tế ban hành |
| 759 | Decision/Quyết định | 3484/QD-BYT | Decision 3484/QD-BYT dated July 16, 2021 on the list of circulation numbers of in vitro diagnostic medical equipment issued in Vietnam (Issuance 13/2021) issued by the Minister of Health | Quyết định 3484/QĐ-BYT ngày 16 tháng 7 năm 2021 về danh mục số lưu hành trang thiết bị y tế chẩn đoán in vitro được cấp tại Việt Nam (Đợt 13/2021) do Bộ trưởng Bộ Y tế ban hành |
| 758 | Decision/Quyết định | 3448/QD-BYT | Decision 3448/QD-BYT dated July 15, 2021, on conditional approval of vaccines for urgent needs in the prevention and control of the COVID-19 epidemic, issued by the Minister of Health | Quyết định 3448/QĐ-BYT ngày 15 tháng 7 năm 2021 phê duyệt có điều kiện vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh COVID-19 do Bộ trưởng Bộ Y tế ban hành |
| 757 | Decision/Quyết định | 3416/QD-BYT | Decision 3416/QD-BYT dated July 14, 2021 on Guidelines for the diagnosis and treatment of COVID-19 caused by a new strain of Corona virus (SARS-CoV-2) issued by the Minister of Health | Quyết định 3416/QĐ-BYT ngày 14 tháng 7 năm 2021 về Hướng dẫn chẩn đoán và điều trị COVID-19 do chủng vi rút Corona mới (SARS-CoV-2) do Bộ trưởng Bộ Y tế ban hành |
| 756 | Decision/Quyết định | 3410/QD-BYT | Decision 3410/QD-BYT dated July 13, 2021 on the list of 02 medical equipment for in vitro diagnostics for SARS-CoV-2 testing with registration numbers issued by the Minister of Health | Quyết định 3410/QĐ-BYT ngày 13 tháng 7 năm 2021 về danh mục 02 trang thiết bị y tế chẩn đoán in vitro xét nghiệm SARS-CoV-2 được cấp số đăng ký do Bộ trưởng Bộ Y tế ban hành |
| 755 | Other documents/Văn bản khác | Updated to 7/13/21 by DAV 1. List of domestic establishments meeting GLP standards. 2. List of domestic establishments meeting GMP standards | Cập nhật tới 13/7/21 bởi DAV 1. Danh sách các cơ sở trong nước đạt tiêu chuẩn nguyên tắc GLP. 2. Danh sách các cơ sở trong nước đạt tiêu chuẩn nguyên tắc GMP | |
| 753 | Official letter/Công văn | 5583/BYT-TB-CT | Official Letter 5583/BYT-TB-CT dated July 13, 2021 on the list of biologicals/in-vitro diagnostic medical devices for testing SARS-CoV-2 issued with registration numbers, import licenses and supply capacity and selling prices quoted by suppliers (4th update) issued by the Ministry of Health | Công văn 5583/BYT-TB-CT ngày 13 tháng 7 năm 2021 về danh sách sinh phẩm/trang thiết bị y tế chẩn đoán in vitro xét nghiệm SARS-CoV-2 đã được cấp số đăng ký, giấy phép nhập khẩu kèm thông tin hiệu năng và khả năng cung ứng và giá bán do đơn vị cung ứng công bố (cập nhật lần 4) do Bộ Y tế ban hành |
| 752 | Decision/Quyết định | 3398/QD-BYT | Decision 3398/QD-BYT dated July 12, 2021 on the allocation of 746,460 doses of COVID-19 vaccine BNT162b2 (Comirnaty) provided in July 2021, stage 8 issued by the Minister of Health | Quyết định 3398/QĐ-BYT ngày 12 tháng 7 năm 2021 về phân bổ 746.460 liều vắc xin phòng COVID-19 BNT162b2 (Comirnaty) được cung ứng trong tháng 07/2021 đợt 8 do Bộ trưởng Bộ Y tế ban hành |
| 751 | Resolution/Nghị Quyết | 73/NQ-CP | Resolution 73/NQ-CP in 2021 on the purchase of Sputnik V vaccine from the Russia issued by the Government | Nghị quyết 73/NQ-CP năm 2021 về mua vắc xin Sputnik V của Liên bang Nga do Chính phủ ban hành |
| 750 | Official letter/Công văn | 8026/QLD-ĐK | Official letter 8026/QLD-DK dated July 10, 2021 to ensure supply and stabilize drug prices for the prevention and control of Covid-19. | Công văn 8026/QLD-ĐK ngày 10 tháng 07 năm 2021 đảm bảo cung ứng, bình ổn giá thuốc phòng, chống Covid -19 |
| 749 | Official letter/Công văn | 8025/QLD-ĐK | Official Letter 8025/QLD-ĐK dated July 9, 2021 on supplementing dossiers of validity extension of circulation registration certificate of drugs and medicinal ingredients | Công văn 8025/QLD-ĐK ngày 09 tháng 07 năm 2021 về việc bổ sung hồ sơ gia hạn hiệu lực giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 748 | Decision/Quyết định | 3348/QD-BYT | Decision 3348/QD-BYT dated July 8, 2021 guiding the diagnosis and treatment of myocarditis after vaccination against COVID-19 issued by the Minister of Health | Quyết định 3348/QĐ-BYT ngày 08 tháng 07 năm 2021 hướng dẫn chẩn đoán và điều trị viêm cơ tim sau tiêm chủng vắc xin phòng COVID-19 do Bộ trưởng Bộ Y tế ban hành |
| 746 | Other documents/Văn bản khác | July update 1. List of Reference Authorities 2. List of drug regulatory agencies of countries on the SRA list. 3. List of drug regulatory agencies of countries that are PIC/s and ICH member countries | Cập nhật tháng 7_ban hành bởi DAV 1. Danh sách cơ quan quản lý tham chiếu 2. Danh sách cơ quan quản lý dược các nước thuộc danh sách SRA 3. Danh sách cơ quan quản lý dược các nước là thành viên PIC/s và ICH | |
| 745 | Other documents/Văn bản khác | Update ANNEX III – List of substances which cosmetic products must not contain except subject to restrictions and conditions laid down | Cập nhật phụ lục III – Danh mục các chất mà sản phẩm mỹ phẩm không được chứa ngoại trừ các giới hạn và điều kiện cho phép | |
| 744 | Official letter/Công văn | 5288/BYT-TB-CT | Official letter 5288/BYT-TB-CT dated July 02, 2021 on the list of biologicals/in-vitro diagnostic medical devices for testing SARS-CoV-2 issued with registration numbers, import licenses and supply capacity and selling prices quoted by suppliers (3th update) | Công văn 5288/BYT-TB-CT ngày 02 tháng 7 năm 2021 về danh sách các sinh phẩm/trang thiết bị y tế chẩn đoán in vitro xét nghiệm vi rút SARS-CoV-2 đã được cấp số đăng ký, cấp giấy phép nhập khẩu và khả năng cung ứng và giá bán do đơn vị cung ứng công bố (cập nhật lần 3) |
| 743 | Other documents/Văn bản khác | QT.ĐK.16.04 | SOP of processing application for extension of circulation of drugs and medicinal ingredients | Quy trình giải quyết hồ sơ đăng ký gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 742 | Other documents/Văn bản khác | QT.ĐK.11.06 | SOP of processing application for registration of circulation of drugs and medicinal ingredients | Quy trình giải quyết hồ sơ cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 741 | Circular/Thông tư | 10/2021/TT-BYT | Circular No. 10/2021/TT-BYT dated June 30, 2021 on prescribing Nomenclature List of agents prohibited from production and business of health protection food | Thông tư 10/2021/TT-BYT quy định về Danh mục chất cấm sử dụng trong sản xuất, kinh doanh thực phẩm bảo vệ sức khỏe do Bộ trưởng Bộ Y tế ban hành |
| 740 | Other documents/Văn bản khác | Q&A Conference to popularize Decree on organization and activities of clinical pharmacy | Bảng tổng hợp câu hỏi – trả lời tại Hội nghị phố biến Nghị định tổ chức, hoạt động dược lâm sàng | |
| 739 | Decision/Quyết định | 3122/QD-BYT | Decision 3122/QD-BYT dated June 28, 2021, on conditional approval of vaccines for urgent needs in COVID-19 disease prevention and control, issued by the Minister of Health | Quyết định 3122/QĐ-BYT ngày 28 tháng 06 năm 2021 phê duyệt có điều kiện vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh COVID-19 do Bộ trưởng Bộ Y tế ban hành |
| 738 | Circular/Thông tư | 08/2021/TT-BYT | Circular No. 08/2021/TT-BYT dated June 25, 2021 on issuance of Code of Pharmaceutical Ethics | Thông tư 08/2021/TT-BYT về Nguyên tắc đạo đức hành nghề dược do Bộ trưởng Bộ Y tế ban hành |
| 737 | Official letter/Công văn | 3211/TCHQ-GSQL | Official Letter No. 3211/TCHQ-GSQL dated June 24, 2021 on some problems in the implementation of the Pharmacy Law 2016 (Customs sent to the Ministry of Health) | Công văn số 3211/TCHQ-GSQL ngày 24 tháng 6 năm 2021 về việc một số vướng mắc trong quá trình thực hiện Luật Dược năm 2016 (Hải quan gửi Bộ Y tế) |
| 736 | Decision/Quyết định | 3020/QD-BYT | Decision 3020/QD-BYT dated June 23, 2021 on the distribution of 6th stage of COVID-19 vaccine issued by the Ministry of Health | Quyết định 3020/QĐ-BYT ngày 23 tháng 6 năm 2021 về phân bổ vắc xin phòng COVID-19 đợt 6 do Bộ Y tế ban hành |
| 735 | Decision/Quyết định | 374/QĐ-QLD | Decision No. 374/QD-QLD dated June 22, 2021 on the promulgation of the list of 01 foreign herbal drugs granted circulation registration in Vietnam – Issuance 105 | Quyết định số 374/QĐ-QLD ngày 22 tháng 6 năm 2021 về việc ban hành danh mục 01 thuốc dược liệu nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 105 |
| 734 | Other documents/Văn bản khác | LIST OF PHARMACEUTICAL MANAGEMENT AGENCIES OF COUNTRIES THAT IS MEMBERSHIP PIC/s AND ICH | DANH SÁCH CƠ QUAN QUẢN LÝ DƯỢC CÁC NƯỚC LÀ THÀNH VIÊN PIC/s VÀ ICH | |
| 732 | Decision/Quyết định | 974/QĐ-TTg | Decision 974/QD-TTg 2021 on applying the form of contractor selection in special cases according to the provisions of Article 26 of the Bidding Law for the bidding package “Purchase of COVID-19 vaccine AZD1222 produced by AstraZeneca of Vietnam Vaccine Joint Stock Company” issued by the Prime Minister | Quyết định 974/QĐ-TTg năm 2021 về áp dụng hình thức lựa chọn nhà thầu trong trường hợp đặc biệt theo quy định tại Điều 26 Luật Đấu thầu đối với gói thầu “Mua vắc xin phòng COVID-19 AZD1222 do AstraZeneca sản xuất của Công ty cổ phần vắc xin Việt Nam” do Thủ tướng Chính phủ ban hành |
| 730 | Resolution/Nghị Quyết | 61/NQ-CP | Resolution 61/NQ-CP in 2021 on the purchase of COVID-19 vaccine AZD1222 produced by AstraZeneca by Vietnam Vaccine Joint Stock Company issued by the Government | Nghị quyết 61/NQ-CP năm 2021 về mua vắc xin phòng COVID-19 AZD1222 do AstraZeneca sản xuất của Công ty cổ phần vắc xin Việt Nam do Chính phủ ban hành |
| 729 | Official letter/Công văn | 4882/BYT-TB-CT | Official Letter No. 4882/BYT-TB-CT dated June 18, 2021 on the study, preparation and application of ASEAN common technical documents | Công văn số 4882/BYT-TB-CT ngày 18 tháng 6 năm 2021 về việc nghiên cứu, chuẩn bị triển khai áp dụng hồ sơ kỹ thuật chung Asean |
| 728 | Decision/Quyết định | 371/QĐ-QLD | Decision 371/QD-QLD dated June 18, 2021 on promulgation of the List of 05 vaccines and biological products granted circulation registration in Vietnam – Issuance 41 | Quyết định 371/QĐ-QLD về việc ban hành Danh mục 05 vắc xin, sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 41 |
| 727 | Decision/Quyết định | 370/QĐ-QLD | Decision 370/QD-QLD dated June 18, 2021 on promulgation of the List of 14 vaccines and biological products with extended circulation registration certificates in Vietnam – Issuance 41 | Quyết định 370/QĐ-QLD về việc ban hành Danh mục 14 vắc xin, sinh phẩm được gia hạn giấy đăng ký lưu hành tại Việt Nam – Đợt 41 |
| 726 | Decision/Quyết định | 2974/QD-BYT | Decision 2974/QD-BYT dated June 17, 2021 on the list of 01 circulation number of medical equipment other than in-vitro diagnostic medical equipment issued in Vietnam issued by the Ministry of Health | Quyết định 2974/QĐ-BYT ngày 17 tháng 6 năm 2021 về danh mục 01 số lưu hành trang thiết bị y tế không phải là trang thiết bị y tế chẩn đoán in-vitro được cấp tại Việt Nam do Bộ Y tế ban hành |
| 725 | Official letter/Công văn | 4860/BYT-TB-CT | Official Letter No. 4860/BYT-TB-CT dated June 17, 2021 reporting on bidding, procurement and signing of contracts for purchase and sale of medical equipment and consumables. | Công văn số 4860/BYT-TB-CT ngày 17 tháng 06 năm 2021 về việc báo cáo việc đấu thầu, mua sắm và ký kết hợp đồng mua bán trang thiết bị, vật tư y tế. |
| 724 | Official letter/Công văn | 7096/QLD-ĐK | Official Letter No. 7096/QLD-DK dated June 17, 2021 on suspected adverse reactions related to Phenformin-containing pills of unknown origin | Công văn số 7096/QLD-ĐK ngày 17 tháng 6 năm 2021 về việc phản ứng có hại nghi ngờ liên quan đến viên hoàn chứa Phenformin không rõ nguồn gốc, xuất xứ |
| 723 | Decision/Quyết định | 2971/QD-BYT | Decision 2971/QD-BYT dated June 17 in 2021 on the distribution of the 5th stage of COVID-19 vaccine issued by the Ministry of Health | Quyết định 2971/QĐ-BYT ngày 17 tháng 6 năm 2021 về phân bổ vắc xin phòng COVID-19 đợt 5 do Bộ Y tế ban hành |
| 722 | Official letter/Công văn | 7075/QLD-CL | Official Letter 7075/QLD-CL of June 16, 2021 on the announcement of GMP evaluation results of foreign manufacturers (issuance 16). | Công văn số 7075/QLD-CL ngày 16 tháng 06 năm 2021 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất thuốc nước ngoài (đợt 16) |
| 721 | Official letter/Công văn | 7066/QKD-CL | Official letter No. 7066/QKD-CL dated June 16, 2021 on reporting capacity in preservation of Covid-19 vaccines (to the health departments of the provinces and cities directly under the central government) | Công văn 7066/QKD-CL ngày 16 tháng 06 năm 2021 về việc báo cáo năng lực bảo quản vắc xin Covid-19 (gửi sở y tế các tỉnh thành phố trực thuộc trung ương) |
| 720 | Decision/Quyết định | 2932/QD-BYT | Decision No. 2932/QD-BYT dated June 15, 2021 on correction to Circular No. 04/2021/TT-BYT guiding capitation payment of costs of covered healthcare services | Quyết định 2932/QĐ-BYT năm 2021 đính chính Thông tư 04/2021/TT-BYT hướng dẫn thanh toán chi phí khám bệnh, chữa bệnh bảo hiểm y tế theo định suất do Bộ Y tế ban hành |
| 719 | Official letter/Công văn | 7048/QLD-CL | Official letter No. 7048/QLD-CL dated June 16, 2021 on reporting capacity in preservation of Covid-19 vaccines (to enterprises, establishments manufacturing drugs and medicinal ingredients) | Công văn 7048/QLD-CL ngày 16 tháng 06 năm 2021 về việc báo cáo năng lực bảo quản vắc xin Covid-19 (gửi doanh nghiệp, cơ sở sản xuất thuốc, nguyên liệu làm thuốc) |
| 718 | Circular/Thông tư | 43/2021/TT-BTC | Circular No. 43/2021/TT-BTC dated June 11, 2021 on amendment to Clause 11 Article 10 of Circular No. 219/2013/TT-BTC guiding implementation of Law on Value-Added Tax and Decree No. 209/2013/ND-CP on elaborating to Law on Value-Added Tax (and amendment thereto under Circular No. 26/2015/TT-BTC) | Thông tư 43/2021/TT-BTC sửa đổi Khoản 11 Điều 10 Thông tư 219/2013/TT-BTC hướng dẫn Luật Thuế giá trị gia tăng và Nghị định 209/2013/NĐ-CP Luật Thuế giá trị gia tăng (đã được sửa đổi tại Thông tư 26/2015/TT-BTC) do Bộ Tài chính ban hành |
| 717 | Official letter/Công văn | 6634/QLD-KD | Official letter No. 6634/QLD-KD dated June 07, 2021 on reporting capacity in supply and storage of Covid-19 vaccines (2nd) | Công văn số 6634/QLD-KD ngày 07 tháng 6 năm 2021 về việc báo cáo năng lực trong cung ứng, bảo quản vắc xin phòng Covid-19 (lần 2) |
| 716 | Decision/Quyết định | 2789/QĐ-BYT | Decision 2789/QĐ-BYT dated June 05, 2021 on adjusting the distribution of Covid-19 vaccine – stage 3 | Quyết định 2789/QĐ-BYT ngày 05 tháng 6 năm 2021 về điều chỉnh phân bổ vắc xin phòng COVID-19 đợt 3 do Bộ Y tế ban hành |
| 715 | Decision/Quyết định | 2787/QĐ-BYT | Decision 2787/QD-BYT dated June 05, 2021 promulgating guidelines on plans for covid-19 prevention and control in case of covid-19 cases in business establishments and industrial parks | Quyết định 2787/QĐ-BYT ngày 05 tháng 6 năm 2021 về việc ban hành “hướng dẫn các phương án phòng, chống dịch khi có trường hợp mắc covid-19 tại cơ sở sản xuất, kinh doanh, khu công nghiệp” |
| 714 | Decision/Quyết định | 318/QĐ-QLD | Decision 318/QĐ-QLD dated June 04, 2021 on “Standard for data connection of information technology application software for connecting drug distribution establishments” | Quyết định 318/QĐ-QLD năm 2021 về “Chuẩn kết nối dữ liệu phần mềm ứng dụng công nghệ thông tin kết nối liên thông cơ sở phân phối thuốc” do Cục Quản lý dược ban hành. |
| 713 | Decision/Quyết định | 317/QĐ-QLD | Decision 317/QD-QLD dated June 03, 2021 announcing the List of drugs with proven bioequivalence issuance 26 issued by the Drug Administration of Vietnam | Quyết định 317/QĐ-QLD năm 2021 công bố Danh mục thuốc có chứng minh tương đương sinh học Đợt 26 do Cục Quản lý dược ban hành |
| 712 | Decision/Quyết định | 2748/QD-BYT | Decision 2748/QD-BYT dated June 03, 2021 on the distribution of Covid-19 vaccine – stage 4 | Quyết định 2748/QĐ-BYT ngày 03 tháng 06 năm 2021 về việc phân bổ vắc xin phòng Covid-19 đợt 4 |
| 711 | Other documents/Văn bản khác | List of establishments granted certificates of eligibility for pharmaceutical business with the scope of importing and providing vaccine preservation services (updated to June 2, 2021) | Danh sách các cơ sở được cấp giấy chứng nhận đủ điều kiện kinh doanh dược có phạm vi nhập khẩu, kinh doanh dịch vụ bảo quản vắc xin (cập nhật đến ngày 2/6/2021) | |
| 709 | Other documents/Văn bản khác | List of establishments granted certificates of eligibility for pharmaceutical business with the scope of importing and providing vaccine preservation services (updated to June 2, 2021) | Danh sách các cơ sở được cấp giấy chứng nhận đủ điều kiện kinh doanh dược có phạm vi nhập khẩu, kinh doanh dịch vụ bảo quản vắc xin (cập nhật đến ngày 2/6/2021) | |
| 708 | Decision/Quyết định | 2684/QD-BYT | Decision 2684/QD-BYT dated May 31, 2021 on adjusting the distribution of Covid-19 vaccine – stage 3 | Quyết định 2684/QĐ-BYT ngày 31 tháng 05 năm 2021 về việc điều chỉnh phân bổ vắc xin phòng Covid-19 đợt 3 |
| 707 | Official letter/Công văn | 4433/BYT-QLD | Official Letter 4433/BYT-QLD dated May 31, 2021 on increasing access to Covid-19 vaccines | Công văn 4433/BYT-QLD ngày 31 tháng 5 năm 2021 về việc tăng cường tiếp cận vắc xin phòng Covid-19 |
| 706 | Decision/Quyết định | 2626/QD-BYT | Decision No. 2626/QD-BYT dated May 28, 2021 on promulgating the List of needs for equipment, consumables and essential drugs of COVID-19 treatment areas | Quyết định số 2626/QĐ-BYT ngày 28 tháng 5 năm 2021 về việc ban hành Danh mục nhu cầu trang thiết bị, vật tư tiêu hao và thuốc thiết yếu của các Khu vực điều trị người bệnh COVID-19 |
| 705 | Official letter/Công văn | 4384/BYT-TB-CT | Official Letter No. 4384/BYT-TB-CT dated May 28, 2021 on the list of biological products/medical equipment for in-vitro diagnostic testing for Corona virus (SARS-CoV-2) has been granted registration number, granting import license (2nd update) | Công văn số 4384/BYT-TB-CT ngày 28 tháng 5 năm 2021 về việc danh sách các sinh phẩm/trang thiết bị y tế chẩn đoán in vitro xét nghiệm vi rút Corona (SARS-CoV-2) đã được cấp số đăng ký, cấp giấy phép nhập khẩu (cập nhật lần 2) |
| 704 | Official letter/Công văn | 5785/QLD-DK | Official Letter No. 5785/QLD-DK dated May 24, 2021 on providing information related to the safety of quinolone and fluoroquinolone antibiotics | Công văn số 5785/QLD-ĐK ngày 24 tháng 05 năm 2021 về việc cung cấp thông tin liên quan đến tính an toàn của kháng sinh nhóm quinolon, fluoroquinolon |
| 702 | Decision/Quyết định | 2499/QD-BYT | Decision 2499/QD-BYT dated May 20, 2021 on the distribution of Covid-19 vaccine – stage 3 | Quyết định 2499/QĐ-BYT ngày 20 tháng 05 năm 2021 về việc phân bổ vắc xin phòng Covid-19 đợt 3 |
| 701 | Official letter/Công văn | 5329/QLD-KD | Official letter No. 5329/QLD-KD dated May 13, 2021 on reporting capacity in supply and storage of Covid-19 vaccines | Công văn số 5329/QLD-KD ngày 13 tháng 5 năm 2021 về việc báo cáo năng lực trong cung ứng, bảo quản vắc xin phòng Covid-19 |
| 700 | Decision/Quyết định | 2369/QĐ-BYT | Decision No. 2369/QD-BYT dated May 12, 2021 on promulgating the list of circulation numbers of medical equipment non in-vitro diagnostic medical equipment issued in Vietnam (Issuance 05/2021) | Quyết định số 2369/QĐ-BYT ngày 12 tháng 5 năm 2021 về việc ban hành danh mục số lưu hành trang thiết bị y tế không phải là trang thiết bị y tế chẩn đoán in-vitro được cấp tại Việt Nam (đợt 05/2021) |
| 699 | Decision/Quyết định | 2426/QĐ-BYT | Decision 2426/QD-BYT dated May 15, 2021 promulgating instructions on how to prepare general technical documents on medical equipment according to ASEAN regulations | Quyết định 2426/QĐ-BYT ngày 15 tháng 5 năm 2021 về việc ban hành hướng dẫn cách chuẩn bị hồ sơ kỹ thuật chung về trang thiết bị y tế theo quy định Asean |
| 698 | Other documents/Văn bản khác | List of drug bioequivalence testing facilities (updated to May 7, 2021) | Danh sách cơ sở thử tương đương sinh học thuốc (cập nhật đến ngày 07/5/2021) | |
| 697 | Decision/Quyết định | 2263/QD-BYT | Decision 2263/QD-BYT dated May 7, 2021 promulgating the list of 01 in-vitro diagnostic medical equipment to determine RNA of SARS-COV-2 virus with a registration number. | Quyết định 2263/QĐ-BYT ngày 07 tháng 5 năm 2021 về việc ban hành danh mục 01 trang thiết bị y tế chẩn đoán in vitro xác định RNA của vi rút SARS-COV-2 được cấp số đăng ký |
| 696 | Decision/Quyết định | 2263/QD-BYT | Decision 2263/QD-BYT dated May 7, 2021 promulgating the list of 01 in-vitro diagnostic medical equipment to determine RNA of SARS-COV-2 virus with a registration number. | Quyết định 2263/QĐ-BYT ngày 07 tháng 5 năm 2021 về việc ban hành danh mục 01 trang thiết bị y tế chẩn đoán in vitro xác định RNA của vi rút SARS-COV-2 được cấp số đăng ký |
| 695 | Official letter/Công văn | 272/TTMS-NVD | Official Letter 272/TTMS-NVD dated May 6, 2021 regarding the information on original brand-name drugs to organize the first price negotiation | Công văn 272/TTMS-NVD ngày 06 tháng 05 năm 2021 về việc thông tin các thuốc biệt dược gốc tổ chức đàm phán giá đợt 1 |
| 692 | Official letter/Công văn | 4679/QLD-CL | Official Letter 4679/QLD-CL of April 29, 2021 on the announcement of GMP evaluation results of foreign manufacturers (issuance 15). | Công văn số 4679/QLD-CL ngày 29 tháng 04 năm 2021 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất thuốc nước ngoài (đợt 15) |
| 691 | Circular/Thông tư | 04/2021/TT-BYT | Circular 04/2021/TT-BYT dated April 29, 2021 payment instructions capitation costs of medical examination and treatment covered by health insurance | Thông tư 04/2021/TT-BYT ngày 29 tháng 04 năm 2021 hướng dẫn thanh toán chi phí khám bệnh, chữa bệnh bảo hiểm y tế theo định suất |
| 689 | Decision/Quyết định | 1966/QĐ-BYT | Decision No. 1966/QD-BYT dated April 22, 2021 on promulgating guidelines for diagnosis and treatment of thrombocytopenia syndrome and thrombosis after covid-19 vaccination | Quyết định số 1966/QĐ-BYT ngày 22 tháng 4 năm 2021 về việc ban hành hướng dẫn chẩn đoán và điều trị hội chứng giảm tiểu cầu, huyết khối sau tiêm vắc xin covid-19 |
| 688 | Decision/Quyết định | 226/QĐ-QLD | Decision 226/QĐ-QLD dated April 20, 2021 promulgating the list of 112 imprted drugs granted circulation registration in Vietnam – Added issuance 105 | Quyết định 226/QĐ-QLD ngày 20 tháng 04 năm 2021 về việc ban hành danh mục 112 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại việt nam – đợt 105 bổ sung |
| 687 | Decision/Quyết định | 1907/QĐ-BYT | Decision 1907/QD-BYT dated April 19, 2021 on the publication of new administrative procedures issued/amended and supplemented in the field of cosmetics under the management functions of the Ministry of Health. | Quyết định 1907/QĐ-BYT ngày 19 tháng 04 năm 2021 về việc công bố thủ tục hành chính mới ban hành/sửa đổi, bổ sung trong lĩnh vực mỹ phẩm thuộc phạm vi chức năng quản lý của bộ y tế |
| 686 | Decision/Quyết định | 1908/QD-BYT | Decision 1908/QD-BYT dated April 19, 2021 on adjusting the distribution of Covid-19 vaccine – stage 2 | Quyết định 1908/QĐ-BYT ngày 19 tháng 04 năm 2021 về việc điều chỉnh phân bổ vắc xin phòng Covid-19 đợt 2 |
| 685 | Decision/Quyết định | 1896/QD-BYT | Decision 1896/QD-BYT dated April 16, 2021 on adjusting the distribution of Covid-19 vaccine – stage 2 | Quyết định 1896/QĐ-BYT ngày 16 tháng 04 năm 2021 về việc điều chỉnh phân bổ vắc xin phòng Covid-19 đợt 2 |
| 684 | Decision/Quyết định | 1821/QD-BYT | Decision 1821/QD-BYT dated April 7, 2021 on the distribution of Covid-19 vaccine – stage 2 | Quyết định 1821/QĐ-BYT ngày 07 tháng 04 năm 2021 về việc phân bổ vắc xin phòng Covid-19 đợt 2 |
| 683 | Official letter/Công văn | 2794/QLD-ĐK | Official letter No. 2794/QLD-DK dated 1 April 2021 on the online publication of medicinal ingredients such as excipients and capsule shells (To General Department of Customs – Ministry of Finance) | Công văn số 2794/QLD-ĐK ngày 1 tháng 4 năm 2021 về việc công bố nguyên liệu làm thuốc là tá dược, vỏ nang trên hệ thống trực tuyến (gửi Tổng cục hải quan – Bộ tài chính) |
| 682 | Official letter/Công văn | 2795/QLD-ĐK | Official letter No. 2795/QLD-DK dated 1 April 2021 on the online publication of medicinal ingredients such as excipients and capsule shells (To applicant of drug, drug raw material) | Công văn số 2795/QLD-ĐK ngày 1 tháng 4 năm 2021 về việc công bố nguyên liệu làm thuốc là tá dược, vỏ nang trên hệ thống trực tuyến (gửi các cơ sở đăng ký thuốc, nguyên liệu làm thuốc) |
| 681 | Other documents/Văn bản khác | The list of drugs without circulation registration number granted import permits remains valid until March 31, 2021 | Danh mục các thuốc chưa có giấy đăng ký lưu hành được cấp giấy phép nhập khẩu còn hiệu lực đến ngày 31/3/2021 | |
| 680 | Decree/Nghị định | 38/2021/NĐ-CP | Decree 38/2021/ND-CP dated 29 March 2021 regulating the sanctioning of administrative violations in the field of culture and advertising | Nghị định 38/2021/NĐ-CP ngày 29 tháng 3 năm 2021 quy định xử phạt vi phạm hành chính trong lĩnh vực văn hóa và quảng cáo |
| 679 | Official letter/Công văn | 2691/QLD-ĐK | Official Letter 2691/QLD-DK dated March 26, 2021 on the deployment of online software to correct information of marketitng authorization of drugs and medicinal ingredients | Công văn 2691/QLD-ĐK ngày 26 tháng 03 năm 2021 về việc triển khai phần mềm trực tuyến đính chính thông tin giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 678 | Other documents/Văn bản khác | QT.KD.28.01 | The process of reviewing the application for import license of Covid-19 vaccines that does not have the marketing authorization, meets urgent needs for epidemic prevention and control | Quy trình xét duyệt hồ sơ đề nghị cấp phép nhập khẩu vắc xin phòng Covid-19 chưa có giấy đăng ký lưu hành đáp ứng nhu cầu cấp bách cho phòng, chống dịch bệnh |
| 677 | Other documents/Văn bản khác | QT.KD.28.01 | The process of reviewing the application for import license of Covid-19 vaccines that does not have the marketing authorization, meets urgent needs for epidemic prevention and control | Quy trình xét duyệt hồ sơ đề nghị cấp phép nhập khẩu vắc xin phòng Covid-19 chưa có giấy đăng ký lưu hành đáp ứng nhu cầu cấp bách cho phòng, chống dịch bệnh |
| 676 | Decision/Quyết định | 1654/QĐ-BYT | Decision 1654/QD-BYT dated March 23, 2021 on conditional approval of vaccines for urgent needs in the prevention and control of the Covid-19 epidemic | Quyết định 1654/QĐ-BYT ngày 23 tháng 03 năm 2021 về việc phê duyệt có điều kiện vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh covid-19 |
| 675 | Official letter/Công văn | 2511/QLD-KD | Official Letter No. 2511/QLD-KD dated 22 March 2021 on increasing and diversifying supplies of Covid-19 vaccines (the second time) | Công văn số 2511/QLD-KD ngày 22 tháng 03 năm 2021 về việc tăng cường, đa dạng hóa nguồn cung vắc xin phòng Covid-19 (lần 2) |
| 674 | Official letter/Công văn | 2367/QLD-MP | Official Letter No. 2367/QLD-MP dated March 18, 2021 regarding the review of the use of some substances in cosmetic products | Công văn số 2367/QLD-MP ngày 18 tháng 03 năm 2021 về việc rà soát việc sử dụng của một số chất trong sản phẩm mỹ phẩm |
| 673 | Decision/Quyết định | 376/QD-TTg | Decision No. 376/QD-TTg dated May 17, 2021 on approving Development program for pharmaceuticals industry and domestically produced herbal ingredient until 2030 and vision to 2045 | Quyết định 376/QĐ-TTg năm 2021 phê duyệt Chương trình phát triển công nghiệp dược, dược liệu sản xuất trong nước đến năm 2030, tầm nhìn đến năm 2045 do Thủ tướng Chính phủ ban hành |
| 672 | Integrated document/Văn bản hợp nhất | 11/VBHN-BYT | Consolidated Document 11/VBHN-BYT dated March 16, 2021 of Circular No. 32/2018/TT-BYT and Circular No. 29/2020/TT-BYT regulating the registration of circulation of drugs and medicinal ingredients | Văn bản hợp nhất 11/VBHN-BYT ngày 16 tháng 03 năm 2021 của thông tư số 32/2018/TT- BYT và thông tư số 29/2020/TT-BYT quy định việc đăng ký lưu hành thuốc và nguyên liệu làm thuốc |
| 671 | Integrated document/Văn bản hợp nhất | 07/VBHN-BYT | Consolidated Document 07/VBHN-BYT dated March 16, 2021 of Circular No. 06/2011/TT-BYT and Circular No. 29/2020/TT-BYT regulating cosmetic management | Văn bản hợp nhất 07/VBHN-BYT ngày 16 tháng 03 năm 2021 của thông tư số 06/2011/TT- BYT và thông tư số 29/2020/TT-BYT quy định về quản lý mỹ phẩm |
| 670 | Official letter/Công văn | 2194/QLD-CL | Official Letter No. 2194/QLD-CL dated 15 March 2021 regarding quality control of Metformin Drug | Công văn số 2194/QLD-CL ngày 15 tháng 03 năm 2021 về việc kiểm tra chất lượng thuốc Metformin |
| 669 | Official letter/Công văn | 2183/QLD-CL | Official Letter 2183/QLD-CL of March 15, 2021 on the announcement of GMP evaluation results of foreign manufacturers (issuance 14). | Công văn số 2183/QLD-CL ngày 15 tháng 03 năm 2021 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất thuốc nước ngoài (đợt 14) |
| 668 | Decision/Quyết định | 101/QĐ-QLD | Decision 101/QĐ-QLD dated March 09, 2021 promulgating the list of 07 biologicals granted registration for circulation in Vietnam – Added Issuance 40 (1st time) | Quyết định 101/QĐ-QLD ngày 09 tháng 03 năm 2021 về việc ban hành danh mục 07 sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 40 bổ sung (lần 01) |
| 667 | Decision/Quyết định | 102/QĐ-QLD | Decision 102/QĐ-QLD dated March 09, 2021 promulgating the list of 01 biologicals granted registration for circulation in Vietnam – Added Issuance 40 (1st time) | Quyết định 102/QĐ-QLD ngày 09 tháng 03 năm 2021 về việc ban hành danh mục 01 sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 40 bổ sung (lần 01) |
| 666 | Decision/Quyết định | 103/QĐ-QLD | Decision 103/QĐ-QLD dated March 09, 2021 promulgating the list of 01 biologicals extended registration for circulation in Vietnam – Added Issuance 40 (1st time) | Quyết định 102/QĐ-QLD ngày 09 tháng 03 năm 2021 về việc ban hành danh mục 01 sinh phẩm được gia hạn giấy đăng ký lưu hành tại Việt Nam – Đợt 40 bổ sung (lần 01) |
| 665 | Decision/Quyết định | 101/QĐ-QLD | Decision 101/QD-QLD dated March 09, 2021 on the issuance of the list of 07 biologicals granted marketing authorization in Vietnam – Added issuance 40 (1st time) | Quyết định 101/QĐ-QLD ngày 09 tháng 03 năm 2021 về việc ban hành danh mục 07 sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 40 bổ sung (lần 01) |
| 664 | Decision/Quyết định | 102/QĐ-QLD | Decision 102/QD-QLD dated March 09, 2021 on the issuance of the list of 01 biologicals granted marketing authorization in Vietnam – Added issuance 40 (1st time) | Quyết định 102/QĐ-QLD ngày 09 tháng 03 năm 2021 về việc ban hành danh mục 01 sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 40 bổ sung (lần 01) |
| 663 | Decision/Quyết định | 103/QĐ-QLD | Decision 103/QD-QLD dated March 09, 2021 on the issuance of the list of 01 biologicals renewed marketing authorization in Vietnam – Added issuance 40 (1st time) | Quyết định 103/QĐ-QLD ngày 09 tháng 03 năm 2021 về việc ban hành danh mục 01 sinh phẩm được gia hạn giấy đăng ký lưu hành tại Việt Nam – Đợt 40 bổ sung (lần 01) |
| 662 | Decision/Quyết định | 1473/QĐ-BYT | Decision 1473/QD-BYT dated March 8, 2021 on the announcement of amended and supplemented administrative procedures in the pharmaceutical sector under the management functions of the Ministry of Health specified in Circular No. 29/2020/TT-BYT December 31, 2020 of Minister of Health | Quyết định 1473/QĐ-BYT ngày 08 tháng 03 năm 2021 về việc công bố thủ tục hành chính được sửa đổi, bổ sung lĩnh vực dược phẩm thuộc phạm vi chức năng quản lý của Bộ y tế quy định tại thông tư số 29/2020/TT-BYT ngày 31 tháng 12 năm 2020 của Bộ trưởng Bộ Y tế |
| 661 | Decision/Quyết định | 1469/QD-BYT | Decision 1469/QD-BYT dated March 6, 2021 on the distribution of Covid-19 vaccine – stage 1 | Quyết định 1469/QĐ-BYT ngày 06 tháng 03 năm 2021 về việc phân bổ vắc xin phòng Covid-19 đợt 1 |
| 660 | Decision/Quyết định | 1464/QĐ-BYT | Decision 1464/QĐ-BYT dated March 5, 2021 guidelines for receiving, preserving, distributing and using covid-19 vaccines | Quyết định số 1464/QĐ-BYT ngày 05 tháng 03 năm 2021 về việc ban hành hướng dẫn tiếp nhận, bảo quản, phân phối và sử dụng vắc xin phòng covid-19 |
| 659 | Decision/Quyết định | 1467/QD-BYT | Decision 1467/QD-BYT dated March 5, 2021 on approving the Covid-19 vaccination plan for the period of 2021 – 2022 | Quyết định 1467/QĐ-BYT ngày 05 tháng 3 năm 2021 về việc phê duyệt kế hoạch tiêm vắc xin phòng covid-19 giai đoạn 2021 – 2022 |
| 658 | Other documents/Văn bản khác | Guidance on the preparation of legal documents for registration of free sale of domestically manufactured medical equipment | Hướng dẫn chuẩn bị hồ sơ pháp lý đăng ký lưu hành trang thiết bị y tế sản xuất trong nước | |
| 656 | Resolution/Nghị Quyết | 21/NQ-CP | Resolution No. 21/NQ-CP dated February 26, 2021 on purchase and use of Covid-19 vaccines | Nghị quyết số 21/NQ-CP ngày 26 tháng 02 năm 2021 về mua và sử dụng vắc xin phòng COVID-19 |
| 655 | Official letter/Công văn | 1120/BYT-YDCT | The official letter No. 1120/BYT-YDCT dated February 24, 2021 guiding the implementation of administrative procedures related to herbal products at Traditional Medicine and Pharmacy Administration and DAV | Công văn số 1120/BYT-YDCT ngày 24 tháng 02 năm 2021 về việc hướng dẫn thực hiện các thủ tục hành chính liên quan đến dược liệu thuốc cổ truyền, thuốc dược liệu tại cục quản lý y dược cổ truyền và cục quản lý dược. |
| 654 | Official letter/Công văn | 1438/QLD-KD | Official Letter 1438/QLD-KD dated 23 February 2021 regarding the implementation of Directive 06/CT-TTg dated 19/02/2021 (vaccine Covid-19) | Công văn 1438/QLD-KD ngày 23 tháng 02 năm 2021 về việc triển khai chỉ thị 06/CT-TTg ngày 19/02/2021 (vaccine Covid-19) |
| 653 | Official letter/Công văn | 1002/QLD-CL | Official Letter 1002/QLD-CL of Feb 09, 2021 on the announcement of GMP evaluation results of foreign manufacturers (issuance 13). | Công văn số 1002/QLD-CL ngày 09 tháng 02 năm 2021 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất thuốc nước ngoài (đợt 13) |
| 652 | Official letter/Công văn | 939/BYT-TB-CT | The Official Letter No. 939/BYT-TB-CT dated February 9, 2021 on the registration of circulation of domestically manufactured medical equipment and imported products for only one purpose: disinfection of medical equipment | Công văn số 939/BYT-TB-CT ngày 09 tháng 02 năm 2021 về việc đăng ký lưu hành trang thiết bị y tế sản xuất trong nước và sản phẩm nhập khẩu chỉ có một mục đích là khử khuẩn trang thiết bị y tế |
| 651 | Decision/Quyết định | 1210/QĐ-BYT | Decision 1210/QD-BYT dated February 09, 2021 approving plan for receipt, storage, distribution and use of covid-19 vaccines provided by COVAX FACILITY for 2021 – 2022 | Quyết định số 1210/QĐ-BYT ngày ngày 09 tháng 02 năm 2021 về việc phê duyệt kế hoạch tiếp nhận, bảo quản, phân phối và sử dụng vắc xin phòng COVID-19 giai đoạn 2021 – 2022 do COVAX FACILITY hỗ trợ |
| 649 | Official letter/Công văn | 777/QLD-ĐK | Official Letter No. 777/QLD-DK dated February 3, 2021 on the deployment of online tools to maintain the validity of registration numbers for circulation of drugs and medicinal ingredients | Công văn số 777/QLD-ĐK ngày 03 tháng 02 năm 2021 về việc triển khai công cụ trực tuyến duy trì hiệu lực giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 647 | Decision/Quyết định | 983/QĐ-BYT | Decision 983/QD-BYT dated Feb. 01, 2021 on conditional approval of vaccines for urgent needs in the prevention and control of the Covid-19 epidemic | Quyết định 983/QĐ-BYT ngày 01 tháng 02 năm 2021 về việc phê duyệt có điều kiện vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh covid-19 |
| 646 | Decision/Quyết định | 973/QĐ-BYT | Decision 973/QD-BYT dated January 31, 2021 on conditional approval of vaccines for urgent needs in the prevention and control of the Covid-19 epidemic | Quyết định 973/QĐ-BYT ngày 31 tháng 01 năm 2021 về việc phê duyệt có điều kiện vắc xin cho nhu cầu cấp bách trong phòng, chống dịch bệnh covid-19 |
| 645 | Official letter/Công văn | 297/QLD-CL | Official Letter No. 297/QLD-CL dated 25 January 2021 regarding quality control of Metformin Drug | Công văn số 297/QLD-CL ngày 25 tháng 01 năm 2021 về việc kiểm tra chất lượng thuốc Metformin |
| 644 | Decision/Quyết định | 43/QĐ-QLD | Decision No. 43/QD-QLD dated January 22, 2021 promulgating the list of 21 imported drugs granted circulation registration in Vietnam – Issuance 105, session 2 | Quyết định số 43/QĐ-QLD ngày 22 tháng 01 năm 2021 về việc ban hành danh mục 21 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại VN – Đợt 105 phiên 2 |
| 643 | Other documents/Văn bản khác | Annexes of the ASEAN Cosmetic Treaty on substances used in cosmetics updated on 15.01.2021 | Phụ lục của Hiệp định Mỹ phẩm ASEAN về các chất sử dụng trong mỹ phẩm cập nhật ngày 15.01.2021 | |
| 642 | Official letter/Công văn | 162/QLD-MP | Official Letter No. 162/QLD-MP dated January 15, 2021 about updating regulations on substances used in cosmetics | Công văn số 162/QLD-MP ngày 15 tháng 01 năm 2021 về việc cập nhật quy định về các chất sử dụng trong mỹ phẩm |
| 640 | Official letter/Công văn | 110/QLD-KD | Official Letter No. 110/QLD-KD dated 12 January 2021 regarding the notification of the list of wholesalers conducting the distribution of drugs and medicinal ingredients | Công văn số 110/QLD-KD ngày 12 tháng 01 năm 2021 về việc thông báo danh sách cơ sở bán buôn thực hiện việc phân phối thuốc, nguyên liệu làm thuốc |
| 639 | Decision/Quyết định | 122/QD-BYT | Decision No. 122/QD-BYT of January 11, 2021 on the issuance of national guidelines on pharmacovigilance | Quyết định số 122/QĐ-BYT ngày 11 tháng 01 năm 2021 về việc ban hành hướng dẫn quốc gia về cảnh giác dược |
| 638 | Official letter/Công văn | 48/QLD-ĐK | Official Letter No. 48/QLD-DK dated January 8, 2021 on proposing amendments to Circular No. 32/2018/TT-BYT and Circular No. 01/2018/TT-BYT | Công văn số 48/QLD-ĐK ngày 08 tháng 01 năm 2021 về việc đề xuất nội dung sửa đổi Thông tư số 32/2018/TT-BYT và thông tư số 01/2018/TT-BYT |
| 637 | Official letter/Công văn | 49/QLD-ĐK | Official Letter No. 49/QLD-ĐK dated January 8, 2021 on the implementation of online public services regarding the Notification of drug information content/ advertising on the new system | Công văn số 49/QLD-ĐK ngày 08 tháng 01 năm 2021 về việc triển khai thực hiện dịch vụ công trực tuyến về giấy xác nhận nội dung thông tin/quảng cáo thuốc trên hệ thống mới |
| 636 | Official letter/Công văn | 75/TCHQ-PC | Official Letter No. 75/TCHQ-PC dated January 7, 2021 on answering questions and recommendations on customs procedures | Công văn số 75/TCHQ-PC ngày 07 tháng 01 năm 2021 về việc trả lời vướng mắc và kiến nghị về thủ tục hải quan |
| 635 | Official letter/Công văn | 34/BYT-QLD | Official Letter No. 34/BYT-QLD dated January 5, 2021 regulating for the COA of drugs and medicinal ingredients | Công văn số 34/BYT-QLD ngày 05 tháng 01 năm 2021 quy định về Phiếu kiểm nghiệm thuốc, nguyên liệu làm thuốc |
| 634 | Circular/Thông tư | 28/2020/TT-BYT | Circular 28/2020/TT-BYT dated December 31, 2020 providing the list of minimum equipment for commune health stations | Thông tư 28/2020/TT-BYT ngày 31 tháng 12 năm 2020 quy định danh mục trang thiết bị tối thiểu của trạm y tế tuyến xã |
| 632 | Circular/Thông tư | 27/2020/TT-BYT | Circular 27/2020/TT-BYT dated December 31, 2020 amending and supplementing Article 5 of Circular 05/2015/TT-BYT promulgating the list of traditional medicines, herbal medicines and traditional materials covered by the health insurance fund | Thông tư 27/2020/TT-BYT ngày 31 tháng 12 năm 2020 sửa đổi, bổ sung điều 5 thông tư 05/2015/TT-BYT ban hành danh mục thuốc đông y, thuốc từ dược liệu và vị thuốc y học cổ truyền thuộc phạm vi thanh toán của quỹ bảo hiểm y tế |
| 631 | Circular/Thông tư | 29/2020/TT-BYT | Circular 29/2020/TT-BYT dated December 31, 2020 on amending, supplementing and repealing a number of legal normative documents promulgated by the Health Minister; jointly promulgated with other ministries | Thông tư 29/2020/TT-BYT ngày 31 tháng 12 năm 2020 sửa đổi, bổ sung và bãi bỏ một số văn bản quy phạm pháp luật do bộ trưởng bộ y tế ban hành, liên tịch ban hành |
| 630 | Circular/Thông tư | 33/2020/TT-BYT | Circular 33/2020/TT-BYT dated December 31, 2020 list of medical devices subject to mandatory safety and technical inspection | Thông tư 33/2020/TT-BYT ngày 31 tháng 12 năm 2020 quy định danh mục trang thiết bị y tế phải kiểm định an toàn và tính năng kỹ thuật |
| 629 | Official letter/Công văn | 7395/BYT-TB-CT | Official Letter No. 7395/BYT-TB-CT dated December 31, 2020 regarding the application for circulated registration of medical equipment | Công văn số 7395/BYT-TB-CT ngày 31 tháng 12 năm 2020 về việc hồ sơ đăng ký lưu hành trang thiết bị y tế |
| 627 | Decision/Quyết định | 664/QĐ-QLD | Decision 664/QD-QLD December 31, 2020 promulgating the list of 131 imported drugs granted circulation registration in Vietnam – Issuance 105 | Quyết định 664/QĐ-QLD ngày 31 tháng 12 năm 2020 về việc ban hành danh mục 131 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 105 |
| 626 | Official letter/Công văn | 7359/QLD-BYT | Official Letter No. 7359/QLD-BYT dated December 30, 2020 on updating some information in Decisions on publication of the List of drugs with evidence of bioequivalence | Công văn số 7359/QLD-BYT ngày 30 tháng 12 năm 2020 về việc cập nhật một số thông tin tại các Quyết định công bố Danh mục thuốc có chứng minh tương đương sinh học |
| 625 | Circular/Thông tư | 112/2020/TT-BTC | Circular 112/2020/TT-BTC dated December 29, 2020 regulating the rates of a number of charges and fees to support and remove difficulties for production and business, ensuring social security to cope with epidemics covid-19 | Thông tư 112/2020/TT-BTC ngày 29 tháng 12 năm 2020 quy định mức thu một số khoản phí, lệ phí nhằm hỗ trợ, tháo gỡ khó khăn cho sản xuất kinh doanh, bảo đảm an sinh xã hội ứng phó với dịch covid-19 |
| 624 | Official letter/Công văn | 1115/BYT-TB-CT | The official letter No. 1115/BYT-TB-CT dated February 24, 2021 on ensuring providing and updating of accurate information on prices of medical supplies, medical equipment and IVD for pandemic prevention of Covid-19 | Công văn số 1115/BYT-TB-CT ngày 24 tháng 02 năm 2021 về việc bảo đảm cung ứng và cập nhật thông tin chính xác về giá vật tư, thiết bị y tế, sinh phẩm xét nghiệm có liên quan đến công tác phòng chống dịch Covid-19 |
| 623 | Official letter/Công văn | 18565/QLD-ĐK | Official Letter No. 18565/QLD-DK dated December 23, 2020 on registration and importation of orders for drugs with combination of salbutamol and guaifenesin | Công văn số 18565/QLD-ĐK ngày 23 tháng 12 năm 2020 về việc đăng ký, nhập khẩu đơn hàng thuốc phối hợp salbutamol và guaifenesin |
| 622 | Official letter/Công văn | 18563/QLD-ĐK | Official Letter No. 18563/QLD-DK dated December 23, 2020 regarding the registration, import, production of drugs containing the active ingredient Diacerein with a content of over 50 mg | Công văn số 18563/QLD-ĐK ngày 23 tháng 12 năm 2020 về việc đăng ký, nhập khẩu, sản xuất, các thuốc chứa hoạt chất Diacerein có hàm lượng trên 50 mg |
| 621 | Official letter/Công văn | 18564/QLD-ĐK | Official Letter 18564/QLD-DK dated December 23, 2020 on registration and import of drug orders containing fenspirid | Công văn 18564/QLD-ĐK ngày 23 tháng 12 năm 2020 về việc đăng ký, nhập khẩu đơn hàng thuốc chứa dược chất fenspirid |
| 620 | Decision/Quyết định | 651/QĐ-QLD | Decision 651/QD-QLD dated December 21, 2020 on the issuance of the list of 02 vaccines with registration renewal in Vietnam – issuance 40 | Quyết định 651/QĐ-QLD ngày 21 tháng 12 năm 2020 về việc ban hành danh mục 02 vắc xin được gia hạn giấy đăng ký lưu hành tại việt nam – đợt 40 |
| 619 | Decision/Quyết định | 653/QĐ-QLD | Decision 653/QD-QLD dated December 21, 2020 promulgating the list of 54 imported drugs granted circulation registration in Vietnam – third supplemented issuance 104 | Quyết định 653/QĐ-QLD ngày 21 tháng 12 năm 2020 về việc ban hành danh mục 54 thuốc nước ngoài được cấp giấy đăng ký lưu hành tại việt nam – đợt 104 bổ sung lần 3 |
| 618 | Other documents/Văn bản khác | QT.ĐK.23.01 | Process of appraisal of application for drug information/drug advertisement of DAV | Quy trình thẩm định hồ sơ đề nghị xác nhận nội dung thông tin/quảng cáo thuốc của Cục quản lý Dược |
| 617 | Decision/Quyết định | 5284/QĐ-BYT | Decision 5284/QD-BYT dated December 18, 2020 announced the additional list of original branded-name drugs issuance 20 | Quyết định 5284/QĐ-BYT ngày 18 tháng 12 năm 2020 công bố danh mục biệt dược gốc đợt 20 bổ sung |
| 616 | Official letter/Công văn | 7085/BYT-QLD | Official Letter No. 7085/BYT-QLD dated December 18, 2020 regarding the correction and adjustment of information in Decisions on publication of the list of original brand-name drugs | Công văn số 7085/BYT-QLD ngày 18 tháng 12 năm 2020 về việc đính chính, điều chỉnh thông tin tại các Quyết định công bố danh mục thuốc biệt dược gốc |
| 615 | Official letter/Công văn | 18360/QLD-CL | Official Letter 18360/QLD-CL of December 16, 2020 on the announcement of GMP evaluation results of foreign manufacturers (issuance 12). | Công văn 18360/QLD-CL ngày 16 tháng 12 năm 2020 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất nước ngoài (đợt 12) |
| 614 | Decision/Quyết định | 618/QĐ-QLD | Decision 618/QD-QLD dated December 8, 2020 promulgating the list of 01 imported drug for treatment of HIV/AIDS to be extended for circulation registration in Vietnam – Issuance 105 | Quyết định 618/QĐ-QLD ngày 08 tháng 12 năm 2020 về việc ban hành danh mục 01 thuốc nước ngoài điều trị HIV/AIDS được gia hạn giấy đăng ký lưu hành tại Việt Nam – Đợt 105 |
| 613 | Official letter/Công văn | 17879/QLD-ĐK | Official Letter No. 17879/QLD-DK dated December 3, 2020 providing information regarding the safety of drugs containing Mephenesin | Công văn số 17879/QLD-ĐK ngày 03 tháng 12 năm 2020 về việc cung cấp thông tin liên quan đến tính an toàn của thuốc chứa Mephenesin |
| 612 | Decision/Quyết định | 605/QĐ-QLD | Decision 605/QD-QLD dated December 3, 2020 promulgating the list of 23 biologicals granted registration for circulation in Vietnam – Added Issuance 39 (1st time) | Quyết định 605/QĐ-QLD ngày 03 tháng 12 năm 2020 về việc ban hành danh mục 23 sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam – Đợt 39 bổ sung (lần 01) |
| 611 | Decision/Quyết định | 606/QĐ-QLD | Decision 606/QD-QLD dated December 3, 2020 on the issuance of the list of 02 biologicals with registration renewal in Vietnam – Added issuance 39 (1st time) | Quyết định 606/QĐ-QLD ngày 03 tháng 12 năm 2020 về việc ban hành danh mục 02 sinh phẩm được gia hạn giấy đăng ký lưu hành tại Việt Nam – Đợt 39 bổ sung (lần 01) |
| 610 | Official letter/Công văn | 5888/BYT-TB-CT | Official Letter 5888/BYT-TB-CT dated October 29, 2020 guiding the implementation of bidding for medical equipment according to Circular No. 14/2020/TT-BYT | Công văn 5888/BYT-TB-CT ngày 29 tháng 10 năm 2020 về việc hướng dẫn triển khai đấu thầu trang thiết bị y tế theo Thông tư số 14/2020/TT-BYT |
| 609 | Decision/Quyết định | 4490/QĐ-BYT | Decision 4490/QD-BYT dated October 28, 2020 issue a plan to implement the Government’s Decree No. 117/2020/ND-CP dated September 28, 2020 on sanctioning administrative violations in the health sector and other decrees on sanctioning violations related to the health sector | Quyết định 4490/QĐ-BYT ngày 28 tháng 10 năm 2020 ban hành kế hoạch triển khai thi hành nghị định số 117/2020/NĐ-CP ngày 28/9/2020 của chính phủ quy định xử phạt vi phạm hành chính trong lĩnh vực y tế và các nghị định quy định xử phạt vi phạm hành chính khác liên quan đến lĩnh vực y tế |
| 608 | Official letter/Công văn | 15966/QLD-CL | Official Letter 15966/QLD-CL of October 16, 2020 on the announcement of GMP evaluation results of foreign manufacturers (issuance 10). | Công văn 15966/QLD-CL ngày 16 tháng 10 năm 2020 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất nước ngoài (đợt 10) |
| 606 | Decree/Nghị định | 117/2020/NĐ-CP | Decree No. 117/2020/ND-CP dated September 28, 2020 regulating on the sanctioning of administrative violations in the health sector | Nghị định số 117/2020/NĐ-CP ngày 28 tháng 9 năm 2020 quy định xử phạt vi phạm hành chính trong lĩnh vực y tế |
| 605 | Official letter/Công văn | 15336/QLD-CL | Official Letter 15336/QLD-CL of September 28, 2020 on the announcement of GMP evaluation results of foreign manufacturers (issuance 9). | Công văn 15336/QLD-CL ngày 28 tháng 9 năm 2020 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất nước ngoài (đợt 9) |
| 604 | Official letter/Công văn | 5159/BYT-TB-CT | Official Letter 5159/BYT-TB-CT dated September 28, 2020 regarding the public disclosure of medical equipment prices | Công văn 5159/BYT-TB-CT ngày 28 tháng 9 năm 2020 về việc thực hiện công khai giá trang thiết bị y tế |
| 603 | Official letter/Công văn | 6068/TCHQ-GSQL | Official Letter 6068/TCHQ-GSQL dated September 16, 2020 on strengthening inspection of imported drugs and drug raw materials | Công văn 6068/TCHQ-GSQL ngày 16 tháng 9 năm 2020 về việc tăng cường kiểm tra thuốc, nguyên liệu làm thuốc nhập khẩu |
| 601 | Decision/Quyết định | 3986/QĐ-BYT | Decision 3986/QĐ-BYT dated September 16, 2020 on promulation of “handbook for quarantine practices in areas with reported confirmed covid-19” | Quyết định 3986/QĐ-BYT ngày 16 tháng 9 năm 2020 về việc ban hành “sổ tay hướng dẫn tổ chức thực hiện cách ly y tế vùng có dịch covid – 19” |
| 600 | Decision/Quyết định | 3888/QD-BYT | Decision 3888/QD-BYT dated September 8, 2020 on promugation of handbook “guidance on prevention and control of covid-19 in community in the new normal” | Quyết định 3888/QĐ-BYT ngày 08 tháng 9 năm 2020 về việc ban hành sổ tay “hướng dẫn phòng, chống dịch covid-19 tại cộng đồng trong trạng thái bình thường mới” |
| 599 | Integrated document/Văn bản hợp nhất | 35/VBHN-BTC | Joint Circular No. 35/VBHN-BTC dated September 7, 2020, Circular No. 279/2016/TT-BTC, Circular 117/2018/TT-BTC and Circular 75/2020/TT-BTC regulating the rates, the regime of collection, payment, management and use of fees in food safety and hygiene | Văn bản hợp nhất số 35/VBHN-BTC ngày 7 tháng 9 năm 2020 thông tư số 279/2016/TT-BTC, thông tư 117/2018/TT-BTC và thông tư 75/2020/TT-BTC quy định mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong công tác an toàn vệ sinh thực phẩm |
| 598 | Integrated document/Văn bản hợp nhất | 11/VBHN-BYT | Consolidated Document No. 11/VBHN-BYT dated October 6, 2020 consolidating Circulars 02/2018/TT-BYT and Circular 12/2020/TT-BYT on good pharmacy practices | Văn bản hợp nhất số 11/VBHN-BYT ngày 6 tháng 10 năm 2020 hợp nhất các thông tư số 02/2018/TT-BYT và thông tư 12/2020/TT-BYT về thực hành tốt cơ sở bán lẻ thuốc |
| 596 | Official letter/Công văn | 4454/BYT-TTrB | Official Letter No. 4454/BYT-TTrB dated 21 August 2020 on strengthening health insurance specialized inspection | Công văn số 4454/BYT-TTrB ngày 21 tháng 8 năm 2020 về việc tăng cường thanh tra chuyên ngành bảo hiểm y tế |
| 595 | Decision/Quyết định | 3659/QĐ-BYT | Decision 3659/QĐ-BYT dated August 21, 2020 promulgating guidelines for covid-19 vaccine research, clinical trials, marketing authorization and use | Quyết định số 3659/QĐ-BYT ngày 21 tháng 8 năm 2020 ban hành hướng dẫn về nghiên cứu, thử nghiệm lâm sàng, đăng ký lưu hành, sử dụng vắc xin phòng covid-19 |
| 592 | Official letter/Công văn | 13600/QLD-CL | Official Letter 13600/QLD-CL of August 18, 2020 on the announcement of GMP evaluation results of foreign manufacturers (issuance 8). | Công văn 13600/QLD-CL ngày 18 tháng 8 năm 2020 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất nước ngoài (đợt 8) |
| 591 | Circular/Thông tư | 15/2020/TT-BYT | Circular 15/2020/TT-BYT dated August 10, 2020 promulgating list of drugs procured through bidding, list of drugs procured through centralized bidding, list of drugs procured through price negotiation | Thông tư 15/2020/TT-BYT ngày ngày 10 tháng 8 năm 2020 ban hành danh mục thuốc đấu thầu, danh mục thuốc đấu thầu tập trung, danh mục thuốc được áp dụng hình thức đàm phán giá ban hành danh mục thuốc đấu thầu, danh mục thuốc đấu thầu tập trung, danh mục thuốc được áp dụng hình thức đàm phán giá |
| 590 | Official letter/Công văn | 12346/QLD-CL | The official letter 12346/QLD-CL dated August 08, 2020 on roadmap for implementation of GMP regulations on excipients and capsules | Công văn 12346/QLD-CL ngày 05 tháng 8 năm 2020 về việc lộ trình thực hiện quy định GMP tá dược, vỏ nang. |
| 588 | Decision/Quyết định | 2722/QĐ-BYT | Decision 2722/QD-BYT dated June 29, 2020 announcing newly issued administrative procedures within the scope of management functions of the Ministry of Health | Quyết định 2722/QĐ-BYT ngày 29 tháng 6 năm 2020 về việc công bố thủ tục hành chính mới ban hành thuộc phạm vi chức năng quản lý của bộ y tế |
| 587 | Circular/Thông tư | 13/2020/TT-BYT | Circular 13/2020/TT-BYT dated June 22, 2019 amending a number of articles of circular no. 35/2016/tt-byt dated september 28, 2016 by minister of health on list of medical services covered by health insurance, coinsurance percentages and coverage thereof | Thông tư 13/2020/TT-BYT ngày 22 tháng 6 năm 2020 sửa đổi, bổ sung một số điều của thông tư số 35/2016/tt-byt ngày 28 tháng 9 năm 2016 của bộ trưởng bộ y tế ban hành danh mục và tỷ lệ, điều kiện thanh toán đối với dịch vụ kỹ thuật y tế thuộc phạm vi được hưởng của người tham gia bảo hiểm y tế |
| 586 | Circular/Thông tư | 12/2020/TT-BYT | Circular 12/2020/TT-BYT dated June 22, 2020 amending circular no. 02/2018/TT-BYT dated january 22, 2018 of minister of health on good pharmacy practice | Thông tư 12/2020/TT-BYT ngày 22 tháng 6 năm 2020 sửa đổi, bổ sung một số điều của thông tư số 02/2018/TT-BYT ngày 22 tháng 01 năm 2018 của bộ trưởng bộ y tế quy định về thực hành tốt cơ sở bán lẻ thuốc |
| 585 | Circular/Thông tư | 8/2020/TT-BYT | Circular 8/2020/TT-BYT dated May 27, 2020 amendments to the circular no. 04/2018/TT-BYT dated february 09, 2018 of the minister of health on good laboratory practice | Thông tư 8/2020/TT-BYT ngày 27 tháng 5 năm 2020 sửa đổi, bổ sung một số điều của thông tư số 04/2018/TT-BYT ngày 09 tháng 02 năm 2018 của bộ trưởng bộ y tế quy định về thực hành tốt phòng thí nghiệm |
| 584 | Circular/Thông tư | 9/2020/TT-BYT | Circular 9/2020/TT-BYT dated June 10, 2020 amendments to the circular No. 03/2018/TT- BYT dated february 09, 2018 of the minister of health on good distribution practices for pharmaceutical products and pharmaceutical starting materials | Thông tư 9/2020/TT-BYT ngày 10 tháng 6 năm 2020 sửa đổi, bổ sung một số điều của thông tư số 03/2018/TT-BYT ngày 09 tháng 02 năm 2018 của bộ trưởng bộ y tế quy định về thực hành tốt phân phối thuốc, nguyên liệu làm thuốc |
| 582 | Decision/Quyết định | 3248/QĐ-BYT | Decision 3248/QD-BYT dated July 22, 2020 announcing abolished administrative procedures in the pharmaceutical sector under the management functions of the Ministry of Health | Quyết định 3248/QĐ-BYT ngày 22 tháng 7 năm 2020 về việc công bố thủ tục hành chính bị bãi bỏ trong lĩnh vực dược phẩm thuộc phạm vi chức năng quản lý của bộ y tế |
| 580 | Official letter/Công văn | 10364/QLD-CL | Official Letter 10364/QLD-CL of July 09, 2020 on the announcement of GMP evaluation results of foreign manufacturers (issuance 7). | Công văn 10364/QLD-CL ngày 9 tháng 7 năm 2020 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất nước ngoài (đợt 7) |
| 579 | Circular/Thông tư | 14/2020/TT-BYT | Circular 14/2020/TT-BYT dated July 10, 2020 stipulating a number of contents in bidding for medical devices at public healthcare facilities | Thông tư 14/2020/TT-BYT ngày 10 tháng 7 năm 2020 quy định một số nội dung trong đấu thầu trang thiết bị y tế tại các cơ sở y tế công lập |
| 573 | Official letter/Công văn | 9459/QLD-ĐK | The official letter 9459/QLD-ĐK dated 30th June, 2020 on informing the deployment of implementing online public service system of registration for circulation of drugs, drug materials. | Công văn 9459/QLD-ĐK ngày 30 tháng 06 năm 2020 về việc thông báo triển khai thực hiện dịch vụ công trực tuyến về đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 572 | Other documents/Văn bản khác | Quy trình các thủ tục hành chính DAV | ||
| 571 | Circular/Thông tư | 10/2020/TT-BYT | Circular No. 10/2020/TT-BYT dated June 11, 2020 regulating on bioequivalence Studies of drugs | Thông tư 10/2020/TT-BYT ngày 11 tháng 6 năm 2020 quy định về thử tương đương sinh học của thuốc |
| 569 | Decision/Quyết định | 1933/QĐ-BYT | Decision No. 1933/QD-BYT dated April 29, 2020 approving the instructions for the release of vaccines and medical biologicals. | Quyết định số 1933/QĐ-BYT ngày 29 tháng 4 năm 2020 về việc phê duyệt hướng dẫn xuất xưởng vắc xin và sinh phẩm y tế |
| 568 | Circular/Thông tư | 11/2020/TT-BYT | Circular 11/2020/TT-BYT dated June 19, 2020 promulgating the list of prohibited and restricted active ingredients in insecticidal and microbicidal preparations for household and medical use | Thông tư 11/2020/TT-BYT ngày 19 tháng 6 năm 2020 ban hành danh mục hoạt chất cấm sử dụng và hạn chế phạm vi sử dụng trong chế phẩm diệt côn trùng, diệt khuẩn dùng trong lĩnh vực gia dụng và y tế |
| 567 | Official letter/Công văn | 7711/QLD-CL | The official letter 7711/QLD-CL dated June 12, 2020 about specify the test conditions for the Microbial limit test and Sterility test | Công văn 7711/QLD-CL ngày 12 tháng 6 năm 2020 về việc ghi rõ điều kiện thử nghiệm của phép thử giới hạn nhiễm khuẩn và thử độ vô khuẩn |
| 566 | Official letter/Công văn | 3218/BYT-QLD | The official letter 3218/BYT-QLD dated June 11, 2020 regarding the maintenance of validity of drug registration certificates as prescribed in Clause 2, Article 47 of Circular No. 32/2018/TT-BYT | Công văn 3218/BYT-QLD ngày 11 tháng 6 năm 2020 về việc duy trì hiệu lực giấy đăng ký lưu hành thuốc theo quy định tại khoản 2 điều 47 thông tư số 32/2018/TT-BYT |
| 565 | Official letter/Công văn | 7210/QLD-CL | Official Letter 7210/QLD-CL of June 3, 2020 on the announcement of GMP evaluation results of foreign manufacturers (version 6) | Công văn 7210/QLD-CL ngày 3 tháng 6 năm 2020 về việc công bố kết quả đánh giá đáp ứng GMP của cơ sở sản xuất nước ngoài (đợt 6) |
| 564 | Official letter/Công văn | 3013/BYT-TB-CT | Document No. 3013/BYT-TB-CT of June 01, 2020 on the grant of circulation registration numbers for domestic medical equipment | Văn bản số 3013/BYT-TB-CT ngày 01 tháng 06 năm 2020 về việc thực hiện cấp số đăng ký lưu hành đối với trang thiết bị y tế sản xuất trong nước |
| 563 | Decision/Quyết định | 2057/QĐ-BYT | Decision 2057/QD-BYT dated May 14, 2020 issuance of specialized document on “guidelines for mental health care during covid-19 epidemic” | Quyết định 2057/QĐ-BYT ngày 14 tháng 5 năm 2020 về việc ban hành tài liệu chuyên môn “hướng dẫn chăm sóc sức khỏe tâm thần trong dịch covid-19” |
| 562 | Official letter/Công văn | 2560/BYT-TB-CT | Official Letter 2560 / BYT-TB-CT dated 11 May 2020 list of biological products/in-vitro diagnostic medical equipment for Corona virus testing (SARS-CoV-2) which have been granted registration numbers, issued import license | Công văn 2560/BYT-TB-CT ngày 11 tháng 5 năm 2020 danh sách các sinh phẩm/trang thiết bị y tế chẩn đoán in vitro xét nghiệm vi rút Corona (SARS-CoV-2) đã được cấp số đăng ký, cấp giấy phép nhập khẩu |
| 559 | Official letter/Công văn | 2111/BYT-QLD | Official Letter No. 2111/BYT-QLD of April 15, 2020 on correcting and adjusting information in decisions to announce the list of branded drug | Công văn số 2111/BYT-QLD ngày 15 tháng 4 năm 2020 về việc đính chính, điều chỉnh thông tin tại các quyết định công bố danh mục thuốc biệt dược gốc |
| 558 | Official letter/Công văn | 3517/QLD-CL | The official letter 3517/QLD-CL dated April 09, 2020 announcement of manufacturers meet requirements of GMP EU, PICs standards – Version 72 | Công bố cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP và EU-GMP (Đợt 72) |
| 557 | Official letter/Công văn | 3518/QLD-CL | The official letter 3518/QLD-CL dated April 09, 2020 announcement of manufacturers have not yet met requirements of GMP EU, PICs standards and request to supplement – Version 72 | Các hồ sơ đề nghị công bố cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP và EU-GMP không đạt yêu cầu và cần bổ sung giải trình (Đợt 72) |
| 555 | BRANDED | List of Branded Drug for Tender | Cập nhật Danh mục Biệt Dược gốc | |
| 554 | Official letter/Công văn | 3323/QLD-GT | The official Letter 3323/QLD-GT of April 7, 2020, informing the council’s opinions to dossiers announcing the list of original brand name drugs (Version 20) | Công văn 3323/QLD-GT ngày 7 tháng 4 năm 2020 về việc thông báo ý kiến hội đồng đối với các hồ sơ công bố danh mục thuốc biệt dược gốc (đợt 20) |
| 553 | Decision/Quyết định | 1465/QĐ-BYT | Decision 1465/QĐ-BYT dated March 30, 2020 list of branded drug granted issuance 20th | Quyết định 1465/QĐ-BYT năm 2020 công bố danh mục thuốc biệt dược gốc do Bộ Y tế ban hành đợt 20 |
| 552 | Official letter/Công văn | 1742/BYT-QLD | The official letter 1742/BYT-QLD dated March 30, 2020 correction, revision information in Decisions issuing list of Branded drugs | Đính chính, điều chỉnh thông tin tại các Quyết định công bố danh mục thuốc biệt dược gốc |
| 551 | Official letter/Công văn | 1743/BYT-QLD | The official letter 1743/BYT-QLD dated March 30, 2020 correction, revision information in Decisions issuing list of Branded drugs | Đính chính, điều chỉnh thông tin tại các Quyết định công bố danh mục thuốc biệt dược gốc |
| 550 | Decision/Quyết định | 1444/QĐ-BYT | Decision 1444/QĐ-BYT dated March 29, 2020 temporary guideline on choosing and using facemask in covid-19 pandemic’s prevention | Quyết định 1444/QĐ-BYT ngày 29 tháng 3 năm 2020 về việc hướng dẫn tạm thời về lựa chọn và sử dụng khẩu trang trong phòng chống dịch covid-19 |
| 549 | Official letter/Công văn | 2767/QLD-CL | The official letter 2767/QLD-CL dated March 23, 2020 Announcement of manufacturers meet requirements of GMP EU, PICs standards (Third list according to Circular 15) | Công bố cơ sở sản xuất đạt tiêu chuẩn PIC/S-GMP và EU-GMP (Theo thông tư 15-đợt 3) |
| 547 | Official letter/Công văn | 1592/BYT-TB-CT | The official letter 1592/BYT-TB-CT dated March 23, 2020 manufacturing and importing medical equipment/in-vitro diagnostic products for diagnosis of Corona virus (SARS-CoV-2). | Sản xuất, nhập khẩu trang thiết bị y tế/sinh phẩm chẩn đoán in vitro chẩn đoán vi rút Corona (SARS-CoV-2). |
| 546 | Official letter/Công văn | 1592/BYT-TB-CT | Official letter No. 1592/BYT-TB-CT dated March 25, 2020 about manufacturing and importing medical equipment/in-vitro diagnostic products for diagnosis of Corona virus (SARS-CoV-2).) | Công văn số 1592/BYT-TB-CT ngày 25 tháng 03 năm 2020 về việc sản xuất, nhập khẩu trang thiết bị y tế/sinh phẩm chuẩn đoán in vitro chẩn đoán virus Corona (SARS-CoV-2) |
| 544 | Integrated document/Văn bản hợp nhất | 01/VBHN-BYT | Consolidated documents Decree 36/2016, Decree 169/2018, Decree 03/2020 by The Gorvenment on Medical Equipment Management dated March 16, 2020 | Văn bản hợp nhất 01/VBHN-BYT năm 2020 hợp nhất Nghị định về quản lý trang thiết bị y tế do Bộ Y tế ban hành (Văn bản hợp nhất nghị định 36/2016, nghị định 169/2018, nghị dịnh 03/2020 của chính phủ về quản lý trang thiết bị y tế) |
| 543 | Official letter/Công văn | 2782/QLD-KD | The official letter 2782/QLD-KD dated March 23, 2020 ensuring adequate supply of drugs treat acute respiratory infections COVID-19 | Công văn 2782/QLD-KD ngày 23 tháng 3 năm 2020 đảm bảo cung ứng thuốc chống dịch bệnh viêm đường hô hấp cấp COVID-19 |
| 542 | Official letter/Công văn | 2647/QLD-ĐK | The official letter 2647/QLD-ĐK dated March 23, 2020 correcting, revising information in Decisions issuing Circulation Cirtificates, Temprory Extension letter | Đính chính thông tin trong Quyết định giấy ĐKLH, Công văn duy trì hiệu lực giấy ĐKLH |
| 541 | Decision/Quyết định | 1282/QĐ-BYT | Decision 1282/QD-BYT dated March 21, 2020 providing “provisional instructions for covid-19 testing” | Quyết định số 1282/QĐ-BYT ngày ngày 21 tháng 3 năm 2020 về việc ban hành “hướng dẫn tạm thời việc xét nghiệm COVID-19” |
| 539 | Official letter/Công văn | 2503/QLD-KD | Official letter No. 2503/QLD-KD dated March 17, 2020 on providing information on the list of drug suppliers for Covid-19 Vaccines | Công văn số 2503/QLD-KD ngày 17/3/2020 về việc cung cấp thông tin về danh mục các đơn vị cung ứng thuốc phòng Covid-19 |
| 538 | Official letter/Công văn | 2507/QLD-KD | The official letter 2507/QLD-KD dated March 17, 2020 ensuring adequate supply of drugs treat acute respiratory infections COVID-19 | Đảm bảo cung ứng thuốc chống dịch bệnh viêm đường hô hấp cấp COVID-19 |
| 537 | Official letter/Công văn | 2510/QLD-KD | The official letter 2510/QLD-KD dated March 17, 2020 report on the amount of inventory and the production and import of medicines to prevent and combat acute respiratory infections caused by COVID-19 | Báo cáo số lượng hàng tồn kho và tình hình sản xuất, nhập khẩu thuốc phòng, chống dịch viêm đường hô hấp cấp do COVID-19 gây ra |
| 536 | Official letter/Công văn | 1512/TCHQ-PC | The official letter 1512/TCHQ-PC dated March 11, 2020 guidance on handling imported products violating labelling regulations | Hướng dẫn xử lý hàng hóa nhập khẩu vi phạm về ghi nhãn |
| 535 | Official letter/Công văn | 2345/QLD-CL | The official letter 2345/QLD-CL dated March 12, 2020 supplementing document for Dossier requesting announcement of list of Bioequivalent product | Bổ sung hồ sơ công bố thuốc có chứng minh tương đương sinh học |
| 534 | Circular/Thông tư | 11/2020/TT-BTC | Circular No. 11/2020/TT-BTC dated February 20, 2020 amending a number of Articles of Circular No. 278/2016/TT-BTC providing for fees in medical sector and collection, transfer, management and use thereof | Thông tư 11/2020/TT-BTC sửa đổi Thông tư 278/2016/TT-BTC quy định về mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong lĩnh vực y tế do Bộ Tài chính ban hành |
| 533 | Decision/Quyết định | 774/QĐ-BYT | The Decision 774/QĐ-BYT dated March 04, 2020 issuing list of 02 invitro diagnostic bio-products for testing virus corona (SARS-CoV-2) granted registration number | Quyết định 774/QĐ-BYT năm 2020 về danh mục 02 sinh phẩm chẩn đoán invitro xét nghiệm vi rút Corona (SARS-CoV-2) được cấp số đăng ký do Bộ trưởng Bộ Y tế ban hành |
| 532 | Official letter/Công văn | 1974/QLD-CL | The official letter 1974/QLD-CL dated March 02, 2020 announcement of manufacturers meet requirements of GMP EU, PICs standards – Version 71 | Công bố cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP và EU-GMP (Đợt 71) |
| 531 | Official letter/Công văn | 1976/QLD-CL | The official letter 1976/QLD-CL dated March 02, 2020 announcement of manufacturers have not yet met requirements of GMP EU, PICs standards and request to supplement – Version 71 | Các hồ sơ đề nghị công bố cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP và EU-GMP không đạt yêu cầu và cần bổ sung giải trình (Đợt 71) |
| 530 | Official letter/Công văn | 1979/QLD-CL | The official letter 1979/QLD-CL dated March 02, 2020 announcement of manufacturers meet requirements of GMP EU, PICs standards (Second list according to Circular 15) | Công bố cơ sở sản xuất đạt tiêu chuẩn PIC/S-GMP và EU-GMP (Theo thông tư 15-đợt 2) |
| 529 | Decision/Quyết định | 336/QĐ-BYT | On the pilot implementation of Level 4 online public services with respect to procedures for licensing import of drugs without circulation registration Certificates in Vietnam | Quyết định 336/QĐ-BYT năm 2020 về triển khai thí điểm dịch vụ công trực tuyến mức độ 4 đối với thủ tục cấp phép nhập khẩu thuốc chưa có giấy đăng ký lưu hành tại Việt Nam do Bộ Y tế ban hành |
| 528 | Decision/Quyết định | 380/QĐ-BYT | PROMULGATING THE LIST OF 36 IN-VITRO diagnostic BIOLOGICALS with circulation registration number in Vietnam – Version 03 | Quyết định 380/QĐ-BYT năm 2020 về danh mục 36 sinh phẩm chẩn đoán invitro được cấp số đăng ký lưu hành tại Việt Nam – Đợt 03 do Bộ Y tế ban hành |
| 527 | Official letter/Công văn | 1727/QLD-ĐK | Correcting, revising information in Decisions issuing Circulation Cirtificates, Temprory Extension letter | Đính chính thông tin trong Quyết định giấy ĐKLH, Công văn duy trì hiệu lực giấy ĐKLH |
| 526 | Decision/Quyết định | 202/QĐ-SYT | Withdraw the receipt of announcement of standards for application of type-A medical equipment and production for non-water-hand disinfecting preparations | Thu hồi phiếu tiếp nhận công bố tiêu chuẩn áp dụng trang thiết bị y tế loại A và sản xuất đối với chế phẩm diệt khuẩn tay không dùng nước |
| 525 | Official letter/Công văn | 1710/QLD-KD | Official letter No. 1710/QLD-KD dated February 19, 2020 reporting on inventory quantity and production and import of drugs for prevention and control of acute respiratory infections caused by Covid-19. | Công văn số 1710/QLD-KD ngày 19 tháng 02 năm 2020 về việc báo cáo số lượng tồn kho và tình hình sản xuất, nhập khẩu thuốc phòng, chống dịch bệnh viêm đường hô hấp cấp do Covid-19 gây ra. |
| 523 | Official letter/Công văn | 1494/QLD-CL | Announcement of manufacturers meet requirements of GMP EU, PICs standards (the first list according to Circular 15) | Công bố cơ sở sản xuất đạt tiêu chuẩn PIC/S-GMP và EU-GMP (Theo thông tư 15-đợt 1) |
| 522 | Official letter/Công văn | 1512/QLD-ĐK | Correction, revision information in Decisions issuing list of Branded drugs applying for Bidding | Đính chính, điều chỉnh thông tin tại các Quyết định công bố danh mục thuốc biệt dược gốc |
| 521 | Circular/Thông tư | 03/2020/TT-BYT | Circular No. 03/2020/TT-BYT dated January 22, 2020 on amendments to Circular No. 11/2018/TT-BYT on quality of pharmaceutical products and pharmaceutical starting materials | Thông tư 03/2020/TT-BYT sửa đổi Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc do Bộ Y tế ban hành |
| 520 | Official letter/Công văn | 763/TCHQ-PC | Guidance to handling with goods With label violence | Công văn ngày 11 tháng 02 năm 2020 hướng dẫn xử lý hàng hóa nhập khẩu vi phạm về ghi nhãn |
| 519 | Decision/Quyết định | 155/QĐ-BYT | Quyết định 155/QĐ-BTC năm 2020 về Danh mục các mặt hàng được miễn thuế nhập khẩu phục vụ phòng, chống dịch viêm đường hô hấp cấp do chủng mới của virus Corona gây ra do Bộ Tài chính ban hành | |
| 518 | Official letter/Công văn | 939/QLD-KD | The official letter 939/QLD-KD ensuring adequate supply of drugs to prevent and combat acute respiratory infections caused by nCOV | Công văn số 939/QLD-KD đảm bảo cung ứng đủ thuốc phòng, chống dịch bệnh viêm đường hô hấp cấp do nCOV gây ra |
| 517 | Official letter/Công văn | 862/QLD-KD | Official Letter No. 862/QLD-KD dated January 31, 2020 on ensuring adequate supply of drugs for prevention and control of acute respiratory infections caused by nCOV. | Công văn số 862/QLD-KD ngày 31 tháng 01 năm 2020 về việc đảm bảo cung ứng đủ thuốc phòng, chống dịch bệnh viêm đường hô hấp cấp do nCOV gây ra. |
| 510 | BABE | List of BABE for tender | Cập nhật Danh mục BA-BE | |
| 509 | Decision/Quyết định | 207/QĐ-BYT | List of drugs with document approving bioequivalence – version 24 | Quyết định 207/QĐ-BYT năm 2020 công bố Danh mục thuốc có tài liệu chứng minh tương đương sinh học – Đợt 24 do Bộ Y tế ban hành |
| 508 | Decision/Quyết định | 322/BYT-QLD | Updating information of Decisions on list of drugs with document approving bioequivalence | Cập nhật một số thông tin tại các quyết định công bố danh mục thuốc có chứng minh tương đương sinh học |
| 507 | Official letter/Công văn | 03/QLD-ĐK | update information of registration Dossier for drug, drug material that submitted by hard copy to online system | Cập nhật thông tin hồ sơ đề nghị cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đã nộp trực tiếp bằng bản giấy tại Cục quản lý Dược vào hệ thống trực tuyến |
| 506 | Decree/Nghị định | 03/2020/NĐ-CP | Decree No. 03/2020/ND-CP dated January 01, 2020 amending Article 68 of the Government’s Decree No. 36/2016/ND-CP on medical device management amended by the Government’s Decree No. 169/2018/ND-CP | Nghị định 03/2020/NĐ-CP sửa đổi Điều 68 Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế đã được sửa đổi tại Nghị định 169/2018/NĐ-CP sửa đổi Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế |
| 505 | Official letter/Công văn | 4241/TĐC-QLCL | attn the question on handling goods with label violence | Công văn ngày 27 tháng 12 của Bộ Khoa Học công nghệ trả lời vướng mắc trong xử lý hàng hóa nhập khẩu vi phạm về ghi nhãn |
| 504 | Official letter/Công văn | 7550/BYT-TB-CT | deploying Public services level 04 of advertisement of medical devices | Triển khai dịch vụ công trực tuyến cấp độ 4 đối với 03 thủ tục hành chính về quảng cáo TTBYT |
| 503 | Official letter/Công văn | 21307/QLD-KD | Reporting on production, export, import of drug according to provision in Article 47 and Clause 21 Article 91, Decree 54/2017/NĐ-CP | Báo cáo tình hình sản xuất, xuất khẩu, nhập khẩu thuốc theo quy định tại Điều 47 và khoản 21 điều 91 Nghị định số 54/2017/NĐ-CP |
| 501 | Official letter/Công văn | 7685/TCHQ-GSQL | Declaring product number on imported medical devices | Khai mã sản phẩm trang thiết bị y tế nhập khẩu (chấp nhận giải trình sự khác nhau giữa tên sản phẩm, nhưng có cùng mã sản phẩm trên GPNK khi thông quan) |
| 500 | Other documents/Văn bản khác | List of PICS, ICH Authorities | Danh sách cơ quan quản lý dược các nước là thành viên PIC/s và ICH | |
| 499 | Other documents/Văn bản khác | List of SRA Authorities | Danh sách cơ quan quản lý Dược các nước thuộc danh sách SRA | |
| 497 | Official letter/Công văn | 19677/QLD-ĐK | update information on the online portal of DAV of extension registration dossier of MA of drug/drug raw material have submitted by hard copy. | Cập nhật thông tin hồ sơ đăng ký gia hạn giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đã nộp trực tiếp bằng bản giấy vào hệ thống trực tuyến |
| 495 | List of Branded PI | List of Branded PI verion 1 | Danh mục tờ hướng dẫn sử dụng các Biệt Dược gốc (Đợt 1) | |
| 494 | Decision/Quyết định | 5252/QĐ-BYT | Quyết định 5252/QĐ-BYT ngày 05 tháng 11 năm 2019 về việc triển khai dịch vụ công trực tuyến cấp độ 4 đối với 03 thủ tục hành chính thuộc lĩnh vực trang thiết bị y tế | |
| 493 | Decision/Quyết định | 5074/QD-BYT | Quyết định 5074/QĐ-BYT năm 2019 về áp dụng cơ chế một cửa quốc gia đối với 04 thủ tục hành chính thuộc lĩnh vực trang thiết bị y tế do Bộ trưởng Bộ Y tế ban hành | |
| 492 | Official letter/Công văn | 18438/QLD-CL | Tăng cường kiểm tra chất lượng thuốc chứa hoạt chất Alphachymotrypsin, men vi sinh (probiotic) không đảm bảo chất lượng trong quá trình lưu hành trên thị trường | |
| 491 | Official letter/Công văn | 16813/QLD-CL | Phát hiện thuốc chứa Ranitidine có chứa tạp chất NDMA vượt giới hạn cho phép | |
| 490 | Official letter/Công văn | 16814/QLD-CL | Recall drug with API Ranitidine containing NDMA impurities over limit allowed | Thu hồi thuốc chứa Ranitidine có chứa tạp chất NDMA vượt giới hạn cho phép |
| 489 | Official letter/Công văn | 16324/QLD-KD | Triển khai thí điểm công cụ xây dựng dữ liệu quốc gia về GCN Đủ điều kiện KDD và CCHN (lần 2) | |
| 488 | Decision/Quyết định | 4043/QĐ-BYT | Quyết định 4043/QĐ-BYT năm 2019 đính chính về nồng độ/hàm lượng và đơn vị tính của 02 thuốc và loại bỏ 11 thuốc khỏi Danh mục thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị, giá thuốc và khả năng cung cấp tại Phụ lục kèm theo Thông tư 03/2019/TT-BYT Danh mục thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị, giá thuốc và khả năng cung | |
| 487 | Circular/Thông tư | 26/2019/TT-BYT | Circular No. 26/2019/TT-BYT dated August 30, 2019 on list of orphan drugs | Thông tư 26/2019/TT-BYT quy định về Danh mục thuốc hiếm do Bộ trưởng Bộ Y tế ban hành |
| 486 | Circular/Thông tư | 24/2019/TT-BYT | Circular 24/2019/TT-BYT dated August 30, 2019 regulations on the management and use of food additives | Thông tư 24/2019/TT-BYT quy định về quản lý và sử dụng phụ gia thực phẩm do Bộ trưởng Bộ Y tế ban hành |
| 485 | Circular/Thông tư | 25/2019/TT-BYT | Circular 25/2019/TT-BYT on Traceability of food-related products under management of Ministry of Health | Thông tư 25/2019/TT-BYT quy định về truy xuất nguồn gốc sản phẩm thực phẩm thuộc lĩnh vực quản lý của Bộ Y tế |
| 483 | Decision/Quyết định | 3657/QĐ-BYT | PROMULGATING THE LIST OF 100 MEDICINES THAT HAVE HIGH MEDICAL AND ECONOMIC VALUES FOR CONCENTRATION OF DEVELOPMENT IN THE 2020-2030 PERIOD | Quyết định 3657/QĐ-BYT năm 2019 về Danh mục 100 dược liệu có giá trị y tế và kinh tế cao để tập trung phát triển giai đoạn 2020-2030 do Bộ trưởng Bộ Y tế ban hành |
| 482 | Official letter/Công văn | 13873/QLD-ĐK | Deploying online tool for announcement of medicinal materials | Triển khai công cụ công bố nguyên liệu làm thuốc trực tuyến |
| 481 | Official letter/Công văn | 4658/BYT-TB-CT | Guiding on procedure for importing Medical devices | Hướng dẫn thủ tục nhập khẩu Trang thiết bị y tế |
| 479 | Official letter/Công văn | 13431/QLD-MP | udpate regulation on substance used in cosmetics | cập nhật quy định về các chất dùng trong mỹ phẩm |
| 478 | Integrated document/Văn bản hợp nhất | 06/VBHN-BNNPTNT | Joint Circular 13 and 18 guiding on veterinary drug management | Văn bản hợp nhất 06/VBHN-BNNPTNT năm 2019 hợp nhất Thông tư quy định về quản lý thuốc thú y do Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn ban hành (Văn bản hợp nhất thông tư 13 thông tư 18 quy định về quản lý thuốc thú y) |
| 477 | Circular/Thông tư | 18/2019/TT-BYT | Circular 18/2019/TT-BYT dated July 17, 2019 guiding on Good Manufacturing Practices (GMP) in the production and trading of health supplements | Thông tư 18/2019/TT-BYT hướng dẫn Thực hành sản xuất tốt (GMP) trong sản xuất, kinh doanh thực phẩm bảo vệ sức khỏe do Bộ trưởng Bộ Y tế ban hành |
| 476 | Circular/Thông tư | 15/2019/TT-BYT | Circular No. 15/2019/TT-BYT dated July 11, 2019 providing guidance on bidding for supply of drugs for public health facilities | Thông tư 15/2019/TT-BYT quy định việc đấu thầu thuốc tại các cơ sở y tế công lập do Bộ trưởng Bộ Y tế ban hành |
| 475 | Circular/Thông tư | 12/2019/TT-BYT | Circular No. 12/2019/TT-BYT dated June 28, 2019 on annulment of certain legislative documents in health sector promulgated or co-promulgated by the Minister of Health | Thông tư 12/2019/TT-BYT bãi bỏ văn bản quy phạm pháp luật trong lĩnh vực y tế do Bộ trưởng Bộ Y tế ban hành, liên tịch ban hành |
| 474 | Official letter/Công văn | 3664/BYT-TB-CT | Implementing registration Medical Device Classification B, C, D | Thực hiện cấp đăng ký lưu hành đối với trang thiết bị y tế thuộc loại B, C, D. |
| 473 | Circular/Thông tư | 05/2019/TT-BKHCN | Circular No. 05/2019/TT-BKHCN dated June 26 2019 providing details of Decree 43/2017/ND-CP on good labels | Thông tư 05/2019/TT-BKHCN hướng dẫn Nghị định 43/2017/NĐ-CP về nhãn hàng hóa do Bộ trưởng Bộ Khoa học Công nghệ ban hành |
| 472 | Official letter/Công văn | 12575/QLD-GT | Deploying declaration of domestic drug price provision on Decree 155 | Triển khai xem xét kê khai lại giá thuốc sản xuất trong nước tại NĐ 155 |
| 471 | Official letter/Công văn | 9220/QLD-ĐK | notification of developing an online tool for maintaining the validity of visa number as per Circular No.32/2018/TT-BYT | Thông báo triển khai công cụ trực tuyến đề nghị duy trì hiệu lực số đăng ký lưu hành theo quy định tại thông tư số 32 |
| 469 | Circular/Thông tư | 08/2019-TT-BYT | Thông tư 08/2019/TT-BYT hướng dẫn tiêu chuẩn, định mức sử dụng máy móc, thiết bị chuyên dùng thuộc lĩnh vực y tế | |
| 468 | Official letter/Công văn | 7959/QLD-KD | guiding on periodic report vaccines have expired registration numbers but are still in non—expiry date and are circulating in the market | Báo cáo định kỳ vắc xin đã hết hiệu lực số đăng ký nhưng còn hạn dùng và đang lưu hành trên thị trường |
| 467 | Official letter/Công văn | 7735/QLD-KD | custom border gate for importing vaccines | Quy định về cửa khẩu nhập khẩu vắc xin |
| 466 | Official letter/Công văn | 7787/QLD-CL | guiding on recall and destruction vaccines | Hướng dẫn việc thu hồi và tiêu hủy vắc xin |
| 464 | Decision/Quyết định | 1899/QĐ-BYT | on the announcement of the list of conditions for business investment and the list of specialized products and goods under the state management of the Ministry of Health | Quyết định 1899/QĐ-BYT năm 2019 công bố Danh mục điều kiện đầu tư kinh doanh và danh mục sản phẩm, hàng hóa kiểm tra chuyên ngành thuộc phạm vi quản lý nhà nước của Bộ Y tế |
| 462 | Official letter/Công văn | 229/YDCT-QLHN | Hướng dẫn cấp, cấp lại Giấy chứng nhận bài thuốc gia truyền, phương pháp chữa bệnh gia truyền | |
| 460 | Official letter/Công văn | 5853/QLD-CL | about quality control of drug raw material sartan group | về việc kiểm tra chất lượng nguyên liệu làm thuốc nhóm sartan |
| 459 | Official letter/Công văn | 1234/TB-ATTP | guiding on supplementation GMP on registration, announcement dossier of health protection food | Hướng dẫn bổ sung giấy chứng nhận cơ sở đủ điều kiện ATTP đạt yêu cầu GMP trong SX, kinh doanh và đăng ký bản công bố sản phẩm TPBVSK |
| 458 | Official letter/Công văn | 5320/QLD-ĐK | Informing deployment of online tool which suggested correcting the information in the decision to issue registration certification for circulation of drugs and drug raw materials | Thông báo triển khai công cụ trực tuyến đề nghị đính chính thông tin trong quyết định cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc |
| 457 | Integrated document/Văn bản hợp nhất | 10/VBHN-BYT | Văn bản hợp nhất 10/VBHN-BYT năm 2019 hợp nhất Nghị định về quản lý hóa chất, chế phẩm diệt côn trùng, diệt khuẩn dùng trong lĩnh vực gia dụng và y tế do Bộ Y tế ban hành (Văn bản hợp nhất nghị định 91/2016 và nghị định 155/2018) | |
| 456 | Integrated document/Văn bản hợp nhất | 08/VBHN-BYT | Regulate the manufacturing and trading condition in the field covered by the Ministry of Health | Văn bản hợp nhất 08/VBHN-BYT năm 2019 hợp nhất Nghị định quy định về điều kiện sản xuất, kinh doanh thực phẩm thuộc lĩnh vực quản lý chuyên ngành của Bộ Y tế (Văn bản hợp nhất nghị định 67/2016 và nghị định 155/2018) |
| 455 | Integrated document/Văn bản hợp nhất | 09/VBHN-BYT | Văn bản hợp nhất 09/VBHN-BYT năm 2019 hợp nhất Nghị định hướng dẫn Luật an toàn thực phẩm do Bộ Y tế ban hành (Văn bản hợp nhất Nghị định 15/2018 và nghị định 155/2018) | |
| 454 | Decision/Quyết định | 1181/QĐ-BYT | Quyết định 1181/QĐ-BYT năm 2019 công bố thủ tục hành chính mới/ bị bãi bỏ trong lĩnh vực an toàn thực phẩm và dinh dưỡng thuộc phạm vi chức năng quản lý của Bộ Y tế | |
| 453 | Circular/Thông tư | 05/2019/TT-BYT | Circular No. 05/2021/TT-BYT dated May 5, 2021 on regulating implementation of practices of democracy in activities of public medical establishments | Thông tư 05/2019/TT-BYT bãi bỏ Thông tư 31/2017/TT-BYT về Danh mục sản phẩm, hàng hóa có khả năng gây mất an toàn thuộc phạm vi được phân công quản lý của Bộ Y tế |
| 452 | Circular/Thông tư | 03/2019/TT-BYT | Thông tư 03/2019/TT-BYT về Danh mục thuốc sản xuất trong nước đáp ứng yêu cầu về điều trị, giá thuốc và khả năng cung cấp do Bộ trưởng Bộ Y tế ban hành | |
| 451 | Official letter/Công văn | 3583/QLD-GT | Deploying online service level 4 on declaration and re-declaration of drug prices | Triển khai dịch vụ công trực tuyến mức độ 4 về kê khai, kê khai lại giá thuốc |
| 448 | Official letter/Công văn | 2396/QLD-ĐK | Requirements of origin of drug formulas for generic drug | Yêu cầu về xuất xứ công thức đối với thuốc Generics |
| 447 | Official letter/Công văn | 1968/QLD-ĐK | Informing the deployment of a tool to search for circulation registration certification (Marketing Authorization) of drug/drug raw materials on the website of the Drug Administration of Vietnam | thông báo triển khai công cụ tra cứu giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc trên website của Cục quản lý Dược |
| 446 | Integrated document/Văn bản hợp nhất | 03/VBHN-BYT | Joint Decree of Decree 36 and Decree 169 on Medical Equipment Management | Văn bản hợp nhất 03/VBHN-BYT năm 2019 hợp nhất Nghị định về quản lý trang thiết bị y tế do Bộ Y tế ban hành |
| 445 | Decision/Quyết định | 37/QD-QLD | About withdrawing registration numbers of drug containing Cefterol circulating in Vietnam | Về việc rút số đăng ký lưu hành thuốc chứa hoạt chất Cefterol lưu hành tại Việt Nam |
| 444 | Official letter/Công văn | 885/QLD-ĐK | registration and import orders of drugs containing Sulfaguanidin; Drugs containing single-ingredient Ephedrine oral administration and drugs containing the active substance Nitroglycerin oral administration | đăng ký, nhập khẩu đơn hàng các thuốc chứa hoạt chất Sulfaguanidin; các thuốc chứa hoạt chất Ephedrin đơn thành phần dùng đường uống và các thuốc chứa hoạt chất Nitroglycerin dùng đường uống |
| 443 | Official letter/Công văn | 888/QLD-ĐK | Registration, import Orders of drug containing paracetamol modified release | đăng ký, nhập khẩu đơn hàng thuốc chứa hoạt chất paracetamol dạng giải phóng biến đổi |
| 442 | Official letter/Công văn | 889/QLD-ĐK | Update pharmcological information of drug containing Diacerein | Cập nhật thông tin dược lý đối với thuốc chứa Diacerein |
| 440 | Official letter/Công văn | 757/QLD-ĐK | Update Package insert of drug containing Phospholipid soy bean | Cập nhật thông tin hướng dẫn sử dụng của thuốc chứa Phospholipid đậu nành |
| 438 | Decision/Quyết định | 73/QĐ-BYT | about imroving implementation plan of Decree 169/2018/NĐ-CP on amending, revising some articles of Decree 36 about medical equipment management | Về việc phê duyệt kế hoạch triển khai nghị định số 169/2018/NĐ-CP ngày 31/12/2018 của chính phủ sửa đổi, bổ sung một số điều của nghị định số 36 về quản lý trang thiết bị y tế |
| 437 | Official letter/Công văn | 14/BYT-TB-CT | About deploying Decree 169/2018/NĐ-CP dated December 31, 2018 on Medical Equipment Management | triển khai nghị định số 169/2018/NĐ-CP ngày 31/12/2018 của chính phủ |
| 436 | Official letter/Công văn | 15/BYT-TB-CT | About deploying Decree 169/2018/NĐ-CP dated December 31, 2018 on Medical Equipment Management | triển khai nghị định số 169/2018/NĐ-CP ngày 31/12/2018 của chính phủ |
| 435 | Official letter/Công văn | 16/BYT-TB-CT | About deploying Decree 169/2018/NĐ-CP dated December 31, 2018 on Medical Equipment Management | triển khai nghị định số 169/2018/NĐ-CP ngày 31/12/2018 của chính phủ |
| 434 | Other documents/Văn bản khác | Price Declaration | Cập nhật Kê khai giá | |
| 433 | Decree/Nghị định | 169/2018/NĐ-CP | Decree No. 169/2018/ND-CP dated December 31, 2018 amendments to Decree No. 36/2016/ND-CP on medical device management | Nghị định 169/2018/NĐ-CP sửa đổi Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế |
| 432 | Decision/Quyết định | 7867/QĐ-BYT | Announcing newly promulgated / amended, supplemented / replaced administrative procedures in the pharmaceutical sector under the management of the Ministry of Health | Công bố thủ tục hành chính mới ban hành/được sửa đổi, bổ sung/thay thế/bị bãi bỏ trong lĩnh vực Dược phẩm thuộc phạm vi chức năng quản lý của Bộ Y tế |
| 431 | Official letter/Công văn | 20426/QLD-Ttra | Provisional guidance on the implementation of interconnection of data of drug retail establishments | Hướng dẫn tạm thời việc triển khai kết nối liên thông dữ liệu liên thông cơ sở bán lẻ thuốc |
| 430 | Decision/Quyết định | 7868/QĐ-BYT | Defining the functions, tasks, powers and organizational structure of the Ministry of Health | Quyết định 7868/QĐ-BYT năm 2018 quy định về chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Cục Quản lý dược thuộc Bộ Y tế |
| 429 | Decision/Quyết định | 7866/QĐ-BYT | Announcing newly promulgated / amended and supplemented administrative procedures in the cosmetics sector under the management of the Ministry of Health | Công bố thủ tục hành chính mới ban hành/được sửa đổi, bổ sung trong lĩnh vực mỹ phẩm thuộc phạm vi chức năng quản lý của Bộ Y tế |
| 428 | Decision/Quyết định | 7757/QĐ-BYT | Declaration of List of Procedures in-valid until December 31, 2018 | Quyết định 7757/QĐ-BYT công bố Danh mục văn bản quy phạm pháp luật hết hiệu lực toàn bộ hoặc một phần thuộc lĩnh vực quản lý nhà nước của Bộ Y tế đến 31 tháng 12 năm 2018 |
| 427 | Circular/Thông tư | 37/2018/TT-BYT | Circular 37/2018/TT-BYT dated November 30, 2018 regulating on the maximum price for medical examination and treatment services not covered by the Health Insurance Fund in the state medical examination and treatment facilities and guiding the application of prices and payment of examination and treatment expenses in some cases. | Thông tư 37/2018/TT-BYT quy định mức tối đa khung giá dịch vụ khám bệnh, chữa bệnh không thuộc phạm vi thanh toán của Quỹ bảo hiểm y tế trong cơ sở khám bệnh, chữa bệnh của Nhà nước và hướng dẫn áp dụng giá, thanh toán chi phí khám bệnh chữa bệnh trong một số trường hợp do Bộ trưởng Bộ Y tế ban hành |
| 426 | Circular/Thông tư | 39/2018/TT-BYT | Circular 39/2018/TT-BYT dated November 30, 2018 regulating on unifying prices of medical examination and treatment services for health insurance among hospitals nationwide and guide the application of prices and payment of medical examination and treatment expenses in some cases. | Thông tư 39/2018/TT-BYT quy định thống nhất giá dịch vụ khám bệnh, chữa bệnh bảo hiểm y tế giữa các bệnh viện cùng hạng trên toàn quốc và hướng dẫn áp dụng giá, thanh toán chi phí khám bệnh, chữa bệnh trong một số trường hợp do Bộ trưởng Bộ Y tế ban hành |
| 425 | Decision/Quyết định | 48/2018/QĐ-TTg | Decision 48/2018/QĐ-TTg dated November 29, 2018 rejected Decision No. 54/2014/QĐ-TTG of September 19, 2014 on the import tax exemption for imported components for manufacturing and assembling medical equipment for requirements priority study, creative | Quyết định 48/2018/QĐ-TTg bãi bỏ Quyết định 54/2014/QĐ-TTg về miễn thuế nhập khẩu đối với linh kiện nhập khẩu để sản xuất, lắp ráp sản phẩm trang thiết bị y tế cần được ưu tiên nghiên cứu, chế tạo do Thủ tướng Chính phủ ban hành |
| 424 | Circular/Thông tư | 117/2018/TT-BTC | Circular 117/2018/TT-BTC dated November 28, 2018 revising, amending some articles of Circular 279 on the rates, the regime of collection, remittance, management and use of charges in food safety and hygiene work | Thông tư 117/2018/TT-BTC sửa đổi Thông tư 279/2016/TT-BTC quy định mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong công tác an toàn vệ sinh thực phẩm do Bộ trưởng Bộ Tài chính ban hành |
| 423 | Official letter/Công văn | 777/QĐ-QLD | promulgating the “data connection standard for information technology application interconnection drug retail software” version 1.0 | về việc ban hành “chuẩn kết nối dữ liệu phần mềm ứng dụng công nghệ thông tin kết nối liên thông cơ sở bán lẻ thuốc” phiên bản 1.0 |
| 422 | Circular/Thông tư | 36/2018/TT-BYT | Circular 36/2018/TT-BYT dated November 22, 2018 regulating on Good Storage Practices | Thông tư 36/2018/TT-BYT quy định về Thực hành tốt bảo quản thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành |
| 421 | Circular/Thông tư | 35/2018/TT-BYT | Circular 35/2018/TT-BYT dated November 22, 2018 regulating on Good Manufacturing Practices | Thông tư 35/2018/TT-BYT quy định về Thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành |
| 420 | Circular/Thông tư | 34/2018/TT-BYT | Circular 34/2018/TT-BYT dated November 16, 2018 regulating and details a number of articles of Decree 104/2016/NĐ-CP dated July 01, 2016 by Government regulating on vaccination activities | Thông tư 34/2018/TT-BYT hướng dẫn Nghị định 104/2016/NĐ-CP quy định về hoạt động tiêm chủng do Bộ trưởng Bộ Y tế ban hành |
| 419 | Circular/Thông tư | 18/2018/TT-BNNPTNT | Circular No. 18/2018/TT-BNNPTNT dated November 15, 2018 on amending and repealing Circular No. 13/2016/TT-BNNPTNT on veterinary drug management | Thông tư 18/2018/TT-BNNPTNT sửa đổi Thông tư 13/2016/TT-BNNPTNT quy định về quản lý thuốc thú y do Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn ban hành |
| 418 | Circular/Thông tư | 43/2018/TT-BCT | Circular 43/2018/TT-BCT dated November 15, 2018 regulating on food safety management under the responsibility of the Ministry of Industry and Trade | Thông tư 43/2018/TT-BCT quy định về quản lý an toàn thực phẩm thuộc trách nhiệm của Bộ Công thương |
| 417 | Circular/Thông tư | 32/2018/TT-BYT | Circular No. 32/2018/TT-BYT dated November 12, 2018 marketing authorization of drugs and medicinal ingredients | Thông tư 32/2018/TT-BYT quy định việc đăng ký lưu hành thuốc, nguyên liệu thuốc do Bộ trưởng Bộ Y tế ban hành |
| 416 | Decree/Nghị định | 155/2018/NĐ-CP | Decree 155/2018/NĐ-CP dated November 12, 2018 amending and supplementing a number of provisions relating to the conditions for business investment under the state management section of the Ministry of Health | Sửa đổi, bổ sung một số quy định liên quan đến điều kiện đầu tư kinh doanh thuộc phạm vi quản lý nhà nước của bộ y tế |
| 415 | Circular/Thông tư | 30/2018/TT-BYT | Circular 30/2018/TT-BYT dated October 30, 2018 issuing list, rates and conditions for payment of pharmaco-chemical medicines, biologicals, radioactive drugs and markers eligible for health insurance participants. | Thông tư 30/2018/TT-BYT về danh mục và tỷ lệ, điều kiện thanh toán đối với thuốc hóa dược, sinh phẩm, thuốc phóng xạ và chất đánh dấu thuộc phạm vi được hưởng của người tham gia bảo hiểm y tế do Bộ trưởng Bộ Y tế ban hành |
| 414 | Circular/Thông tư | 31/2018/TT-BYT | Circular 31/2018/TT-BYT dated October 30, 2018 regulating the implementation of patient assistance programs for drugs sponsored by pharmaceutical business establishments to medical service establishment for the treatment of patients | Thông tư 31/2018/TT-BYT quy định về thực hiện chương trình hỗ trợ thuốc miễn phí cho cơ sở khám bệnh, chữa bệnh để điều trị cho người bệnh do Bộ trưởng Bộ Y tế ban hành |
| 413 | Circular/Thông tư | 29/2018/TT-BYT | Circular 29/2018/TT-BYT dated October 29, 2018 guiding Drug Clinical trial | Thông tư 29/2018/TT-BYT quy định về thử thuốc trên lâm sàng do Bộ trưởng Bộ Y tế ban hành |
| 412 | Circular/Thông tư | 27/2018/TT-BYT | Circular 27/2018/TT-BYT dated October 26, 2018 guiding on implementation of health insurance and examination, treatment related to HIV/AIDS | Thông tư 27/2018/TT-BYT hướng dẫn thực hiện bảo hiểm y tế và khám bệnh, chữa bệnh liên quan đến HIV/AIDS do Bộ trưởng Bộ Y tế ban hành |
| 411 | Official letter/Công văn | 6264/BYT-VPB6 | Update list of administrative procedures in field of Medical equipment and construction | cập nhật danh mục TTHC thuộc lĩnh vực Trang thiết bị và Công trình y tế |
| 410 | Official letter/Công văn | 6269/BYT-VPB6 | Update list of administrative procedures in field of Food Supplement | cập nhật danh mục TTHC thuộc lĩnh vực An toàn thực phẩm và dinh dưỡng |
| 409 | Official letter/Công văn | 6265/BYT-VPB6 | Update list of administrative procedures in field of Cosmetic | cập nhật danh mục TTHC thuộc lĩnh vực Mỹ phẩm. |
| 408 | Decree/Nghị định | 146/2018/NĐ-CP | Decree 146/2018/NĐ-CP dated October 17, 2018 about detailing and guiding on measures for the implementation of a number of articles of health insurance Law | Nghị định 146/2018/NĐ-CP hướng dẫn Luật bảo hiểm y tế |
| 407 | Circular/Thông tư | 23/2018/TT-BYT | Circular 23/2018/TT-BYT dated September 14, 2018 about recall and handing of foods without safety covered by The Ministry of Health | Thông tư 23/2018/TT-BYT quy định về thu hồi và xử lý thực phẩm không bảo đảm an toàn thuộc thẩm quyền quản lý của Bộ Y tế |
| 406 | Circular/Thông tư | 21/2018/TT-BYT | Circular 21/2018/TT-BYT dated September 12, 2018 about guiding on registration for circulation of traditional medicine and pharmaceutical herbal ingredient. | Thông tư 21/2018/TT-BYT quy định về đăng ký lưu hành thuốc cổ truyền, dược liệu do Bộ trưởng Bộ Y tế ban hành |
| 405 | Circular/Thông tư | 22/2018/TT-BYT | Circular 22/2018/TT-BYT dated September 12, 2018 about promulgating list of functional foods for children under 6 years old is subject to the price declaration | Thông tư 22/2018/TT-BYT quy định về danh mục thực phẩm chức năng dành cho trẻ em dưới 06 tuổi thuộc diện kê khai giá do Bộ trưởng Bộ Y tế ban hành |
| 404 | Decree/Nghị định | 115/2018/NĐ-CP | Decree No. 115/2018/ND-CP dated September 04, 2018 on penalties for administrative violations against regulations on food safety | Nghị định 115/2018/NĐ-CP quy định xử phạt vi phạm hành chính về an toàn thực phẩm |
| 403 | Circular/Thông tư | 19/2018/TT-BYT | Circular No. 19/2018/TT-BYT dated August 30, 2018 introducing list of essential medicines | Thông tư 19/2018/TT-BYT về danh mục thuốc thiết yếu do Bộ trưởng Bộ Y tế ban hành |
| 402 | Circular/Thông tư | 18/2018/TT-BYT | Thông tư 18/2018/TT-BYT sửa đổi Thông tư 52/2017/TT-BYT về đơn thuốc và kê đơn thuốc hóa dược, sinh phẩm trong điều trị ngoại trú do Bộ trưởng Bộ Y tế ban hành | |
| 401 | Official letter/Công văn | 540/QĐ-QLD | The Decision 540/QĐ-QLD dated August 20, 2018 about issuing “Standardized output data software applied information technology connection interconnected drug retail establishments” version 1.0 | Về việc ban hành “chuẩn dữ liệu đầu ra phần mềm ứng dụng công nghệ thông tin kết nối liên thông cơ sở bán lẻ thuốc” Phiên bản 1.0 |
| 399 | Official letter/Công văn | 4196/BYT-TB-CT | The official letter 4196/BYT-TB-CT dated July 23, 2018 about implementation of extension the validity of import license of Medical devices | Thực hiện điều chỉnh hiệu lực giấy phép Nhập khẩu trang thiết bị y tế |
| 398 | Official letter/Công văn | 12952/QLD-KD | The official letter 12952/QLD-KD dated July 06, 2018 about adding ranges of special control drug on Certificate of Trading Eligibility | Bổ sung phạm vi kinh doanh thuốc phải kiểm soát đặc biệt |
| 391 | Circular/Thông tư | 14/2018/TT-BYT | Circular No. 14/2018/TT-BYT dated May 15, 2018 promulgating the nomenclature of medical equipment whose HS codes have been assigned in the Vietnam’s nomenclature of exports and imports | Thông tư 14/2018/TT-BYT về danh mục trang thiết bị y tế được xác định mã số hàng hóa theo danh mục hàng hóa xuất khẩu, nhập khẩu Việt Nam do Bộ trưởng Bộ Y tế ban hành |
| 390 | Circular/Thông tư | 13/2018/TT-BYT | Circular No. 13/2018/TT-BYT dated May 15, 2018 quality of herbal ingredidents and traditional drugs | Thông tư 13/2018/TT-BYT quy định về chất lượng dược liệu, thuốc cổ truyền do Bộ trưởng Bộ Y tế ban hành |
| 389 | Circular/Thông tư | 11/2018/TT-BYT | Circular No. 11/2018/TT-BYT dated May 4, 2018 on Drug/Drug Ingredient Quality | Thông tư 11/2018/TT-BYT quy định về chất lượng thuốc, nguyên liệu làm thuốc do Bộ Y tế ban hành |
| 386 | Circular/Thông tư | 09/2018/TT-BYT | Circular No. 09/2018/TT-BYT dated April 27, 2018 promulgating the List of Insecticidal and Germicidal Chemicals and Preparations for household and medical use which are under the state management of the Ministry of Health and whose HS codes can be indentified according to Vietnam’s Nomenclature of Exports and Imports | Thông tư 09/2018/TT-BYT về Danh mục hóa chất, chế phẩm diệt côn trùng, diệt khuẩn dùng trong gia dụng và y tế thuộc lĩnh vực quản lý nhà nước của Bộ Y tế được xác định mã số hàng hóa theo Danh mục hàng hóa xuất khẩu, nhập khẩu Việt Nam do Bộ trưởng Bộ Y tế ban hành |
| 380 | Circular/Thông tư | 07/2018/TT-BYT | Circular No. 07/2018/TT-BYT dated April 12, 2018 on guidelines on pharmacy business of the Law on Pharmacy and the Decree 54/2017/ND-CP | Thông tư 07/2018/TT-BYT hướng dẫn về kinh doanh dược của Luật dược và Nghị định 54/2017/NĐ-CP hướng dẫn Luật dược do Bộ Y tế ban hành |
| 379 | Official letter/Công văn | 6151/QLD-ĐK | Nguyên liệu làm thuốc công bố được nhập khẩu không cần giấy phép nhập khẩu (cách ghi tên nguyên liệu, thay đổi thông tin liên quan đến thuốc thành phẩm) | |
| 378 | Circular/Thông tư | 06/2018/TT-BYT | Circular No. 06/2018/TT-BYT dated April 06, 2018 promulating the nomenclature of imported and exported drugs and medicinal ingredients for human use and cosmetics whose HS codes have been assigned in the Vietnam’s nomenclature of exports and imports | Thông tư 06/2018/TT-BYT về Danh mục thuốc, nguyên liệu làm thuốc dùng cho người và mỹ phẩm xuất khẩu, nhập khẩu được xác định mã số hàng hóa theo Danh mục hàng hóa xuất khẩu, nhập khẩu Việt Nam do Bộ Y tế ban hành |
| 377 | Decision/Quyết định | 2318/QĐ-BYT | Quyết định 2318/QĐ-BYT năm 2018 công bố thủ tục hành chính mới/ bị bãi bỏ lĩnh vực an toàn thực phẩm và dinh dưỡng thuộc phạm vi chức năng quản lý của Bộ Y tế | |
| 376 | Circular/Thông tư | 05/2018/TT-BYT | Circular No. 05/2018/TT-BYT dated April 05,2018 promulgating the Nomenclature of foods, food additives, food processing aids, and food implements, packaging and containers whose HS codes have been assigned in the Vietnam’s Nomenclature of exports and imports | Thông tư 05/2018/TT-BYT về Danh mục thực phẩm, phụ gia thực phẩm, chất hỗ trợ chế biến thực phẩm và dụng cụ, vật liệu bao gói, chứa đựng thực phẩm được xác định mã số hàng hóa theo Danh mục hàng hóa xuất khẩu, nhập khẩu Việt Nam do Bộ trưởng Bộ Y tế ban hành |
| 375 | Circular/Thông tư | 05/2018/TT-BCT | Circular No. 05/2018/TT-BCT dated April 3, 2018 on origin of goods | Thông tư 05/2018/TT-BCT quy định về xuất xứ hàng hóa do Bộ trưởng Bộ Công Thương ban hành |
| 370 | Circular/Thông tư | 04/2018/TT-BYT | Circular No. 04/2018/TT-BYT dated February 09, 2018 on Good Laboratory Practice | Thông tư 04/2018/TT-BYT về quy định Thực hành tốt phòng thí nghiệm do Bộ Y tế ban hành |
| 369 | Circular/Thông tư | 03/2018/TT-BYT | Circular No. 03/2018/TT-BYT dated February 09, 2018 Good Distribution Practices for pharmaceutical products and pharmaceutical starting materials | Thông tư 03/2018/TT-BYT quy định về Thực hành tốt phân phối thuốc, nguyên liệu làm thuốc do Bộ trưởng Bộ Y tế ban hành |
| 367 | Circular/Thông tư | 02/2018/TT-BYT | Circular No. 02/2018/TT-BYT dated January 22, 2018 on Good Pharmacy Practices | Thông tư 02/2018/TT-BYT quy định về Thực hành tốt cơ sở bán lẻ thuốc do Bộ trưởng Bộ Y tế ban hành |
| 366 | Circular/Thông tư | 01/2018/TT-BYT | Circular No. 01/2018/TT-BYT dated January 18, 2018 on labeling and package inserts of drugs and medicinal ingredients | Thông tư 01/2018/TT-BYT về quy định ghi nhãn thuốc, nguyên liệu làm thuốc và tờ hướng dẫn sử dụng thuốc do Bộ trưởng Bộ Y tế ban hành |
| 363 | Circular/Thông tư | 50/2017/TT-BYT | Thông tư 50/2017/TT-BYT về sửa đổi quy định liên quan đến thanh toán chi phí khám bệnh, chữa bệnh do Bộ trưởng Bộ Y tế ban hành | Circular No. 50/2017/TT-BYT dated December 29, 2017 amending and supplementing regulations on reimbursement of costs of covered medical services |
| 362 | Circular/Thông tư | 56/2017/TT-BYT | Circular No. 56/2017/TT-BYT dated December 29, 2017 guidelines for some articles on health of the Law on social insurance and the Law on occupational safety and hygiene | Thông tư 56/2017/TT-BYT về hướng dẫn Luật bảo hiểm xã hội và Luật an toàn vệ sinh lao động thuộc lĩnh vực y tế do Bộ trưởng Bộ Y tế ban hành |
| 355 | Decision/Quyết định | 3105/QĐ-BHXH | Quyết định 3105/QĐ-BHXH năm 2017 về Quy định việc tham gia đấu thầu thuốc của cơ quan Bảo hiểm xã hội tại các cơ sở y tế do Bảo hiểm xã hội Việt Nam ban hành | |
| 354 | Circular/Thông tư | 46/2017/TT-BYT | Circular No. 46/2017/TT-BYT dated December 15, 2017 guidelines 36/2016/ND-CP on management of medical equipment | Thông tư 46/2017/TT-BYT hướng dẫn Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế do Bộ trưởng Bộ Y tế ban hành |
| 350 | Decision/Quyết định | 5358/QĐ-BYT | Quyết định 5358/QĐ-BYT năm 2017 về Dược điển Việt Nam V do Bộ trưởng Bộ Y tế ban hành | |
| 348 | Circular/Thông tư | 43/2017/TT-BYT | Thông tư 43/2017/TT-BYT về quy định tỷ lệ hao hụt đối với vị thuốc cổ truyền và việc thanh toán chi phí hao hụt tại các cơ sở khám bệnh, chữa bệnh do Bộ trưởng Bộ Y tế ban hành | |
| 344 | Circular/Thông tư | 42/2017/TT-BYT | Thông tư 42/2017/TT-BYT về Danh mục dược liệu độc làm thuốc do Bộ trưởng Bộ Y tế ban hành | |
| 342 | Circular/Thông tư | 114/2017/TT-BTC | Thông tư 114/2017/TT-BTC về sửa đổi Biểu mức thu phí trong lĩnh vực dược, mỹ phẩm kèm theo Thông tư 277/2016/TT-BTC quy định mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong lĩnh vực dược, mỹ phẩm do Bộ trưởng Bộ Tài chính ban hành | |
| 334 | Circular/Thông tư | 30/2017/TT-BYT | Circular No. 30/2020/TT-BYT dated December 31, 2020 on elaborating to Decree No. 146/2018/ND-CP on elaborating to Law on Health Insurance | Thông tư 30/2017/TT-BYT về hướng dẫn phương pháp chế biến các vị thuốc cổ truyền do Bộ trưởng Bộ Y tế ban hành |
| 330 | Decision/Quyết định | 62/QD-K2DT | Decision No. 62/QD-K2DT dated June 02, 2017 promulgating guideline on recording, management and reporting of afverse events and serious adverse events in clinical trials in Vietnam | Quyết định 62/QĐ-K2ĐT năm 2017 Hướng dẫn về ghi nhận, xử trí và báo cáo các biến cố bất lợi, biến cố bất lợi nghiêm trọng trong nghiên cứu thử nghiệm lâm sàng tại Việt Nam do Cục trưởng Cục Khoa học công nghệ và Đào tạo ban hành |
| 329 | Official letter/Công văn | 6922/QLD-ĐK | Updates pharmacological information for drugs containing Testosterone | cập nhật thông tin dược lý đối với thuốc chứa Testosteron |
| 328 | Circular/Thông tư | 20/2017/TT-BYT | Circular No. 20/2017/TT-BYT dated May 10, 2017, elaborating some Articles on controlled drugs and medicinal ingredients of the Law on Pharmacy and the Government’s Decree No. 54/2017/ND-CP | Thông tư 20/2017/TT-BYT về hướng dẫn Luật dược và Nghị định 54/2017/NĐ-CP về thuốc và nguyên liệu làm thuốc phải kiểm soát đặc biệt do Bộ trưởng Bộ Y tế ban hành |
| 326 | Circular/Thông tư | 07/2017/TT-BYT | Circular No. 07/2017/TT-BYT dated May 03, 2017, promulgation of List of OTC drugs | Thông tư 07/2017/TT-BYT Danh mục thuốc không kê đơn do Bộ trưởng Bộ Y tế ban hành |
| 325 | Circular/Thông tư | 06/2017/TT-BYT | Circular No. 06/2017/TT-BYT dated May 03, 2017, promulgating List of Toxic Drugs and Toxic Medicinal Ingredients | Thông tư 06/2017/TT-BYT Danh mục thuốc độc và nguyên liệu độc làm thuốc do Bộ trưởng Bộ Y tế ban hành |
| 324 | Official letter/Công văn | 5748/QLD-ĐK | Updating pharmacology information of fluoroquinolone antibacterial drugs | cập nhật thông tin dược lý đối với thuốc chứa kháng sinh nhóm fluoroquinolon |
| 323 | Official letter/Công văn | 5749/QLD-ĐK | updating Package insert of non-aspirin nonsteroidal anti-inflammatory drugs (NSAIDs) | cập nhật hướng dẫn sử dụng thuốc chống viêm không steroid (NSAIDS) và không phải aspirin |
| 322 | Official letter/Công văn | 5750/QLD-ĐK | update the pharmacology information of Hydroxyzine-containing drugs | Cập nhật thông tin dược lý đối với thuốc chứa hoạt chất hydroxyzin |
| 321 | Official letter/Công văn | 5751/QLD-ĐK | Cập nhật thông tin dược lý đối với thuốc chứa Warfarin | |
| 320 | Decree/Nghị định | 43/2017/NĐ-CP | Decree No. 43/2017/ND-CP dated April 14th, 2017, on good labels | Nghị định 43/2017/NĐ-CP về nhãn hàng hóa |
| 318 | Official letter/Công văn | 4533/QLD-ĐK | Đăng ký, nhập khẩu đơn hàng thuốc chứa phối hợp Domperidone với Ranitidin | |
| 317 | Official letter/Công văn | 4040/QLD-TT | Provide the safety information of Levonorgestrel-containing emergency contraceptives, Direct acting antiviral drugs (DAA) for the treatment of hepatitis C, Warfarin-containing drugs | cung cấp thông tin liên quan đến tính an toàn của thuốc tránh thai khẩn cấp chứa levonorgestrel, thuốc kháng vi rút tác động trực tiếp (DAA) điều trị viêm gan siêu vi C, thuốc chứa warfarin |
| 311 | Decision/Quyết định | 7115/QĐ-BYT | Quyết định 7115/QĐ-BYT năm 2016 về Quy trình thanh tra trang thiết bị y tế do Bộ trưởng Bộ Y tế ban hành | |
| 309 | Circular/Thông tư | 277/2016/TT-BTC | Circular No. 277/2016/TT-BTC dated November 14, 2016, on amounts, collection, payment, management and use of fees in the fields of pharmacy and cosmetics | Thông tư 277/2016/TT-BTC quy định mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong lĩnh vực dược, mỹ phẩm do Bộ trưởng Bộ Tài chính ban hành |
| 308 | Circular/Thông tư | 278/2016/TT-BTC | Circular No. 278/2016/TT-BTC dated November 14, 2016, providing for fees in medical sector, and the collection, transfer, management and use thereof | Thông tư 278/2016/TT-BTC quy định mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong lĩnh vực y tế do Bộ trưởng Bộ Tài chính ban hành |
| 307 | Circular/Thông tư | 279/2016/TT-BTC | Circular No. 279/2016/TT-BTC dated November 14, 2016, providing for fees for food safety and hygiene affairs and the collection, transfer, management and use thereof | Thông tư 279/2016/TT-BTC quy định mức thu, chế độ thu, nộp, quản lý và sử dụng phí trong công tác an toàn vệ sinh thực phẩm do Bộ trưởng Bộ Tài chính ban hành |
| 306 | Resolution/Nghị Quyết | 99/NQ-CP | Nghị quyết 99/NQ-CP năm 2016 về ký Thỏa thuận thừa nhận lẫn nhau trong ASEAN đối với báo cáo nghiên cứu tương đương sinh học của thuốc generic do Chính phủ ban hành | |
| 305 | Circular/Thông tư | 39/2016/TT-BYT | Circular No. 39/2016/TT-BYT dated October 28, 2016, classification of medical devices | Thông tư 39/2016/TT-BYT quy định chi tiết việc phân loại trang thiết bị y tế do Bộ trưởng Bộ Y tế ban hành |
| 304 | Official letter/Công văn | 19197/QLD-ĐK | Rút nguyên liệu salbutamol ra khỏi danh mục nguyên liệu đã được công bố | |
| 303 | Decision/Quyết định | 5539/QĐ-BYT | Quyết định 5539/QĐ-BYT năm 2016 về Dược thư Quốc gia Việt Nam dùng cho tuyến y tế cơ sở, lần xuất bản thứ 2 do Bộ trưởng Bộ Y tế ban hành | |
| 302 | Official letter/Công văn | 18274/QLD-ĐK | Đăng ký, nhập khẩu đơn hàng thuốc chứa phối hợp Domperidone và chất ức chế bơm Proton | |
| 301 | Official letter/Công văn | 18275/QLD-ĐK | Đăng ký, nhập khẩu đơn hàng thuốc chứa phối hợp Trypsin và Bromelain | |
| 300 | Official letter/Công văn | 18276/QLD-ĐK | Đăng ký nhập khẩu đơn hàng thuốc dạng xịt chứa Fusafungin | |
| 298 | Official letter/Công văn | 17702/QLD-ĐK | cập nhật thông tin dược lý đối với thuốc chứa acid zoledronic | |
| 297 | Official letter/Công văn | 16315/QLD-KD | Nhập khẩu nguyên liệu salbutamol làm thuốc | |
| 296 | Official letter/Công văn | 16342/QLD-KD | Nhập khẩu nguyên liệu salbutamol | |
| 295 | Decision/Quyết định | 4554/QĐ-BYT | Quyết định 4554/QĐ-BYT năm 2016 công bố thủ tục hành chính tại Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế do Bộ trưởng Bộ Y tế ban hành | |
| 294 | Decision/Quyết định | 4288/QĐ-BYT | Quyết định 4288/QĐ-BYT năm 2016 về tài liệu Hướng dẫn Thực hành sản xuất tốt (GMP) thực phẩm bảo vệ sức khỏe (Health Supplements) do Bộ trưởng Bộ Y tế ban hành | |
| 292 | Official letter/Công văn | 12973/QLD-ĐK | cập nhật thông tin dược lý của thuốc chứa codein | |
| 291 | Official letter/Công văn | 12597/QLD-TT | cung cấp thông tin liên quan đến tính an toàn của thuốc chứa Azithromycin, Clozapin, Mycophenolate mofetil hoặc Clopidogrel | |
| 286 | Decision/Quyết định | 2660/QĐ-BYT | Quyết định 2660/QĐ-BYT năm 2016 áp dụng cơ chế hải quan một cửa quốc gia đối với thủ tục hành chính nhập khẩu thuốc thành phẩm có số đăng ký lưu hành tại Việt Nam do Bộ trưởng Bộ Y tế ban hành | |
| 285 | Decision/Quyết định | 2659/QĐ-BYT | Quyết định 2659/QĐ-BYT năm 2016 áp dụng cơ chế hải quan một cửa quốc gia đối với thủ tục hành chính cấp số tiếp nhận Phiếu công bố sản phẩm mỹ phẩm nhập khẩu do Bộ trưởng Bộ Y tế ban hành | |
| 284 | Circular/Thông tư | 13/2016/TT-BNNPTNT | Circular No. 13/2016/TT-BNNPTNT dated June 02, 2016, on veterinary drug management | Thông tư 13/2016/TT-BNNPTNT quy định về quản lý thuốc thú y do Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn ban hành |
| 283 | Circular/Thông tư | 10/2016/TT-BNNPTNT | Circular No. 10/2016/TT-BNNPTNT dated June 1, 2016, promulgating list of veterinary drugs permitted to be marketed and banned from use in Vietnam, and announcement of HS codes of imported veterinary drugs permitted to be marketed in Vietnam | Thông tư 10/2016/TT-BNNPTNT Danh mục thuốc thú y được phép lưu hành, cấm sử dụng ở Việt Nam, công bố mã HS đối với thuốc thú y nhập khẩu được phép lưu hành tại Việt Nam do Bộ trưởng Bộ Nông nghiệp và Phát triển nông thôn ban hành |
| 282 | Decree/Nghị định | 36/2016/NĐ-CP | Decree No. 36/2016/ND-CP dated May 15th, 2016, on medical equipment management | Nghị định 36/2016/NĐ-CP về quản lý trang thiết bị y tế |
| 275 | Decision/Quyết định | 1348/QĐ-BYT | Quyết định 1348/QĐ-BYT năm 2016 đính chính Thông tư 48/2015/TT-BYT quy định hoạt động kiểm tra an toàn thực phẩm trong sản xuất, kinh doanh thực phẩm thuộc phạm vi quản lý của Bộ Y tế | |
| 274 | Law/Luật | 105/2016/QH13 | Law No. 105/2016/QH13 dated April 06th, 2016, on pharmacy | Luật Dược 2016 |
| 273 | Decision/Quyết định | 1231/QĐ-BYT | Quyết định 1231/QĐ-BYT năm 2016 đính chính Thông tư 23/2014/TT-BYT về Danh mục thuốc không kê đơn do Bộ trưởng Bộ Y tế ban hành | |
| 266 | Other documents/Văn bản khác | Danh mục hoạt chất ngừng tiếp nhận hồ sơ đăng ký mới, đăng ký lại hoặc yêu cầu phải có hồ sơ lâm sàng (tính đến 23/2/2016) | ||
| 264 | Decree/Nghị định | 09/2016/NĐ-CP | Decree No. 09/2016/ND-CP dated January 28, 2016, providing for fortification of food with micronutrients | Nghị định 09/2016/NĐ-CP quy định về tăng cường vi chất dinh dưỡng vào thực phẩm |
| 261 | Circular/Thông tư | 02/2016/TT-BYT | Circular No. 02/2016/TT-BYT dated January 12th, 2016, addition to Article 9 of the Circular No. 14/2012/TT-BYT on principles and criteria for “good manufacturing practice for pharmaceutical packaging” and guidelines for implementation | Thông tư 02/2016/TT-BYT bổ sung Điều 9 Thông tư 14/2012/TT-BYT quy định các nguyên tắc, tiêu chuẩn “Thực hành tốt sản xuất bao bì dược phẩm” (GMP) và hướng dẫn triển khai, áp dụng do Bộ trưởng Bộ Y tế ban hành |
| 259 | Official letter/Công văn | 22982/QLD-TT | Cung cấp thông tin liên quan đến tính an toàn của thuốc điều trị ĐTĐ type 2 nhóm DPP-4, thuốc chứa Methotrexate, thuốc NSAID không phải Aspirin | |
| 257 | Circular/Thông tư | 46/2015/TT-BYT | Circular No. 46/2015/TT-BYT dated December 01, 2015, on introduction of National Technical Regulation on Food Flavoring – Vanilla Flavouring Substances | Thông tư 46/2015/TT-BYT Quy chuẩn kỹ thuật quốc gia về hương liệu thực phẩm – các chất tạo hương Vani do Bộ trưởng Bộ Y tế ban hành |
| 256 | Circular/Thông tư | 47/2015/TT-BYT | Circular No. 47/2015/TT-BYT dated December 01st 2015, on the national technical regulation on food processing aids – solvents | Thông tư 47/2015/TT-BYT Quy chuẩn kỹ thuật quốc gia về chất hỗ trợ chế biến thực phẩm – Dung môi do Bộ trưởng Bộ Y tế ban hành |
| 255 | Circular/Thông tư | 48/2015/TT-BYT | Circular No. 48/2015/TT-BYT dated December 01, 2015, regulations on food safety inspection in food production and trading under the administration of the Ministry of Health | Thông tư 48/2015/TT-BYT Quy định hoạt động kiểm tra an toàn vệ sinh thực phẩm trong sản xuất, kinh doanh thực phẩm thuộc phạm vi quản lý của Bộ Y tế |
| 253 | Circular/Thông tư | 44/2015/TT-BYT | Circular No. 44/2015/TT-BYT dated November 30, 2015, compilation of “list of added micronutrients in foods” | Thông tư 44/2015/TT-BYT về danh mục vi chất dinh dưỡng sử dụng trong thực phẩm do Bộ trưởng Bộ Y tế ban hành |
| 248 | Circular/Thông tư | 35/2015/TT-BYT | Circular No. 35/2015/TT-BYT dated October 28, 2015 promulgating National technical regulation on the safety and hygiene for glass, ceramic, porcelain and enameled implements, containers and packaging in direct contact with food | Thông tư 35/2015/TT-BYT ban hành Quy chuẩn kỹ thuật quốc gia về vệ sinh an toàn đối với bao bì, dụng cụ làm bằng thủy tinh, gốm, sứ và tráng men tiếp xúc trực tiếp với thực phẩm do Bộ trưởng Bộ Y tế ban hành |
| 246 | Decision/Quyết định | 3970/QĐ-BYT | Quyết định 3970/QĐ-BYT năm 2015 Bảng Phân loại thống kê quốc tế về bệnh tật và các vấn đề sức khỏe có liên quan phiên bản lần thứ 10 (ICD 10) tập 1 và tập 2 do Bộ trưởng Bộ Y tế ban hành | |
| 243 | Decision/Quyết định | 442/QĐ-QLD | Quyết định 442/QĐ-QLD năm 2015 về rút số đăng ký, đình chỉ lưu hành và thu hồi thuốc chứa hoạt chất Biphenyl dimethyl dicarboxylat, thuốc chứa hoạt chất Cefetamet đang lưu hành tại Việt Nam do Cục trưởng Cục Quản lý Dược ban hành | |
| 242 | Official letter/Công văn | 14167/QLD-ĐK | cập nhật thông tin dược lý đối với thuốc chứa docetaxel | |
| 233 | Official letter/Công văn | 10107/QLD-ĐK | Cập nhật thông tin dược lý đối với thuốc chứa Valproat | |
| 231 | Circular/Thông tư | 13/2015/TT-BYT | Thông tư 13/2015/TT-BYT sửa đổi Khoản 2 điều 21 Thông tư 47/2010/TT-BYT hướng dẫn hoạt động xuất, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc do Bộ trưởng Bộ Y tế ban hành | |
| 228 | Official letter/Công văn | 9234/QLD-ĐK | Cập nhật thông tin dược lý đối với thuốc chứa domperidon | |
| 227 | Official letter/Công văn | 8762/QLD-TT | Cung cấp thông tin liên quan đến tính an toàn của thuốc chứa Ambroxol, Bromhexine, thuốc chứa Hydroxyzine, thuốc chứa Hydrochloroquine, Chloroquine, thuốc chứa Topiramate | |
| 226 | Official letter/Công văn | 8185/QLD-ĐK | Cập nhật thông tin dược lý đối với thuốc olmesartan medoxomil | |
| 224 | Decision/Quyết định | 1738/QĐ-BYT | Quyết định 1738/QĐ-BYT năm 2015 về triển khai dịch vụ công trực tuyến mức độ 4 cấp số tiếp nhận phiếu công bố sản phẩm mỹ phẩm do Bộ Y tế ban hành | |
| 220 | Official letter/Công văn | 5543/QLD-ĐK | Cập nhật thông tin dược lý đối với chế phẩm chứa diacerein | |
| 219 | Official letter/Công văn | 5131/QLD-CL | Đình chỉ lưu hành và thu hồi các thuốc chứa hoạt chất Lysozym | |
| 217 | Official letter/Công văn | 5078/QLD-ĐK | Ngừng nhập khẩu, đăng ký, lưu hành thuốc chứa hoạt chất Tetrazepam | |
| 215 | Circular/Thông tư | 26/2015/TT-BTC | Circular No. 26/2015/TT-BTC dated February 27, 2015, guidelines for value-added tax and tax administration in Decree No. 12/2015/ND-CP on guidelines for the Law on amendments to Laws, Decrees on taxations, and amendments to Circular No. 39/2014/TT-BTC on invoices for goods sale and service provision | Thông tư 26/2015/TT-BTC hướng dẫn thuế giá trị gia tăng và quản lý thuế tại Nghị định 12/2015/NĐ-CP, sửa đổi Thông tư 39/2014/TT-BTC về hóa đơn bán hàng hóa, cung ứng dịch vụ do Bộ Tài chính ban hành |
| 214 | Decision/Quyết định | 101/QĐ-QLD | Quyết định 101/QĐ-QLD năm 2015 về rút số đăng ký của thuốc chứa hoạt chất Gatifloxacin ra khỏi Danh mục thuốc được cấp số đăng ký lưu hành tại Việt Nam do Cục trưởng Cục Quản lý Dược ban hành | |
| 213 | Official letter/Công văn | 1209/QLD-CL | Đình chỉ lưu hành và thu hồi các thuốc chứa hoạt chất Lysozym | |
| 212 | Official letter/Công văn | 1297/QLD-TT | Stop using and withdrawal of pure form-drugs containing artemisinin or containing derivatives of artemisinin. | việc ngừng sử dụng và thu hồi các thuốc uống dạng đơn chất chứa hoạt chất Artemisinin hoặc chứa các dẫn xuất của Artemisinin |
| 202 | Official letter/Công văn | 18671/QLD-ĐK | Sử dụng Misoprostol phối hợp với mifepriston để chấm dứt thai kỳ | |
| 201 | Official letter/Công văn | 18672/QLD-ĐK | Cập nhật thông tin dược lý đối với thuốc chứa Calcitonin dạng tiêm | |
| 199 | Official letter/Công văn | 16734/QLD-ĐK | Thống nhất cách ghi tên hoạt chất thuốc Cerebrolisin | |
| 198 | Official letter/Công văn | 16751/QLD-ĐK | Đăng ký thuốc chứa phối hợp các vitamin và khoáng chất dùng đường uống | |
| 197 | Official letter/Công văn | 16752/QLD-ĐK | Đăng ký lưu hành thuốc chứa hoạt chất Metoclopramid | |
| 194 | Circular/Thông tư | 30/2014/TT-BYT | Circular No. 30/2014/TT-BYT dated August 28, 2014 on humanitarian healthcare | Thông tư 30/2014/TT-BYT về khám, chữa bệnh nhân đạo do Bộ trưởng Bộ Y tế ban hành |
| 189 | Integrated document/Văn bản hợp nhất | 09/VBHN-BYT | Văn bản hợp nhất 09/VBHN-BYT năm 2014 hợp nhất Thông tư hướng dẫn hoạt động xuất, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc do Bộ trưởng Bộ Y tế ban hành | |
| 185 | Circular/Thông tư | 83/2014/TT-BTC | Circular No. 83/2014/TT-BTC dated June 26, 2014, guiding the application of value-added tax according to Vietnam’s list of imports | Thông tư 83/2014/TT-BTC hướng dẫn thực hiện thuế giá trị gia tăng theo Danh mục hàng hóa nhập khẩu Việt Nam do Bộ trưởng Bộ Tài chính ban hành |
| 184 | Decree/Nghị định | 63/2014/ND-CP | Decree No. 63/2014/ND-CP dated June 26, 2014, detailing the implementation of several provisions of Law on Bidding regarding the selection of contractors | Nghị định 63/2014/NĐ-CP hướng dẫn Luật Đấu thầu về lựa chọn nhà thầu |
| 183 | Official letter/Công văn | 11039/QLD-ĐK | Cập nhật thông tin dược lý đối với dịch truyền Hydroxyethyl starch (HES) | |
| 182 | Law/Luật | 46/2014/QH13 | Law No. 46/2014/QH13 dated June 13, 2014, amendments to the Law on Health insurance | Luật Bảo hiểm y tế sửa đổi 2014 |
| 181 | Official letter/Công văn | 9049/QLD-ĐK | Cập nhật thông tin dược lý đối với thuốc chứa phối hợp cyproteron acetat và ethinyl estradiol | |
| 179 | Official letter/Công văn | 3048/BYT-TB-CT | Temporarily guiding extension the validity of registration numbers & deadline for submitting renewal registration dossiers of in-vitro diagnostic biologicals | Hướng dẫn tạm thời việc gia hạn số đăng ký, thời hạn nộp hồ sơ đăng ký lại sinh phẩm chẩn đoán invitro |
| 164 | Circular/Thông tư | 08/2014/TT-BYT | Circular No. 08/2014/TT-BYT dated February 26, 2014, providing for activities supporting clinical trial research in Vietnam | Thông tư 08/2014/TT-BYT quy định hoạt động hỗ trợ nghiên cứu thử nghiệm lâm sàng tại Việt Nam do Bộ trưởng Bộ Y tế ban hành |
| 156 | Circular/Thông tư | 10/2013/TT-BVHTTDL | Circular No. 10/2013/TT-BVHTTDL of December 06, 2013, detailing and guiding implementation of Law on advertising and Decree No. 181/2013/ND-CP implementation of Law on advertising | Thông tư 10/2013/TT-BVHTTDL hướng dẫn thực hiện Luật quảng cáo và Nghị định 181/2013/NĐ-CP do Bộ trưởng Bộ Văn hóa, Thể thao và Du lịch ban hành |
| 154 | Official letter/Công văn | 19799/QLD-ĐK | Về việc xác định tên khoa học đối với dược liệu Biển súc của thuốc lưu hành | |
| 150 | Decree/Nghị định | 181/2013/NĐ-CP | Decree No. 181/2013/ND-CP of November 14, 2013, on elaboration of some articles of the law on advertising | Nghị định 181/2013/NĐ-CP hướng dẫn Luật quảng cáo |
| 134 | Circular/Thông tư | 23/2013/TT-BYT | Circular No. 23/2013/TT-BYT of August 13, 2013, guidance on drug processing activities | Thông tư 23/2013/TT-BYT hướng dẫn hoạt động gia công thuốc do Bộ trưởng Bộ Y tế ban hành |
| 127 | Decision/Quyết định | 1545/QĐ-BYT | Decision No. 1545/QD-BYT of May 08, 2013, on amending and supplementing the Decision No. 2962/QD-BYT dated August 22, 2012 of the Ministry of Health, on promulagting temporary regulation on documents need supply in order to announce lists of original proprietary medicines, medicines used for treatment similar with original proprietary medicines, | Quyết định 1545/QĐ-BYT năm 2013 sửa đổi quy định tạm thời về tài liệu cần cung cấp để công bố danh mục thuốc biệt dược gốc, thuốc tương đương điều trị với thuốc biệt dược gốc, thuốc có tài liệu chứng minh tương đương sinh học kèm theo Quyết định 2962/QĐ-BYT do Bộ trưởng Bộ Y tế ban hành |
| 126 | Decision/Quyết định | 1387/2013/QD-BYT | Quyết định 1387/QĐ-BYT năm 2013 công bố danh mục văn bản quy phạm pháp luật do Bộ Y tế ban hành đã hết hiệu lực pháp luật tính đến ngày 31 tháng 3 năm 2013 | |
| 121 | Circular/Thông tư | 06/2013/TT-BYT | Circular No. 06/2013/TT-BYT of February 08, 2013, providing guidance on the experiment in drug price management by maximum wholesale surplus in a cycle, applicable to the drugs covered by the state budget and health insurance | Thông tư 06/2013/TT-BYT hướng dẫn thực hiện thí điểm quản lý giá thuốc bằng phương pháp thặng số bán buôn tối đa toàn chặng đối với thuốc do ngân sách nhà nước và bảo hiểm y tế chi trả do Bộ trưởng Bộ Y tế ban hành |
| 120 | Directive/Chỉ thị | 01/CT-BYT | Chỉ thị 01/CT-BYT năm 2013 tăng cường an toàn tiêm chủng và giám sát phản ứng sau tiêm chủng do Bộ Y tế ban hành | |
| 111 | Official letter/Công văn | 6586/BYT-K2ĐT | Guiding report, recognition SAE in clinical trials | Hướng dẫn báo cáo, ghi nhận SAE trong thử nghiệm lâm sàng |
| 102 | Decision/Quyết định | 219/QĐ-QLD | Quyết định 219/QĐ-QLD năm 2012 rút số đăng ký của thuốc do phản ứng có hại do Cục trưởng Cục Quản lý dược ban hành. Rút tất cả các thuốc có chứa hoạt chất Buflomedil ra khỏi Danh mục các thuốc được cấp số đăng ký lưu hành tại VN do phản ứng có hại | |
| 99 | Decision/Quyết định | 2962/QĐ-BYT | Decision No. 2962/QD-BYT of August 22, 2012, on promulagting temporary regulation on documents need supply in order to announce lists of original proprietary medicines, medicines used for treatment similar with original proprietary medicines, medicines with documents proving bioequivalence | Quyết định 2962/QĐ-BYT năm 2012 về Quy định tạm thời tài liệu cần cung cấp để công bố danh mục thuốc biệt dược gốc, thuốc tương đương điều trị với thuốc biệt dược gốc, thuốc có tài liệu chứng minh tương đương sinh học do Bộ trưởng Bộ Y tế ban hành |
| 96 | Law/Luật | 16/2012/QH13 | Law No. 16/2012/QH13 of June 21, 2012, On advertising | Luật Quảng cáo 2012 |
| 62 | Official letter/Công văn | 1479/QLD-TT | Thông tin về 59 loại thuốc trong danh mục cần quản lý đặc biệt của cơ quan quản lý dược phẩm Pháp | |
| 50 | Circular/Thông tư | 08/2010/TT-BYT | Circular No. 08/2010/TT-BYT of April 26, 2010, guiding report of bioavailability/bioequivalence study data when registering drugs | Thông tư 08/2010/TT-BYT hướng dẫn báo cáo số liệu nghiên cứu sinh khả dụng/ tương đương sinh học trong đăng ký thuốc do Bộ Y tế ban hành |
| 48 | Circular/Thông tư | 05/2010/TT-BYT | Circular No. 05/2010/TT-BYT of March 01, 2010, guiding the keeping of confidentiality of trial data in medicine registration | Thông tư 05/2010/TT-BYT hướng dẫn bảo mật dữ liệu thử nghiệm trong đăng ký thuốc do Bộ Y tế ban hành |
| 23 | Decision/Quyết định | 36/2006/QĐ-BYT | Decision No. 36/2006/QD-BYT dated November 14th, 2006, on promulgation of “the regulation on clinical trials for medical equipment” | Quyết định 36/2006/QĐ-BYT về thử lâm sàng trang thiết bị y tế do Bộ trưởng Bộ Y tế ban hành |
| 8 | Decree/Nghị định | 58/2003/NĐ-CP | Decree No. 58/2003/ND-CP of May 29, 2003, prescribing the control of the import, export and transit through Vietnams territory of narcotics, pre-substances, addictive drugs and psychotropic medicines | Nghị định 58/2003/NĐ-CP quy định về kiểm soát nhập khẩu, xuất khẩu, vận chuyển quá cảnh lãnh thổ Việt Nam chất ma tuý, tiền chất, thuốc gây nghiện, thuốc hướng thần |