| UBND THÀNH PHỐ HÀ NỘI
SỞ Y TẾ |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập – Tự do – Hạnh phúc |
|
Số: 4137/SYT-NVD V/v thuốc giả Cefixim 200. |
Hà Nội, ngày 30 tháng 8 năm 2024 |
Kính gửi:
– Thủ trưởng các cơ sở y tế trên địa bàn;
– Trưởng phòng Y tế các quận, huyện, thị xã;
– Các cơ sở kinh doanh Dược trên địa bàn.
Ngày 29/8/2024, Sở Y tế nhận được công văn số 2963/QLD-CL của Cục Quản lý Dược v/v thuốc giả Cefixim 200mg, cụ thể: thuốc giả trên nhãn ghi Viên nén bao phim CEFIXIM 200; SỐ GĐKLH: VD-28887-18; Số lô: 30201123; Ngày sản xuất: 201123; Hạn sử dụng: 201125; Cơ sở sản xuất: Công ty cổ phần Dược phẩm Cửu Long có đặc điểm, dấu hiệu phân biệt thuốc giả với thuốc thật theo văn bản đính kèm.
Để đảm bảo an toàn cho người sử dụng, Sở Y tế Hà Nội yêu cầu:
1. Các cơ sở y tế, các cơ sở bán buôn, bán lẻ thuốc trên địa bàn không kinh doanh, phân phối, sử dụng thuốc CEFIXIM 200 giả có các dấu hiệu nhận biết theo công văn số 2963/QLD-CL; tuân thủ việc kinh doanh, mua bán thuốc có nguồn gốc xuất xứ rõ ràng, rà soát hoạt động của cơ sở, nếu phát hiện thấy thuốc có thông tin như đã nêu, khẩn trương thông báo về Sở Y tế (Thanh tra Sở) để có biện pháp xử lý.
2. Các Phòng y tế quận, huyện, thị xã: Thông báo đến các cơ sở hành nghề trên địa bàn quản lý không kinh doanh, phân phối, sử dụng các thuốc giả nêu trên; tiếp nhận thông tin từ cơ sở, phối hợp với các phòng ban liên quan tiến hành kiểm tra các cơ sở kinh doanh thuốc trên địa bàn, xác minh thông tin và truy tìm nguồn gốc các thuốc giả nêu trên, xử lý vi phạm theo thẩm quyền (nếu có);
3. Văn phòng Sở: đăng tải công văn số 2963/QLD-CL của Cục Quản lý Dược lên trang thông tin điện tử của Sở; phối hợp với các cơ quan truyền thông, thông tin tới các cơ sở kinh doanh, sử dụng thuốc và người dân biết để không buôn bán, sử dụng. Khuyến cáo người dân thông tin đến đường dây nóng của Sở về thuốc giả, thuốc nhập lậu, thuốc không rõ nguồn gốc xuất xứ ngay khi phát hiện.
4. Trung tâm Kiểm nghiệm thuốc, mỹ phẩm, thực phẩm Hà Nội: rà soát lô thuốc nêu trên trong quá trình đi lấy mẫu; tăng cường lấy mẫu kiểm tra chất lượng thuốc lưu hành trên địa bàn đối với các thuốc có nguy cơ bị làm giả hoặc kém chất lượng, báo cáo về Sở Y tế (nếu có) để có biện pháp xử lý.
Sở Y tế Hà Nội thông báo để các cơ sở, đơn vị biết, thực hiện và báo cáo việc thực hiện về Sở Y tế./.
| Nơi nhận:
– Như trên; – Cục QLD (để b/c); – Ban Chỉ đạo 389 TP (để p/h); – Thanh tra Sở, P. QLHN (để thanh, kiểm tra); – BQL các DNLK: 01 Ng Huy Tường, 168 Ngọc Khánh; – Hội các nhà thuốc HN, Hội các doanh nghiệp dược HN; – Lưu: VT, NVD(Q. Anh) |
KT. GIÁM ĐỐC
Nguyễn Đình Hưng |
| BỘ Y TẾ
CỤC QUẢN LÝ DƯỢC |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập – Tự do – Hạnh phúc |
|
Số 2963/QLD-CL V/v thuốc giả Cefixim 200 |
Hà Nội, ngày 29 tháng 08 năm 2024 |
Kính gửi: Sở Y tế các tỉnh, thành phố trực thuộc Trung ương
Căn cứ công văn số 110/CV-TTKN để ngày 28/8/2024 của Trung tâm kiểm nghiệm tỉnh Bình Dương, báo cáo về việc mẫu sản phẩm có thông tin ghi trên nhãn: Viên nén bao phim CEFIXIM 200; số GĐKLH: VD-28887-18; số lô: 30201123, NSX: 201123, HD: 201125, nơi sản xuất: Công ty cổ phần Dược phẩm Cửu Long, mẫu thuốc do Trung tâm kiểm nghiệm tỉnh Bình Dương lấy tại Nhà thuốc tây Bích Ngọc 1 (địa chỉ: 395/14 Hai Bà Trưng, phường Đông Hòa, Tp. Dĩ An, tỉnh Bình Dương). Mẫu thuốc trên không đạt yêu cầu chất lượng về chỉ tiêu Định tính cefixim theo TCCS;
Căn cứ công văn số 284/DCL đề ngày 23/7/2024 của Công ty cổ phần dược Cửu Long, báo cáo việc sản xuất các lô thuốc Cefixim 200 và dấu hiệu khác biệt giữa mẫu thuốc lưu tại Công ty và mẫu thuốc do Trung tâm Kiểm nghiệm tỉnh Thanh Hóa thu được trên thị trường.
Sau khi đối chiếu, xem xét, để đảm bảo an toàn cho người sử dụng, tiếp theo các công văn số 2611/QLD-CL ngày 26/7/2024 và công văn số 2621/QLD- CL ngày 30/7/2024 của Cục Quản lý Dược về việc thuốc CEFIXIM 200 giả, Cục Quản lý Dược đề nghị Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, Y tế các ngành:
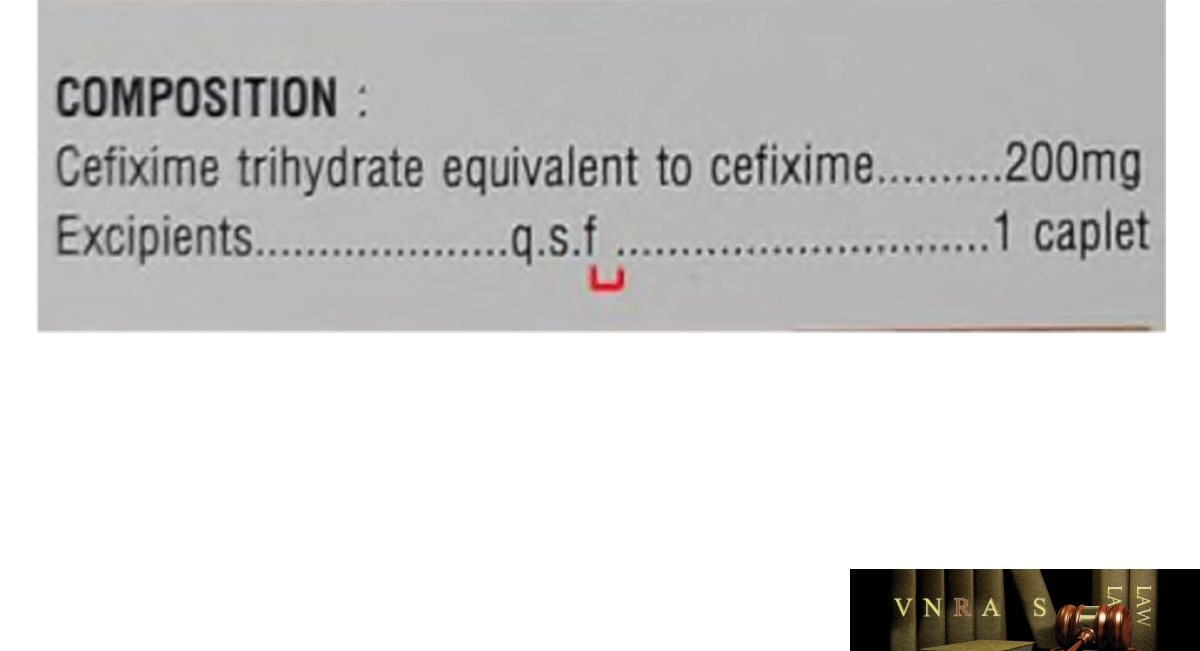
1. Thông báo cho các cơ sở kinh doanh, sử dụng thuốc thông tin về thuốc giả trên nhãn ghi: Viên nén bao phim CEFIXIM 200, số GĐKLH: VD-28887-18; số lô: 30201123, NSX: 201123, HD: 201125; Cơ sở sản xuất: Công ty cổ phần Dược phẩm Cửu Long có các đặc điểm, dấu hiệu phân biệt với thuốc thật như sau:
| STT | DẤU HIỆU NHẬN DẠNG | THUỐC THẬT | THUỐC GIẢ |
| 1 | Chi tiết in trên hộp | Hộp THẬT sau chữ “q.s.f” Có khoảng trắng
|
Hộp GIẢ sau chữ “q.s.f” KHÔNG có khoảng trắng
|
| 2 | Hình thức viên | Thuốc THẬT các viên đều màu, cạnh và mặt viên không sức mẻ | Thuốc GIẢ cạnh viên sức mẻ nhiều, lớp bao mỏng, màu sắc các viên trong cùng 1 vỉ không đồng nhất, có lốm đốm màu. |
|
Ghi chú: G: thuốc giả |
|||
2. Tiếp tục triển khai thực hiện nghiêm Chỉ thị 17/CT-TTg ngày 19/6/2018 của Thủ tướng Chính phủ về tăng cường đấu tranh chống buôn lậu, gian lận thương mại, sản xuất, kinh doanh hàng giả, hàng kém chất lượng thuộc nhóm hàng dược phẩm, mỹ phẩm, thực phẩm chức năng, dược liệu và vị thuốc y học cổ truyền; Thực hiện nghiêm các chỉ đạo tại Công văn số 7173/BYT-QLD ngày 12/12/2022 của Bộ Y tế về việc tăng cường quản lý, kiểm tra chất lượng thuốc, đấu tranh chống thuốc giả, thuốc không rõ nguồn gốc xuất xứ.
3. Phối hợp với các cơ quan truyền thông, thông tin tới các cơ sở buôn bán, sử dụng thuốc và người dân biết để không buôn bán, sử dụng sản phẩm CEFIXIM 200 giả có các dấu hiệu nhận biết nêu trên; Chỉ mua bán thuốc tại các cơ sở kinh doanh dược hợp pháp; không mua bán thuốc không rõ nguồn gốc; kịp thời thông báo các dấu hiệu nghi ngờ về sản xuất, kinh doanh thuốc giả, thuốc không rõ nguồn gốc tới cơ quan y tế và cơ quan có chức năng liên quan.
4. Phối hợp với cơ quan công an, quản lý thị trường, Ban chỉ đạo 389 và
các cơ quan chức năng liên quan tiến hành kiểm tra các cơ sở kinh doanh thuốc trên địa bàn; điều tra, xác minh thông tin và truy tìm nguồn gốc về sản phẩm CEFIXIME 200 giả nêu trên, xử lý các tổ chức, cá nhân vi phạm theo quy định hiện hành; kịp thời phát hiện và ngăn chặn việc sản xuất, buôn bán và sử dụng thuốc CEFIXIM 200 giả.
5. Chỉ đạo Trung tâm kiểm nghiệm tăng cường lấy mẫu, kiểm tra chất lượng thuốc lưu hành trên địa bàn đối với các thuốc có nguy cơ bị làm giả hoặc kém chất lượng; báo cáo kịp thời các vụ việc phát hiện tới Sở Y tế và cơ quan chức năng liên quan.
6. Thiết lập đường dây nóng, tiếp nhận các thông tin về thuốc giả, thuốc nhập lậu, thuốc không rõ nguồn gốc xuất xứ trên địa bàn để kịp thời phối hợp với các cơ quan chức năng xác minh, xử lý.
Báo cáo kết quả kiểm tra, xử lý vi phạm và nguồn gốc lô thuốc giả về Cục Quản lý Dược.
Cục Quản lý Dược thông báo để các Sở Y tế biết và thực hiện ./.
| Nơi nhận:
– Như trên; – Thứ trưởng Đỗ Xuân Tuyên (để b/c); – CT. Vũ Tuấn Cường (để b/c); – Ban chỉ đạo 389 Quốc gia (để b/c); – Thanh tra Bộ Y tế (để p/h); – Cục Quản lý khám chữa bệnh (đề p/h); – VKN TW, VKN Tp. HCM (đề p/h); – Cục Quân Y- Bộ Quốc Phòng; – Cục Y tế – Bộ Công an; – Cục Y tế Giao thông vận tải – Bộ GTVT; – TTKN Thanh Hóa, TTKN Bình Dương; – Các phòng: QLKDD, ĐKT – Cục QLD; – Công ty cổ phần dược phẩm Cửu Long (Đ/c: Số 150 đường 14/9, Phường 5, Tp. Vĩnh Long); – Website Cục QLD; – Lưu: VT, CL (Hi). |
KT, CỤC TRƯỜNG PHÓ CỤC TRƯỞNG
Tạ Mạnh Hùng |