Tác giả: Parisa Ghasemiyeh, Rahil Fazlinejad, Mohammad Reza Kiafar, Shiva Rasekh, Mohammad Mokhtarzadegan and Soliman Mohammadi-Samani
Người dịch: Bác sĩ chuyên khoa 1 Trần Thanh Liêm
Tải PDF bản dịch TẠI ĐÂY
Nám da là một chứng rối loạn tăng sắc tố da mãn tính phổ biến hơn ở giới tính nữ. Mặc dù nám là một rối loạn da đa yếu tố, tuy nhiên, tiếp xúc với ánh nắng mặt trời và yếu tố di truyền được coi là yếu tố căn nguyên chính gây ra nám. Mặc dù nhiều tác nhân điều trị tại chỗ và toàn thân cũng như các phương pháp điều trị không dùng thuốc đã được xem xét trong quản lý nám, tuy nhiên, các lựa chọn điều trị phổ biến hiện nay có một số hạn chế bao gồm thiếu hiệu quả lâm sàng đầy đủ, nguy cơ tái phát và tỷ lệ tác dụng phụ không mong muốn cao. Việc ứng dụng công nghệ nano để phân phối thuốc tại chỗ trong quản lý nám có thể giúp tăng cường khả năng thẩm thấu vào da, phân phối thuốc nhắm mục tiêu đến vị trí tác dụng, lắng đọng lâu hơn ở vùng mục tiêu và hạn chế sự hấp thu toàn thân, do đó hạn chế tính khả dụng toàn thân và phản ứng bất lợi của thuốc. Trong đánh giá hiện nay, nguyên nhân, sinh lý bệnh và phân loại mức độ nghiêm trọng của nám đã được xem xét. Sau đó, các lựa chọn điều trị bằng thuốc và các biện pháp điều trị khác nhau trong điều trị nám đã được thảo luận. Sau đó, việc sử dụng các loại hạt nano khác nhau nhằm mục đích phân phối thuốc tại chỗ để quản lý nám đã được xem xét. Cuối cùng, nhiều nghiên cứu lâm sàng và thử nghiệm lâm sàng có kiểm soát nhằm đánh giá hiệu quả của các công thức bôi ngoài da mới này trong việc kiểm soát nám đã được tóm tắt.
KEYWORDS
melasma, hyperpigmentation, topical drug delivery, nanoparticles, nanotechnology, skin permeation, clinical effectiveness
Giới thiệu.
Nám da là một chứng rối loạn tăng sắc tố phổ biến, đặc biệt là ở nữ giới, thường biểu hiện đối xứng dưới dạng các đốm tăng sắc tố màu nâu nhạt đến nâu sẫm trên mặt và tình trạng này cũng có thể trầm trọng hơn khi tiếp xúc với ánh nắng mặt trời kéo dài (Espósito và cộng sự, 2022). Nám da, là một rối loạn đa yếu tố, là rối loạn sắc tố phổ biến nhất và có thể được biểu hiện dưới dạng các mảng da ở trung tâm mặt, má và hàm dưới (Guarneri, 2014) với các đặc điểm viêm có thể xảy ra (Noh và cộng sự, 2014). Tỷ lệ nám có thể thay đổi từ 1% ở người bình thường đến 50% ở người có nguy cơ cao. Sự khác biệt về mức độ phổ biến của nám ở các quốc gia khác nhau có thể là do chủng tộc, di truyền và mức độ tiếp xúc với ánh nắng mặt trời. Như đã báo cáo, tỷ lệ mắc bệnh nám cao hơn nhiều ở người Trung Đông và Đông Nam Á, người Mỹ gốc Tây Ban Nha, người Châu Phi Địa Trung Hải và cả người Brazil (Majid và Aleem, 2021). Nám da có thể ảnh hưởng đến tất cả các loại da, tuy nhiên, nó phổ biến hơn ở loại da ở giữa (loại da Fitzpatrick II, III, IV và V) (Guarneri, 2014).
Bảng 1. Tăng sắc tố do thuốc và cơ chế bệnh sinh.
| Pharmacologic category | Drug | Pathogenesis | Ref. |
| Analgesics | NSAIDsa | NSAIDs can act as haptens that can bind to melanocyte-linked proteins and further induction of cytotoxic reaction against the complex and FDEb occurrence which can lead to the post-inflammatory hyperpigmentation | Ben Padhel et aL (2019), Nahhas et al. (2019) |
| Acetaminophen | Acetaminophen can act as hapten that can bind to melanocyte-linked proteins and further induction of cytotoxic reaction against the complex and FDEb occurrence which can lead to the post-inflammatory hyperpigmentation | Pathallah et al. (2011), Genovese et al. (2020) | |
| Cardiovascular drugs | Amiodarone | -Reversible, dose, and time-dependent hyperpigmentation (dose >400-800 mg/day and at least 6 months of therapy) | Kounis et al. (1996), Stãhli and Schwab (2011) |
| -Accumulation of lipofuscin deposits within the dermal histiocytes that can induce hypepigmentat ion | |||
| -Acting on lysosomes and induction of phototoxic- induced lysosomal damage | |||
| Diltiazem | Absorption of UVA and UVB wavelength and induction of photosensitivity reactions | Saladi et al. (2006) | |
| Eltrombopag | -Stimulation of inelanin synthesis | Braunstein et al. (2013) | |
| -Eltrombopag-induced pigment deposition, inflammation, and vesseỉ damage that can lead to erythrocyte leakagc and hemosiderin deposition and therefore hyperpigmentation occurrence | |||
| Tinzaparin sodium | Unknown mechanism | Takci and Ozoguz (2012), Nahhas et al. (2019) | |
| Antineoplastic agents | 5-FUc | 5-FU intravenous injection can induce the loss of endothelial vessel integrity which can lead to drug leakage from the vessels to the surrounding epidermis vvhich in turn can interfere with the melanogenesis process and might induce hyperpigmentation | Geddes and Cohen (2010), Suvirya et al. (2014) |
| Bleomycin | -Irritation, itching, or scratching of the skin followed by drug leakage from the vessels and hyperpigmentation occurrence | Ibrahimi and Anderson (2010), Ziemer et al. (2011) | |
| -Direct action of bleomycin on keratinocytes and FDEb occurrence | |||
| Cydophosphamide | -Genetic predisposition | chittari et al. (2009) | |
| -Photosensitivity induction | |||
| -Focal melanocyte stimulation and therefore pigmentation occurrence | |||
| -Drug-induced renal dysfunction and further drug accumulation and hyperpigmentation occurrence | |||
| Ifosfamide | -Genetic predisposition | Reyes-Habito and Roh (2014) | |
| -Photosensitivity induction | |||
| -Focal melanocyte stimulation and therefore pigmentation occurrence | |||
| Daunorubicin | -Photodistribution pattem and skin pigmentation | Kroiimpouzos et al. (2002) | |
| -Stimulation of melanocytes | |||
| Doxorubicin | -Photodistribution pattem and skin pigmentation
-Stimuiation of melanocytes |
Abbasi and Wang (2008) | |
| Gehtinib | -Functional changes in melanocytes | chang et aL (2004) | |
| -Post-inflammatory process in melanocytes | |||
| -Enhanced pigment transfer to the keratinocytes and also to the dermal macrophages | |||
| Hydroxyurea | -Genetic predisposition | Tansir et al. (2022) | |
| -Focal melanocyte accumuiation | |||
| -Photosensitivity | |||
| Imatinib mesylate | -Mutation in the c-kit gene or variant of the kinase | Di Tullio et ai. (2018), Nahhas et al. (2019) | |
| -Direct effect on melanocytes | |||
| -Increased pigmentation incidence due to the enhanced drug deposition through the chelation of its metabolite to iron and melanin | |||
| -Imatinib mesylate-induced immune dysfunction and further melanin incontinence | |||
| Sorafenib | Drug excretion through the skin | Gupta et al. (2015) | |
| Sunitinib | -Drug excretion through the skin | Vignand-Courtin ct al. (2012) | |
| -Reversible and dose-dependent hyperpigmentation | |||
| Paditaxel | -Local alteration in blood ílow and induction of reticulate hyperpigmentation | Cohen (2016) | |
| Pemetrexed | Unknoun mechanism | Schallier et al. (2011) | |
| Tegatul | -Melanocyte deposition through the direct stimulation of melanocytes Via the melanocyte- stimulating hormone | Nahhas et al. (2019) | |
| -Melanocyte hyperplasia | |||
| -Decreased keratinocyte tumover | |||
| Antiepileptic agents | Phenytoin | Hydantoin-induced direct stimuiation of melanocytes and facial melasma occurrence | Roji et al. (2018) |
| Retigabine (Ezogabine) | -Melanin deposition vvithin the perivascular and periadnexal dermal celỉs | Shkolnik et aỉ. (2014) | |
| -Tyndall effect | |||
| Antimicrobial agents | Chloroquine/Hydroxychloroquine | -Formation of chloroquine-melanin complex | Mir et al. (2013) |
| -Drug-induced hyperpigmented macules merging in to íacial patches | |||
| Mefloquine | -Drug-induced hyperpigmented macules merging in to facial patches | Nahhas et al. (2019) | |
| Mepacrine | Drug-induced tissue staining through the acridine dye component of mepacrine | Kleinegger et al. (2000) | |
| Dapsone | -Photoaggravated hypermelanosis | Garcia and Cohen (2017) | |
| -Induction of FDEb | |||
| Isoniazid | Enhanced dermal melanophages | KIM et aL (2008) | |
| Levofloxacin | Direct effect on melanocytes and overproduction of melanin especially in sun-exposed areas and in those with inflammatory skin disorders | Connors et al. (2018) | |
| Minocycline | Direct effect on melanocytes and overproduction of melanin especially in sun-exposed areas and in those vvith inflammatory skin disorders | Fiscus et al. (2014) | |
| Rifampin (Rifampicin) | Drug excretion through the skin | Thangaraju et al. (201S), Nahhas et al. (2019) | |
| Polymyxin B | Augmentation of melanogenesis pathway through the release of drug-induced inflammatory mediators | Li et al (2020) | |
| Emtricitabine | Enhanced melanin ofthe basal level of the epidermis layer | Nelson and Schiavone (2004) | |
| Zidovudine | Reversible and dose-dependent hyperpigmentation through the melanocyte stimulation and enhanced melanin amounts | Premjith and Karthikeyan (2022) | |
| Prostaglandin analogs | Latanoprost and Bimatoprost | Enhanced tyrosinase activity and melanogenesis in melanocytes through the prostanoid receptors | Nahhas et al. (2019) |
| Psychotropic Agents | Chlorpromazine | -UV exposure can lead to the formation of chlorpromazine polymers | Calheiros et al. (2020) |
| -Binding of chlorpromazine to melanocytes and induction of melanin synthesis | |||
| Amitriptyline | Unknovvn mechanism of pigmentation, hovvever, synergistic hyperpigmentation was seen with concurrent minocydine therapy which induced rapid onset of pigmentation | Nahhas et al. (2019) | |
| Desipramine | Formation of drug-melanosome complex in response to chronic uv exposure | ||
| Imipramine | -Formation of drug-nielanosome complex in response to chronic uv exposure | ||
| -Accumulation of imipramine-free radicals | |||
| -Photoactivation of imipramine and/or its metaboỉites and induction of tyrosinase activation and increment of melanin synthesis | |||
| Miscellaneous | Adalimumab | Promotion of melanocyte activities and induction of melanin synthesis | Blomberg et al (2009) |
| Afamelanotide | Enhanced eumelanin expression to induce skin pigmentation | De Baat et al. (2020) | |
| Beta-Carotene, Vitamin A, and Derivatives | Dose dependent skin di&coloration | Nahhas et al. (2019) | |
| Hydroquinone | Skin pigmentation through the local inhibition of homogentisic acid and its metabolites and formation of ochronotic pigments in dermis layer | Mishra et al- (2013) | |
| Minoxidil | skin pigmentation through the opening of luminal vessels and reduction of tissue lymphocytes | Nahhas et al. (2019) | |
| Oral Contraceptives | Estrogen-induced hyperpigmcntation and melasma | Resnik (1967) |
*Non-steroidal anti-inilammatory drugs.
bFixed drug eruption.
C5-Fluorouracil.
Độ tuổi trung bình bắt đầu bị nám có thể thay đổi từ 20 đến 40 tuổi theo báo cáo từ nhiều quốc gia khác nhau. Ngoài ra, nám chiếm ưu thế hơn ở giới tính nữ và có báo cáo rằng nữ giới có nguy cơ mắc chứng rối loạn nám cao gấp 9-10 lần so với nam giới (Majid và Aleem, 2021). Tỷ lệ nám ở phụ nữ khi mang thai cao hơn rất nhiều và có thể lên tới 63% ở phụ nữ mang thai. Yếu tố nguy cơ phổ biến nhất gây ra nám ở phụ nữ là mang thai, trong khi yếu tố nguy cơ phổ biến nhất ở nam giới là tiếp xúc với ánh nắng mặt trời và tiền sử gia đình mắc bệnh nám (Majid và Aleem, 2021). Mặc dù nám là một rối loạn da không ác tính, tuy nhiên, nếu không xem xét chế độ điều trị thích hợp, đúng lúc và tối ưu, nó có thể gây ra nhiều ảnh hưởng về tâm lý và cảm xúc bao gồm cảm giác thất vọng, kém hấp dẫn và bối rối (Wu et al. , 2021).
Nguyên nhân gây nám.
Nhiều yếu tố đã được xem xét trong nguyên nhân gây nám. Về vấn đề này, khuynh hướng di truyền và đa hình gen, tiếp xúc với ánh nắng mặt trời và bức xạ tia cực tím, thay đổi nội tiết tố, các rối loạn tiềm ẩn bao gồm rối loạn tuyến giáp, mang thai và cả nám do thuốc gây ra đều có vai trò quan trọng trong việc gây ra nám. Danh sách tăng sắc tố do thuốc gây ra được tóm tắt trong Bảng 1.
Vì di truyền có vai trò quan trọng trong tỷ lệ mắc và mức độ phổ biến của nám trong quần thể bệnh nhân nên mối tương quan giữa các đa hình gen khác nhau và sự xuất hiện của nám đã được xem xét. Mối tương quan giữa kiểu gen Val92Met và Arg163Gln của gen thụ thể Melanocortin-1 (MC1R) và tỷ lệ mắc nám được đánh giá ở phụ nữ Indonesia. Trong nghiên cứu này, 158 phụ nữ Indonesia từ 18 đến 60 tuổi được đưa vào. Kiểu gen Val92Met của gen MC1R phổ biến hơn đáng kể ở bệnh nhân bị nám, tuy nhiên, kiểu gen Arg163Gln không liên quan đáng kể đến tỷ lệ mắc nám. Ngoài ra, kết quả của nghiên cứu này cho thấy mức độ tiếp xúc với ánh nắng mặt trời và tiền sử gia đình mắc bệnh nám cũng là những yếu tố nguy cơ khác gây ra nám ở người Java (Suryaningsih và cộng sự, 2019). Một nghiên cứu khác trên dân số Ai Cập cho thấy mối tương quan giữa đa hình gen thụ thể vitamin D (VDR) (TaqI) và tỷ lệ mắc nám. Về vấn đề này, 95 phụ nữ Ai Cập đã được đưa vào nghiên cứu này và kết quả cho thấy có mối liên quan đáng kể giữa t allele và kiểu gen tt với sự xuất hiện nám. Do đó, tính đa hình TaqI của gen VDR có liên quan đáng kể đến tình trạng nám ở người Ai Cập (Seleit và cộng sự, 2017). Một nghiên cứu khác cho thấy mối tương quan giữa đa hình gen thụ thể estrogen (ER) (đa hình PvuII và Xbal đối với gen ERa và đa hình AluI, Rsal đối với gen ERP) và tỷ lệ mắc nám. Trong nghiên cứu này, 56 trường hợp và 39 bệnh nhân đối chứng được đưa vào. Theo kết quả, có mối tương quan thuận giữa sự biểu hiện quá mức của gen ERa và ERp và sự xuất hiện nám trong nhóm trường hợp. Có mối liên quan đáng kể giữa tính đa hình XbaI và tỷ lệ mắc nám. Ngoài ra, còn có mối liên quan đáng kể giữa đa hình AluI và RsaI với nám. Dựa trên kết quả, bệnh nhân có kiểu gen Xx, Aa và RR chiếm ưu thế dễ bị nám hơn (Bai, 2016).
Sinh bệnh học của nám.
Như đã đề cập trước đây, sự phát triển của nám có thể bị ảnh hưởng và thúc đẩy bởi nhiều yếu tố khác nhau bao gồm tiếp xúc lâu dài với ánh nắng mặt trời và bức xạ tia cực tím, khuynh hướng di truyền, rối loạn chức năng tuyến giáp, thuốc đặc trị, stress oxy hóa, mất cân bằng nội tiết tố và giới tính nữ, đặc biệt là phụ nữ mang thai. và cả những người đang sử dụng thuốc tránh thai đường uống (OCP) (Ortonne và cộng sự, 2009; Kwon và Park, 2014b; Katiyar và Yadav, 2022). Ngoài ra, hoạt động của nhiều loại tế bào da khác nhau bao gồm tế bào sừng, tế bào mast, tế bào nội mô, nguyên bào sợi và thậm chí cả tế bào bã nhờn đều có liên quan đến tỷ lệ mắc nám (KrupaShankar et al., 2014). Hơn nữa, việc gây ra quá trình viêm ở lớp hạ bì và kích hoạt các enzyme khác nhau bao gồm cả metallicoproteinase nền có thể gây ra nám. Xem xét những trở ngại còn lại trong điều trị nám, việc hiểu sâu hơn về cơ chế bệnh sinh đa yếu tố của nó có thể cải thiện kết quả điều trị và khắc phục tỷ lệ tái phát và kháng thuốc cao (Rajanala và cộng sự, 2019b; Artzi và cộng sự, 2021).
Trong giai đoạn tạo phôi, các nguyên bào hắc tố, là các tế bào tiền thân của tế bào hắc tố, di chuyển đến lớp biểu bì và nang lông để tạo ra sắc tố. Như được liệt kê dưới đây, các yếu tố khác nhau có thể ảnh hưởng đến việc sản xuất melanin:
- Sản xuất proopiomelanocortin (POMC) và các dẫn xuất của POMC bởi tế bào da.
- Tăng số lượng thụ thể melanocortin-1 (MC-1R) trên bề mặt tế bào hắc tố.
- Bài tiết Diacylglycerol (DAG) kích hoạt protein Kinase-C.
- Giải phóng oxit nitric (NO) kích hoạt con đường cGMP.
- Tăng sản xuất Cytokine và yếu tố tăng trưởng bằng cytokine.
Sự tăng động hoặc kích hoạt quá mức của từng con đường bình thường này có thể dẫn đến tăng cường sản xuất melanin ở lớp hạ bì, từ đó có thể gây ra tình trạng tăng sắc tố và nám bất thường (da Cunha và da Silva Urzedo, 2022). Người ta đã chứng minh rằng việc tiếp xúc với ánh nắng mặt trời kéo dài là một yếu tố nguy cơ quan trọng đối với sự phát triển của nám và có thể đóng vai trò quan trọng trong việc tăng cường từng con đường hình thành hắc tố này (Passeron và Picardo, 2018; Artzi và cộng sự, 2021). Hơn nữa, các nghiên cứu gần đây đã chỉ ra rằng các bức xạ chính góp phần gây ra nám là ánh sáng nhìn thấy năng lượng cao (HEVL) và UVA sóng dài (UVA-1). Sự kết hợp của những điều này có thể có tác dụng hiệp đồng gây tăng sắc tố, viêm và ban đỏ (Kohli và cộng sự, 2018; Kohli và cộng sự, 2019). Do đó, nám có thể được phân loại là một chứng rối loạn lão hóa do ánh sáng, đặc biệt ở những bệnh nhân dễ bị tổn thương về mặt di truyền (Passeron và Picardo, 2018). Cơ chế bệnh lý chính của nám xuất hiện do tiếp xúc với ánh nắng mặt trời được mô tả trong Hình 1.
Nhìn chung, các nghiên cứu trước đây đã tìm ra 5 cơ chế bệnh chính liên quan đến sự xuất hiện của nám (Kwon và cộng sự, 2016; Artzi và cộng sự, 2021; Morgado-Carrasco và cộng sự, 2022):
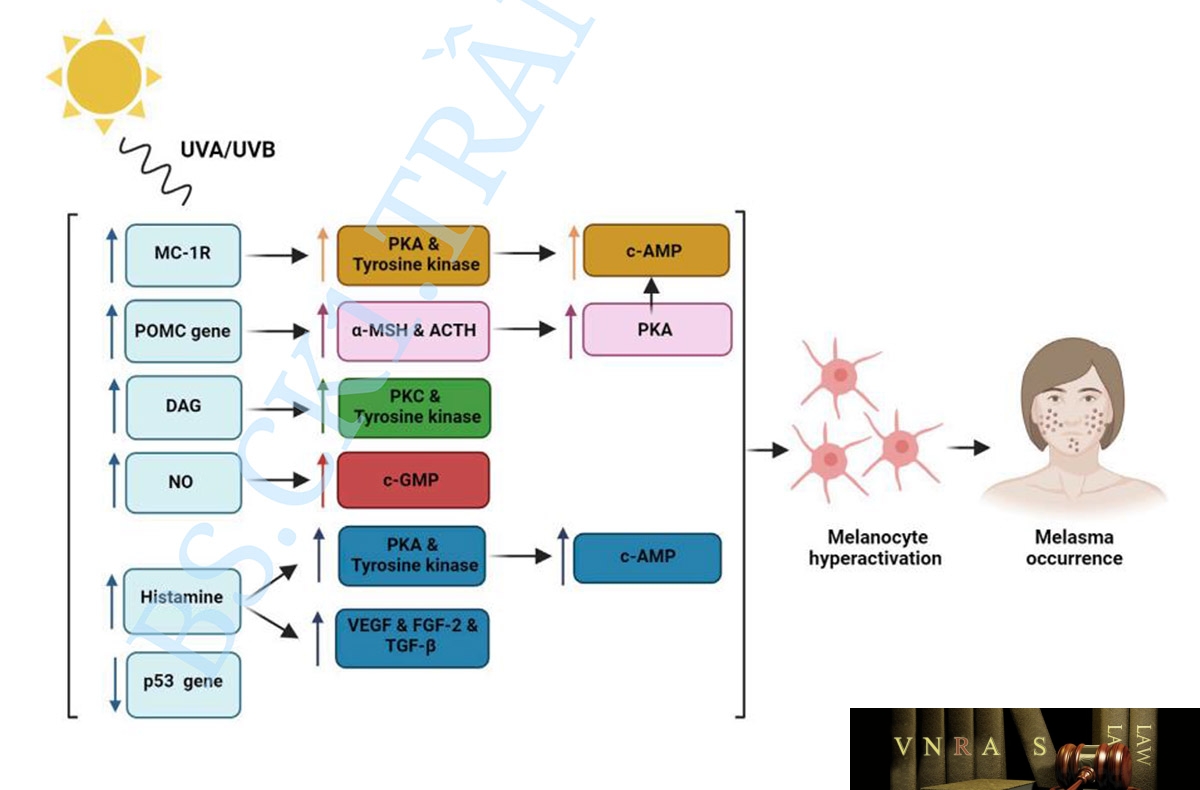
| Hình 1. Ánh nắng mặt trời điều chỉnh thụ thể Melanocortin-1 (MC-1R), tạo ra hoạt động của protein kinase A (PKA) và tyrosine kinase dẫn đến c-AMP phosphoryl hóa và tăng hoạt động tế bào hắc tố; Cảm ứng gen Proopiomela- nocortin (POMC) thông qua bức xạ UV giúp tăng cường tế bào alpha-melanocyte kích thích sản xuất hormone (α-MSH) và adrenocorticotropic (ACTH) làm tăng quá trình PKA và melanogen; Cảm ứng Diacylglycerol (DAG) thông qua bức xạ UV sẽ kích hoạt hoạt động của protein kinase C (PKC) và tyrosine kinase; Giải phóng oxit nitric (NO) kích hoạt con đường cGMP; Sự giải phóng histamine từ tế bào mast kích hoạt PKA và tyrosine kinase và gây ra tình trạng tăng cường mạch máu thông qua cảm ứng của yếu tố tăng trưởng nội mô mạch máu (VEGF), yếu tố tăng trưởng nguyên bào sợi-2 (FGF-2) và yếu tố tăng trưởng biến đổi-beta (TGF-β) gây ra sự hình thành hắc tố; Tổn thương gen ức chế khối u p53 thông qua bức xạ UV dẫn đến tăng cường sản xuất melanin |
Hoạt động của tế bào hắc tố không đúng cách và tích tụ tế bào hắc tố ở thượng bì và lớp bì.
Mặc dù sự gia tăng nồng độ melanin ở bệnh nhân nám là một thực tế đã được biết đến, tuy nhiên, cơ chế chính xác của sự gia tăng này vẫn chưa được hiểu đầy đủ. Người ta biết rằng bức xạ UV có thể kích hoạt quá mức các tế bào hắc tố thông qua nhiều cách khác nhau, bao gồm cả việc điều hòa các thụ thể hormone kích thích melatonin (MSHR), còn được gọi là thụ thể Melanocortin-1 (MC-1R), có thể tạo ra sự liên kết với hormone và tăng cường protein kinase nội sinh. Do đó, biểu hiện A (PKA) và tyrosine kinase có thể dẫn đến quá trình phosphoryl hóa cAMP và kiểm soát quá trình hình thành melanogen, từ đó có thể tạo ra sản xuất melanin cao hơn. Hơn nữa, bức xạ UV có thể kích hoạt gen proopiomelanocortin (POMC) và do đó tăng cường sản xuất hormone kích thích tế bào hắc tố alpha (a-MSH) và hormone vỏ thượng thận (ACTH) có thể dẫn đến tăng PKA và hình thành hắc tố (Im et al., 2002). Một cơ chế khác là sự gia tăng nồng độ diacylglycerol (DAG) nội sinh có thể kích hoạt quá trình hình thành hắc tố do tyrosine kinase gây ra (Carsberg và cộng sự, 1995). Ngoài ra, tổn thương gen ức chế khối u p53 thông qua bức xạ UV có thể dẫn đến tăng cường sản xuất melanin (Videira và cộng sự, 2013).
Tăng số lượng và hoạt động của tế bào Mast.
Tế bào mast có liên quan đến một số cơ chế bệnh lý của nám. Các nghiên cứu trước đây đã chỉ ra rằng bức xạ UV có thể làm tăng sự giải phóng histamine từ tế bào mast. Histamine liên kết với thụ thể H2 có thể kích hoạt PKA và tạo ra con đường tyrosinase, và do đó tạo ra quá trình hình thành melanogen (Gilchrest và cộng sự, 1981; Malaviya và cộng sự, 1996; Yoshida và cộng sự, 2000). Histamine có thể gây ra sự di chuyển và tăng sinh tế bào hắc tố (Kim và Lee, 2010). Hơn nữa, tế bào mast có thể gây ra tình trạng tăng sinh mạch máu bằng cách tạo ra các yếu tố tạo mạch bao gồm yếu tố tăng trưởng nội mô mạch máu (VEGF), yếu tố tăng trưởng nguyên bào sợi (FGF-2), và yếu tố tăng trưởng jiến đổi-beta (TGF-P) (Crivellato và cộng sự, 2008). Do đó, tế bào mast có vai trò quan trọng trong quá trình quang hóa do tiếp xúc với tia cực tím kéo dài và có liên quan đến hiện lão hóa da do ánh sáng, giãn mạch và tắc nghẽn màng đáy, tất cả đều là những đặc điểm chính của nám (Kwon và cộng sự, 2016).
Lão hóa da do ánh sáng hoặc bất thường chất nền ngoại bào ở hạ bì.
Việc tiếp xúc lâu dài với bức xạ tia cực tím có thể gây ra sự tích tụ bất thường của mô đàn hồi, có thể dẫn đến quá trình quang hóa, được gọi là chứng lão hóa da do ánh sáng mặt trời. Người ta đã chỉ ra rằng 83%-93% bệnh nhân bị nám có hiện diện lão hóa da do ánh nắng mặt trời ở các mức độ khác nhau bao gồm các sợi đàn hồi không điển hình dày hơn, phân mảnh hơn và cong hơn (Kang và cộng sự, 2002; Torres-Álvarez và cộng sự, 2011). Bức xạ tia cực tím có thể nâng cao việc sản xuất enzyme tryptase trong tế bào mast. Ngược lại, tryptase có thể gây ra hiện tượng lão hóa da do ánh sáng mặt trời bằng cách kích thích sản xuất elastin trong nguyên bào sợi (Grimbaldeston và cộng sự, 2003). Tế bào mast cũng có thể tạo ra sự sản xuất elastin thông qua các cytokine (Hernández-Barrera và cộng sự, 2008), điều này có thể dẫn đến việc kích hoạt metallicoproteinase của tế bào mast (MMP), từ đó gây ra sự thoái hóa của collagen loại 4 và làm tổn thương màng đáy (Bosset et cộng sự, 2003; Iddamalgoda và cộng sự, 2008).
Tăng sinh mạch máu.
Ở những bệnh nhân bị nám, lượng mạch máu trên da tăng 68,75% là rõ ràng so với người bình thường (Kim và cộng sự, 2007). Như đã đề cập trước đây, dưỡng bào và tế bào sừng có thể tạo ra sự tạo mạch thông qua sự gia tăng bài tiết VEGF, tăng cường TGF-P và FGF-2, do đó có thể tạo ra nhiều m ạch máu lớn và giãn nở hơn, xử lý vấn đề tăng sinh mạch máu được coi là mục tiêu quan trọng trong điều trị nám (Kim et al. ., 2005; Kwon và Park, 2014a; Kwon và cộng sự, 2016). Mặc dù VEGF là một yếu tố tạo mạch quan trọng nhưng không có đủ bằng chứng kết nối nó với quá trình hình thành hắc tố. Các lý do khác gây ra tình trạng tăng cường mạch máu là hiện tượng lão hóa da do ánh sáng mặt trời do tia cực tím gây ra và sự gia tăng các cytokine như yếu tố tế bào gốc (SCF), tổng hợp oxit nitric cảm ứng (iNOS) và c-KIT (một cytokine gây hắc tố mạnh) (Kang và cộng sự, 2006). ; JO và cộng sự, 2009). Tóm lại, có vẻ như các chất chống tạo mạch sẽ là một phương pháp điều trị nám đầy hứa hẹn (Kwon và cộng sự, 2016).
Phá vỡ màng đáy.
Sự phá vỡ màng đáy là một phát hiện quan trọng trong tình trạng nám. Kết quả của một nghiên cứu gần đây chỉ ra rằng sự phá vỡ màng đáy từ 83%-95% là rõ -à–g ở bệnh nhân bị nám thông qua các kỹ thuật nhuộm khác nhau (Torres-Álvarez và cộng sự, 2011). Tiếp xúc với tia cực tím kéo dài có thể kích hoạt ma trận metallicoproteinase-2 (MMP-2) và MMP-9 ở màng đáy, dẫn đến suy thoái collagen loại 4 và 6 và tích tụ nhiều sợi elastin hơn ở bệnh nhân nám (Inomata et al., 2003). Hơn nữa, Cadherin-11, một phân tử bám dính có trong nguyên bào sợi, có thể kích hoạt MMP, từ đó dẫn đến suy giảm collagen nhiều hơn và tăng cường các sợi elastin trên da. Ngoài ra, Cadherin-11 có thể kích hoạt quá trình hình thành hắc tố trong tế bào hắc tố (Kim và cộng sự, 2016). Hơn nữa, các yếu tố khác nhau bao gồm lão hóa, quá trình hình thành và các yếu tố môi trường có thể dẫn đến tổn thương màng đáy và do đó các tế bào melanocytes và melanin di chuyển dễ dàng hơn đến các lớp da và tích tụ chúng trong lớp hạ bì. Những tế bào tích tụ ở lớp hạ bì này được gọi là tế bào hắc tố lơ lửng thường thấy ở những bệnh nhân bị nám (Kang và cộng sự, 2002; Torres-Álvarez và cộng sự, 2011). Hiện tượng này có thể gây ra phản ứng kháng trị ở bệnh nhân bị nám, làm tăng khả năng tái phát (Sanchez và cộng sự, 1981). Về vấn đề này, việc phục hồi màng đáy và ngăn chặn sự giải phóng các tế bào hắc tố và melanin vào lớp hạ bì là điều cần thiết để điều trị nám lâu dài. Do đó, bất kỳ kích ứng da nào do sự phá vỡ màng đáy đều có thể làm tình trạng nám trở nên trầm trọng hơn và cũng có thể gây ra tình trạng nám dai dẳng hoặc tái phát (Kwon và cộng sự, 2016).
Cơ chế bệnh lý khác.
Estrogen có thể là yếu tố góp phần quan trọng vào sự phát triển của nám và tác dụng của nó chủ yếu thấy ở phụ nữ sau tuổi dậy thì và phụ nữ mang thai cũng như ở phụ nữ sử dụng thuốc tránh thai. Hơn nữa, sự gia tăng thụ thể estrogen và progesterone thể hiện rõ ràng ở lớp hạ bì và biểu bì của các tổn thương nám. Thông qua việc estrogen liên kết với thụ thể của nó, yếu tố phiên mã tyrosinase và microphthalmia (MITF) có thể được kích hoạt và do đó melanin sẽ tăng lên (Cohen, 2017). Estrogen cũng có thể làm tăng sự biểu hiện của protein miền PDZ thận-1 (PDZK-1), có thể tăng cường quá trình hình thành melanosome và chuyển melanosome (Lee, 2015).
Tiếp xúc lâu dài với bức xạ tia cực tím có thể gây viêm và tăng cường các nguyên bào sợi trên da, từ đó tạo ra SCF có thể liên kết với thụ thể của nó (thụ thể c-KIT hoặc cụ thể hơn là thụ thể m-KIT) và do đó sản xuất melanin thông qua kích hoạt các con đường tyrosine kinase trong tế bào hắc tố (Yuan và Jin, 2018; Rajanala và cộng sự, 2019b). Tình trạng viêm do tia cực tím thường xảy ra do sự gia tăng nồng độ cyclooxygenase-2 (COX-2) và prostaglandin, từ đó có thể tăng cường con đường tyrosinase và kích thích quá trình sản xuất melanocytes và melanogen. Do đó, có vẻ như chất ức chế COX sẽ là loại thuốc hứa hẹn giúp làm giảm các tổn thương do nám (Kim và cộng sự, 2012; Rajanala và cộng sự, 2019b). Ngoài ra, sự gia tăng superoxide effutase và giảm đáng kể nồng độ glutathione, nguyên nhân chính gây ra stress oxy hóa, là điều hiển nhiên ở những bệnh nhân bị nám (Kuthial và cộng sự, 2019).
Hơn nữa, thông qua bức xạ UVB, các tế bào sừng có thể làm tăng sự tiết ra các cytokine, các yếu tố tăng trưởng và hormone bao gồm iNOS, từ đó kích thích sản xuất melanin trong các tế bào hắc tố (IMOKAWA và cộng sự, 1998; Taraz và cộng sự, 2017).
Thật thú vị khi biết rằng, mặc dù toàn bộ khuôn mặt đều tiếp xúc với ánh nắng mặt trời, nhưng chỉ một số vùng, đặc biệt là những vùng có tuyến bã nhờn tập trung bao gồm trán, má và môi trên là thường bị nám hơn. Nó có thể là do các vùng da này có khả năng hấp thụ vitamin D, các cytokine khác nhau và sản xuất các yếu tố tăng trưởng khác nhau (Abdel-Naser và cộng sự, 2012).
Phân loại nám.
Nám da có thể được phân loại trên lâm sàng là các mảng nám trung tâm mặt (có tỷ lệ mắc cao nhất), các mảng nám ở vùng má và hàm dưới. Ở kiểu trung tâm mặt, trán, má, cằm, mũi và môi trên có liên quan. Trong khi nám má, má và mũi và nám vùng hàm dưới thì có liên quan đến nhánh xương hàm dưới (Guarneri, 2014). Ngoài ra, nám có thể được phân loại dựa trên độ sâu của melanin. Về vấn đề này, qua phương pháp kiểm tra bằng đèn của Wood, nám được phân thành loại thượng bì bì, bì, hỗn hợp và trung gian trong đó nám thượng bì là loại phổ biến nhất ở những bệnh nhân có tổn thương nám. Tuy nhiên, do sự khác biệt giữa kỹ thuật đèn Wood và kết quả mô bệnh học in vivo trong phân loại nám, kính hiển vi đồng tiêu phản xạ (RCM) đã được giới thiệu (Liu và cộng sự, 2011). Dựa trên hình ảnh RCM, nám có thể được phân thành loại thượng bì và hỗn hợp để phù hợp hơn với kết quả mô bệnh học (Kang và Bahadoran, 2012). Kỹ thuật RCM là một kỹ thuật hình ảnh in vivo không xâm lấn, có thể được sử dụng trong phân tích da bằng kính hiển vi với độ phân giải cao và không cần chuẩn bị sinh thiết da (Liu và cộng sự, 2011).
Lựa chọn điều trị và hạn chế.
Như được hiển thị trong Hình 2, nhiều lựa chọn điều trị khác nhau đã được xem xét trong việc kiểm soát nám (Goel và Trivedi, 2023; Li và cộng sự, 2023). Về vấn đề này, hầu hết đều tiến hành bảo vệ da khỏi ánh sáng, những ảnh hưởng đến hoạt động của tế bào hắc tố, điều chỉnh các tế bào thượng bì và bao gồm tế bào nội mô, nguyên bào sợi, tế bào mast, tế bào bã nhờn và tế bào sừng, từ đó có thể ảnh hưởng đến hoạt động của tế bào hắc tố và đảo ngược tổn thương mô bất thường và quá trình lão hóa (Kwon và cộng sự, 2019). Hydroquinone như một chất làm mất sắc tố tại chỗ là một trong những lựa chọn điều trị được sử dụng phổ biến nhất trong quản lý nám. Tuy nhiên, các chất làm mất sắc tố tại chỗ khác bao gồm niacinamide, axit azelaic, 4-n-butylresorcinol, axit kojic, resveratrol và axit ascorbic được xem xét trong việc kiểm soát nám. Ngoài ra, các chất chống lão hóa đã được thêm vào các chất khử sắc tố để tạo ra phản ứng lâm sàng tối ưu. Về vấn đề này, liệu pháp phối hợp thuốc ba thành phần tại chỗ chứa hydroquinone 4%, tretinoin 0,05% và fluocinolone 0,01% đã nhận được sự chấp thuận của Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) trong quản lý nám. Tretinoin có cả đặc tính giảm sắc tố và chống lão hóa. Trong khi đó, các steroid bao gồm fluocinolone có thể ức chế tổn thương da do viêm và hình thành hắc tố. Bên cạnh các lựa chọn điều trị bằng thuốc và trị liệu khác nhau, nhiều phương pháp điều trị theo quy trình bao gồm liệu pháp laser, liệu pháp ánh sáng và lăn kim vi điểm đã được xem xét trong điều trị nám (Kwon và cộng sự, 2019).
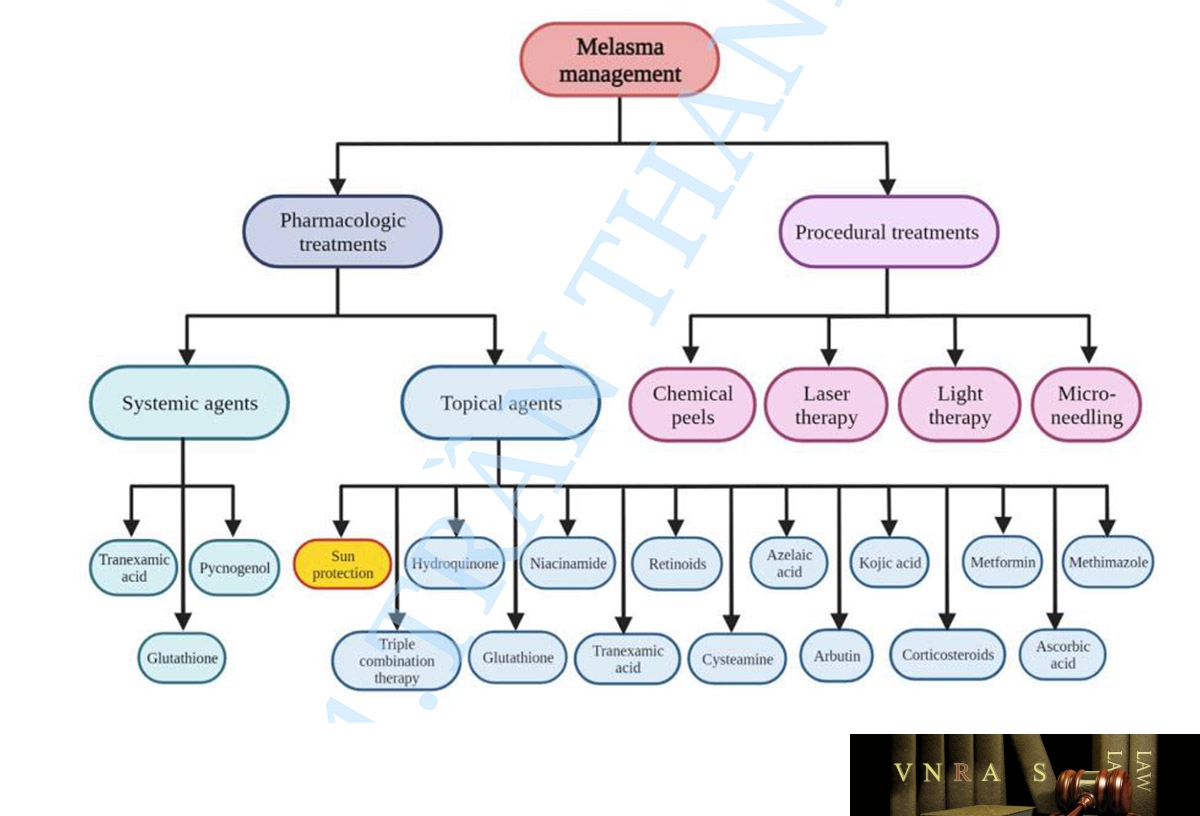
Mặc dù các phương pháp điều trị khác nhau bao gồm điều trị bằng thuốc và thủ thuật đã được xem xét trong quản lý nám, tuy nhiên, đây là một chứng rối loạn da mãn tính và tái phát. Do đó, điều trị nám, đặc biệt ở những bệnh nhân có loại da sẫm màu được phân loại từ Fitzpatrick loại IV đến VI, là một thách thức do khả năng tái phát và dễ bị tăng sắc tố sau viêm (PIH) (Rodrigues và Pandya, 2015). Các tác nhân điều trị tại chỗ và toàn thân khác nhau cũng như các phương pháp điều trị theo quy trình được xem xét trong quản lý nám được tóm tắt như sau.
Thuốc thoa điều trị nám.
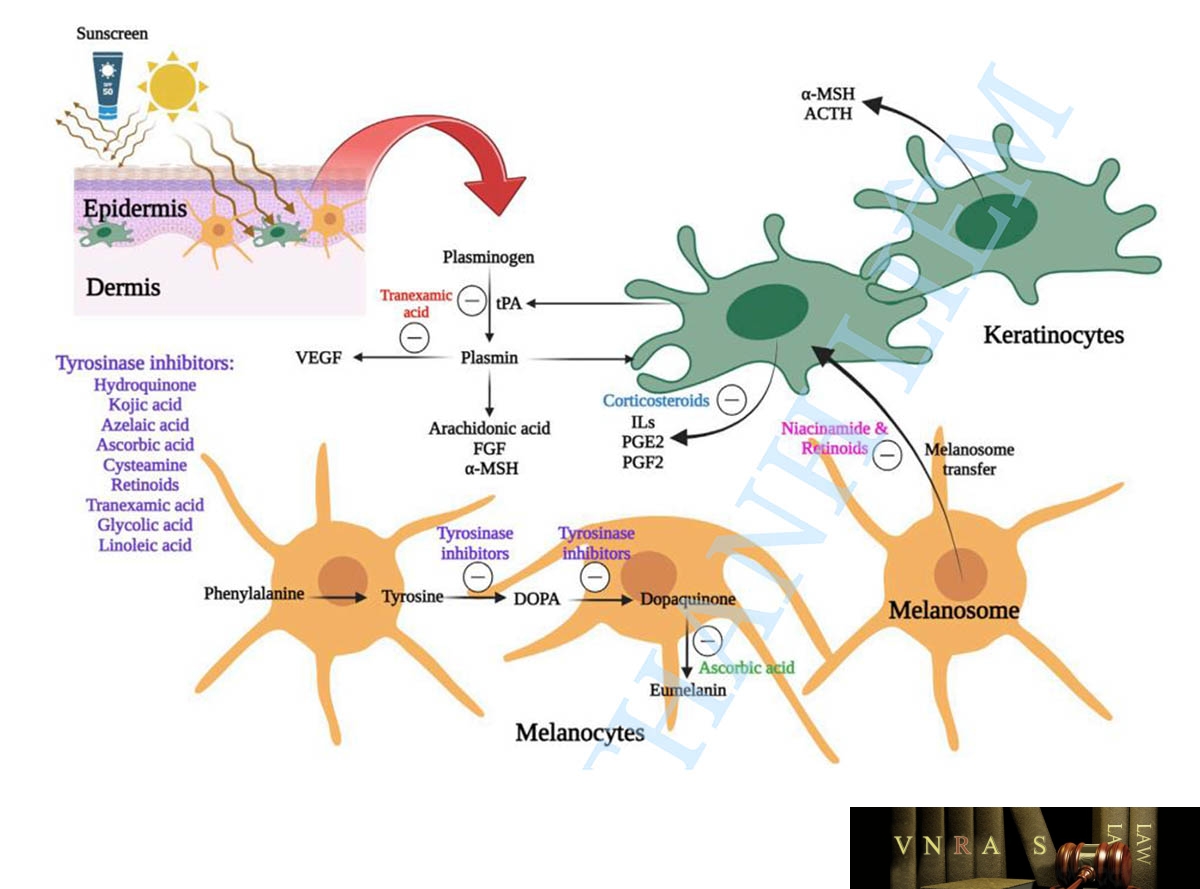
Đường dùng tại chỗ đã được coi là chiến lược chính để điều trị nám. Sơ đồ về các tác nhân trị liệu khác nhau và cơ chế hoạt động của chúng trong việc kiểm soát nám được trình bày trong Hình 3.
Kem chống nắng.
Chiến lược quan trọng để quản lý nám là bảo vệ da khỏi ánh nắng một cách nhất quán thông qua việc sử dụng các loại kem chống nắng phổ rộng với chỉ số chống nắng (SPF) ở mức cao đáng chú ý là 50+ và PPD là +++ hoặc ++++) (Jansen và cộng sự, 2013). Lão hóa da do ánh sáng mặt trời được mô tả là sự tích tụ elastin bất thường trong lớp bì do tiếp xúc với ánh nắng mặt trời lâu dài hoặc quá trình quang hóa. Mức độ elastin do năng lượng mặt trời cao đã được quan sát thấy ở da của bệnh nhân bị nám. Hơn nữa, kiểm tra mô học cho thấy da nám dày hơn, cong hơn và chứa nhiều sợi elastin phân mảnh hơn so với da bình thường (Rajanala et al., 2019a). Người ta đã báo cáo rằng việc tiếp xúc kéo dài với cả tia cực tím và ánh sáng khả kiến có thể dẫn đến tăng sắc tố ở mọi loại da, đặc biệt là những làn da sẫm màu (Mahmoud và cộng sự, 2010). Do đó, một trong những phương pháp quan trọng nhất trong quản lý nám và có khả năng giảm thiểu sự tiến triển của nó là bảo vệ da khỏi ánh sáng. Vì vậy, việc sử dụng thường xuyên kem chống nắng cùng với các tác nhân trị liệu khác có thể cải thiện kết quả lâm sàng ở bệnh nhân bị nám (Lakhdar và cộng sự, 2007).
Hydroquinone.
Hydroquinone là một chất hydroxyphenolic tự nhiên được sử dụng rộng rãi trong điều trị nám (Gupta và cộng sự, 2006; Tse, 2010). Các công thức bôi tại chỗ của hydroquinone có sẵn trên thị trường với nồng độ từ 2%-4% và được khuyến nghị là tiêu chuẩn vàng cho các rối loạn tăng sắc tố bao gồm cả nám (Boo, 2021). Hydroquinone có thể phá vỡ cấu trúc của tế bào hắc tố và ức chế cạnh tranh tyrosinase (Adalatkhah và Sadeghi-Bazargani, 2015; McKesey và cộng sự, 2020; Suryantari và cộng sự, 2020), do đó nó có thể ức chế sự chuyển đổi 1-3,4- dihydroxyphenylalanine thành melanin (Tse, 2010) và tiếp tục gây ra hoại tử melanin, điều này có thể tránh được quá trình hình thành hắc tố. Mặc dù có nhiều bằng chứng về tác dụng có lợi của hydroquinone tại chỗ trong điều trị nám (Haddad và cộng sự, 2003; Nordlund và cộng sự, 2006a; Tirado-Sánchez và cộng sự, 2009; Khosravan và cộng sự, 2017), tuy nhiên nó có thể gây ra nhiều phản ứng bất lợi khác nhau bao gồm ngứa, ban đỏ, viêm da tiếp xúc và bệnh ochronosis (Adalatkhah và Sadeghi-Bazargani, 2015; McKesey và cộng sự, 2020; Suryantari và cộng sự, 2020). Ochronosis có thể xảy ra thông qua việc sử dụng hydroquinone kéo dài mà không có đủ biện pháp bảo vệ khỏi ánh sáng (Bronzina và cộng sự, 2020). Hơn nữa, bệnh bạch cầu, mất sắc tố vĩnh viễn, giảm sắc tố giống bạch biến (Zhang và cộng sự, 2019) và khả năng xuất hiện ung thư có thể phát triển do tác dụng phụ của hydroquinone (Briganti và cộng sự, 2003; Westerhof và Kooyers, 2005). Tuy nhiên, các phản ứng bất lợi nêu trên có thể được ngăn chặn thông qua việc theo dõi bệnh nhân cẩn thận và hạn chế thời gian điều trị bằng hydroquinone (Nordlund và cộng sự, 2006b).
Retinoids.
Tất cả axit trans retinoic (ATRA), isotretinoin, retinol, retinaldehyd, tazarotene và adapalene đều nằm trong số các retinoids được sử dụng làm chất khử sắc tố trong quản lý nám. Chúng có thể được sử dụng với mục đích ức chế hoạt động tyrosinase, giảm sự vận chuyển melanin, tăng tốc độ luân chuyển tế bào sừng, phân tán melanin và tăng cường thẩm thấu vào da qua lớp sừng (Ortonne, 2006). Do đó, retinoids có thể được sử dụng đồng thời với các chất trị liệu tại chỗ khác để tăng cường khả năng thẩm thấu vào da (Ortonne, 2006; McKesey và cộng sự, 2020).
Việc áp dụng tretinoin (ATRA) trong các tổn thương ‘ám ở nồ ng độ từ 0,05%-0,1% có thể làm giảm sắc tố da một cách hiệu quả. Khả năng làm mất sắc tố này có thể là do sự ức chế phiên mã tyrosinase và làm gián đoạn quá trình tổng hợp melanin (Rendon và Dryer, 2016; McKesey và cộng sự, 2020). Mặc dù hiệu quả của tretinoin trong quản lý nám đã được xác định, tuy nhiên, cần có thời gian điều trị tối thiểu là 24 tuần để đạt được hiệu quả lâm sàng. Hơn nữa, việc bôi retinoids tại chỗ trên các tổn thương nám có thể liên quan đến tình trạng tăng sắc tố thứ phát do kích ứng do thuốc gây ra (Piẹtowska và cộng sự, 2022). Retinoids bôi tại chỗ cũng có thể gây ban đỏ, khô da, bong tróc và nhạy cảm với ánh sáng (Ball Arefiev và Hantash, 2012; Chandorkar et al., 2021). Hơn nữa, cảm giác nóng rát và châm chích là rõ ràng ở một số bệnh nhân. Tuy nhiên, những phản ứng bất lợi này chủ yếu được dung nạp tốt (Rendon và Dryer, 2016; González-Molina và cộng sự, 2022).
Corticosteroids.
Corticosteroids có vai trò quan trọng trong việc ức chế quá trình hình thành hắc tố do bức xạ UV-B gây ra. Cơ chế hoạt động tiềm năng của chúng là ức chế prostaglandin và cytokine, bao gồm nội mô 1 và yếu tố kích thích đại thực bào bạch cầu hạt (GM-CSF), là những chất kích thích chính sản xuất melanin (Ebanks và cộng sự, 2009). Corticosteroids là chất làm giảm sắc tố đơn trị liệu đã được chứng minh là có hiệu quả hạn chế và cũng có thể gây ra các phản ứng bất lợi tiềm ẩn bao gồm teo thượng bì, giãn mao mạch, mụn trứng cá, ban đỏ giống bệnh rosacea và viêm da quanh miệng (Menter, 2004). Vì vậy, sẽ hợp lý hơn nếu sử dụng corticosteroid đồng thời với các thuốc bôi khác để điều trị nám (Menter, 2004; González-Molina và cộng sự, 2022).
Liệu pháp phối hợp thuốc bôi 3 thành phần.
Hiệu quả lâm sàng của liệu pháp kết hợp thuốc ba thành phần (TC), còn được gọi là công thức Kligman’s- Willi, đã được chứng minh ở bệnh nhân nám. Một loại kem kết hợp ba thành phần cải tiến bao gồm hydroquinone, retinoids và steroids nồng độ thấp đã được coi là một phác đồ điều trị để kiểm soát nám. Dựa trên các nghiên cứu trước đây, liệu pháp phối hợp thuốc bà thành phần này được dung nạp tốt và có đủ hiệu quả lâm sàng. Việc bổ sung steroids vào sự kết hợp giữa hydroquinone và ATRA có thể ức chế hiệu quả các cytokine bài tiết có liên quan đến việc kích hoạt tế bào hắc tố cho quá trình tổng hợp melanin. Hơn nữa, việc áp dụng chế độ trị liệu kết hợp thuốc ba thành phần này có thể làm giảm tỷ lệ viêm và kích ứng da do hydroquinone hoặc retinoids gây ra (Gupta và cộng sự, 2006).
Kem Tri-Luma® chứa hydroquinone 4%, tretinoin 0,05% và fluocinolone acetonide 0,1% đã được FDA cấp phép để kiểm soát nám và nên bôi một lần mỗi ngày lên vùng da mặt bị ảnh hưởng trong ít nhất 8 tuần (Ferreira Cestari et al. , 2007; Spierings, 2020) Người ta đã báo cáo rằng sự khác biệt về hiệu quả lâm sàng của kem kết hợp ba thần phần và hydroquinone rõ ràng hơn ở những bệnh nhân có tông màu da sẫm hơn và cả ở những người có loại nám hỗn hợp (Chan và cộng sự, 2008).
Azelaic acid.
Axit Azelaic có thể ức chế enzyme ty thể và tổng hợp DNA trong tế bào hắc tố, có thể gây độc tế bào. Tác dụng ức chế tyrosinase của axit azelaic có thể ngăn chặn sự tổng hợp DNA trong các dòng tế bào khối u ác tính mà không có nguy cơ gây ra các phản ứng bất lợi có hại bao gồm chứng . chronosis (Balina và Graupe, 1991; González-Molina và cộng sự, 2022). Các nghiên cứu trước đây đã so sánh hiệu quả lâm sàng của axit azelaic với hydroquinone trong việc kiểm soát tình trạng tăng sắc tố da. Dựa trên các báo cáo, axit azelaic vượt trội hơn hydroquinone trong điều trị tăng sắc tố (Balina và Graupe, 1991; Farshi, 2011a; Komal và cộng sự, 2021; Sobhan và cộng sự, 2023). Mặc dù tiềm năng điều trị đầy hứa hẹn của axit azelaic trong trị nám, tuy nhiên do khả năng hòa tan trong nước hạn chế và tính thẩm thấu của da kém, các công thức bôi tại chỗ thông thường của nó đã được chế tạo với liều lượng cao hơn (10%-20%) để đạt được kế. quả lâm sàng mong muốn (Sieber và Hegel, 2014; Sobhan và cộng sự, 2023). Các phản ứng bất lợi phổ biến nhất đã được báo cáo với các công thức axit azelaic tại chỗ là nóng rát, ngứa, châm chích, khô và ban đỏ tạm thời và nhẹ (Kirsch và cộng sự, 2019; Malik và cộng sự, 2019; Pekmezci, 2019; Searle và cộng sự, 2022).
Tranexamic acid.
Việc sử dụng axit tranexamic trong điều trị nám lần đầu tiên được ghi nhận vào năm 1979. Axit tranexamic là một chất chống plasmin làm giảm sự hình thành axit arachidonic, từ đó làm giảm hormone kích thích tế bào hắc tố (MSH) và sản xuất sắc tố (Kanechorn và cộng sự, 2012b). Hơn nữa, axit tranexamic có thể ức chế sắc tố gây ra do tiếp xúc với ánh nắng mặt trời và bức xạ tia cực tím (Shihab et al., 2020). Hơn nữa, người ta đã chứng minh rằng endthelin-1 và VEGF, những chất chịu trách nhiệm tăng cường tưới máu ở các tổn thương nám, có thể bị giảm bớt khi sử dụng axit tranexamic. Axit Tranexamic có thể được sử dụng qua đường uống, trong da hoặc tại chỗ để điều trị nám (Shankar và cộng sự, 2014; Adalatkhah và Sadeghi-Bazargani, 2015; McKesey và cộng sự, 2020; Suryantari và cộng sự, 2020).
Sử dụng axit azelaic 20% tại chỗ và axit tranexamic 5% cho thấy kết quả đầy hứa hẹn trong việc kiểm soát tình trạng tăng sắc tố sau viêm ở những bệnh nhân được chẩn đoán mắc bệnh mụn trứng cá. Tuy nhiên, có vẻ như axit tranexamic bôi tại chỗ sẽ an toàn hơn so với axit azelaic trong điều trị tăng sắc tố (Sobhan và cộng sự, 2023)
Kojic acid.
Axit Kojic có thể có hiệu quả trong việc kiểm soát nám thông qua việc ức chế tổng hợp tyrosinase tự do (VIEIRA BRAZIL và cộng sự, 2023). Kojic dipalmitate là dẫn xuất este hóa của axit kojic có thể trải qua quá trình thủy phân tại chỗ ở các lớp da khác nhau để giải phóng axit kojic. Axit kojic được giải phóng có thể ức chế hơn nữa quá trình tổng hợp tyrosinase và melanin. Ưu điểm chính của kojic dipalmitate so với axit kojic là khả năng quang hóa, ổn định nhiệt và ổn định ở phạm vi pH rộng trong các công thức bôi ngoài da khác nhau. Tuy nhiên, do tính chất kết tinh, tính ưa mỡ cao và khả năng hòa tan trong nước thấp của kojic dipalmitate, việc kết hợp nó trong các công thức thuốc bôi sẽ khó khăn hơn (Zilles và cộng sự, 2023). Dựa trên các nghiên cứu trước đây, sự kết hợp giữa axit kojic tại chỗ và hydroquinone sẽ là một chế độ điều trị khử sắc tố đầy hứa hẹn. Axit Kojic cũng có thể được sử dụng trong bệnh viêm da tiếp xúc kích ứng và erythema (Deo và cộng sự, 2013; Yenny, 2018). Các nghiên cứu trước đây đã báo cáo kết quả hiệu quả lâm sàng thuận lợi của các công thức axit kojic tại chỗ ở nồng độ khác nhau, riêng lẻ hoặc kết hợp với các tác nhân trị liệu khác (Monteiro và cộng sự, 2013; Saeedi và cộng sự, 2019).
Cysteamine.
Cysteamine là một aminothiol sinh tổng hợp được sản xuất trong tế bào động vật có vú và được biết đến rộng rãi nhờ đặc tính chống oxy hóa (Besouw et al., 2013). Ngoài ra, nhiều nghiên cứu in vivo và in vitro đã chứng minh đặc tính chống ung thư và chống đột biến của nó. Hơn nữa, Cysteamine đã được công nhận là chất làm mất sắc tố hiệu quả trong điều trị nám (Besouw và cộng sự, 2013). Mặc dù cơ chế chính xác về khả năng khử sắc tố của Cysteamine vẫn chưa rõ ràng, tuy nhiên, đã có báo cáo rằng không liên quan đến độc tính tế bào hắc tố (Qiu và cộng sự, 2000; Karrabi và cộng sự, 2021). Mặc dù có những kết quả đầy hứa hẹn về liệu pháp điều trị nám bằng Cysteamine tại chỗ về mặt hiệu quả và an toàn lâm sàng, tuy nhiên, việc áp dụng nó vẫn còn nhiều thách thức do tính không ổn định và mùi khó chịu được tạo ra trong quá trình oxy hóa (2013).
Ascorbic acid.
Axit ascorbic, còn được gọi là vitamin C, là một chất chống oxy hóa có thể liên kết với đồng và ức chế thành công enzyme tyrosinase. Do đó, nó có thể ngăn chặn quá trình oxy hóa của các chất trung gian melanin. Do đó, việc sản xuất melanin trong quá trình hình thành hắc tố sẽ bị ức chế khi sử dụng axit ascorbic (Ebanks và cộng sự, 2009; Telang, 2013). Dựa trên các nghiên cứu trước đây, axit ascorbic, như một chất khử sắc tố, có thể được dung nạp tốt với nguy cơ kích ứng tối thiểu so với hydroquinone 4% tại chỗ (Espinal-Perez và cộng sự, 2004; Hwang và cộng sự, 2009). Các công thức ’itamin C bôi ngoài da khác nhau với nồng độ trong khoảng 3,75%- 30% đã được xem xét trong điều trị nám, tuy nhiên, trong hầu hết các nghiên cứu, nồng độ vitamin C nhỏ hơn 10% cho mục đích điều trị nám và tổn thương da do ánh sáng (Correia và Magina, 2023).
Glycolic acid.
Axit glycolic, dưới dạng axit a-hydroxy (AHA), có vai trò quan trọng trong việc phá vỡ sự bám dính của tế bào và làm bong tróc da. Ngoài ra, axit glycolic có thể ức chế hoạt động của tyrosinase và do đó ngăn chặn việc sản xuất melanin (Chaudhary và Dayal, 2013; Austin và cộng sự, 2019). Nhiều nghiên cứu đã chỉ ra rằng lột da bằng axit glycolic có thể làm tăng hiệu quả lâm sàng của các thuốc bôi khác, đặc biệt ở những người có tông màu da sẫm màu hơn (Ibrahim và cộng sự, 2015; Choi và cộng sự, 2019). Các phản ứng bất lợi phổ biến nhất của axit glycolic tại chỗ là ban đỏ, ngứa và viêm từ nhẹ đến trung bình. Việc sử dụng các chất giữ ẩm cường độ cao sẽ hữu ích để giảm bớt những phản ứng bất lợi này (Ibrahim và cộng sự, 2015).
Niacinamide
Niacinamide, còn được gọi là vitamin B3, là dạng hoạt động của niacin (Farshi, 2011b; Rolfe, 2014) và có thể được sử dụng trong điều trị nám (Navarrete-Solís et al., 2011) và rối loạn tăng sắc tố (Kimball et al., 2010) thông qua việc điều hòa chuyển melanosome từ tế bào hắc tố sang tế bào sừng. Do đó, niacinamide có thể làm giảm sự tích tụ melanin ở các lớp da. Ngoài khả năng làm mất sắc tố, niacinamide còn thể hiện đặc tính chống viêm và bảo vệ da trước những thay đổi thoái hóa do ánh nắng mặt trời (Farshi, 2011b; Rolfe, 2014). Về vấn đề này, việc sử dụng niacinamide tại chỗ đã được xem xét rộng rãi trong việc kiểm soát nám. Việc sử dụng niacinamide tại chỗ kéo dài có thể đi kèm với một số phản ứng bất lợi nhẹ bao gồm bỏng nhẹ, ban đỏ và ngứa (Taylor và cộng sự, 2003).
Salicylic acid.
Axit salicylic, dưới dạng axit P-hydroxy (BHA), thường được sử dụng trong các sản phẩm mỹ phẩm như một chất tẩy tế bào chết nhằm mục đích làm sáng da. Tác dụng này có thể là do khả năng tiêu sừng và khả năng hòa tan lipid của nó. Ngoài ra, axit salicylic còn có đặc tính kháng khuẩn và chống viêm. Việc sử dụng axit salicylic tại chỗ trong điều trị nám có thể dẫn đến một số phản ứng bất lợi bao gồm ban đỏ, cảm giác nóng rát, kích ứng, bong tróc, phồng rộp hoặc đóng vảy (Dahl và cộng sự, 2013; González-Molina và cộng sự, 2022). Hiệu quả của lột da bằng axit salicylic trong điều trị nám có thể được nâng cao thông qua liệu pháp kết hợp với axit mandelic (Spierings, 2020).
Arbutin.
Arbutin là một glucopyranoside hữu cơ có thể ức chế hoạt động của tyrosinase và tránh sự trưởng thành của tế bào hắc tố mà không có nguy cơ bị tác dụng độc hại. Ngoài ra, deoxy-arbutin là chất ức chế tyrosine hydroxylase phụ thuộc vào liều lượng, có thể ức chế hơn nữa quá trình hình thành hắc tố. Do đó, arbutin bôi ngoài da có khả năng làm sáng da sẽ có triển vọng trong điều trị nám và tăng sắc tố (Raton, 2011; Searle et al., 2020).
Các thuốc thoa khác.
Các chất bôi ngoài da khác bao gồm thiamidol, axit linoleic, axit phytic, chiết xuất nấm men, chiết xuất dâu tằm, rucinol, undecylenoyl phenylalanine và các yếu tố tăng trưởng thượng bì đã được báo cáo trong các nghiên cứu trước đây là hợp chất hiệu quả trong quản lý nám (Lee và cộng sự, 2002; Gupta và cộng sự, 2006; Khemis và cộng sự, 2007; Alvin và cộng sự, 2011; Katoulis và cộng sự, 2014; Lyons và cộng sự, 2018; Huerth và cộng sự, 2019; González-Molina và cộng sự, 2022).
Thuốc uống điều trị nám.
Tranexamic acid.
Axit tranexamic đường uống đã được chứng minh là có hiệu quả như một liệu pháp bổ trợ cho các trường hợp nám dai dẳng hoặc là phương pháp điều trị thứ hai hoặc thứ ba (Kim và cộng sự, 2017). Axit Tranexamic thường được dùng trong điều trị nám với liều 250 mg hai lần mỗi ngày (Shin và cộng sự, 2013) đơn trị liệu hoặc kết hợp với các lựa chọn điều trị khác (Karn và cộng sự, 2012; Kim và cộng sự, 2017; Bala và cộng sự ., 2018). Nhiều thử nghiệm lâm sàng đã chỉ ra rằng tác dụng khử sắc tố của axit tranexamic được quan sát thấy sau một đợt điều trị ít nhất 2-3 tháng (Lee và cộng sự, 2016a; Kim và cộng sự, 2017). Không nên rút ngắn thời gian điều trị bằng axit tranexamic do nguy cơ tái phát nám cao sau khi ngừng thuốc (Kim và cộng sự, 2017). Các phản ứng bất lợi có thể xảy ra khi điều trị bằng axit tranexamic đường uống là chướng bụng, đau đầu và kinh nguyệt không đều, hiếm gặp và thoáng qua (Lee và cộng sự, 2016a). Mối quan tâm chính liên quan đến liệu pháp điều trị bằng axit tranexamic toàn thân là nguy cơ xảy ra các biến cố huyết khối. Về vấn đề này, nên xem xét sàng lọc chính xác tiền sử cá nhân và gia đình về các biến cố huyết khối, đột quỵ và bệnh tim trước khi bắt đầu trị liệu (Ball Arefiev và Hantash, 2012; Lee và cộng sự, 2016a).
Các điều trị khác.
Glutathione
Glutathione là một tripeptide sinh tổng hợp bao gồm glutamate, cysteine và glycine, được coi là một trong những chất chống oxy hóa nội sinh mạnh nhất. Cơ chế làm sáng da của glutathione có thể là do sự ức chế tyrosinase và sự thay đổi hơn nữa trong quá trình chuyển đổi eumelanin thành pheomelanin (Pillaiyar và cộng sự, 2017; Weschawalit và cộng sự, 2017; Grimes và cộng sự, 2019).
Carotenoids
Carotenoids là các sắc tố tự nhiên được chiết xuất từ thực vật, tảo và vi khuẩn quang hợp. Chúng được biết đến với đặc tính chống viêm, chống oxy hóa và bảo vệ da khỏi ánh sáng có thể ngăn chặn quá trình lão hóa do ánh sáng (Galasso và cộng sự, 2017).
Thiamidol
Thiamidol là một chất ức chế tyrosinase mạnh có thể ngăn ngừa hiệu quả tình trạng tăng sắc tố do UVB gây ra (Vachiramon và cộng sự, 2021). Kết quả của một thử nghiệm lâm sàng ngẫu nhiên cho thấy hiệu quả của kem thiamidol 0,2% tương đương với kem hydroquinone 4% (Vachiramon và cộng sự, 2021).
Chất chống oxi hóa.
Các chất chống oxy hóa khác nhau bao gồm axit ascorbic và kẽm thường được sử dụng thông qua đường bôi hoặc đường uống để kiểm soát nám (Sarkar và cộng sự, 2012b; Yousefi và cộng sự, 2014). Việc bôi vitamin C và kẽm tại chỗ đã giúp cải thiện đáng kể các tổn thương da với ít phản ứng bất lợi nhất (Sharquie và cộng sự, 2008; Hwang và cộng sự, 2009). Các chất chống oxy hóa khác bao gồm hồng sâm Hàn Quốc (Song và cộng sự, 2011), Petroselinum Crispum (Khosravan và cộng sự, 2017), và chiết xuất hoa lan cũng được xem xét trong điều trị nám và cho thấy hiệu quả và khả năng dung nạp thuận lợi (Tadokoro và cộng sự, 2010).
Pycnogenol
Pycnogenol là một chiết xuất thảo dược đã được tiêu chuẩn hóa với khả dụng sinh học cao, tác dụng hiệp đồng với các chất làm sáng da khác và khả năng gây độc thấp qua đường uống. Pycnogenol giúp giảm tình trạng tăng sắc tố ở bệnh nhân nám sau 1 tháng điều trị toàn thân (Sarkar và cộng sự, 2012b; Babbush và cộng sự, 2021).
Thủ thuật điều trị.
Lột da bằng hóa chất.
Lột da bằng hóa chất bao gồm axit glycolic, axit salicylic hoặc axit trichloroacetic đã được xem xét trong việc kiểm soát nám và cho thấy hiệu quả lâm sàng ở mức vừa phải. Tuy nhiên, lột da bằng hóa chất có thể gây kích ứng, rát và viêm sau khi điều trị và cũng có thể gây tái phát nám (Sheth và Pandya, 2011; Sarkar và cộng sự, 2012a). Axit Glycolic được sử dụng phổ biến nhất để điều trị nám (Erbil và cộng sự, 2007). Dựa trên các nghiên cứu trước đây, liệu pháp đơn trị liệu hoặc kết hợp axit glycolic với hydroquinone và tretinoin đều không mang lại kết quả lâm sàng vượt trội và có thể gây ra nhiều phản ứng bất lợi hơn (Lim và Tham, 1997; Faghihi và cộng sự, 2011; Chaudhary và Dayal, 2013).
Liệu pháp laser và ánh sáng.
Các liệu pháp điều trị bằng laser và ánh sáng là những phương thức sử dụng năng lượng ánh sáng để điều trị các tổn thương da (Piẹtowska và cộng sự, 2022). Liệu pháp laser và ánh sáng được coi là lựa chọn điều trị thứ ba trong quản lý nám cho những người không đáp ứng với các tác nhân trị liệu tại chỗ và lột da bằng hóa chất. Liệu pháp laser và ánh sáng có thể đẩy nhanh quá trình loại bỏ melanin (Trivedi và cộng sự, 2017). Ánh sáng xung cường độ cao (IPL), laser Q-switching lưu lượng thấp (LFQS), laser phân đoạn không xâm lấn (NAFL) và laser picosecond là một trong những liệu pháp ánh sáng và laser được sử dụng thường xuyên nhất trong quản lý nám (Goel et al. , 2011). Tuy nhiên, phản ứng của bệnh nhân có thể không thể đoán trước và dẫn đến tình trạng tăng sắc tố tái phát (Hofbauer Parra và cộng sự, 2016; Piẹtowska và cộng sự, 2022).
Micro-needling.
Micro-needling thường được coi là phương pháp điều trị kích thích sản sinh collagen, bao gồm việc chọc thủng da nhiều lần bằng kim siêu nhỏ vô trùng (Ball Arefiev và Hantash, 2012). Quy trình này có thể tạo ra phản ứng sinh lý giúp tạo điều kiện thuận lợi hơn nữa cho quá trình phục hồi vết thương cũng như tổng hợp collagen và elastin (Bailey và cộng sự, 2022). Micro-needling có thể được sử dụng để tăng cường khả năng vận chuyển dược phẩm qua da. Micro-needling có thể bảo tồn tính toàn vẹn của lớp thượng bì đồng thời có thể đẩy nhanh quá trình chữa lành và giảm nguy cơ nhiễm trùng và hình thành sẹo (Cohen và Elbuluk, 2016; Saleh và cộng sự, 2019).
Phương pháp mới trong điều trị nám.
Các phản ứng có hại khác nhau của thuốc có liên quan đến điều trị toàn thân và cũng có nhiều thách thức liên quan đến khả năng thẩm thấu qua da và hiệu quả lâm sàng của các công thức thông thường tại chỗ được xem xét trong quản lý nám. Về vấn đề này, trong những năm gần đây, các phương pháp tiếp cận mới bao gồm việc sử dụng công nghệ nano trong việc phân phối thuốc bôi tại chỗ có mục tiêu đã được xem xét để khắc phục những nhược điểm này và mang lại phản ứng lâm sàng tối ưu (Salvioni và cộng sự, 2021). Do đó, các loại hạt nano khác nhau bao gồm cả hạt nano lipid , nhũ tương nano/vi nhũ tương, chất mang nano, hạt nano polyme, tinh thể nano và hạt nano kim loại đã được sử dụng làm hệ thống phân phối thuốc tại chỗ để quản lý nám.
Hạt nano lipid.
Các hạt nano lipid rắn (SLN) và chất mang lipid có cấu trúc nano (NLC), lần lượt là thế hệ hạt nano lipid thứ nhất và thứ hai, có các đặc tính đầy hứa hẹn cho mục đích phân phối thuốc tại chỗ. Ngoài ra, SLN và NLC có thể mang lại lợi ích vượt trội về mặt thẩm mỹ và da liễu, bao gồm tăng độ đàn hồi cho da, tăng cường hydrat hóa, cải thiện khả năng thẩm thấu và lắng đọng thuốc của da cũng như bảo vệ thuốc chống lại sự thoái hóa (Hajare và cộng sự, 2014; Ghanbarzadeh và cộng sự, 2015b).
SLNs
SLNs là hệ thống phân phối thuốc dạng keo bao gồm các ma trận lipid rắn ở nhiệt độ cơ thể và cả chất nhũ hóa. Những hạt nano này thường có đường kính trung bình từ 50 đến 1.000 nm (Paliwal và cộng sự, 2020).
SLNs cho thấy kết quả đầy hứa hẹn trong việc đóng gói hydroquinone như một tác nhân ưa nước. Về vấn đề này, việc đóng gói hydroquinone trong SLNs đi kèm với độ ổn định thuốc cao hơn trước quá trình oxy hóa và tăng cường khả năng thâm nhập vào da cùng với sự hấp thu toàn thân giảm đi. Kết quả của các nghiên cứu trước đây về công thức gel bôi tại chỗ của SLNs chứa hydroquinone cho thấy sự lắng đọng thuốc cao hơn đáng kể trong lớp thượng bì (46,5% ± 2,6%) so với gel thông thường của hydroquinone (15,1% ± 1,8%) (Ghanbarzadeh et al. , 2015b). Ngoài ra, kết quả của một nghiên cứu về tính thẩm thấu trong ống nghiệm trên da chuột cho thấy sự tích lũy thuốc trong các lớp da cao hơn khoảng 3 lần, trong khi dòng thuốc đi vào pha thụ thể của tế bào Franz thấp hơn khoảng 6,5 lần trong SLNs chứa hydroquinone ở so sánh với gel hydroquinone đã xác nhận khả năng hấp thụ toàn thân giảm và giảm hơn nữa các phản ứng có hại của thuốc thông qua việc đóng gói trong SLNs (Wu và cộng sự, 2017).
Việc đóng gói axit Kojic trong SLNs có thể cải thiện đáng kể việc dẫn thuốc qua da. Về vấn đề này, SLNs chứa axit kojic cho thấy nồng độ thuốc cao hơn trong các lớp da, giải phóng thuốc được kiểm soát và khả năng ức chế tyrosinase cao hơn so với công thức thông thường (Khezri và cộng sự, 2020b).
NLCs
Dựa trên kết quả của các nghiên cứu trước đây, việc đóng gói hydroquinone trong NLCs đi kèm với việc tăng cường độ ổn định của thuốc, phân phối thuốc theo mục tiêu và giảm kích ứng da (Wu và cộng sự, 2019). Hơn nữa, NLCs chứa hydroquinone cải thiện đáng kể khả năng thẩm thấu vào da và bảo vệ bức xạ UVA/UVB so với công thức hydroquinone thông thường (Wu và cộng sự, 2017).
Theo các nghiên cứu trước đây, NLCs chứa axit azelaic mang lại đặc tính bít tắc hơn, tăng cường khả năng thẩm thấu vào da, đưa thuốc đến các tế bào hắc tố với hiệu quả lâm sàng được nâng cao (Kumari và cộng sự, 2015). Hơn nữa, khả năng giải phóng bền vững của NLCs chứa axit azelaic sẽ thuận lợi cho việc vận chuyển thuốc tại chỗ do sự lắng đọng thuốc cục bộ kéo dài trong các lớp da (Tangau và cộng sự, 2022).
Liposomes/Nanosomes.
Liposomes là hệ thống phân phối hạt nano dạng bóng bóng hoặc hình cầu bao gồm các lớp lipid kép gồm phospholipid và cholesterol. Liposomes có khả năng bao bọc cả thuốc kỵ nước và thuốc ưa nước, đồng thời cũng có khả năng kết hợp với màng tế bào để điều chỉnh tính lưu động của nó và tạo điều kiện cho thuốc được nạp vào da và phân phối (Sharma et al., 2018). Việc sử dụng liposomes làm hệ thống phân phối thuốc tại chỗ sẽ đầy hứa hẹn nhờ nhiều ưu điểm của chúng bao gồm tăng cường khả năng thẩm thấu vào da qua lớp sừng, tác dụng giữ ẩm và phục hồi da, kiểm soát giải phóng thuốc cũng như các đặc tính tương thích sinh học và phân hủy sinh học (Rahimpour và Hamishehkar, 2012).
Kết quả của một nghiên cứu in vitro trước đây chỉ ra rằng liposome chứa arbutin có tốc độ hấp thụ và dòng thuốc chậm hơn cùng với sự lắng đọng trên da cao hơn và lâu hơn so với dung dịch arbutin. Do đó, sự hấp thu toàn thân của thuốc được nạp giảm đáng kể thông qua việc đóng gói trong liposomes (Wen và cộng sự, 2006b).
Bệnh nhân bị nám được điều trị bằng huyết thanh liposome có chứa axit azelaic, 4-n-butylresorcinol và retinol. Sau quá trình điều trị, điểm MASI của các bệnh nhân tham gia đã tăng từ 41,7% lên 85%, tuy nhiên, thang mức độ nghiêm trọng của nám (MSS) đã giảm từ trung bình (điểm 2) xuống nhẹ (điểm 1) trong suốt quá trình điều trị (Kusumawardani và cộng sự, 2019).
Những phát hiện của một cuộc điều tra sơ bộ chỉ ra rằng liposome hydroquinone, như một chất ức chế tyrosinase, nâng cao hiệu quả điều trị một cách hiệu quả. Các niosomes chứa hydroquinone 4% được chế tạo thông qua phương pháp nhiệt hạch và được đặc trưng. Điểm MASI thu được từ nghiên cứu sơ đồ này cho thấy hiệu quả điều trị đáng kể của hydroquinone liposomal so với kem hydroquinone thông thường (Banihashemi et al., 2015a). Kết quả của một nghiên cứu khác chỉ ra rằng mặc dù tác dụng điều trị của hydroquinone trong điều trị nám vẫn được duy trì sau khi đóng gói trong liposomes, tuy nhiên, không có sự vượt trội đáng kể nào so với kem thông thường (Taghavi và cộng sự, 2019b).
Việc kết hợp 4-n-butyl resorcinol vào liposomes đã giúp tăng cường độ ổn định của thuốc, cải thiện khả năng thẩm thấu vào da, cũng như tăng khả năng ức chế tyrosinase, từ đó dẫn đến ức chế hình thành hắc tố hiệu quả hơn (Huh và cộng sự, 2010).
Niosomes.
Niosomes là các chất mang nano dạng hình cầu (hạt nước) bao gồm các chất hoạt động bề mặt không ion có khả năng tăng cường khả năng thẩm thấu. Niosomes được chế tạo thông qua quá trình tự tổng hợp các chất hoạt động bề mặt không ion trong môi trường nước, thường thông qua kỹ thuật hydrat hóa màng mỏng hoặc phun dung môi (Rigano và Lionetti, 2016; Singh và Sharma, 2016).
Axit Kojic và hydroquinone được bao bọc đồng thời trong các hạt noisomes. Công thức bôi tại chỗ được bào chế có mô hình giải phóng thuốc kéo dài (Divanbeygikermani và cộng sự, 2018).
Transfersomes.
Transfersomes là các chất mang nano dạng hạt nước tương thích sinh học với khả năng biến dạng cao được cấu thành từ lớp lipid kép và chất làm mềm màng (Chiranjeevi và cộng sự, 2013; Fadel và cộng sự, 2017). Transfersomes có triển vọng trong việc vận chuyển thuốc qua da do khả năng biến dạng cao, dễ dàng thẩm thấu vào da qua lớp sừng, tăng cường dòng thuốc qua thượng bì và lắng đọng da lâu hơn (Hatem et al., 2018).
Việc kết hợp niacinamide vào các transfersomes đi kèm với việc tăng cường khả năng thẩm thấu vào da và cải thiện hiệu quả khử sắc tố so với công thức niacinamide liposomal thông thường (Lee và cộng sự, 2016b).
Việc đóng gói arbutin trong các thể chuyển giao đã làm tăng khả năng thẩm thấu qua da và nâng cao hiệu quả khử sắc tố của thuốc được nạp (Wen và cộng sự, 2006b).
Nanoemulsions/microemulsions.
Nhũ tương nano được coi là hệ thống phân phối thuốc phù hợp để đi qua hàng rào ưa mỡ nhằm mục đích phân phối thuốc qua da. Nhũ tương nano và vi nhũ tương bao gồm các pha nước và pha hữu cơ không thể trộn lẫn được ổn định thông qua việc kết hợp một lượng tương đối lớn hơn các chất hoạt động bề mặt thích hợp làm chất nhũ hóa. Vi nhũ tương có triển vọng trong lĩnh vực dược mỹ phẩm và hệ thống phân phối thuốc tại chỗ với ưu điểm chính là tăng khả năng hòa tan thuốc, cải thiện khả năng thẩm thấu của da qua hàng rào lớp sừng và tăng cường khả dụng sinh học (Ghosh và Murthy, 2006; Hatem và cộng sự, 2020).
Arbutin với nhũ tương nano được bao bọc cùng với axit coumaric cho thấy hiệu quả bao bọc được nâng cao, độ ổn định của thuốc tăng lên, giải phóng thuốc được duy trì và cải thiện khả năng phân phối qua da so với thuốc tự do (Wen và cộng sự, 2006a; Huang và cộng sự., 2019). Hơn nữa, arbutin được kết hợp với axit lactic và niacinamide trong vi nhũ tương để tăng cường độ ổn định của thuốc, khả năng thẩm thấu vào da và tác dụng làm trắng (Surini và Mellani, 2017b).
Kết quả của một nghiên cứu trước đây về nhũ tương nano chứa axit azelaic và axit hyaluronic cho thấy sự lắng đọng thuốc vượt trội trong các lớp da, tăng cường khả năng ức chế tyrosinase và giảm độc tính tế bào (Tomic và cộng sự, 2019b). Hơn nữa, việc bổ sung axit hyaluronic vào nhũ tương nano axit azelaic làm giảm tổng hợp melanin một cách hiệu quả thông qua các tương tác tăng cường tế bào hắc tố-nano nhũ tương (Atrux-Tallau và cộng sự, 2014b).
Dựa trên kết quả của một nghiên cứu in vitro trước đây, vi nhũ tương hydroquinone 4% cho thấy lượng thuốc giải phóng cao hơn, độ ổn định của thuốc cao hơn và giảm kích ứng da cũng như rối loạn lớp da so với kem hydroquinone thông thường (ủstũndag Okur et al., 2019) . Hơn nữa, việc bao bọc hydroquinone trong vi nhũ tương đi kèm với việc tăng tính thấm của da qua lớp sừng và cũng tăng cường khả năng ổn định ánh sáng (Tirnaksiz và cộng sự, 2012; Salimi và Hajiani, 2018).
Kojic monooleate, như một chất ức chế tyrosinase được biết đến, được bao bọc trong nhũ tương nano và kết quả gây độc tế bào cho thấy tỷ lệ sống sót là 54,76% đối với tế bào 3T3 (Syed Azhar và cộng sự, 2018). Hơn nữa, việc đóng gói kojic dipalmitate trong nhũ tương nano đi kèm với sự ổn định của thuốc được cải thiện (Al-Edresi và Baie, 2009).
Sự kết hợp của axit ascorbic trong vi nhũ cải thiện hiệu quả sự thẩm thấu qua da của thuốc được nạp và cũng tạo ra khả năng bảo vệ da cao hơn (Pakpayat và cộng sự, 2009).
Việc kết hợp axit kojic và arbutin trong vi nhũ tương đi kèm với khả năng ổn định ánh sáng cao hơn trước bức xạ UVB đối với cả hai loại thuốc so với dung dịch nước của axit kojic và arbutin (Gallarate và cộng sự, 2004).
Metal nanoparticles.
Phân tán các hạt nano vàng trong nước với độ ổn định cao, khả năng tương thích sinh học và khả năng trơ hóa học cao là các chất mang nano thích hợp cho mục đích phân phối thuốc tại chỗ (Khodakiya và cộng sự, 2012).
Các hạt nano Arbutin và vàng được trộn lẫn để tạo ra một phức hợp nano có khả năng làm sáng da cao hơn. Kết quả của nghiên cứu này chỉ ra rằng phức hợp nano arbutin được điều chế đi kèm với việc sản xuất melanin nội bào và ngoại bào thấp hơn, tác dụng chống viêm cao hơn và giảm khả năng độc tính so với thuốc tự do (Jiménez-Pérez và cộng sự, 2018; Park và cộng sự ., 2019a).
Polymeric nanoparticles.
Các hạt nano polyme bao gồm các hạt nano và các viên nang nano có thể hoạt động như một hệ thống ma trận hoặc bể chứa (Banihashemi et al., 2015b). Do đó, chúng có thể được sử dụng để bao bọc các tác nhân trị liệu khác nhau nhằm kiểm soát kiểu giải phóng thuốc và kéo dài thời gian lắng đọng thuốc trong các lớp da nhằm mục đích phân phối thuốc tại chỗ (Guterres và cộng sự, 2007).
Các hạt nano guar gum lưỡng tính liên kết với arbutin đã được điều chế và mô tả. Dựa trên kết quả, các hạt nano polyme được chế tạo có mức độ kỵ nước cao hơn, giúp cải thiện khả năng thẩm thấu của da qua lớp sừng. Ngoài ra, kết quả về độc tính tế bào trên tế bào keratinocyte ở người (tế bào HaCaT) cho thấy khả năng gây độc thấp hơn đối với các hạt nano polyme được nạp arbutin đã được điều chế (Bostanudin và cộng sự, 2021).
Việc sử dụng N-(2-hydroxyl) propyl-3-trimethyl amoni chitosan clorua làm vật liệu phủ bề mặt liposome đi kèm với việc tăng cường khả năng thẩm thấu vào da của axit kojic và giảm tổng hợp melanin so với công thức axit kojic liposome thông thường (Wang et al. , 2012a; Singh và cộng sự, 2023).
Việc bao bọc axit ascorbic trong các hạt nano ethyl cellulose giúp tăng cường độ ổn định của thuốc, tăng hoạt tính chống tyrosinase và do đó cải thiện khả năng làm trắng da (Duarah và cộng sự, 2017b; Singh và cộng sự, 2023).
Nanocrystals.
Các tinh thể nano với khả năng hòa tan thuốc được cải thiện, tốc độ hòa tan được tăng cường và độ bám dính của da tăng lên hứa hẹn cho mục đích phân phối thuốc tại chỗ (Vidlárová và cộng sự, 2016; Malamatari và cộng sự, 2018).
Axit Azelaic là thuốc tan trong nước, có cấu trúc gồm 2 nhóm axit cacboxylic nên có khả năng thẩm thấu qua da hạn chế. Về vấn đề này, việc chế tạo các tinh thể nano axit azelaic phân tán trong Pluronic F127 và axit hyaluronic đi kèm với khả năng hòa tan, tốc độ hòa tan, độ ổn định của thuốc và tính thấm của da được tăng cường (Tomic và cộng sự, 2019b).
Fullerenes.
Fullerenes, còn được gọi là xi lanh ống nano carbon C60, là các hạt nano hình cầu có carbon trong cấu trúc của chúng (Jiménez-Pérez và cộng sự, 2018). Thể tích bên trong khổng lồ của fullerenes có khả năng chứa nhiều phân tử sinh học khác nhau. Ngoài ra, bề mặt bên ngoài của fullerenes có thể được biến đổi về mặt hóa học nhằm mục đích phân phối thuốc tại chỗ (Koo và cộng sự, 2005).
Trong một nghiên cứu khác, axit L-ascorbic và fullerenes chứa arbutin được kết hợp trong polyvinyl pyrrolidone. Theo kết quả, hệ thống phân phối này có liên quan đến việc tăng cường hoạt động chống tyrosinase và giảm sự hình thành hắc tố do UVA gây ra so với axit L-ascorbic và dung dịch arbutin (Xiao và cộng sự, 2007b).
Bảng 2. Tóm tắt các loại hạt nano khác nhau, tải trọng, kích thước hạt và ưu điểm của việc bọc thuốc trong quản lý nám.
| Nanocarrier | Drug | Drug percentage | Particle size | Entrapment efficiency (% EE) and loading capacity (%LC) | Advantages/Outcome | Reference(s) |
| SLNs(a) | Hydroquinone | 2% | 86 nm | %EE: 89.50% ± 4.50% | Enhanced skin deposition | Ghanbarzadeh et al. (2015a). Salimi and Hajiani (2018) |
| %LC: 11.20% ± 1.30% | Higher drug accumulition within skin layer | |||||
| Reduced systemic absorption | ||||||
| Kojic acid | 0.2% | 156.97 ± 7.15 nm | %EE 59.02% ± 0.74% | Improve dermal delivery of kojic acid | Khezri et al., 2020a | |
| %LC: 14.75% ± 1.63% | ||||||
| NLCs(b) | Hydroquinone | 5% | 393.30 ± 28.23 nm | %EE 22.13% ± 2.66% | Enhanced drug stability | Wu et al. (2017) |
| Diminished skin irritation | ||||||
| LC: 19.28% ± 4.77% | Improved skin penetration | |||||
| Enhanced protection against UVA/UVB radiation | ||||||
| Azelaic acid | NA(c) | 81.57 ± 9.6 nm | NA | Targeted drug delivery to the melanocytes | Kumari et al. (2015) | |
| Improved effectiveness | ||||||
| Delayed drug release | ||||||
| Reduced adverse drug reactions effects due to the gradual exposure of the skin with lower concentrations of azelaic acid | ||||||
| Liposomes
|
Azelaic acid & 4-n- butylresorcinol and retinol | NA | NA | NA | Reduced melasma severity | Kusumawardani et al. (2019) |
| Hydroquinone | 4% | 126 nm | NA | Preserved therapeutic effectiveness | Taghavi et al. (2019) | |
| Azelaic acid | 20% | 500 nm | %EE 85.73% | Maintain therapeutic efficacy | Ayumi et al., 2019; Akl (20226), Pasca et al. (2022) | |
| Lower recurrence rate | ||||||
| Fewer adverse reactions | ||||||
| Kojic acid and hydroquinone | NA | 10 µm | NA | High encapsulation efficiency | Divanbeygikermani et al (2018), Kusumawardani et al. (2019) | |
| High protection against photodegradation and oxidation of hydroquinone | ||||||
| Prolonged drug release pattern | ||||||
| Arbutin and coumaric acid
|
0.05% arbutin and 0.05% coumaric acid
|
569.67 nm
|
%EE: 91.08% for arbutin and 80.92% for coumaric acid
|
Improved drug stability | Taghavi et al. (2019a), Huang et al. (2019) | |
| Enhanced drug solubility | ||||||
| Sustained drug release |
| Nanocarrier | Drug | Drug percentage | Particle size | Entrapment efficiency (% EE) and loading capacity (%LC) | Advantages/Outcome | Reference(s) |
| Arbutin | 4% | 179.9-212.8 nm | %EE: 17.6% ± 1.38% | Maintain therapeutic efficacy | Wen et al. (20066) | |
| Tranexamic acid | 5% | 126 nm | NA | A significant reduction in melasma area and severity index | Banihashemi et al. (2015b) | |
| No serious adverse drug reaction | ||||||
| Resulted in omparative clinical responses to hydroquinone 4% as an standard medication for melasma management | ||||||
| Niosomes | Kojic acid and hydroquinone | NA | <10 µm | NA | Prolonged drug release pattern | Divanbeygikermani et al. (2018) |
| Arbutin | 0.5% | 114.76 mm | %EE: 35.55% ±1.59% | High encapsulation efficiency of arbutin within niosomes | Radmard et al. (2021) | |
| Enhanced in vivo skin permeation and topical delivery along with reduced transdermal delivery in comparison to arbutin plain gel | ||||||
| No potential toxicity and high cell viability percentage of about 86% | ||||||
| No skin irritation potentail | ||||||
| Nanoemulsions | Arbutin and coumaric acid | NA | Pore diameter of 1-50 µm | NA | Zero-order drug release pattern | Huang et al. (2019) |
| Azelaic acid | 1% | 419 nm | %EE: 84.65% | Enhanced skin penetration | Jacobus Berlitz et al. (2019) | |
| Decreased tyrosinase activity | ||||||
| Improve skin permeation and targeted delivery to dermis and epidermis | ||||||
| No cytotoxicity potential | ||||||
| Promising for dermal melasma management | ||||||
| Licorce | 1% | 62.7 nm | NA | Enhanced whitening effect | Atrux-Tallau et al. (2014a) | |
| Enhanced epidermal and dermal bioavailability | ||||||
| Enhanced in vitro cellular uptake | ||||||
| Microemulaion | Ascorbic acid | 4% | <100 nm | NA | Improved skin permeation | Pakpayat et al. (2009) |
| Enhanced skin protection against UV radiation |
| Nanocarrier | Drug | Drug percentage | Particle size | Entrapment efficiency (% EE) and Loading capacity (%LC) | Advantages/Outcome | Reference(s) |
| Targeted delivery to the epidermis and dermis layers | ||||||
| Promising for melasma management and relieve of oxygen matrix damage | ||||||
| Alpha arbutin, lactic acid, and niacinamide | NA | <100 nm | NA | Enhanced drug stability | Surini and Mellani (2017a) | |
| Concurrent administration of three active ingredients with various mechanism of actions for melasma management | ||||||
| Hydroquinone | 4% | 358 nm | NA | Reduced skin irritation or epidermal layer disturbance | Üstündağ Okur et al. (2019) | |
| Enhanced skin permeation through the stratum corneum | ||||||
| Enhanced in vitro drug release | ||||||
| Enhanced photostability of the loaded drug | ||||||
| Kojic acid and arbutin | 0.25% kojic acid & 0.25% arbutin | 25-30 nm | NA | Enhanced photostability of the loaded drugs | Gallarate et al. (2004) | |
| The presence of linalool in the prepared formulation could enhance kojic acid photostability | ||||||
| Gold nanoparticles | Arbutin | 0.5% | 10.30-17.13 nm | NA | Enhanced anti-inflammatory properties | Parket aL 2019b |
| Improved bioavailability | ||||||
| Significantly reduced intracellular and extracellular melanin content | ||||||
| Increases tyrosinase enzyme inhibition | ||||||
| Reduced arbutin-related toxicities | ||||||
| Polymeric nanoparticles | Kojic acid | 10 μΜ | 441 nm | %EE: 3.6% | Wang et al. (20126) | |
| Azelaic acid | 10% | 38.3-117.7 nm | NA | Significant reduction in melanin synthesis | Tomić et al. (2019a) | |
| Improved skin diffusivity | ||||||
| Improved skin bioavailability | ||||||
| Enhanced water solubility and dissolution rate | ||||||
| Ascorbic acid | 50 mg | 209-260 nm | %EE: 69%-96% | Sustained drug release within 8h | Duarah et al. (2017a) | |
| Enhanced ex vivo skin permeation |
| Nanocarrier | Drug | Drug percentage | Particle size | Entrapment efficiency (% EE) and loading capacity (%LC) | Advantages/Outcome | Reference(s) |
| Nanocrystals | Azelaic acid | 10% | 38.3-117.7 nm | NA | Improved skin diffusivity |
Tomić et al. (2019)
|
| Improved skin bioavailability | ||||||
| Enhanced water solubility and dissolution rate | ||||||
| Transfersomes | Ascorbic palmitate | -13% | 110 nm | %EE: 91.3% | Enhanced drug penetration and deposition within the epidermis layer | Wen et al. (20066), Li et al. (2021)
|
| %LC: 11.9% | Sustained drug release | |||||
| Reduced skin irritation | ||||||
| Linoleic acid | 0.05% and 0.1% | 151.2 nm and 237.2 nm | %EE: 23.55 ± 5.29 and 62.64 ± 5.49 | Enhanced stability of the loaded linoleic acid | ||
| Increased penetration through the stratum corneum layer | ||||||
| Fullerenes | L-ascorbic acid and arbutin | 50 μ.Μ | NA | NA | Diminished UVA-induced melanogenesis | Xiao et al. (2007a), Xiao et al. (20076) |
| Reduced melanin synthesis |
(a)Solid lipid nanoparticles.
(b)Nanostructured lipid carriers.
(c)Data not available.
Nhìn chung, mặc dù điều trị tại chỗ có nhiều hứa hẹn trong việc kiểm soát nám, tuy nhiên, hầu hết các công thức bôi thông thường hiện có đều gặp khó khăn do khả năng thẩm thấu qua da hạn chế, độ hòa tan trong nước thấp, khả dụng sinh học qua da thấp và do đó không đủ đáp ứng lâm sàng. Do đó, như được trình bày trong Bảng 2, nhiều loại hạt nano khác nhau bao gồm nhũ tương nano/vi nhũ tương, hạt nano lipid, chất mang nano dạng mụn nước, hạt nano polyme và hạt nano vàng đã được sử dụng để tăng cường khả năng thẩm thấu vào da, cải thiện khả năng hòa tan của thuốc, tăng khả năng quang hóa, kiểm soát đặc tính giải phóng thuốc, tạo ra Sự lắng đọng thuốc lâu hơn trong các lớp da và do đó nâng cao hiệu quả lâm sàng của các lựa chọn điều trị nám.
Kết quả lâm sàng của các liệu pháp điều trị.
Cho đến nay, nhiều nghiên cứu lâm sàng bao gồm thử nghiệm lâm sàng ngẫu nhiên mù đôi hoặc mù đơn và nghiên cứu chia khuôn mặt đã được thực hiện để đánh giá hiệu quả điều trị của các công thức bôi ngoài da thông thường và mới lạ khác nhau trong quản lý nám như được tóm tắt trong Bảng 3.
Bảng 3. Tóm tắt kết quả thử nghiệm lâm sàng của các công thức bôi ngoài da khác nhau trong điều trị nám
| Type of climcal study | Therapeutic option | Nurmber of cases | Cliriical outcome | Reference |
| Single-blinded comparative study | Topical Vitamin C Nanosomes | 14 | Better clinical response in comparison to glycolic acid 70% chemical peel | Sobhi and Sobhi (2012) |
| Considered as safe with no severe adverse drug reaction | ||||
| Uncontrolled study | Topical tranexamic acid emulsion | 25 | Successful results in 80% of participants during 8-week period | Kondou et al. (2007) |
| No observed adverse drug reactions | ||||
| Split-face trial | Topical liposomal tranexamic acid | 23 | No observed adverse drug reactions | Banihashemi et al. (2015b) |
| Prospective, randomized, single blind study | Topical Politranexamide liposomal emulsion | 26 | A significant improvement in melasma lesions and reduction in MASI score after 6 and 12 weeks of treatment | Manfreda et al. (2023) |
| Double-blind randomized clinical trial study | Topical hydroquinone-loaded NLCs(a) | 20 | A statistically significant reduction in mMASI score | Taghavi et al. (2019a) |
| Visual assessment | Topical niacinamide-loaded flexible liposomes | 21 | A statistically significant increase in the whitening efficacy after 4 and 8 weeks of therapy compared to the baseline | Lee et al. (20166) |
| Comparative, randomized, controlled study | Topical liposomal azelaic acid cream | 50 | Superior clinical efficacy of liposomal azelaic acid 20% in comparison to hydroquinone 4% | Ald (20222) |
| More tolerable in comparison to hydroquinone cream | ||||
| Improved MELASQOL | ||||
| Prospective comparative split- face study | Topical arbutin-loaded chitosan nanoparticles | 20 | Better therapeutic efficacy for arbutin-loaded chitosan nanoparticles in comparison to the conventional arbutin hydrogel | Hatem et al. (2022 |
| Reduced mMASI score and reduced epidermal melanin particle size surface area (MPSA) in comparison to the conventional arbutin hydrogel | ||||
| Randomized, double-blind, vehicle-controlled, split-face study | 4-n-butyl resorcinol and resveratrol-loaded liposomes | 21 | A significant reduction in melanin index (MI) of the melasma lesions | Kwon et al. (2020) |
(a)Nanostructured lipid carriers.
Tranexamic acid.
Axit tranexamic liposomal bôi tại chỗ được thiết kế và phát triển để giảm thiểu kích ứng da và tăng cường hiệu quả làm trắng. Nhiều nghiên cứu đã chứng minh rằng axit tranexamic liposomal có hiệu quả ở khoảng 80% số người tham gia trong suốt quá trình điều trị kéo dài 8 tuần (Manosroi và cộng sự, 2002). Tuy nhiên, kết quả của một thử nghiệm được tiến hành ở Thái Lan vào năm 2012 cho thấy axit tranexamic liposom không có thêm lợi ích gì so với công thức axit tranexamic thông thường do nghiên cứu này có cỡ mẫu nhỏ (Kanechorn và cộng sự, 2012a). Tuy nhiên, kết quả của nghiên cứu này đã xác nhận hiệu quả lâm sàng của axit tranexamic tại chỗ với việc giảm đáng kể điểm MASI trung bình sau 12 tuần điều trị. Điều thú vị là những tác động tích cực này vẫn tồn tại thậm chí 1 tháng sau khi ngừng điều trị (Kanechorn và cộng sự, 2012a).
Một nghiên cứu trước đây đã so sánh hiệu quả và khả năng dung nạp của hai loại nhũ tương liposome bao gồm Politranexamide® (mẫu A) và acetylglucosamine, ethyl linoleate và phenylethylresorcinol (mẫu B) trong điều trị nám da mặt. Dựa trên kết quả của báo cáo này, mẫu A vượt trội hơn so với mẫu B trong điều trị nám sau 6 và 12 tuần theo dõi bệnh nhân. Hơn nữa, cả hai nhóm điều trị đều cho thấy điểm MASI giảm đáng kể so với ban đầu (Manfreda và cộng sự, 2023).
Hydroquinone.
Một nghiên cứu lâm sàng đã được thực hiện để đánh giá hiệu quả điều trị của liposomal hydroquinone 4% trong điều trị nám. Các bệnh nhân được phân ngẫu nhiên vào nhóm hydroquinone 4% thông thường và hydroquinone 4% liposomal và mức độ nghiêm trọng của nám được đánh giá thông qua điểm MASI tại các thời điểm xác định. Các phát hiện của nghiên cứu chỉ ra rằng mặc dù liposomal hydroquinone 4% có hiệu quả trong việc kiểm soát nám và có thể làm giảm đáng kể điểm MASI, tuy nhiên, không có sự vượt trội rõ ràng so với kem hydroquinone thông thường (Taghavi và cộng sự, 2019a).
Axit Azelaic, resorcinol 4-n-butyl và retinol.
Hiệu quả lâm sàng của huyết thanh liposome chứa axit azelaic, 4-n-butylresorcinol và retinol được đánh giá ở những bệnh nhân bị nám má. Sau khi điều trị, MSS được cải thiện từ mức độ trung bình đến nhẹ, cả điểm MASI và thang điểm chất lượng cuộc sống trị nám (MELASQOL) đều có sự cải thiện đáng kể khi kết thúc điều trị ở những bệnh nhân này. Do đó, có vẻ như chế phẩm liposomal được bào chế tại chỗ có triển vọng trong điều trị nám (Kusumawardani và cộng sự, 2019).
Aloe vera.
Kết quả của một thử nghiệm lâm sàng ngẫu nhiên, mù đôi trên bệnh nhân bị nám cho thấy sự cải thiện 32% về điểm MASI đối với nhóm dùng gel lô hội liposomal, trong khi chỉ cải thiện 10% rõ ràng đối với nhóm dùng gel lô hội thông thường (Ghafarzadeh và Eatemadi, 2017).
Vitamin C.
Tính an toàn và hiệu quả của nanosome vitamin C tại chỗ bằng phương pháp điện di ion đã được đánh giá thông qua một nghiên cứu lâm sàng mù đơn và kết quả được so sánh với phương pháp lột da hóa học bằng axit glycolic 70% ở bệnh nhân bị nám. Kết quả cho thấy nanosome vitamin C vượt trội hơn so với phương pháp kiểm soát tăng sắc tố bằng lột axit glycolic. Hơn nữa, nanosome vitamin C còn giúp giảm tỷ lệ phản ứng có hại của thuốc bao gồm bỏng da, kích ứng và khô da (Sobhi và Sobhi, 2012).
4-n-butylresorcinol và resveratrol.
Kết quả của một nghiên cứu lâm sàng trước đây về liposomal 4-n-butyl resorcinol và kem resveratrol cho thấy hiệu quả vượt trội trong việc kiểm soát nám. Công thức liposome này đi kèm với việc giảm đáng kể chỉ số melanin (MI) của các tổn thương nám sau 2 tuần điều trị, trong khi sự thay đổi MI ở da bình thường là không đáng kể (Kwon và cộng sự, 2020; Shaw và cộng sự, 2022).
Arbutin.
Một nghiên so sánh chia khuôn mặt đã được thực hiện ở những bệnh nhân bị nám để đánh giá hiệu quả lâm sàng của hydrogel hạt nano chitosan chứa arbutin so với gel arbutin thông thường trong suốt quá trình điều trị 2 tháng. Kết quả của nghiên cứu này cho thấy hiệu quả điều trị tốt hơn đối với các hạt nano chitosan chứa arbutin về mặt giảm điểm MASI và giảm diện tích bề mặt kích thước hạt melanin thượng bì (MPSA) so với thuốc tự do (Hatem et al., 2022).
Niacinamide
Một nghiên cứu lâm sàng được thiết kế để đánh giá hiệu quả của liposome linh hoạt chứa niacinamide với khả năng làm trắng da ở bệnh nhân bị nám. Giá trị M, thước đo lượng melanin được ước tính bằng Mexameter, được đánh giá sau 4 và 8 tuần bắt đầu trị liệu. Kết quả cho thấy sự cải thiện đáng kể về giá trị M, lần lượt là 9,96% và 16,80% sau 4 và 8 tuần điều trị so với giá trị cơ bản. Hơn nữa, kết quả đánh giá trực quan và báo cáo đánh giá chủ quan cho thấy sự gia tăng đáng kể về mặt thống kê về hiệu quả làm trắng của niacinamide sau 4 và 8 tuần điều trị so với ban đầu (Lee và cộng sự, 2016b).
Azelaic acid.
Một nghiên cứu lâm sàng khác được thực hiện ở những phụ nữ bị nám để đánh giá hiệu quả của kem bôi 20% axit azelaic liposomal so với kem hydroquinone 4% thông thường trong suốt quá trình điều trị 3 tháng. Tất cả những người tham gia cũng được nhận liều axit tranexamic uống một lần mỗi ngày trong suốt quá trình điều trị. Theo kết quả nghiên cứu này, người ta đã nhận thấy sự cải thiện rõ rệt ở những bệnh nhân được dùng kem axit azelaic liposomal so với kem hydroquinone thông thường. Hơn nữa, khả năng dung nạp của axit azelaic liposome vượt trội hơn đáng kể so với kem hydroquinone (Hagag và Allah, 2022).
Kết luận.
Tóm lại, nám là một chứng rối loạn da mãn tính với nhiều nguyên nhân bao gồm ánh nắng mặt trời và môi trường địa lý, yếu tố di truyền cũng như các rối loạn tăng sắc tố da do thuốc và bệnh lý gây ra. Mặc dù các phương thức điều trị khác nhau bao gồm các phương pháp điều trị bằng thuốc và thủ thuật toàn thân và tại chỗ thường có sẵn để quản lý nám, tuy nhiên, nhiều phương pháp điều trị này cho thấy phản ứng lâm sàng hạn chế và đi kèm với nhiều phản ứng phụ không mong muốn của thuốc. Hơn nữa, do tính chất của nám và các rối loạn tăng sắc tố da khác nên tình trạng tái phát, tái phát sau khi ngừng điều trị là rất thường gặp. Do đó, việc thiết kế và phát triển các tác nhân trị liệu tại chỗ hiệu quả sẽ hứa hẹn trong việc kiểm soát nám không chỉ tạo ra phản ứng lâm sàng tối ưu mà còn tránh các phản ứng bất lợi không mong muốn của thuốc và tái phát thông qua việc tăng cường khả năng hòa tan trong nước, tăng tính thẩm thấu của da, tăng cường khả năng quang hóa và cải thiện sinh khả dụng qua da của thuốc được nạp.
Author contributions
PG: Data curation, Methodology, Writing-original draft, Writing-review and editing, Investigation. RF: Data curation, Writing-original draft. MK: Data curation, Writing-original draft. SR: Data curaticn, Writing-original draft. MM: Data curation, Writing-original draft. SM-S: Conceptualization, Funding acquisition, Investigation, Methodology, Project administration, Supervision, Writing-original draft, Writing-review and editing.
Funding
The author(s) declare that no financial support was received for the research, authorship, and/or publication of this article.
Acknowledgments
We would like to sincerely appreciate Iran’s National Elites Foundation and Vice Chancellor for Research of Shiraz University of Medical Sciences [Grant No. 27787] for their support.
Conflict of interest
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Publisher’s note
All claims expressed in this article are solely those of the authors and do not necessarily represent those of their affiliated organizations, or those of the publisher, the editors and the reviewers. Any product that may be evaluated in this article, or claim that may be made by its manufacturer, is not guaranteed or endorsed by the publisher.
References
Abbasi, N. R., and Wang, N. (2008). Doxorubicin-induced hyperpigmentation. Dermatology Online J. 14, 18. doi:10.5070/d365m8x79p
PubMed Abstract | CrossRef Full Text | Google Scholar
Abdel Naser, M. B., Seltmann, H., and Zouboulis, C. C. (2012). SZ95 sebocytes induce epidermal melanocyte dendricity and proliferation in vitro. Exp. Dermatol. 21, 393-395. doi:10.1111/j.1600-0625.2012.01468.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Adalatkhah, H., and Sadeghi-Bazargani, H. (2015). The first clinical experience on efficacy of topical flutamide on melasma compared with topical hydroquinone: a randomized clinical trial. Drug Des. Devel Ther. 9, 4219- 4225. doi:10.2147/DDDT.S80713
PubMed Abstract | CrossRef Full Text | Google Scholar
Akl, E. M. (2022a). Liposomal azelaic acid 20% cream vs hydroquinone 4% cream as adjuvant to oral tranexamic acid in melasma: a comparative study. J. Dermatol. Treat. 33, 2008-2013. doi:10.1080/09546634.2021.1905765
CrossRef Full Text | Google Scholar
Akl, E. M. (2022b). Liposomal azelaic acid 20% cream vs hydroquinone 4% cream as adjuvant to oral tranexamic acid in melasma: a comparative study. J. Dermatological Treat. 33, 2008-2013. doi:10.1080/09546634.2021.1905765
CrossRef Full Text | Google Scholar
Al-Edresi, S., and Baie, S. (2009). Formulation and stability of whitening VCO-in-water nano-cream. Int. J. Pharm. 373, 174-178. doi:10.1016/j.ijpharm.2009.02.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Alvin, G., Catambay, N., Vergara, A., and Jamora, M. J. (2011). A comparative study of the safety and efficacy of 75% mulberry (Morus alba) extract oil versus placebo as a topical treatment for melasma: a randomized, single- blind, placebo-controlled trial. J. Drugs Dermatol 10, 1025-1031.
American Academy of Dermatology (2013). Cysteamine cream as a new skin depigmenting product. J. Am.Acad. Dermatology 68, AB189. doi:10.1016/j.jaad.2012.12.781
CrossRef Full Text | Google Scholar
Artzi, O., Horovitz, T., Bar-Ilan, E., Shehadeh, W., Koren, A., Zusmanovitch, L., et al. (2021). The pathogenesis of melasma and implications for treatment. J. Cosmet. Dermatology 20, 3432-3445. doi:10.1111/jocd.14382
CrossRef Full Text | Google Scholar
Atrux-Tallau, N., Lasselin, J., Han, S.-H., Delmas, T., and Bibette, J. (2014a). Quantitative analysis of ligand effects on bioefficacy of nanoemulsion encapsulating depigmenting active. Colloids Surfaces B Biointerfaces 122, 390-395. doi:10.1016/j.colsurfb.2014.07.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Atrux-Tallau, N., Lasselin, J., Han, S. H., Delmas, T., and Bibette, J. (2014b). Quantitative analysis of ligand effects on bioefficacy of nanoemulsion encapsulating depigmenting active. Colloids Surf. B Biointerfaces 122, 390-395. doi:10.1016/j.colsurfb.2014.07.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Austin, E., Nguyen, J. K., and Jagdeo, J. (2019). Topical treatments for melasma: a systematic review of randomized controlled trials. J. Drugs Dermatol 18, S1545961619P1156X.
PubMed Abstract | Google Scholar
Ayumi, N. S., Sahudin, S., Hussain, Z., Hussain, M., and Samah, N. H. A. (2019). Polymeric nanoparticles for topical delivery of alpha and beta arbutin: preparation and characterization. Drug Deliv. Transl. Res. 9, 482-496. doi:10.1007/s13346-018-0508-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Babbush, K. M., Babbush, R. A., and Khachemoune, A. (2021). Treatment of melasma: a review of less commonly used antioxidants. Int. J. Dermatol 60, 166-173. doi:10.1111/ijd.15133
Bailey, A. J. M., Li, H. O., Tan, M. G., Cheng, W., and Dover, J. S. (2022). Microneedling as an adjuvant to topical therapies for melasma: a systematic review and meta-analysis. J. Am. Acad. Dermatol 86, 797-810. doi:10.1016/j.jaad.2021.03.116
PubMed Abstract | CrossRef Full Text | Google Scholar
Bai, Z. (2016). The relationship between the incidence of melasma and estrogen gene polymorphism. Tianjin Med. J., 887-891.
Google Scholar
Bala, H. R., Lee, S., Wong, C., Pandya, A. G., and Rodrigues, M. (2018). Oral tranexamic acid for the treatment of melasma: a review. Dermatol. Surg. 44, 814-825. doi:10.1097/DSS.0000000000001518
PubMed Abstract | CrossRef Full Text | Google Scholar
Balina, L. M., and Graupe, K. (1991). The treatment of melasma. 20% azelaic acid versus 4% hydroquinone cream. Int. J. Dermatol 30, 893-895. doi:10.1111/j.1365-4362.1991.tb04362.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ball Arefiev, K. L., and Hantash, B. M. (2012). Advances in the treatment of melasma: a review of the recent literature. Dermatol Surg. 38, 971-984. doi:10.1111/j.1524-4725.2012.02435.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Banihashemi, M., Zabolinejad, N., Jaafari, M. R., Salehi, M., and Jabari, A. (2015a). Comparison of therapeutic effects of liposomal Tranexamic Acid and conventional Hydroquinone on melasma. J. Cosmet. Dermatol 14, 174-177. doi:10.1111/jocd.12152
PubMed Abstract | CrossRef Full Text | Google Scholar
Banihashemi, M., Zabolinejad, N., Jaafari, M. R., Salehi, M., and Jabari, A. (2015b). Comparison of therapeutic effects of liposomal tranexamic acid and conventional hydroquinone on melasma. J. Cosmet. dermatology 14, 174-177. doi:10.1111/jocd.12152
Ben Fadhel, N., Chaabane, A., Ammar, H., Ben Romdhane, H., Soua, Y., Chadli, Z., et al. (2019). Clinical features, culprit drugs, and allergology workup in 41 cases of fixed drug eruption. Contact Dermat. 81, 336-340. doi:10.1111/cod.13351
CrossRef Full Text | Google Scholar
Besouw, M., Masereeuw, R., Van Den Heuvel, L., and Levtchenko, E. (2013). Cysteamine: an old drug with new potential. Drug Discov. Today 18, 785-792. doi:10.1016/j.drudis.2013.02.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Blomberg, M., Zachariae, C., and Gr0nh0j, F. (2009). Hyperpigmentatio. of the face following adalimumab treatment. Acta dermato-venereologica 89, 546-547. doi:10.2340/00015555-0697
PubMed Abstract | CrossRef Full Text | Google Scholar
Boo, Y. C. (2021). Arbutin as a skin depigmenting agent with antimelanogenic and antioxidant properties. Antioxidants (Basel) 10, 1129. doi:10.3390/antiox10071129
PubMed Abstract | CrossRef Full Text | Google Scholar
Bosset, S., Bonnet-Duquennoy, M., Barre, P., Chalon, A., Kurfurst, R., Bonte, F., et al. (2003). Photoageing shows histological features of chronic skin inflammation without clinical and molecular abnormalities. Br. J. Dermatology 149, 826-835. doi:10.1046/j.1365-2133.2003.05456.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bostanudin, M. F., Salam, A., Mahmood, A., Arafat, M., Kaharudin, A. N., Sahudin, S., et al. (2021). Formulation and in-vitro characterisation of cross-linked amphiphilic guar gum nanocarriers for percutaneous delivery of arbutin. J. Pharm. Sci. 110, 3907-3918. doi:10.1016/j.xphs.2021.08.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Braunstein, I., Wanat, K. A., Elenitsas, R., Xu, X., Frey, N., and Rosenbach, M. (2013). Eltrombopag-associated hyperpigmentation. JAMA dermatol. 149, 1112-1115. doi:10.1001/jamadermatol.2013.5107
Briganti, S., Camera, E., and Picardo, M. (2003). Chemical and instrumental approaches to treat hyperpigmentation. Pigment Cell. Res. 16, 101-110. doi:10.1034/j.1600-0749.2003.00029.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Bronzina, E., Clement, A., Marie, B., Fook Chong, K. T., Faure, P., and Passeron, T. (2020). Efficacy and tolerability on melasma of a topical cosmetic product acting on melanocytes, fibroblasts and endothelial cells: a randomized comparative trial against 4% hydroquinone. J. Eur. Acad. Dermatol Venereol. 34, 897-903. doi:10.1111/jdv.16150
PubMed Abstract | CrossRef Full Text | Google Scholar
Calheiros, T., De Almeida, H. L., Jorge, V. M., De Almeida, A. L., and Motta, L. (2020). Light and electron microscopy of chlorpromazine-induced hyperpigmentation. J. Cutan. Pathology 47, 402-405. doi:10.1111/cup.13612
PubMed Abstract | CrossRef Full Text | Google Scholar
Carsberg, C. J., Ohanian, J., and Friedmann, P. (1995). Ultraviolet radiation stimulates a biphasic pattern of 1, 2- diacylglycerol formation in cultured human melanocytes and keratinocytes by activation of phospholipases C and D. Biochem. J. 305, 471-477. doi:10.1042/bj3050471
PubMed Abstract | CrossRef Full Text | Google Scholar
Celia, C., Cilurzo, F., Trapasso, E., Cosco, D., Fresta, M., and Paolino, D. (2012). Ethosomes® and transfersomes® containing linoleic acid: physicochemical and technological features of topical drug delivery carriers for the potential treatment of melasma disorders. Biomed. microdevices 14, 119-130. doi:10.1007/s10544-011-9590-y
PubMed Abstract | CrossRef Full Text | Google Scholar
Chandorkar, N., Tambe, S., Amin, P., and Madankar, C. (2021). Alpha arbutin as a skin lightening agent. A Rev. 13, 3502-3510. doi:10.31838/ijpr/2021.13.02.446
CrossRef Full Text | Google Scholar
Chang, G.-C., Yang, T.-Y., Chen, K.-C., Yin, M.-C., Wang, R.-C., and Lin, Y.-C. (2004). Complications of therapy in cancer patients: case 1. Paronychia and skin hyperpigmentation induced by gefitinib in advanced non- small-cell lung cancer. J. Clin. Oncol. 22, 4646-4648. doi:10.1200/JCO.2004.02.168
PubMed Abstract | CrossRef Full Text | Google Scholar
Chan, R., Park, K. C., Lee, M. H., Lee, E. S., Chang, S. E., Leow, Y. H., et al. (2008). A randomized controlled trial of the efficacy and safety of a fixed triple combination (fluocinolone acetonide 0.01%, hydroquinone 4%, tretinoin 0.05%) compared with hydroquinone 4% cream in Asian patients with moderate to severe melasma. Br. J. Dermatol 159, 697-703. doi:10.1111/j.1365-2133.2008.08717.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Chaudhary, S., and Dayal, S. (2013). Efficacy of combination of glycolic acid peeling with topical regimen in treatment of melasma. J. Drugs Dermatol 12, 1149-1153.
PubMed Abstract | Google Scholar
Chiranjeevi, G., Muthukumaran, M., and Krishnamoorthy, B. (2013). A review on potency of vesicular systems in targeting drug delivery. Res. J. Pharm. Biol. Chem. Sci. 4, 156-170.
Google Scholar
Chittari, K., Tagboto, S., and Tan, B. (2009). Cyclophosphamide-induced nail discoloration and skin hyperpigmentation: a rare presentation. Clin. Exp. dermatology 34, 405-406. doi:10.1111/j.1365- 2230.2008.02896.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Choi, F. D., Sung, C. T., Juhasz, M. L., and Mesinkovsk, N. A. (2019). Oral collagen supplementation: a systematic review of dermatological applications. J. Drugs Dermatol 18, 9-16.
PubMed Abstract | Google Scholar
Cohen, B. E., and Elbuluk, N. (2016). Microneedling in skin of color: a review of uses and efficacy. J. Am. Acad. Dermatol 74, 348-355. doi:10.1016/j.jaad.2015.09.024
Cohen, P. R. (2016). Paclitaxel-associated reticulate hyperpigmentation: report and review of chemotherapy- induced reticulate hyperpigmentation. World J. Clin. Cases 4, 390-400. doi:10.12998/wjcc.v4.i12.390
PubMed Abstract | CrossRef Full Text | Google Scholar
Cohen, P. R. (2017). Melasma treatment: a novel approach using a topical agent that contains an anti-estrogen and a vascular endothelial growth factor inhibitor. Med. Hypotheses 101, 1-5. doi:10.1016/j.mehy.2017.01.020
PubMed Abstract | CrossRef Full Text | Google Scholar
Connors, T. M., Restrepo, A., and Dao, H. (2018). Brown-gray hyperpigmentation in a photosensitive distribution after levofloxacin exposure. Dermatology Online J. 24. doi:10.5070/d3247040912
PubMed Abstract | CrossRef Full Text | Google Scholar
Correia, G., and Magina, S. (2023). Efficacy of topical vitamin C in melasma and photoaging: a systematic review. J. Cosmet. Dermatology 22, 1938-1945. doi:10.1111/jocd.15748
PubMed Abstract | CrossRef Full Text | Google Scholar
Crivellato, E., Nico, B., and Ribatti, D. (2008). Mast cells and tumour angiogenesis: new insight from experimental carcinogenesis. Cancer Lett. 269, 1-6. doi:10.1016/j.canlet.2008.03.031
PubMed Abstract | CrossRef Full Text | Google Scholar
Da Cunha, M. G., and Da Silva Urzedo, A. P. (2022). Melasma: a review about pathophysiology and treatment London, UK: Pigmentation Disorders.
Google Scholar
Dahl, A., Yatskayer, M., Raab, S., and Oresajo, C. (2013). Tolerance and efficacy of a product containing ellagic and salicylic acids in reducing hyperpigmentation and dark spots in comparison with 4% hydroquinone. J. Drugs Dermatol 12, 52-58.
PubMed Abstract | Google Scholar
De Baat, C., Phoa, K., Zweers, P., Bolling, M., Rozema, F., and Vissink, A. (2020). Medicaments and oral healthcare. Hyperpigmentation of oral soft tissues due to afamelanotide. Nederl. Tijdschr. Voor Tandheelkd. 127, 237-243. doi:10.5177/ntvt.2020.04.19115
CrossRef Full Text | Google Scholar
Deo, K. S., Dash, K. N., Sharma, Y. K., Virmani, N. C., and Oberai, C. (2013). Kojic acid vis-a-vis its combinations with hydroquinone and betamethasone valerate in melasma: a randomized, single blind, comparative study of efficacy and safety. Indian J. Dermatol 58, 281-285. doi:10.4103/0019-5154.113940
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Tullio, F., Mandel, V. D., Scotti, R., Padalino, C., and Pellacani, G. (2018). Imatinib-induced diffuse hyperpigmentation of the oral mucosa, the skin, and the nails in a patient affected by chronic myeloid leukemia: report of a case and review of the literature. Int. J. Dermatology 57, 784-790. doi:10.1111/ijd.13931
CrossRef Full Text | Google Scholar
Divanbeygikermani, M., Pardakhty, A., and Amanatfard, A. (2018). Kojic acid and hydroquinone non-ionic surfactant vesicles for topical application. Int. Pharm. Acta 1, 110. doi:10.22037/ipa.v1i1.20494
CrossRef Full Text | Google Scholar
Duarah, S., Durai, R. D., and Narayanan, V. B. (2017a). Nanoparticle-in-gel system for delivery of vitamin C for topical application. Drug Deliv. Transl. Res. 7, 750-760. doi:10.1007/s13346-017-0398-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Duarah, S., Durai, R. D., and Narayanan, V. B. (2017b). Nanoparticle-in-gel system for delivery of vitamin C for topical application. Drug Deliv. Transl. Res. 7, 750-760. doi:10.1007/s13346-017-0398-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Ebanks, J. P., Wickett, R. R., and Boissy, R. E. (2009). Mechanisms regulating skin pigmentation: the rise and fall of complexion coloration. Int. J. Mol. Sci. 10, 4066-4087. doi:10.3390/ijms10094066
Erbil, H., Sezer, E., Taậtan, B., Arca, E., and Kurumlu, Z. (2007). Efficacy and safety of serial glycolic acid peels and a topical regimen in the treatment of recalcitrant melasma. J. dermatology 34, 25-30. doi:10.1111/j.1346- 8138.2007.00211.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Espinal-Perez, L. E., Moncada, B., and Castanedo-Cazares, J. P. (2004). A double-blind randomized trial of 5% ascorbic acid vs. 4% hydroquinone in melasma Int. J. Dermatol 43, 604-607. doi:10.1111/j.1365- 4632.2004.02134.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Espósito, A. C. C., Cassiano, D. P., Da Silva, C. N., Lima, P. B., Dias, J. A., Hassun, K., et al. (2022). Update on melasma—Part I: pathogenesis. Dermatology Ther. 12, 1967-1988. doi:10.1007/s13555-022-00779-x
CrossRef Full Text | Google Scholar
Fadel, M., Samy, N., Nasr, M., and Alyoussef, A. A. (2017). Topical colloidal indocyanine green-mediated photodynamic therapy for treatment of basal cell carcinoma. Pharm. Dev. Technol. 22, 545-550. doi:10.3109/10837450.2016.1146294
PubMed Abstract | CrossRef Full Text | Google Scholar
Faghihi, G., Shahingohar, A., and Siadat, A. H. (2011). Comparison between 1% tretinoin peeling versus 70% glycolic acid peeling in the treatment of female patients with melasma. J. Drugs Dermatol 10, 1439-1442.
PubMed Abstract | Google Scholar
Farshi, S. (2011a). Comparative study of therapeutic effects of 20% azelaic acid and hydroquinone 4% cream in the treatment of melasma. J. Cosmet. Dermatol 10, 282-287. doi:10.1111/j.1473-2165.2011.00580.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Farshi, S. (2011b). Comparative study of therapeutic effects of 20% azelaic acid and hydroquinone 4% cream in the treatment of melasma. J. Cosmet. dermatology 10, 282-287. doi:10.1111/j.1473-2165.2011.00580.x
Fathallah, N., Salem, C. B., Slim, R., Boussofara, L., Ghariani, N., and Bouraoui, K. (2011). Acetaminophen- induced cellulitis-like fixed drug eruption. Indian J. Dermatology 56, 206-208. doi:10.4103/0019-5154.80419
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferreira Cestari, T., Hassun, K., Sittart, A., and De Lourdes Viegas, M. (2007). A comparison of triple combination cream and hydroquinone 4% cream for the treatment of moderate to severe facial melasma. J. Cosmet. Dermatol 6, 36-39. doi:10.1111/j.1473-2165.2007.00288.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Fiscus, V., Hankinson, A., and Alweis, R. (2014). Minocycline-induced hyperpigmentation. J. Community Hosp. Intern. Med. Perspect. 4, 24063. doi:10.3402/jchimp.v4.24063
PubMed Abstract | CrossRef Full Text | Google Scholar
Galasso, C., Corinaldesi, C., and Sansone, C. (2017). Carotenoids from marine organisms: biological functions and industrial applications. Antioxidants 6, 96. doi:10.3390/antiox6040096
PubMed Abstract | CrossRef Full Text | Google Scholar
Gallarate, M., Carlotti, M. E., Trotta, M., Grande, A. E., and Talarico, C. (2004). Photostability of naturally occurring whitening agents in cosmetic microemulsions. J. Cosmet. Sci. 55, 139-148.
PubMed Abstract | Google Scholar
Garcia, D., and Cohen, P. R. (2017). Dapsone-associated fixed drug eruption. Expert Rev. Clin. Pharmacol. 10, 717-725. doi:10.1080/17512433.2017.1322508
PubMed Abstract | CrossRef Full Text | Google Scholar
Geddes, E., and Cohen, P. R. (2010). Antineoplastic agent-associated serpentine supravenous hyperpigmentation: superficial venous system hyperpigmentation following intravenous chemotherapy. South. Med. J. 103, 231-235. doi:10.1097/SMJ.0b013e3181ce0f5e
Genovese, G., Gelmetti, C., Spigariolo, C., and Colonna, C. (2020). Acetaminophen-induced generalized fixed drug eruption in a 5-year-old girl. Pediatr. Dermatol. 37, 756-758. doi:10.1111/pde.14161
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghafarzadeh, M., and Eatemadi, A. (2017). Clinical efficacy of liposome-encapsulated Aloe vera on melasma treatment during pregnancy. J. Cosmet. Laser Ther. 19, 181-187. doi:10.1080/14764172.2017.1279329
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghanbarzadeh, S., Hariri, R., Kouhsoltani, M., Shokri, J., Javadzadeh, Y., and Hamishehkar, H. (2015a). Enhanced stability and dermal delivery of hydroquinone using solid lipid nanoparticles. Colloids surfaces B biointerfaces 136, 1004-1010. doi:10.1016/j.colsurfb.2015.10.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghanbarzadeh, S., Hariri, R., Kouhsoltani, M., Shokri, J., Javadzadeh, Y., and Hamishehkar, H. (2015b). Enhanced stability and dermal delivery of hydroquinone using solid lipid nanoparticles. Colloids Surf. B Biointerfaces 136, 1004-1010. doi:10.1016/j.colsurfb.2015.10.041
PubMed Abstract | CrossRef Full Text | Google Scholar
Ghosh, P. K., and Murthy, R. S. (2006). Microemulsions: a potential drug delivery system. Curr. Drug Deliv. 3, 167-180. doi:10.2174/156720106776359168
PubMed Abstract | CrossRef Full Text | Google Scholar
Gilchrest, B. A., Soter, N. A., Stoff, J. S., and Mihm, M. C. (1981). The human sunburn reaction: histologic and biochemical studies. J. Am. Acad. Dermatology 5, 411-422. doi:10.1016/s0190-9622(81)70103-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Goel, A., Krupashankar, D. S., Aurangabadkar, S., Nischal, K. C., Omprakash, H. M., and Mysore, V. (2011). Fractional lasers in dermatology–current status and recommendations. Indian J. Dermatol Venereol. Leprol. 77, 369-379. doi:10.4103/0378-6323.79732
Goel, A., and Trivedi, N. (2023). Current updates on melasma treatments. Cosmoderma 3, 79. doi:10.25259/csdm_84_2023
CrossRef Full Text | Google Scholar
González-Molina, V., Martí-Pineda, A., and González, N. (2022). Topical treatments for melasma and their mechanism of action. J. Clin. Aesthet. Dermatol 15, 19-28.
Google Scholar
Grimbaldeston, M. A., Simpson, A., Finlay-Jones, J., and Hart, P. H. (2003). The effect of ultraviolet radiation exposure on the prevalence of mast cells in human skin. Br. J. Dermatology 148, 300-306. doi:10.1046/j.1365- 2133.2003.05113.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Grimes, P. E., Ijaz, S., Nashawati, R., and Kwak, D. (2019). New oral and topical approaches for the treatment of melasma. Int. J. Womens Dermatol 5, 30-36. doi:10.1016/j.ijwd.2018.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Guarneri, F. (2014). Etiopathogenesis of melasma. Pigment. Disord. 1, 2376-2427. doi:10.4172/2376-0427.S1- 003
CrossRef Full Text | Google Scholar
Gupta, A. K., Gover, M. D., Nouri, K., and Taylor, S. (2006). The treatment of melasma: a review of clinical trials. J. Am. Acad. Dermatol 55, 1048-1065. doi:10.1016/j.jaad.2006.02.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Gupta, M., Gupta, H., and Gupta, A. (2015). Sorafenib induced acral pigmentation: a new entity. Avicenna J. Med. 5, 46-48. doi:10.4103/2231-0770.154199
Guterres, S. S., Alves, M. P., and Pohlmann, A. R. (2007). Polymeric nanoparticles, nanospheres and nanocapsules, for cutaneous applications. Drug target insights 2, 117739280700200-157. doi:10.1177/117739280700200002
PubMed Abstract | CrossRef Full Text | Google Scholar
Haddad, A. L., Matos, L. F., Brunstein, F., Ferreira, L. M., Silva, A., and Costa, D. (2003). A clinical, prospective, randomized, double-blind trial comparing skin whitening complex with hydroquinone vs. placebo in the treatment of melasma Int. J. Dermatol 42, 153-6. doi:10.1046/j.1365-4362.2003.01621.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Hagag, M., and Allah, S. (2022). The effect of topical nano vitamin-C iontophoresis versus the effect of trichloroacetic acid 20% peel in treatment of melasma. Menoufia Med. J. 35, 489-495. doi:10.4103/mmj.mmj_237_21
CrossRef Full Text | Google Scholar
Hajare, A., Mali, S., Ahir, A., Thorat, J., Salunkhe, S., Nadaf, S., et al. (2014). Lipid nanoparticles: a modern formulation approach in topical drug delivery systems. J. Adv. Drug Deliv. 1, 30-37.
Google Scholar
Hatem, S., El Hoffy, N. M., Elezaby, R. S., Nasr, M., Kamel, A. O., and Elkheshen, S. A. (2020). Background and different treatment modalities for melasma: conventional and nanotechnology-based approaches. J. Drug Deliv. Sci. Technol. 60, 101984. doi:10.1016/j.jddst.2020.101984
CrossRef Full Text | Google Scholar
Hatem, S., Elkheshen, S. A., Kamel, A. O., Nasr, M., Moftah, N. H., Ragai, M. H., et al. (2022). Functionalized chitosan nanoparticles for cutaneous delivery of a skin whitening agent: an approach to clinically augment the therapeutic efficacy for melasma treatment. Drug Deliv. 29, 1212-1231. doi:10.1080/10717544.2022.2058652
PubMed Abstract | CrossRef Full Text | Google Scholar
Hatem, S., Nasr, M., Elkheshen, S. A., and Geneidi, A. S. (2018). Recent Advances in antioxidant cosmeceutical topical delivery. Curr. Drug Deliv. 15, 953-964. doi:10.2174/1567201815666180214143551
Hernández-Barrera, R., Torres-Alvarez, B., Castanedo-Cazares, J., Oros-Ovalle, C., and Moncada, B. (2008). Solar elastosis and presence of mast cells as key features in the pathogenesis of melasma. Clin. Exp. dermatology 33, 305-308. doi:10.1111/j.1365-2230.2008.02724.x
CrossRef Full Text | Google Scholar
Hofbauer Parra, C. A., Careta, M. F., Valente, N. Y., De Sanches Osório, N. E., and Torezan, L. A. (2016). Clinical and histopathologic assessment of facial melasma after low-fluence Q-switched neodymium-doped yttrium aluminium garnet laser. Dermatol Surg. 42, 507-12. doi:10.1097/DSS.0000000000000653
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, H., Belwal, T., Liu, S., Duan, Z., and Luo, Z. (2019). Novel multi-phase nano-emulsion preparation for co-loading hydrophilic arbutin and hydrophobic coumaric acid using hydrocolloids. Food Hydrocoll. 93, 92-101. doi:10.1016/j.foodhyd.2019.02.023
CrossRef Full Text | Google Scholar
Huerth, K. A., Hassan, S., and Callender, V. D. (2019). Therapeutic insights in melasma and hyperpigmentation management. J. Drugs Dermatol 18, 718-729.
PubMed Abstract | Google Scholar
Huh, S. Y., Shin, J. W., Na, J. I., Huh, C. H., Youn, S. W., and Park, K. C. (2010). Efficacy and safety of liposome- encapsulated 4-n-butylresorcinol 0.1% cream for the treatment of melasma: a randomized controlled split-face trial. J. dermatology 37, 311-315. doi:10.1111/j.1346-8138.2010.00787.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Hwang, S. W., Oh, D. J., Lee, D., Kim, J. W., and Park, S. W. (2009). Clinical efficacy of 25% L-ascorbic acid (C’ensil) in the treatment of melasma. J. Cutan. Med. Surg. 13, 74-81. doi:10.2310/7750.2008.07092
Ibrahim, Z. A., Gheida, S. F., El Maghraby, G. M., and Farag, Z. E. (2015). Evaluation of the efficacy and safety of combinations of hydroquinone, glycolic acid, and hyaluronic acid in the treatment of melasma. J. Cosmet. Dermatol 14, 113-23. doi:10.1111/jocd.12143
PubMed Abstract | CrossRef Full Text | Google Scholar
Ibrahimi, O. A., and Anderson, R. R. (2010). Images in clinical medicine. Bleomycin-induced flagellate hyperpigmentation. N. Engl. J. Med. 363, e36. doi:10.1056/NEJMicm1002334
PubMed Abstract | CrossRef Full Text | Google Scholar
Iddamalgoda, A., Le, Q. T., Ito, K., Tanaka, K., Kojima, H., and Kido, H. (2008). Mast cell tryptase and photoaging: possible involvement in the degradation of extra cellular matrix and basement membrane proteins. Archives dermatological Res. 300, 69-76. doi:10.1007/s00403-007-0806-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Imokawa, G., Yada, Y., Morisaki, N., and Kimura, M. (1998). Biological characterization of human fibroblast- derived mitogenic factors for human melanocytes. Biochem. J. 330, 1235-1239. doi:10.1042/bj3301235
PubMed Abstract | CrossRef Full Text | Google Scholar
Im, S., Kim, J., and Kang, W. (2002). Increased expression of alpha-melanocyte-stimulating hormone in the lesional skin of melasma. Br. J. dermatology 146, 165-167. doi:10.1046/j.1365-2133.2002.4513_3.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Inomata, S., Takada, K., Tsunenaga, M., Fukuda, M., Matsunaga, Y., Amano, S., et al. (2003). Possible involvement of gelatinases in basement membrane damage and wrinkle formation in chronically ultraviolet B- exposed hairless mouse. J. Investigative Dermatology 120, 128-134. doi:10.1046/j.1523-1747.2003.12021.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jacobus Berlitz, S., De Villa, D., Maschmann Inacio, L. A., Davies, S., Zatta, K. C., Guterres, S. S., et al. (2019). Azelaic acid-loaded nanoemulsion with hyaluronic acid-a new strategy to treat hyperpigmentary skin disorders. Drug Dev. industrial Pharm. 45, 642-650. doi:10.1080/03639045.2019.1569032
Jansen, R., Osterwalder, U., Wang, S. Q., Burnett, M., and Lim, H. W. (2013). Photoprotection: part II. Sunscreen: development, efficacy, and controversies. J. Am. Acad. Dermatology 69, 867. e1-14. doi:10.1016/j.jaad.2013.08.022
PubMed Abstract | CrossRef Full Text | Google Scholar
Jiménez-Pérez, Z. E., Singh, P., Kim, Y.-J., Mathiyalagan, R., Kim, D.-H., Lee, M. H., et al. (2018). Applications of Panax ginseng leaves-mediated gold nanoparticles in cosmetics relation to antioxidant, moisture retention, and whitening effect on B16BL6 cells. J. ginseng Res. 42, 327-333. doi:10.1016/j.jgr.2017.04.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Jo, H. Y., Kim, C. K., Suh, I. B., Ryu, S. W., Ha, K. S., Kwon, Y. G., et al. (2009). Co-localization of inducible nitric oxide synthase and phosphorylated Akt in the lesional skins of patients with melasma. J. dermatology 36, 10-16. doi:10.1111/j.1346-8138.2008.00579.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanechorn, N. A., Ayuthaya, P., Niumphradit, N., Manosroi, A., and Nakakes, A. (2012a). Topical 5% tranexamic acid for the treatment of melasma in Asians: a double-blind randomized controlled clinical trial. J. Cosmet. Laser Ther. 14, 150-154. doi:10.3109/14764172.2012.685478
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanechorn, N. A., Ayuthaya, P., Niumphradit, N., Manosroi, A., and Nakakes, A. (2012b). Topical 5% tranexamic acid for the treatment of melasma in Asians: a double-blind randomized controlled clinical trial. J. Cosmet. Laser Ther. 14, 150-4. doi:10.3109/14764172.2012.685478
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, H. Y., and Bahadoran, P. (2012). Application of in vivo reflectance confocal microscopy in melasma classification. J. Am. Acad. Dermatology 67, 157-158. doi:10.1016/j.jaad.2012.02.046
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, H., Hwang, J., Lee, J., Ahn, J., Kim, J. Y., Lee, E. S., et al. (2006). The dermal stem cell factor and c-kit are overexpressed in melasma. Br. J. dermatology 154, 1094-1099. doi:10.1111/j.1365-2133.2006.07179.x
Kang, W., Yoon, K., Lee, E. S., Kim, J., Lee, K., Yim, H., et al. (2002). Melasma: histopathological characteristics in 56 Korean patients. Br. J. dermatology 146, 228-237. doi:10.1046/j.0007-0963.2001.04556.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Karn, D., Kc, S., Amatya, A., Razouria, E. A., and Timalsina, M. (2012). Oral tranexamic acid for the treatment of melasma. Kathmandu Univ. Med. J. (KUMJ) 10, 40-3. doi:10.3126/kumj.v10i4.10993
CrossRef Full Text | Google Scholar
Karrabi, M., David, J., and Sahebkar, M. (2021). Clinical evaluation of efficacy, safety and tolerability of cysteamine 5% cream in comparison with modified Kligman’s formula in subjects with epidermal melasma: a randomized, double-blind clinical trial study. Skin Res. Technol. 27, 24-31. doi:10.1111/srt.12901
PubMed Abstract | CrossRef Full Text | Google Scholar
Katiyar, S., and Yadav, D. (2022). Correlation of oxidative stress with melasma: an overview. Curr. Pharm. Des. 28, 225-231. doi:10.2174/1381612827666211104154928
PubMed Abstract | CrossRef Full Text | Google Scholar
Katoulis, A., Alevizou, A., Soura, E., Mantas, N., Bozi, E., Gregoriou, S., et al. (2014). A double-blind vehicle- controlled study of a preparation containing undecylenoyl phenylalanine 2% in the treatment of melasma in females. J. Cosmet. Dermatol 13, 86-90. doi:10.1111/jocd.12089
PubMed Abstract | CrossRef Full Text | Google Scholar
Khemis, A., Kaiafa, A., Queille-Roussel, C., Duteil, L., and Ortonne, J. P. (2007). Evaluation of efficacy and safety of rucinol serum in patients with melasma: a randomized controlled trial. Br. J. Dermatol 156, 997-1004. doi:10.1111/j.1365-2133.2007.07814.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Khezri, K., Saeedi, M., Morteza-Semnani, K., Akbari, J., and Rostamkalaei, S. S. (2020a). An emerging technology in lipid research for targeting hydrophilic drugs to the skin in the treatment of hyperpigmentation disorders: kojic acid-solid lipid nanoparticles. Artif. Cells, Nanomedicine, Biotechnol. 48, 841-853. doi:10.1080/21691401.2020.1770271
PubMed Abstract | CrossRef Full Text | Google Scholar
Khezri, K., Saeedi, M., Morteza-Semnani, K., Akbari, J., and Rostamkalaei, S. (2020b). An emerging technology in lipid research for targeting hydrophilic drugs to the skin in the treatment of hyperpigmentation disorders: kojic acid-solid lipid nanoparticles. Artif. Cells, Nanomedicine, Biotechnol. 48, 841-853. doi:10.1080/21691401.2020.1770271
PubMed Abstract | CrossRef Full Text | Google Scholar
Khodakiya, A. S., Chavada, J., Jivani, N., Patel, B. N., Khodakiya, M. S., and Ramoliya, A. P. (2012). Microemulsions as enhanced drug delivery carrier: an overview. Am. J. Pharmtech. Res., 206-226.
Google Scholar
Khosravan, S., Alami, A., Mohammadzadeh-Moghadam, H., and Ramezani, V. (2017). The effect of topical use of Petroselinum Crispum (parsley) versus that of hydroquinone cream on reduction of epidermal melasma: a randomized clinical trial. Holist. Nurs. Pract. 31, 16-20. doi:10.1097/HNP.0000000000000186
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, B.-S., Won, T.-H., Seo, P.-S., and Park, S.-D. (2008). A case of generalized hyperpigmentation caused by antituberculosis drugs. Korean J. Dermatology, 1513-1516.
Google Scholar
Kim, E. H., Kim, Y. C., Lee, E.-S., and Kang, H. Y. (2007). The vascular characteristics of melasma. J. dermatological Sci. 46, 111-116. doi:10.1016/j.jdermsci.2007.01.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, E. J., Park, H. Y., Yaar, M., and Gilchrest, B. A. (2005). Modulation of vascular endothelial growth factor receptors in melanocytes. Exp. Dermatol. 14, 625-633. doi:10.1111/j.0906-6705.2005.00345.x
Kim, H. J., Moon, S. H., Cho, S. H., Lee, J. D., and Kim, H. S. (2017). Efficacy and safety of tranexamic acid in melasma: a meta-analysis and systematic review. Acta Derm. Venereol. 97, 776-781. doi:10.2340/00015555- 2668
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, J. Y., Shin, J. Y., Kim, M. R., Hann, S. K., and Oh, S. H. (2012). siRNA-mediated knock-down of COX-2 in melanocytes suppresses melanogenesis. Exp. Dermatol. 21, 420-425. doi:10.1111/j.1600-0625.2012.01483.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, N.-H., Choi, S.-H., Lee, T. R., Lee, C.-H., and Lee, A.-Y. (2016). Cadherin 11 involved in basement membrane damage and dermal changes in melasma. Acta Dermato-Venereologica 96, 635-640. doi:10.2340/00015555-2315
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, N. H., and Lee, A. Y. (2010). Histamine effect on melanocyte proliferation and vitiliginous keratinocyte survival. Exp. Dermatol. 19, 1073-1079. doi:10.1111/j.1600-0625.2010.01133.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kimball, A. B., Kaczvinsky, J. R., Li, J., Robinson, L. R., Matts, P. J., Berge, C. A., et al. (2010). Reduction in the appearance of facial hyperpigmentation after use of moisturizers with a combination of topical niacinamide and N-acetyl glucosamine: results of a randomized, double-blind, vehicle-controlled trial. Br. J. Dermatol 162, 435-41. doi:10.1111/j.1365-2133.2009.09477.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kirsch, B., Hoesly, P. M., Jambusaria, A., Heckman, M. G., Diehl, N. N., and Sluzevich, J. C. (2019). Evaluating the efficacy, safety, and tolerability of the combination of tazarotene, azelaic acid, tacrolimus, and zinc oxide for the treatment of melasma: a pilot study. J. Clin. Aesthet. Dermatol 12, 40-45.
Google Scholar
Kleinegger, C. L., Hammond, H. L., and Finkelstein, M. W. (2000). Oral mucosal hyperpigmentation secondary to antimalarial drug therapy. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod. 90 (2), 189-194. doi:10.1067/moe.2000.106340
Kohli, I., Chaowattanapanit, S., Mohammad, T. F., Nicholson, C. L., Fatima, S., Jacobsen, G., et al. (2018). Synergistic effects of long-wavelength ultraviolet A1 and visible light on pigmentation and erythema. Br. J. Dermatology 178, 1173-1180. doi:10.1111/bjd.15940
PubMed Abstract | CrossRef Full Text | Google Scholar
Kohli, I., Zubair, R., Lyons, A. B., Nahhas, A. F., Braunberger, T. L., Mokhtari, M., et al. (2019). Impact of long- wavelength ultraviolet A1 and visible light on light-skinned individuals. Photochem. Photobiol. 95, 1285-1287. doi:10.1111/php.13143
PubMed Abstract | CrossRef Full Text | Google Scholar
Komal, S., Mashhood, A., Farooq, M., and Qayyum, N. (2021). A comparison of efficacy of intradermal tranexamic acid with topical 20% azelaic acid in the treatment of melasma. PAFMJ 71, 494-97. doi:10.51253/pafmj.v71i2.4528
CrossRef Full Text | Google Scholar
Kondou, S., Okada, Y., and Tomita, Y. (2007). Clinical study of effect of tranexamic acid emulsion on melasma and freckles. Hifu no kagaku 6, 309-315. doi:10.11340/skinresearch.6.3_309
CrossRef Full Text | Google Scholar
Koo, O. M., Rubinstein, I., and Onyuksel, H. (2005). Role of nanotechnology in targeted drug delivery and imaging: a concise review. Nanomedicine Nanotechnol. Biol. Med. 1, 193-212. doi:10.1016/j.nano.2005.06.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kounis, N. G., Frangides, C., Papadaki, P. J., Zavras, G. M., and Goudevenos, J. (1996). Dose-dependent appearance and disappearance of amiodarone-induced skin pigmentation. Clin. Cardiol. 19, 592-594. doi:10.1002/clc.4960190713
Kroumpouzos, G., Travers, R., and Allan, A. (2002). Generalized hyperpigmentation with daunorubicin chemotherapy. J. Am. Acad. Dermatology 46, S1-S3. doi:10.1067/mjd.2002.104509
PubMed Abstract | CrossRef Full Text | Google Scholar
Krupashankar, D. S. R., Somani, V. K., Kohli, M., Sharad, J., Ganjoo, A., Kandhari, S., et al. (2014). A cross- sectional, multicentric clinico-epidemiological study of melasma in India. Dermatology Ther. 4, 71-81. doi:10.1007/s13555-014-0046-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Kumari, S., Pandita, D., Poonia, N., and Lather, V. (2015). Nanostructured lipid carriers for topical delivery of an anti-acne drug: characterization and ex vivo evaluation. Pharm. Nanotechnol. 3, 122-133. doi:10.2174/221173850302151116124757
CrossRef Full Text | Google Scholar
Kusumawardani, A., Paramitasari, A., Dewi, S., and Betaubun, A. (2019). The application of liposomal azelaic acid, 4-n butyl resorcinol and retinol serum enhanced by microneedling for treatment of malar pattern melasma: a case series. Dermatol. Rep. 11. doi:10.4081/dr.2019.8075
CrossRef Full Text | Google Scholar
Kuthial, M., Kaur, T., and Malhotra, S. (2019). Estimation of serum copper, superoxide dismutase and reduced glutathione levels in melasma: a case control study. Int. J. Sci. Res. 8, 25-27. doi:10.36106/ijsr
CrossRef Full Text | Google Scholar
Kwon, S.-H., Hwang, Y.-J., Lee, S.-K., and Park, K.-C. (2016). Heterogeneous pathology of melasma and its clinical implications. Int. J. Mol. Sci. 17, 824. doi:10.3390/ijms17060824
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S. H., Na, J. I., Choi, J. Y., and Park, K. C. (2019). Melasma: updates and perspectives. Exp. Dermatol. 28, 704-708. doi:10.1111/exd.13844
Kwon, S. H., Yang, J. H., Shin, J. W., Park, K. C., Huh, C. H., and Na, J. I. (2020). Efficacy of liposome- encapsulated 4-n-butylresorcinol and resveratrol cream in the treatment of melasma. J. Cosmet. Dermatol 19, 891-895. doi:10.1111/jocd.13080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S., Park, K., and Park, H. G. (2014b). Design of plasmonic cavities. J. Clin. Investig. Dermatol 2, 8. doi:10.1186/s40580-014-0008-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, S., Park, K., Yoon, S. Y., Moon, J. Y., Choi, S. R., Choi, H. S., et al. (2014a). Acid evoked thermal hyperalgesia involves peripheral P2Y1 receptor mediated TRPV1 phosphorylation in a rodent model of thrombus induced ischemic pain. Pigment. Disord. 1, 2. doi:10.1186/1744-8069-10-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Lakhdar, H., Zouhair, K., Khadir, K., Essari, A., Richard, A., Seité, S., et al. (2007). Evaluation of the effectiveness of a broad-spectrum sunscreen in the prevention of chloasma in pregnant women. J. Eur. Acad. Dermatol Venereol. 21, 738-42. doi:10.1111/j.1468-3083.2007.02185.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, A. Y. (2015). Recent progress in melasma pathogenesis. Pigment Cell. & melanoma Res. 28, 648-660. doi:10.1111/pcmr.12404
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, H. C., Thng, T. G., and Goh, C. L. (2016a). Oral tranexamic acid (TA) in the treatment of melasma: a retrospective analysis. J. Am. Acad. Dermatol 75, 385-92. doi:10.1016/j.jaad.2016.03.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Lee, M.-H., Kim, H.-J., Ha, D.-J., Paik, J.-H., and Kim, H.-Y. (2002). Therapeutic effect of topical application of linoleic acid and lincomycin in combination with betamethasone valerate in melasma patients. J. Korean Med. Sci. 17, 518-23. doi:10.3346/jkms.2002.17.4.518
Lee, M.-H., Lee, K.-K., Park, M.-H., Hyun, S.-S., Kahn, S.-Y., Joo, K.-S., et al. (2016b). In vivo anti- melanogenesis activity and in vitro skin permeability of niacinamide-loaded flexible liposomes (Bounsphere™). J. Drug Deliv. Sci. Technol. 31, 147-152. doi:10.1016/j.jddst.2015.12.008
CrossRef Full Text | Google Scholar
Li, H. O.-Y., Pastukhova, E., and Dover, J. S. (2023). Update on melasma management. Adv. Cosmet. Surg. 6, 193-211. doi:10.1016/j.yacs.2022.10.003
CrossRef Full Text | Google Scholar
Li, Y. M., Milikowski, C., Selvaggi, G., Abbo, L. M., Skiada, D., and Galimberti, F. (2020). Polymyxin B- induced skin hyperpigmentation. Transpl. Infect. Dis. 22, e13312. doi:10.1111/tid.13312
PubMed Abstract | CrossRef Full Text | Google Scholar
Li, J., Duan, N., Song, S., Nie, D., Yu, M., Wang, J., et al. (2021). Transfersomes improved delivery of ascorbic palmitate into the viable epidermis for enhanced treatment of melasma. Int. J. Pharm. 608, 121059. doi:10.1016/j.ijpharm.2021.121059
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, J. T., and Tham, S. N. (1997). Glycolic acid peels in the treatment of melasma among Asian women. Dermatol Surg. 23, 177-9. doi:10.1111/j.1524-4725.1997.tb00016.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, H., Lin, Y., Nie, X., Chen, S., Chen, X., Shi, B., et al. (2011). Histological classification of melasma with reflectance confocal microscopy: a pilot study in Chinese patients. Skin Res. Technol. 17, 398-403. doi:10.1111/j.1600-0846.2011.00517.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Lyons, A., Stoll, J., and Moy, R. (2018). A randomized, double-blind, placebo-controlled, split-face study of the efficacy of topical epidermal growth factor for the treatment of melasma. J. Drugs Dermatol 17, 970-973.
Mahmoud, B. H., Ruvolo, E., Hexsel, C. L., Liu, Y., Owen, M. R., Kollias, N., et al. (2010). Impact of long- wavelength UVA and visible light on melanocompetent skin. J. Investig. Dermatol 130, 2092-7. doi:10.1038/jid.2010.95
PubMed Abstract | CrossRef Full Text | Google Scholar
Majid, I., and Aleem, S. (2021). Melasma: update on epidemiology, clinical presentation, assessment, and scoring. J. Skin Stem Cell. 8. doi:10.5812/jssc.120283
CrossRef Full Text | Google Scholar
Malamatari, M., Taylor, K. M. G., Malamataris, S., Douroumis, D., and Kachrimanis, K. (2018). Pharmaceutical nanocrystals: production by wet milling and applications. Drug Discov. Today 23, 534-547. doi:10.1016/j.drudis.2018.01.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Malaviya, R., Morrison, A. R., and Pentland, A. P. (1996). Histamine in human epidermal cells is induced by ultraviolet light injury. J. investigative dermatology 106, 785-789. doi:10.1111/1523-1747.ep12346356
PubMed Abstract | CrossRef Full Text | Google Scholar
Malik, F., Hanif, M. M., and Mustafa, G. (2019). Combination of oral tranexamic acid with topical 3% tranexamic acid versus oral tranexamic acid with topical 20% azelaic acid in the treatment of melasma. J. Coll. Physicians Surg. Pak 29, 502-504. doi:10.29271/jcpsp.2019.06.502
PubMed Abstract | CrossRef Full Text | Google Scholar
Manfreda, V., Eleonora, D. M., and Luca, B. (2023). Efficacy and safety of Politranexamide® liposomal emulsion on facial melasma: a comparative study. J. Cosmet. Dermatol 22, 1780-1785. doi:10.1111/jocd.15648
PubMed Abstract | CrossRef Full Text | Google Scholar
Manosroi, A., Podjanasoonthon, K., and Manosroi, J. (2002). Development of novel topical tranexamic acid liposome formulations. Int. J. Pharm. 235, 61-70. doi:10.1016/s0378-5173(01)00980-2
Mckesey, J., Tovar-Garza, A., and Pandya, A. G. (2020). Melasma treatment: an evidence-based review. Am. J. Clin. Dermatol 21, 173-225. doi:10.1007/s40257-019-00488-w
PubMed Abstract | CrossRef Full Text | Google Scholar
Menter, A. (2004). Rationale for the use of topical corticosteroids in melasma. J. Drugs Dermatol 3, 169-74.
PubMed Abstract | Google Scholar
Mir, A., Boyd, K. P., Meehan, S. A., and Mclellan, B. (2013). Hydroxycholoroquine-induced hyperpigmentation. Dermatology online J. 19, 20723. doi:10.5070/d31912020723
PubMed Abstract | CrossRef Full Text | Google Scholar
Mishra, S. N., Dhurat, R. S., Deshpande, D. J., and Nayak, C. S. (2013). Diagnostic utility of dermatoscopy in hydroquinone-induced exogenous ochronosis. Int. J. Dermatology 52, 413-417. doi:10.1111/j.1365- 4632.2011.05305.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Monteiro, R., Kishore, B., Bhat, R., Dandekeri, S., Martis, J., and Hundi, G. (2013). A comparative study of the efficacy of 4% hydroquinone vs 0.75% kojic acid cream in the treatment of facial melasma. Indian J. dermatology 58, 157. doi:10.4103/0019-5154.108070
PubMed Abstract | CrossRef Full Text | Google Scholar
Morgado-Carrasco, D., Piquero-Casals, J., Granger, C., Trullàs, C., and Passeron, T. (2022). Melasma: the need for tailored photoprotection to improve clinical outcomes. Photodermatol. Photoimmunol. Photomed. 38, 515- 521. doi:10.1111/phpp.12783
PubMed Abstract | CrossRef Full Text | Google Scholar
Nahhas, A. F., Braunberger, T. L., and Hamzavi, I. H. (2019). An update on drug-induced pigmentation. Am. J. Clin. dermatology 20, 75-96. doi:10.1007/s40257-018-0393-2
Navarrete-Solís, J., Castanedo-Cázares, J. P., Torres-Álvarez, B., Oros-Ovalle, C., Fuentes-Ahumada, C., González, F. J., et al. (2011). A double-blind, randomized clinical trial of niacinamide 4% versus hydroquinone 4% in the treatment of melasma. Dermatol Res. Pract. 2011, 379173. doi:10.1155/2011/379173
PubMed Abstract | CrossRef Full Text | Google Scholar
Nelson, M., and Schiavone, M. (2004). Emtricitabine (FTC) for the treatment of HIV infection. Int. J. Clin. Pract. 58, 504-510. doi:10.1111/j.1368-5031.2004.00100.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Noh, T. K., Choi, S. J., Chung, B. Y., Kang, J. S., Lee, J. H., Lee, M. W., et al. (2014). Inflammatory features of melasma lesions in Asian skin. J. Dermatology 41, 788-794. doi:10.1111/1346-8138.12573
PubMed Abstract | CrossRef Full Text | Google Scholar
Nordlund, J. J., Grimes, P. E., and Ortonne, J. P. (2006a). The safety of hydroquinone. J. Eur. Acad. Dermatology Venereol. 20, 781-787. doi:10.1111/j.1468-3083.2006.01670.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nordlund, J., Grimes, P., and Ortonne, J. (2006b). The safety of hydroquinone. J. Eur. Acad. Dermatology Venereol. 20, 781-787. doi:10.1111/j.1468-3083.2006.01670.x
CrossRef Full Text | Google Scholar
Ortonne, J. P. (2006). Retinoid therapy of pigmentary disorders. Dermatol Ther. 19, 280-8. doi:10.1111/j.1529- 8019.2006.00085.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Ortonne, J., Arellano, I., Berneburg, M., Cestari, T., Chan, H., Grimes, P., et al. (2009). A global survey of the role of ultraviolet radiation and hormonal influences in the development of melasma. J. Eur. Acad. Dermatology Venereol. 23, 1254-1262. doi:10.1111/j.1468-3083.2009.03295.x
Pakpayat, N., Nielloud, F., Fortuné, R., Tourne-Peteilh, C., Villarreal, A., Grillo, I., et al. (2009). Formulation of ascorbic acid microemulsions with alkyl polyglycosides. Eur. J. Pharm. Biopharm. 72, 444-52. doi:10.1016/j.ejpb.2009.01.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Paliwal, R., Paliwal, S. R., Kenwat, R., Kurmi, B. D., and Sahu, M. K. (2020). Solid lipid nanoparticles: a review on recent perspectives and patents. Expert Opin. Ther. Pat. 30, 179-194. doi:10.1080/13543776.2020.1720649
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, J. J., Hwang, S. J., Kang, Y. S., Jung, J., Park, S., Hong, J. E., et al. (2019a). Synthesis of arbutin-gold nanoparticle complexes and their enhanced performance for whitening. Archives Pharmacal Res. 42, 977-989. doi:10.1007/s12272-019-01164-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Park, J., Hwang, S., Kang, Y., Jung, J.-S., Park, S., Hong, J., et al. (2019b). Synthesis of arbutin-gold nanoparticle complexes and their enhanced performance for whitening. Archives Pharmacal Res. 42, 977-989. doi:10.1007/s12272-019-01164-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Pasca, P. M., Antonescu, A., Fritea, L., Banica, F., Vicas, S. I., Laslo, V., et al. (2022). Novel liposomal formulation with azelaic acid: preparation, characterization, and evaluation of biological properties. Appl. Sci. 12, 13039. doi:10.3390/app122413039
CrossRef Full Text | Google Scholar
Passeron, T., and Picardo, M. (2018). Melasma, a photoaging disorder. Pigment Cell. & melanoma Res. 31, 461- 465. doi:10.1111/pcmr.12684
PubMed Abstract | CrossRef Full Text | Google Scholar
Pekmezci, E. (2019). A novel triple combination in treatment of melasma: significant outcome with far less actives. J. Cosmet. Dermatol 18, 1700-1704. doi:10.1111/jocd.12904
Piẹtowska, Z., Nowicka, D., and Szepietowski, J. C. (2022). Understanding melasma-how can Pharmacology and cosmetology procedures and prevention help to achieve optimal treatment results? A narrative review. Int. J. Environ. Res. Public Health 19, 12084. doi:10.3390/ijerph191912084
PubMed Abstract | CrossRef Full Text | Google Scholar
Pillaiyar, T., Manickam, M., and Namasivayam, V. (2017). Skin whitening agents: medicinal chemistry perspective of tyrosinase inhibitors. J. Enzyme Inhib. Med. Chem. 32, 403-425. doi:10.1080/14756366.2016.1256882
PubMed Abstract | CrossRef Full Text | Google Scholar
Premjith, R., and Karthikeyan, K. (2022). Zidovudine induced hyperpigmentation. Indian Dermatology Online J. 13, 398-399. doi:10.4103/idoj.idoj_449_21
PubMed Abstract | CrossRef Full Text | Google Scholar
Qiu, L., Zhang, M., Sturm, R. A., Gardiner, B., Tonks, I., Kay, G., et al. (2000). Inhibition of melanin synthesis by cystamine in human melanoma cells. J. Investig. Dermatol 114, 21-7. doi:10.1046/j.1523-1747.2000.00826.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Radmard, A., Saeedi, M., Morteza-Semnani, K., Hashemi, S. M. H., and Nokhodchi, A. (2021). An eco-friendly and green formulation in lipid nanotechnology for delivery of a hydrophilic agent to the skin in the treatment and management of hyperpigmentation complaints: arbutin niosome (Arbusome). Colloids Surfaces B Biointerfaces 201, 111616. doi:10.1016/j.colsurfb.2021.111616
PubMed Abstract | CrossRef Full Text | Google Scholar
Rahimpour, Y., and Hamishehkar, H. (2012). Liposomes in cosmeceutics. Expert Opin. drug Deliv. 9, 443-455. doi:10.1517/17425247.2012.666968
PubMed Abstract | CrossRef Full Text | Google Scholar
Rajanala, S., Maymone, M. B. C., and Vashi, N. A. (2019a). Melasma pathogenesis: a review of the latest research, pathological findings, and investigational therapies. Dermatol Online J. 25. doi:10.5070/d32510045810
Rajanala, S., Maymone, M. B. D. C., and Vashi, N. A. (2019b). Melasma pathogenesis: a review of the latest research, pathological findings, and investigational therapies. Dermatology Online J. 25. doi:10.5070/d32510045810
PubMed Abstract | CrossRef Full Text | Google Scholar
Raton, B. (2011). “Ethnic skin and pigmentation,” in Cosmetics and dermatologic problems and solutions.
Google Scholar
Rendon, M., and Dryer, L. (2016). Investigator-blinded, single-center study to evaluate the efficacy and tolerability of a 4% hydroquinone skin care system plus 0.02% tretinoin cream in mild-to-moderate melasma and photodamage. J. Drugs Dermatol 15, 466-75.
PubMed Abstract | Google Scholar
Resnik, S. (1967). Melasma induced by oral contraceptive drugs. Jama 199, 601-605. doi:10.1001/jama.199.9.601
PubMed Abstract | CrossRef Full Text | Google Scholar
Reyes-Habito, C. M., and Roh, E. K. (2014). Cutaneous reactions to chemotherapeutic drugs and targeted therapies for cancer: part I. Conventional chemotherapeutic drugs. J. Am. Acad. Dermatology 71, 203. e1-203. doi:10.1016/j.jaad.2014.04.014
PubMed Abstract | CrossRef Full Text | Google Scholar
Rigano, L., and Lionetti, N. (2016). “Chapter 6 – nanobiomaterials in galenic formulations and cosmetics,” in Nanobiomaterials in galenic formulations and cosmetics. Editor A. M. GRUMEZESCU (Norwich, New York, USA: William Andrew Publishing).
Google Scholar
Rodrigues, M., and Pandya, A. G. (2015). Melasma: clinical diagnosis and management options. Australas. J. Dermatol 56, 151-63. doi:10.1111/ajd.12290
Roji, M., Sebastian, M., Lucca, J. M., and Ranugha, P. (2018). Phenytoin induced oral Lichenoid eruption and melasma: a case report. Indian J. Pharm. Pract. 11, 55-57. doi:10.5530/ijopp.11.1.10
CrossRef Full Text | Google Scholar
Rolfe, H. M. (2014). A review of nicotinamide: treatment of skin diseases and potential side effects. J. Cosmet. Dermatol 13, 324-8. doi:10.1111/jocd.12119
PubMed Abstract | CrossRef Full Text | Google Scholar
Saeedi, M., Eslamifar, M., and Khezri, K. (2019). Kojic acid applications in cosmetic and pharmaceutical preparations. Biomed. Pharmacother. 110, 582-593. doi:10.1016/j.biopha.2018.12.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Saladi, R. N., Cohen, S. R., Phelps, R. G., Persaud, A. N., and Rudikoff, D. (2006). Diltiazem induces severe photodistributed hyperpigmentation: case series, histoimmunopathology, management, and review of the literature. Archives dermatology 142, 206-210. doi:10.1001/archderm.142.2.206
PubMed Abstract | CrossRef Full Text | Google Scholar
Saleh, F., Abdel-Azim, E., Ragaie, M., and Guendy, M. (2019). Topical tranexamic acid with microneedling versus microneedling alone in treatment of melasma: clinical, histopathologic, and immunohistochemical study. J. Egypt. Women’s Dermatologic Soc. 16, 89. doi:10.4103/jewd.jewd_25_19
CrossRef Full Text | Google Scholar
Salimi, A., and Hajiani, M. (2018). Enhanced stability and dermal delivery of hydroquinone using microemulsion-based system, 11.
Google Scholar
Salvioni, L., Morelli, L., Ochoa, E., Labra, M., Fiandra, L., Palugan, L., et al. (2021). The emerging role of nanotechnology in skincare. Adv. Colloid Interface Sci. 293, 102437. doi:10.1016/j.cis.2021.102437
Sanchez, N. P., Pathak, M. A., Sato, S., Fitzpatrick, T. B., Sanchez, J. L., and Mihm, M. C. (1981). Melasma: a clinical, light microscopic, ultrastructural, and immunofluorescence study. J. Am. Acad. Dermatology 4, 698- 710. doi:10.1016/s0190-9622(81)70071-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarkar, R., Bansal, S., and Garg, V. K. (2012a). Chemical peels for melasma in dark-skinned patients. J. Cutan. Aesthet. Surg. 5, 247-53. doi:10.4103/0974-2077.104912
PubMed Abstract | CrossRef Full Text | Google Scholar
Sarkar, R., Chugh, S., and Garg, V. K. (2012b). Newer and upcoming therapies for melasma. Indian J. Dermatol Venereol. Leprol. 78, 417-28. doi:10.4103/0378-6323.98071
PubMed Abstract | CrossRef Full Text | Google Scholar
Schallier, D., Decoster, L., and De Greve, J. (2011). Pemetrexed-induced hyperpigmentation of the skin. Anticancer Res. 31, 1753-1755.
PubMed Abstract | Google Scholar
Searle, T., Ali, F. R., and Al-Niaimi, F. (2022). The versatility of azelaic acid in dermatology. J. Dermatological Treat. 33, 722-732. doi:10.1080/09546634.2020.1800579
PubMed Abstract | CrossRef Full Text | Google Scholar
Searle, T., Al-Niaimi, F., and Ali, F. R. (2020). The top 10 cosmeceuticals for facial hyperpigmentation. Dermatol Ther. 33, e14095. doi:10.1111/dth.14095
PubMed Abstract | CrossRef Full Text | Google Scholar
Seleit, I., Bakry, O. A., Masoud, E., and Nabil, S. (2017). Identification of genotypes and allelic frequencies of vitamin D receptor gene polymorphism (TaqI) in egyptian melasma patients. Indian Dermatology Online J. 8, 443-448. doi:10.4103/idoj.IDOJ_363_16
Shankar, K., Godse, K., Aurangabadkar, S., Lahiri, K., Mysore, V., Ganjoo, A., et al. (2014). Evidence-based treatment for melasma: expert opinion and a review. Dermatology Ther. 4, 165-186. doi:10.1007/s13555-014- 0064-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Sharma, D., Ali, A. A. E., and Trivedi, L. R. (2018). An Updated Review on: liposomes as drug delivery system. PharmaTutor 6, 50-62. doi:10.29161/pt.v6.i2.2018.50
CrossRef Full Text | Google Scholar
Sharquie, K. E., Al-Mashhadani, S. A., and Salman, H. A. (2008). Topical 10% zinc sulfate solution for treatment of melasma. Dermatol. Surg. 34, 1346-1349. doi:10.1111/j.1524-4725.2008.34287.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Shaw, T. K., Paul, P., and Chatterjee, B. (2022). Research-based findings on scope of liposome-based cosmeceuticals: an updated review. Future J. Pharm. Sci. 8, 46. doi:10.1186/s43094-022-00435-3
CrossRef Full Text | Google Scholar
Sheth, V. M., and Pandya, A. G. (2011). Melasma: a comprehensive update: part II. J. Am. Acad. Dermatol 65, 699-714. doi:10.1016/j.jaad.2011.06.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Shihab, N., Prihartono, J., Tovar-Garza, A., Agustin, T., Legiawati, L., and Pandya, A. G. (2020). Randomised, controlled, double-blind study of combination therapy of oral tranexamic acid and topical hydroquinone in the treatment of melasma. Australas. J. Dermatology 61, 237-242. doi:10.1111/ajd.13267
PubMed Abstract | CrossRef Full Text | Google Scholar
Shin, J. U., Park, J., Oh, S. H., and Lee, J. H. (2013). Oral tranexamic acid enhances the efficacy of low-fluence 1064-nm quality-switched neodymium-doped yttrium aluminum garnet laser treatment for melasma in Koreans: a randomized, prospective trial. Dermatol Surg. 39, 435-42. doi:10.1111/dsu.12060
Shkolnik, T. G., Feuerman, H., Didkovsky, E., Kaplan, I., Bergman, R., Pavlovsky, L., et al. (2014). Blue-gray mucocutaneous discoloration: a new adverse effect of ezogabine. JAMA dermatol. 150, 984-989. doi:10.1001/jamadermatol.2013.8895
PubMed Abstract | CrossRef Full Text | Google Scholar
Sieber, M. A., and Hegel, J. K. (2014). Azelaic acid: properties and mode of action. Skin. Pharmacol. Physiol. 27 (Suppl. 1), 9-17. doi:10.1159/000354888
CrossRef Full Text | Google Scholar
Singh, T. G., and Sharma, N. (2016). “Chapter 7 – nanobiomaterials in cosmetics: current status and future prospects,” in Nanobiomaterials in galenic formulations and cosmetics. Editor A. M. GRUMEZESCU (Norwich, New York, USA: William Andrew Publishing).
Google Scholar
Singh, S., Sharma, N., Zahoor, I., Behl, T., Antil, A., Gupta, S., et al. (2023). Decrypting the potential of nanotechnology-based approaches as cutting-edge for management of hyperpigmentation disorder. Molecules 28, 220. doi:10.3390/molecules28010220
CrossRef Full Text | Google Scholar
Sobhan, M., Talebi-Ghane, E., and Poostiyan, E. (2023). A comparative study of 20% azelaic acid cream versus 5% tranexamic acid solution for the treatment of postinflammatory hyperpigmentation in patients with acne vulgaris: a single-blinded randomized clinical trial. J. Res. Med. Sci. 28, 18. doi:10.4103/jrms.jrms_443_22
PubMed Abstract | CrossRef Full Text | Google Scholar
Sobhi, R. M., and Sobhi, A. M. (2012). A single-blinded comparative study between the use of glycolic acid 70% peel and the use of topical nanosome vitamin C iontophoresis in the treatment of melasma. J. Cosmet. Dermatol 11, 65-71. doi:10.1111/j.1473-2165.2011.00599.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Song, M., Mun, J. H., Ko, H. C., Kim, B. S., and Kim, M. B. (2011). Korean red ginseng powder in the treatment of melasma: an uncontrolled observational study. J. Ginseng Res. 35, 170-5. doi:10.5142/jgr.2011.35.2.170
Spierings, N. M. K. (2020). Melasma: a critical analysis of clinical trials investigating treatment modalities published in the past 10 years. J. Cosmet. Dermatol 19, 1284-1289. doi:10.1111/jocd.13182
PubMed Abstract | CrossRef Full Text | Google Scholar
Stãhli, B., and Schwab, S. (2011). Amiodarone-induced skin hyperpigmentation. QJM Int. J. Med. 104, 723-724. doi:10.1093/qjmed/hcq131
CrossRef Full Text | Google Scholar
Surini, S., and Mellani, T. (2017a). Formulation and physical evaluation of microemulsion and W/O/W multiple emulsions dosage forms with alpha arbutin, lactic acid, and niacinamide as skin-whitening cosmetics. Int. J. Appl. Pharm. 9, 67. doi:10.22159/ijap.2017.v9s1.39_45
CrossRef Full Text | Google Scholar
Surini, S., and Mellani, T. (2017b). Formulation and physical evaluation of microemulsion and W/O/W multiple emulsions dosage forms with alpha arbutin, lactic acid, and niacinamide as skin-whitening cosmetics. Int. J. Appl. Pharm. 9, 67. doi:10.22159/ijap.2017.v9s1.39_45
CrossRef Full Text | Google Scholar
Suryaningsih, B. E., Sadewa, A. H., Wirohadidjojo, Y. W., and Soebono, H. (2019). Association between heterozygote Val92Met MC1R gene polymorphisms with incidence of melasma: a study of Javanese women population in Yogyakarta. Clin. Cosmet. investigational dermatology 12, 489-495. doi:10.2147/CCID.S206115
PubMed Abstract | CrossRef Full Text | Google Scholar
Suryantari, S., Suweta, N. P. T., Veronica, E., Hartawan, I. G. N. B., and Karna, N. (2020). Systematic review of melasma treatments: advantages and disadvantages. Bali Dermatology Venereol. J. 3, 37-51. doi:10.15562/bdv.v3i2.41
CrossRef Full Text | Google Scholar
Suvirya, S., Agrawal, A., and Parihar, A. (2014). 5-Fluorouracil-induced bilateral persistent serpentine supravenous hyperpigmented eruption, bilateral mottling of palms and diffuse hyperpigmentation of soles. Case Rep. 2014, bcr2014206793. doi:10.1136/bcr-2014-206793
PubMed Abstract | CrossRef Full Text | Google Scholar
Syed Azhar, S. N. A., Ashari, S. E., and Salim, N. (2018). Development of a kojic monooleate-enriched oil-in- water nanoemulsion as a potential carrier for hyperpigmentation treatment. Int. J. Nanomedicine 13, 6465-6479. doi:10.2147/IJN.S171532
PubMed Abstract | CrossRef Full Text | Google Scholar
Tadokoro, T., Bonté, F., Archambault, J. C., Cauchard, J. H., Neveu, M., Ozawa, K., et al. (2010). Whitening efficacy of plant extracts including orchid extracts on Japanese female skin with melasma and lentigo senilis. J. dermatology 37, 522-530. doi:10.1111/j.1346-8138.2010.00897.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Taghavi, F., Banihashemi, M., Zabolinejad, N., Salehi, M., Jaafari, M. R., Marhamati, H., et al. (2019a). Comparison of therapeutic effects of conventional and liposomal form of 4% topical hydroquinone in patients with melasma. J. Cosmet. Dermatol 18, 870-873. doi:10.1111/jocd.12744
PubMed Abstract | CrossRef Full Text | Google Scholar
Taghavi, F., Banihashemi, M., Zabolinejad, N., Salehi, M., Jaafari, M. R., Marhamati, H., et al. (2019b). Comparison of therapeutic effects of conventional and liposomal form of 4% topical hydroquinone in patients with melasma. J. Cosmet. Dermatology 18, 870-873. doi:10.1111/jocd.12744
PubMed Abstract | CrossRef Full Text | Google Scholar
Takci, Z., and Ozoguz, P. (2012). Nail discoloration due to tinzaparin sodium. Cutan. Ocular Toxicol. 31, 332- 334. doi:10.3109/15569527.2011.647178
PubMed Abstract | CrossRef Full Text | Google Scholar
Tangau, M. J., Chong, Y. K., and Yeong, K. Y. (2022). Advances in cosmeceutical nanotechnology for hyperpigmentation treatment. J. Nanoparticle Res. 24, 155. doi:10.1007/s11051-022-05534-z
Tansir, G., Gogia, A., and Gupta, R. (2022). Hydroxyurea-induced hyperpigmentation. Cancer Res. Statistics, Treat. 5, 385-386. doi:10.4103/crst.crst_72_22
CrossRef Full Text | Google Scholar
Taraz, M., Niknam, S., and Ehsani, A. H. (2017). Tranexamic acid in treatment of melasma: a comprehensive review of clinical studies. Dermatol. Ther. 30, e12465. doi:10.1111/dth.12465
PubMed Abstract | CrossRef Full Text | Google Scholar
Taylor, S. C., Torok, H., Jones, T., Lowe, N., Rich, P., Tschen, E., et al. (2003). Efficacy and safety of a new triple-combination agent for the treatment of facial melasma. Cutis 72, 67-72.
PubMed Abstract | Google Scholar
Telang, P. S. (2013). Vitamin C in dermatology. Indian Dermatol Online J. 4, 143-6. doi:10.4103/2229- 5178.110593
PubMed Abstract | CrossRef Full Text | Google Scholar
Thangaraju, P., Singh, H., Punitha, M., Giri, V., and Ali, M. S. (2015). Hyperpigmentation, a marker of rifampicin overuse in leprosy patient: an incidental finding. Sudan Med. Monit. 10, 25. doi:10.4103/1858-5000.157506
CrossRef Full Text | Google Scholar
Tirado-Sánchez, A., Santamaría-Román, A., and Ponce-Olivera, R. M. (2009). Efficacy of dioic acid compared with hydroquinone in the treatment of melasma. Int. J. Dermatol 48, 893-5. doi:10.1111/j.1365- 4632.2009.04105.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Tirnaksiz, F., Kayiậ, A., Ọelebi, N., Adiậen, E., and Erel, A. (2012). Preparation and evaluation of topical microemulsion system containing metronidazole for remission in rosacea. Chem. Pharm. Bull. (Tokyo) 60, 583- 92. doi:10.1248/cpb.60.583
Tomic, I., Juretic, M., Jug, M., Pepic, I., Cetina Cizmek, B., and FilipoviC-GrCiC, J. (2019a). Preparation of in situ hydrogels loaded with azelaic acid nanocrystals and their dermal application performance study. Int. J. Pharm. 563, 249-258. doi:10.1016/j.ijpharm.2019.04.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomic, I., Juretic, M., Jug, M., Pepic, I., Cetina Cizmek, B., and Filipovic-Grcic, J. (2019b). Preparation of in situ hydrogels loaded with azelaic acid nanocrystals and their dermal application performance study. Int. J. Pharm. 563, 249-258. doi:10.1016/j.ijpharm.2019.04.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Torres-Álvarez, B., Mesa-Garza, I. G., Castanedo-Cázares, J. P., Fuentes-Ahumada, C., Oros-Ovalle, C., Navarrete-Solis, J., et al. (2011). Histochemical and immunohistochemical study in melasma: evidence of damage in the basal membrane. Am. J. Dermatopathol. 33, 291-295. doi:10.1097/DAD.0b013e3181ef2d45
PubMed Abstract | CrossRef Full Text | Google Scholar
Trivedi, M. K., Yang, F. C., and Cho, B. K. (2017). A review of laser and light therapy in melasma. Int. J. Womens Dermatol 3, 11-20. doi:10.1016/j.ijwd.2017.01.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tse, T. W. (2010). Hydroquinone for skin lightening: safety profile, duration of use and when should we stop? J. Dermatol. Treat. 21, 272-5. doi:10.3109/09546630903341945
PubMed Abstract | CrossRef Full Text | Google Scholar
ủstundag Okur, N., Caglar, E., Pekcan, A., Okur, M., and Ayla, S. (2019). Preparation, optimization and in vivo anti-inflammatory evaluation of hydroquinone loaded microemulsion formulations for melasma treatment, 23, 662-670.
Google Scholar
Vachiramon, V., Kositkuljorn, C., Leerunyakul, K., and Chanprapaph, K. (2021). Isobutylamido thiazolyl resorcinol for prevention of UVB-induced hyperpigmentation. J. Cosmet. Dermatol 20, 987-992. doi:10.1111/jocd.13615
Videira, I. F. D. S., Moura, D. F. L., and Magina, S. (2013). Mechanisms regulating melanogenesis. An. Bras. Dermatol. 88, 76-83. doi:10.1590/s0365-05962013000100009
PubMed Abstract | CrossRef Full Text | Google Scholar
Vidlárová, L., Romero, G. B., Hanus, J., Stèpánek, F., and Muller, R. H. (2016). Nanocrystals for dermal penetration enhancement – effect of concentration and underlying mechanisms using curcumin as model. Eur. J. Pharm. Biopharm. 104, 216-25. doi:10.1016/j.ejpb.2016.05.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Vieira Brazil, R., Brasil Dos Santos, J., Bucco De Campos, V. E., Pereira Dos Santos, E., and Faria De Freitas, Z. (2023). Clinical application of kojic acid in the treatment of melasma: a scope review. J. Cosmet. Sci. 74.
Google Scholar
Vignand-Courtin, C., Martin, C., Le Beller, C., Mateus, C., Barbault-Foucher, S., and Rieutord, A. (2012). Cutaneous side effects associated with sunitinib: an analysis of 8 cases. Int. J. Clin. Pharm. 34, 286-289. doi:10.1007/s11096-012-9615-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, Y.-W., Jou, C.-H., Hung, C.-C., and Yang, M.-C. (2012a). Cellular fusion and whitening effect of a chitosan derivative coated liposome. Colloids Surfaces B Biointerfaces 90, 169-176. doi:10.1016/j.colsurfb.2011.10.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, Y. W., Jou, C. H., Hung, C. C., and Yang, M. C. (2012b). Cellular fusion and whitening effect of a chitosan derivative coated liposome. Colloids Surf. B Biointerfaces 90, 169-76. doi:10.1016/j.colsurfb.2011.10.024
PubMed Abstract | CrossRef Full Text | Google Scholar
Wen, A.-H., Choi, M.-K., and Kim, D.-D. (2006a). Formulation of liposome for topical delivery of arbutin. Archives pharmacal Res. 29, 1187-1192. doi:10.1007/BF02969312
Wen, A. H., Choi, M. K., and Kim, D. D. (2006b). Formulation of liposome for topical delivery of arbutin. Arch. Pharm. Res. 29, 1187-92. doi:10.1007/BF02969312
PubMed Abstract | CrossRef Full Text | Google Scholar
Weschawalit, S., Thongthip, S., Phutrakool, P., and Asawanonda, P. (2017). Glutathione and its antiaging and antimelanogenic effects. Clin. Cosmet. Investig. Dermatol 10, 147-153. doi:10.2147/CCID.S128339
PubMed Abstract | CrossRef Full Text | Google Scholar
Westerhof, W., and Kooyers, T. (2005). Hydroquinone and its analogues in dermatology-a potential health risk. J. Cosmet. dermatology 4, 55-59. doi:10.1111/j.1473-2165.2005.40202.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, P. S., Li, Y. S., Kuo, Y. C., Tsai, S. J., and Lin, C. C. (2019). Preparation and evaluation of novel transfersomes combined with the natural antioxidant resveratrol. Molecules 24, 600. doi:10.3390/molecules24030600
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, P.-S., Lin, C.-H., Kuo, Y.-C., and Lin, C.-C. (2017). Formulation and characterization of hydroquinone nanostructured lipid carriers by homogenization emulsification method. J. Nanomater. 2017, 1-7. doi:10.1155/2017/3282693
CrossRef Full Text | Google Scholar
Wu, M., Antony, R., and Mayrovitz, H. (2021). Melasma: a condition of asian skin. Cureus 13, e14398. doi:10.7759/cureus.14398
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Matsubayashi, K., and Miwa, N. (2007a). Inhibitory effect of the water-soluble polymer-wrapped derivative of fullerene on UVA-induced melanogenesis via downregulation of tyrosinase expression in human melanocytes and skin tissues. Arch. Dermatol Res. 299, 245-57. doi:10.1007/s00403-007-0740-2
Xiao, L., Matsubayashi, K., and Miwa, N. (2007b). Inhibitory effect of the water-soluble polymer-wrapped derivative of fullerene on UVA-induced melanogenesis via downregulation of tyrosinase expression in human melanocytes and skin tissues. Archives Dermatological Res. 299, 245-257. doi:10.1007/s00403-007-0740-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Yenny, S. W. (2018). Comparison of the use of 5% methimazole cream with 4% kojic acid in melasma treatment. Turkish J. Dermatology 12, 167-171. doi:10.4274/tdd.3640
CrossRef Full Text | Google Scholar
Yoshida, M., Takahashi, Y., and Inoue, S. (2000). Histamine induces melanogenesis and morphologic changes by protein kinase A activation via H2 receptors in human normal melanocytes. J. investigative dermatology 114, 334-342. doi:10.1046/j.1523-1747.2000.00874.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Yousefi, A., Khani Khoozani, Z., Zakerzadeh Forooshani, S., Omrani, N., Moini, A. M., and Eskandari, Y. (2014). Is topical zinc effective in the treatment of melasma? A double-blind randomized comparative study. Dermatol Surg. 40, 33-7. doi:10.1111/dsu.12296
PubMed Abstract | CrossRef Full Text | Google Scholar
Yuan, X., and Jin, Z. (2018). Paracrine regulation of melanogenesis. Br. J. Dermatology 178, 632-639. doi:10.1111/bjd.15651
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhang, Q., Tu, Y., Gu, H., Sun, D., Wu, W., Man, M. Q., et al. (2019). A cream of herbal mixture to improve melasma. J. Cosmet. Dermatol 18, 1721-1728. doi:10.1111/jocd.12938
Ziemer, M., Goetze, S., Juhasz, K., and Elsner, P. (2011). Flagellate dermatitis as a bleomycin-specific adverse effect of cytostatic therapy: a clinical-histopathologic correlation. Am. J. Clin. dermatology 12, 68-76. doi:10.2165/11537080-000000000-00000
PubMed Abstract | CrossRef Full Text | Google Scholar
Zilles, J. C., Duarte, L. P., Ruaro, T. C., Zimmer, A. R., Kulkamp-Guerreiro, I. C., and Contri, R. V. (2023). Nanoemulsion containing kojic dipalmitate and Rosehip oil: a promising formulation to treat melasma. Pharmaceutics 15, 468. doi:10.3390/pharmaceutics15020468
PubMed Abstract | CrossRef Full Text | Google Scholar
Keywords: melasma, hyperpigmentation, topical drug delivery, nanoparticles, nanotechnology, skin permeation, clinical effectiveness
Citation: Ghasemiyeh P, Fazlinejad R, Kiafar MR, Rasekh S, Mokhtarzadegan M and Mohammadi-Samani S (2024) Different therapeutic approaches in melasma: advances and limitations. Front. Pharmacol. 15:1337282. doi: 10.3389/fphar.2024.1337282
Received: 12 November 2023; Accepted: 18 March 2024;
Published: 02 April 2024.
Edited by:
Jia-You Fang, Chang Gung University, Taiwan
Reviewed by:
Sergio Alberto Bernal Chávez, Universidad de las Américas Puebla, Mexico
Zhixing Wu, University of Florida, United States
André Rolim Baby, University of São Paulo, Brazil
Copyright © 2024 Ghasemiyeh, Fazlinejad, Kiafar, Rasekh, Mokhtarzadegan and Mohammadi-Samani. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums is permitted, provided the original author(s) and the copyright owner(s) are credited and that the original publication in this journal is cited, in accordance with accepted academic practice. No use, distribution or reproduction is permitted which does not comply with these terms.
*Correspondence: Soliman Mohammadi-Samani, smsamani@sums.ac.ir
Disclaimer: All claims expressed in this article are solely those of the authors and do not necessarily represent those of their affiliated organizations, or those of the publisher, the editors and the reviewers. Any product that may be evaluated in this article or claim that may be made by its manufacturer is not guaranteed or endorsed by the publisher.



































