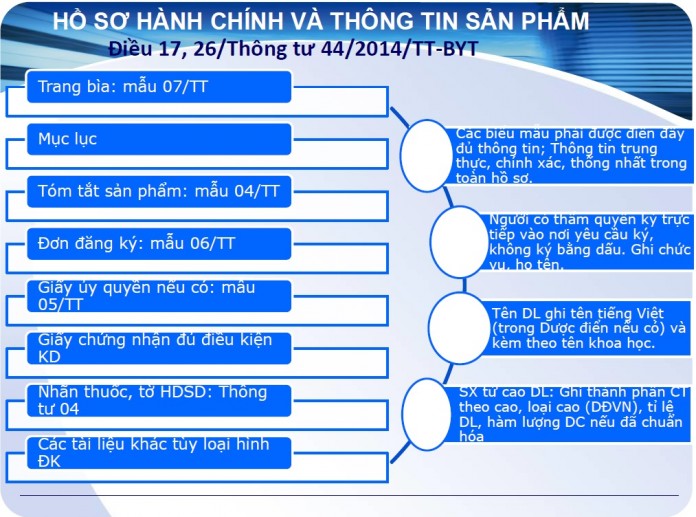
Công văn 5078/QLD-ĐK nhập khẩu, đăng ký, lưu hành thuốc chứa hoạt chất tetrazepam
| BỘ Y TẾ CỤC QUẢN LÝ DƯỢC ——- |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc ————— |
| Số 5078/QLD-ĐK V/v nhập khẩu, đăng ký, lưu hành thuốc chứa hoạt chất tetrazepam |
Hà Nội, ngày 20 tháng 03 năm 2015 |
Kính gửi:
- Các công ty đăng ký, sản xuất thuốc lưu hành tại Việt Nam;
- Các bệnh viện, viện có giường bệnh trực thuộc Bộ Y tế.
Vừa qua, Hội đồng châu Âu đã quyết định đình chỉ lưu hành các thuốc chứa tetrazepam tại các nước thành viên thuộc liên minh châu Âu trên cơ sở khuyến cáo của ủy ban đánh giá rủi ro cảnh giác dược (PRAC) thuộc Cơ quan quản lý dược phẩm Châu Âu (EMA) vì tetrazepam có liên quan tới việc làm tăng nhẹ nguy cơ xảy ra các phản ứng nghiêm trọng trên da so với các thuốc khác trong nhóm Benzodiazepine (bao gồm: hội chứng Stevens-Johnson, hội chứng ly giải biểu bì nhiễm độc và hội chứng DRESS). PRAC cũng nhấn mạnh, với các nguy cơ đã được xác định, các dữ liệu hiện có về hiệu quả của tetrazepam không đủ mạnh đế hỗ trợ cho việc sử dụng thuốc đối với các chỉ định đã được phê duyệt. Thuốc chứa hoạt chất tetrazepam không còn SĐK lưu hành ở Việt Nam, nhưng đã được nhập khẩu theo giấy phép nhập khẩu để lưu hành ở Việt Nam.
Căn cứ kết luận của Hội đồng tư vấn cấp số đăng ký lun hành thuốc – Bộ Y tế đối với thuốc có chứa hoạt chất tetrazepam, để đảm bảo sử dụng thuốc hợp lý, an toàn, hiệu quả, Cục Quản lý Dược thông báo như sau:
- Ngừng xem xét hồ sơ, ngừng cấp phép nhập khẩu và ngừng cấp số đăng ký đối với các thuốc chứa hoạt chất tetrazepam
Trường hợp công ty muốn đăng ký thuốc chứa hoạt chất tetrazepam, yêu cầu công ty đăng ký/nhà sản xuất nộp kèm dữ liệu lâm sàng chứng minh lợi ích của tetrazepam lớn hơn nguy cơ của thuốc để Cục Quản lý Dược thẩm định, đánh giá lợi ích, nguy cơ đối với chỉ định sử dụng thuốc.
- Ngừng lưu hành đối với các thuốc chứa hoạt chất tetrazepam đã nhập khẩu vào Việt Nam trước ngày ký công văn này. Yêu cầu các công ty có nhập khẩu thuốc chứa hoạt chất tetrazepam tiến hành thu hồi và tiêu hủy thuốc, báo cáo kết quả thu hồi về Cục Quản lý Dược trước ngày 30/4/2015.
Cục Quản lý Dược thông báo để các đơn vị biết và thực hiện./.
KT. CỤC TRƯỞNG
PHÓ CỤC TRƯỞNG
NGUYỄN VIỆT HÙNG (ĐÃ KÝ)
Công văn 5078/QLD-ĐK nhập khẩu, đăng ký, lưu hành thuốc chứa hoạt chất tetrazepam
DOWNLOAD VĂN BẢN GỐC DƯỚI ĐÂY
[sociallocker id=7424]
[/sociallocker]
Copy vui lòng ghi nguồn vnras.com