
| BỘ Y TẾ ——- Số: 3429/QĐ-BYT |
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM Độc lập – Tự do – Hạnh phúc ————— Hà Nội, ngày 14 tháng 7 năm 2021 |
QUYẾT ĐỊNH
VỀ VIỆC BAN HÀNH TÀI LIỆU CHUYÊN MÔN “HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ NHIỄM NẤM XÂM LẤN”
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật Khám bệnh, chữa bệnh năm 2009;
Căn cứ Nghị định số 75/2017/NĐ-CP ngày 20 tháng 6 năm 2017 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh,
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị nhiễm nấm xâm lấn”.
Điều 2. Tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị nhiễm nấm xâm lấn” được áp dụng tại các cơ sở khám bệnh, chữa bệnh trong cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký, ban hành.
Điều 4. Các ông, bà: Chánh Văn phòng Bộ, Chánh thanh tra Bộ, Tổng Cục trưởng, Cục trưởng và Vụ trưởng các Tổng cục, Cục, Vụ thuộc Bộ Y tế, Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc trung ương, Giám đốc các Bệnh viện trực thuộc Bộ Y tế, Thủ trưởng Y tế các ngành chịu trách nhiệm thi hành Quyết định này./.
| Nơi nhận: – Như Điều 4;- Bộ trưởng (để báo cáo);- Các Thứ trưởng;- Cổng thông tin điện tử Bộ Y tế; Website Cục KCB;- Lưu: VT, KCB. |
KT. BỘ TRƯỞNG THỨ TRƯỞNGNguyễn Trường Sơn |
HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ NHIỄM NẤM XÂM LẤN
(Ban hành kèm theo Quyết định số 3429/QĐ-BYT ngày 14 tháng 7 năm 2021)
CHỈ ĐẠO BIÊN SOẠN
PGS.TS. Nguyễn Trường Sơn, Thứ trưởng Bộ Y tế
CHỦ BIÊN
PGS.TS. Lương Ngọc Khuê, Cục trưởng Cục Quản lý Khám, Chữa bệnh – Bộ Y tế.
ĐỒNG CHỦ BIÊN
GS.TS. Nguyễn Gia Bình, Chủ tịch Hội Hồi Hội sức Cấp cứu và Chống độc Việt Nam.
GS.TS. Ngô Quý Châu, Chủ tịch Hội Hô Hấp Việt Nam, Giám đốc chuyên môn, Bệnh viện đa khoa Tâm Anh.
PGS.TS. Chu Thị Hạnh, Phó Chủ tịch Hội Hô hấp Việt Nam, Chủ tịch Hội Hô Hấp Hà Nội.
THAM GIA BIÊN SOẠN:
PGS.TS. Nguyễn Hoàng Anh, Phó trưởng khoa Dược, Bệnh viện Bạch Mai
TS. Huỳnh Văn Ân, Phó Giám đốc Bệnh viện nhân dân Gia Định
PGS.TS. Trần Quang Bính, Bệnh viện Quốc tế City thành phố Hồ Chí Minh
PGS.TS. Trần Thanh Cảng, Giám đốc chuyên môn Bệnh viện đa khoa Quốc tế Vinmec Hải Phòng
PGS.TS. Đào Xuân Cơ, Phó Giám đốc Bệnh viện Bạch Mai
PGS.TS. Lê Tiến Dũng, Trưởng khoa Hô hấp, Bệnh viện Đại học Y dược TP. HCM
TS. Vương Ánh Dương, Phó Cục trưởng Cục Quản lý Khám, chữa bệnh
PGS.TS. Vũ Văn Giáp, Phó Giám đốc Trung tâm Hô hấp, Bệnh viện Bạch Mai.
TS. Lê Quốc Hùng, Trưởng Khoa Bệnh nhiệt đới, Bệnh viện Chợ Rẫy
TS. Đỗ Quốc Huy, Phó Giám đốc Bệnh viện nhân dân 115
ThS. Nguyễn Trọng Khoa, Phó Cục trưởng Cục Quản lý Khám, chữa bệnh
BSCKII. Nguyễn Thị Nam Liên, Nguyên Trưởng khoa Vi sinh, Bệnh viện TW Huế
TS. Cẩn Tuyết Nga, Trưởng Khoa Dược, Bệnh viện đa khoa Tâm Anh
BSCKII. Trần Thị Thanh Nga, Nguyên Trưởng khoa Vi sinh, Bệnh viện Chợ Rẫy
PGS.TS. Trần Văn Ngọc, Chủ tịch Liên chi Hội Hô hấp thành phố Hồ Chí Minh
ThS. Trương Lê Vân Ngọc, Phó trưởng Phòng Nghiệp vụ – Thanh tra – Bảo vệ sức khỏe cán bộ, Cục Quản lý Khám, chữa bệnh
TS. Lê Đức Nhân, Giám đốc Bệnh viện Đà Nẵng
TS. Phạm Hồng Nhung, Phó Trưởng khoa Vi sinh, Bệnh viện Bạch Mai
TS. Trương Thiên Phú, Trưởng khoa Vi sinh, Bệnh viện Chợ Rẫy
PGS.TS. Phan Thu Phương, Giám đốc Trung tâm Hô hấp, Bệnh viện Bạch Mai
ThS. Trương Thái Phương, Trưởng khoa Vi sinh, Bệnh viện Bạch Mai
GS.TS. Đỗ Quyết, Giám đốc Học viện Quân Y
ThS. Đỗ Danh Quỳnh, Giám đốc Trung tâm Gây mê và hồi sức ngoại khoa, Bệnh viện Việt Đức
PGS.TS. Phạm Thị Ngọc Thảo, Phó Giám đốc Bệnh viện Chợ Rẫy
TS. Nguyễn Đăng Tuân, Bệnh viện Đa khoa quốc tế Vinmec Times City
TS. Lê Diễm Tuyết, Nguyên Phó Trưởng khoa Hồi sức tích cực, Bệnh viện Bạch Mai
PGS.TS. Đặng Quốc Tuấn, Phụ trách khoa Hồi sức tích cực, Bệnh viện Bạch Mai
TS. Lê Thượng Vũ, Phó Trưởng Khoa Hô hấp, Bệnh viện Chợ Rẫy
BSCKII. Phan Thị Xuân, Trưởng khoa Hồi sức cấp cứu, Bệnh viện Chợ Rẫy
BAN THƯ KÝ:
ThS. Hoàng Anh Đức, Bộ môn Nội tổng hợp, Trường Đại học Y Hà Nội
ThS. Nguyễn Thanh Huyền, Phó Giám đốc Trung tâm Hô hấp – Bệnh viện Bạch Mai
ThS Nguyễn Mai Hương, Khoa Hồi sức tích cực – Bệnh viện Bạch Mai
ThS. Trương Lê Vân Ngọc, Phó trưởng Phòng Nghiệp vụ – Thanh tra – Bảo vệ sức khỏe cán bộ, Cục Quản lý Khám, chữa bệnh
ThS. Đào Ngọc Phú, Bộ môn Nội tổng hợp, Trường Đại học Y Hà Nội
ThS. Phạm Thị Lệ Quyên, Trung tâm Hô hấp, Bệnh viện Bạch Mai
ThS. Phạm Thế Thạch – Phó Trưởng khoa Hồi sức tích cực, Bệnh viện Bạch Mai
ThS. Nguyễn Thanh Thuỷ, Bộ môn Nội tổng hợp, Trường Đại học Y Hà Nội
LỜI NÓI ĐẦU
Nhiễm nấm xâm lấn trong đó nhiễm nấm máu và nhiễm nấm xâm lấn phổi là một trong các bệnh lý nhiễm trùng có tiên lượng nặng và tỷ lệ tử vong cao. Nhiễm nấm xâm lấn thường xảy ra trên các bệnh nhân có yếu tố nguy cơ như suy giảm miễn dịch, ghép tạng, ung thư máu. Các nghiên cứu trên thế giới cho thấy nhiễm nấm xâm lấn đang có xu hướng gia tăng trong vòng 20 năm gần đây do sự gia tăng các bệnh nhân có yếu tố nguy cơ nhiễm nấm và sự đề kháng của căn nguyên gây bệnh với các thuốc chống nấm hiện có. Về mặt dịch tễ học, nhiễm nấm xâm lấn gồm có nhiễm nấm cơ hội và nhiễm nấm lưu hành. Các căn nguyên hay gặp trong nhiễm nấm xâm lấn là Candida, Aspergillus, Cryptococcus, Talaromyces marneffei và Pneumocystis jirovecii.
Việc chẩn đoán, điều trị và dự phòng sớm các trường hợp nhiễm nấm xâm lấn giúp cải thiện tỷ lệ tử vong. Tuy nhiên việc chẩn đoán sớm nhiễm nấm xâm lấn trên lâm sàng còn gặp nhiều khó khăn do các triệu chứng lâm sàng không đặc hiệu, đòi hỏi phải dựa vào việc đánh giá các yếu tố nguy cơ nhiễm nấm và các kỹ thuật vi sinh, giải phẫu bệnh…
“Hướng dẫn chẩn đoán và điều trị nhiễm nấm xâm lấn” được biên soạn lần đầu tiên vào năm 2021 bởi các chuyên gia của Hội Hô Hấp Việt Nam và Hội Hồi Sức Cấp Cứu và Chống Độc Việt Nam đã cung cấp cho các cán bộ y tế những kiến thức cần thiết về chẩn đoán và điều trị nhiễm nấm xâm lấn trên thực hành lâm sàng. Với mong muốn cập nhật các kiến thức và bằng chứng khoa học trong chẩn đoán và điều trị nấm xâm lấn đồng thời để hoàn thiện khuyến cáo cho phù hợp với quá thực hành lâm sàng tại Việt Nam, cuốn khuyến cáo đã được hoàn thiện với sự tâm huyết và nỗ lực của các chuyên gia hàng đầu có kinh nghiệm về quản lý, lâm sàng, giảng dạy của của cả 3 miền Bắc, Trung, Nam. Cục Quản lý Khám, chữa bệnh trân trọng cảm ơn sự đóng góp công sức và trí tuệ của lãnh đạo các bệnh viện, các giáo sư, phó giáo sư, tiến sỹ, bác sỹ chuyên khoa hô hấp đã tham gia góp ý cho tài liệu này. Trong quá trình biên tập, in ấn tài liệu khó có thể tránh được các sai sót, chúng tôi rất mong nhận được sự đóng góp từ quý độc giả đồng nghiệp để tài liệu ngày một hoàn thiện hơn. Mọi ý kiến góp ý xin gửi về Cục Quản lý Khám, chữa bệnh – Bộ Y tế, 138A Giảng Võ, Ba Đình, Hà Nội.
Trân trọng cảm ơn!
| CHỦ BIÊN
PGS.TS. Lương Ngọc Khuê Cục trưởng |
MỤC LỤC
CHƯƠNG 1. TỔNG QUAN VỀ NHIỄM NẤM XÂM LẤN
1.1. Đại cương
1.1.1. Định nghĩa
1.1.2. Cơ chế bệnh sinh
1.2. Dịch tễ học nhiễm nấm xâm lấn
1.2.1. Dịch tễ học nhiễm nấm xâm lấn trên thế giới
1.2.2. Dịch tễ học nhiễm nấm xâm lấn tại Việt Nam
1.3. Tình trạng kháng thuốc kháng nấm
CHƯƠNG 2. CHẨN ĐOÁN NHIỄM NẤM XÂM LẤN
2.1. Tiêu chuẩn chẩn đoán nhiễm Candida và Aspergillus xâm lấn
2.1.1. Các xét nghiệm chẩn đoán
2.1.2. Yếu tố nguy cơ và biểu hiện lâm sàng nhiễm nấm Candida và Aspergillus xâm lấn
2.1.3. Sơ đồ tiếp cận chẩn đoán nhiễm Candida và Aspergillus xâm lấn
2.2. Chẩn đoán nhiễm nấm Cryptococcus
2.3. Chẩn đoán viêm phổi do Pneumocystis jirovecii
2.4. Chẩn đoán nhiễm nấm Talaromyces marneffei
2.5. Chẩn đoán nhiễm nấm Coccidioides immitis
2.6. Chẩn đoán nhiễm nấm Histoplasma
2.7. Chẩn đoán nhiễm nấm Sporothrix schenckii
2.8. Chẩn đoán nhiễm nấm Blastomyces
CHƯƠNG 3. THUỐC CHỐNG NẤM
3.1. Đặc tính dược lý của thuốc kháng nấm
3.1.1. Dược động học
3.1.2. Dược lực học
3.1.3. Các thông số dược động học/dược lực học (PK/PD) của thuốc kháng nấm và giám sát nồng độ thuốc trong máu
3.2. Dược lý lâm sàng các thuốc kháng nấm
3.2.1. Nhóm polyen
3.2.2. Nhóm azol
3.2.3. Nhóm echinocandin
3.2.4. Nhóm flucytosin
CHƯƠNG 4. ĐIỀU TRỊ NHIỄM NẤM XÂM LẤN
4.1. Nhiễm nấm Candida xâm lấn
4.1.1. Điều trị nhiễm Candida máu đơn độc
4.1.2. Nhiễm nấm Candida xâm lấn cơ quan khác
4.1.3. Nhiễm nấm Candida máu có kèm theo xâm lấn cơ quan khác
4.2. Nhiễm Aspergillus xấm lấn
4.2.1. Điều trị nhiễm Aspergillus phổi (IPA)
4.2.2. Điều trị nhiễm Aspergillus ngoài phổi
4.2.3. Một số lưu ý trong điều trị nhiễm nấm Aspergillus
4.3. Nhiễm nấm Cryptococcus
4.3.1. Nhiễm nấm Cryptococcus ở người HIV (-)
4.3.2. Nhiễm nấm Cryptococcus ở người HIV (+)
4.4. Viêm phổi do Pneumocystic Jirovecii
4.5. Nhiễm nấm Talaromyces Marneffei
4.6. Nhiễm nấm khác
4.6.1. Nhiễm nấm Coccidioides immitis phổi
4.6.2. Nhiễm nấm Histoplasma phổi
4.6.3. Nhiễm nấm Sporothrix schenckii phổi
4.6.4. Nhiễm nấm Blastomyces phổi
4.7. Nhiễm một số loài nấm hiếm gặp khác
CHƯƠNG 5. CÁC BIỆN PHÁP KHÁC DỰ PHÒNG NHIỄM NẤM XÂM LẤN
5.1. Bệnh nhân ngoại trú
5.2. Bệnh nhân nội trú
5.2.1. Cách ly bệnh nhân
5.2.2. Các yêu cầu của phòng cách ly
5.2.3. Thực hiện tốt vệ sinh răng miệng
Phụ lục 1: Liều dùng các thuốc chống nấm
Phụ lục 2: Hướng dẫn pha truyền các thuốc chống nấm
Phụ lục 3: Hướng dẫn dự phòng phản ứng dị ứng do tiêm truyền Amphotericin B phức hợp lipid hoặc Amphotericin B quy ước
Phụ lục 4: Tương tác cần lưu ý của các thuốc nhóm Azol
Phụ lục 5: Điều kiện thanh toán bảo hiểm y tế theo Thông tư số 30/2018/TT-BYT
TÀI LIỆU THAM KHẢO
DANH MỤC CHỮ VIẾT TẮT
| AIDS | Acquired Immunodeficiency Syndrome (Hội chứng suy giảm miễn dịch mắc phải) |
| AUC | Area Under the Curve (Diện tích dưới đường cong) |
| BCTT | Bạch cầu trung tính |
| BHI | Brain Heart Infusion |
| CF | Complement Fixation (Cố định bổ thể) |
| COPD | Chronic Obstructive Pulmonary Disease (Bệnh phổi tắc nghẽn mạn tính) |
| CT | Computed Tomography (Chụp cắt lớp vi tính) |
| DPD | Dihydropyrimidine Dehydrogenase |
| EORTC | The European Organization for Research and Treatment of Cancer (Tổ chức nghiên cứu và điều trị ung thư Châu Âu) |
| FDA | Food and Drug Administration (Cơ quan quản lý thuốc và thực phẩm) |
| GOLD | Global Initiative for Chronic Obstructive Lung Disease (Chiến lược toàn cầu về bệnh phổi tắc nghẽn mạn tính) |
| HIV | Human Immunodeficiency Virus (Vi-rút gây suy giảm miễn dịch ở người) |
| HSTC | Hồi sức tích cực |
| IA | Invasive Aspergillus (Aspergillus xâm lấn) |
| IC | Invasive Candida (Candida xâm lấn) |
| ID | Immunodiffusion (Miễn dịch khuếch đại) |
| LFD | Lateral Flow Device |
| MIC | Minimum Inhibitory Concentration (Nồng độ ức chế tối thiểu) |
| MRI | Magnetic Resonance Imaging (Chụp cộng hưởng từ) |
| MSG | Mycoses Study Group (Nhóm nghiên cứu nấm) |
| NADPH | Nicotinamide Adenine Dinucleotide Phosphate |
| NPV | Negative Predictive Value (Gía trị dự đoán âm tính) |
| PAS | Periodic Acid Schiff |
| PCR | Polymerase Chain Reaction (Phản ứng khuếch đại chuổi) |
| PDA | Potato Destrose Agar |
| PET | Positron Emission Tomography (Chụp cắt lớp phát xạ positron) |
| PPV | Positive Predictive Value (Giá trị dự đoán dương tính) |
| RNA | Ribonucleic acid |
| SDA | Sabouraud Dextrose Agar |
| TNF – a | Tumor Necrosis Factors – alpha (Yếu tố hoại tử khối u alpha) |
| TB | Tế bào |
| TKTU | Thần kinh trung ương |
| TM | Tĩnh mạch |
| XN | Xét nghiệm |
CHƯƠNG 1. TỔNG QUAN VỀ NHIỄM NẤM XÂM LẤN
1.1. Đại cương
Trong số hơn 1,5 triệu loài vi nấm (thường được gọi là nấm) có mặt ở trên trái đất, có khoảng 300 loài nấm có khả năng gây bệnh ở người. Trong số đó một số ít loài là căn nguyên gây bệnh thường gặp. Con người có khả năng đề kháng tự nhiên với nhiều loại vi nấm nhờ hệ thống miễn dịch và nhiệt độ cơ thể người tương đối cao (35 – 37 độ C) trong khi hầu hết các loài vi nấm phát triển tốt ở điều kiện nhiệt độ từ 12 đến 30 độ C. Tuy nhiên, sự nóng lên toàn cầu cùng với sự biến đổi khí hậu làm tăng tỷ lệ nhiễm nấm do mở rộng vùng địa lý cho các loài nấm gây bệnh sẵn có và chọn lọc các loài nấm dung nạp nhiệt thích nghi thành dạng có khả năng gây bệnh. Ước tính có khoảng 150 triệu người bị nhiễm nấm nặng đe dọa tính mạng và nhiễm nấm gây hơn 1,6 triệu ca tử vong hàng năm. Số tử vong này là nhiều hơn so với tử vong do sốt rét và tương tự như do lao. Hơn 90% các ca tử vong do là do nhiễm một trong bốn chi nấm Candida, Aspergillus, Cryptococcus và Pneumocystis. Mặc dù xu hướng hiện nay cho thấy sự gia tăng tổng thể của các bệnh nấm xâm lấn, tỷ lệ mắc vẫn bị ước tính thấp. Chẩn đoán nhiễm nấm xâm lấn vẫn là thách thức trong thực hành lâm sàng và việc điều trị sớm thường phụ thuộc vào mức độ nghi ngờ trên lâm sàng. Vì vậy, khuyến cáo này nhằm mục đích cung cấp cho các bác sỹ lâm sàng một cái nhìn tổng quan của về dịch tễ học, lâm sàng, chẩn đoán và điều trị nấm xâm lấn.
1.1.1. Định nghĩa
Nhiễm nấm xâm lấn được xác định khi có mặt của nấm sợi hoặc nấm men ở các mô sâu được xác nhận bằng xét nghiệm nuôi cấy hoặc mô bệnh học.
Phân loại: Nhiễm nấm được phân loại theo vị trí giải phẫu và dịch tễ học.
Phân loại theo giải phẫu và vị trí tổn thương gồm có: nhiễm nấm da – niêm mạc và nhiễm nấm sâu hay nhiễm nấm xâm lấn các cơ quan. Trong đó nhiễm nấm máu và nhiễm nấm phổi là hai thể bệnh phổ biến nhất của nhiễm nấm xâm lấn.
Phân loại dịch tễ gồm có nhiễm nấm lưu hành và nhiễm nấm cơ hội. Nhiễm nấm lưu hành (Ví dụ: Coccodiodes) là nhiễm nấm gây ra bởi các chủng nấm không phải thành phần của vi hệ bình thường. Ngược lại, nhiễm nấm cơ hội xảy ra khi tình trạng miễn dịch của cơ thể bị suy giảm bởi các tác nhân (ví dụ:Candida) thuộc thành phần của vi hệ bình thường. Nhiễm nấm lưu hành có thể do lây từ người sang người, nhưng phần lớn là do lây nhiễm từ môi trường tiếp xúc. Ngược lại, nhiễm nấm cơ hội do nhiễm các nấm cư trú ở vi hệ bình thường trên cơ thể như trên da, niêm mạc đường tiêu hóa.
Dựa trên đặc điểm hình thái học, nấm được phân thành dạng nấm men (nấm tế bào), nấm sợi (nấm mốc) và nấm lưỡng hình. Nấm men có cấu trúc đơn bào, hình cầu hoặc hình ovan, kích thước từ 2-60 µm. Nấm men thường sinh sản bằng cách nảy chồi hoặc tạo ra các túi bào tử hay bào tử đảm. Khi chồi kéo dài mà không phân tách ra được sẽ hình thành sợi giả (Pseudohyphae). Nấm men gây bệnh thường gặp là Candida và Cryptococcus. Nấm sợi có cấu trúc đa bào, gồm những sợi có nhánh dài, rõ rệt, thường có một hoặc nhiều nhân. Nấm sợi được chia thành hai loại là nấm sợi có vách ngăn (Aspergillus, Trichophyton, Microsporum…) và nấm sợi không có vách ngăn (Rhizopus, Mucor…). Nấm lưỡng hình là loại nấm có hình thể thay đổi theo điều kiện môi trường. Khi ở trong mô hoặc môi trường nuôi cấy 35 – 37ºC, nấm phát triển dạng nấm men và có cấu trúc dạng nấm men nhưng lại có cấu trúc dạng nấm sợi ở nhiệt độ 25 – 30ºC. Nấm lưỡng hình thường chỉ lưu hành ở một số khu vực địa lý nên nhiễm các nấm này thường được gọi là nhiễm nấm lưu hành. Nấm lưỡng hình gây bệnh hay gặp là Blastomyces, Paracoccidioides, Coccidioides, Histoplasma, Sporothrix, Talaromyces marneffei.
1.1.2. Cơ chế bệnh sinh
Hầu hết các căn nguyên nấm gây bệnh cho người đều là các căn nguyên gây nhiễm trùng cơ hội chứ không phải là căn nguyên gây bệnh thực sự. Khả năng gây bệnh của nấm có liên quan trực tiếp đến sự thay đổi miễn dịch tại chỗ hoặc toàn thân của cơ thể. Quá trình hình thành nấm xâm lấn phụ thuộc vào hai yếu tố: độc lực của tác nhân gây bệnh và sự suy giảm miễn dịch của chủ thể. Yếu tố độc lực chủ yếu của nấm là các cơ chế giúp tế bào nấm chống lại sự đề kháng của cơ thể. Ví dụ, các căn nguyên nấm gây bệnh có thể tạo ra các enzyme như catalase, superoxide dismutase để giúp chúng giải độc các loại nitơ và oxi hoạt động do các tế bào miễn dịch tiết ra. Các cấu trúc ngoại bào như vỏ, dạng bào tử thiếu các lớp protein kị nước hay chất melanin có ở vách tế bào nấm giúp cho chúng tránh được hiện tượng thực bào và sự tấn công của hệ miễn dịch. Khả năng chuyển dạng hình thái dạng tế bào nấm men sang dạng sợi giả, sợi thật hoặc từ dạng sợi sang dạng men của một số nấm gây bệnh đóng vai trò quan trọng trong cơ chế bệnh sinh cũng như sự biểu hiện của các gene độc lực. Dạng nấm men dễ lan tràn cũng như cư trú trên các bề mặt thì dạng sợi dễ xâm nhập vào các mô và hình thành màng sinh học. Các yếu tố gây ra tình trạng suy giảm miễn dịch là: giảm bạch cầu, sau ghép tạng, HIV – AIDS, trẻ đẻ non, dùng các thuốc ức chế miễn dịch kéo dài, điều trị kháng sinh phổ rộng, điều trị hóa chất ung thư,…và một số yếu tố liên quan đến tình trạng suy giảm miễn dịch bẩm sinh như rối loạn hoạt động hệ enzyme oxi hóa NADPH, bất thường trong tổng hợp yếu tố hoại tử khối u (TNF – a), Interleukin 10…
1.2. Dịch tễ học nhiễm nấm xâm lấn
1.2.1. Dịch tễ học nhiễm nấm xâm lấn trên thế giới
Tần suất nhiễm nấm xâm lấn đang tăng lên nhanh chóng trong vòng hơn 20 năm qua do sự gia tăng của quần thể có nguy cơ nhiễm nấm.
Bảng 1.1: Số liệu thống kê 10 loại nhiễm nấm xâm lấn đáng quan tâm nhất
|
Bệnh (Loài thường gặp nhất) |
Vùng |
Số nhiễm nấm nặng ước tính/năm |
Tỷ lệ tử vong (% trong quần thể nhiễm nấm) |
| Nhiễm nấm xâm lấn cơ hội | |||
| Aspergillosis (Aspergillus fumigatus) |
Toàn thế giới |
> 200.000 |
30-95 |
| Candidiasis (Candida albicans) |
Toàn thế giới |
> 400.000 |
46-75 |
| Cryptococcosis (Cryptococcus neoformans) |
Toàn thế giới |
> 1.000.000 |
20-70 |
| Mucormycosis (Rhizopus oryzae) |
Toàn thế giới |
> 10.000 |
30-90 |
| Pneumocystis (Pneumocystis jirovecii) |
Toàn thế giới |
> 400.000 |
20-80 |
| Nhiễm nấm lưỡng hình lưu hành | |||
| Blastomycosis (Blastomyces dermatitidis) |
Trung tây và Atlantic United State |
~3.000 |
< 2-68 |
| Coccidioidomycosis (Coccidioides immitis) |
Tây nam Mỹ |
~25.000 |
< 1-70 |
| Histoplasmosis (Histoplasma capsulatum) |
Trung tây Mỹ |
~25.000 |
28-50 |
| Paracoccidioidomycosis (Paracoccidioides brasiliensis) |
Brazil |
~ 4.000 |
5-27 |
| Talaromycosis (Talaromyces marneffei) |
Đông nam á |
> 8.000 |
2-75 |
* Candida
Tỷ lệ nhiễm Candida máu ngày càng có xu hướng tăng lên trong vòng hai, ba thập kỷ qua. Trong các nghiên cứu về dịch tễ học gần đây cho thấy nhiễm nấm do Candida spp. chiếm đến 75-88% các nhiễm nấm xâm lấn mắc phải tại bệnh viện. Candida spp. là căn nguyên phổ biến đứng hàng thứ 5 trong số căn căn nguyên gây nhiễm trùng huyết bệnh viện tại Mỹ và Châu Âu. 95 – 97% các trường hợp nhiễm Candida máu do 5 loài Candida: C. albicans, C. tropicalis, C. parapsilosis, C. glabrata, và C. krusei trong đó C. albicans thường gặp nhất. C. albicans hay gặp ở các nước Mỹ, Bắc Âu và Trung Âu. Các non-albicans Candida phổ biến ở Nam Mỹ, Châu Á và Nam Âu, C. glabrata hay gặp ở Mỹ, Bắc Âu và Trung Âu, C. parapsilosis hay gặp ở Nam Mỹ, Nam Âu và một số vùng của Châu Á, C. tropicalis phổ biến ở Nam Mỹ và Châu Á. Tỷ lệ nhiễm Candida máu khác nhau ở các quần thể bệnh nhân khác nhau nhưng khoảng 1-14 ca/100000 dân. Ước tính nhiễm Candida xâm lấn cao hơn nhiễm Candida máu vì cấy máu phát hiện được Candida chỉ có độ nhạy khoảng 40% nên số ca nhiễm Candida xâm lấn thực sự có thể cao hơn 2,5 lần số ca bệnh ước tính. Tỷ lệ tử vong do nhiễm Candida xâm lấn vẫn rất cao, khoảng trên 60%, ở bệnh nhân có shock lên đến 90% mặc dù đã có nhiều tiến bộ trong chẩn đoán cũng như trong điều trị, C. auris là tác nhân Candida mới lần đầu tiên được công bố ở Nhật năm 2009 nhưng đến nay đã hơn 20 nước ở cả 5 châu lục phân lập được loài nấm này. Tỷ lệ nhiễm C. auris thực sự vẫn còn chưa biết rõ vì loài nấm này có kiểu hình giống với các loài Candida khác và các phương pháp định danh thương mại hiện nay phổ biến tại các phòng xét nghiệm vi sinh lâm sàng thường không định danh được chính xác mà có thể định danh nhầm là C. haemulonii, C. famata. C. sake, C. guilliermondii, … nên thường bị chẩn đoán nhầm hoặc bỏ sót nhiều ca nhiễm C. auris liên quan đến các vụ dịch nhiễm trùng bệnh viện ở các khoa hồi sức tích cực. Nhiễm C. auris có tỷ lệ tử vong 30-72%. Khó khăn trong điều trị C. auris vì khả năng đề kháng cao với nhiều loại thuốc kháng nấm, khả năng dễ dàng gây nên các vụ dịch nhiễm trùng bệnh viện và khả năng tồn tại lâu dài ngoài môi trường, trên các bề mặt làm cho C. auris là một trong những tác nhân gây bệnh rất đáng quan ngại.
* Aspergillus
Nhiễm nấm Aspergillus đứng hàng thứ 2 trong số các trường hợp nhiễm nấm xâm lấn, với tỷ lệ tăng lên trong hơn 20 năm qua cùng với sự gia tăng các biện pháp điều trị các bệnh máu ác tính. Giảm bạch cầu hạt kéo dài là yếu tố nguy cơ chính của nhiễm Aspergillus xâm lấn cũng như các nấm khác. Tỷ lệ nhiễm Aspergillus xâm lấn hàng năm ở 40 nước có dữ liệu công bố ước tính khoảng 81927 ca trong số 2000 triệu người. Tỷ lệ nhiễm nấm Aspergillus ước tính ở các bệnh nhân bệnh máu ác tính khoảng 0,8-2,3%. Tỷ lệ tử vong có thể từ 18 đến 57,8%. Ở những bệnh nhân cấy ghép các mô đặc thì tỷ lệ nhiễm Aspergillus còn cao hơn, có thể đến 49% ở những bệnh nhân ghép phổi, 11% ở bệnh nhân ghép gan, 10% ở bệnh nhân ghép tim và 2% ở bệnh nhân ghép thận. Tỷ lệ nhiễm nấm Aspergillus xâm lấn ở bệnh nhân hồi sức tích cực khoảng 1,7-6,3/1000 lần vào khoa hồi sức tích cực. Tỷ lệ tử vong ở những bệnh nhân không có giảm bạch cầu lên đến 63-72% do chẩn đoán muộn.
Có khoảng 19 loài Aspergillus gây bệnh đã được ghi nhận, phần lớn tác nhân Aspergillus thường gặp là A. fumigatus, A. flavus, A. niger, A. terreus, trong đó 90% là A. fumigatus. Sự phân bố của các loài Aspergillus gây bệnh khác nhau ở các khu vực địa lý khác nhau. Đường xâm lấn thường gặp của Aspergillus là đường mũi xoang và hô hấp. Do vậy, biểu hiện hay gặp nhất là viêm phổi. Các dữ liệu về nhiễm nấm cơ hội cho thấy tỷ lệ nhiễm Aspergillus có xu hướng tăng lên trong khi đó tỷ lệ nhiễm Candida có xu hướng ổn định.
* Cryptoccoccus
Có hai loài Cryptoccoccus gây bệnh cho người là Cryptococcus neoformans và Cryptococcus gattii. C. gattii chủ yếu gặp ở các vùng nhiệt đới và cận nhiệt đới có nhiều cây bạch đàn. Bệnh nấm do Cryptoccoccus (Cryptococcosis) là bệnh lý nhiễm trùng nặng do C. neoformans hoặc C. gattii. Viêm phổi do Cryptococcus có thể là biểu hiện ban đầu nhưng viêm não màng não mới là bệnh cảnh hay gặp nhất và nặng nề nhất. Nhiễm C. neoformans thường gặp ở bệnh nhân suy giảm miễn dịch nhưng C. gattii lại thường gây bệnh ở những người có hệ miễn dịch bình thường . Mỗi năm, ước tính trên toàn thế giới có hơn một triệu ca viêm não màng não do C. neoformans ở bệnh nhân AIDS và khoảng 625 000 trường hợp tử vong hàng năm. Trong đó, 73% các ca nhiễm và 75% số ca tử vong là ở vùng châu phi hạ Sahara. Viêm màng não do Cryptococcus là một nhiễm trùng cơ hội chủ yếu ở bệnh nhân nhiễm HIV với số lượng tế bào CD4 < 100 tế bào/ml hoặc ở bệnh nhân có tình trạng ức chế miễn dịch do dùng thuốc. Viêm màng não hiếm gặp ở châu Âu nhưng ở châu Phi có tỷ lệ cao từ 100/100 000 đến 4 000/100 000 trong số bệnh nhân nhiễm HIV. Ở nhiều nước có thu nhập thấp và trung bình, tỷ lệ viêm màng não do Cryptococcus ở bệnh nhân HIV có xu hướng giảm nhưng viêm màng não do Cryptococcus ở những bệnh nhân có ghép tạng và các bệnh nhân bị thiếu hụt miễn dịch qua trung gian tế bào lại là một vấn đề đáng quan tâm. Nhiễm Cryptococcus còn gặp ở các bệnh nhân có hệ miễn dịch hoàn toàn bình thường trên toàn thế giới, đặc biệt là ở khu vực viễn đông. Trong hàng loạt các ca bệnh ở Mỹ, có đến 30% các bệnh nhân không có bệnh lý nền.
* Pneumocystis jirovecii
Trước đây, Pneumocystis jirovecii được coi là một sinh vật đơn bào. Cho đến năm 1988, các phân tích ở mức độ phân tử chỉ ra rằng trình tự ARN của ribosome và ty thể của loài này thuộc về giới nấm. Tuy nhiên, Pneumocystis là một loại nấm không điển hình vì nó cũng có nhiều điểm khác biệt như trong cấu trúc màng bào tương của nó không có ergosterol như các nấm khác mà nó có cholesterol. Chính vì vậy mà các thuốc kháng nấm có đích tác động là ergosterol như amphotericin B và ketoconazole không có tác dụng với Pneumocystis , P. jirovecii lây truyền từ người này sang người khác qua không khí. Có nhiều người đã phơi nhiễm với Pneumocystis từ lúc bé nhưng không bị nhiễm trùng do hệ miễn dịch tốt. Trước kia, người ta cho rằng phơi nhiễm với Pneumocystis từ lúc nhỏ có thể phát triển thành viêm phổi do P. jirovecii (PJP – P. jirovecii pneumonia) khi hệ miễn dịch bị suy giảm. Tuy nhiên, hiện nay, người ta thấy nguồn lây nhiễm là từ một số người khoẻ mạnh có mang P. jirovecii ở trong phổi nhưng không có triệu chứng lâm sàng. Mặc dù hay gặp PJP ở người suy giảm miễn dịch nhưng cũng có những trường hợp PJP ở người có hệ miễn dịch hoàn toàn bình thường. Ngoài bệnh nhân nhiễm HIV, bệnh nhân ung thư, bệnh nhân cấy ghép cơ quan đặc, bệnh nhân bị thiếu hụt miễn dịch qua trung gian tế bào là những đối tượng có nguy cơ cao nhiễm P. jirovecii. Yếu tố nguy cơ có ý nghĩa ở những bệnh nhân PJP không có HIV là sử dụng glucocorticoid phối hợp với liệu pháp ức chế miễn dịch. Ước tính có khoảng 400.000 người bị PJP mỗi năm. Ở các nước phương Tây, PJP là nhiễm trùng cơ hội thường gặp nhất ở bệnh nhân HIV dương tính. Tỷ lệ PJP lên đến hơn 60% ở những bệnh nhân HIV ở Mỹ. Với sự ra đời của thuốc kháng virus tỷ lệ mắc P. jirovecii đã giảm đáng kể. Trong một nghiên cứu gần đây ở châu Âu, P. jirovecii là loại nấm phổ biến thứ hai trong số các tác nhân gây bệnh nấm xâm lấn ở cả bệnh nhân HIV dương tính và âm tính với tỷ lệ mắc là 1,5/100 000 và tỷ lệ tử vong là 9,5%. Theo các dữ liệu thì tỷ lệ tử vong ở những bệnh nhân HIV âm tính cao hơn (30-60%) so với những người HIV dương tính (10-20%).
* Talaromyces marneffei (Penicillium marneffei)
Nhiễm nấm T. marneffei là loại nhiễm nấm lưu hành ở các vùng nhiệt đới, đặc biệt phổ biến ở các nước thuộc khu vực đông nam á. Đây là loài duy nhất trong chi nấm lưỡng hình Talaromyces có thể gây nhiễm nấm hệ thống ở người. Ca bệnh nhiễm Talaromyces marneffei mắc phải tại phòng xét nghiệm được phát hiện đầu tiên vào năm 1959 và ca bệnh tự nhiên đầu tiên được báo cáo vào năm 1973. Chuột tre và đất trong hang chuột này là ổ chứa trong động vật và ngoài môi trường của T. marneffei. Cho đến hiện nay, nguồn lây T. marneffei từ chuột hay từ môi trường sang người vẫn chưa được sáng tỏ, nhưng không lây trực tiếp từ người sang người. Trước kia, nhiễm T. marneffei chỉ được cho là có liên quan đến những bệnh nhân nhiễm HIV/AIDS. Ở các nước như Hồng Kông và nam Trung Quốc, T. marneffei là một trong ba căn nguyên hàng đầu gây nhiễm trùng cơ hội ở bệnh nhân AIDS. Tỷ lệ nhiễm T. marneffei là 10% ở bệnh nhân AIDS ở nam Trung Quốc và khoảng 30% bệnh nhân AIDS ở Thái Lan. Gần đây, khi liệu pháp điều trị cũng như các dự phòng nhiễm HIV được cải thiện làm cho đặc điểm dịch tễ của nhiễm T. marneffei cũng thay đổi với tỷ lệ nhiễm T. marneffei ở những bệnh nhân không nhiễm HIV nhưng có tình trạng suy giảm miễn dịch tăng lên.
* Các loại nấm sợi khác
Ngoài Aspergillus, các loài nấm sợi hay gặp gây ra tình trạng nhiễm nấm xâm lấn là Fusarium, Scedosporium và Zygomycetes. Nhìn chung, các loại nấm này tương đối hiếm gặp nhưng tần suất đang có xu hướng tăng lên.
1.2.2. Dịch tễ học nhiễm nấm xâm lấn tại Việt Nam
Để có dữ liệu chính xác về tỷ lệ mắc và tỷ lệ nhiễm nấm xâm lấn mới của Việt Nam thì cần có một chương trình điều tra dịch tễ học nhiễm nấm trên toàn quốc. Tuy nhiên, để thực hiện được là rất khó khăn. Chính vì vậy mà một nhóm nghiên cứu đã dựa trên dữ liệu sẵn có và các đặc điểm của quần thể để ước tính tỷ lệ nhiễm nấm xâm lấn ở Việt Nam. Mỗi năm, có khoảng 5/100000 dân nhiễm nấm Candida máu. Tỷ lệ nhiễm nấm Aspergillus xâm lấn khoảng 10% ở các bệnh nhân leucemi dòng tuỷ cấp, 10% ở những bệnh nhân bị bệnh máu ác tính khác, 0,5% ở bệnh nhân ghép thận, 4% ở bệnh nhân ghép phổi, 6% ở bệnh nhân ghép tim, 4% ở bệnh nhân ghép gan và khoảng 3,9% ở bệnh nhân nhập viện vì bệnh phổi tắc nghẽn mạn tính. Ước tính tỷ lệ PJP là 0,67/100000 dân.
Tác nhân chủ yếu gây nhiễm nấm máu là Candida spp. Một nghiên cứu đa trung tâm, trong đó có 4 bệnh viện của Việt Nam, về tình hình nhiễm Candida máu và mức độ nhạy cảm của các chủng nấm phân lập được tại Châu Á – Thái Bình Dương đã ghi nhận C. albicans và C. tropicalis là hai loài Candida gây bệnh chủ yếu tại Việt Nam với tỉ lệ lần lượt là 39,9% và 39,2%. Ngoài ra, còn gặp các loài nấm Candida khác như C. glabrata (7,8%), C. rugosa (3,9%), C. guilliermondii (0,7%). Chưa thấy có ca nhiễm C. auris nào được báo cáo ở Việt Nam nhưng cũng có thể là chưa gặp thực sự hoặc có thể bị bỏ sót do phòng xét nghiệm còn gặp khó khăn trong vấn đề định danh chính xác loài nấm này.
Nghiên cứu ở bệnh viện Bạch Mai năm 2016 cho thấy tỉ lệ nấm trong tổng số căn nguyên gây nhiễm trùng huyết phân lập được là 9,8%. Trong đó, căn nguyên Candida spp., đứng hàng thứ tư (7,9%) trong tổng số các căn nguyên vi sinh vật gây bệnh. Ba loài nấm gây nhiễm nấm huyết phổ biến nhất là C. albicans (38,2%), C. tropicalis (36,1%) và C. parapsilosis (14,5%).
Theo thống kê tại viện Huyết học truyền máu trung ương từ năm 2013 đến năm 2015, tỷ lệ cấy nấm máu dương tính trong các trường hợp cấy máu dương tính là từ 14,5 đến 16,9%.
Nghiên cứu hồi cứu trong vòng 5 năm từ 2004 – 2009 tại bệnh viện Nhiệt đới thành phố Hồ Chí Minh cho thấy mỗi năm trung bình các bệnh nhân AIDS nhập viện có 4,4% bệnh nhân nhiễm T. marneffei và là nguyên nhân gây tử vong cho 6,3% các bệnh nhân AIDS.
Tình hình nhiễm các loại nấm khác hầu như không có nghiên cứu công bố nên rất cần thêm nhiều các nghiên cứu về nhiễm nấm xâm lấn tại Việt Nam.
1.3. Tình trạng kháng thuốc kháng nấm
Tỷ lệ nhiễm nấm xâm lấn có xu hướng gia tăng nhanh chóng trong những năm gần đây. Bệnh cảnh lâm sàng của nhiễm nấm xâm lấn nặng nề, chẩn đoán khó khăn, chậm trễ trong điều trị cùng với tình trạng đề kháng thuốc của các căn nguyên nấm càng làm cho tỷ lệ tử vong tăng cao khó chấp nhận (30-80%). Tình trạng nấm Candida và Aspergillus đề kháng các thuốc nhóm azole và đề kháng các thuốc echinocandin của Candida là những thách thức rất lớn cho các bác sĩ lâm sàng.
Khả năng đề kháng thuốc cho dù là kiểu đề kháng tự nhiên hay đề kháng thu được đều dẫn đến hậu quả lâm sàng xấu hoặc thất bại điều trị. Dưới áp lực chọn lọc của các thuốc kháng nấm khi được sử dụng sẽ có thể chọn lọc và giữ lại các chủng nấm đề kháng tự nhiên hoặc các biến chủng đề kháng thu được trong quá trình điều trị kéo dài. Thêm nữa, các chủng nấm ngoài môi trường có sẵn khả năng đề kháng có thể gây nhiễm cho các bệnh nhân chưa từng dùng thuốc kháng nấm làm cho tình trạng đề kháng thuốc trở nên phức tạp và khó lường.
Trong chi Candida, mức độ nhạy cảm với các thuốc kháng nấm rất khác nhau ở các loài Candida khác nhau. Nghiên cứu trên toàn cầu trong giai đoạn từ năm 2005 đến năm 2007 cho thấy các mức độ nhạy cảm với fluconazole và voriconazole của chủng C. albicans gây nhiễm nấm huyết là 98% và 98,5%. Mức độ nhạy cảm với hai thuốc này của các chủng C. tropicalis là 91% và 90%; của các chủng C. parapsilosis là 93% và 97%; của C. glabrata là 68% và 83% và C. krusei đề kháng tự nhiên với fluconazole và còn nhạy cảm 83% với voriconazole. Mặc dù vẫn còn là căn nguyên gây bệnh chưa phổ biến nhưng C. auris là một tác nhân đáng quan ngại do khả năng đề kháng được nhiều loại thuốc kháng nấm. Trong nghiên cứu thử nghiệm trên 54 chủng C. auris phân lập được ở 3 lục địa trên thế giới cho thấy mức độ nhạy cảm với fluconazole chỉ còn 7% và với voriconazole là 46%. Tại các nước châu Á – Thái Bình Dương, C. albicans có mức độ nhạy cảm cao với fluconazole với tỷ lệ là 99,7%. Trong khi mức độ nhạy cảm với fluconazole của các loài C. tropicalis (75.8 %), C. glabrata (94.8%) C. parapsilosis (94.8%) đều thấp hơn. Ở Việt Nam, các loài nấm C. albicans, C. glabrata và C. parapsilosis phân lập từ máu còn nhạy cảm cao với tất cả các nhóm thuốc kháng nấm. C. tropicalis đã giảm nhạy cảm với fluconazole và voriconazole, chỉ còn ở mức 67,1% và 46,7%. Các chủng C. albicans, C. tropicalis và C. parapsilosis đều còn nhạy cảm với nhóm echinocandins.
Với nhiễm nấm do Aspergillus, thuốc ưu tiên lựa chọn hàng đầu cho điều trị là các thuốc nhóm azole. Trên toàn cầu, A. fumigatus là loài gây nhiễm nấm Aspergillus xâm lấn thường gặp nhất, chiếm 90% trong tổng số các Aspergillus gây bệnh phân lập được. Ba loài A. flavus, A. niger và A. terrus cũng thường gặp, chỉ phổ biến sau A. fumigatus. Tính chất đề kháng tự nhiên với các thuốc nhóm azole khác nhau ở các loài Aspergillus khác nhau. Tất cả các loài Aspergillus đều đề kháng tự nhiên với fluconazole và ketoconazole do có sự thay thế acid amin ở 14-α sterol demethylase A mã hoá cho CYP51A. Ngoài hai azole này, hầu hết các Aspergillus được coi là nhạy cảm tự nhiên với các azole khác. Đề kháng azole ở Aspergillus là hậu quả của việc tăng sử dụng azole cho điều trị dự phòng và điều trị kéo dài. Mặc dù, những nghiên cứu điều tra toàn cầu công bố có khoảng 3,2% các chủng A. fumigatus đã đề kháng với một hay nhiều thuốc nhóm azole nhưng có vùng có tỷ lệ đề kháng cao hơn hẳn các vùng khác. Sự khác nhau này có thể bị ảnh hưởng của do qui trình phân lập và kháng nấm đồ khác nhau ở các khu vực khác nhau. Có một vấn đề cần quan tâm đến khi nghiên cứu về tính kháng thuốc của Aspergillus là khái niệm “cryptic species”. Các nghiên cứu về phân loại học Aspergillus có khái niệm “Cryptic species” là các loài gần như không thể phân biệt được với nhau về mặt hình thái học kinh điển mà chỉ phân biệt được bằng các nghiên cứu về di truyền học. Loài phổ biến nhất ví dụ như A. fumigatus thực chất là một phức hợp loài với rất nhiều cryptic species (A. fumigatus sensu stricto, A. lentulus, A. felis, A. parafelis, A. pseudofelis, A. pseudoviridinutans, A. udagawae…). A. fumigatus sensu stricto thường nhạy cảm với nhiều azole nhưng các cryptic species khác kháng azole cao hơn. Có rất ít nghiên cứu về tỷ lệ nhiễm của các cryptic species. Nghiên cứu của Mỹ và Tây Ban Nha thấy có khoảng 10 – 15% các Aspegillosis có tác nhân gây bệnh là các cryptic species. Do vậy, dịch tễ học phân tử rất quan trọng để xác định được chính xác căn nguyên gây bệnh cũng như mức độ nhạy cảm với thuốc kháng nấm của Aspergillus spp.
Giám sát mức độ đề kháng thuốc của nấm vẫn còn bị bỏ trống rất nhiều bởi lẽ nhiều phòng xét nghiệm lâm sàng đặc biệt ở các nước có nguồn lực hạn hẹp chưa thể định danh nấm đến loài và làm kháng nấm đồ một cách thường qui. Do vậy, các bác sĩ lâm sàng ở mọi nơi hiện đang phải tiếp cận các dữ liệu dịch tễ học mức độ nhạy cảm với thuốc kháng nấm từ các phòng xét nghiệm tham chiếu để có được các hướng dẫn trong điều trị nấm.
CHƯƠNG 2. CHẨN ĐOÁN NHIỄM NẤM XÂM LẤN
2.1. Tiêu chuẩn chẩn đoán nhiễm Candida và Aspergillus xâm lấn
Theo tiêu chuẩn hội nghị đồng thuận của EORTC/MSG 2008 thì tùy theo yếu tố nguy cơ, lâm sàng và mức độ chắc chắn của các bằng chứng về nấm chia thành 3 mức độ:
(EORTC/MSG: The European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group)
(1) Chắc chắn (Proven) nhiễm nấm xâm lấn
Có tiêu chuẩn vàng: Có bằng chứng nấm trong mô bệnh học, hoặc cấy dịch vô khuẩn
dương tính hoặc cấy máu dương với Candida.
(2) Nhiều khả năng (Probable) nhiễm nấm xâm lấn
– Có yếu tố nguy cơ.
– Tiêu chuẩn lâm sàng.
– Có xét nghiệm huyết thanh hoặc PCR dương.
(3) Có thể (Possible) nhiễm nấm xâm lấn
– Có yếu tố nguy cơ.
– Tiêu chuẩn lâm sàng.
2.1.1. Các xét nghiệm chẩn đoán
a. Phương pháp nhuộm soi và nuôi cấy
– Soi nhuộm và quan sát dưới kính hiển vi các mẫu sinh thiết mô bệnh học tìm Aspergillus bằng Gomori’s methenamine silver hoặc PAS (periodic acid Schiff). Nhuộm huỳnh quang giúp tăng độ nhạy giảm độ đặc hiệu: Calco fluor white, Uvitex 2B và Brancophor.
– Cấy máu là tiêu chuẩn chẩn đoán chắc chắn nhiễm Candida máu. Cấy máu dương tính ở khoảng 50% bệnh nhân nhiễm Candida xâm lấn. Các yếu tố giúp tăng tỉ lệ cấy máu dương tính: lấy ít nhất 10 ml máu cho một chai cấy, cấy hàng ngày và cấy thêm khi sốt, cấy máu trong môi trường dành cho nấm tăng tỉ lệ dương tính. Kỹ thuật thực hiện định danh sau khi chai cấy máu dương tính bằng kỹ thuật MALDI-TOF và PNA-FISH xác định chủng nấm trong 1 – 2 giờ, rút ngắn thời gian trả kết quả. Cấy máu dương tính Aspergilus hầu hết là ngoại nhiễm.
– Cấy bệnh phẩm vô trùng như mô sinh thiết, dịch màng phổi, dịch não tủy…dương tính với nấm là tiêu chuẩn chẩn đoán chắc chắn nhiễm nấm xâm lấn.
– Cấy bệnh phẩm tìm Candida trên môi trường CHROMagar: với các môi trường truyền thống như thạch Sabouraud, việc xác định các khuẩn lạc trong quần thể là khó khăn, trong khi CHROMagarTM Candida, 24 giờ sau cấy, các khuẩn lạc đã mọc trên đĩa cấy và thông qua màu sắc của khuẩn lạc, có thể phân biệt ngay các loài Candida khác nhau, tạo điều kiện cho sự lựa chọn điều trị kháng nấm thích hợp và tối ưu hóa.
– Cấy đờm, dịch rửa phế quản và các mẫu không vô trùng khác tìm Aspergillus cần thực hiện đủ trên 3 môi trường SDA (Sabouraud dextrose agar), BHI (brain heart infusion) và PDA (potato destrose agar) ở 30 và 37oC trong 72 giờ. Khi có kết quả dương đồng thời kèm 1 kết quả khác như galactomannan, soi trực tiếp dương … giúp xác nhận sự hiện diện nấm có giá trị chẩn đoán xác định.
b. Phương pháp huyết thanh chẩn đoán
– β-D-Glucan: là thành phần cấu tạo vách tế bào của nấm Candida, Aspergillus, Pneumocystis jirovecii và một số vi nấm khác, vì thế không đặc hiệu. Tuy nhiên β-D-Glucan có giá trị trong chẩn đoán nhiễm Candida xâm lấn mô sâu mà không kèm nhiễm Candida máu, đặc biệt nếu dương tính 2 lần liên tiếp. β-D-Glucan dương tính giả trong một số trường hợp như truyền các chế phẩm của máu, lọc máu, dùng gạc phẫu thuật có chứa glucan, dùng kháng sinh piperacillin- tazobactam, ampicillin-clavulante…
– Kháng nguyên mannan và kháng thể anti-mannan: mannan là kháng nguyên polysaccharide trên thành tế bào Candida được giải phóng vào máu, đặc hiệu cho nấm Candida. Kết hợp mannan và anti-mannan làm tăng độ nhạy lên 83% và độ đặc hiệu 86%, đặc biệt với các chủng C. albicans, C. glabrata, C. tropicalis. Xét nghiệm thực hiện trên huyết thanh hoặc dịch não tủy.
– Galactomannan được sử dụng nhiều nhất trong chẩn đoán Aspergillus. Galactomannan dương tính 2 lần liên tiếp trong huyết thanh hoặc trong dịch rửa phế quản hoặc dương một lần kèm với Lateral flow device (LFD), Beta D glucan, PCR Aspergillus, kháng thể kháng Aspergillus dương tính … giúp chẩn đoán xác định. Galactomanan dương ở điểm cắt 0,5 có độ nhạy cao, nhưng dương tính ở điểm cắt 1 có độ đặc hiệu cao.
c. Phương pháp sinh học phân tử
Các kỹ thuật thường dùng gồm: PCR, nested – PCR, RT-PCR.
PCR là xét nghiệm được kỳ vọng nhất hiện nay trong chẩn đoán sớm nhiễm Candida xâm lấn. Trước kia PCR Aspergillus kém chuẩn hóa, không giúp ích cho chẩn đoán nhưng với những tiến bộ hiện nay trong kỹ thuật xét nghiệm, PCR Aspergillus dương 2 lần giúp chẩn đoán xác định.
T2 Candida: là PCR chẩn đoán Candida được FDA Hoa Kỳ chấp thuận từ năm 2014, sử dụng máu toàn phần, cho kết quả chủng nấm Candida theo từng cặp C. albicans/C. tropicalis, C. krusei/C. glabrata, C. parapsilosis, có kết quả sau 3 – 4 giờ. Các nghiên cứu cho thấy độ chính xác rất cao với giá trị dự đoán dương tính (PPV) là 91,7% và giá trị dự đoán âm tính (NPV) 99,6%.
d. Phương pháp chẩn đoán hình ảnh
Các xét nghiệm hình ảnh học phổi được ưu tiên để chẩn đoán nhiễm Aspergillus xâm lấn theo thứ tự sau: chụp cắt lớp vi tính không tiêm thuốc cản quang,chụp cắt lớp vi tính có tiêm thuốc cản quang khi có hiện diện các nốt phổi và/hoặc ở bệnh nhân ho ra máu, MRI phổi, PET-CT.
– Các hình ảnh gợi ý cao khả năng nhiễm nấm nhưng hiếm gặp bao gồm tổn thương dạng đám mờ xung quanh có quầng sáng (halo sign), dấu liềm hơi (crescent sign).
– Các biểu hiện khác không đặc hiệu gồm đông đặc đáy tựa màng phổi, nốt lớn > 1cm hoặc khối, dấu cắt cụt mạch máu, hình giảm đậm độ bên trong hang, dấu quầng sáng ngược (reverse halo sign), hình kính mờ và tràn dịch màng phổi gợi ý trung bình khả năng nhiễm nấm Aspergillus.
e. Phương pháp giải phẫu bệnh học
Là tiêu chuẩn chẩn đoán chắc chắn nếu phát hiện hình ảnh nhiễm nấm trong mẫu mô sinh thiết.
2.1.2. Yếu tố nguy cơ và biểu hiện lâm sàng nhiễm nấm Candida và Aspergillus xâm lấn
a. Nhiễm Candida xâm lấn
◊ Yếu tố nguy cơ nhiễm Candida xâm lấn
– Bệnh nhân nặng, đặc biệt bệnh nhân điều trị tại HSTC thời gian dài.
– Bệnh nhân có phẫu thuật bụng, đặc biệt có rò chỗ nối ruột hoặc phải phẫu thuật bụng nhiều lần.
– Viêm tụy cấp hoại tử.
– Dùng kháng sinh phổ rộng.
– Bệnh nhân có lọc máu.
– Bệnh nhân đặt catheter tĩnh mạch trung tâm.
– Bệnh nhân dinh dưỡng đường tĩnh mạch toàn phần.
– Bệnh nhân dùng corticosteroid hoặc hoá trị ung thư.
– Bệnh máu ác tinh
– U tạng đặc
– Ghép tạng đặc
– Sơ sinh, đặc biệt trẻ thiếu cân, sinh thiếu tháng.
– Có sự phát triển khuẩn lạc Candida nhiều nơi (chỉ số khuẩn lạc > 0,5 hoặc chỉ số khuẩn lạc điều chỉnh > 0,4).
Các thang điểm như Chỉ Số Khuẩn Lạc (Colonization Index), Thang điểm Candida (Candida Score), Qui Tắc Tiên Đoán… có giá trị tiên đoán dương (PPV) thấp từ 4 – 57% nhưng giá trị tiên đoán âm cao từ 97 – 99%, nên có giá trị loại trừ chẩn đoán nhiễm nấm Candida xâm lấn nếu âm tính.
◊ Biểu hiện lâm sàng
– Nhiễm Candida xâm lấn có 3 thể lâm sàng.
+ Nhiễm Candida máu không có xâm lấn mô sâu.
+ Nhiễm Candida máu có xâm lấn mô sâu.
+ Nhiễm Candida xâm lấn mô sâu mà không có nhiễm Candida máu.
– Biểu hiện lâm sàng của nhiễm Candida máu thay đổi từ sốt nhẹ đến đầy đủ các dấu hiệu của suy đa tạng và sốc, không phân biệt được với các tác nhân khác gây nhiễm khuẩn huyết.
– Biểu hiện lâm sàng của Candida xâm lấn mô sâu gồm
+ Mắt: viêm màng mạch võng mạc xảy ra từ 2 – 26% bệnh nhân nhiễm Candida xâm lấn, có thể kèm theo viêm thủy tinh thể. Soi đáy mắt cần phải thực hiện khi nghĩ đến nhiễm Candida máu.
+ Nhiễm Candida xâm lấn hệ thần kinh trung ương: có thể nhiễm ngoại sinh sau phẫu thuật, chấn thương, chọc dịch não tuỷ hoặc Candida theo đường máu đến não. Các thể bệnh bao gồm viêm màng não, viêm u hạt mạch máu, viêm não lan tỏa với nhiều vi áp xe, phình mạch do nấm.
+ Candida xâm lấn đường hô hấp: có thể ở thanh quản, khí – phế quản hoặc phổi. Viêm phổi do Candida thường nằm trong bệnh cảnh nhiễm Candida máu. Soi hoặc cấy đờm dương tính không giúp ích cho chẩn đoán vì tỉ lệ bệnh nhân có Candida cư trú ở đường hô hấp cao.
+ Viêm cơ tim – viêm màng ngoài tim do Candida: thường dưới dạng nhiều ổ áp xe nhỏ trong cơ tim.
+ Viêm nội tâm mạc do Candida: chiếm 2 – 4% trường hợp viêm nội tâm mạc nhưng là thể nặng của nhiễm Candida xâm lấn, thường gặp ở bệnh nhân được phẫu thuật thay van tim nhân tạo.
+ Candida xâm lấn ổ bụng: thường xảy ra ở bệnh nhân viêm phúc mạc thứ phát, áp xe ổ bụng, nhiễm trùng đường mật, viêm tụy cấp và viêm phúc mạc tái phát.
+ Candida xâm lấn ở thận: bệnh nhân không có triệu chứng, thường chẩn đoán khi mổ tử thi.
+ Viêm cơ, áp xe cơ do Candida: gây đau, thăm khám có dấu hiệu sưng, nóng, đỏ, đau vùng cơ liên quan.
+ Viêm khớp, viêm tuỷ xương do Candida.
b. Nhiễm Aspergillus xâm lấn
◊ Yếu tố nguy cơ nhiễm Aspergillus xâm lấn
– Giảm bạch cầu hạt nặng <500 TB/mm3 và kéo dài trong bệnh cảnh bệnh lý huyết học ghép tế bào máu, ghép tạng, hóa trị bạch cầu cấp…là yếu tố nguy cơ cao nhiễm Aspergillus xâm lấn.
– Điều trị tại HSTC với các bệnh cảnh lâm sàng như sử dụng corticosteroid (nhất là dạng uống, liều cao, kéo dài); HIV; điều trị làm giảm lympho bào T; bệnh phổi tắc nghẽn mạn tính (COPD) hoặc bệnh đường hô hấp mạn tính khác; cúm nặng; xơ gan mất bù, suy gan…là các yếu tố nguy cơ nhiễm Aspergillus trung bình.
◊ Biểu hiện lâm sàng
Các triệu chứng lâm sàng ở phổi, xoang, da, thần kinh và các cơ quan khác.
• Lâm sàng gợi ý khả năng nhiễm nấm cao
– Sốt trên 3 ngày dù điều trị kháng sinh thích hợp hoặc không có ổ nhiễm trùng rõ ràng nào khác.
– Sốt tái phát sau hết sốt 48 giờ dù chưa ngưng kháng sinh và/hoặc không có ổ nhiễm trùng rõ ràng nào khác
• Lâm sàng gợi ý khả năng nhiễm nấm trung bình
– Đau ngực màng phổi
– Khó thở
– Ho ra máu
– Tiếng cọ màng phổi
– Suy hô hấp tiến triển thêm
Các triệu chứng nghi ngờ tổn thương cơ quan: đau, viêm nơi cơ quan tổn thương, có loét, hoại tử, tạo nốt, giả mạc, đóng vẩy…
◊ Các tiêu chuẩn chẩn đoán nhiễm Aspergillus xâm lấn ở các đối tượng khác nhau
• EORTC/MSG 2008 (The European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group)
Chẩn đoán xác định nhiễm nấm Aspergillus phổi xâm lấn:
Quan sát trên bệnh phẩm vô khuẩn: mô bệnh học, tế bào học, hoặc soi trực tiếp thấy sợi nấm cùng hình ảnh hủy hoại mô trên bệnh phẩm lấy qua chọc hút kim nhỏ hoặc sinh thiết vô khuẩn. Nuôi cấy trên bệnh phẩm vô khuẩn thấy hình ảnh Aspergillus trên bệnh phẩm sinh thiết phổi.
Chẩn đoán có khả năng nhiễm nấm Aspergillus phổi xâm lấn (có cả 3 tiêu chuẩn):
Yếu tố nguy cơ (1 trong các yếu tố sau):
– Tiền sử giảm bạch cầu (<500 BCTT/mm3) trong vòng 110 ngày.
– Ghép tế bào gốc đồng loài.
– Sử dụng kéo dài corticosteroid với liều trung bình tối thiểu tương đương prednisone 0,3mg/kg/ngày trong 13 tuần.
– Điều trị thuốc ức chế miễn dịch tế bào T.
– Suy giảm miễn dịch bẩm sinh nặng.
– Sử dụng các thuốc sinh học.
Đặc điểm cận lâm sàng (1 trong 3 dấu hiệu trên CT scan ngực):
– Tổn thương đặc, bờ rõ có hoặc không có quầng sáng (halo sign) là tổn thương “hình ảnh kính mờ xung quanh một đám mờ đậm”.
– Dấu liềm hơi
– Hang
Tiêu chuẩn vi sinh (1 trong các tiêu chuẩn):
– Xét nghiệm trực tiếp (tế bào học, soi trực tiếp, nuôi cấy) trên đờm, dịch rửa phế quản, dịch chải phế quản có mặt sợi nấm hoặc cấy dương tính với Aspergillus.
– Xét nghiệm khác (phát hiện kháng nguyên hoặc thành phần vách tế bào) phát hiện kháng nguyên galactomannan trong huyết tương, huyết thanh hoặc dịch rửa phế quản.
Chẩn đoán nghi ngờ nhiễm nấm Aspergillus phổi xâm lấn:
Có yếu tố nguy cơ và đặc điểm cận lâm sàng nhưng âm tính với xét nghiệm vi sinh.
● AspICU (Aspergillus species in Intensive Care Unit Patients)
Chẩn đoán xác định nhiễm nấm Aspergillus phổi xâm lấn:
Cũng như tiêu chuẩn EORTC/MSG
Chẩn đoán giả định nhiễm nấm Aspergillus phổi xâm lấn (bắt buộc có mặt 4 tiêu chuẩn):
Tiêu chuẩn 1: Nuôi cấy bệnh phẩm đường hô hấp dưới dương tính với Aspergillus
Tiêu chuẩn 2: Triệu chứng lâm sàng phù hợp (có 1 trong các triệu chứng sau đây):
– Sốt ít nhất 3 ngày không giảm dù điều trị kháng sinh thích hợp
– Sốt lại sau 1 thời gian không sốt (ít nhất 48 giờ) trong khi vẫn dùng kháng sinh và không có nguyên nhân gây sốt khác.
– Đau kiểu màng phổi
– Tiếng cọ màng phổi
– Khó thở
– Ho máu
– Hô hấp ngày càng kém hiệu quả dù điều trị kháng sinh và hỗ trợ thông khí thích hợp.
Tiêu chuẩn 3: Bất thường hình ảnh phổi trên X quang hoặc CT Scan ngực:
Tiêu chuẩn 4: Kèm theo có 4a hoặc 4b
4a. Yếu tố nguy cơ (1 trong các tình trạng sau):
– Giảm bạch cầu (BCTT tuyệt đối < 500/mm3) trước hoặc tại thời điểm vào HSTC.
– Có bệnh lý máu ác tính hoặc ung thư khác đang được điều trị thuốc độc tế bào.
– Điều trị corticosteroid (tương đương prednisone >20 mg/ ngày).
– Suy giảm miễn dịch bẩm sinh hoặc mắc phải.
4b. Nuôi cấy bán định lượng dịch rửa phế quản dương tính với Aspergillus không có vi khuẩn mọc kèm theo tế bào học dương tính với hình ảnh nhánh sợi nấm.
Nấm Aspergillus cư trú đường hô hấp (loại trừ nhiễm nấm xâm lấn)
Khi không có ≥ 1 tiêu chuẩn cần thiết cho chẩn đoán giả định nhiễm nấm Aspergillus phổi xâm lấn.
● Tiêu chuẩn Bulpa sửa đổi cho chẩn đoán có khả năng (probable) nhiễm nấm Aspergillus phổi xâm lấn ở bệnh nhân COPD nặng nhập HSTC (Modified Bulpa Criteria for probable IPA in critically Ill COPD patients admitted to an ICU)
Yếu tố nguy cơ (đồng thời có)
– Chức năng phổi: GOLD III hoặc IV
– Corticosteroid: dùng corticosteroid toàn thân mà không có yêu cầu đặc hiệu về liều hoặc liệu trình điều trị, hoặc điều trị với corticosteroid đường hít trong ít nhất 3 tháng.
Dấu hiệu hoặc triệu chứng phù hợp (1 trong số sau đây)
– Sốt kéo dài ít nhất 3 ngày dù điều trị phác đồ kháng sinh phù hợp.
– Sốt lại sau 1 thời gian ít nhất 48 giờ không sốt dù đang dùng kháng sinh và không có nguyên nhân sốt nào khác.
– Khó thở hoặc ho máu gần đây.
– Hô hấp ngày càng kém hiệu quả dù điều trị kháng sinh và hỗ trợ thông khí thích hợp.
Hình ảnh học (1 trong số các dấu hiệu sau)
Bất thường hình ảnh trên CT scan hoặc X quang ngực trong vòng 3 tháng:
– Thâm nhiễm và hình ảnh không đồng nhất không đặc hiệu
– Đa nốt lan tỏa đường hô hấp
– Nốt bờ rõ, có hoặc không có dấu quầng sáng (halo sign)
– Đám mờ hình chêm
– Đám mờ dạng khối
– Dấu liềm hơi
– Hang
Dữ liệu nấm học (1 trong số cận lâm sàng sau)
– Cấy và/ hoặc soi tươi bệnh phẩm đường hô hấp dưới dương tính với Aspergillus.
– XN galactomannan huyết thanh hoặc dịch rửa phế quản dương tính trong 2 lần liên tiếp.
– XN galactomannan dương tính với huyết thanh và dương tính với dịch rửa phế quản.
2.1.3. Sơ đồ tiếp cận chẩn đoán nhiễm Candida và Aspergillus xâm lấn
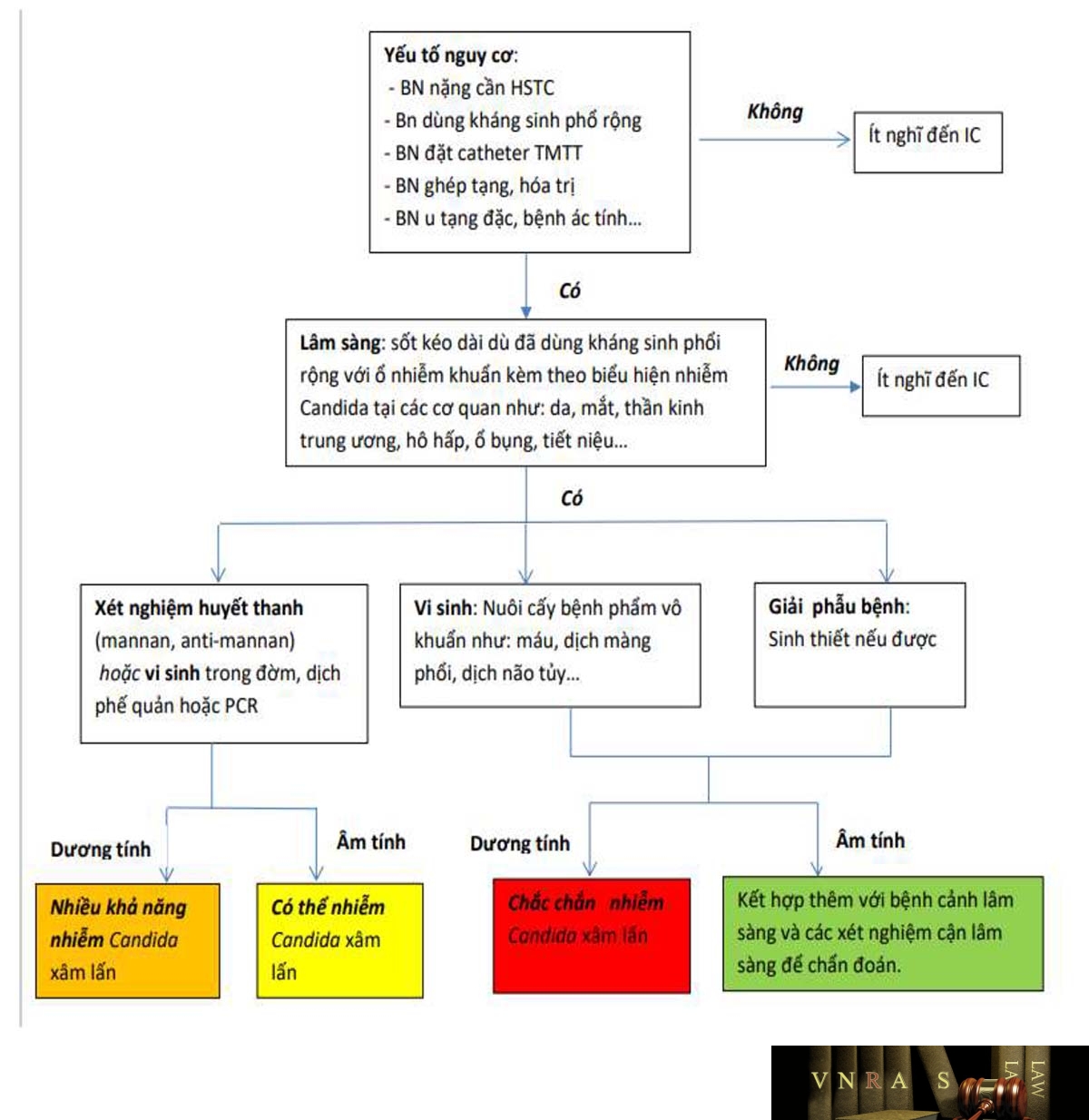
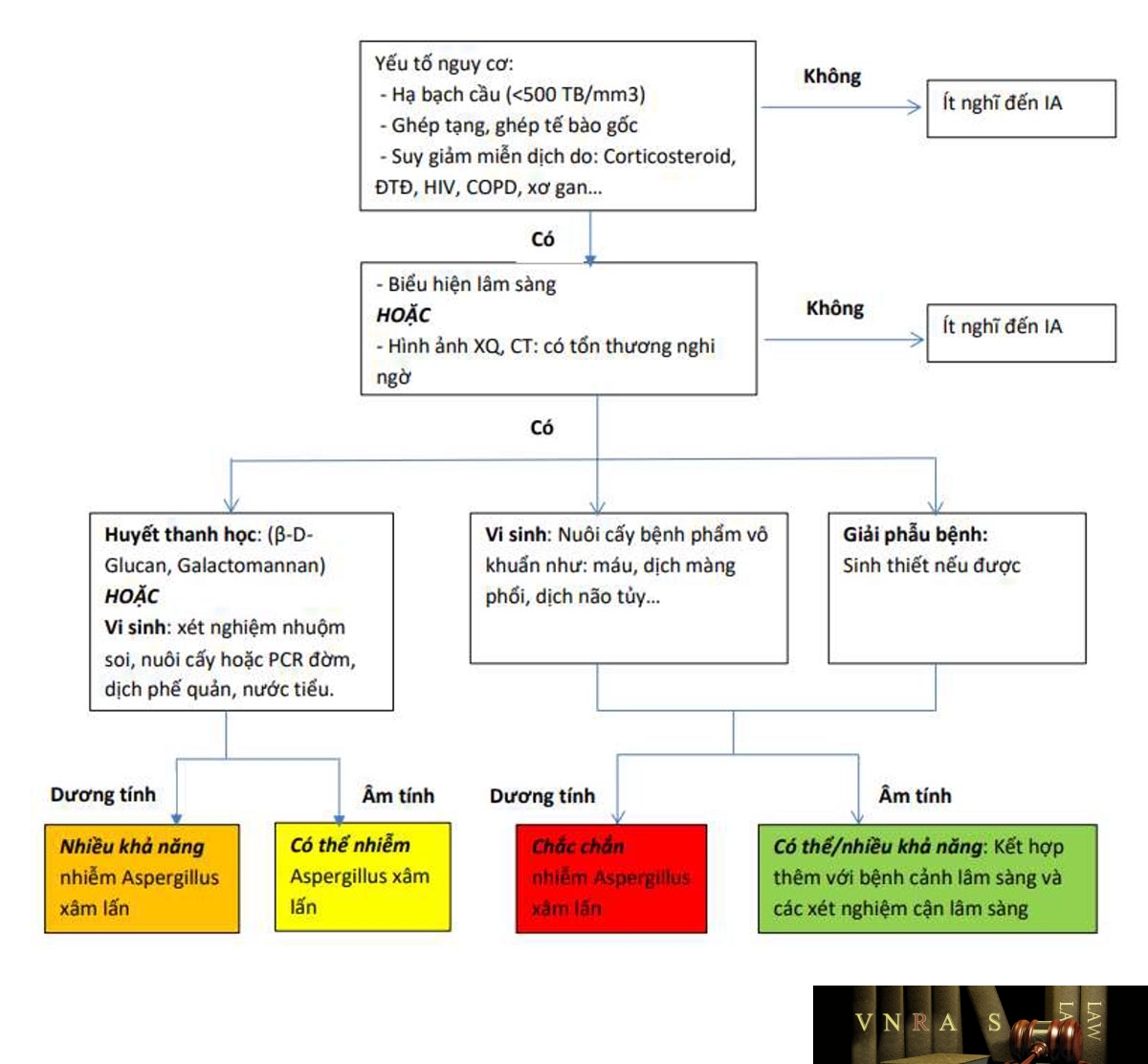
2.2. Chẩn đoán nhiễm nấm Cryptococcus
Nhiễm nấm Cryptococcus (Cryptococcosis) là nhiễm nấm men có vỏ bọc Cryptococcus neoformans.
Phần lớn nhiễm nấm xảy ra trên người bệnh suy giảm miễn dịch, đặc biệt trên người bệnh AIDS. Viêm màng não là bệnh cảnh lâm sàng thường gặp nhất.
Về phân bố địa lý, gặp ở mọi nơi, nhưng có sự khác biệt về phân bố loài gây bệnh.
Nấm Cryptococcus là loại nấm men có vỏ bọc. Có 2 loại:
– C. neoformans var. neoformans type huyết thanh A và D, phân bố khắp thế giới, thường ở chim bồ câu.
– C. neoformans var. gattii type huyết thanh B và C giới hạn ở vùng nhiệt đới và cận nhiệt đới, thường liên quan đến cây thông đỏ (red gum tree).
Có thể gặp dạng hữu tính là nấm mốc sợi Filobasidiella neoformans.
Biểu hiện lâm sàng
– Nhiễm nấm xảy ra sau khi hít bào tử khô của nấm Cryptococcus. Nhiễm nấm phổi không triệu chứng ở 30% người bình thường; một số người khác có triệu chứng ho có đờm, đau ngực, sụt cân và sốt. Hình ảnh x quang phổi cho thấy những tổn thương nốt đơn độc hoặc nhiều nốt bờ rõ, không vôi hóa.
– Nhiễm nấm phổi có thể xảy ra và ổn định trong nhiều tuần đến nhiều tháng trước khi nhiễm nấm lan tỏa có biểu hiện lâm sàng trên người bệnh suy giảm miễn dịch.
– Ở người bệnh suy giảm miễn dịch thường có biểu hiện viêm màng não với xét nghiệm dịch não tủy bất thường: áp lực tăng, protein tăng, glucose giảm, bạch cầu lympho tăng.
– Bệnh thường khởi đầu âm ỉ, yên lặng. Những khiếm khuyết về miễn dịch qua trung gian tế bào thường là yếu tố thuận lợi chính và là nguyên nhân chủ yếu của bệnh suất và tử vong ở người bệnh AIDS.
– Nhiễm nấm thường do C. neoformans var. neoformans ngay cả ở những vùng có tìm thấy C. neoformans var. gattii trong môi trường. Những tổn thương da, xương tủy hoặc nội nhãn có thể theo sau sự lan tỏa nấm bằng đường máu. Tuyến tiền liệt là ổ chứa cho sự tái phát bệnh.
Chẩn đoán xét nghiệm:
Xét nghiệm dưới kính hiển vi phết nhuộm mực tàu dịch não tủy tìm thấy nấm men có vỏ bọc.
Cấy bệnh phẩm: dịch não tủy, đờm, máu, nước tiểu, dịch tuyến tiền liệt; bệnh phẩm cần ly tâm và lấy phần cặn lắng cho vào hộp thạch chứa glucose peptone và ủ ở nhiệt độ 30-35°C trong 2 tuần. Kết quả cấy máu dương tính trên 35-70% người bệnh AIDS.
Môi trường thạch hạt đen (Niger seed agar) có thể dùng để phân biệt Cryptococcus spp. (khúm màu nâu) với Candida spp. (khúm màu trắng). Môi trường Concanaval có thể dùng để phân biệt C. neoformans var. neoformans (vàng) với C. neoformans var. gattii (xanh dương).
Xét nghiệm kháng nguyên (LPA hoặc ELISA) trong dịch não tủy, huyết thanh, nước tiểu và dịch rủa phế quản phế nang (BAL) là các xét nghiệm chẩn đoán rất tin cậy. 90% người bệnh bị viêm màng não do Cryptococcus có xét nghiệm LPA (Latex Particle Agglutination) dương tính.
Các kháng thể được phát hiện ở những bệnh nhân nhiễm khuẩn sớm hoặc khu trú và là một dấu hiệu tiên lượng tốt sau đó khi nhiễm nấm đã khỏi.
2.3. Chẩn đoán viêm phổi do Pneumocystis jirovecii
Pneumocystis jirovecii (trước đây gọi là Pneumocystis carinii) gây ra viêm nhu mô phổi do P. carinii (PCP). Bệnh thường xảy ra ở người suy giảm miễn dịch hoặc ở người bệnh suy nhược và là nguyên nhân gây viêm phổi thường gặp nhất ở người bệnh AIDS.
Về phân bố địa lý, bệnh gặp ở mọi nơi trên thế giới. Pneumocystis jirovecii có đặc điểm về cấu trúc và hình thái học nằm giữa nấm và đơn bào nguyên sinh động vật.
Biểu hiện lâm sàng của viêm phổi do Pneumocystis jirovecii: Phổi là vị trí nhiễm bệnh đầu tiên. Thở nhanh có thể là dấu hiệu duy nhất. Bệnh ghi nhận trên 30% các trường hợp bệnh nhân AIDS. Các nang được tạo thành trong lớp lót biểu mô phế nang và các mô khác, đặc biệt là thận, bệnh lan tỏa có thể bằng đường máu.
Xét nghiệm chẩn đoán:
– Phương pháp cấy không thể phân lập được P. jirovecii; chẩn đoán bằng cách phát hiện nang (cysts) hoặc thể tư dưỡng (trophozoites).
– Phương pháp nhuộm miễn dịch huỳnh quang (Immunofluorescence staining) phát hiện được các kháng thể đơn dòng đặc hiệu.
– Dạng nấm men của Pneumocystis jirovecii có thể giống Histoplasma capsulatum nhưng không đâm chồi và thường ở ngoại bào. Hiện nay các phương pháp phân tử giúp chẩn đoán nhanh chóng hiệu quả.
2.4. Chẩn đoán nhiễm nấm Talaromyces marneffei
Talaromyces marneffei, trước đây gọi là Penicillium marneffei, là một trong những tác nhân gây nhiễm trùng cơ hội thường gặp nhất trên bệnh nhân AIDS sống hoặc có đi đến vùng Đông Nam á hay Nam Trung Quốc. Bệnh vẫn có thể xảy ra trên những người khỏe mạnh.
Về phân bố địa lý: bệnh gặp ở vùng Đông Nam Á, Bắc Thái Lan và nam Trung Quốc. Talaromyces marneffei là loại nấm lưỡng hình: sợi nấm phát triển ở nhiệt độ 28°C; nhưng ở mô và ở nhiệt độ 37°C trong môi trường thạch não tim, nấm tạo ra những tế bào tròn đến hình ellip phân chia bằng cách phân đôi. Talaromyces marneffei thường được phân lập từ nội tạng của chuột tre trong trường hợp hiển nhiên không có nhiễm trùng. Môi trường sống tự nhiên chưa được xác định, nhưng có thể trong đất, nấm được tìm thấy trong phân và trong hang của loài chuột tre. Yếu tố nguy cơ chính có lẽ là nghề nghiệp phơi nhiễm với đất. Số trường hợp bệnh tăng gấp đôi trong mùa mưa. Đây là nhiễm trùng hàng thứ ba trong những nhiễm trùng thường gặp nhất trên bệnh nhân AIDS ở miền Bắc Thái Lan. Có sự gia tăng trong chẩn đoán bệnh này ở bệnh nhân AIDS đi du lịch hoặc giao lưu với vùng dịch tễ.
Biểu hiện lâm sàng:
Nhiễm nấm thường theo sau sự hít phải nấm và bệnh thường xảy ra ban đầu ở phổi. Phần lớn bệnh nhân có biểu hiện nhiễm nấm lan tỏa và thường bệnh tiến triển mạn tính. Các triệu chứng thường gặp là sốt, sụt cân, suy nhược, tổn thương da nhiều mảng dạng sẩn, viêm hạch bạch huyết toàn thân và gan lách to. Bệnh thường tử vong nếu không được điều trị.
Chẩn đoán xét nghiệm:
Chủ yếu là xem dưới kính hiển vi và cấy. Dưới kính hiển vi tế bào nấm có hình tròn, bầu dục hoặc ellip, thường có vách ngăn nhô ra, thấy được trên phết nhuộm Wright của tủy xương hoặc phết nhuộm sinh thiết da, hạch lympho. Cấy phân lập được từ sinh thiết da, hạch lympho, mủ, chọc hút tủy xương, đờm và dịch rửa phế quản, phế nang. Có thể cấy máu tìm được nấm dương tính trong > 70% các trường hợp bệnh nhân AIDS. Cấy nấm sợi sau 1 tuần ở nhiệt độ 25-30°C trên môi trường thạch glucose peptone; có màu xanh lá, đôi khi có màu vàng, nấm mốc có bột phấn với sắc tố đỏ khuếch tán phân biệt. Nấm men phát triển ở nhiệt độ 37°C trên môi trường thạch não tim, một đặc điểm có thể dùng để phân biệt loại gây bệnh với loại Penicillium spp khác trong môi trường là các loại này không tạo nấm men ở nhiệt độ 37°C.
2.5. Chẩn đoán nhiễm nấm Coccidioides immitis
Nhiễm nấm Coccidioides phổi (Coccidioidomycosis), thường nhẹ, thoáng qua do nấm lưỡng hình Coccidioides immitis gây ra. Bệnh có thể diễn tiến thành nhiễm nấm tiến triển hoặc nhiễm nấm toàn thân trên những bệnh nhân suy giảm miễn dịch.
Về phân bố địa lý, phần lớn các trường hợp xảy ra ở miền Tây nam Hoa Kỳ và những vùng thuộc Trung và Nam Mỹ. Nhiễm nấm được chẩn đoán ngoài những vùng này xảy ra trên những người bệnh có giao lưu, phơi nhiễm với vùng dịch tễ. Những cơn bão bụi thường lan tỏa nấm gây bệnh ra xa ngoài vùng dịch tễ.
Coccidioides immitis, được tìm thấy trong đất chỉ ở vùng California, không thể phân biệt kiểu hình với Coccidioides posadasii, được tìm thấy ở những nơi khác. Cả hai loại nấm hiện diện trong tự nhiên với dạng nấm sợi với các phân đoạn thành các bào tử có khớp nối (arthrospores) dễ lây lan vào môi trường không khí. Bệnh xảy ra khi hít vào các bào tử dẫn đến sự hình thành các cầu nấm lớn, tròn, có vách dầy chứa các nội bào tử (endospores) trong mô.
Biểu hiện lâm sàng:
Nhiễm Coccidioides phổi tiên phát, có khoảng 60% người nhiễm mới tiến triển bệnh không có triệu chứng sau khi hít vào các bào tử có khớp nối. Số còn lại tiến triển có triệu chứng sau 1- 4 tuần. Phơi nhiễm mức độ cao gia tăng khả năng bệnh có triệu chứng. Phần lớn bệnh nhân có triệu chứng giống cúm nhẹ hoặc vừa, tự khỏi bệnh không cần điều trị. Đến 50% số bệnh nhân có hồng ban nhẹ, lan rộng hoặc hồng ban dát sẩn (maculopapular rash). Hồng ban nút hoặc hồng ban đa dạng gặp trong 30% số trường hợp, thường gặp ở nữ giới. X quang phổi thường thấy có viêm các phân thùy phổi. Khoảng 20% các trường hợp có hạch lympho rốn phổi to hoặc có tràn dịch màng phổi. Có nốt đơn độc hoặc nhiều nốt, có hang vách dầy hoặc mỏng cũng như phì đại hạch trung thất có thể xảy ra.
Nhiễm Coccidioides phổi mạn tính, một số ít bệnh nhân nhiễm nấm phổi tiên phát còn để lại những tổn thương lành tính. Phần lớn những bệnh nhân không có triệu chứng nhưng ho ra máu có thể chiếm đến 25% các trường hợp. Các hang tồn lưu có thể lớn ra và vỡ. Ở những người suy giảm miễn dịch, tổn thương của bệnh phổi cấp có thể gây tử vong. Ở người có miễn dịch bình thường, bệnh có thể giống lao.
Nhiễm Coccidioides lan tỏa, các tạng bất kỳ của cơ thể đều có thể nhiễm bệnh. Dưới 1% số bệnh nhân có bệnh tiến triển, lan tỏa và gây tử vong. Nam giới mắc bệnh cao hơn nữ giới 5 lần; tỉ lệ này đảo ngược nếu phụ nữ có thai. Nguy cơ bệnh lan tỏa cao ở người châu Phi hoặc người Philippine. Bệnh thường tiến triển trong vòng 12 tháng khi bắt đầu nhiễm trên các tổn thương yên lặng hoặc tái hoạt hóa. Bệnh ở da, mô mềm, xương, khớp và màng não rất thường gặp. Biến chứng viêm màng não thường nghiêm trọng; xảy ra từ 30 -50% số bệnh nhân nhiễm lan tỏa; thường có biến chứng đầu nước (hydrocephalus); tử vong nếu không được điều trị. Ở người suy giảm miễn dịch, tổn thương lan rộng thường xảy ra.
Nhiễm Coccidioides trên bệnh nhân AIDS, phần lớn các trường hợp gần đấy mắc bệnh ở vùng dịch tễ lưu hành. Bệnh lý ở phổi là biểu hiện thường gặp nhất; x quang ngực cho thấy thâm nhiễm dạng lưới nốt (reticulonodular) lan tỏa; hơn 70% bệnh nhân tử vong trong vòng 01 tháng mặc dù có điều trị.
Xét nghiệm chẩn đoán:
Dưới kính hiển vi có thể thấy các cầu nấm chứa các nội bào tử lớn, vách dầy trong mủ, đờm, dịch khớp, nhưng hiếm gặp trong máu.
Cấy phân lập C. immitis hoặc C. posadasii từ đờm, dịch khớp, cặn lắng dịch não tủy, mủ và những bệnh phẩm khác. Những khúm nấm sợi có thể được xác định sau khi ủ ở nhiệt độ 25-30°C từ 2-7 ngày. Xét nghiệm ngoại kháng nguyên có thể khẳng định định loại nấm này.
Test da (Skin tests): không phân biệt được nhiễm nấm hiện tại hoặc đã mắc trong quá khứ. Nếu kết quả chuyển đổi từ âm tính sang dương tính gợi ý tình trạng mới nhiễm. Kết quả âm tính giả thường gặp ở bệnh nhân nhiễm lan tỏa nhưng trơ không phản ứng.
Huyết thanh học phát hiện IgM đặc hiệu, giúp ích trong chẩn đoán nhiễm cấp; kháng thể xuất hiện trong vòng 4 tuần từ khi nhiễm nấm và mất đi sau 2- 6 tháng. IgM có thể được phát hiện bằng phương pháp ngưng kết latex (latex agglutination – LA), ngưng kết trong ống nghiệm (test-tube precipitation – TP), hoặc miễn dịch khuếch tán (immunodiffusion – ID). IgG đặc hiệu giúp phát hiện những giai đoạn sau của nhiễm nấm Coccidioides; hiệu giá kháng thể tăng với sự tiến triển của bệnh. IgG có thể được phát hiện bằng phương pháp cố định bổ thể (complement fixation – CF) hoặc miễn dịch khuếch tán, hiệu giá kháng thể tăng với sự tiến triển của bệnh
2.6. Chẩn đoán nhiễm nấm Histoplasma
Nhiễm nấm Histoplasma phổi thường nhẹ, thoáng qua ở người bình thường gây ra do nấm lưỡng hình Histoplasma capsulatum. Bệnh có thể tiến triển mạn ở phổi hoặc nhiễm nấm lan tỏa ở những cơ địa thuận lợi.
Về phân bố địa lý, bệnh thường gặp ở miền trung Bắc Mỹ, Trung và Nam Mỹ. Những vùng dịch tễ khác Châu Phi, Úc, Ấn Độ, và châu Á (Mã Lai).
H. capsulatum hiện diện là nấm sợi trong tự nhiên; trong mô nó tạo thành những tế bào đâm chồi tròn, nhỏ. Hai loại được biết gây bệnh ở người là: Histoplasma capsulatum và Histoplasma duboisii được tìm thấy trong đất có nhiều phân chim và phân dơi. H. capsulatum var. duboisii chỉ thấy ở Trung Phi. Khi một lượng lớn các bào tử được phát tán vào không khí, có thể có nhiều người bị nhiễm trong ổ dịch.
Biểu hiện lâm sàng:
Nhiễm nấm Histoplasma phổi cấp: người bình thường hít một số lượng lớn bào tử có thể tiến triển các triệu chứng cấp và thường nhiễm nấm nặng sau thời gian ủ bệnh 1-3 tuần. Ở những bệnh nhân có triệu chứng, bệnh giống cúm không đặc hiệu, có thể lui bệnh không cần điều trị. Những triệu chứng thường gặp gồm sốt, lạnh run, nhức đầu, đau cơ, ăn mất ngon, ho và đau ngực. Hơn nữa: 10% số bệnh nhân có viêm khớp vô khuẩn hoặc đau khớp với hồng ban đa dạng hoặc hồng ban nút. X quang ngực bình thường trong đa số bệnh nhân, phì đại hạch rốn phổi là chứng cứ thường gặp. Thâm nhiễm có thể lành sau thời gian nhiều tháng để tạo thành khối u nấm Histoplasma (Histoplasmoma), đôi khi phát triển lớn hơn. Trường hợp tái nhiễm với bệnh cảnh tương tự nhưng có những khác biệt về bệnh cảnh lâm sàng nhẹ hơn và xảy ra với thời gian ủ bệnh ngắn hơn, dấu hiệu x quang khác biệt với những trường hợp nhiễm mới, không có phì đại hạch trung thất; không có tràn dịch màng phổi.
Nhiễm nấm Histoplasma phổi mạn: gặp ở đàn ông tuổi trung niên, bệnh tiến triển chậm với bệnh nền là bệnh phổi tắc nghẽn mạn tính. Viêm phân thùy phổi thoáng qua tiến triển đến xơ hóa và tạo hang do hủy hoại nhu mô phổi. Nếu không được điều trị, tử vong có thể xảy ra do suy hô hấp tiến triển. Ở những bệnh nhân viêm phổi, triệu chứng gồm có ho đờm, sốt, lạnh run, sụt cân, mệt mỏi, đổ mồ hôi về đêm, và đau ngực màng phổi. X quang phổi có thể thấy thâm nhiễm mô kẽ ở phân thùy đỉnh của thùy trên phổi. Ở những bệnh nhân có hang và xơ hóa mạn tính có thể ho và tăng tiết đờm, sốt, đau ngực, mệt và sụt cân, khái huyết xảy ra trên 30% số bệnh nhân. X quang phổi phát hiện hang và xơ hóa tiến triển, thường gặp ở thùy trên phổi phải, dầy màng phổi cận bên tổn thương được ghi nhận trong 50% số bệnh nhân.
Nhiễm nấm Histoplasma lan tỏa: bệnh tiến triển thường dẫn đến tử vong liên quan đến khiếm khuyết miễn dịch qua trung gian tế bào. Ở trẻ em và người suy giảm miễn dịch, triệu chứng gồm sốt cao, lạnh run, suy kiệt, mệt mỏi, ăn mất ngon và sụt cân. Ngoài ra có gan và lách to, bất thường chức năng gan, và thiếu máu thường gặp. Ở người bệnh có miễn dịch bình thường: diễn tiến mạn tính, không đau, nhiễm nấm gan, hủy hoại tuyến thượng thận thường gặp. Tổn thương niêm mạc gặp trên 60% số bệnh nhân. Viêm màng não là một biến chứng mạn: xảy ra trong 10 -25% số bệnh nhân nhiễm nấm lan tỏa không đau, đa số có bất thường dịch não tủy và thường phân lập được H. capsulatum, đôi khi có viêm nội tâm mạc và loét niêm mạc đường tiêu hóa.
Nhiễm nấm Histoplasma ở người Phi châu: do nấm Histoplasma capsulatum var. duboisii gây ra. Bệnh khởi đầu thường không đau. Da và xương là những vị trí ưu thế thường gặp. Tổn thương, gan, lách và các tạng khác là nguyên nhân bệnh dẫn đến tử vong. Tổn thương da thường gặp với 2 dạng nốt và sẩn, thường to và loét. Viêm xương tủy xảy ra trong 30% số bệnh nhân: xương sọ, xương sống, xương sườn, xương ức, và các xương dài là các vị trí thường gặp nhất. Tổn thương thường không đau, lan tỏa đến khớp gây viêm khớp, lan đến mô gần bên gây áp xe mủ dưới da.
Nhiễm nấm Histoplasma ở bệnh nhân AIDS: xảy ra trong 2-5% bệnh nhân AIDS. Bệnh có thể nhiễm cấp hoặc tái hoạt hóa của một nhiễm nấm tiềm tàng cũ. Phần lớn bệnh nhân AIDS biểu hiện nhiễm Histoplasma lan tỏa với các triệu chứng không đặc hiệu như sốt và sụt cân, 25% số bệnh nhân có gan và lách to, thiếu máu, giảm bạch cầu hạt và giảm tiểu cầu.
Xét nghiệm chẩn đoán:
Tất cả bệnh phẩm phải được xét nghiệm làm phết nhuộm. Dưới kính hiển vi nấm là những tế bào đâm chồi hình bầu dục nhỏ thường thấy trong các đại thực bào. Có thể nhầm với Candida glabrata, Penicillium marneffei và các tế bào không vỏ bọc nhỏ của Cryptococcus neoformans.
Cấy phân lập giúp chẩn đoán xác định, mặc dù không còn bàn cãi, xác định bằng cấy cần chuyển sang dạng nấm men hoặc xét nghiệm ngoại kháng nguyên. Cấy phải được ủ ở nhiệt độ 25-30°C trong 4 – 6 tuần.
Huyết thanh học: phương pháp miễn dịch khuếch tán (Immunodiffusion – ID) và cố định bổ thể (complement fixation – CF) dương tính khoảng 80% số bệnh nhân. Phương pháp cố định bổ thể thường nhạy cảm hơn miễn dịch khuếch tán, nhưng miễn dịch khuếch tán đặc hiệu hơn. Phản ứng âm tính giả xảy ra ở người suy giảm miễn dịch có bệnh lan tỏa. Phát hiện kháng nguyên trong máu và nước tiểu là những xét nghiệm hữu ích nhất trong nhiễm nấm lan tỏa ở bệnh nhân AIDS.
2.7. Chẩn đoán nhiễm nấm Sporothrix schenckii
Nhiễm nấm Sporothrix schenckii (Sporotrichosis) là loại nấm lưỡng hình gây nhiễm nấm da hoặc mô dưới da bán cấp hoặc mạn. Bệnh thường lan rộng bằng đường bạch huyết. Đôi khi có nhiễm nấm phổi, khớp và xương xảy ra trên các cơ địa thuận lợi.
Về phân bố địa lý, bệnh gặp khắp thế giới, mặc dù thường gặp ở vùng khí hậu nhiệt đới, ôn hòa, ấm. Phần lớn các trường hợp ghi nhận ở Mỹ cũng có thể ở các vùng dịch tễ khác ở Trung, Nam Mỹ, Châu Phi và Úc.
Nấm Sporothrix schenckii được tìm thấy trong đất, thảo mộc và những vật liệu thảo mộc. Dạng nấm sợi có trong tự nhiên, trong mô là dạng các tế bào đâm chồi nhỏ. Bệnh thường gặp ở người lớn và tỉ lệ cao ở những người tiếp xúc với đất, thảo mộc hoặc các vật liệu thảo mộc. Phần lớn các trường hợp lẻ tẻ, đôi khi xảy ra dịch ở vùng dịch tễ.
Biểu hiện lâm sàng:
Nhiễm Sporothrix schenckii da (Cutaneous sporotrichosis) theo sau sự tiêm nhiễm nấm do chấn thương vào da và mô dưới da. Một chấn thương nhỏ đủ để nấm xâm nhập, ảnh hưởng tại các vị trí phơi nhiễm, đặc biệt ở bàn tay và ngón tay. Tổn thương ban đầu xuất hiện 1- 4 tuần sau chấn thương tình cờ với những nốt nhỏ, chắc, không đau. Sau đó, da trở nên tím, nốt trở nên mềm, loét với bờ không đều và chảy dịch liên tục, loét phù lên và đóng mài, những nốt tiến triển dọc theo mạch bạch huyết và loét. Không lan theo mạch bạch huyết khoảng 25% các trường hợp nhiễm nấm da. Dạng nhiễm nấm da lan tỏa đôi khi cũng xảy ra.
Nhiễm Sporothrix schenckii ngoài da (Extra Cutaneous sporotrichosis) phần lớn các trường hợp liên quan đến bệnh nền. Người bệnh nhiễm HIV thường có bệnh lan tỏa theo đường máu. Các vị trí thường gặp: phổi, khớp và xương, hậu quả là viêm khớp, bệnh phổi mạn, viêm màng não và bệnh ở mắt không thường gặp.
Chẩn đoán xét nghiệm: Sporothrix schenckii hiếm khi thấy trong mủ hoặc mô khi xem dưới kính hiển vi. Tìm thấy các tế bào hình bầu dục hoặc các thể hình sao giúp khẳng định chẩn đoán.
Chẩn đoán xác định bằng cấy phân lập. Dùng nhiều môi trường, gồm thạch glucose peptone. Trên thạch cấy, các khúm sợi nấm xuất hiện sau 3-5 ngày ở nhiệt độ 25-30°C. Khởi đầu khúm nấm ướt và mất màu trắng, thường tạo ra sắc tố đen hoặc nâu sau 10 ngày. Đặc trưng hoa hồng của các bào tử nhỏ dạng hình giọt nước được tạo thành ở cuối bào tử đính. Các đính bào tử tạo ra sau cùng được hình thành dọc sợi nấm và có sắc tố đậm. Nấm hiếm gặp hơn là Sporothrix cyanescens sinh ra sắc tố màu tím.
Để xác định và định danh cần cấy chuyển đổi sang dạng nấm men trên thạch máu ở 37°C. Các khúm màu kem, trơn láng, dưới kính hiển vi thấy có nhiều tế bào nấm men đâm chồi dài hoặc bầu dục.
2.8. Chẩn đoán nhiễm nấm Blastomyces
Nấm họ Blastomycetes, Blastomyces dermatitidis có thể gây nhiễm nấm phổi ở người bình thường, bệnh tiến triển thường lan đến các tạng khác, đặc biệt da và xương.
Về phân bố địa lý, bệnh thường gặp ở vùng trung tây và đông nam của Bắc Mỹ; có thể gặp ở Trung và Nam Mỹ và một số nơi của châu Phi.
Nấm Blastomyces dermatitidis hiện diện trong tự nhiên dưới dạng sợi nấm; trong mô là các tế bào đâm c hồi lớn và tròn. Đất là môi trường sống tự nhiên; Phần lớn tồn tại trong đất ẩm ướt chứa gỗ mục hoặc các mảnh phân hủy hữu cơ. Bệnh thường gặp ở nam giới mặc dù phụ nữ và trẻ em cũng bị nhiễm trong đợt dịch, liên quan đến nghề nghiệp hoặc vui chơi giải trí ngoài trời, bệnh có tính chất tản phát trong vùng dịch tễ nhưng cũng có thể gây thành dịch sau khi phơi nhiễm với một nguồn lây. Tuy vậy những vùng dịch tễ không dễ xác định và các yếu tố nguy cơ cũng chưa được xác định.
Biểu hiện lâm sàng
Nhiễm nấm Blastomyces phổi xảy ra sau khi hít. Phổi là vị trí đầu tiên của nhiễm nấm. Tuy nhiên có đến 50% các trường hợp nhiễm nấm không triệu chứng (50%). Thời gian ủ bệnh 30 – 45 ngày, tổn thương ở phổi thường không được phát hiện cho đến khi nhiễm nấm lan tỏa ra các vị trí khác. Bệnh cảnh cấp giống cúm, sốt, lạnh run, ho có đờm, đau nhức cơ, đau khớp, đau ngực màng phổi. Hình ảnh x quang không đặc hiệu; gồm đông đặc thùy hoặc phân thùy phổi, thường ở những thùy dưới. Phần lớn bệnh nhân hồi phục sau 2-12 tuần có triệu chứng. Bệnh nhân không hồi phục có thể tiến triển đến nhiễm nấm phổi mạn tính hoặc bệnh lan tỏa.
Nhiễm Blastomyces da với tổn thương da xảy ra trên 70% các trường hợp bệnh lan tỏa biểu hiện với tổn thương dạng sùi không đau với bờ không đều. Những tổn thương loét được tạo ra khi dẫn lưu các ổ áp xe dưới da. Mặt, chi trên, cổ và da đầu thường bị tổn thương.
Nhiễm Blastomyces xương khớp xảy ra khoảng 30% các trường hợp bệnh lan tỏa. Xương sống, xương sườn, các xương dài là các vị trí nhiễm nấm thường gặp. Những tổn thương thường vẫn không có triệu chứng cho đến khi nhiễm nấm lan tỏa đến các khớp gần kề hoặc các mô gần kề gây ra các ổ áp xe. Viêm khớp xảy ra đến 10% số bệnh nhân; vị trí đầu gối, mắt cá, cùi chỏ hoặc cổ tay. Hình ảnh x quang không đặc hiệu, có những tổn thương tiêu xương và tạo xương có giới hạn rõ không thể phân biệt với các nấm hoặc nhiễm trùng khác.
Nhiễm Blastomyces tiết niệu – sinh dục (Genitourinary blastomycosis) 15-35% nam giới có nhiễm Blastomyces lan tỏa có tổn thương tiền liệt tuyến. Viêm mào tinh hoàn với biểu hiện thường gặp là sưng phù bìu.
Nhiễm Blastomyces ở một số cơ địa đặc biệt: nhiễm Blastomyces đôi khi phối hợp với tổn thương chức năng miễn dịch tế bào T, gặp trên người bệnh AIDS.
Chẩn đoán xét nghiệm
Dưới kính hiển vi Blastomyces dermatitidis là những tế bào tròn to với vách gấp khúc dầy và một chồi đơn lớn tìm thấy trong mủ, đờm, dịch rửa phế quản và nước tiểu.
Chẩn đoán xác định bằng cấy phân lập với những khúm nấm sợi với bào tử tròn nhỏ thấy được sau 1- 4 tuần ở nhiệt độ 25-30°C. Xét nghiệm ngoại kháng nguyên có thể khẳng định kết quả định loại nấm. Định loại cũng có thể xác định bằng biểu hiện lưỡng hình nhiệt trên cấy chuyển vào môi trường tim – não (brain-heart infusion agar) ở nhiệt đô 37°C; với những điều kiện này các tế bào nấm men lớn với chồi to ở đáy là những chứng cứ để xác định.
Xét nghiệm huyết thanh học với phản ứng cố định bổ thể không đặc hiệu và kém nhạy cảm. Phản ứng khuếch tán miễn dịch đặc hiệu hơn nhưng cho kết quả âm tính trên nhiều trường hợp có bệnh.
CHƯƠNG 3. THUỐC CHỐNG NẤM
Lưu ý: Thuốc có đánh dấu *: Chỉ được kê đơn khi được cấp giấy phép lưu hành sản phẩm tại Việt Nam
3.1. Đặc tính dược lý của thuốc kháng nấm
Theo cấu trúc hóa học và cơ chế tác dụng, các nhóm thuốc kháng nấm chính trong điều trị hiện nay gồm có nhóm azol, polyen, echinocandin và ức chế tổng hợp thymidylat. Nhóm azol được phân chia thành hai nhóm theo cấu trúc hóa học là dẫn chất imidazol (ketoconazol, miconazol) và dẫn chất triazol (fluconazol, itraconazol, voriconazol, posaconazol và isavuconazol*). Nhóm echinocandin hiện có các thuốc caspofungin, anidulafungin* và micafungin. Flucytosin là đại diện của nhóm ức chế tổng hợp thymidylat trong khi đó amphotericin B là dẫn chất điển hình của nhóm polyen.
3.1.1. Dược động học
Amphotericin B và echinocandin hấp thu kém qua đường tiêu hóa nên phải dùng đường truyền tĩnh mạch. Các thuốc triazol hấp thu được qua đường tiêu hóa nên có thể dùng đường uống tuy nhiên khả năng hấp thu giữa các thuốc là rất khác nhau. Fluconazol và voriconazol có sinh khả dụng cao trên 90% nên hầu như không có lo ngại về hấp thu. Itraconazol và posaconazol (dạng hỗn dịch) cần thời gian để hòa tan trong dạ dày do đó nên dùng kèm bữa ăn. Cần đặc biệt lưu ý posaconazol vì khả năng hấp thu rất bấp bênh nhất là ở những bệnh nhân có tổn thương đường tiêu hóa do hóa trị liệu ung thư, ghép tạng hoặc bệnh nhân dùng thuốc ức chế tiết acid dịch vị. Để tăng hấp thu, nên dùng posaconazol với bữa ăn giàu chất béo và chia nhỏ liều dùng trong ngày (3 đến 4 lần/ngày). Do khả năng hấp thu kém và sinh khả dụng bấp bênh nên posaconazol là thuốc được khuyến cáo giám sát nồng độ trong máu để đảm bảo hiệu quả điều trị hoặc dự phòng nấm.
Trong chuyển hóa và thải trừ cần lưu ý các thuốc nhóm triazol. Fluconazol chuyển hóa ít ở gan và thải trừ chủ yếu qua thận do đó cần lưu ý chức năng thận của bệnh nhân để chỉnh liều. Posaconazol chuyển hóa ít qua gan và thải trừ qua phân. Itraconazol chuyển hóa chủ yếu thông qua CYP3A4 còn voriconazol chuyển hóa mạnh qua hệ CYP2C19 nên có nguy cơ tương tác với rất nhiều thuốc ức chế và cảm ứng enzym này. Ví dụ khi dùng đồng thời rifampicin là chất cảm ứng mạnh hệ CYP, nồng độ các azol có thể rất thấp làm tăng nguy cơ thất bại điều trị. Do hệ enzym CYP2C19 có tính chất đa hình di truyền cao nên nồng độ voriconazol có thể rất khác nhau giữa các bệnh nhân. Do đặc tính chuyển hóa mạnh qua gan, việc thực hiện giám sát nồng độ thuốc trong máu được khuyến cáo với voriconazol và itraconazol để đảm bảo hiệu quả điều trị cũng như hạn chế nguy cơ gặp độc tính. Hầu hết các thuốc kháng nấm azol phổ rộng và echinocandin không hoặc ít thải trừ ở dạng còn hoạt tính qua thận nên không có vai trò trong điều trị Candida đường tiết niệu.
3.1.2. Dược lực học
Cơ chế tác dụng của các nhóm thuốc kháng nấm là khác nhau do đó phổ tác dụng cũng khác nhau trên các chủng nấm. Trong nhóm triazol, fluconazol là đại diện đầu tiên với phổ tác dụng hẹp chủ yếu trên một số chủng Candida và Cryptococcus và không có tác dụng trên các chủng nấm sợi. Trong khi đó, itraconazol, voriconazol và posaconazol là các triazol phổ rộng với khả năng tác dụng trên hầu hết các chủng nấm men, nấm sợi và lưỡng tính. Các thuốc nhóm echinocandin có tác dụng tốt trên hầu hết các chủng Candida và Aspergillus. Tóm tắt về biểu diễn phổ tác dụng của các thuốc kháng nấm được trình bày trong hình 1.
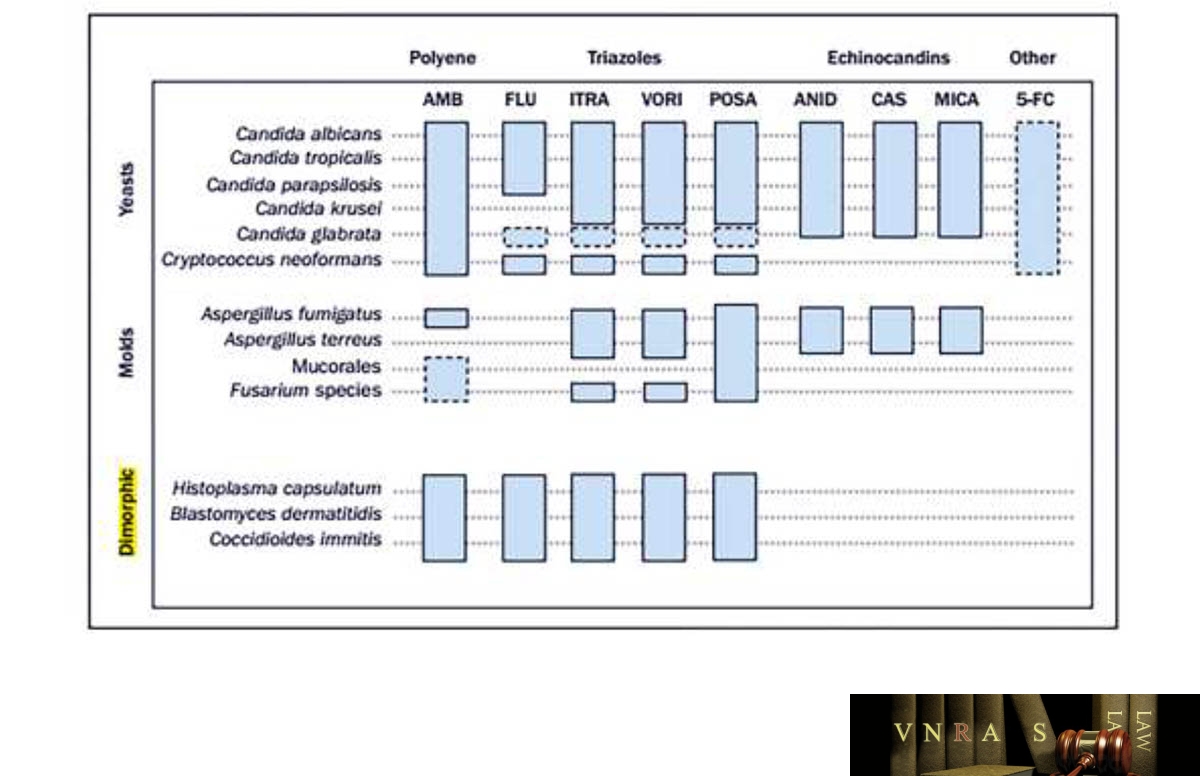
AMB: amphotericin B; FLU: fluconazol; ITRA: itraconazol; VORI: voriconazol; POSA: posaconazol; ANID: anidulafungin; CAS: caspofungin; MICA: micafungin; 5-FC: flucytosin.
3.1.3. Các thông số dược động học/dược lực học (PK/PD) của thuốc kháng nấm và giám sát nồng độ thuốc trong máu
Tương tự các thuốc kháng sinh, dựa trên đặc điểm dược động học và dược lực học, các thuốc kháng nấm được chia thành ba nhóm phụ thuộc thời gian (thông số PK/PD đặc trưng là T>MIC), phụ thuộc nồng độ (thông số PK/PD đặc trưng là Cpeak/MIC) và phụ thuộc vào tổng lượng thuốc vào cơ thể (thông số PK/PD đặc trưng là AUC/MIC). Do thời gian hậu kháng nấm của flucytosin ngắn nên cần duy trì nồng độ trên MIC để đạt hiệu quả và do đó thuốc có đặc tính phụ thuộc thời gian. Đích PK/PD của flucytosin được gợi ý là T>MIC đạt trên 25%. Với echinocandin và polyen, do thời gian hậu kháng nấm dài nên thông số đặc trưng là Cpeak/MIC với đích là 10 để đạt hiệu lực tối đa. Nhóm triazol cũng thể hiện tác dụng hậu kháng nấm kéo dài nhưng các nghiên cứu PK/PD không cho thấy vai trò rõ rệt về nồng độ thuốc đối với hiệu lực tác dụng. Thông số PK/PD đặc trưng của nhóm triazol là AUC/MIC với đích dự kiến là 25.
Cho đến nay, có ba thuốc kháng nấm được khuyến cáo cần giám sát nồng độ thuốc trong máu là posaconazol, voriconazol và itraconazol do biến thiên nồng độ thuốc lớn nếu dùng theo chế độ liều chuẩn theo hướng dẫn. Posaconazol cần được giám sát nồng độ để đảm bảo hiệu quả với đích nồng độ đáy ở trạng thái cân bằng là 0,7mg/L với chỉ định dự phòng và 1mg/L với chỉ định điều trị. Do cần đảm bảo cả hiệu quả cũng như hạn chế độc tính, đích nồng độ đáy của voriconazol cần nằm trong khoảng 1mg/L đến khoảng 4mg/L hoặc 6mg/L và của itraconazol cần nằm trong khoảng 0,5mg/L đến khoảng 5 mg/L (định lượng bằng máy miễn dịch).
3.2. Dược lý lâm sàng các thuốc kháng nấm
3.2.1. Nhóm polyen
Amphotericin B
Chỉ định:
– Điều trị nhiễm nấm Candida hoặc Aspergilus xâm lấn nặng, đe dọa tính mạng.
Chỉ định khác (được khuyến cáo trong Hướng dẫn điều trị):
– Điều trị kinh nghiệm khi nghi ngờ nhiễm nấm Candida hoặc Aspergilus xâm lấn.
– Dự phòng nhiễm nấm xâm lấn ở bệnh nhân giảm bạch cầu trung tính kéo dài (bệnh nhân có bệnh máu ác tính điều trị hóa trị liệu hoặc bệnh nhân ghép tế bào gốc).
Chống chỉ định:
– Mẫn cảm với amphotericin B.
Cơ chế tác dụng: Amphotericin B có tác dụng kìm nấm hoặc diệt nấm tùy thuộc vào nồng độ, số lượng và độ nhạy cảm của vi nấm. Amphotericin B gắn vào ergosterol ở màng tế bào nấm, làm rò rỉ các thành phần tế bào nấm và gây chết tế bào nấm. Amphotericin B có ái lực với ergosterol ở tế bào nấm cao hơn so với ở tế bào người nhưng amphotericin B cũng gây độc tính trên tế bào người theo cơ chế tương tự.
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: chỉ sử dụng khi lợi ích vượt trội nguy cơ.
– Phụ nữ cho con bú: chỉ sử dụng khi lợi ích vượt trội nguy cơ.
Lưu ý phân biệt giữa các dạng bào chế của amphotericin B:
Trên thế giới, hiện nay có 4 dạng bào chế khác nhau của amphotericin B, bao gồm:
Amphotericin B deoxycholat: amphotericin B dạng quy ước, được bào chế dưới dạng bột đông khô pha truyền, tạo dung dịch keo trong nước. Trong cơ thể, amphotericin B tạo phức hợp với deoxycholat muối mật.
Amphotericin B deoxycholat hệ phân tán keo (Amphotericin B colloidal dispersion – ABCD): dạng amphotericin B deoxycholat được ổn định bằng cholesteryl sulfat tạo phức hợp keo dạng đĩa.
Amphotericin B liposom (Liposomal amphotericin B – L-AMB): dạng amphotericin B được tích hợp trong liposome một lớp màng kép kích thước nhỏ.
Amphotericin B phức hợp lipid (Amphotericin B lipid complex – ABLC) : dạng amphotericin B được gắn 2 lớp phospholipid hình dải.
Lưu ý, không tự động chuyển đổi giữa các dạng amphotericin B do các dạng thuốc này không tương đương nhau về dược động học, liều dùng và tác dụng không mong muốn. Sự khác biệt về dược động học giữa các dạng bào chế của amphotericin B được trình bày trong Bảng 3.2. So với amphotericin B dạng quy ước, các dạng bào chế lipid của amphotericin B đều có nguy cơ xuất hiện độc tính thấp hơn, đặc biệt là độc tính trên thận. Amphotericin B dạng phức hợp lipid được ghi nhận có độc tính cao hơn so với amphotericin B liposom. Cần cân nhắc lợi ích – nguy cơ và chi phí điều trị để lựa chọn chế phẩm amphotericin B phù hợp. Không có sự khác biệt về hiệu quả lâm sàng giữa các dạng bào chế của amphotericin B nhưng việc sử dụng dạng bào chế lipid là giải pháp an toàn hơn cho bệnh nhân để giảm thiểu độc tính, đặc biệt trong một số tình trạng lâm sàng được liệt kê trong bảng sau:
Bảng 3.1. Một số tình trạng lâm sàng cần cân nhắc ưu tiên sử dụng amphotericin B dạng phức hợp lipid (Wade RL, 2013)
|
Các tình trạng lâm sàng cần cân nhắc ưu tiên sử dụng amphotericin B dạng phức hợp lipid |
Các thuốc có độc tính trên thận |
| ● Suy thận trước khi bắt đầu điều trị
● Đang sử dụng hoặc trước đó có sử dụng thuốc lợi tiểu hoặc các thuốc khác cùng độc tính trên thận (Bảng 11) ● Hạ kali huyết thanh trước khi bắt đầu điều trị ● Hạ magie huyết thanh trước khi bắt đầu điều trị ● Đa niệu ● Bệnh nhân đã được điều trị trước đó tại đơn vị hồi sức tích cực hoặc đang được điều trị tại các đơn vị này tại thời điểm chỉ định thuốc kháng nấm ● Bệnh nhân ghép tạng rắn (bao gồm cả ghép tủy xương) ● Cao tuổi |
● Thuốc kháng virus: acyclovir, adefovir dipivoxil, cidofovir, foscarnet, ganciclovir, ganciclovir, tenofovir, valacyclovir, valganciclovir
● Kháng sinh aminoglycosid: gentamicin, neltimicin, streptomycin, tobramycin, amikacin ● Các kháng sinh khác: colistin, vancomycin, teicoplanin ● Thuốc ức chế calcineurin: cyclosporin, tacrolimus ● Thuốc điều trị ung thư: carboplatin, camustin, cisplatin, cyclophosphamid, ifosfamid, methotrexat, streptozotocin ● Thuốc cản quang: amidotrizoat, ioxithamat meglumin, ioxagalat, iopamidol, iohexol, iomeprol, iopentol, ioversol, iopromid, iobitridol, iodixanol, iotrolan |
Bảng 3.2: Sự khác biệt về dược động học giữa các dạng bào chế của amphotericin B (Hamill RJ, 2013)
|
Dạng bào chế |
Amphotericin B deoxycholat |
Amphotericin B phức hợp lipid |
Amphotericin B hệ phân tán keo |
Amphotericin B liposom |
| Kích thước (nm) |
0,035 |
1.600 – 11.000 |
122 x 4 |
80 |
| Liều dùng (mg/kg) |
0,035 |
5,0 |
4,0 |
5,0 |
| Cmax (µg/mL) |
1,5 – 2,9 |
1,7 |
2,9 |
83,0 ± 35,2 |
| AUC (µg x h/mL) |
17,1 – 36,0 |
14,0 ± 7,0 |
36 |
555 ± 311 |
| Thể tích phân bố (L/kg) |
5,0 ± 2,8 |
131,0 ± 57,7 |
4,1 |
0,16 |
| Nửa đời thải trừ (h) |
24 |
173,4 |
28,2 |
8,6 ± 3,1 |
| Độ thanh thải (mL/h/kg) |
38,0 ± 15,0 |
436 ± 188 |
112 |
11,0 ± 6,0 |
Tác dụng không mong muốn:
Độc tính trên thận
– Độc tính trên thận là độc tính phổ biến và nghiêm trọng nhất của amphotericin B deoxycholat, có thể dẫn đến phải giảm liều, dừng thuốc và làm tăng tỷ lệ tử vong. Độc tính trên thận thể hiện qua các xét nghiệm bất thường liên quan đến chức năng thận như tăng ure huyết, toan ống thận và tỷ trọng nước tiểu thấp, nhiễm canxi thận, suy thận cấp, đái tháo nhạt do thận, thiểu niệu, vô niệu. Chức năng thận có thể hồi phục sau khi dừng thuốc, tuy nhiên có một vài trường hợp bị suy giảm chức năng thận vĩnh viễn đặc biệt là những bệnh nhân dùng liều cao hoặc liều tích lũy lớn (trên 5 g).
– Các yếu tố nguy cơ có thể dẫn đến tăng độc tính trên thận của amphotericin B deoxycholat bao gồm việc sử dụng đồng thời với các thuốc có độc tính trên thận, thuốc lợi tiểu, có bất thường chức năng thận ban đầu, dùng thuốc kéo dài với liều tích lũy cao,…
– Nếu creatinin huyết thanh > 260 µmol/L, nên dừng thuốc hoặc giảm liều cho tới khi chức năng thận cải thiện. Theo dõi các xét nghiệm liên quan đến công thức máu và điện giải đồ huyết thanh (đặc biệt là kali và magie). Nếu kết quả xét nghiệm bất thường, cân nhắc hiệu chỉnh liều (giảm 50% tổng liều hàng ngày hoặc đưa liều cách ngày) hoặc dừng thuốc.
– Các dạng bào chế lipid của amphotericin B được chứng minh có độc tính trên thận thấp hơn nhiều so với amphotericin B deoxycholat. Tuy nhiên, suy thận vẫn có thể xảy ra. Vì vậy, cần kiểm tra chức năng thận khi bắt đầu điều trị ở bệnh nhân có tiền sử bệnh thận hoặc suy thận và theo dõi ít nhất 1 lần/tuần trong quá trình dùng thuốc. Nồng độ kali và magie máu nên được theo dõi thường xuyên.
Phản ứng dị ứng liên quan đến tiêm truyền
– Các phản ứng dị ứng liên quan đến tiêm truyền cũng xảy ra phổ biến khi sử dụng amphotericin B deoxycholat và dẫn đến phải giảm liều hoặc dừng thuốc. Các biểu hiện thường xuất hiện vào ngày đầu dùng thuốc bao gồm sốt, rét run, đau đầu, đau khớp, nôn, buồn nôn và tụt huyết áp. Các phản ứng thường xảy ra ở ngày đầu tiên dùng thuốc.
– Để dự phòng các phản ứng dị ứng liên quan đến tiêm truyền xảy ra hoặc làm giảm nhẹ các phản ứng dị ứng nặng bằng cách giảm tốc độ truyền (thời gian truyền từ 2-6 giờ) và sử dụng một số thuốc trước khi truyền Amphotericin B deoxycholate như aspirin, thuốc hạ sốt, kháng histamin, chống nôn.
+ Sử dụng 25-50 mg pethidin đường tĩnh giúp làm giảm thời gian hoặc mức độ rét run và sốt.
+ Sử dụng corticosteroid liều thấp trước hoặc trong thời gian truyền như 25 mg hydrocortisone (tương đương khoảng 4mg methylprednisolone) làm giảm phản ứng sốt (liều và thời gian dùng corticoid nên đưa ở mức tối thiểu).
+ Có thể dùng Heparin liều thấp (1000 UI), thay đổi vị trí truyền thuốc, dùng thuốc cách ngày nhằm hạn chế viêm tĩnh mạch và huyết khối.
– Phản ứng liên quan đến tiêm truyền không hoàn toàn giảm đi khi sử dụng các dạng bào chế lipid của amphotericin B. Amphotericin B hệ phân tán keo gây ra nhiều phản ứng liên quan đến tiêm truyền nhiều hơn so với amphotericin B deoxycholat. Còn dạng liposom lại ít liên quan đến phản ứng này hơn so với dạng phức hợp lipid. Nhìn chung, phản ứng liên quan đến tiêm truyền thường giảm rõ rệt ở những lần truyền sau. (Tham khảo hướng dẫn dự phòng các phản ứng dị ứng do tiêm truyền của amphotericin B phức hợp lipid, có thể áp dụng cho cả Amphotericin B deoxycholat – Phụ lục 3)
Phản vệ/kiểu phản vệ
– Phản vệ/kiểu phản vệ cũng có thể xảy ra khi truyền amphotericin B deoxycholat hoặc các dạng bào chế lipid của amphotericin B nhưng hiếm gặp.
– Xử trí theo Thông tư số 51/2017/TT-BYT về việc hướng dẫn phòng, chẩn đoán và xử trí phản vệ.
Tác dụng không mong muốn khác
– Thường gặp: đau đầu, buồn nôn, nôn, mệt mỏi, sút cân, viêm tắc tĩnh mạch tại vị trí truyền thuốc, thiếu máu.
– Nghiêm trọng: hạ kali máu, bệnh não, co giật.
3.2.2. Nhóm azol
● Fluconazol
Chỉ định:
– Điều trị nhiễm nấm Candida xâm lấn.
– Điều trị kinh nghiệm khi nghi ngờ nhiễm nấm Candida xâm lấn.
– Điều trị viêm màng não do Cryptococcus.
– Dự phòng viêm màng não do Cryptococcus ở bệnh nhân có nguy cơ cao tái phát.
– Dự phòng nhiễm nấm Candida xâm lấn ở bệnh nhân giảm bạch cầu trung tính kéo dài (bệnh nhân có bệnh máu ác tính điều trị hóa trị liệu hoặc bệnh nhân ghép tế bào gốc).
Chỉ định khác (được khuyến cáo trong Hướng dẫn điều trị):
– Điều trị kinh nghiệm khi nghi ngờ nhiễm nấm Candida xâm lấn.
Chống chỉ định:
– Mẫn cảm với fluconazol và các thuốc chống nấm azol khác tương tự.
– Sử dụng đồng thời với các thuốc là cơ chất của CYP3A4 có nguy cơ kéo dài khoảng QT, ví dụ: terfenadin, astemizol, cisaprid, pimozid hoặc quinidin.
(cụ thể xin xem thêm Phụ lục 4)
Cơ chế tác dụng: Các azol có tác dụng kìm nấm bằng cách ức chế CYP450 14α- demethylase của nấm, dẫn đến giảm tổng hợp ergosterol, ngăn chặn tổng hợp màng tế bào nấm. Các azol chỉ có ái lực cao với CYP450 của nấm nhưng ít ảnh hưởng lên CYP450 ở người.
Dược động học:
– Hấp thu tốt qua đường uống. Sinh khả dụng đường uống đạt trên 90%. Hấp thu không phụ thuộc vào thức ăn.
– Nồng độ tối đa của fluconazol trong huyết thanh đạt được trong 0,5 – 1,5 giờ sau khi uống thuốc lúc đói.
– Tỷ lệ liên kết protein huyết tương thấp (11 – 12%).
– Thể tích phân bố: 0,7 L/kg. Thuốc thấm tốt vào tất cả các dịch của cơ thể. Ở bệnh nhân viêm màng não do nấm, nồng độ fluconazol trong dịch não tủy tương ứng khoảng 80% nồng độ trong huyết thanh.
– Chuyển hóa một lượng nhỏ qua gan. Fluconazol ức chế trung bình CYP2C9 và CYP3A4 và ức chế mạnh CYP2C19.
– Thải trừ chủ yếu qua nước tiểu (80%): 11% dưới dạng chất chuyển hóa.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 27/100 giờ.
– Lọc máu làm giảm 50% nồng độ thuốc trong huyết thanh.
Tác dụng không mong muốn:
Thường gặp:
– Tiêu hóa: tiêu chảy, nôn.
– Thần kinh: đau đầu
Nghiêm trọng:
– Tim mạch: kéo dài khoảng QT, xoắn đỉnh.
– Da: hội chứng Stevens – Johnson/Lyell.
– Huyết học: mất bạch cầu hạt
– Miễn dịch: phản vệ
– Thần kinh: co giật.
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng, đặc biệt với liều cao và/hoặc kéo dài, trừ trường hợp nhiễm nấm đe dọa tính mạng.
– Phụ nữ cho con bú: không nên cho trẻ bú sau khi mẹ dùng nhiều liều hoặc liều cao fluconazol.
● Itraconazol
Chỉ định:
– Điều trị nhiễm nấm toàn thân khi các chống nấm lựa chọn hàng đầu không hiệu quả hoặc có chống chỉ định bao gồm: nhiễm nấm Histoplasma, Aspergillus, Candida và Cryptococcus (bệnh nhân suy giảm miễn dịch nhiễm nấm Cryptococcus và ở tất cả bệnh nhân nhiễm nấm Cryptococcus thần kinh trung ương).
– Dự phòng nhiễm nấm ở bệnh nhân giảm bạch cầu trung tính kéo dài khi các thuốc chống nấm khác bị chống chỉ định.
Chống chỉ định:
– Mẫn cảm với itraconazol.
– Phụ nữ có thai trừ trường hợp đe dọa tính mạng.
– Sử dụng đồng thời với các thuốc là cơ chất của CYP3A4
(cụ thể xin xem thêm Phụ lục 4)
Cơ chế tác dụng: tương tự fluconazol.
Dược động học:
– Hấp thu nhanh qua đường tiêu hóa. Sinh khả dụng đường uống khoảng 55%. Hấp thu viên nang itraconazol tăng lên khi sử dụng thuốc cùng thức ăn và giảm đi khi pH dạ dày tăng.
– Nồng độ tối đa của itraconazol trong huyết thanh đạt được trong 2 – 5 giờ sau khi uống và vào cuối thời gian truyền khi truyền tĩnh mạch.
– Tỷ lệ liên kết protein huyết tương cao (> 99%).
– Thể tích phân bố lớn (> 700 L). Thuốc được phân bố rộng rãi vào các mô. Nồng độ trong dịch não tủy thấp hơn nhiều trong huyết thanh nhưng vẫn đạt hiệu quả điều trị khi viêm màng não.
– Chuyển hóa mạnh qua gan, chủ yếu qua CYP3A4. Hydroxy-itraconazol là chất chuyển hóa chính và có hoạt tính kháng nấm tương tự itraconazol. Itraconazol là chất ức chế mạnh CYP3A4.
– Thải trừ chủ yếu qua nước tiểu (35%) và qua phân (54%) dưới dạng không còn hoạt tính.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 21 – 64/35 giờ.
– Không bị thải qua lọc máu.
Tác dụng không mong muốn:
Thường gặp:
– Tim mạch: tăng huyết áp, phù.
– Da: ngứa, phát ban.
– Tiêu hóa: đau bụng, tiêu chảy, nôn, buồn nôn.
– Gan mật: ↑ALAT, ↑ ASAT.
– Thần kinh: chóng mặt, đau đầu.
– Hô hấp: viêm mũi, viêm xoang, nhiễm trùng hô hấp trên.
– Khác: sốt.
Nghiêm trọng:
– Tim mạch: suy tim xung huyết.
– Tiêu hóa: viêm tụy.
– Gan mật: độc tính trên gan.
– Miễn dịch: phản vệ.
– Thần kinh: viêm dây thần kinh ngoại vi.
– Hô hấp: phù phổi.
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: chỉ sử dụng trong trường hợp nhiễm nấm đe dọa tính mạng.
– Phụ nữ cho con bú: ngừng cho bú trước khi dùng thuốc.
Lưu ý: Với dạng tiềm truyền tĩnh mạch: Chống chỉ định cho bệnh nhân suy thận nặng (độ thanh thải creatinin < 30ml/phút) để phòng tránh tích lũy tá dược cyclodextrin thải trừ chủ yếu qua thận có thể gây độc tính.
● Posaconazol
Chỉ định:
– Điều trị nhiễm nấm Aspergilus xâm lấn ở bệnh nhân kháng trị hoặc không dung nạp với amphotericin B hoặc itraconazol.
– Dự phòng nhiễm nấm xâm lấn ở bệnh nhân giảm bạch cầu trung tính kéo dài (bệnh nhân có bệnh máu ác tính điều trị hóa trị liệu hoặc bệnh nhân ghép tế bào gốc).
Chống chỉ định:
– Mẫn cảm với posaconazol.
– Sử dụng đồng thời với các alcaloid cựa lõa mạch.
– Sử dụng đồng thời với các thuốc là cơ chất của CYP3A4 đồng thời có nguy cơ kéo dài khoảng QT, ví dụ: terfenadin, astemizol, cisaprid, pimozid hoặc quinidin.
– Sử dụng đồng thời với các thuốc ức chế HMG-CoA (simvastatin, lovastatin và atorvastatin)
(cụ thể xin xem thêm Phụ lục 4).
Cơ chế tác dụng: tương tự fluconazol.
Dược động học:
– Hấp thu chậm qua đường tiêu hóa. Sinh khả dụng đường uống: 54%. Mức độ hấp thu khi uống thuốc sau bữa ăn cao hơn nhiều lần so với khi dùng thuốc lúc đói.
– Thời gian để thuốc đạt nồng độ tối đa trong máu là 4 – 5 giờ (với dạng viên nén).
– Tỷ lệ liên kết với protein huyết tương cao (> 98%).
– Thể tích phân bố lớn (394 L với dạng viên nén).
– Chuyển hóa qua con đường glucoronid hóa, ít chuyển hóa qua hệ CYP450.
– Thải trừ chủ yếu qua phân (77%) và qua nước tiểu (14%). 66% liều thải trừ qua phân dưới dạng không đổi.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 35 giờ/không đổi.
– Không bị thải qua lọc máu.
Tác dụng không mong muốn:
Thường gặp:
– Nội tiết – chuyển hóa: hạ kali máu
– Tiêu hóa: tiêu chảy, buồn nôn, nôn.
– Thần kinh: đau đầu
– Khác: sốt
Nghiêm trọng:
– Tim mạch: kéo dài khoảng QT, xoắn đỉnh.
– Gan mật: ứ mật, suy gan.
– Nội tiết: suy vỏ thượng thận, ↓ gonatropin máu
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng, đặc biệt trong 3 tháng đầu của thai kỳ. Chỉ sử dụng trong trường hợp không còn lựa chọn nào khác.
– Phụ nữ cho con bú: ngừng cho con bú trước khi bắt đầu điều trị bằng posaconazol.
Lưu ý: (với biệt dược Noxafil viên kháng acid và hỗn dịch uống)
– Không nhai/nghiền viên.
– Có dạng hỗn dịch uống với hàm lượng 40 mg/ml. Không chuyển đổi giữa dạng viên và dạng hỗn dịch uống do khác biệt về tần suất đưa thuốc, ảnh hưởng của thức ăn và nồng độ thuốc đạt được trong máu.
● Voriconazol
Chỉ định:
– Điều trị nhiễm nấm Aspergilus xâm lấn (lựa chọn ưu tiên).
– Điều trị Candida máu ở bệnh nhân không giảm bạch cầu trung tính.
– Điều trị nhiễm nấm Candida xâm lấn (bao gồm cả C. krusei) ở bệnh nhân đề kháng với fluconazol.
– Dự phòng nhiễm nấm xâm lấn ở bệnh nhân ghép tế bào gốc có nguy cơ cao.
Chỉ định khác (được khuyến cáo trong Hướng dẫn điều trị):
– Điều trị kinh nghiệm khi nghi ngờ nhiễm nấm Aspergilus xâm lấn.
– Dự phòng nhiễm nấm ở bệnh máu ác tính điều trị hóa trị liệu có giảm bạch cầu trung tính kéo dài.
Chống chỉ định:
– Mẫn cảm với voriconazol.
– Sử dụng đồng thời với các thuốc là cơ chất của CYP3A4 đồng thời có nguy cơ kéo dài khoảng QT, ví dụ: terfenadin, astemizol, cisaprid, pimozid hoặc quinidin.
– Sử dụng đồng thời với rifampicin, carbamazepin và phenobarbital.
– Sử dụng đồng thời với efavirenz liều ≥ 400 mg/lần/ngày hoặc ritonavir liều ≥ 400 mg/lần x 2 lần/ngày.
– Sử dụng đồng thời với các alcaloid cựa lõa mạch.
– Sử dụng đồng thời với sirolimus.
(cụ thể xin xem thêm Phụ lục 4).
Cơ chế tác dụng: tương tự fluconazol.
Dược động học:
– Hấp thu nhanh và gần như hoàn toàn qua đường tiêu hóa. Sinh khả dụng đường uống khoảng 96%. Hấp thu của voriconazol giảm đi khi sử dụng thuốc cùng thức ăn và không bị ảnh hưởng bởi pH dạ dày.
– Nồng độ tối đa của thuốc trong huyết thanh đạt được trong 1 – 2 giờ sau khi uống thuốc.
– Tỷ lệ liên kết protein huyết tương khoảng 58%.
– Thể tích phân bố lớn, khoảng 4,6 L/kg. Thuốc được phân bố rộng rãi vào các mô và dịch não tủy.
– Chuyển hóa qua gan bởi CYP2C19 (chủ yếu), CYP2C9 và CYP3A4 đồng thời cũng là chất ức chế các enzym này.
– Thải trừ chủ yếu qua nước tiểu (80%): 2% dưới dạng không đổi.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 6 giờ/không đổi.
– Bị thải bởi lọc máu nhưng với lượng nhỏ, không cần thiết hiệu chỉnh liều.
Tác dụng không mong muốn:
Thường gặp:
– Tim mạch: tăng huyết áp, phù ngoại vi.
– Da: phát ban.
– Nội tiết – chuyển hóa: hạ kali máu
– Tiêu hóa: đau bụng, tiêu chảy, buồn nôn, nôn.
– Gan mật: tăng enzym gan.
– Huyết học: giảm tiểu cầu
– Thần kinh: đau đầu
– Thị giác: mờ mắt, sợ ánh sáng.
– Tâm thần: ảo giác
– Hô hấp: ho, chảy máu cam, nhiễm trùng hô hấp trên.
– Khác: sốt, viêm màng nhày.
Nghiêm trọng:
– Tim mạch: ngừng tim, loạn nhịp tim, kéo dài khoảng QT, xoắn đỉnh.
– Da: ban đỏ đa dạng, ung thư tế bào hắc tố, ung thư tế bào vảy, hội chứng Stevens – Johnson/Lyell.
– Tiêu hóa: viêm tụy.
– Gan mật: ứ mật, vàng da, viêm gan, suy gan.
– Miễn dịch: phản vệ.
– Thần kinh: bệnh não nhiễm độc.
– Thị giác: phù đĩa thị, viêm dây thần kinh thị giác.
– Thận: suy thận.
– Nội tiết: suy vỏ thượng thận, cường/suy giáp
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng, trừ trường hợp lợi ích cho người mẹ vượt trội nguy cơ trên thai nhi.
– Phụ nữ cho con bú: ngừng cho con bú trước khi bắt đầu điều trị bằng voriconazol.
Lưu ý:
– Tránh lái xe hoặc vận hành máy móc khi dùng thuốc do voriconazol có thể gây ảnh hưởng đến thị giác (nhìn mờ, sợ ánh sáng) thoáng qua và có thể hồi phục.
– Theo dõi enzym gan của bệnh nhân trước và sau khi điều trị bằng voriconazol.
– Uống thuốc xa bữa ăn, uống thuốc trước ăn 1 giờ hoặc sau ăn 2 giờ.
– Với dạng tiêm truyền tĩnh mạch: không nên sử dụng cho bệnh nhân suy thận trung bình đến nặng (CrCl < 50 ml/ph) để phòng tránh tích lũy tá dược cyclodextrin thải trừ chủ yếu qua thận có thể gây độc tính. Trong trường hợp sử dụng cho đối tượng này, cần theo dõi chặt chẽ nồng độ creatinin huyết thanh.
● Isavuconazol*
Chỉ định: Điều trị nhiễm nấm Aspergilus xâm lấn.
Chống chỉ định:
– Mẫn cảm với isavuconazol*.
– Bệnh nhân có khoảng QT ngắn có tính chất gia đình.
– Sử dụng đồng thời với ketoconazol, ritonavir liều cao (> 200 mg mỗi 12 giờ).
– Sử dụng đồng thời với các thuốc cảm ứng CYP3A4/3A5 mạnh (như rifampicin, rifabutin, carbamazepin, dẫn chất barbiturat tác dụng kéo dài (ví dụ: phenobarbital), phenytoin) hoặc cảm ứng CYP3A4/3A5 trung bình (như efavirenz).
(cụ thể xin xem thêm Phụ lục 4)
Cơ chế tác dụng: tương tự fluconazol.
Dược động học:
– Hấp thu tốt qua đường uống. Sinh khả dụng đường uống đạt trên 98% cho phép chuyển đổi đường tĩnh mạch sang đường uống.
– Tỷ lệ liên kết protein huyết tương cao (> 99%).
– Thể tích phân bố: 4,4 – 7,7 L/kg.
– Chuyển hóa chủ yếu qua gan bởi hệ CYP (CYP3A4 và CYP3A5) hoặc qua phản ứng glucuronic hóa.
– Thải trừ qua phân (46,1%) và nước tiểu (45,5%), chủ yếu dưới dạng chất chuyển hóa.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): IV: 76 – 104 giờ; uống: 56 – 77 giờ/ không có thông tin về thời gian bán thải ở bệnh nhân suy thận giai đoạn cuối.
Tác dụng không mong muốn:
Thường gặp:
– Nội tiết chuyển hóa: hạ kali máu
– Tiêu hóa: táo bón, tiêu chảy, buồn nôn, nôn.
– Cơ xương khớp: đau lưng
– Thần kinh: đau đầu.
– Hô hấp: ho, khó thở.
– Toàn thân: phù ngoại vi.
Nghiêm trọng:
– Gan mật: viêm gan, tắc mật, tăng enzym gan, suy gan.
– Miễn dịch: phản ứng quá mẫn.
– Thận: suy thận.
– Hô hấp: suy hô hấp.
– Khác: phản ứng liên quan đến tiêm truyền.
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng, chỉ sử dụng trong trường hợp đe dọa tính mạng và cần đánh giá lợi ích/nguy cơ cẩn thận.
– Phụ nữ cho con bú: nên ngừng cho con bú khi người mẹ điều trị bằng isavuconazol*.
Lưu ý:
– Với bột pha truyền Cresemba: sau khi hoàn nguyên, tiền thuốc isavuconazonium (tan trong nước) thủy phân ngay và tạo thành tủa isavuconazol* không tan, vì vậy, cần sử dụng bộ tiêm truyền có bộ lọc bên trong (với kích thước lỗ lọc 0.2 μm đến 1.2 μm, làm bằng polyether sulfon). Khi pha loãng dung dịch truyền, tránh rung lắc mạnh để hạn chế hình thành tiểu phân.
– Với viên nang Cresemba, không nhai/nghiền viên.
3.2.3. Nhóm echinocandin
● Caspofungin
Chỉ định:
– Điều trị kinh nghiệm khi nghi ngờ nhiễm nấm Candida hoặc Aspergilus xâm lấn.
– Điều trị nhiễm nấm Candida xâm lấn.
– Điều trị nhiễm nấm Aspergilus xâm lấn ở bệnh nhân kháng trị hoặc không dung nạp với amphotericin B, amphotericin B phức hợp lipid và/hoặc các azol.
Chỉ định khác (được khuyến cáo trong Hướng dẫn điều trị):
– Dự phòng nhiễm nấm xâm lấn ở bệnh nhân ghép tế bào gốc có bệnh ghép chống chủ.
Chống chỉ định: Mẫn cảm với caspofungin.
Cơ chế tác dụng: Các echinocandin ức chế tổng hợp β (1,3)-D-glucan – thành phần thiết yếu trong thành tế bào của một số loài nấm. Đối với Candida spp., các echinocandin có tác dụng diệt nấm nhưng thuốc lại có tác dụng kìm nấm với Aspergilus spp. Sự khác biệt này do sự khác nhau về thành phần glucan trong màng tế bào của các loại nấm.
Dược động học:
– Hấp thu qua đường tiêu hóa thấp nên caspofungin được sử dụng qua đường tĩnh mạch.
– Tỷ lệ liên kết với protein huyết tương cao (97%). Nồng độ tối đa trong mô (92%) đạt được sau khi 1,5 – 2 ngày dùng thuốc.
– Chuyển hóa bằng cách tự phân hủy, thủy phân chuỗi peptid và N-acetyl hóa. Thuốc không phải là cơ chất, chất ức chế hay cảm ứng của hệ CYP450.
– Thải trừ chậm khỏi cơ thể qua nước tiểu (41%) và phân (34%). 1,4% liều thải trừ qua nước tiểu dưới dạng không đổi.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 10 giờ/không đổi.
– Không bị thải qua lọc máu.
Tác dụng không mong muốn:
Thường gặp:
– Tim mạch: hạ huyết áp.
– Da: phát ban.
– Tiêu hóa: tiêu chảy.
– Gan mật: ↑ ALAT, ↑ ALAT, ↑ ALP.
– Khác: sốt, phản ứng tại vị trí truyền, run.
Nghiêm trọng:
– Da: hội chứng Stevens – Johnson/Lyell.
– Tiêu hóa: viêm tụy.
– Gan mật: hoại tử tế bào gan, suy gan.
– Miễn dịch: phản vệ, nhiễm trùng huyết, sốc nhiễm trùng.
– Thận: suy thận.
– Hô hấp: tràn dịch màng phổi, suy hô hấp.
– Khác: phù mạch.
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng trừ trường hợp thực sự cần thiết.
– Phụ nữ cho con bú: không nên cho con bú khi dùng thuốc.
● Micafungin
Chỉ định:
– Điều trị nhiễm nấm Candida xâm lấn.
– Dự phòng nhiễm nấm Candida xâm lấn ở bệnh nhân giảm bạch cầu trung tính kéo dài (bệnh nhân có bệnh máu ác tính điều trị hóa trị liệu hoặc bệnh nhân ghép tế bào gốc).
Chỉ định khác (được khuyến cáo trong Hướng dẫn điều trị):
– Điều trị kinh nghiệm theo hướng nhiễm nấm Candida hoặc Aspergilus.
– Điều trị nhiễm nấm Aspergilus xâm lấn ở bệnh nhân kháng trị hoặc không dung nạp với amphotericin B, amphotericin B phức hợp lipid và/hoặc các azol.
Chống chỉ định: Mẫn cảm với micafungin.
Cơ chế tác dụng: tương tự caspofungin.
Dược động học:
– Hấp thu qua đường tiêu hóa thấp nên micafungin được sử dụng qua đường tĩnh mạch.
– Tỷ lệ liên kết với protein huyết tương cao (> 99%). Thuốc phân bố nhanh vào các mô. Thể tích phân bố: 18 – 19 L.
– Chuyển hóa bằng nhiều con đường khác nhau. Micafungin là cơ chất của CYP3A4 nhưng đây không phải là con đường chuyển hóa chính của micafungin.
– Thải trừ chủ yếu qua phân (71%) và nước tiểu (11%).
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 10 – 15 giờ/không đổi.
– Không bị thải qua lọc máu.
Tác dụng không mong muốn:
Thường gặp:
– Tiêu hóa: tiêu chảy, buồn nôn, nôn.
– Huyết học: giảm tiểu cầu.
– Thần kinh: đau đầu.
– Khác: sốt.
Nghiêm trọng:
– Tim mạch: rung nhĩ.
– Huyết học: thiếu máu, tan máu, tiểu ra máu.
– Gan mật: viêm gan, suy gan.
– Miễn dịch: phản vệ.
– Thận: suy thận.
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng trừ trường hợp thực sự cần thiết.
– Phụ nữ cho con bú: cân nhắc lợi ích/nguy cơ để tiếp tục/ngừng cho con bú khi dùng thuốc.
3.2.4. Nhóm flucytosin
Chỉ định:
Kết hợp với amphotericin B (hoặc fluconazol) trong điều trị:
– Điều nhiễm nấm Candida máu, màng tim hoặc tiết niệu khi đã thất bại với các chống nấm lựa chọn đầu tay hoặc không dung nạp với các thuốc này.
– Điều trị nhiễm nấm Cryptococcus thần kinh trung ương hoặc phổi.
Chống chỉ định:
– Mẫn cảm với flucytosin.
– Phụ nữ cho con bú.
– Sử dụng đồng thời với các thuốc kháng virus có cấu trúc nucleosid ức chế không hồi phục enzym dihydropyrimidine dehydrogenase (DPD) (ganciclovir, valganciclovir, brivudin, sorivudin).
Cơ chế tác dụng: Flucytosin có tác dụng kìm nấm và diệt nấm bằng cách xâm nhập vào tế bào nấm thông qua protein vận chuyển màng tế bào, tạo thành chất chuyển hóa có hoạt tính, ức chế tổng hợp DNA và RNA, từ đó, ức chế tổng hợp protein của tế bào nấm.
Dược động học:
– Hấp thu nhanh và gần như hoàn toàn qua đường tiêu hóa. Sinh khả dụng đường uống khoảng 76 – 98%. Thức ăn làm giảm tốc độ hấp thu nhưng không ảnh hưởng đến mức độ hấp thu.
– Nồng độ tối đa của thuốc trong huyết thanh đạt được trong 1 – 2 giờ sau khi uống thuốc nhưng chậm hơn ở bệnh nhân suy thận (4 – 6 giờ).
– Tỷ lệ liên kết protein huyết tương khoảng thấp (< 5%).
– Thể tích phân bố lớn, khoảng 0,5 – 1 L/kg. Thuốc được phân bố rộng rãi vào các mô và dịch cơ thể. Thuốc đạt nồng độ điều trị cả trong dịch não tủy.
– Chỉ một lượng nhỏ flucytosin được chuyển hóa bởi các enzym trong ruột tạo thành 5-fluorouracil (5-FTU).
– Thải trừ chủ yếu qua nước tiểu: 90% dưới dạng không đổi. Nồng độ của flucytosin trong nước tiểu gấp 100 lần nồng độ trong huyết thanh ở người có chức năng thận bình thường.
– Thời gian bán thải (bình thường/suy thận giai đoạn cuối): 4/85 giờ.
– Bị thải nhanh qua lọc máu.
Tác dụng không mong muốn:
Thường gặp:
– Tiêu hóa: đau bụng, tiêu chảy, buồn nôn, nôn.
– Thần kinh: nhầm lẫn, đau đầu.
– Tâm thần: ảo giác
Nghiêm trọng:
– Tim mạch: độc tính trên tim
– Tiêu hóa: xuất huyết tiêu hóa
– Huyết học: giảm bạch cầu, giảm tiểu cầu, ức chế tủy xương
– Thận: suy thận
Sử dụng ở phụ nữ có thai, cho con bú
– Phụ nữ có thai: không nên sử dụng, đặc biệt trong 3 tháng đầu thai kỳ. Chỉ sử dụng trong trường hợp đe dọa tính mạng và không có lựa chọn nào khác.
– Phụ nữ cho con bú: chống chỉ định.
CHƯƠNG 4. ĐIỀU TRỊ NHIỄM NẤM XÂM LẤN
4.1. Nhiễm nấm Candida xâm lấn
Theo phân loại, bệnh nhiễm Candida xâm lấn được chia làm 3 loại:
Nhiễm Candida máu đơn độc, nhiễm Candida máu xâm lấn mô sâu và nhiễm Candia xâm lấn mô sâu có cấy máu âm tính.
4.1.1. Điều trị nhiễm Candida máu đơn độc
Nhiễm Candida máu đơn độc được định nghĩa là khi phát hiện ra trong máu có nấm Candida, tuy nhiên không tìm thấy nhiễm Candida tại một vị trí mô sâu nào khác của cơ thể.
a. Điều trị đặc hiệu
Điều trị đặc hiệu (điều trị đích) chỉ định khi chấn đoán chắc chắn nhiễm nấm xâm lấn.
● Nhóm BN không có giảm bạch cầu hạt, không ghép tế bào gốc tạo máu
Lựa chọn ưu tiên:
Caspofungin với liều nạp 70mg, sau đó duy trì 50mg hàng ngày.
Hoặc Micafungin 100mg hàng ngày.
Hoặc Anidulafungin* với liều nạp 200mg, sau đó duy trì 100mg hàng ngày
Lựa chọn thay thế: Fluconazole có thể lựa chọn thay thế cho echinocandin trong trường hợp bệnh nhân không nặng và nhiễm loại Candida không kháng fluconazole. Uống hoặc truyền tĩnh mạch với liều nạp 800mg (12mg/kg), sau đó duy trì 400mg (6mg/kg) hàng ngày. Đường tĩnh mạch được chỉ định nếu không dùng được đường uống
Lựa chọn khác:
Dẫn xuất lipid của Amphotericin B (3 – 5 mg/kg/ngày) được chỉ định khi bệnh nhân không dung nạp hoặc kháng với các thuốc chống nấm khác.
Kháng nấm đồ với azole: cần chỉ định cho tất cả các chủng Candida phân lập được.
Kháng nấm đồ với echinocandin nên làm ở bệnh nhân trước đó đã được điều trị bằng echinocandin và bệnh nhân nhiễm C. glabrata hoặc C. parapsilosis.
Xuống thang điều trị
Từ echinocandin sang fluconazole (thường sau 7 ngày) ở bệnh nhân lâm sàng ổn định, loại Candida nhạy với fluconazole (ví dụ C. albicans) và cấy máu sau điều trị khởi đầu với thuốc chống nấm cho kết quả âm tính.
Ở bệnh nhân nhiễm C. glabrata nhạy cảm với fluconazole hoặc nhạy cảm với voriconazole nên chuyển dùng liều cao fluconazole 800mg (12mg/kg)/ngày hoặc voriconazole 200 – 300mg (3 – 4 mg/kg) hai lần/ngày.
Thay thế từ Amphotericin B sang fluconazole sau 7 ngày ở bệnh nhân nhạy với fluconazole có lâm sàng ổn định và cấy máu sau điều trị khởi đầu bằng thuốc chống nấm cho kết quả âm tính.
Voriconazole 400mg (6mg/kg) hai lần/ngày cho 2 liều sau đó duy trì 200mg (3 mg/kg) hai lần/ngày nên được lựa chọn điều trị xuống thang đường uống ở bệnh nhân nhiễm nấm C. krusei.
– Tất cả bệnh nhân nhiễm nấm Candida máu không giảm bạch cầu nên được khám chuyên khoa mắt trong tuần đầu tiên sau chẩn đoán.
– Nếu có điều kiện, có thể cấy máu cách 2 ngày để xác định thời điểm không còn nấm Candida trong máu.
– Ở bệnh nhân có catheter tĩnh mạch trung tâm, nếu nghi ngờ nhiễm Candida máu liên quan catheter nên rút catheter càng sớm càng tốt.
Thời gian điều trị nhiễm nấm Candida máu không kèm theo nhiễm Candida xâm lấn mô sâu là 2 tuần sau khi cấy máu cho kết quả âm tính và cải thiện triệu chứng do nấm Candida.
● Bệnh nhân có giảm bạch cầu hạt hoặc ghép tế bào gốc tạo máu
Lựa chọn ưu tiên:
Caspofungin với liều nạp 70mg, sau đó duy trì 50mg hàng ngày.
Hoặc Micafungin 100mg hàng ngày.
Hoặc Anidulafungin* với liều nạp 200mg, sau đó duy trì 100mg hàng ngày
Lựa chọn thay thế: Dẫn xuất lipid của Amphotericin B (3 – 5 mg/kg/ngày) được chỉ định khi bệnh nhân không dung nạp hoặc kháng với các thuốc chống nấm khác.
Lựa chọn khác:
Fluconazole có thể lựa chọn thay thế cho echinocandin trong trường hợp bệnh nhân không nặng và nhiễm loại Candida không kháng fluconazole. Uống hoặc truyền tĩnh mạch với liều nạp 800mg (12mg/kg), sau đó duy trì 400mg (6mg/kg) hàng ngày. Đường tĩnh mạch được chỉ định nếu không dùng được đường uống
Kháng nấm đồ với azole: cần chỉ định cho tất cả các chủng Candida phân lập được.
Kháng nấm đồ với echinocandin nên làm ở bệnh nhân trước đó đã được điều trị bằng echinocandin và bệnh nhân nhiễm C. glabrata hoặc C. parapsilosis.
Xuống thang điều trị
– Fluconazole 400mg (6mg/kg/ngày) được sử dụng điều trị xuống thang trong giai đoạn giảm bạch cầu khi lâm sàng bệnh nhân ổn định và mắc các chủng nhạy cảm.
– Điều trị bằng voriconazole 400mg (6mg/kg) hai lần/ngày trong 2 ngày, sau đó duy trì 200 – 300 mg (3 – 4 mg/kg) hai lần/ngày có thể dùng điều trị xuống thang ở bệnh nhân giảm bạch cầu có tình trạng lâm sàng ổn định, chủng Candida phân lập được nhạy cảm với Voriconazole, cấy máu lại tìm nấm âm tính.
– Đối với nhiễm C. krusei, echinocandin, dẫn xuất lipid của amphotericin B hoặc voriconazole được khuyến cáo sử dụng.
Thời gian điều trị nhiễm nấm Candida máu không kèm theo nhiễm Candida xâm lấn mô sâu là 2 tuần sau khi cấy máu cho kết quả âm tính và cải thiện triệu chứng do nấm Candida và cải thiện tình trạng giảm bạch cầu.
– Khám mắt phát hiện nhiễm nấm hắc mạc và thủy tinh thể ngay khi bạch cầu phục hồi về giá tri bình thường. Soi đáy mắt trong tuần đầu tiên sau khi bạch cầu hồi phục về giá trị bình thường.
– Ở bệnh nhân giảm bạch cầu, nguồn nhiễm Candida hay găp thường không phải là catheter tĩnh mạch trung tâm. Do đó cân nhắc rút catheter tùy thuộc từng trường hợp.
b. Điều trị kinh nghiệm
Điều trị kinh nghiệm chỉ định khi chẩn đoán “nhiều khả năng” hoặc chẩn đoán “có thể” nhiễm nấm xâm lấn. Điều trị kinh nghiệm giúp cho việc điều trị được tiến hành sớm, và do đó tăng khả năng thành công trong điều trị nhiễm nấm xâm lấn.
● Bệnh nhân bệnh máu ác tính có hóa trị, hay ghép tế bào gốc tạo máu, có giảm BC hạt, sốt > 38°C và dùng kháng sinh không phải đường uống > 96 giờ
– Những bệnh nhân có sốt và giảm bạch cầu, trước đó đã được điều trị kháng nấm hoặc điều trị dự phòng nhiễm nấm, hoặc kèm theo dấu hiệu tổn thương các cơ quan.
+ Caspofungin truyền TM liều nạp 70mg, sau đó duy trì 50mg hàng ngày (cân nặng < 80kg)
+ Hoặc micafungin 100mg hàng ngày
+ Hoặc Anilafungin liều nạp 200mg, sau đó duy trì 100mg hàng ngày
Nếu tình trạng lâm sàng không cải thiện sau 3 – 5 ngày điều trị, cân nhắc dùng Amphotericin B liposomal* 3-5mg/kg/ngày
– Những bệnh nhân chỉ có sốt, giảm bạch cầu, trước đó chưa điều trị dự phòng nhiễm nấm:
+ Fluconazole 800mg (12mg/kg) liều đầu, sau đó duy trì 400mg/ngày (6mg/kg/ngày). Đường tĩnh mạch được chỉ định nếu không dùng được đường uống
+ Hoặc Posaconazole 300mg/ngày
+ Hoặc Voriconazole 400mg (6mg/kg) hai lần/ngày cho 2 liều sau đó duy trì 200mg (3 mg/kg) hai lần/ngày
Nếu tình trạng lâm sàng không cải thiện sau 3 – 5 ngày điều trị, cân nhắc dùng Amphotericin B liposomal* 3-5mg/kg/ngày
● Bệnh nhân không có bệnh máu ác tính
Điều trị kinh nghiệm nhiễm Candida xâm lấn có thể được đặt ra khi bênh nhân có một hay nhiều các bệnh phẩm không vô trùng cấy ra nấm Candida, Candida Score ≥ 3 và/hoặc thỏa mãn các yếu tố tiên đoán Ostrosky – Zeichnet kèm theo các yếu tố lâm sàng gợi ý đến nhiễm nấm Candida.
Lựa chọn ưu tiên:
Caspofungin với liều nạp 70mg, sau đó duy trì 50mg hàng ngày.
Hoặc Micafungin 100mg hàng ngày.
Hoặc Anidulafungin* với liều nạp 200mg, sau đó duy trì 100mg hàng ngày
Lựa chọn thay thế: Fluconazole liều nạp 800mg (12mg/kg), sau đó duy trì 400mg (6mg/kg) hàng ngày nếu bệnh nhân chưa được dùng thuốc nhóm azole và không có chủng Candida cư trú kháng azole.
Lựa chọn khác: Dẫn xuất lipid của Amphotericin B (3 – 5 mg/kg/ngày) được chỉ định khi bệnh nhân không dung nạp với các thuốc chống nấm khác.
Thời gian điều trị kinh nghiệm bệnh nhân nghi ngờ nhiễm Candida xâm lấn giống như điều trị đặc hiệu.
Bảng 4.1. Phác đồ điều trị hội chứng nhiễm Candida xâm lấn
|
Điều trị ban đầu |
Điều trị thay thế |
Điều trị khác |
| – Caspofungin với liều nạp 70mg, sau đó duy trì 50mg hàng ngày.
– Hoặc Micafungin 100mg hàng ngày. – Hoặc Anidulafungin* với liều nạp 200mg, sau đó duy trì 100mg hàng ngày |
Fluconazole ở những bệnh nhân không có biểu hiện lâm sàng và không có nhiễm loại Candida kháng fluconazole. Uống hoặc truyền tĩnh mạch với liều nạp 800mg (12mg/kg). Sau đó duy trì 400mg (6mg/kg) hàng ngày. | Dẫn xuất lipid của Amphotericin B (3 – 5 mg/kg/ngày) được chỉ định khi bệnh nhân không dung nạp hoặc kháng với các thuốc chống nấm khác. |
c. Điều trị thuốc kháng nấm ở nhóm bệnh nhân có nguy cơ cao
◊ Điều trị dự phòng nhiễm Candida xâm lấn ở các đơn vị hồi sức cấp cứu, trên bệnh nhân không có bệnh máu ác tính:
Điều trị dự phòng không được khuyến cáo áp dụng thường quy ở bệnh nhân nặng, tuy nhiên trong những đơn vị hồi sức cấp cứu có tỷ lệ nhiễm Candida xâm lấn từ 5% trở lên, cần điều trị dự phòng cho các bệnh nhân có nguy cơ cao.
– Lựa chọn ưu tiên: Fluconazole 800mg (12mg/kg) liểu nạp, duy trì 400mg/ngày (6mg/kg/ngày)
– Lựa chọn thay thế:
+ Hoặc Caspofungin với liều loading 70mg, sau đó duy trì 50mg hàng ngày
+ Hoặc micafungin 100mg hàng ngày.
+ Hoặc anidulafungin* với liều loading 200mg, sau đó duy trì 100mg hàng ngày.
◊ Điều trị dự phòng nhiễm Candida xâm lấn ở bệnh nhân có bệnh máu ác tính:
Bệnh nhân leukemia cấp dòng tủy, rối loạn sinh tủy được điều trị hóa chất giai đoạn tấn công, nhất là có nhiễm nấm niêm mạc đường tiêu hóa, cần được điều trị dự phòng nhiễm Candida xâm lấn.
– Lựa chọn ưu tiên: Fluconazole 400mg/ngày (6mg/kg/ngày)
– Lựa chọn thay thế: itraconazole, voriconazole, posaconazole, micafungin, caspofungin, hoặc anidulafungin*.
Trường hợp nghi ngờ nhiễm nấm sợi, không dùng fluconazole vì không có tác dụng trên nấm sợi (hướng dẫn cụ thể xin xem phần ” Nhiễm Aspergillus xấm lấn”).
d. Điều trị cứu cánh
– Chỉ định khi tình trạng người bệnh tiển triển xấu đi ngay khi đang điều trị thuốc kháng nấm, tuy nhiên trước khi kết luận nguyên nhân xấu đi do thuốc kháng nấm không có hiệu quả cần phải xem xét kỹ lưỡng tổng thể các yếu tố liên quan như; mức độ nặng, tốc độ và sự lan rộng của nhiễm khuẩn, các bệnh lí phối hợp nhằm mục đích loại trừ tiến triển xấu đó là do các căn nguyên mới.
– Chiến lược điều trị cứu cánh bao gồm: (i) thay đổi thuốc kháng nâm thuốc các nhóm khác nhau có tác dụng; (ii) điều chỉnh hoặc đảo ngược tình trạng ức chế miễn dịch nếu có thể; (iii) phẫu thuật cắt bỏ tổ chức hoại tử trong các trường hợp có chỉ định.
– Có thể thêm thuốc kháng nấm vào liệu pháp kháng nấm hiện tại hoặc có thể phối hợp các thuốc kháng nấm khác nhóm
– Khi thay đổi thuốc kháng nấm vì tác dụng phụ của thuốc, tránh thay các thuốc kháng nấm mới có tác dụng phụ tương tự.
4.1.2. Nhiễm nấm Candida xâm lấn cơ quan khác:
Nhiễm nấm Candida các cơ quan khác ngoài máu bao gồm: nhiễm Candida nội tạng (gan, lách), nhiễm Candida ổ bụng, nhiễm Candida nội tâm mạc, nhiễm Candida cơ xương khớp….
a. Nhiễm Candida xâm lấn nội tạng
Bảng 4.2: Điều trị nhiễm nấm Candida xâm lấn nội tạng (gan, lách)
| Điều trị ban đầu |
| Dẫn xuất lipid của Amphotericin B 3-5mg/kg/ngày
Hoặc Caspofungin liều nạp 70 mg, sau đó 50 mg/ngày Hoặc Micafungin 100 mg/ngày Hoặc Anidulafungin* 200mg liều nạp, sau đó 100 mg/ngày trong vài tuần. |
| Điều trị duy trì |
| Fluconazole đường uống 400 mg (6 mg/kg) hàng ngày |
– Điều trị duy trì cho đến khi các tổn thương cải thiện dựa vào chẩn đoán hình ảnh, thường là vài tháng. Ngừng điều trị sớm có thể dẫn đến tái phát.
– Nếu có chỉ định hóa trị liệu hoặc cấy ghép tế bào tạo máu, không nên trì hoãn điều trị mà nên kết hợp với điều trị thuốc chống nấm.
– Bệnh nhân sốt cao kéo dài có thể dùng thuốc corticoid hoặc NSAIDs trong 1 – 2 tuần.
b. Nhiễm nấm Candida trong ổ bụng
– Điều trị thuốc chống nấm theo kinh nghiệm cho bệnh nhân có nguy cơ nhiễm nấm Candida và có bằng chứng lâm sàng nhiễm trùng ổ bụng gồm phẫu thuật ổ bụng gần đây, rò hậu môn hoặc viêm tụy hoại tử.
– Điều trị nhiễm nấm Candida trong ổ bụng bao gồm kiểm soát nguồn lây kết hợp dẫn lưu và/hoặc làm sạch ổ bụng.
– Điều trị thuốc chống nấm tương tự điều trị nhiễm nấm Candida máu hoặc điều trị theo kinh nghiệm ở bệnh nhân ICU không có giảm bạch cầu.
– Thời gian điều trị dựa vào việc kiểm soát nguồn lây và đáp ứng lâm sàng.
c. Nhiễm nấm Candida nội tâm mạc
Bảng 4.3: Điều trị nhiễm nấm Candida nội tâm mạc đối với van tự nhiên
| Điều trị ban đầu |
| Dẫn xuất lipid của Amphotericin B 3-5 mg/kg/ngày, có hoặc không có flucytosine 25 mg/ kg 4 lần hàng ngày
Hoặc Echinocandin đường uống liều cao (Caspofungin 150 mg/ngày, micafungin 150 mg/ngày, hoặc anidulafungin* 200 mg/ ngày) |
| Điều trị duy trì |
| Fluconazole 400-800 mg (6-12 mg/kg)đối với bệnh nhân mắc chủng Candida có nhạy cảm với thuốc, lâm sàng ổn định và xét nghiệm máu âm tính với Candida
Hoặc Voriconazole đường uống 200-300 mg (3-4 mg/kg) hai lần/ngày Hoặc Posaconazole đường uống 300 mg/ngày ở bệnh nhân mắc chủng không nhạy cảm với Fluconazole |
– Điều trị tiếp tục thuốc chống nấm ít nhất 6 tuần sau phẫu thuật thay van hoặc dài hơn ở bệnh nhân áp xe van và biến chứng khác.
– Ở bệnh nhân không thể thay van, kéo dài thời gian điều trị với fluconazole 400-800 mg (6-12 mg/ kg/ ngày).
d. Nhiễm nấm Candida xương khớp
Bảng 4.4: Điều trị nhiễm nấm Candida cơ xương khớp
|
Điều trị ban đầu |
Điều trị thay thế |
Điều trị khác |
| Fluconazole 400 mg (6 mg/ kg/ ngày) trong 6-12 tháng Hoặc Echinocandin đường uống (caspofungin 50-70 mg/ ngày, micafungin 100 mg/ ngày, hoặc anidulafungin* 100 mg/ ngày) trong ít nhất 2 tuần. Cân nhắc chuyển sang fluconazol uống với liều tương đương khi điều kiện lâm sàng cho phép | Dẫn xuất Lipid của Amphotericin B 3-5 mg/ kg/ ngày ít nhất là 2 tuần. | Phẫu thuật tháo khớp, dẫn lưu, tháo khớp giả được chỉ định trong tất cả các trường hợp viêm khớp hoại tử |
Điều trị duy trì: fluconazole 400 mg (6 mg/ kg/ ngày 6-12 tháng
4.1.3. Nhiễm nấm Candida máu có kèm theo xâm lấn cơ quan khác
Bảng 4.5. Điều trị nhiễm nấm Candida máu có kèm theo xâm lấn các cơ quan khác
|
Vị trí |
Thuốc điều trị ban đầu |
Thuốc điều trị duy trì |
Thời gian điều trị |
| Nhiễm Candida máu kèm xâm lấn nội tạng | Như nhiễm Candida máu | Fluconazole đường uống 400mg (6mg/kg) hàng ngày | Vài tuần |
| Nhiễm Candida máu kèm xâm lấn ổ bụng | Như nhiễm Candida máu | Như nhiễm Candida máu | Dựa vào việc kiểm soát nguồn lây và đáp ứng lâm sàng |
| Nhiễm Candida máu kèm viêm nội tâm mạc | Như nhiễm Candida nội tâm mạc | Như nhiễm Candida nội tâm mạc | Ít nhất 6 tuần sau phẫu thuật thay van.
Kéo dài hơn 6 tuần ở nhóm bệnh nhân: áp xe van, không phẫu thuật thay van |
| Nhiễm Candida máu kèm theo viêm xương khớp | Như nhiễm Candida máu | Fluconazole 400mg(6mg/kg) hàng ngày |
6 – 12 tháng |
4.2. Nhiễm Aspergillus xấm lấn
Bệnh nhiễm nấm Aspergillus (Aspergillosis) chia làm 3 loại: (1) nhiễm nấm Aspergillus xâm lấn – Invasive Aspergillosis – IA; (2) nhiễm nấm Aspergillus mạn tính – chronic form of Aspergillosis; (3) thể dị ứng do Aspergillus – allergic form of Aspergillosis. Trong nhiễm Apergillus xâm lấn, có đến 85% các trường hợp nhiễm Aspergillus tại phổi và khoảng 15% ngoài phổi, có thể gặp ở các cơ quan thần kinh trung ương, mắt, các xoang, nội tâm mạc, tủy xương, da, phúc mạc, tiêu hóa, thận, tai và móng …
4.2.1. Điều trị nhiễm Aspergillus phổi (IPA)
a. Điều trị đặc hiệu
Điều trị đặc hiệu (điều trị đích) chỉ định khi chấn đoán chắc chắn nhiễm nấm xâm lấn.
Nhóm bệnh nhân không có giảm bạch cầu hạt, không ghép tế bào gốc tạo máu
Lựa chọn ưu tiên:
– Voriconazole 6mg/kg mỗi 12h truyền TM trong ngày 1, sau đó 4mg/kg truyền TM mỗi 12h trong các ngày tiếp theo. Cân nhắc chuyển sang voriconazol uống với liều tương đương khi điều kiện lâm sàng cho phép
– Hoặc Isavuconazole* 200mg mỗi 8h cho 6 liều đầu, sau đó 200mg/ngày.
Lựa chọn thay thế:
– Amphotericin B liposomal* 3mg/kg/ngày truyền TM, tối đa có thể tới 5mg/kg/ngày
– Echinocandin không khuyến cáo lựa chọn điều trị đầu tiên, dùng khi có chống chỉ định với các thuốc nhóm azole: Caspofungin 70mg/ngày truyền TM trong ngày 1, sau đó 50mg/ngày truyền TM.
Nhóm bệnh nhân giảm bạch cầu hạt, không ghép tế bào gốc tạo máu
+ Isavuconazole* 200mg, truyền tĩnh mạch 3 lần/ngày trong 1 – 2 ngày đầu, sau đó uống 200mg/ngày.
Nhóm bệnh nhân ghép tế bào gốc tạo máu khác loài (có giảm bạch cầu hạt) và nhóm bệnh nhân ghép tế bào gốc tạo máu khác loài (không giảm bạch cầu hạt) và nhóm khác không giảm bạch cầu hạt, các mức ưu tiên giảm dần:
+ Voriconazole truyền tĩnh mạch 6 mg/kg mỗi 12 giờ hoặc uống 400mg trong ngày đầu, sau đó 2 – 4 mg/kg tĩnh mạch
+ Hoặc Amphotericin B liposomal* 3mg/kg. Tối đa có thể tới 5 mg/kg/ngày
+ Hoặc phối hợp giữa voriconazole khởi đầu 6mg/kg sau đó 4 mg/kg 2 lần/ngày, sau 1 tuần chuyển uống 300mg 2 lần/ngày phối hợp cùng Anidulafungin* 200mg/100mg
+ Hoặc Caspofungin 70mg tĩnh mạch ngày đầu, các ngày sau 50mg (cho bệnh nhân dưới 80kg), hoặc Itraconazole truyền TM 200mg mỗi 12 giờ trong này đầu, sau đó 200mg các ngày sau.
+ Hoặc Amphotericin B phức hợp lipid 5mg/kg, hoặc Amphotericin B deoxycholate 0,5 – 1 mg/kg/ngày. Tối đa có thể tới 1,5mg/kg/ngày
Nhóm bệnh nhân có ho máu đe dọa tính mạng: áp dụng các biện pháp điều trị kết hợp (nút mạch phổi hoặc phẫu thuật cầm máu).
Nhiễm Aspergillus khí phế quản xâm lấn: dùng thuốc kháng nấm nhóm azole nếu còn nhạy cảm, hoặc amphotericin B nhũ dịch lipid.
Lưu ý: hạn chế tối thiểu các tác động thúc đẩy tình trạng suy giảm miễn dịch (hóa chất hoặc các thuốc ức chế miễn dịch ở các bệnh nhân ghép), nên kết hợp loại bỏ tổ chức hoại tử bằng biện pháp nội soi khí phế quản (tùy từng trường hợp cụ thể nếu có chỉ định).
Thời gian điều trị kháng nấm tối thiểu 6-12 tuần. Có thể điều trị dài hơn phụ thuộc vào mức độ và thời gian ức chế miễn dịch, cơ quan nhiễm nấm và bằng chứng về cải thiện bệnh trên lâm sàng và chẩn đoán hình ảnh.
Bảng 4.6: Phác đồ điều trị hội chứng nhiễm nấm Aspergillus xâm lấn phổi
|
Lựa chọn ưu tiên |
Lựa chọn thay thế |
Lựa chọn khác |
| Voriconazole 6mg/kg mỗi 12h truyền TM trong ngày đầu sau đó 4 mg/kg truyền TM mỗi 12h trong các ngày tiếp theo
Hoặc voriconazole đường uống 400mg ngày đầu, những ngày sau 200-300mg Bệnh nhân giảm bạch cầu hạt: ưu tiên Isavuconazole* 200mg truyền TM mỗi 8giờ trong 48 giờ đầu, sau đó 200mg.ngày (có thể uống) |
AmB liposomal 3 mg/kg ngày truyền TM.
Itraconazole 200mg mỗi 6h truyền TM |
ABLC 5mg/kg/ngày truyền TM.
Hoặc cAmB 0,5 – 1mg/kg/ngày Hoặc Caspofungin 70mg/ngày đầu rồi 50mg/ngày, các ngày tiếp theo Hoặc Micafungin 100-150mg/ngày, truyền TM Hoặc Posaconazole đường uống 600mg/ngày chia 2-3lần Hoặc Itraconazole đường uống 200mg mỗi 12h |
AmB liposomal: Amphotericin B liposomal;
ABLC: amphotericin B phức hợp lipid;
cAmB: amphotericin B thông thường (dạng deoxycholate).
cAmB nguy cơ độc với gan, thận, mắt, rối loạn điện giải dẫn đến rung thất. Trong những trường hợp này cần lựa chọn Amphotericin B liposomal* hoặc ABLC.
b. Điều trị kinh nghiệm
Điều trị kinh nghiệm chỉ định khi chẩn đoán “nhiều khả năng” hoặc chẩn đoán “có thể” nhiễm nấm xâm lấn.
Điều trị kinh nghiệm giúp đáp ứng tiêu chí điều trị sớm, do đó tăng khả năng thành công điều trị và dễ áp dụng cho các quần thể bệnh nhân đặc thù, hoặc các bệnh nhân có nguy cơ nhiễm Aspergillus phổi xâm lấn cao hoặc các trường hợp sốt với định hướng nhiễm nấm Aspergillus.
– Với nhóm bệnh nhân máu ác tính có hóa trị, hay ghép tế bào gốc tạo máu, giảm bạch cầu hạt, sốt > 38°C và dùng kháng sinh đường tiêm 96 giờ không cải thiện triệu chứng lâm sàng. Các thuốc lựa chọn điều trị theo thứ tự ưu tiên
+ Voriconazole 6mg/kg truyền TM 2 lần/ngày hoặc uống 400mgx2 lần/ngày cho ngày đầu tiên, các ngày sau 4mg/kg truyền TM hoặc uống 200-300mgx 2 lần/ngày.
+ Amphotericin B liposomal* 3mg/kg/ngày truyền TM; amphotericin B phức hợp lipid 5mg/kg/ngày hoặc cAmB 0,5-1mg/kg/ngày
+ Itraconazole 200mg, truyền TM 2 lần/ngày
+ Caspofungin truyền TM 70mg ngày đầu, các ngày sau 50mg (với cân nặng < 80kg)
+ Micafungin 100mg/ngày
– Bệnh nhân có sốt, tổn thương phổi đã làm các xét nghiệm loại trừ nguyên nhân như do lao …, không đáp ứng với điều trị kháng sinh ở một số nhóm bệnh nhân chọn lọc dưới đây: thuốc kháng nấm đầu tay là voriconazole, thuốc thay thế điều trị là amphotericin B
+ Trên phim MS-CT ngực có thâm nhiễm mới, và/hoặc có tổn thương tắc mạch (cắt cụt) hoặc tổn thương ăn mòn mạch máu, có ho ra máu.
+ Bệnh nhân không có bệnh lý ác tính nhưng nằm ở khoa có mật độ bảo tử nấm>25 CFU/m3
+ Bệnh nhân ghép tạng đặc (gan, thận, phổi). Ung thư
+ Bệnh nhân điều trị corticosteroid kéo dài trên 3 tuần hoặc thuốc ức chế miễn dịch.
+ Cơ địa nghiện rượu, lạm dụng rượu
+ COPD hoặc bệnh phổi mạn với thay đổi cấu trúc phổi
+ ARDS tiến triển
+ Bệnh nhân xơ gan nằm tại khoa Hồi sức quá 7 ngày. Suy gan. Bệnh viêm phổi do vi rút cúm
+ Mắc các bệnh nặng đang điều trị tại khoa hồi sức: bỏng nặng, phẫu thuật tiêu hóa phức tạp hoặc có biến chứng, suy dinh dưỡng.
+ Nhóm bệnh nhân ghép tạng đặc, ghép tim và ghép phổi.
c. Điều trị thuốc kháng nấm ở nhóm bệnh nhân có nguy cơ cao
▪ Nhóm bệnh nhân không có bệnh về tế bào máu ác tính.
– Ghép tạng đặc (gan, thận, phổi…):
+ Nằm ở khoa có mật độ bào tử nấm nấm trong không khí Aspergillus cao
+ Bệnh nhân ghép đang điều trị các thuốc ức chế miễn dịch, trước ghép 2-4 tuần có điều trị corticosteroid, thải ghép cấp hoặc mạn, hoặc có bạch cầu đa nhân trung tính trong máu dưới 500/ml.
+ Nhận tạng của người mắc CMV hoặc tạng ghép bị thiếu máu kéo dài
– Người nhiễm HIV có số lượng CD4 < 100 tế bào/ml, hoặc giai đoạn lâm sàng 3 hoặc 4.
– Bệnh nhân ở đơn vị hồi sức cấp cứu:
+ Suy gan cấp, bỏng diện rộng, nhiễm trùng nặng, suy dinh dưỡng
+ Bệnh nhân COPD có 1 trong các đặc điểm: điều trị corticosteroid liều cao kéo dài, không đáp ứng với thuốc kháng sinh đang điều trị
+ Lâm sàng: sốt kéo dài ≥96 giờ không đáp ứng với kháng sinh phổ rộng, hoặc có giảm bạch cầu trung tính <500/ml
– Bệnh nhân đang điều trị các thuốc ức chế TNF-α, các thuốc kháng thể đơn dòng (rituximab, basiliximab, daclizumab…)
– Thuốc điều trị:
+ Caspofungin 70 mg ngày đầu, tiếp theo 50 mg/ngày
+ Amphotericin B liposomal* 3 mg/kg hoặc amphotericin B phức hợp lipid 5 mg/kg/ngày
+ Voriconazole 6 mg/kg x 2 lần/ngày truyền tĩnh mạch (uống 400 mg x 2 lần/ngày) ngày 1, sau đó 4 mg/kg x 2 lần từ ngày thứ 2 tĩnh mạch, (uống 200-300 mg x 2 lần/ngày).
+ Itraconazole 200 mg/ngày truyền tĩnh mạch
▪ Nhóm bệnh nhân mắc bệnh tế bào máu ác tính
– Bệnh nhân mắc một trong các bệnh: tế bào máu ác tính (bệnh bạch cấu cấp…), ghép tủy đồng loài, rối loạn sinh tủy có bạch cầu trung tính dưới 0,5×109/l, kéo dài > 7 ngày.
– Thuốc:
+ Posaconazole 200 mg 3 lần/ngày nhũ dịch uống hoăc 300mg x 4 lần/ngày (khuyến cáo A).
+ Amphotericin B liposomal* 12.5 mg x 2/tuần khí dung (khuyến cáo B)
+ Hoặc voriconazole 200 mg x 2 lần/ngày, micafungin 50mg/ngày (khuyến cáo C).
4.2.2. Điều trị nhiễm Aspergillus ngoài phổi
a. Nhiễm Aspergillus máu
– Bình thường hiếm khi phân lập được nấm Aspergillus trong máu.
– Nhóm bệnh nhân nhiễm Aspergillus xâm lấn có tỷ lệ tổn thương ở nhiều cơ quan và tình trạng sốc nhiễm khuẩn phải duy trì thuốc vận mạch cao, tỷ lệ tử vong ở nhóm này rất cao. Các yếu tố nguy cơ của nhóm bệnh nhân này bao gồm đái đường, COPD, dùng thuốc ức chế miễn dịch kéo dài, tình trạng nhiễm khuẩn nặng, ung thư, ghép tạng đặc…
– Điều trị giống như với nhiễm nấm Aspergillus xâm lấn phổi.
b. Nhiễm Aspergillus ngoài phổi khác
Bảng 4.7. Điều trị nhiễm Aspergillus ngoài phổi
|
Cơ quan nhiễm nấm Aspergillus xâm lấn |
Điều trị lựa chọn ưu tiên |
Điều trị thay thế |
Điều trị khác |
| Thần kinh trung ương (TKTU) | Voriconazole 6mg/kg mỗi 12h truyền TM ngày 1, sau đó 4 mg/kg truyền TM mỗi 12h các ngày tiếp theo
Hoặc voriconazole uống 400mg ngày 1, những ngày sau 200-300mg |
AmB liposomal | |
| Tim (viêm nội tâm mạc, màng ngoài tim, cơ tim) | Như nhiễm nấm TKTU | AmB liposomal | Kết hợp phẫu thuật van tim, đề phòng tắc mạch. Xem xét thuốc kháng nấm suốt đời sau phẫu thuật van tim |
| Viêm khớp, viêm tủy xương | Như nhiễm nấm TKTU | Nên kết hợp can thiệp phẫu thuật | |
| Nội nhãn | Như nhiễm nấm TKTU đường uống/TM | Amphoteri cin B deoxychol ate | Kết hợp tiêm dịch kính Amphotericin B deoxycholate |
| Xâm lấn xoang mũi | Như nhiễm nấm TKTU | AmB liposomal | Phẫu thuật cắt u nấm |
| Tai (viêm tai giữa) | Kháng nấm tại chỗ, bôi, làm thuốc. Nhiễm trùng nặng: voriconazole toàn thân | Bôi axit boric tai | Làm sạch ống tai, kết hợp phẫu thuật |
| Phúc mạc | Như nhiễm nấm TKTU đường toàn thân | Rút các thiết bị trong ổ bụng, bỏ lọc máu phúc mạc | |
| Da | Như nhiễm nấm TKTU | Nên kếp hợp điều trị tại chỗ, phẫu thuật nếu cần | |
| Dạ dày, thực quản, ruột, ruột, gan | Như nhiễm nấm TKTU | AmB liposomal khi nhiễm nấm gan | Phẫu thuật dự phòng xuất huyết, thủng, tắc nghẽn, nhồi máu |
| Thận (tổn thương nhu mô thận, tắc nghẽn niệu quản…) | Như nhiễm nấm TKTU | ||
| Giác mạc | Điều trị tại chỗ: nhỏ voriconazole, natamycin 5% |
4.2.3. Một số lưu ý trong điều trị nhiễm nấm Aspergillus a.
Điều trị cứu cánh
– Chỉ định khi tình trạng người bệnh tiển triển xấu đi ngay khi đang điều trị thuốc kháng nấm, tuy nhiên trước khi kết luận nguyên nhân xấu đi do thuốc kháng nấm không có hiệu quả cần phải xem xét kỹ lưỡng tổng thể các yếu tố liên quan như; mức độ nặng, tốc độ và sự lan rộng của nhiễm khuẩn, các bệnh lí phối hợp nhằm mục đích loại trừ tiến triển xấu đó là do các căn nguyên mới.
– Chiến lược điều trị cứu cánh bao gồm: (i) thay đổi thuốc kháng nấm thuộc các nhóm khác nhau có tác dụng; (ii) điều chỉnh hoặc đảo ngược tình trạng ức chế miễn dịch nếu có thể; (iii) phẫu thuật cắt bỏ tổ chức hoại tử trong các trường hợp có chỉ định.
– Có thể phối hợp các thuốc kháng nấm khác nhóm nếu nhiễm nấm Aspergillus xâm lấn kháng trị (xem phần 3.2).
– Khi thay đổi thuốc kháng nấm vì lý do tác dụng phụ của thuốc, tránh thay các thuốc kháng nấm mới có tác dụng phụ tương tự.
– Sử dụng thuốc kháng nấm nhóm triazole cho liệu pháp điều trị cứu cánh cần xem xét tổng thể: kháng nấm triazole đã dùng trước đó chưa, yếu tố vật chủ, các yếu tố dược lực học của thuốc và khả năng đề kháng với thuốc kháng nấm triazole.
– Các biện pháp cải thiện hay đảo ngược miễn dịch trong điều trị cứu cánh:
+ Giảm liều hoặc bỏ hoàn toàn thuốc ức chế miễn dịch nếu có thể.
+ Bệnh nhân giảm bạch cầu hạt, xem xét dùng các chất kích thích dòng bạch cầu.
+ Dùng interferon-γ tái tổ hợp dự phòng ở bệnh nhân u hạt mạn tính.
b. Phối hợp thuốc kháng nấm
– Không khuyến cáo phối hợp điều trị thuốc kháng nấm như là một lựa chọn đầu tay cho tất cả các trường hợp nhiễm nấm và nghi ngờ nhiễm nấm Aspergillus.
– Trường hợp Voriconazole có MIC = 2mg/ml: phối hợp voriconazole và echonocandin hoặc điều trị Amphotericin B liposomal* đơn độc (ví dụ nhiễm nấm Aspergillus ở bệnh nhân bệnh phổi mạn)
– Voriconazole có MIC > 2mg/ml: lựa chọn Amphotericin B liposomal*; amphotericin B phức hợp lipid; Voriconazole kết hợp với anidulafungin*; Posaconazole kết hợp caspofungin.
c. Theo dõi nồng độ thuốc kháng nấm
– Nên tiến hành theo dõi nồng độ thuốc Itraconazole, Voriconazole, Posaconazole và Isavuconazole* trong quá trình điều trị nhiễm nấm Aspergillus xâm lấn.
– Itraconazole: đích liều dự phòng là đạt nồng độ đáy 0,4 – 5mg/L, mẫu được lấy sau khi bắt đầu liệu trình điều trị 5 – 7 ngày, sau đó định lượng hàng tuần.
– Voriconazole: đích liều dự phòng là nồng độ đáy đạt 1 – 5,5 mg/L, nồng độ đáy đạt 2-6 mg/L là phù hợp cho các bệnh nhân nhiễm nấm nặng, lấy mẫu định lượng sau 2-5 ngày bắt đầu liệu trình điều trị và nhắc lại cho đến khi đạt được nồng độ đích.
– Posaconazole: đích cho liều dự phòng nồng độ đáy cần đạt > 0,7 mg/L, đích điều trị cho bệnh nhân có bằng chứng hay nghi ngờ nhiễm nấm Aspergillus xâm lấn cần đạt > 1mg/L, lấy mẫu định lượng nồng độ vào ngày thứ 5 từ khi bắt đầu liệu trình điều trị.
– Isavuconazole*: nồng độ đích đạt hiệu quả điều trị là 2-3 mg/L, lấy mẫu ngày thứ 5 từ khi bắt đầu liệu trình điều trị.
d. Theo dõi đáp ứng điều trị
Nên xét nghiệm GM huyết thanh liên tiếp ở những bệnh nhân có bệnh gan ác tính hoặc có ghép tế bào gốc tạo máu mà có nền GM tăng cao, nhằm đánh giá tiến triển và đáp ứng điều trị cũng như tiên lượng kết quả điều trị thuốc kháng nấm.
4.3. Nhiễm nấm Cryptococcus
4.3.1. Nhiễm nấm Cryptococcus ở người HIV (-)
a. Bệnh nhân không có giảm miễn dịch, không tổn thương thần kinh trung ương, bệnh lý ở phổi hoặc ngoài phổi mức độ nhẹ (1 ổ), hoặc nuôi cấy dương tính nhưng không có triệu chứng
– Lựa chọn ưu tiên: fluconazole: 400-800 mg/ngày, uống 1 lần, trong 6 tháng
– Hoặc: itraconazole: 400 mg/ngày, uống 1-2 lần, trong 6 tháng
– Lựa chọn thay thế khi có chống chỉ định với nhóm azole: amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày.
Trường hợp lựa chọn điều trị như trên không hiệu quả (không cải thiện tình trạng sau 2 tuần điều trị hoặc tình trạng bệnh nhân xấu đi), thay thế bằng:
Lựa chọn ưu tiên:
– amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày;
hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày;
hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ.
Lựa chọn thay thế:
– fluconazole: 400-800 mg/ngày, uống 1 lần và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ.
Xem xét chỉ định phẫu thuật khi tổn thương ở xương, phổi tồn tại kéo dài hoặc không đáp ứng điều trị.
b. Bệnh nhân có giảm miễn dịch, hoặc có tổn thương thần kinh trung ương, hoặc tổn thương ở phổi hay ngoài phổi mức độ nặng không kèm theo tổn thương thần kinh trung ương
Điều trị tấn công
Lựa chọn ưu tiên:
amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày;
hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ, điều trị trong 2 tuần, sau đó nếu dịch não tủy âm tính:
fluconazole: 400-800 mg/ngày, uống 1 lần;
hoặc itraconazole: 400 mg/ngày, uống 1-2 lần trong 8 tuần
Lựa chọn thay thế: điều trị trong 6 đến 10 tuần
amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ; hoặc amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày và fluconazole: 400-800 mg/ngày, uống 1 lần.
hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ (trong 2 tuần); hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày và fluconazole: 400-800 mg/ngày, uống 1 lần.
hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ (trong 2 tuần); hoặc amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày và fluconazole: 400-800 mg/ngày, uống 1 lần.
Lựa chọn khác: điều trị trong 6 đến 10 tuần
fluconazole: 400-800 mg/ngày, uống 1 lần và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ.
Điều trị duy trì
fluconazole: 200 mg/ngày, uống 1 lần.
Điều trị hỗ trợ khác
– Dẫn lưu dịch não tủy khi có tăng áp lực nội sọ (chọc tủy sống qua da).
– Xem xét chỉ định phẫu thuật khi tổn thương ở xương, phổi, thần kinh trung ương tồn tại kéo dài hoặc không đáp ứng điều trị.
4.3.2. Nhiễm nấm Cryptococcus ở người HIV (+)
a. Viêm màng não do Cryptococcus
Điều trị bao gồm 3 giai đoạn: tấn công, củng cố, và duy trì
Điều trị tấn công: trong ít nhất là 2 tuần
Lựa chọn ưu tiên:
amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày;
hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày;
và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ
Lựa chọn thay thế:
amphotericin B phức hợp lipid: 5 mg/kg tiêm TM, 1 lần/ngày và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ;
hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày và fluconazole: 800 mg/ngày, uống hoặc tiêm TM;
hoặc amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày và fluconazole: 800 mg/ngày, uống hoặc tiêm TM;
hoặc amphotericin B liposomal*: 3-6 mg/kg tiêm TM, 1 lần/ngày; hoặc amphotericin B deoxycholate: 0,7 – 1 mg/kg tiêm TM, 1 lần/ngày;
hoặc fluconazole 400 mg/ngày, uống hoặc tiêm TM và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ; hoặc
fluconazole: 800 mg/ngày, uống hoặc tiêm TM và flucytosine: 100 mg/kg/ngày, chia 4 lần uống mỗi 6 giờ; hoặc
fluconazole: 1200 mg/ngày, uống hoặc tiêm TM
Điều trị củng cố: trong ít nhất là 8 tuần
Bắt đầu sau 2 tuần điều trị tấn công thành công (tình trạng lâm sàng cải thiện và cấy lại dịch não tủy âm tính)
Lựa chọn ưu tiên:
fluconazole 400 mg/ngày, uống hoặc tiêm TM Lựa chọn thay thế:
itraconazole: 400 mg/ngày, uống chia 2 lần
Điều trị duy trì
fluconazole 200 mg/ngày, uống trong ít nhất 1 năm.
Ngừng điều trị duy trì: khi thỏa mãn tiêu chuẩn dưới đây
Điều trị ban đầu đầy đủ (tấn công, củng cố) và điều trị duy trì ít nhất 1 năm, và
Không có triệu chứng nhiễm Cryptococcus, và
CD4 ≥ 100 tế bào/mm3 trong ≥ 3 tháng và điều trị HIV bằng ART thành công (tải lượng HIV dưới ngưỡng ức chế).
Điều trị duy trì trở lại khi CD4 giảm ≤ 100 tế bào/mm3.
Không ngừng điều trị duy trì cho trẻ em dưới 2 tuổi. Đối với trẻ từ 2-5 tuổi ngừng điều trị duy trì khi trẻ ổn định và điều trị ARV cùng với thuốc kháng nấm duy trì ít nhất 1 năm và có tỉ lệ % CD4 > 25% hoặc số lượng CD4 > 750 tế bào/mm3.
b. Nhiễm Cryptococcus ngoài phổi hoặc tổn thương phổi lan tỏa, không có tổn thương thần kinh trung ương
Điều trị giống nhiễm Cryptococcus có tổn thương thần kinh trung ương.
c. Nhiễm Cryptococcus tổn thương phổi một ổ, không có tổn thương thần kinh trung ương và có kháng nguyên Cryptococcus trong máu fluconazole 400 mg/ngày, uống trong 12 tháng.
Lưu ý
Ở phụ nữ có thai, lựa chọn điều trị an toàn nhất là dùng amphotericin B phức hợp lipid hoặc amphotericin B liposomal*. Dùng flucytosine và dùng fluconazole trên 400 mg/ngày có thể gây dị tật bẩm sinh cho thai nhi.
Echinocandin không có tác dụng trên Cryptococcus.
4.4. Viêm phổi do Pneumocystic Jirovecii
Tất cả bệnh nhân suy giảm miễn dịch có bằng chứng viêm phổi do Pneumocystic jirovecii phải điều trị bằng Trimethoprim 15-20 mg/kg/ngày và Sulfamethoxazole 75-100 mg/kg/ngày chia bốn liều hàng ngày. Định lượng được nồng độ thuốc Sulfamethoxazole hoặc Trimethoprim là cần thiết và bắt buộc ở bệnh nhân dùng đường tĩnh mạch. Thời gian điều trị thông thường là 3 tuần. Ít nhất điều trị 7 – 10 ngày mới có đáp ứng lâm sàng.
Điều trị thay thế gồm Primaquine 30 mg/ngày phối hợp với Clindamycin 600 mg ba lần/ngày; hoặc Atovaquone đơn trị liệu 750 mg hai lần/ngày; hoặc Pentamidine đường tĩnh mạch 4 mg/kg/ngày.
Điều trị bổ sung kháng sinh ở bệnh nhân nhiễm HIV có viêm phổi do Pneumocystis mức độ trung bình đến nặng biểu hiện thiếu oxy máu nặng (Pa02 < 70 mmHg thở khí trời hoặc chênh áp oxy phế nang-động mạch > 35). Các bệnh nhân này nên được điều trị thêm prednisone 40 mg hai lần/ngày trong 5 ngày, sau đó 40 mg/ngày từ ngày thứ 6 đến thứ 11 và sau đó là 20 mg/ngày đến ngày thứ 2.
Điều trị dự phòng bằng co-trimoxazole có hiệu quả ngăn ngừa viêm phổi do Pneumocystis jirovecii, được khuyến cáo cho người lớn, phụ nữ mang thai, đang cho con bú và trẻ phơi nhiễm hoặc nhiễm HIV:
– Trẻ phơi nhiễm với HIV: bắt đầu điều trị cho tất cả các trẻ, bắt đầu từ 4 – 6 tuần sau sinh, cho đến khi hết nguy cơ lây truyền HIV hoặc trẻ được khẳng định không nhiễm HIV.
– Trẻ ≤ 5 tuổi nhiễm HIV: bắt đầu điều trị cho Tất cả các trẻ, Ngừng khi trẻ được 5 tuổi.
– Trẻ nhiễm HIV ≥ 5 tuổi: bắt đầu điều trị khi CD4 ≤ 350 tế bào/mm3 hoặc giai đoạn lâm sàng 3 hoặc 4. Ngừng khi lâm sàng ổn định (điều trị ARV ít nhất 12 tháng và không có biểu hiện của nhiễm HIV giai đoạn lâm sàng 2, 3, 4) và tải lượng HIV dưới 200 bản sao/ml hoặc CD4 > 350 tế bào/mm3.
– Người trưởng thành, phụ nữ mang thai, đang cho con bú nhiễm HIV: bắt đầu điều trị khi CD4 ≤ 350 tế bào/mm3 hoặc giai đoạn lâm sàng 3 hoặc 4. Ngừng khi lâm sàng ổn định (điều trị ARV ít nhất 12 tháng và không có biểu hiện của nhiễm HIV giai đoạn lâm sàng 2, 3, 4) và CD4 > 350 tế bào/mm3 hoặc tải lượng HIV dưới 200 bản sao/ml.
4.5. Nhiễm nấm Talaromyces Marneffei
Nên bắt đầu điều trị bằng thuốc kháng nấm ngay khi được chẩn đoán.
Phân loại mức độ:
Nặng: tổn thương nhiều cơ quan kèm suy hô hấp hoặc suy tuần hoàn.
Trung bình: tổn thương nhiều cơ quan không kèm suy hô hấp hoặc suy tuần hoàn.
Nhẹ: chỉ có tổn thương da.
Điều trị ban đầu:
Nhiễm Talaromyces marneffei mức độ trung bình đến nặng: Dẫn xuất lipid của amphotericin B truyền tĩnh mạch (3 đến 5 mg/kg/ngày) hoặc phức hợp lipid amphotericin B (ABLC) (5 mg/kg/ngày) trong hai tuần, tiếp theo là itraconazole (200 mg x 2 lần/ngày) trong 10 tuần.
Nhiễm nấm Talaromyces marneffei hệ thần kinh trung ương: Dẫn xuất lipid của amphotericin B truyền tĩnh mạch 5 mg/kg/ngày từ 4 đến 6 tuần, tiếp theo là itraconazole (200 mg x 2 lần/ngày) trong 10 tuần.
Điều trị thay thế:
Nhiễm Talaromyces marneffei mức độ trung bình đến nặng: Voriconazole tiêm tĩnh mạch (6 mg/kg mỗi 12 giờ vào ngày đầu, tiếp theo là 4 mg/kg mỗi 12 giờ) trong 3 ngày, sau đó chuyển sang uống voriconazole (200 mg x 2 lần/ngày) trong 12 tuần.
Nhiễm Talaromyces marneffei mức độ nhẹ: Uống itraconazole (200 mg x 2 lần/ngày) trong 8 đến 12 tuần mà không điều trị bằng amphotericin B. Điều trị thay thế bằng voriconazole đường uống 400 mg mỗi ngày một lần vào ngày thứ nhất, tiếp theo là 200 mg x 2 lần/ngày trong 12 tuần.
4.6. Nhiễm nấm khác
4.6.1. Nhiễm nấm Coccidioides immitis phổi
Điều trị thuốc kháng nấm ngay tại thời điểm chẩn đoán có triệu chứng suy kiệt, bệnh nhân có bệnh phổi lan tỏa hoặc có bệnh đồng mắc như đái tháo đường.
Điều trị ban đầu bằng azole đường uống với liều ≥ 400mg/ngày ở bệnh nhân không có thai.
Nhiễm nấm Coccidioides immitis phổi dạng nốt không triệu chứng không phải điều trị.
Nhiễm nấm Coccidioides immitis phổi dạng hang không triệu chứng điều trị thuốc kháng nấm.
Viêm phổi mạn tính do nấm Coccidioides immitis nên điều trị bằng đường uống bằng fluconazole hoặc itraconazole. Điều trị bằng phẫu thuật (nội soi lồng ngực) khi tổn thương tồn tại trên 2 năm và triệu chứng còn tồn tại sau dừng điều trị thuốc kháng nấm.
Ở bệnh nhân vỡ hang nấm Coccidioides nên nhanh chóng bóc vỏ và giải phẫu hang nấm. Nếu vỡ ra khoang màng phổi nên đặt sonde dẫn lưu màng phổi. Điều trị thuốc bằng azole đường uống hoặc Amphotericin B nếu bệnh nhân không dung nạp azole hoặc đã trải qua hai lần phẫu thuật.
Các thuốc kháng nấm điều trị nhiễm nấm Coccidioides:
|
Thuốc |
Liều |
Ghi chú |
| Amphotericin B | 0,5 – 1 mg/kg/ngày IV | Điều trị ban đầu |
| Fluconazole | Dự phòng: 200mg/ngày
Thấp: 400mg/ngày hoặc 6 – 12mg/kg/ngày Cao: 800 – 1200mg/ngày |
FDA không phê duyệt |
| Itraconazole | 200mg mối 12h | FDA không phê duyệt |
| Posaconazole | 400mg mỗi 12h đường uống | FDA không phê duyệt |
| Voriconazole | 200mg hoặc 4 mg/kg mỗi 12h | FDA không phê duyệt |
4.6.2. Nhiễm nấm Histoplasma phổi
* Nhiễm nấm Histoplasma phổi cấp mức độ trung bình đến nặng
Điều trị bằng dẫn xuất lipid của Amphotericin B với liều 3 – 5 mg/kg/ngày truyền TM trong 1 – 2 tuần, sau đó chuyển sang Itraconazole 200 mg 3 lần/ngày trong 3 ngày và tiếp theo duy trì 200 mg/ngày, tổng thời gian điều trị itraconazole là 12 tuần.
Điều trị thay thế bằng Amphotericin B deoxycholate với liều 0.7 – 1,0 mg/kg/ngày truyền tĩnh mạch) ở bệnh nhân có nguy cơ thấp độc cho thận.
Methylprednisolone 0,5-1,0 mg/kg/ngày tiêm tĩnh mạch trong 1-2 tuần đầu tiên điều trị chống nấm nên dùng ở bệnh nhân có biến chứng hô hấp như giảm nồng độ oxy trong máu hoặc suy hô hấp.
* Nhiễm nấm Histoplasma phổi cấp mức độ nhẹ đến trung bình
Điều trị là thường không cần thiết.
Bệnh nhân có triệu chứng kéo dài > 1 tháng nên điều trị bằng Itraconazole 200 mg 3 lần/ngày trong 3 ngày và sau đó 200 mg một hoặc hai lần/ngày trong 6-12 tuần).
* Nhiễm nấm Histoplasma phổi mạn tính
Điều trị bằng Itraconazole 200 mg 3 lần/ ngày trong 3 ngày, sau đó một lần/ngày hoặc hai lần/ngày trong ít nhất 1 năm. Có thể duy trì 18-24 tháng để ngăn nguy cơ tái phát.
Nên định lượng nồng độ trong máu của Itraconazole sau khi bệnh nhân điều trị được ít nhất 2 tuần để đảm bảo tiếp xúc với thuốc thích hợp.
4.6.3. Nhiễm nấm Sporothrix schenckii phổi
Đối với trường hợp nhiễm nấm Sporothrix phổi nghiêm trọng hoặc đe dọa tính mạng, điều trị bằng dẫn xuất lipid của Amphotericin B 3 – 5 mg/kg/ngày hoặc có thể dùng Amphotericin B deoxycholate 0,7-1,0 mg/kg/ngày.
Sau khi bệnh nhân có phản ứng tích cực với điều trị Amphotericin B, có thể được thay thế duy trì tiếp bằng Itraconazole 200 mg hai lần/ngày đường uống trong 12 tháng.
Đối với trường hợp nhiễm nấm Sporothrix phổi ít nghiêm trọng, điều trị bằng Itraconazole 200 mg hai lần/ngày đường uống trong 12 tháng
Nên định lượng nồng độ trong máu của Itraconazole sau khi bệnh nhân điều trị được ít nhất 2 tuần để đảm bảo tiếp xúc với thuốc thích hợp.
Nếu tổn thương khu trú nên kết hợp phẫu thuật với liệu pháp Amphotericin B.
4.6.4. Nhiễm nấm Blastomyces phổi
Đối với trường hợp nhiễm nấm phổi Blastomyces mức độ trung bình đến nặng, điều trị ban đầu bằng dẫn xuất lipid amphotericin B 3 – 5 mg/kg/ngày hoặc Amphotericin B deoxycholate 0,7-1 mg/kg/ngày trong 1-2 tuần hoặc cho đến khi cải thiện, sau đó điều trị tiếp theo bằng Itraconazole 200 mg 3 lần/ngày đường uống trong 3 ngày và 200 mg hai lần/ngày đến khi tổng thời gian điều trị là 6 đến12 tháng.
Đối với trường hợp nhiễm nấm phổi Blastomyces mức độ nhẹ đến trung bình, điều trị bằng Itraconazole 200 mg 3 lần/ngày đường uống trong 3 ngày và 200 mg hai lần/ngày đến khi tổng thời gian điều trị là 6-12 tháng
Nên định lượng nồng độ trong máu của Itraconazole sau khi bệnh nhân điều trị được ít nhất 2 tuần để đảm bảo tiếp xúc với thuốc thích hợp.
4.7. Nhiễm một số loài nấm hiếm gặp khác
Các loại nấm hiếm khác mới gồm Zygomyces, nấm màu sáng của hyaline (Hyalohyphomycoses), nấm chứa sắc tố melanin trong vách tế bào (Phaeohyphomycoses) và nhiễm nấm Trichosporon.
Phác đồ điều trị:
|
Nấm |
Điều trị ban đầu |
Điều trị thay thế |
| Zygomyces | Dẫn xuất lipid của Amphotericin B 5 mg/kg/ngày hoặc Amphotericin B deoxycholate 0,7 – 1 mg/ kg/ngày | Posaconozole 400 mg uống hai lần/ngày hoặc 200 mg uống 4 lần/ngày |
| Paecilomyces/ Trchosporon | Voriconazole | Posaconazole |
| Fusarium | Voriconazole hoặc Posaconazole hoặc dẫn xuất lipid của Amphotericin B | |
| Scedosporium apiospernum | Voriconazole 200 mg đường tĩnh mạch hoặc uống hai lần/ ngày; hoặc posaconozole 200 mg bốn lần/ngày | |
| Scedosporium prolificans | Chưa xác định | |
| Phaeohyphomyces | Itraconazole hoặc voriconazole 200 mg đường uống hai lần/ngày | Posaconazole 200 mg bốn lần/ngày, flucytosine 100mg/kg/ngày |
CHƯƠNG 5. CÁC BIỆN PHÁP KHÁC DỰ PHÒNG NHIỄM NẤM XÂM LẤN
5.1. Bệnh nhân ngoại trú
Tránh các khu vực có nhiều bụi bẩn ô nhiễm như công trường xây dựng, phòng ở hoặc nhà ẩm mốc. Đeo khẩu trang dự phòng khi đi vào các khu vực ô nhiễm.
Hạn chế tiếp xúc với môi trường bụi bẩn, tránh làm các hoạt động nông nghiệp, tiếp xúc với đất, phân bón. Đeo đầy đủ dụng cụ bảo hộ như khẩu trang, găng tay, ủng khi phải làm việc trong môi trường bẩn, ô nhiễm.
5.2. Bệnh nhân nội trú
5.2.1. Cách ly bệnh nhân
– Bệnh nhân có yếu tố nguy cơ cao như bệnh nhân suy giảm miễn dịch, bệnh nhân điều trị hóa chất, bệnh nhân sau ghép tạng cần được nằm điều trị tại phòng cách ly để giảm nguy cơ nhiễm nấm.
– Bệnh nhân có nguy cơ cao nằm phòng cách ly, không nằm chung phòng với với các bệnh nhân đang có bệnh nhiễm trùng.
5.2.2. Các yêu cầu của phòng cách ly
– Về thông khí phòng, phòng bệnh nhân có hệ số trao đổi không khí trên 12;
– Phòng cách ly nên có hệ thống tạo áp lực không khí dương;
– Phòng cách ly nên trang bị bộ lọc không khí HEPA cho phép loại bỏ các phân tử bụi, bào tử nấm có kích thước > 0,3 micromet đường kính.
– Không cho phép những người đang mắc bệnh nhiễm trùng cấp tính vào thăm bệnh nhân trong phòng cách ly.
– Không mang cây cối, hoa vào trong phòng cách ly.
5.2.3. Thực hiện tốt vệ sinh răng miệng
– Đánh răng ít nhất 2 lần/ngày
– Không dùng chung bàn chải đánh răng
– Súc miệng bằng nước muối ấm
– Các trường hợp nhiễm nấm Candida vùng miệng nhẹ có thể dùng 1 số nhóm thuốc để điều trị tại chỗ như: Clotrimazol, Miconazol, Nystatin… Nếu tình trạng không cải thiện nên chuyển sang Fluconazol đường toàn thân.
– Phát hiện và điều trị kịp thời nhiễm nấm vùng miệng mũi và hầu họng
5.3. Tuân thủ các quy tắc về vệ sinh bàn tay và mang găng
Vệ sinh tay bằng cồn hoặc chlorhexidine có hiệu quả trong việc làm giảm tỷ lệ lây nhiễm Candida.
Các thời điểm cần vệ sinh tay:
– Trước khi chạm vào bệnh nhân.
– Trước các thủ thuật sạch và vô trùng
– Sau khi phơi nhiễm với dịch cơ thể của bệnh nhân.
– Sau khi chạm vào bệnh nhân.
– Sau khi tiếp xúc vào môi trường xung quanh bệnh nhân.
Các quy tắc về sử dụng găng tay:
– Mang găng tay vô khuẩn khi thực hiện các thủ thuật vô trùng như đặt đường truyền trung tâm, đặt ống sonde bàng quang.
– Mang găng tay sạch khi làm tiếp xúc với máu, dịch tiết cơ thể và các chất tiết và dụng cụ có nguy cơ gây nhiễm khuẩn chéo.
– Thay găng khi làm các thủ thuật khác nhau trên cùng một bệnh nhân đặc biệt khi thay đổi vị trị tiếp xúc trên cở thể bệnh nhân từ vùng bị nhiễm trùng đến vùng sạch.
– Không sử dụng chung găng tay khi chăm sóc cho nhiều bệnh nhân.
– Vứt bỏ găng sau khi hoàn thành thủ thuật.
– Rửa tay sau khi bỏ găng.
Đối với các bệnh nhân có đường truyền tĩnh mạch trung tâm:
– Ưu tiên đặt đường truyền tĩnh mạch ở phía trên cao (vùng cổ, chi trên).
– Kiểm tra chân catheter và thay băng hàng ngày.
– Đánh giá mức độ cần thiết hàng ngày của đường truyền tĩnh mạch trung tâm và rút sớm ngay khi có thể.
PHỤ LỤC 1: LIỀU DÙNG CÁC THUỐC CHỐNG NẤM
|
TT |
Tên hoạt chất |
Đường dùng |
Liều thông thường |
Liều dùng cho bệnh nhân suy thận |
Liều dùng cho bệnh nhân suy gan |
||
| I. Nhóm Polyen | |||||||
| 1 | Amphotericin B deoxycholat | Truyền TM | Người lớn:
Liều thường dùng: 0,8 – 1 mg/kg/ngày Liều tối đa: 1,5 mg/kg/ngày (đối với BN nặng) |
Suy thận, lọc máu: Không cần chỉnh liều | Không cần chỉnh liều | ||
| 2 | Amphotericin B phức hợp lipid | Truyền TM | Người lớn: 3- 5 mg/kg/ngày | Suy thận, lọc máu: Không cần chỉnh liều | Không cần chỉnh liều | ||
| II. Nhóm Echinocandin | |||||||
| 3 | Caspofungin | Truyền TM | Người lớn:
Liều nạp: 70 mg/ngày đầu Liều duy trì: – Cân nặng ≤ 80 kg: liều 50 mg/ngày – Cân nặng > 80 kg: liều 70 mg/ngày |
Suy thận, lọc máu: Không cần chỉnh liều | Người lớn:
Suy gan mức độ TB (Child-Pugh từ 7 – 9 điểm): Liều nạp: 70 mg/ ngày đầu. Liều duy trì: 35 mg/ngày Suy gan mức độ nặng: Chưa có dữ liệu lâm sàng |
||
| Trẻ em (12 tháng – 17 tuổi):
Liều nạp: 70 mg/m2/ngày đầu (không vượt quá 70 mg) Liều duy trì: 50 mg/m2/ngày. Có thể tăng liều lên 70 mg/m2 (không vượt quá 70 mg/ngày)
|
Trẻ em: chưa có dữ liệu lâm sàng | ||||||
| 4 | Micafungin | Truyền TM | Người lớn, TE ≥ 4 tháng tuổi | Trẻ em < 4 tháng (gồm cả trẻ sơ sinh) | Suy thận, lọc máu: Không cần chỉnh liều | BN suy gan nhẹ và TB: Không cần chỉnh liều
BN suy gan nặng: Khuyến cáo không sử dụng |
|
| Điều trị Candida xâm lấn | > 40 kg: 100 mg/ngày (có thể tăng lên 200 mg/ngày)
≤ 40 kg: 2 mg/kg/ngày (có thể tăng lên 4 mg/kg/ngày) |
4 -10 mg/kg/ngày | |||||
| Dự phòng nhiễm Candida | > 40 kg: 50 mg/ngày
≤ 40 kg: 1 mg/kg/ngày |
2 mg/kg/ngày | |||||
| III. Nhóm Azol | |||||||
| 5 | Fluconazol | Uống Truyền TM | Người lớn
Liều nạp: 800 mg/ngày đầu (12 mg/kg) Liều duy trì: 400 mg/ngày (6 mg/kg) |
Clcr ≤ 50 ml/phút: Giảm 50% liều mỗi 24 giờ
Lọc máu ngắt quãng: bổ sung 100% liều sau lọc (ngày không lọc tính liều theo Clcr) Lọc máu liên tục: 200-400 mg mỗi 24 giờ |
Không cần chỉnh liều
Sử dụng thận trọng |
||
| Trẻ em từ 28 ngày tuổi – 17 tuổi: 6 – 12 mg/kg/ngày. Tối đa 400 mg/ngày | Chưa có nghiên cứu trên trẻ em suy thận | ||||||
| Trẻ sơ sinh 0 -14 ngày tuổi: 6 – 12 mg/kg mỗi 72 giờ
Trẻ sơ sinh 15 – 27 ngày tuổi: 6 – 12 mg/kg mỗi 48 giờ |
|||||||
| 6 | Itraconazol | Truyền TM | Người lớn:
Liều nạp: 200mg mỗi 12 giờ (ngày 1 và 2) Liều duy trì: 200mg mỗi 24 giờ (từ ngày thứ 3 trở đi) Liều cho trẻ em: dữ liệu còn hạn chế. Khuyến cáo không nên sử dụng. |
Clcr < 30 ml/phút:
Chống chỉ định do tích lũy tá dược hydroxypropyl-β- cyclodextrin |
Sử dụng thận trọng | ||
| Uống (viên) | Người lớn: 200 mg mỗi 12 giờ
Trẻ em: Khuyến cáo không sử dụng. |
Không cần chỉnh liều
Sử dụng thận trọng |
Sử dụng thận trọng | ||||
| 7 | Voriconazol | Truyền TM | Người lớn, trẻ em > 15 tuổi hoặc trẻ em 12 – 14 tuổi có cân nặng ≥ 50 kg
Liều nạp: 6 mg/kg mỗi 12 giờ (trong 24 giờ đầu) Liều duy trì: 4 mg/kg mỗi 12 giờ |
Clcr < 50 ml/phút: Chuyển sang đường uống hoặc dừng thuốc do tích lũy tá dược Sulfobutylether beta cyclodextrin sodium
BN lọc máu: tránh sử dụng Trẻ 2 – <12 tuổi suy thận chưa có nghiên cứu |
Suy gan mức độ nhẹ và TB (Child-Pugh A, B):
Sử dụng liều nạp như bình thường. Liều duy trì: 50% liều duy trì bình thường Suy gan mức độ nặng (Child-Pugh C): chưa có nghiên cứu Trẻ 2 – <12 tuổi suy gan chưa có nghiên cứu |
||
| Trẻ em (2 – <12 tuổi hoặc 12 – 14 tuổi có cân nặng < 50 kg)
Liều nạp: 9 mg/kg mỗi 12 giờ (trong 24 giờ đầu) Liều duy trì: 8 mg/kg mỗi 12 giờ |
|||||||
| Uống | Người lớn, trẻ em > 15 tuổi hoặc trẻ em 12 – 14 tuổi có cân nặng ≥ 50 kg
Liều nạp: 400 mg mỗi 12 giờ (trong 24 giờ đầu) Liều duy trì: 200 mg mỗi 12 giờ |
Không cần chỉnh liều
Trẻ 2 – <12 tuổi suy thận chưa có nghiên cứu |
|||||
| Uống | Trẻ em (2 – <12 tuổi hoặc 12 – 14 tuổi có cân nặng < 50 kg)
Liều duy trì: 9 mg/kg mỗi 12 giờ (tối đa 350 mg mỗi 12 giờ) Trẻ em < 2 tuổi: Không khuyến cáo sử dụng |
Không cần chỉnh liều
Trẻ 2 – <12 tuổi suy thận chưa có nghiên cứu |
|||||
| 8 | Posaconazol | Truyền TM | Điều trị và dự phòng nhiễm nấm xâm lấn:
Liều nạp: 300 mg mỗi 12 giờ (24 giờ đầu) Liều duy trì: 300 mg mỗi 24 giờ Trẻ em < 18 tuổi: dữ liệu về độ an toàn và hiệu quả chưa được thiết lập |
Clcr < 50 ml/phút: Chuyển sang đường uống hoặc dừng thuốc do tích lũy tá dược Betadex Sulfobutyl Ether Sodium | Sử dụng thận trọng. Không cần chỉnh liều | ||
| Uống (viên) | Liều tương tự đường truyền TM | Không cần chỉnh liều | Sử dụng thận trọng. Không cần chỉnh liều | ||||
| 9 | Flucytosin (5-fluorocytosin; 5-FC) | Uống | Người lớn: 25 mg/kg mỗi 6 giờ
Trẻ em: Chưa có đầy đủ dữ liệu |
Clcr 20 – < 40 (ml/phút): 25 mg/kg mỗi 12 giờ
Clcr 10 – <20 (ml/phút): 25 mg/kg mỗi 24 giờ Clcr <10 (ml/phút): 25 mg mỗi 48 giờ |
Sử dụng thận trọng. Không cần chỉnh liều. | ||
| Truyền TM | Người lớn: 50 mg/kg mỗi 6 giờ.
Trẻ em: Chưa có đầy đủ dữ liệu |
Clcr 20 – < 40 (ml/phút): 50 mg/kg mỗi 12 giờ
Clcr 10 – <20 (ml/phút): 50 mg/kg mỗi 24 giờ Clcr <10 (ml/phút): liều khởi đầu 50 mg/kg, các liều tiếp theo dựa trên nồng độ thuốc trong máu |
Sử dụng thận trọng. Không cần chỉnh liều. | ||||
PHỤ LỤC 2: HƯỚNG DẪN PHA TRUYỀN CÁC THUỐC CHỐNG NẤM
1. Nhóm Polyen
Hướng dẫn pha truyền Amphotericin B deoxycholat và Amphotericin B phức hợp lipid
|
Các bước thực hiện |
Amphotericin B deoxycholat |
Amphotericin B phức hợp lipid |
| Hoàn nguyên | – Thêm 10 ml nước cất pha tiêm vô trùng vào lọ thuốc để được dung dịch có nồng độ 5mg/ml | – Lắc lọ nhẹ nhàng cho đến khi hết cặn màu vàng ở đáy lọ |
| Pha loãng | – Dùng dung dịch glucose 5% có pH > 4,2 để pha loãng dung dịch trên với tỷ lệ 1:50 để được nồng độ 10 mg/100 ml | – Rút liều amphotericin B theo cân nặng của bệnh nhân từ lọ (các lọ) vào bơm tiêm vô khuẩn 20ml bằng kim tiêm cỡ 17-19
– Thay kim tiêm cỡ 5 μm có màng lọc đi kèm lọ thuốc, bơm thuốc vào chai dung môi glucose 5% để được dung dịch có nồng độ 1mg/ml (với bệnh nhân nhi hoặc có bệnh tim mạch, nồng độ dung dịch sau pha có thể là 2mg/ml) |
| Truyền thuốc | – Liều test (lần truyền thuốc đầu tiên): 1 mg Amphotret (10 ml dung dịch nồng độ 0,1mg/ml đã pha ở trên), truyền tĩnh mạch trong 20-30 phút. Theo dõi bệnh nhân trong 30 phút. Nếu bệnh nhân không có dấu hiệu dị ứng thì tiếp tục truyền thuốc.
– Thời gian truyền: trong 2 – 6 giờ. Truyền chậm có thể giảm các tác dụng phụ của thuốc |
– Trước khi truyền: Lắc nhẹ và lắc đều chai dịch truyền amphoterincin B
– Liều test (lần truyền thuốc đầu tiên): 1mg (tương ứng với 1ml dung dịch đã pha loãng) truyền tĩnh mạch bằng bơm tiêm điện trong 15 phút. Theo dõi bệnh nhân trong 30 phút. Nếu bệnh nhân không có dấu hiệu dị ứng thì mới tiếp tục truyền thuốc – Tốc độ truyền: 2,5 mg/kg/giờ – Thời gian truyền: nếu kéo dài > 2 giờ, cần lắc nhẹ chai dịch truyền mỗi 2 giờ |
| Lưu ý | – Chỉ sử dụng Glucose 5% làm dung môi pha loãng.
– Dung dịch thuốc đã pha loãng nên sử dụng trong 8 giờ ở 25°C và 24 giờ ở 2-8°C, bảo quản tránh ánh sáng – Nên sử dụng bộ dây truyền riêng, bỏ lượng thuốc thừa sau khi truyền. |
– Chỉ sử dụng Glucose 5% làm dung môi pha loãng.
– Dung dịch thuốc đã pha loãng sử dụng trong 24 giờ ở 2-8°C trong điều kiện vô khuẩn. – Nên sử dụng bộ dây truyền riêng, bỏ lượng thuốc thừa sau khi truyền |
2. Nhóm azol
Hướng dẫn pha truyền các thuốc chống nấm nhóm azol
|
Các bước thực hiện |
Itraconazol |
Voriconazol |
Posaconazol |
| Hoàn nguyên | Thêm 19 ml nước cất pha tiêm hoặc NaCl 0,9% vào lọ thuốc bột voriconazol để được 20 ml dung dịch có nồng độ 10 mg/ml | ||
| Pha loãng | Rút hết lượng thuốc vào bơm tiêm, sau đó bơm toàn bộ thể tích (25 ml) dung dịch thuốc đậm đặc vào túi truyền trong 1 lần bơm chậm duy nhất (lên đến 60 giây). Trộn nhẹ nhàng các thành phần trong túi truyền. Dung dịch truyền sẽ trở nên trong suốt nhưng có thể quan sát thấy tủa nội tại (được mô tả có dạng sợi đến bông, mờ mờ, hạt trắng). Những tủa này không ảnh hưởng đến chất lượng sản phẩm. | Dung dịch hoàn nguyên được pha loãng bằng dung môi tương hợp (như NaCl 0,9%, NaCl 0,45%, Glucose 5%) để được dung dịch có nồng độ 0,5-5 mg/ml | Chuyển toàn bộ dung dịch thuốc (16,7ml) vào chai chứa khoảng 150 – 283 ml dung môi tương hợp (như NaCl 0,9%; NaCl 0,45%) để đạt được dung dịch có nồng độ trong khoảng 1-2 mg/ml |
| Truyền thuốc | Tốc độ truyền: 1 ml/phút (khoảng 25 giọt/phút). Truyền 60ml thì dừng truyền (tương ứng với 200mg Itraconazol).
Không được truyền Itraconazol cùng lúc với bất kỳ thuốc hay dung dịch nào khác. Cần tráng kỹ đường truyền bằng NaCl 0,9% trước và sau khi truyền Itraconazol nếu dùng chung đường truyền với các thuốc khác. |
Truyền thuốc trong khoảng 1-3 giờ, tốc độ không vượt quá 3 mg/kg/giờ | Truyền chậm trong khoảng 90 phút qua đường tĩnh mạch trung tâm bao gồm đường truyền tĩnh mạch trung tâm hoặc đường truyền tĩnh mạch trung tâm từ ngoại vi.
Nếu không có đường truyền tĩnh mạch trung tâm, có thể đưa qua tĩnh mạch ngoại vi với nồng độ pha loãng khoảng 2 mg/ml, thời gian truyền khoảng 30 phút. |
| Lưu ý | – Dung dịch sau khi pha nên được sử dụng ngay lập tức và nên được bảo vệ tránh ánh sáng mặt trời trực tiếp (có thể tiếp xúc với ánh sáng bình thường trong phòng khi tiêm truyền).
– Chỉ pha thuốc trong túi truyền được cung cấp. Chỉ sử dụng các đơn vị đóng gói kèm theo sản phẩm bao gồm túi truyền, dây nối với khóa 2 đầu và bộ lọc bên trong ống 0,2 μm và ống tiêm. |
Dung dịch sau khi hoàn nguyên và pha loãng nên được sử dụng ngay. | – Dung dịch thuốc đậm đặc ban đầu phải được pha loãng trước khi sử dụng, không được tiêm bolus tĩnh mạch.
– Dung dịch sau khi pha loãng nên sử dụng ngay. Nếu không sử dụng ngay được, có thể bảo quản đến 24 giờ ở 2-8°C trong điều kiện vô trùng. |
3. Nhóm echinocandin
3.1. Caspofungin (Hướng dẫn pha thuốc với liều dùng cho người lớn)
Hoàn nguyên:
– Lấy lọ thuốc (70 mg hoặc 50 mg) trong tủ lạnh ra để ở nhiệt độ phòng, thêm 10,5 ml nước cất pha tiêm vô trùng. Nồng độ lọ thuốc sau khi hoàn nguyên sẽ là 7,2 mg/ml (lọ 70 mg) hoặc 5,2 mg/ml (lọ 50mg).
– Khi hoàn nguyên, khối bột màu trắng đến trắng ngà sẽ tan hoàn toàn. Lắc nhẹ cho đến khi dung dịch trong suốt.
– Dung dịch đã hoàn nguyên có thể bảo quản trong vòng 24 giờ ở nhiệt độ dưới 25°C.
Pha loãng:
– Dung môi pha loãng gồm: nước muối tiêm vô trùng (NaCl 0,9%, 0,45 %, 0,225 %) và dung dịch Ringer lactat. Thể tích dung môi cần là 250 ml (có thể giảm còn 100 ml nếu cần thiết)
– Thể tích dung dịch thuốc sau hoàn nguyên ở trên cần lấy để pha loãng (theo bảng 3.4):
Hướng dẫn pha truyền caspofungin
|
Liều dùng |
Thể tích thuốc đã hoàn nguyên cần lấy để pha loãng |
Nồng độ chế phẩm tiêu chuẩn (sau khi pha loãng trong 250 ml) |
Nồng độ chế phẩm với thể tích dịch truyền giảm (pha loãng trong 100 ml) |
|
70 mg |
10 ml |
0,28 mg/ml |
Không khuyến cáo |
|
70 mg (từ 2 lọ 50 mg)* |
14 ml |
0,28 mg/ml |
Không khuyến cáo |
|
50 mg |
10 ml |
0,20 mg/ml |
0,47 mg/ml |
| 35 mg cho suy gan mức độ vừa (từ 1 lọ 70 mg) |
5 ml |
0,14 mg/ml |
0,34 mg/ml |
| 35 mg cho suy gan mức độ vừa (từ 1 lọ 50 mg) |
7 ml |
0,14 mg/ml |
0,34 mg/ml |
*Nếu không có lọ 70mg, liều 70 mg có thể pha từ 2 lọ 50 mg
Truyền thuốc: Truyền chậm khoảng 1 giờ
Lưu ý:
– Kiểm tra bằng mắt thường dung dịch thuốc xem có vật lạ hoặc bị biến màu trong khi pha thuốc và trước khi truyền. Không được dùng nếu dung dịch bị đục hoặc kết tủa.
– Dung dịch sau pha loãng sử dụng trong 24 giờ ở nhiệt độ dưới 25°C hoặc 48 giờ ở 2-8°C trong điều kiện vô khuẩn.
– Không sử dụng bất kỳ dung môi nào chứa Glucose để pha truyền Caspofungin.
– Không trộn lẫn hoặc truyền Caspofungin cùng với các thuốc khác.
3.2. Micafungin
Hoàn nguyên:
– Bơm chậm vào dọc theo thành lọ thuốc 5 ml dung dịch pha truyền NaCl 0,9% hoặc Glucose 5% (lấy từ chai 100ml). Cố gắng để giảm thiểu việc tạo bọt của dung dịch đậm đặc.
– Xoay lọ nhẹ nhàng. Không được lắc. Thuốc sẽ được hòa tan hoàn toàn. Dung dịch sau khi hoàn nguyên nên được sử dụng ngay. Loại bỏ ngay phần thuốc còn thừa không dùng đến.
Pha loãng:
– Rút toàn bộ lượng thuốc đã hoàn nguyên vào chai dung dịch pha tiêm đã dùng ban đầu. Nên sử dụng ngay dung dịch đã pha loãng. Nên đảo ngược chai dung dịch nhẹ nhàng, không lắc mạnh để tránh tạo bọt. Không nên sử dụng dung dịch vẩn đục hoặc có tủa.
Truyền thuốc: Thời gian truyền trong khoảng 1 giờ
Lưu ý:
– Chai dung dịch sau khi pha loãng nên được bảo quản trong túi mầu tránh ánh sáng
– Độ ổn định vật lý và hóa học của thuốc duy trì trong 96 giờ ở 250C với điều kiện tránh ánh sáng và pha thuốc theo đúng hướng dẫn trên.
– Không trộn lẫn hoặc truyền chung dung dịch Micafungin với các thuốc khác.
PHỤ LỤC 3: HƯỚNG DẪN DỰ PHÒNG PHẢN ỨNG DỊ ỨNG DO TIÊM TRUYỀN AMPHOTERICIN B PHỨC HỢP LIPID HOẶC AMPHOTERICIN B QUY ƯỚC
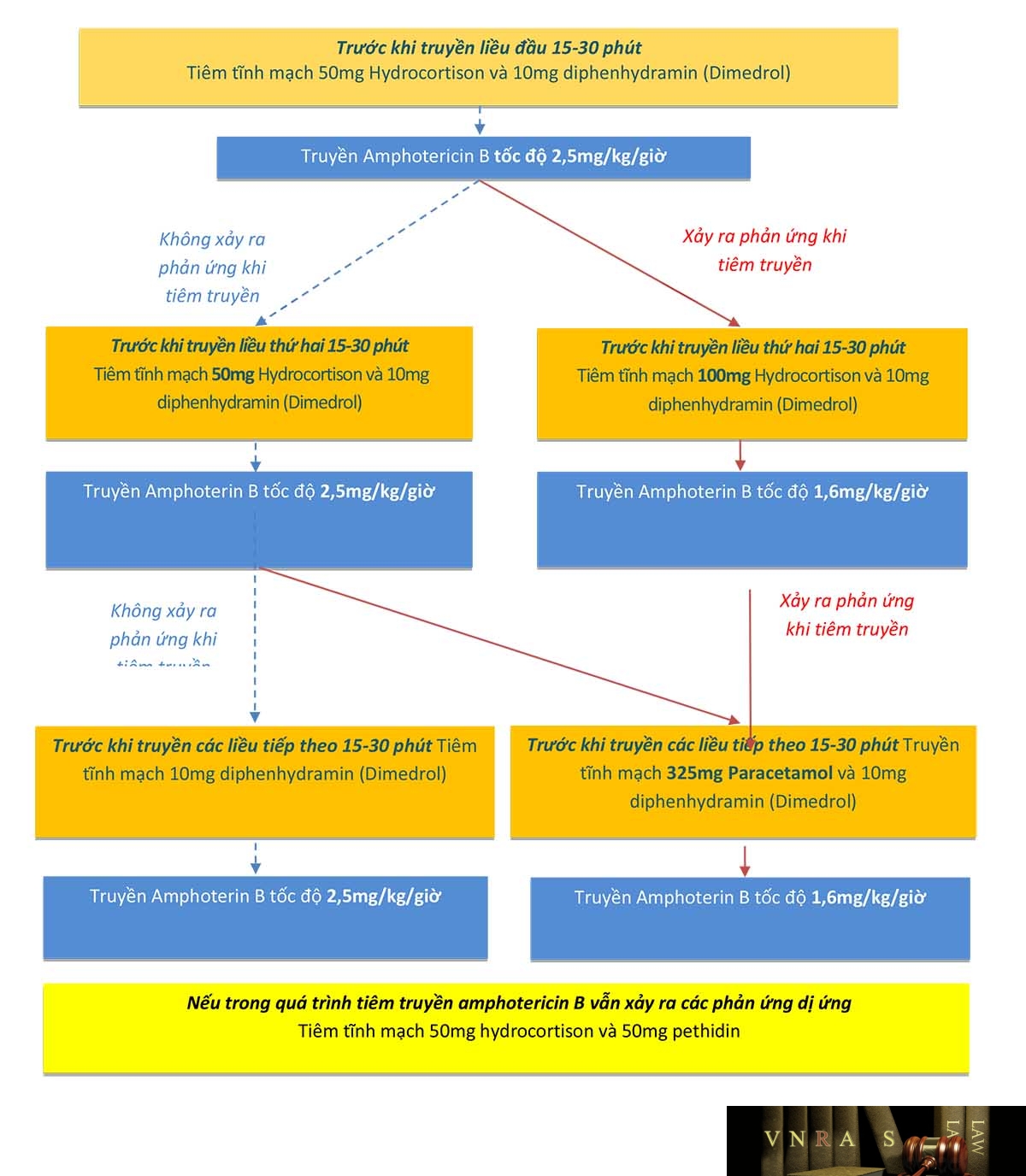
Có thể cân nhắc sử dụng methylprednisolon với liều tương đương (20 mg hydrocortison tương đương với 4 mg methylprednisolon) để thay thế khi không có hydrocortison
PHỤ LỤC 4: TƯƠNG TÁC CẦN LƯU Ý CỦA CÁC THUỐC NHÓM AZOL
|
Lưu ý |
Thuốc |
Hậu quả |
Xử trí |
| FLUCONAZOL | |||
| Chống chỉ định | Astemizol, cisaprid, erythromycin (IV), halofantrin, pimozid, quinidin, terfenadin | Kéo dài khoảng QT | Chống chỉ định phối hợp |
| Nghiêm trọng | Rifampicin | ↓ nồng độ fluconazol | ↑ liều fluconazol |
| Acenocoumarol, alfetanil, amitriptylin, carbamazepin, celecoxib, cyclosporin, fentanyl, ivacaftor, methadon, midazolam (uống), nortriptylin, NSAIDs (naproxen, lornoxicam, meloxicam, diclofenac), olaparib, phenytoin, rifabutin, saquinavir, sirolimus, statins (atorvastatin, simvastatin, fluvastatin), sulfonylureas (clorpropamid, glibenclamid, glipizid, tolbutamid), tacrolimus, thuốc chẹn kênh canxi (nifedipin, nicardipin, amlodipin, verapamil và felodipin), tofacitinib, vinblastin, vincristin, warfarin, zidovudin | ↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Theo dõi độc tính, cân nhắc↓ liều thuốc bị tương tác (cyclosporin ↓ còn1/2 liều). | |
| ITRACONAZOL | |||
| Chống chỉ định | Alcaloid nấm cựa gà (ví dụ ergotamine) | ↑ nguy cơ độc tính của alcaloid cựa lõa mạch (nôn, buồn nôn, hoại tử đầu chi, thiếu máu cục bộ do co thắt mạch,…) | Chống chỉ định phối hợp |
| Statins (simvastatin, lovastatin) | ↑ nguy cơ bệnh cơ hoặc tiêu cơ vân cấp (đau cơ, mỏi cơ, yếu cơ) | Chống chỉ định phối hợp | |
| Astemizol, cisaprid, disopyramid, dofetilid, dronedaron, halofantrin, mizolastin pimozid, quinidin, terfenadin | ↑ nguy cơ kéo dài khoảng QT | Chống chỉ định phối hợp | |
| Aliskiren, bepridil, dabigatran, darifenacin, domperidon, eplerenon, felodipin, irinotecan, ivabradin, lercanidipin, lurasidon, methadon, midazolam (uống), nisoldipin, nisoldipin, quetiapin, ranolazin, sertindol, ticagrelor, triazolam
Một số trường hợp đặc biệt: – Fesoterodin, solifenacin, colchicin, telithromycin: ở bệnh nhân suy gan/thận nặng – Vardenafil: ở BN trên 75 tuổi – Sildenafil: với chỉ định tăng áp động mạch phổi |
↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Chống chỉ định phối hợp | |
| Nghiêm trọng | Carbamazepin*, efavirenz, isoniazid, nevirapin, phenobarbital, phenytoin, rifabutin* | ↓ nồng độ itraconazol
(*↑ nồng độ, ↑ nguy cơ độc tính của carbamazepin, rifabutin) |
Tránh phối hợp. Nếu bắt buộc phối hợp, ↑ liều itraconazol |
| Apixaban, atorvastatin, axitinib, ciclesonid, colchicin, dabrafenib, dasatinib, ebastin, eletriptan, everolimus, fentanyl, ibrutinib, lapatinib, nilotinib, riociguat, rivaroxaban, salmeterol, simeprevir, sunitinib, tamsulosin, temsirolimus, tolterodin, trabectedin, vardenafil (ở bệnh nhân dưới 75 tuổi) | ↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Tránh phối hợp. Nếu bắt buộc phối hợp, theo dõi độc tính, ↓ liều thuốc bị tương tác | |
| Ciprofloxacin, clarithromycin, darunavir, erythromycin, fosamprenavir, indinavir, ritonavir, telaprevir | ↑ nồng độ, ↑ nguy cơ độc tính của itraconazol | Theo dõi độc tính, cân nhắc↓ liều itraconazol | |
| Acenocoumarol, alfentanil, alitretinoin (uống), alprazolam, aprepitant, aripiprazol,brotizolam, bilastin, bortezomib, bosentan, budesonid, buprenorphin (IV và ngậm dưới lưỡi), buspiron, busulphan, cilostazol, cinacalcet, cyclosporin, dexamethason, digoxin, docetaxel, erlotinib, fesoterodin, fluticason, gefitinib, haloperidol, imatinib, indinavirb, ixabepilon, maraviroc, methylprednisolon, midazolam (IV), nadolol, oxybutynin, oxycodon, perospiron, ponatinib, praziquantel, reboxetin, repaglinid, risperidon, ritonavir, saquinavir, saxagliptin, sildenafil (với chỉ định rối loạn cương dương), sirolimus, solifenacin, sufentanil, tacrolimus, tadalafil, telithromycin, thuốc chẹn kênh canxi nhóm dihydropyridin khác, tolvaptan, trimetrexat, verapamil, vinblastin, vincristin | ↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Theo dõi độc tính, cân nhắc ↓ liều thuốc bị tương tác | |
| Antacid | ↓ hấp thu itraconazol (với dạng viên nang) | Uống antacid 1 giờ trước hoặc 2 giờ sau itraconazol | |
| POSACONAZOL | |||
| Chống chỉ định | Alcaloid nấm cựa gà (ví dụ ergotamine) | ↑ nguy cơ độc tính của alcaloid cựa lõa mạch (nôn, buồn nôn, hoại tử đầu chi, thiếu máu cục bộ do co thắt mạch,…) | Chống chỉ định phối hợp |
| Statins (simvastatin, lovastatin và atorvastatin) | ↑ nguy cơ bệnh cơ hoặc tiêu cơ vân cấp (đau cơ, mỏi cơ, yếu cơ) | Chống chỉ định phối hợp | |
| Astemizol, cisaprid, halofantrin, pimozid, quinidin, terfenadin | ↑ nguy cơ kéo dài khoảng QT | Chống chỉ định phối hợp | |
| Nghiêm trọng | Carbamazepin, efavirenz, phenobarbital, phenytoin, primidon, rifabutin* | ↓ nồng độ posaconazol (*↑ nồng độ, ↑ nguy cơ của rifabutin) | Tránh phối hợp |
| Antacid, thuốc kháng H2, thuốc ức chế bơm proton | ↓ hấp thu posaconazol (với dạng hỗn dịch uống) | Tránh phối hợp | |
| Sirolimus | ↑ nồng độ, ↑ nguy cơ độc tính của sirolimus | Tránh phối hợp. Nếu bắt buộc phối hợp, ↓ liều sirolimus, theo dõi nồng độ thuốc trong máu | |
| Alprazolam, atazanavir, cyclosporin, midazolam, ritonavir, tacrolimus, thuốc chẹn kênh canxi (diltiazem, verapamil, nifedipin, nisoldipin), triazolam, vinblastin, vincristin | ↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Theo dõi độc tính, cân nhắc ↓ liều thuốc bị tương tác (cyclosporin ↓ còn 3/4 liều, tacrolimus ↓ còn 1/3 liều, theo dõi nồng độ thuốc trong máu). | |
| VORICONAZOL | |||
| Chống chỉ định | Alcaloid cựa lõa mạch | ↑ nguy cơ độc tính của alcaloid cựa lõa mạch (nôn, buồn nôn, hoại tử đầu chi, thiếu máu cục bộ do co thắt mạch,…) | Chống chỉ định phối hợp |
| Sirolimus | ↑ nồng độ sirolimus | Chống chỉ định phối hợp | |
| Astemizol, cisaprid, pimozid, quinidin, terfenadin | ↑ nguy cơ kéo dài khoảng QT | Chống chỉ định phối hợp | |
| Carbamazepin, phenobarbital, rifampicin | ↓ nồng độ voriconazol | Chống chỉ định phối hợp | |
| Efavirenz (liều ≥ 400 mg/lần/ngày) | ↓ nồng độ voriconazol, ↑ nồng độ efavirenz | Chống chỉ định phối hợp. Nếu phối hợp, liều voriconazol 400 mg x 2 lần/ngày, liều efavirenz 300 mg x 1 lần/ngày. | |
| Ritonavir (liều ≥ 400 mg/lần x 2 lần/ngày) | ↓ nồng độ voriconazol | Chống chỉ định phối hợp với liều cao ritonavir. Tránh phối hợp với liều thấp ritonavir (100 mg x 2 lần/ngày), chỉ phối hợp khi lợi ích vượt trội nguy cơ | |
| Nghiêm trọng | Phenytoin | ↓ nồng độ voriconazol | Tránh phối hợp. Nếu phối hợp, liều voriconazol 5 mg/kg (IV) hoặc 200 – 400 mg (đường uống) x 2 lần/ngày (bệnh nhân > 40 kg). |
| Rifabutin | ↓ nồng độ voriconazol, ↑ nồng độ rifabutin | Tránh phối hợp. Nếu bắt buộc phối hợp, liều voriconazol 5 mg/kg (IV) hoặc 200 – 350 mg (đường uống) x 2 lần/ngày (bệnh nhân > 40 kg). | |
| Everolimus | ↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Tránh phối hợp | |
| Acenocoumarol, alfentanil, alprazolam, cyclosporin, fentanyl, lovastatin, methadon, midazolam, NNRTIs (delavirdin, nevirapin), NSAIDs (diclofenac, ibuprofen), omeprazol, oxycodon, sufentanil, sulfonylureas (tolbutamid, glipizid, glyburid), tacrolimus, thuốc ức chế protease (saquinavir, amprenavir, nelfinavir), triazolam, vinblastin, vincristin, warfarin | ↑ nồng độ, ↑ nguy cơ độc tính của thuốc bị tương tác | Theo dõi độc tính, cân nhắc ↓ liều thuốc bị tương tác (cyclosporin ↓ còn1/2 liều, tacrolimus ↓ còn 1/3 liều – theo dõi nồng độ thuốc trong máu; liều omeprazol ↓ còn1/2 liều) | |
PHỤ LỤC 5: ĐIỀU KIỆN THANH TOÁN BẢO HIỂM Y TẾ THEO THÔNG TƯ SỐ 30/2018/TT-BYT
|
Thuốc |
Đường dùng |
Tỷ lệ thanh toán |
Hạng bệnh viện được sử dụng |
| Fluconazol | Uống |
100% |
Tất cả các cơ sở khám, chữa bệnh |
| Truyền tĩnh mạch |
100% |
Hạng đặc biệt, hạng I, II, III, IV | |
| Itraconazol | Uống |
100% |
Hạng đặc biệt, hạng I, II, III, IV |
| Truyền tĩnh mạch |
100% |
Hạng đặc biệt, hạng I, II | |
| Posaconazol | Uống | Quỹ BHYT thanh toán 50% trong trường hợp:
– Nhiễm nấm Fusarium, nhiễm nấm Zygomycetes, bệnh nấm Cryptococcus, bệnh nấm màu và u nấm ở những bệnh nhân mắc bệnh kháng trị với các thuốc khác hoặc những BN không dung nạp với các thuốc khác; – Bệnh nấm Coccidioides immitis, bệnh nấm Coccidioides immitis đã thất bại hoặc không dung nạp với các thuốc chống nấm khác. |
Hạng đặc biệt,
Hạng I |
| Voriconazol | Uống | Quỹ BHYT thanh toán 50% trong điều trị:
– Nhiễm Asperillus nấm xâm lấn; – Nhiễm Candida huyết trên bệnh nhân không giảm bạch cầu; – Nhiễm nấm Candida xâm lấn nặng kháng fluconazol; – Điều trị nhiễm nấm nặng gây ra bởi Scedosporium spp. và Fusarium spp. cho những BN không đáp ứng các điều trị khác. |
Hạng đặc biệt,
Hạng I |
| Caspofungin | Truyền tĩnh mạch | Quỹ bảo hiểm y tế thanh toán trong trường hợp:
– Điều trị theo kinh nghiệm nhiễm nấm xâm lấn (Candida hoặc Aspergilus) ở BN nguy cơ cao có sốt, giảm bạch cầu trung tính; – Điều trị nhiễm nấm Candida xâm lấn; – Điều trị nhiễm nấm Aspergillus xâm lấn ở bệnh nhân kháng trị hoặc không dung nạp với các trị liệu khác. |
Hạng đặc biệt,
Hạng I |
| Flucytosin | Truyền tĩnh mạch |
100% |
Hạng đặc biệt, hạng I, II |
TÀI LIỆU THAM KHẢO
1. Monica A. Garcia-Solache and Arturo Casadevall (2010). Global Warming Will Bring New Fungal Diseases for Mammals. mBio. (1): e00061-10.
2. Robert, V. A., and A. Casadevall (2009). Vertebrate endothermy restricts most fungi as potential pathogens. J. Infect. Dis. (200):1623-1626.
3. Bongomin F et al. (2017) Global and multi-nationaal prevalence of fungal diseaes – Estimate precision. J. Fungi. (3): doi:10.3390/jof3040057
4. Brown GD et al. (2012) Hidden killer: Human Fungal Infections. Sci. Transl. Med (4): 165rv13.
5. Ascioglu S et al. (2002). Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin. Infect. Dis. (1): 7-14.
6. Forbes BA, Sahm DF, Weissfeld AS. Bailey & Scott’s (2007). Diagnostic Microbiology. MOSBY Elsevier. 12th edition: 629-636.
7. C d’Enfert and Bougnoux ME (2014). Human fungal infections. Elsevier :1-13.
8. Saville, S.P., Lazzell, A.L., Monteagudo, C., et al., (2003). Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryot. Cell 2, 1053-1060.
9. Sudbery, P.E., (2011). Growth of Candida albicans hyphae. Nat. Rev. Microbiol 9 (10), 737-748.
10. Nguyen, V.Q., Sil, A., (2008). Temperature-induced switch to the pathogenic yeast form of Histoplasma capsulatum requires Ryp1, a conserved transcriptional regulator. Proc. Natl. Acad. Sci. U.S.A. 105, 4880-4885.
11. Azie, N., Neofytos, D., Pfaller, M., et al., (2012). The PATH (Prospective Antifungal Therapy) Alliance® registry and invasive fungal infections: update 2012. Diagn. Microbiol. Infect. Dis. 73, 293-300.
12. Gudlaugsson, O., Gillespie, S., Lee, K., et al., (2003). Attributable mortality of nosocomial candidemia, revisited. Clin. Infect. Dis. 37, 1172-1177.
13. Lass-Florl, C., (2009). The changing face of epidemiology of invasive fungal disease in Europe. Mycoses 52, 197-205.
14. Lion T, (2017). Human Fungal Pathogen Identication: Method and Protocols, Methods in Molecular Biology., vol 1508. Springer Science+Business Media New York.17-65.
15. Almeida F, Rodrigues ML, Coeellho C. The still underestimated problem of fungal diseases worldwide. Frontiers in Microbiol. Doi: 10.3389/fmicb.2019.00214
16. Kaur H, Chakrabarti (2017). A. strategies to reduce mortality in adult and neonatal candidimia in developing countries. J. Fungi. (3):1-20.
17. Lone SA, Ahmad A. Candida auris – the growing menace to global heath. doi:10.1111/myc.12904.
18. Cortegiani A et al. (2018). Epidemiology, clinical characteristics, resistance, and treatment of infections by Candida auris. J Intensive Care. (6):69.
19. Neofytos D, Fishman JA, Horn D et al (2010). Epidemiology and outcome of invasive fungal infections in solid organ transplant recipients. Transpl Infect Dis 12(3):220- 229.
20. Rajasingham R et al. (2017). Global burden of disease of HIV-associated cryptococal meningitis: an updated analysis. The Lancet Infect Dis. (17):837-881.
21. Williamson PR et al (2016). Cryptococcal meningitis: epidemiology, immunology, diagnosis and therapy. Nature Rev Neurology.. doi:10.1038/nrneurol.167.
22. Sokulska M, Kicia M, Wesolowska M, Hendrich AB (2015). Pneumocytis jorovecii-from a commensal to pathogen: clinical and diagnostic review. Paracitol Res. (114):3577-3585.
23. Masur H (2015). HIV-Related Opportunistic Infections Are Still Relevant in 2015. Top Antivir Med. Aug-Sep;23(3):116-9.
24. Rey A, Losada C, Santillán J, Fiorentini F, Schiaffino M, Peroni HJ, Giunta D, Barcán L, Waisman G (2015). Pneumocystis jirovecii infection in patients with and without HIV: A comparison. Rev Chilena Infectol. Apr;32(2):175-80.
25. Solano L MF, Alvarez Lerma F, Grau S, Segura C, Aguilar A (2015). Pneumocystis jirovecii pneumonia: Clinical characteristics and mortality risk factors in an Intensive Care Unit. Med Intensiva. 2015 Jan-Feb;39(1):13-9.
26. Limper AH, Adenis A, Le T, Harrison TS (2017). Fungal infections in HIV/AIDS. Lancet Infect Dis.
27. Chan JFW, Lau SKP, Yuen KY, Woo PCY (2016). Talaromyces (Penicillium) marneffei infection in non-HIV-infected patients. Emerg Microbes Infect. 2016 (5), e19; doi:10.1038/emi.2016.18.
28. Ning C et al., (2018). Accuracy of rapid diagnosis of Talaromyces marneffei: A systemic review and meta-analysis. Plos ONE. (13): e0195569.
29. Beardsley J, Denning DW, Chau NV, Yen NTB, Crump JA, Day JN. . (I2015). Estimateing the burden of fungal disease in Vietnam. Mycoses. (58):101-106.
30. T. Y. Tan, L. Y. Hsu, M. M. Alejandria và cộng sự (2016), Antifungal susceptibility of invasive Candida bloodstream isolates from the Asia-Pacific region, International society for human and animal mycology, 54, 471 – 477.
31. Nguyễn Nhị Hà, Phạm Hồng Nhung (2017). Tình hình nhiễm nấm máu tại Bệnh viện Bạch Mai từ tháng 1/2016 đến tháng 12/2016. Tạp chí nghiên cứu y học. (107):1-7.
32. Bùi Thị Vân Nga, et al.,(2016). Nghiên cứu đặc điểm vi khuẩn – vi nấm tại Viện Huyết Học truyền máu TW năm 2015. Y Học Việt Nam.
33. Thuy L et al. (2011). Epidemiology, seasonality, and predictors of outcome of AIDS-associated Penicillium marneffei infection in Ho Chi Minh City, Viet Nam. Clin Infect Dis. (52):945-952.
34. Beardsley J, Halliday CL, Chen SC-A, Sorrell TC (2018). Responding to the emergence of antifungal drug resistance: perspectives from the bench and the bedside. Future Microbiol. (13):1175-1191.
35. Pfaller MA, Diekema DJ, Gibbs DL et al (2010). Results from the artemis disk global antifungal surveillance study, 1997 to 2007: a 10.5-year analysis of susceptibilities of Candida species to fluconazole and voriconazole as determined by CLSI standardized disk diffusion. J. Clin. Microbiol. (48):1366-1377.
36. Lockhart SR, Etienne KA, Vallabhaneni S et al. (2017). Simultaneous emergence of multidrug-resistant Candida auris on 3 continents confirmed by whole-genome sequencing and epidemiological analyses. Clin. Infect. Dis. (64):134-140.
37. Tan, T.Y, Hsu, L.Y et al.,(2016). Antifungal susceptibility of invasive Candida bloodstream isolates from the Asia-Pacific region. Medical Mycology Advance Access. (0);1-7.
38. Taccone F, Van den Abeele A-M, Bulpa P et al (2015). Epidemiology of invasive aspergillosis in critically ill patients: clinical presentation, underlying conditions, and outcomes. Crit. Care. (19), 7.
39. Leonardelli F, Macedo D, Dudiuk C, Cabeza MS, Gamarra S, Garcia-Effron G (2016). Aspergillus fumigatus intrinsic fluconazole resistance is due to the naturally occurring T301I substitution in Cyp51Ap. Antimicrob. Agents Chemother. (60):5420-5426.
40. Perlin DS, Rautemaa-Richardson R, Alastruey-Izquierdo (2017). The global problem of antifungal resistance: prevalence, machanisms, and management. Lancet Infect Dis.2017: e383-92.
41. Pinto E, Lopes V, Faria MA, Lameiras C.(2018). Aspergillus species and antifungal susceptibility in clincal setting in the North of Portugal: Cryptic species and emerging azoles resistance in A. fumigatus. Frontier in Microbiol. 2018. 9:1656.
42. Alastruey-Izquierdo A, Alcazar-Fuoli L, Cuenca-Estrella M (2014). Antifungal susceptibility pro le of cryptic species of Aspergillus. Mycopathologia. 2014 (178): 427-33.
43. Antinori S et al. Candidemia and invasive candidiasis in adults: A narrative review. Eur J Intern Med. 2016 Oct;34:21-28.
44. Bassetti M et al. A multicenter multinational study of abdominal candidiasis: epidemiology, outcomes and predictors of mortality. Intensive Care Med. 2015;41(9):1601-1610
45. Clancy CJ, Nguyen MH. Finding the “missing 50%” of invasive candidiasis: how nonculture diagnostics will improve understanding of disease spectrum and transform patient care. Clin Infect Dis. 2013;56(9):1284.
46. Clancy CJ, Nguyen MH. Diagnosing Invasive Candidiasis. J Clin Microbiol 2018. 56:e01909-17.
47. De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis. 2008;46(12):1813-1821.
48. Leroy O and AmarCand Study Group. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005-2006). Crit Care Med. 2009;37(5):1612.
49. Kullberg BJ et al. Invasive Candidiasis. N Engl J Med 2015;373:1445-1456.
50. Thông tin kê toa thuốc Amphotret, nhà sản xuất Bharat serum and vaccines limited, India. Số đăng kí VN – 18166-14.
51. Thông tin kê toa thuốc Ampholip, nhà sản xuất Bharat serum and vaccines limited, India. Số đăng kí VN – 19392-15
52. Charles Craddock et al, Best practice guidelines for the management of adverse events associated with amphotericin B lipid complex, Expert Opin. Drug Saf. (2010) 9(1):139-147.
53. Thông tin kê toa thuốc Amphotret, nhà sản xuất Bharat serum and vaccines limited, India. Số đăng kí VN – 18166-14.
54. Thông tin kê toa thuốc Ampholip, nhà sản xuất Bharat serum and vaccines limited, India. Số đăng kí VN – 19392-15.
55. Caroline A., et al (2018), “The Renal Drug Handbook: The Ultimate Prescribing Guide for Renal Practitioners”, 5th edition, CRC Press.
56. Cunha BA, et al. (2015), Antibiotic essentials, 14th edition, The Health Science Publish.
57. David NG, et al (2017), “The Sanford guide to Antimicrobial Therapy 2017”, 48th edition, Antimicrobial Therapy Incorporated.
58. Electronic Medicine Compendium (eMC), SmPC of Diflucan (Pfizer Ltd.), Sporanox (Janssen-Cilag Ltd.), Noxafil (Merck Sharp & Dohme Ltd.), Vfend (Pfizer Ltd.), Candidas, Mycamine (Astellas Pharma Ltd.), Ancotil (Mylan Ltd.), Fungizone (Bristol-Myers Squibb Pharmaceuticals Ltd.), Abelcet (Teva Pharma B.V.) via https://www.medicines.org.uk/emc, accessed on July 14th, 2019.
59. Grayson ML, et al (2018), “Kucer’s the use of antibiotics: a clinical review of antibacterial, antifungal, antiparasitic, and antiviral drugs”, Section 3 (volume 2): antifungal drugs. 7th edition, CRC Press, Taylor & Francis Group.
60. IBM Micromedex, https://www.micromedexsolutions.com, accessed on July 13rd, 2019.
61. Infectious Diseases Society of America (2016), “Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of American”, Clinical Infections Diseases, 62(4): e1-50. doi: 10.1093/cid/civ933.
62. Infectious Diseases Society of America (2016), “Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America”, Clinical Infections Diseases, 63(4):e1-e60. doi: 10.1093/cid/ciw326.
63. Johns Hopkins Medicines (2015), Antibiotic Guidelines (2015-2016) – Treatment Recomendations for Adult Inpatient, Bukupedia.
64. Laurence Brunton, et al. (2017), “Goodman and Gilman’s The Pharmacological Basis of Therapeutics”, 13th edition, McGraw Hill Professional.
65. National Comprehensive Cancer Network (2017), “Prevention and Treatment of Cancer-related Infections (Version 2.2017)”.
66. US. Food and Drug Administration, Label of Ancobon (Valeant Pharmaceuticals North America LLC) via https://www.accessdata.fda.gov, accessed on July 14th, 2019.
67. Russel E. Lewis, Mayo Clinical Proceeding, 2011, 86(8), tr. 80.
68. Altintop A, Ergul B, Koc N et al (2019). Evaluation of Candida colonization and use of the Candida Colonization Index in a paediatric Intensive Care Unit: a prospective observational study. Le Infezioni in Medicina, 27(2), 159-167
69. Antinori, Spinello et al (2016). Candidemia and invasive candidiasis in adults: A narrative review. European Journal of Internal Medicine, 34, 21 – 28.
70. Bailly S, Leroy O, Montravers P et al (2015). Antifungal de-escalation was not associated with adverse outcome in critically ill patients treated for invasive candidiasis: post hoc analyses of the AmarCAND2 study data. Intensive Care Med, 41, 1931-1940.
71. Bassetti M, Righi E, Ansaldi F et al (2015). A multicenter multina- tional study of abdominal candidiasis: epidemiology, outcomes and predictors of mortality. Intensive Care Med, 41, 1601-1610.
72. Cristina S, Fernanda B, Luciana L et al (2019). Alginate nanoparticles as non-toxic delivery system for miltefosine in the treatment of candidiasis and cryptococcosis. International Journal of Nanomedicine, 14, 5187-5199.
73. Fatma K, Rania A, Samar C et al (2016). Invasive candidiasis in critically ill patients. Trends in Anaesthesia and Critical Care, 11, 1-5.
74. Fernández-Cruz A, Cruz Menárguez M, Muđoz P et al (2015). The search for endocarditis in patients with candidemia: a systematic recommen- dation for echocardiography? A prospective cohort. Eur J Clin Microbiol Infect Dis, 34, 1543-1549.
75. Gabriele S, Minggui W, Capparella M R et al (2019). Evaluation of anidulafungin in the treatment of intra-abdominal candidiasis: a pooled analysis of patient-level data from 5 prospective studies. European Journal of Clinical Microbiology & Infectious Diseases, 0934-9723, 1 – 8.
76. Guarascio A J, Slain D, McKnight R et al (2013). A matched-control evalu- ation of an antifungal bundle in the intensive care unit at a university teaching hospital. Int J Clin Pharm, 35,145-148.
77. Hanson K E, Pfeifer C D, Lease E D et al (2012). β-d-glucan surveillance with preemptive anidulafungin for invasive candidiasis in intensive care unit patients: a randomized pilot study. PLoS One, 7, e42282.
78. Kaufman C A (2015). Complications of candidemia in ICU patients: endophthalmitis, osteomyelitis, endocarditis. Semin Respir Crit Care Med, 36, 641-649.
79. Knitsch W, Vincent J L, Utzolino S et al (2015). A randomized, placebocontrolled trial of preemptive antifungal therapy for the prevention of invasive candidiasis following gastrointestinal surgery for intra-abdomi- nal infections. Clin Infect Dis, 61, 1671-1678.
80. Kollef M, Micek S, Hampton N et al (2012). Septic shock attributed to Candida infection: importance of empiric therapy and source control. Clin Infect Dis, 54, 1739-1746.
81. León C, Sergio R, Saavedra P et al (2006). A bedside scoring system (“Candida score”) for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med, 34. 3, 730 – 737
82. Martin L, Ignacio, Massimo A, Manuel et al (2019). ESICM/ESCMID task force on practical management of invasive candidiasis in critically ill patients. Intensive Care Medicine, 45(6), 789-805.
83. Martínez-Jiménez M C, Muđoz P, Valerio M et al (2015). Combination of Candida biomarkers in patients receiving empirical antifungal therapy in a Spanish tertiary hospital: a potential role in reducing the duration of treatment. J Antimicrob Chemother, 70, 3107-3115.
84. O’Leary, R – A et al (2017). Management of invasive candidiasis and Candidaemia in critically ill adults: expert opinion of the European Society of Anaesthesia Intensive Care Scientific Subcommittee. Journal of Hospital Infection, 98(4), 382 – 390.
85. Ostrosky-Zeichner L (2011). Clinical prediction rules for invasive candidiasis in the ICU: ready for prime time?. Critical Care, 15,189.
86. Ostrosky-Zeichner L, Shoham S, Vazquez J et al (2014). MSG-01: a randomized, double-blnd, placebo-controlled trial of caspofungin prophylaxis followed by preemptive therapy for invasive candidiasis in high-risk adults in the critical care setting. Clin Infect Dis, 58, 1219-1226.
87. Pappas P, Kauffman C, Andes D et al (2016). Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America. Clinical Infectious Diseases, 62.
88. Prattes J, Hoenigl M, Rabensteiner J,et al (2014). Serum 1,3-beta-d-glu- can for antifungal treatment stratifcation at the intensive care unit and the infuence of surgery. Mycoses, 57, 679-686.
89. Rouzé A, Loridant S, Poissy J et al (2017). Biomarker-based strategy for early discontinuation of empirical antifungal treatment in critically ill patients: a randomized controlled trial. Intensive Care Med, 43, 1668- 1677.
90. Vossen M. G., Milacek Ch., Thalhammer F. (2018). Empirical antimicrobial treatment in haemato-/oncological patients with neutropenic sepsis. ESMO Open 2018;3: e000348. doi:10.1136/esmoopen-2018-000348.
91. Taplitz R. A. (2018). Antimicrobial Prophylaxis for Adult Patients With CancerRelated Immunosuppression: ASCO and IDSA Clinical Practice Guideline Update. J Clin Oncol, 36: 3043-3054.
92. Wingard J. R (2020). Prophylaxis of invasive fungal infections in adults with hematologic malignancies. https://www.uptodate.com/contents/prophylaxis-of-invasive-fungal-infections-in-adults-with-hematologic-malignancies/print. (last update: 23/3/2020).
93. Meidani M, Rostami M, Moulaee S (2012). Blood culture in neutropenic patients with fever. Int J Prev Med, 3: 141-142.
94. Garcia-Vidal C, Alastruey-Izquierdo A, Aguilar-Guisado M, Carratala J, Castro C, Fernandez-Ruiz M et al (2019). Executive summary of clinical practice guideline for the management of invasive diseases caused by Aspergillus: 2018 Update by the GEMICOMED-SEIMC/REIPI. Enferm Infecc Microbiol Clin., 37(8):535-541.
95. Marr KA, Schlamm HT, Herbrecht R, Rottinghaus ST, Bow EJ, Cornely OA et al (2015). Combination antifungal therapy for invasive aspergillosis: a randomized trial. Annals of internal medicine, 162: 81-89.
96. Misch EA, Safdar N (2016). Updated guidelines for the diagnosis and management of aspergillosis. J Thorac Dis, 8: E1771-E1776.
97. Patterson TF, Thompson GR III, Denning DW, Fishman JA, Hadley S, Herbrecht R et al (2016). Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clinical Infectious Diseases, 63: e1-e60.
98. Ullmann AJ, Aguado JM, Arikan-Akdagli S, Denning DW, Groll AH, Lagrou K et al (2018). Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline. Clinical microbiology and infection, 24, Suppl 1: e1-e38
99. Jumbo G. T. A, BanWat E. Gyog S. K (2010). Pulmonary and extra pulmonary manifestations of aspergillosis in clinical practice and potential challenges in management: An analysis of literature review. Journal of Clinical Medicine and Research, 2, 11: 185-193.
100. Perfect J. R., Dismukes W. E., Dromer F. et al. (2010). Clinical Practice Guidelines for the Management of Cryptococcal Disease: 2010 Update by the Infectious Diseases Society of America. Clinical Infectious Diseases, 50: 291-322.
101. BMJ Best Practice (2018): Cryptococcosis. BMJ Best Practice (last updated: Feb 09, 2018). https://bestpractice.bmj.com/topics/en-us/917/pdf/917.pdf
102. Centers for Disease Control and Prevention, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America (2019). Guidelines for the Prevention and Treatment of Opportunistic Infections in Adults and Adolescents with HIV (last updated: 2019). https://aidsinfo.nih.gov/guidelines
103. WHO (2018). Guidelines for the diagnosis, prevention and management of cryptococcal disease in HIV-infected adults, adolescents and children (Supplement to “The 2016 consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection”). © World Health Organization 2018, Printed in the Netherlands. ISBN 978-92-4-155027-7 (51p).
104. Bộ Y tế (2019). Hướng dẫn điều trị và chăm sóc HIV/AIDS (Ban hành kèm theo Quyết định số 5456/QĐ-BYT ngày 20/11/2019 của Bộ Y tế). Nxb Y học.
105. Jonathan E. Kaplan, C.B., King K. Holmes, John T. Brooks, Alice Pau, Henry Masur (2009). Guidelines for Prevention and Treatment of Opportunistic Infections in HIV-Infected Adults and Adolescents. Recommendations from CDC, the National Institutes of Health, and the HIV Medicine Association of the Infectious Diseases Society of America. Recommendations and reports, 58, No RR4: 6-10.
106. Supparatpinyo K., Kauffman C. A., Mitty J. (2019). Diagnosis and treatment of Talaromyces (Penicillium) marneffei infection. Up to date (update Aug 2019).
107. Galgiani J. N., Ampel N. M., MacDonald J. D., Blair J. E., Meyerson S. L., Catanzaro A. et al (2016). 2016 Infectious Diseases Society of America (IDSA) Clinical Practice Guideline for the Treatment of Coccidioidomycosis. Coccidioidomycosis Treatment Guidelines, 2016. Clinical Infectious Diseases, 63, 6: e112-e146.
108. Limper A. H., Sarosi G. A., Ampel N. M., Bennett J. E., Catanzaro A., Davies S. F. et al (2011). Treatment of Fungal Infections in Adult Pulmonary and Critical Care Patients. Am J Respir Crit Care Med, 183: 96-128.
109. Wheat L. J., Freifeld A G. , Kleiman M B., Baddley J W., McKinsey D S., Loyd J E. (2007): Clinical Practice Guidelines for the Management of Patients with Histoplasmosis: 2007 Update by the Infectious Diseases Society of America. IDSA Guidelines for Management of Histoplasmosis. Clin Infect Dis.; 45: 807 – 825.
110. Kauffman C A., Chapman S W., Pappas P G. (2007). Clinical Practice Guidelines for the Management of Sporotrichosis: 2007 Update by the Infectious Diseases Society of America. Clin Infect Dis.45,10: 1255-1265.
111. Chapman S W., Dismukes W E., Kauffman C A., Proia L A., Bradsher R W. (2008). Clinical Practice Guidelines for the Management of Blastomycosis: 2008 Update by the Infectious Diseases Society of America. Clin Infect Dis.; 46, 12:1801-1812.
112. Bộ Y tế (2012). “Tài liệu đào tạo Kiểm soát nhiễm khuẩn ban hành kèm theo Quyết định số 5771/BYT-K2ĐT”
113. Pappas PG, Kauffman CA, Andes DR, et al (2016). “Clinical Practice Guideline for the Management of Candidiasis: 2016 Update by the Infectious Diseases Society of America”. Clin Infect Dis. 62(4):e1
114. Victorian Advisory Committee on Infection Control (2007). “Guidelines for the classification and design of isolation rooms in health care facilities”
115. Jane D. Siegel, MD; Emily Rhinehart, RN MPH CIC; Marguerite Jackson, PhD, et al (2007). “Guideline for Isolation Precautions: Preventing Transmission of Infectious Agents in Healthcare Settings”. CDC Guideline
116. Klotz SA (2006). “ Oropharyngeal candidiasis: a new treatment option”. Clin Infect Dis, 42(8):1187
117. Vazquez JA, Patton LL, Epstein JB et al (2010). “Randomized, comparative, double-blind, double-dummy, multicenter trial of miconazole buccal tablet and clotrimazole troches for the treatment of oropharyngeal candidiasis: study of miconazole Lauriad®efficacy and safety (SMiLES)”. HIV Clin Trials; 11(4):186-96
118. Darouiche RO (1998). “Oropharyngeal and esophageal candidiasis in immunocompromised patients: treatment issues”. Clin Infect Dis;26(2):259
119. Klotz SA (2006). “Oropharyngeal candidiasis: a new treatment option”. Clin Infect Dis.42(8):1187
120. Hamill, R.J., Amphotericin B formulations: a comparative review of efficacy and toxicity. Drugs, 2013. 73(9): p. 919-34.
121. Wade, R.L., et al., Comparison of adverse events and hospital length of stay associated with various amphotericin B formulations: sequential conventional amphotericin b/lipid versus lipid-only therapy for the treatment of invasive fungal infections in hospitalized patients. P T, 2013. 38(5): p. 278-87

































