
| SAO Y | Ký bởi: Bộ y tế
Cơ quan: Bộ Y tế Ngày ký: 25-09-2024 15:59:14 +07:00 |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập – Tự do – Hạnh phúc |
| Số 2855/QĐ-BYT | Hà Nội, ngày 25 tháng 9 năm 2024 |
QUYẾT ĐỊNH
Về việc ban hành Hướng dẫn chẩn đoán và điều trị bệnh viêm gan vi rút C
BỘ TRƯỞNG BỘ Y TẾ
Căn cứ Luật Khám bệnh, chữa bệnh năm 2023;
Căn cứ Nghị định số 95/2022/NĐ-CP ngày 15 tháng 11 năm 2022 của Chính phủ quy định chức năng, nhiệm vụ, quyền hạn và cơ cấu tổ chức của Bộ Y tế;
Theo đề nghị của Cục trưởng Cục Quản lý khám, chữa bệnh – Bộ Y tế.
QUYẾT ĐỊNH:
Điều 1. Ban hành kèm theo Quyết định này “Hướng dẫn chẩn đoán và điều trị bệnh viêm gan virus C” thay thế “Hướng dẫn chẩn đoán và điều trị bệnh viêm gan virus C” ban hành kèm theo Quyết định số 2065/QĐ-BYT ngày 29/04/2021 của Bộ Y tế.
Điều 2. Hướng dẫn chẩn đoán và điều trị bệnh viêm gan vi rút C được áp dụng tại các cơ sở khám bệnh, chữa bệnh trong cả nước.
Điều 3. Quyết định này có hiệu lực kể từ ngày ký ban hành.
Điều 4. Các ông, bà: Chánh Văn phòng Bộ, Cục trưởng Cục Quản lý Khám, chữa bệnh, Chánh Thanh tra Bộ, Vụ trưởng, Cục trưởng các Vụ/Cục thuộc Bộ Y tế; Giám đốc các cơ sở khám bệnh, chữa bệnh trực thuộc Bộ Y tế; Giám đốc Sở Y tế các tỉnh, thành phố trực thuộc Trung ương: Thủ trưởng Y tế các Bộ, ngành; Thủ trưởng các đơn vị có liên quan chịu trách nhiệm thi hành Quyết định này ./.
| Nơi nhận:
– Như điều 4; – Bộ trưởng (đề báo cáo); – Các Thứ trưởng (để phối hợp chỉ đạo); – Lưu: VT; KCB. |
KT. BỘ TRƯỞNG
THỨ TRƯỞNG Trần Văn Thuấn |

HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ BỆNH VIÊM GAN VI RÚT C
(Ban hành kèm theo Quyết định số 2855/QĐ-BYT, ngày 25 tháng 9 năm 2024 của Bộ trưởng Bộ Y tế )
Hà Nội, 2024
DANH SÁCH BAN BIÊN SOẠN
“HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ BỆNH VIÊM GAN VI RÚT C”
| Chỉ đạo biên soạn | |
| Gs.Ts. Trần Văn Thuấn | Thứ trưởng Bộ Y tế |
| Chủ biên | |
| Gs.Ts. Nguyễn Văn Kính | Phó Chủ tịch thường trực Tổng Hội Y học Việt Nam, nguyên Giám đốc Bệnh viện Bệnh Nhiệt đới Trung ương |
| Tham gia biên soạn | |
| Ts. Nguyễn Trọng Khoa | Phó Cục trưởng Cục Quản lý Khám, chữa bệnh |
| PGs.Ts. Phan Thị Thu Hương | Cục trưởng Cục Phòng, chống HIV/AIDS |
| PGs.Ts. Trịnh Thị Ngọc | Phó Chủ tịch Hội Gan Mật Việt Nam |
| PGs.Ts. Đỗ Duy Cường | Giám đốc Trung tâm Bệnh Nhiệt đới, Bệnh viện Bạch Mai |
| BsCKI. Nguyễn Xuân Hiền | Trưởng khoa Bệnh Nhiệt đới, Bệnh viện Đa khoa Trung ương Huế |
| BsCKII. Trần Nam Quân | Phó Giám đốc Bệnh viện Bệnh Nhiệt đới Khánh Hòa |
| BsCKII. Nguyễn Ngọc Phúc | Trưởng khoa Viêm gan, Bệnh viện Bệnh Nhiệt đới
Trung ương |
| PGs.Ts. Trần Thị Khánh Tường | Trưởng khoa Y, Trưởng Bộ môn Nội tổng quát,
Trường Đại học Y khoa Phạm Ngọc Thạch |
| BsCKII. Bồ Kim Phương | Trưởng khoa Tiêu hóa — Huyết học lâm sàng, Bệnh
viện đa khoa Trung ương Cần Thơ |
| BsCKII. Đào Bách Khoa | Trưởng khoa Nhiễm A, Bệnh viện Bệnh Nhiệt đới
Thành phố Hồ Chí Minh |
| BsCKII. Hoàng Thị Thư | Trưởng khoa Bệnh Nhiệt đới, Bệnh viện Đa khoa
Trung ương Thái Nguyên |
| Ts. Tạ Thị Diệu Ngân | Phó Trưởng khoa Bệnh Nhiệt đới và Can thiệp giảm
hại, Bệnh viện Đại học Y Hà Nội |
| BsCKII. Huỳnh Thị Kim Yến | Nguyên Trưởng Bộ môn Nhiễm, Trường Đại học Y
Dược Cần Thơ |
| PGs.Ts. Phạm Thị Thu Thủy | Trưởng phòng khám Gan, Công ty TNHH Y tế Hòa
Hảo |
| BsCKII. Nguyễn Thị Chi | Phó Trưởng khoa Nội tổng hợp, Bệnh viện Đại học Y
Hà Nội |
| BsCKII. Nguyễn Nguyên Huyền | Trưởng khoa Khám bệnh & Điều trị ngoại trú (cơ sở
Kim Chung), Bệnh viện Bệnh Nhiệt đới Trung ương |
| BsCKII. Cao Đức Phương | Chuyên viên chính Phòng Nghiệp vụ và Bảo vệ sức
khỏe cán bộ, Cục Quản lý Khám, chữa bệnh |
| Ths. Đỗ Thị Huyền Trang | Cục Quản lý Khám, chữa bệnh |
| Chuyên gia tư vấn | |
| Ts. Nguyễn Thị Thúy Vân | Cán bộ kỹ thuật, Tổ chức Y tế Thế giới tại Việt Nam |
MỤC LỤC
DANH SÁCH BAN BIÊN SOẠN
DANH MỤC CHỮ VIẾT TẮT
- ĐẠI CƯƠNG
- CHẨN ĐOÁN VIÊM GAN VI RÚT C
- ĐIỀU TRỊ VIÊM GAN VI RÚT C
- PHÒNG BỆNH
PHỤ LỤC 1
PHỤ LỤC 2
PHỤ LỤC 3
PHỤ LỤC 4
PHỤ LỤC 5
TÀI LIỆU THAM KHẢO
DANH MỤC CHỮ VIẾT TẮT
| AFP | Alpha-fetoprotein |
| AFP-L3 | Alpha-fetoprotein – L3 |
| ALT | Alanine aminotransferase |
| Ani-HCV | Antibodies against hepatitis C virus – kháng thể kháng vi rút viêm gan C |
| APRI | AST to Platelet Ratio Index – chỉ số tỷ số AST/tiểu cầu |
| ART | Antiretroviral therapy – điều trị kháng retrovirus |
| ARV | Antiretrovirals – thuốc kháng retrovirus |
| AST | Aspartate aminotransferase |
| ATV | Atazanavir |
| CTM | Công thức máu |
| CrCl | Creatine Clearance – độ thanh thải Creatinine |
| CYP | Cytochrome P450 |
| DAA | Direct acting antivirals – các thuốc kháng virus trực tiếp |
| DAC | Daclatasvir |
| DSV | Dasabuvir |
| EBV | Elbasvir |
| ELISA | Enzyme – linked immunosorbent assay – Xét nghiệm hấp thụ miễn dịch gắn enzyme |
| EFV | Efavirenz |
| GZR | Grazoprevir |
| G/P | Glecaprevir/Pibrentasvir |
| HBV | Hepatitis B Virus – Vi rút viêm gan B |
| HCV | Hepatitis C Virus – Vi rút viêm gan C |
| HCC | Hepatocellular carcinoma – Ung thư biểu mô tế bào gan |
| HCV core-Ag | Kháng nguyên lõi vi rút viêm gan C |
| HCV RNA | Hepatitis C Virus – Ribonucleic acid: RNA của vi rút viêm gan C |
| Hb | Hemoglobin – Huyết sắc tố |
| LDV | Ledipasvir |
| LPV | Lopinavir |
| NNRTI | Non-Nucleoside reverse transcriptase inhibitor – Thuốc ức chế enzym sao chép ngược không – nucleoside |
| NA | Nucleot(s)ide analogues |
| PCR | Polymerase Chain Reaction – Xét nghiệm khuếch đại chuỗi polymerase |
| PI | Protease inhibitor – Thuốc ức chế enzym protease |
| PIVKA-II | Prothrombin induced by vitamin K absence-II |
| RBV | Ribavirin |
| RTV | Ribonucleic acid |
| (r) | Ritonavir |
| SOF | Sofosbuvir |
| SVR | Sustained virological response – đáp ứng vi rút bền vững |
| BỘ Y TẾ | CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập – Tự do – Hạnh phúc |
HƯỚNG DẪN CHẨN ĐOÁN VÀ ĐIỀU TRỊ BỆNH VIÊM GAN VI RÚT C
(Ban hành kèm theo Quyết định số 2855/QĐ-BYT, ngày 25 tháng 9 năm 2024)
1. ĐẠI CƯƠNG
Bệnh viêm gan vi rút C là bệnh truyền nhiễm do vi rút viêm gan C (Hepatitis C Virus: HCV) gây ra. HCV có cấu trúc di truyền là sợi đơn RNA, thuộc họ Flaviviridae. HCV có 6 kiểu gen: 1, 2, 3, 4, 5, 6. Mỗi kiểu gen lại chia thành nhiều nhóm nhỏ. Ở Việt Nam, kiểu gen thường gặp nhất là 1 và 6. Các kiểu gen 2 và 3 ít gặp hơn. HCV chủ yếu lây qua đường máu, ngoài ra còn lây qua đường tình dục, mẹ truyền sang con.
Thuốc kháng vi-rút tác dụng trực tiếp (DAA) có thể chữa khỏi hơn 95% số người nhiễm viêm gan C, nhưng khả năng tiếp cận chẩn đoán và điều trị còn thấp. Hiện chưa có vắc-xin hiệu quả chống lại vi rút viêm gan C.
Trên toàn cầu, Tổ chức Y tế Thế giới ước tính có khoảng 50 triệu người bị viêm gan vi rút C mạn tính, với khoảng 1 triệu trường hợp nhiễm mới xảy ra mỗi năm. Năm 2022, ước tính có khoảng 242.000 người tử vong vì viêm gan C, chủ yếu là do xơ gan và ung thư biểu mô tế bào gan (ung thư gan nguyên phát).
Việt Nam là nước có gánh nặng về bệnh gan đứng thứ 4 trong khu vực Tây Thái Bình Dương. Tỷ lệ nhiễm vi rút viêm gan C mạn tính theo giám sát huyết thanh học năm 2018 là 1%; tỷ lệ này cao hơn nhiều ở người sống chung với HIV và người tiêm chích ma túy, năm 2021, theo ước tính gánh nặng bệnh tật của Tổ chức Y tế Thế giới; Bộ Y tế Việt Nam và Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh Hoa Kỳ, nước ta có hơn 900.000 người bị nhiễm HCV mạn trong đó gần 5.000 người tử vong do các bệnh gan liên quan đến HCV.
2. CHẨN ĐOÁN VIÊM GAN VI RÚT C
2.1. Triệu chứng
2.1.1. Lâm sàng
- Phần lớn người nhiễm HCV không có triệu chứng lâm sàng cho đến khi có biểu hiện xơ gan hoặc ung thư gan. Đôi khi có mệt mỏi, chán ăn, đầy bụng, đau nhẹ hạ sườn phải, rối loạn tiêu hóa, đau cơ,…
- Có thể có các biểu hiện ngoài gan như: đau khớp, viêm khớp, viêm da, tóc dễ gãy rụng, cryoglobulinemia (globulin bất thường trong máu), đau cơ, bệnh cơ tim, viêm cầu thận tăng sinh màng,…
2.1.2. Cận lâm sàng
a) Kháng thể kháng HCV (anti-HCV):
- Anti-HCV là xét nghiệm ban đầu để phát hiện tình trạng nhiễm HCV.
- Anti-HCV xuất hiện trong máu của người nhiễm HCV sau 8 – 12 tuần kể từ khi phơi nhiễm. Kháng thể anti-HCV tồn tại suốt đời, vì vậy một người có anti-HCV dương tính có thể đang nhiễm vi rút viêm gan C hoặc đã từng nhiễm vi rút viêm gan C nhưng đã tự khỏi hoặc đã khỏi bệnh do được điều trị.
- Trong trường hợp viêm gan vi rút C cấp ở giai đoạn sớm anti-HCV có thể âm tính nhưng HCV RNA dương tính.
- Một số trường hợp người nhiễm HCV ở người suy giảm miễn dịch nặng như người nhiễm HIV, người chạy thận nhân tạo, người điều trị thuốc ức chế miễn dịch có thể có anti-HCV âm tính vì thế nên được làm xét nghiệm HCV RNA để khẳng định nhiễm HCV khi có các biểu hiện bệnh gan (AST/ALT tăng,…).
- Đối với người bệnh lọc máu chu kỳ có anti-HCV dương tính thì xét nghiệm HCV RNA định kỳ 6 tháng/lần nếu trước đó xét nghiệm HCV RNA âm tính.
b) Kháng nguyên của HCV (HCVcAg, HCV RNA)
- HCV RNA định tính dương tính hoặc định lượng HCV RNA trên ngưỡng phát hiện: khẳng định nhiễm HCV.
- HCV core antigen – kháng nguyên lõi của HCV: xuất hiện trong máu của người bệnh sau 2 tuần nhiễm HCV. Trong trường hợp không làm được xét nghiệm HCV RNA, HCVcAg (HCV core Antigen) dương tính được coi là tiêu chuẩn xác định nhiễm HCV.
- Test đôi HCVcAg kết hợp anti-HCV (xét nghiệm kết hợp giữa kháng nguyên và kháng thể): giúp phát hiện và khẳng định nhiễm HCV sớm trong vòng 2 tuần sau phơi nhiễm. Trường hợp nghi ngờ có thể xét nghiệm khẳng định lại bằng HCV RNA.
c) Các xét nghiệm đánh giá giai đoạn bệnh
- Xơ hóa gan: tình trạng xơ hóa gan được đánh giá bằng các phương pháp không xâm lấn như chỉ điểm sinh hóa (APRI, FIB-4, FibroTest …) hay siêu âm đàn hồi (FibroScan, ARFI…). (Phụ lục 1).
- Xét nghiệm sinh hóa gan như ALT, AST có thể bình thường hoặc tăng; số lượng tiểu cầu, thời gian prothrombin, INR, albumin, bilirubin bình thường hoặc bất thường phụ thuộc vào tình trạng nặng của viêm gan hoặc xơ gan.
- Trường hợp có biến chứng ung thư biểu mô tế bào gan (Hepatocellular Carcinoma: HCC): AFP, AFP-L3, PIVKA-II có thể tăng; siêu âm, chụp cắt lớp vi tính, cộng hưởng từ vùng bụng có hình ảnh khối u gan.
2.2. Chẩn đoán xác định
2.2.1. Viêm gan vi rút C cấp
- Thời gian nhiễm HCV dưới 6 tháng: có chuyển đảo huyết thanh từ anti-HCV âm tính sang dương tính.
- Có tiền sử phơi nhiễm với nguồn bệnh.
- Không có biểu hiện lâm sàng hoặc có biểu hiện của viêm gan cấp: mệt mỏi, vàng da,…
- AST, ALT thường tăng.
- HCV RNA và/hoặc HCV core Ag: dương tính sau 2 tuần phơi nhiễm.
- Anti-HCV có thể âm tính trong vài tuần đầu, xét nghiệm này thường dương tính sau 8 -12 tuần phơi nhiễm.
Chẩn đoán nhiễm HCV cấp khi (1) có chuyển đảo anti-HCV từ âm tính sang dương tính hoặc (2) anti-HCV âm tính nhưng kháng nguyên HCV (HCV RNA, HCVcAg) dương tính ở người bình thường.
2.2.2. Viêm gan vi rút C mạn (xem hình 1)
- Thời gian nhiễm HCV > 6 tháng, tuy nhiên thường khó xác định chính xác thời điểm nhiễm.
- Có hoặc không có biểu hiện lâm sàng.
- Anti-HCV dương tính và HCV RNA dương tính hoặc HCVcAg dương tính.
- Không có/hoặc có xơ hóa gan, xơ gan (Phụ lục 1).
Người bệnh được chẩn đoán viêm gan vi rút C mạn khi có anti-HCV dương tính và HCV RNA dương tính hoặc tải lượng HCV RNA trên ngưỡng phát hiện hoặc HCVcAg dương tính (1868/QĐ-BYT, ngày 24/4/2020 của Bộ Y tế).
a) Các bước thực hiện chẩn đoán nhiễm HCV: (hình 1)
- Xét nghiệm anti-HCV.
- Nếu anti-HCV âm tính ở người bình thường nghĩa là không nhiễm HCV.
- Nếu anti-HCV dương tính nghĩa là đã từng hoặc hiện đang nhiễm HCV. Người bệnh có kết quả anti-HCV dương tính cần được xét nghiệm khẳng định tình trạng nhiễm HCV bằng một trong các xét nghiệm sau:
- Xét nghiệm tải lượng HCV RNA.
- Xét nghiệm định tính HCV RNA.
- Xét nghiệm phát hiện kháng nguyên lõi HCVcAg.
b) Chẩn đoán nhiễm HCV khi:
- Kết quả tải lượng HCV RNA trên giới hạn phát hiện, hoặc
- Xét nghiệm định tính HCV RNA có kết quả dương tính, hoặc
- Kết quả xét nghiệm HCVcAg dương tính.
Đối với người lọc máu hoặc suy giảm miễn dịch nặng, chẩn đoán xác định nhiễm HCV bằng xét nghiệm HCV RNA dương tính hoặc HCVcAg dương tính (anti-HCV có thể âm tính).
3. ĐIỀU TRỊ VIÊM GAN VI RÚT C
3.1. Điều trị viêm gan vi rút C cấp: Khoảng 25% bệnh nhân viêm gan cấp có thể tự khỏi trong vòng 6 tháng.
- Điều trị hỗ trợ: nghỉ ngơi và điều trị triệu chứng.
- Điều trị đặc hiệu:
- Điều trị sofosbuvir/velpatasvir hoặc glecaprevir/pibrentasvir trong thời gian 8 tuần nếu cần thiết.
- Xét nghiệm tải lượng HCV RNA ở tuần thứ 12 sau khi hoàn thành điều trị (SVR12) hoặc xét nghiệm trong khoảng thời gian từ tuần thứ 12 đến tuần thứ 24 nếu không thực hiện được SVR12 để đánh giá khả năng khỏi bệnh.
3.2. Điều trị viêm gan vi rút C mạn (xem hình 1)
3.2.1. Mục tiêu điều trị:
- Loại trừ HCV ra khỏi cơ thể người bệnh (đạt được đáp ứng vi rút bền vững): tải lượng HCV RNA dưới ngưỡng phát hiện ở tuần thứ 12 sau khi hoàn thành điều trị (SVR12) hoặc từ tuần 12 đến tuần 24 nếu khônglàm được SVR12.
- Phòng ngừa các biến chứng về gan và các bệnh ngoài gan liên quan đến HCV bao gồm viêm gan tiến triển, xơ hóa gan, xơ gan, HCC, biểu hiện ngoài gan nặng và tử vong.
- Dự phòng lây nhiễm HCV trong cộng đồng.
3.2.2. Nguyên tắc điều trị:
- Người bệnh được chẩn đoán viêm gan vi rút C cần điều trị sớm, đặc biệt trong các trường hợp sau: người bệnh có xơ hóa gan ≥ F2, người bệnh viêm gan vi rút C có biểu hiện ngoài gan, người bệnh đồng nhiễm HIV/HCV, người bệnh đồng nhiễm HBV/HCV, người bệnh nghiện chích ma túy, phụ nữ độ tuổi sinh đẻ mong muốn có thai,…
- Lựa chọn phác đồ có các thuốc DAA, ưu tiên các phác đồ có hiệu quả với tất cả các kiểu gen để người bệnh được điều trị sớm và điều trị trong ngày.
- Dựa vào tình trạng xơ gan, các chống chỉ định, tương tác thuốc và bệnh đi kèm để lựa chọn phác đồ (Bảng 1 cho người bệnh không xơ gan hoặc xơ gan còn bù; Bảng 2 cho người bệnh xơ gan mất bù).
- Các phác đồ sử dụng thuốc DAA thế hệ mới, chưa đề cập trong hướng dẫn này, có thể được xem xét, bổ sung dựa theo các hướng dẫn chuyên môn của Tổ chức Y tế Thế giới và các Hiệp hội Gan mật Châu Á Thái Bình Dương, Châu Âu, Châu Mỹ và theo các quy định liên quan đến phê duyệt và cấp phép sử dụng thuốc tại Việt Nam.
- Các trường hợp xơ gan mất bù cần được điều trị tại các cơ sở chuyên khoa tuyến tỉnh hoặc trung ương.
3.2.3. Phác đồ điều trị
Bảng 1. Phác đồ điều trị viêm gan vi rút C cho người bệnh > 3 tuổi không có xơ gan, xơ gan còn bù và điều trị lần đầu
| Nhóm tuổi | Thuốc điều trị cho tất cả kiểu gen | Thuốc điều trị kiểu gen 1, 4, 5, 6 | ||
| SOF/DAC1 | SOF/VEL | G/P2 | SOF/LED | |
| ≥ 18 tuổi | 12 tuần | 12 tuần | 8 tuần | 12 tuần |
| 12 – 17 tuổi | 12 tuần | 12 tuần | 8 tuần | 12 tuần |
| 6 – 11 tuổi | 12 tuần | 12 tuần | 8 tuần | 12 tuần |
| 3 – 5 tuổi | 12 tuần | 12 tuần | 8 tuần | 12 tuần |
Lưu ý:
- Liều lượng của các thuốc DAA (xem Bảng 3).
- Điều chỉnh liêu RBV theo cân nặng, mức độ thiếu máu và mức độ suy thận.
1Thời gian điều trị áp dụng cho người không có xơ gan. Trường hợp người bệnh đã từng điều trị trước đây hoặc có xơ gan còn bù cần điều trị trong 24 tuần. Có thể cân nhắc ở nơi có tỷ lệ genotype 3 > 10%;
2Thuốc hiện chưa có tại Việt Nam.
Bảng 2. Phác đồ điều trị viêm gan vi rút C cho người bệnh ≥ 3 tuổi có xơ gan mất bù (Child Pugh B hoặc C) và điều trị lần đầu
| Nhóm tuổi | Thuốc điều trị cho tất cả kiểu gen | Thuốc điều trị kiểu gen 1, 4, 5, 6 | |
| SOF/DAC1 | SOF/VEL | SOF/LED | |
| ≥ 18 tuổi | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) |
| 12 – 17 tuổi | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) |
| 6 – 11 tuổi | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) |
| 3 – 5 tuổi | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) | 24 tuần hoặc 12 tuần (+RBV) |
Lưu ý:
- Liều lượng của các thuốc DAA (xem Bảng 3).
- Điều chỉnh liêu RBV theo cân nặng, mức độ thiếu máu và mức độ suy thận.
3.2.4. Liều lượng thuốc điều trị viêm gan C
Bảng 3. Liều lượng thuốc điều trị viêm gan C
| Thuốc điều trị cho tất cả kiểu gen | Thuốc điều trị kiểu gen 1, 4, 5, 6 | ||
| SOF/DAC1 | SOF/VEL | G/P2 | SOF/LED |
| > 25 kg
400/60 mg x 1 lần/ngày |
> 30 kg
400/100 mg x 1 lần/ngày |
> 45 kg
300/120 mg x 1 lần/ngày |
> 35 kg
400/90 mg x 1 lần/ngày |
| 14 – 25 kg
200/30 mg x 1 lần/ngày |
17 – 30 kg
200/50 mg x 1 lần/ngày |
30 – 45 kg
250/100 mg x 1 lần/ngày |
17 – 35 kg
200/45 mg x 1 lần/ngày |
| 20 – < 30 kg
200/80 mg x 1 lần/ngày |
|||
| < 17 kg
150/37.5 mg x 1 lần/ngày |
< 20 kg
150/60 mg x 1 lần/ngày |
< 17 kg
150/33.75 mg x 1 lần/ngày |
|
3.2.5. Chỉ định và chống chỉ định điều trị viêm gan vi rút C
a) Chỉ định
Người bệnh được chẩn đoán viêm gan vi rút C (theo mục 2.2).
b) Chống chỉ định
Đối với phác đồ có các thuốc kháng vi rút trực tiếp (Directing Acting Antivirals: DAA)
- Trẻ < 3 tuổi.
- Phụ nữ có thai.
- Không sử dụng các DAA cùng với thuốc có tương tác gây ảnh hưởng đến hiệu quả điều trị hoặc gây các biến cố không mong muốn, tăng tác dụng phụ của thuốc.
Đối với phác đồ có ribavirin (RBV):
- Quá mẫn cảm với RBV.
- Thiếu máu nặng (hemoglobin < 8,5 g/dL).
- Bệnh về huyết sắc tố (bệnh hồng cầu hình liềm hoặc thalassemia).
- Phụ nữ có thai hoặc không muốn dùng các biện pháp tránh thai, phụ nữ đang cho con bú, nam giới có bạn tình đang/hoặc mong muốn mang thai.
3.2.6. Chuẩn bị điều trị
a) Đánh giá mức độ nặng của bệnh gan
- Đánh giá tình trạng xơ hóa gan dựa vào các phương pháp không xâm lấn như APRI, FIB-4, FibroScan,…Chẩn đoán xơ gan (F4) khi APRI ≥ 1 hoặc FibroScan ≥ 12.5 kPa. (Phụ lục 1). Sinh thiết gan khi cần thiết.
- Đánh giá xơ gan còn bù, mất bù dựa vào phân loại Child-Pugh: Child-Pugh A là xơ gan còn bù, Child-Pugh B, C là xơ gan mất bù.
b) Đánh giá bệnh lý đi kèm
- Người bệnh viêm gan vi rút C cần được đánh giá các bệnh lý đi kèm như:
- Đánh giá tình trạng đồng nhiễm vi rút viêm gan B, HIV.
- Đánh giá chức năng thận và mức lọc cầu thận.
- Đánh giá các bệnh rối loạn chuyển hóa: đái tháo đường, rối loạn lipid máu, hội chứng chuyển hóa,…
- Đánh giá tình trạng nghiện rượu
c) Đánh giá tương tác thuốc
Đánh giá khả năng tương tác thuốc với các thuốc đang sử dụng như thuốc kháng HIV (antiretrovirals: ARV), thuốc chống lao, thuốc chống co giật, thuốc điều trị rối loạn nhịp tim, thuốc ức chế bơm proton… (xem Phụ lục 5).
d) Các xét nghiệm
- Các xét nghiệm khi bắt đầu điều trị và theo dõi điều trị viêm gan vi rút C (xem Phụ lục 2).
- Xét nghiệm kiểu gen HCV khi sử dụng các phác đồ không điều trị được tất cả các kiểu gen và/hoặc đối với người bệnh đã từng thất bại điều trị viêm gan vi rút C. Những cơ sở làm được xét nghiệm kiểu gen HCV thì có thể thực hiện trước khi điều trị.
- Đối với phụ nữ trong tuổi sinh đẻ hoặc nghi ngờ có thai cần xét nghiệm thử thai.
- Các xét nghiệm khác theo chỉ định lâm sàng.
e) Cung cấp thông tin và tư vấn trước điều trị
- Phác đồ điều trị, hiệu quả của điều trị, tác dụng phụ, khả năng tái nhiễm HCV.
- Nguy cơ HCC đặc biệt đối với người bệnh có độ xơ hóa gan ≥ F3.
- Khả năng tương tác thuốc DAA với các thuốc khác và yêu cầu người bệnh phải thông báo cho thầy thuốc các loại thuốc khác được kê đơn trước và trong khi điều trị viêm gan vi rút C bao gồm cả thực phẩm chức năng.
- Tuân thủ điều trị
- Sự cần thiết của việc xét nghiệm tải lượng HCV lần 2 để khẳng định khỏi bệnh.
- Tránh đồ uống có cồn (rượu, bia,…).
- Tư vấn dự phòng tái nhiễm và dự phòng lây nhiễm HCV.
- Tư vấn sử dụng biện pháp tránh thai trong quá trình điều trị thuốc DAA đối với cả người bệnh và bạn tình. Trong trường hợp sử dụng ribavirin, tiếp tục sử dụng các biện pháp tránh thai cho đến 6 tháng sau khi hoàn thành điều trị.
3.2.7. Điều trị viêm gan vi rút C ở một số trường hợp đặc biệt
a) Điều trị viêm gan vi rút C cho trẻ em không xơ gan và xơ gan (Bảng 1, Bảng 2, Bảng 3)
Trẻ dưới 3 tuổi: yrì hoãn điều trị cho đến khi trẻ đủ 3 tuổi.
b) Người bệnh viêm gan vi rút C đồng nhiễm HIV
Người bệnh đồng nhiễm HCV/HIV cần được điều trị ARV ngay khi phát hiện nhiễm HIV và điều trị HCV khi đã dung nạp được điều trị ARV.
Chỉ định điều trị viêm gan vi rút C cho người nhiễm HIV giống như người không nhiễm HIV.
Lựa chọn phác đồ điều trị ARV và phác đồ điều trị viêm gan vi rút C tối ưu để tránh tương tác thuốc (xem Phụ lục 5), nếu cần thiết phải điều chỉnh liều DAA.
b1) Trường hợp người bệnh điều trị HIV bằng phác đồ tenofovir/lamivudin/dolutegravir
(TDF/3TC/DTG hoặc TLD): điều trị như người viêm gan vi rút C không nhiễm HIV.
Lưu ý: Không chỉ định phác đồ SOF/VEL hoặc SOF/LDV khi mức lọc cầu thận < 60 ml/phút/1.73m².
b2) Trường hợp người bệnh điều trị HIV bằng phác đồ khác TLD:
- Chuyển sang phác đồ TLD nếu có thể trước khi điều trị HCV.
- Người bệnh điều trị phác đồ có efavirenz (EFV), nevirapine (NVP): ưu tiên sử dụng phác đồ SOF/DAC: điều chỉnh liều DAC lên 90 mg.
- Người nhiễm HIV điều trị phác đồ có lopinavir/ritonavir (LPV/r)
- Ưu tiên sử dụng phác đồ: SOF/VEL; SOF/DAC.
- Phác đồ thay thế: SOF/LDV.
- Không sử dụng phác đồ G/P, ELB/GRZ và SOF/VEL/VOX.
Tương tác thuốc giữa LDV và TDF có thể gây tăng độc tính với thận. Người bệnh cần theo dõi chức năng thận nếu sử dụng đồng thời 2 thuốc này. Không chỉ định phác đồ có LDV khi mức lọc cầu thận < 60 ml/phút/1.73m².
Lưu ý không phối hợp các phác đồ sau để điều trị đồng nhiễm HCV/HIV
- SOF/VEL không phối hợp với EFV, NVP.
- SOF/VEL/VOX không dùng đồng thời với EFV, NVP, ATV/r, LPV/r.
- RBV không phối hợp với AZT.
- ELB/GRZ không dùng đồng thời với EFV, NVP hoặc bất kỳ PI.
- G/P không dùng đồng thời với EFV, NVP, LPV, ATV hoặc các phác đồ ARV có ritonavir.
c) Người bệnh đồng nhiễm HCV/HBV
- Người bệnh đồng nhiễm HCV/HBV điều trị bằng các phác đồ kháng HCV như người nhiễm HCV đơn thuần.
- Người đồng nhiễm HCV/HBV đủ tiêu chuẩn điều trị HBV thì điều trị đồng thời HBV và HCV (chú ý tương tác thuốc, đặc biệt giữa TDF và SOF, xem Phụ lục 5).
- Người đồng nhiễm HCV/HBV chưa đủ tiêu chuẩn điều trị HBV thì điều trị dự phòng HBV bằng thuốc kháng HBV (NA: nucleot(s)ide analogues) khi bắt đầu điều trị thuốc DAA, tiếp tục cho đến khi hoàn thành điều trị DAA tối thiểu 12 tuần và theo dõi định kỳ nếu ngưng NA.
- Nguy cơ tái hoạt HBV ở người viêm gan vi rút C có HBsAg âm tính, anti-HBs âm tính, nhưng anti-HBc dương tính rất thấp trong quá trình điều trị thuốc DAA. Những người này không điều trị dự phòng bằng NA, chỉ theo dõi ALT, AST mỗi 4-8 tuần trong thời gian điều trị thuốc DAA và trong 12 tuần sau khi hoàn thành điều trị DAA. Nếu ALT, AST tăng nên làm thêm xét nghiệm HBsAg và HBV DNA để có thể phát hiện HBV tái hoạt. Điều trị NA nếu có bằng chứng tái hoạt (HBsAg dương và/hoặc HBV DNA phát hiện được).
d) Người bệnh có bệnh thận mạn
- Người bệnh suy thận mức độ nhẹ đến trung bình (mức lọc cầu thận > 30 ml/phút/1,73m²) hoặc mức độ nặng (mức lọc cầu thận ≤ 30 ml/phút/1,73m²) bao gồm người bệnh lọc máu, chạy thận nhân tạo được điều trị các phác đồ phù hợp mà không cần điều chỉnh liều thuốc DAA như G/P, SOF/VEL, SOF/DAC cho tất cả kiểu gen.
- Người bệnh xơ gan mất bù có suy thận nhẹ đến trung bình (mức lọc cầu thận > 30 ml/phút/1,73m²) nếu điều trị phác đồ SOF/VEL 12 tuần có RBV thì liều RBV bắt đầu là 600 mg và điều chỉnh liều RBV tùy theo độ dung nạp và hemoglobin.
- Người bệnh xơ gan mất bù có suy thận nặng (mức lọc cầu thận ≤ 30 ml/phút/1,73m²) nên điều trị phác đồ SOF/VEL 24 tuần không có RBV.
e) Người bệnh đồng nhiễm lao/HCV
- Khi điều trị lao và điều trị viêm gan vi rút C, lưu ý tương tác thuốc giữa các thuốc DAA và rifampicin (Phụ lục 5).
- Cân nhắc điều trị lao tiến triển trước, khi ổn định điều trị viêm gan vi rút C. Trường hợp người bệnh xơ hóa tiến triển từ F3 hoặc xơ gan, cân nhắc điều trị viêm gan C sớm và hội chẩn chuyên khoa lao để lựa chọn phác đồ lao không tương tác với thuốc DAA.
- Điều trị viêm gan C cho người bệnh đồng nhiễm lao/HCV như người bệnh viêm gan vi rút C đơn nhiễm.
3.2.8. Theo dõi điều trị
a) Theo dõi tương tác thuốc
- Đánh giá tương tác thuốc trước khi điều trị viêm gan vi rút C và trước khi người bệnh bắt đầu điều trị các thuốc khác trong quá trình điều trị (Phụ lục 5).
- Theo dõi đánh giá tương tác thuốc đặc biệt quan trọng đối với người bệnh đồng nhiễm HCV/HIV do nhiều thuốc DAA có tương tác với ARV, người bệnh có rối loạn nhịp tim điều trị amiodaron có tương tác với SOF, VEL gây chậm nhịp tim, người bệnh đang sử dụng nhóm statin điều trị hạ lipid máu có thể tương tác với SOF gây tăng nguy cơ ly giải cơ vân…
b) Theo dõi tác dụng không mong muốn
- Các thuốc DAA có một số tác dụng không mong muốn nhẹ, thường tự khỏi. Xét nghiệm chức năng thận và đánh giá mức lọc cầu thận nếu nghi ngờ suy thận khi sử dụng các phác đồ DAA cùng với các thuốc khác có khả năng tương tác gây độc tính lên thận.
- Đối với người bệnh điều trị RBV: theo dõi chặt chẽ các tác dụng không mong muốn của RBV, xét nghiệm hemoglobin và điều chỉnh liều dựa trên mức hemoglobin.
- Đối với người bệnh không có bệnh tim mạch: giảm liều RBV nếu Hemoglobin < 10 g/dL hoặc giảm trên 3 g/dL.
- Hemoglobin 8.5 – < 10 g/dL: giảm liều RBV 50% cho đến liều 200 mg/ngày và có thể dùng thêm erythropoietin, darbepoietin.
- Hemoglobin < 8.5 g/dL: ngừng điều trị.
- Đối với người bệnh có tiền sử bệnh tim mạch ổn định: giảm liều RBV nếu hemoglobin giảm nhiều hơn 2 g/dL trong thời gian điều trị 4 tuần. Nếu sau 4 tuần giảm liều mà hemoglobin vẫn giảm nhiều hơn 2 g/dL thì ngừng điều trị RBV.
c) Tuân thủ điều trị và tư vấn hỗ trợ khác
- Người bệnh cần được cung cấp thông tin về tầm quan trọng của tuân thủ điều trị, đánh giá tuân thủ điều trị mỗi lần tái khám, nhận thuốc.
- Tư vấn về tác hại của rượu bia.
- Tư vấn về dinh dưỡng, đặc biệt cho người bệnh xơ gan.
- Tư vấn và kết nối người bệnh viêm gan vi rút C nghiện chích ma túy đến các dịch vụ giảm hại.
- Tư vấn nguy cơ xơ gan và HCC.
d) Xử trí khi người bệnh viêm gan C quên thuốc

e) Theo dõi đáp ứng điều trị viêm gan vi rút C mạn
Điều trị khỏi
- Đạt được đáp ứng vi rút bền vững (SVR): tải lượng HCV RNA dưới ngưỡng phát hiện ở tuần thứ 12 sau khi hoàn thành điều trị (SVR12) hoặc từ tuần 12 đến tuần 24 nếu không làm được SVR12.
- Theo dõi người bệnh sau khi điều trị khỏi:
- Theo dõi để phát hiện sớm biến chứng HCC, đặc biệt ở người có xơ hóa gan ≥ 3 bằng siêu âm bụng và các chỉ dấu ung thư gan mỗi 6 tháng. Các chỉ dấu ung thư gan có thể sử dụng là AFP và/hoặc AFP-L3 và/hoặc PIVKA-II. Trường hợp nghi ngờ ung thư gan thì tiến hành chụp cắt lớp bụng có tiêm thuốc cản quang hoặc chụp cộng hưởng từ có tiêm thuốc cản từ để chẩn đoán xác định.
- Theo dõi biến chứng đối với người bệnh xơ gan: nội soi dạ dày phát hiện giãn tĩnh mạch thực quản để phòng ngừa xuất huyết do vỡ giãn tĩnh mạch thực quản…
- Tư vấn dự phòng tái nhiễm HCV trên người có nguy cơ nhiễm HCV tiếp diễn như tiêm chích ma túy, quan hệ tình dục đồng giới,… Chỉ định xét nghiệm HCV RNA cho các trường hợp có nguy cơ tái nhiễm sau 6 tháng kể từ khi được chẩn đoán khỏi bệnh để phát hiện tái nhiễm vi rút viêm gan C.
- Người bệnh có nguy cơ tái nhiễm HCV hoặc có men gan tăng trở lại: cần xét nghiệm tải lượng HCV để phát hiện bệnh tái phát hoặc tái nhiễm HCV.
Ngừng điều trị
Việc ngừng điều trị do tác dụng phụ rất ít gặp khi điều trị với phác đồ DAA. Tuy nhiên, có thể ngừng điều trị khi người bệnh có các tác dụng không mong muốn nặng, đe dọa tính mạng (đặc biệt đối với phác đồ có ribavirin):
- ALT tăng ≥ 10 lần ở tuần điều trị thứ 4.
- ALT tăng dưới 10 lần ở tuần điều trị thứ 4 nhưng kèm theo bất kỳ tình trạng nào sau đây: suy nhược, buồn nôn, nôn, hội chứng não gan, ứ mật có tăng Bilirubin (Bilirubin TP > 3 mg/dL hoặc Bilirubin TT > 1,5 mg/dL) và/hoặc tăng phosphatase kiềm có ý nghĩa.
- ALT tăng dưới 10 lần ở tuần điều trị thứ 4 và không giảm ở tuần thứ 6 và tuần thứ 8: xem xét ngưng điều trị sau khi đã loại trừ tăng ALT do các nguyên nhân khác.
Điều trị lại đối với người bệnh thất bại điều trị
- Thất bại điều trị được xác nhận khi xét nghiệm tải lượng vi rút HCV lần 2 (sau 12-24 tuần kể từ khi hoàn thành điều trị) có kết quả trên ngưỡng phát hiện.
- Đối với các trường hợp thất bại điều trị, cần đánh giá lại việc tuân thủ điều trị, khả năng có tương tác thuốc… Trong trường hợp người bệnh tuân thủ điều trị tốt nhưng vẫn thất bại điều trị thì cần xét nghiệm kiểu gen HCV, xét nghiệm gen kháng thuốc nếu có điều kiện. Chuyển tuyến/hội chẩn xin ý kiến chuyên gia để chọn lựa phác đồ thích hợp cho từng người bệnh (nếu cần).
Bảng 7. Phác đồ điều trị cho người có thất bại điều trị
| Phác đồ điều trị thất bại | Phác đồ điều trị lại và thời gian điều trị | ||
| Phác đồ thay thế | Không xơ gan và xơ gan còn bù | Xơ gan mất bù | |
| SOF + RBV | SOF/VEL/VOX | 12 tuần | Không |
| SOF/VEL | 12 tuần | 24 tuần (+RBV) | |
| G/P | 12 tuần | Không | |
| SOF/DAC
SOF/LDV |
SOF/VEL/VOX | 12 tuần | Không |
| SOF/VEL +RBV | 24 tuần | 24 tuần | |
| G/P | 12 tuần | Không | |
| SOF/VEL | SOF/VEL/VOX | 12 tuần | Không |
| G/P | 12 tuần | Không | |
| SOF/VEL +RBV | 24 tuần | 24 tuần | |
Lưu ý: DAA các trường hợp thất bại điều trị với các phác đồ chưa đề cập trong Bảng 7, việc chưa chọn phác đồ điều trị lại phải có ý kiến hội chẩn với chuyên gia trọng từng trường hợp cụ thể.
4. PHÒNG BỆNH
4.1. Dự phòng nhiễm HCV
- Hiện tại chưa có vắc xin phòng bệnh viêm gan C, vì vậy biện pháp phòng bệnh cơ bản là phát hiện sớm, chẩn đoán sớm, điều trị bệnh sớm và thích hợp.
- Tăng cường sàng lọc nhiễm HCV và đảm bảo an toàn truyền máu.
- Giảm nguy cơ phơi nhiễm với HCV trong môi trường y tế, đảm bảo tiêm an toàn và thực hiện kiểm soát nhiễm khuẩn.
- Can thiệp giảm hại cho quần thể nguy cơ cao.
- Triển khai chương trình cung cấp bơm kim tiêm sạch, sử dụng bơm tiêm có khoảng chết thấp cho người tiêm chích ma túy.
- Cung cấp điều trị thay thế chất gây nghiện dạng thuốc phiện nhằm giảm hành vi nguy cơ và lây truyền HCV đồng thời góp phần tăng cường tuân thủ điều trị HCV.
- Tư vấn về quan hệ tình dục an toàn bằng cách sử dụng bao cao su dự phòng lây truyền viêm gan C và các bệnh lây truyền qua đường tình dục.
- Lồng ghép dịch vụ cung cấp bao cao su với các dịch vụ y tế cho các quần thể nguy cơ cao và người nhiễm HIV.
4.2. Dự phòng lây truyền HCV từ mẹ sang con
- Phụ nữ độ tuổi sinh đẻ được chẩn đoán viêm gan C cần được điều trị trước khi có kế hoạch mang thai.
- Xét nghiệm anti-HCV cho phụ nữ mang thai có nguy cơ cao. Nếu phụ nữ mang thai có kết quả anti-HCV dương tính thì tư vấn khả năng lây truyền cho con và chuyển gửi xét nghiệm chẩn đoán và điều trị. Tất cả trẻ em sinh ra từ mẹ bị viêm gan vi rút C cần được xét nghiệm xác định tình trạng nhiễm HCV.
- Xét nghiệm anti-HCV thực hiện khi trẻ từ 18 tháng tuổi.
- Trẻ có anti-HCV dương tính cần được xét nghiệm HCV RNA sau 3 tuổi để khẳng định nhiễm HCV mạn.
Hình 1. Sơ đồ xét nghiệm và điều trị nhiễm HCV

PHỤ LỤC 1
Đánh giá các giai đoạn và mức độ xơ hóa gan
(Ban hành kèm theo Quyết định số 2855/QÐ- BYT ngày 25 tháng 9 năm 2024 của Bộ trưởng Bộ Y tế)
Xơ hóa gan gồm 4 giai đoạn theo phân loại Metavir trên mô học:
- F0: không xơ hoá.
- F1: xơ hoá khoảng cửa (portal fibrosis).
- F2: xơ hoá khoảng cửa với vài vách (portal fibrosis with few septa).
- F3: xơ hoá vách (septal fibrosis).
- F4: xơ gan.
Các mức độ xơ hóa gan gồm:
- Xơ hoá nhẹ hay không xơ hoá: F0, F1.
- Xơ hóa đáng kể (significant fibrosis): F ≥ 2.
- Xơ hóa tiến triển hay nặng (advanced fibrosis): F ≥ 3 (có nguy cơ HCC rất cao).
- Xơ gan (cirrhosis): F4.
- Đo độ đàn hồi gan (FibroScan)
F0 – F1: <7,1 Kpa
F2: 7,1 – <9,5 Kpa.
F3: 9,5 – <12,5 KPa.
F4: ≥ 12,5 KPa.
- Chỉ số APRI:

F0 – F1: < 0,5
F2 – F3: 0,5 – 1
F4: >1.
*ULN (upper limit of normal): giới hạn bình thường trên của phòng xét nghiệm.
3. FIB-4
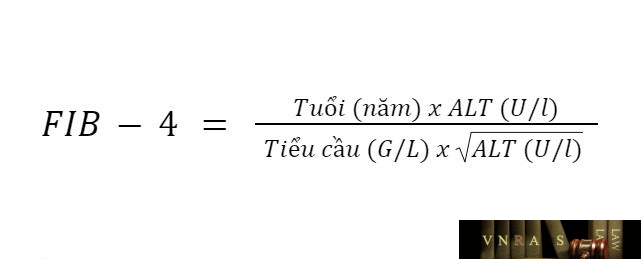
FIB-4 1.45-3,25: F2-F3
FIB-4 > 3,25: F4
(Lưu ý: FIB-4 sử dụng thận trọng ở những bệnh nhân < 35 hoặc > 65 tuổi, vì điểm FIB-4 đã được chứng minh là kém tin cậy hơn ở những người bệnh này).
- Phân loại Child-Pugh
| Tiêu chuẩn để đánh giá | 1 điểm | 2 điểm | 3 điểm |
| Bệnh não gan | Không | Giai đoạn 1 – 2 | Giai đoạn 3 – 4 |
| Cổ chướng | Không | Ít | Nhiều |
| Bilirubin huyết thanh (mg/dl)
(μmol/L) |
< 2
< 35 |
2 – 3
35 – 50 |
> 3
> 50 |
| Albumin huyết thanh (g/dL) | > 3.5 | 2.8 – 3.5 | < 2.8 |
| Tỷ lệ prothrombin (%) hay INR | > 64
< 1.7 |
44 – 64
1.7 – 2.3 |
< 44
> 2.3 |
- Child-Pugh A: 5 – 6 điểm
- Child-Pugh B: 7 – 9 điểm
- Child-Pugh C: ≥ 10 điểm
*Child – Pugh A: xơ gan còn bù: Child – Pugh B, C: xơ gan mất bù
PHỤ LỤC 2
Các xét nghiệm theo dõi trước, trong và sau điều trị viêm gan vi rút C
(Ban hành kèm theo Quyết định số 2855/QÐ- BYT ngày 25 tháng 9 năm 2024 của Bộ trưởng Bộ Y tế)
| Xét nghiệm | Trước điều trị | Tuần thứ 4 | Tuần thứ 12 kể từ khi hoàn thành điều trị |
| Công thức máu | x | x1 | x |
| Tỷ lệ Prothrombin/INR2 | x | x | x |
| Albumin máu2 | x | x | x |
| Bilirubin toàn phần và Bilirubin trực tiếp2 | x | x | x |
| AST, ALT, GGT | x | x3 | x |
| Đường máu | x | x | |
| Mỡ máu | x | ||
| Creatinine máu | x | x4 | x |
| Siêu âm bụng | x | x | |
| Đánh giá tình trạng xơ hóa gan (Phụ lục 1) | x | x | |
| HCV RNA | x5 | x6 | |
| Kiểu gen HCV | x7 | ||
| HIV | x | ||
| HBsAg, anti-HBc, anti-HBs | x | ||
| AFP | x | x | |
| Test thử thai (phụ nữ tuổi sinh đẻ) | x |
- Xét nghiệm bổ sung khi điều trị phác đồ có ribavirin (RBV) hoặc người bệnh xơ gan mất bù.
- Xét nghiệm ở những nơi có sẵn và/hoặc khi nghi ngờ người bệnh xơ gan hoặc theo dõi xơ gan.
- Xét nghiệm khi có men gan tăng trước điều trị hoặc người bệnh xơ gan mất bù.
- Xét nghiệm mỗi tháng khi nghi ngờ có bệnh thận và khi điều trị phác đồ có ribavirin (RBV).
- Nếu không có HCV RNA thì xét nghiệm HCV core Ag.
- Trường hợp không xét nghiệm được HCV RNA ở tuần thứ 12 sau khi hoàn thành điều trị thì tiến hành xét nghiệm từ tuần 12 đến tuần 24.
- Xét nghiệm khi lựa chọn phác đồ không có tác dụng với tất cả các kiểu gen, hoặc khi người bệnh thất bại điều trị.
Các xét nghiệm khác: tùy theo tình trạng lâm sàng của người bệnh.
PHỤ LỤC 3.
Các nhóm thuốc kháng vi rút trực tiếp (Direct Acting Antivirals: DAA)
(Ban hành kèm theo Quyết định số 2855/QÐ- BYT ngày 25 tháng 9 năm 2024 của Bộ trưởng Bộ Y tế)
| Nhóm thuốc điều trị viêm gan C | ||
| NS3/4A (ức chế protease) | Ức chế NS5A | Ức chế polymerase NS5B (NA) |
| Glecaprevir (GLE) | Daclatasvir (DAC) | Sofosbuvir (SOF) |
| Voxilaprevir (VOX) | Velpatasvir (VEL) | |
| Grazoprevir (GRV) | Ledipasvir (LDV) | |
| Pibrentasvir (PIB)* | ||
| Elbasvir (EBV)* | ||
| Dạng thuốc | ||
| Phối hợp liều cố định (FDC) | SOF 400 mg/VEL 100 mg | |
| SOF 400 mg/DAC 60 mg | ||
| GLE 300 mg/PIB 120 mg | ||
| EBV 50 mg/GRV 120 mg | ||
| SOF 400 mg/LDV 90 mg | ||
| SOF 400 mg/VEL 100 mg/VOX 100 mg | ||
| Dạng viên rời | Sofosbuvir 400 mg | |
| Daclatasvir 60 mg | ||
| Daclatasvir 30 mg | ||
| Thuốc dành cho trẻ em từ 3 đến 17 tuổi | Sofosbuvir 400mg/ZLedipasvir 90mg | |
Sofosbuvir/Velpatasvir: có 2 dạng viên phối hợp cho trẻ:
|
||
| G/P: viên phối hợp Glecaprevir 50 mg/Pibrentasvir 20 mg | ||
*Các thuốc thuộc nhóm NS3/4A, Pibrentasvir (P) và Elbasvir (ELV) hiện chưa có tại Việt Nam.
PHỤ LỤC 4.
Bảng liều lượng RBV
(Ban hành kèm theo Quyết định số 2855/QĐ-BYT ngày 25 tháng 9 năm 2024 của Bộ trưởng Bộ Y tế)
| Cân nặng (kg) | Liều lượng |
| < 75 kg | 1000 mg/ngày |
| ≥ 75 kg | 1200 mg/ngày |
| Suy thận | |
| Mức độ trung bình (eGR: 30-59 mL/phút) | 600 mg/ngày |
| Mức độ nặng (15-29 mL/phút) | 400 mg/ngày |
| Giai đoạn cuối (< 15 mL/phút) | 200 mg/ngày |
| Thiếu máu | Giảm liều dựa vào kết quả hemoglobin (xem phần b mục 3.2.8) |
PHỤ LỤC 5.
Một số tương tác giữa thuốc điều trị viêm gan C và các thuốc khác tham khảo theo bảng hoặc link sau https://www.hep-druginteractions.org/
(Ban hành kèm theo Quyết định số 2855/QĐ-BYT ngày 25 tháng 9 năm 2024 của Bộ trưởng Bộ Y tế)
| Thuốc | Thuốc kết hợp | Ảnh hưởng khi kết hợp | Khuyến cáo xử trí |
| RBV | AZT | Tăng nguy cơ thiếu máu | Thay thế AZT bằng ARV khác |
| Sofosbuvir (SOF) | Amiodaron | Làm chậm nhịp tim | Chỉ sử dụng amiodarone khi không sẵn có thuốc thay thế và theo dõi chặt chẽ |
| Các thuốc kích thích
cytochrome P450 3A (CYP3A): thuốc chống co giật (phenobarbital, phenitoin, carbamazepin, oxcarbazepin), rifampicin, tipranavir |
Giảm nồng độ SOF, ảnh hưởng đến hiệu quả điều trị HCV | Không sử dụng SOF cùng với thuốc chống co giật, rifampicin trong quá trình điều trị viêm gan C.
Không sử dụng SOF cùng với tipranavir trong quá trình điều trị viêm gan C. |
|
| Ledipasvir (LDV) | TDF
TDF + PI/r |
Tăng độc tính trên thận | Theo dõi mức lọc cầu thận, không sử dụng LDV cùng TDF nếu mức lọc cầu thận <60ml/phút. Sử dụng LDV cùng TDF + PI/r phải theo dõi độc tính của TDF lên thận. |
| Các thuốc giảm a xít | Giảm hấp thu LDV đo đó giảm nồng độ của LDV | Uống SOF/LDV cách thuốc kháng acid 4 giờ, cách giờ hoặc cùng giờ thuốc đối kháng thụ thể H2, cùng giờ với thuốc ức chế proton. | |
| Daclatasvir (DAC) | Các thuốc kích thích
CYP3A: thuốc chống co giật (phenobarbital, phenitoin, carbamazepin, oxcarbazepin), rifampicin, ARV (EFV, NVP) |
Giảm nồng độ DAC do đó giảm hiệu quả điều trị HCV | Không sử dụng DAC cùng với thuốc chống co giật, rifampicin trong quá trình điều trị viêm gan C.
Tăng liều DAC lên 90 mg/ngày khi điều trị người bệnh nhiễm HIV đang điều trị phác đồ có các thuốc kích thích CYP3A |
| Sử dụng SOF/LDV với các thuốc ức chế CYP3A (clarithromycin, itraconazole, ketoconazole, ATV/r) | Tăng nồng độ DAC | Giảm liều DAC xuống 30 mg/ngày khi điều trị người nhiễm HIV đang dùng phác đồ ARV có ATV/r hoặc các thuốc ức chế CYP3A khác. | |
| Velpatasvir (VEL) | Các thuốc giảm a xít | Giảm nồng độ VEL | Uống SOF/VEL cách thuốc kháng acid 4 giờ, cách 12 giờ hoặc cùng giờ thuốc đối kháng thụ thể H2, uống cùng với thức ăn và trước 4 giờ khi uống omeprazole |
| Amiodaron | Làm chậm nhịp tim | Không dùng đồng thời trong quá trình điều trị viêm gan C. Trường hợp bắt buộc thì cần theo dõi chặt chẽ. | |
| Digoxin | Tăng nồng độ Digoxin | Giảm liều digoxin 50%, theo dõi sát điện tâm đồ và nhịp tim | |
| Chống ung thư: topotecan
Chống co giật: carbamazepine phenytoin phenobarbital oxcarbazepine Kháng mycobacteria: rifabutin, rifampicin, rifapentin |
Tăng nồng độ topotecan, giảm nồng độ SOF/VEL | Không dùng đồng thời trong quá trình điều trị viêm gan C | |
| Efavirenz, nevirapin, Etravirine | Giảm nồng độ VEL | Không dùng đồng thời trong quá trình điều trị viêm gan C | |
| Tenofovir (TDF) | Tăng nồng độ TDF | Theo dõi sát chức năng thận | |
| Tipranavir/ritonavir | Giảm nồng độ SOF/VEL | Không dùng đồng thời trong quá trình điều trị viêm gan C | |
| Rosuvastatin
Atorvastatin |
Tăng nồng độ rosuvastatin và atorvastatin | Tăng nguy cơ bệnh cơ, bao gồm cả tiêu cơ vân, không dùng rosuvastatin quá 10mg. Theo dõi chặt chẽ tình trạng tiêu cơ | |
| SMV tương tác với nhiều thuốc ARV | Giảm nồng độ SMV ảnh hưởng đến hiệu quả điều trị HCV | Không nên sử dụng SMV với NVP, EFV, PI/r, delavirdin, etravirin, cobicistat. | |
| Elbasvir (EBV)/Grazoprevir (GZV) | Elbasvir/Grazoprevir tương tác với các thuốc kích thích CYP3A ở gan (rifampicin, hầu hết các thuốc chống co giật,…) | Giảm nồng độ elbasvir/grazoprevir ảnh hưởng đến hiệu quả điều trị HCV | Không sử dụng đồng thời elbasvir/grazoprevir với các thuốc kích thích CYP3A trong quá trình điều trị viêm gan C. |
| EFV, etravirin, nevirapin | Tăng nồng độ elbasvir/grazoprevir | Không sử dụng đồng thời elbasvir/grazoprevir với các thuốc ức chế CYP3A trong quá trình điều trị viêm gan C. | |
| ATV, darunavir, LPV,
tipranavir |
Có thể gây tăng ALT do tăng nồng độ grazoprevir | Không sử dụng đông thời EBV/GZV với EFV, ATV, LPV, darunavir, tipranavir trong quá trình điều trị viêm gan C | |
| G/P | Cyclosporine | Tăng nồng độ voxilaprevir | Không sử dụng đồng thời trong quá trình điều trị viêm gan C |
| Các thuốc kích thích
CYP3A: thuốc chống co giật (phenobarbital, phenitoin, carbamazepin, oxcarbazepin), rifampicin |
Giảm nồng độ G/P | Không sử dụng đồng thời trong quá trình điều trị viêm gan C | |
| EFV, NVP | Giảm nồng độ G/P | Không sử dụng đồng thời trong quá trình điều trị viêm gan C | |
| ATV/r, LPV/r, ritonavir | Có thể gây tăng nồng độ ATV | Không sử dụng đồng thời trong quá trình điều trị viêm gan C | |
| Các thuốc ức chế proton, kháng H2 | Giảm nồng độ G/P | ||
| Rosuvastatin | Tăng nồng độ Rosuvastatin | Giảm liều rosuvastatin | |
| Atorvastatin
Simvastatin |
Tăng nồng độ Atorvastatin
Simvastatin |
Không sử dụng đồng thời trong quá trình điều trị viêm gan C | |
| Voxilaprevir | Cyclosporine
Methotrexat |
Tăng nồng độ voxilaprevir | Không sử dụng đồng thời trong quá trình điều trị viêm gan C |
| Rosuvastatin | Tăng nồng độ Rosuvastatin | Không sử dụng đồng thời trong quá trình điều trị viêm gan C | |
| Các thuốc chống đông máu: endoxaban, dabigatran | Tăng nồng độ voxilaprevir | Không sử dụng đồng thời trong quá trình điều trị viêm gan C | |
| ATV/r, LPV | Tăng nồng độ voxilaprevir | Không sử dụng đồng thời trong quá trình điều trị viêm gan C |































