Y tế - Sức Khỏe
Hội chứng suy hô hấp cấp 2022 : Chẩn đoán, kết cục và điều trị
nhathuocluuanh. Hội chứng suy hô hấp cấp (ARDS) 2022
Để tải file PDF, hãy click TẠI ĐÂY.
Hội chứng suy hô hấp cấp ở người trưởng thành: chẩn đoán, kết cục, di chứng lâu dài và điều trị
Ellen A Gorman, Cecilia M O’Kane, Daniel F McAuley
Dịch: Bác sĩ.Huỳnh Phạm Hoàng Nam
Hội chứng suy hô hấp cấp (ARDS) có đặc trưng là suy hô hấp giảm oxy máu cấp tính và hình ảnh thâm nhiễm 2 phế trường trên phim phổi, mà không thể giải tích đầy đủ do suy tim hay quá tải dịch. ARDS được định nghĩa theo tiêu chuẩn Berlin. Trong tập san này sẽ thảo luận về chẩn đoán, điều trị, kết cục và di chứng lâu dài. Các hạn chế tiềm năng của định nghĩa ARDS và bằng chứng cung cấp thêm trong tương lai sẽ được xem xét. Hướng dẫn các khuyến cáo, chứng cứ và sự không chắc chắn liên quan điều trị ARDS cũng được thảo luận. Tương lai của ARDS là cố gắng hướng đến một cách tiếp cận chính xác và tìm ra khung điều trị trong chẩn đoán và quản lý ARDS.
Giới thiệu
Hội chứng suy hô hấp cấp (ARDS) được đặc trưng bởi suy hô hấp giảm oxy máu và hình ảnh thâm nhiễm 2 phế trường trên phim phổi, mà không được giải thích đầy đủ bằng suy tim hay quá tải dịch. Các yếu tố nguy cơ dễ mắc phải thúc đẩy ARDS là viêm phổi, nhiễm trùng huyết ngoài phổi, hút dịch dạ dày, chấn thương, viêm tụy, bỏng, tổn thương do hít sặc, quá liều thuốc, truyền máu nhiều lần hoặc sốc. Hậu quả của các yếu tố này gây ra một loạt rối loạn đáp ứng viêm và hoạt hóa cytokine. Tổn thương hàng rào biểu mô – nội mô phế nang có thể xảy ra trực tiếp do tổn thương phổi, với tổn thương nguyên phát biểu mô phổi, hoặc gián tiếp do nguyên nhân ngoài phổi, với tổn thương nguyên phát nội mô mạch máu là hậu quả của viêm toàn thân. Tuy nhiên đáng chú ý là hầu hết các bệnh nhân ARDS đều có đặc điểm tổn thương phổi cả trực tiếp và gián tiếp. Kết quả làm phá vỡ hàng rào biểu mô – nội mô phế nang dẫn đến tích tụ gây phù phổi giàu protein, suy chức năng surfactant và suy giảm trao đổi khí. ARDS có thể liên quan rối loạn chức năng sinh lý như giảm giãn nỡ hệ hô hấp, tăng khoảng chết sinh lý và tăng luồng thông (shunt), cùng với các đặc điểm mô học của phù phổi, viêm phổi, bệnh màng trong và xuất huyết phế nang. Về kinh điển, dấu hiệu mô học ARDS được mô tả là tổn thương phế nang lan tỏa, tuy nhiên, trong dữ liệu khám nghiệm tử thi đã báo cáo thì tổn thương phế nang lan tỏa chỉ xuất hiện <1/2 bệnh nhân ARDS.
Trong bài này chúng ta sẽ thảo luận về chẩn đoán, điều trị, kết cục và di chứng lâu dài của ARDS. Vì phần lớn bệnh nhân nguy kịch mắc COVID19 nặng có khả năng đáp ứng đầy đủ tiêu chuẩn ARDS, bằng chứng liên quan COVID19 được xem xét trong suốt bài này. Bảng 1 mô tả hiểu biết hiện nay của chúng tôi về các điểm giống và khác nhau giữa ARDS do COVID19 và ARDS do các nguyên nhân khác.
Chẩn đoán
Sự hữu ích của các công cụ chẩn đoán trong chăm sóc sức khỏe là khả năng cung cấp thông tin để đưa ra quyết định lâm sàng và xác định quần thể bệnh nhân có chung đặc điểm, kết cục và đáp ứng điều trị. ARDS là một hội chứng, diễn tiến qua nhiều sự lặp đi lặp lại tiêu chuẩn chẩn đoán kể từ khi Ashbaugh và các đồng nghiệp lần đầu mô tả vào năm 1967. Không thống nhất về tiêu chuẩn ARDS cho đến khi sự phát triển của Hiệp hội đồng thuận Mỹ-Âu vào năm 1994. Để giải quyết những hạn chế về định nghĩa ARDS trước đây, hiện nay người ta đưa ra định nghĩa Berlin (bảng 2) vào năm 2012, với sự đồng thuận của các chuyên gia. Một lợi ích của định nghĩa tiêu chuẩn ARDS là tạo điều kiện dễ dàng bổ sung vào các thử nghiệm lâm sàng giúp phát triển các liệu pháp hỗ trợ hiệu quả. Một định nghĩa tiêu chuẩn ARDS cũng cho phép các bác sĩ dễ dàng hiểu quần thể được lựa chọn trong một thử nghiệm lâm sàng và do đó áp dụng các bằng chứng thu được từ các thử nghiệm đó để tiến hành điều trị thích hợp trên lâm sàng. Bệnh nhân ARDS đại diện cho một nhóm nhỏ trong quẩn thể lớn hơn bị suy hô hấp giảm oxy máu cấp tính. Sự khác nhau giữa ARDS và suy hô hấp giảm oxy máu cấp là phải có thâm nhiễm 2 phế trường trên phim phổi. Bằng chứng từ nghiên cứu AN TOÀN CHO PHỔI (LUNG SAFE) chứng minh các kết cục tương tự đối với bệnh nhân thâm nhiễm 1 bên hay 2 bên phổi cho thấy không cần dùng thâm nhiễm 2 phổi như một phần trong định nghĩa ARDS. Cần nghiên cứu thêm để hiểu rõ hơn những điểm tương đồng và khác biệt trong đặc điểm lâm sàng và sinh học ở bệnh nhân ARDS và suy hô hấp hạ oxy máu cấp.
Nghiên cứu chiến lược và lựa chọn tiêu chuẩn
Tài liệu tham khảo cho bài này được lấy từ những nghiên cứu ở các bài báo công bố trên PubMed lúc bắt đầu cơ sở dữ liệu đến 15/07/2022, dựa trên các thuật ngữ “ARDS”, “chẩn đoán”, “kết cục”, “thông khí”, “điều trị” và “các hướng dẫn”. Các nguồn tài liệu tham khảo liên quan được trích từ những nghiên cứu cũng được đánh giá. Chúng tôi tập trung vào những nghiên cứu lâm sàng và danh sách cuối cùng các bài báo được trích dẫn lựa chọn dựa trên mức độ phù hợp của chúng với các mục tiêu trong bài đánh giá này. ClinicalTrials.gov cũng được nghiên cứu sử dụng thuật ngữ “ARDS” và một loạt các thử nghiệm được lựa chọn.
Bảng 1: ARDS do COVID19 so với ARDS do các nguyên nhân khác – tóm tắt các đặc điểm chính:
- Thời gian: khởi phát có thể hơn 7 ngày từ lúc nhiễm SARS-COV-2 và khởi phát triệu chứng.
- Nhân khẩu học: chênh lệch được báo cáo giữa các quần thể dân tộc không phải người da trắng và các nhân viên chăm sóc sức khỏe.
- Hình ảnh ngực: Lát cắt CT ngực chồng lên nhau trong giai đoạn cấp, nhưng chủ yếu dạng kính mờ lan tỏa 2 phổi trong ARDS do COVID19, có bằng chứng bệnh phổi kẽ kéo dài nhưng không chắc chắn khi so với ARDS không do COVID19.10
- Cơ chế hô hấp: các cơ chế hệ hô hấp (bao gồm sự giãn nở, áp suất cao nguyên và áp lực đẩy) được báo cáo là tương tự nhau. 7–9,11
- Các dấu ấn sinh học: số lượng tế bào bạch cầu giảm (chủ yếu do giảm neutrophil) trên bệnh nhân ARDS do COVID19, giảm IL-6 được báo cáo nhưng tương tự các các dấu ấn viêm toàn thân khác và suy chức năng cơ quan ngoài phổi, kiểu hình tăng viêm ít phổ biến.
- Đông máu: số lượng tế bào tiểu cầu và fibrinogen cao; thời gian prothrombin giảm, thời gian hoạt hóa một phần thromboplastin trên bệnh nhân COVID19 kéo dài hơn bệnh nhân ARDS không do COVID19; D-dimer trong ARDS không do COVID19 cao hơn ARDS do COVID19; ARDS do COVID19 làm tăng tỷ lệ mắc huyết khối tĩnh mạch sâu.
- Thuốc: các thuốc được khuyến cáo trong COVID19 nặng (gồm cả ARDS do COVID19) là corticoide, chẹn thụ thể IL-6 hoặc baricitinib (chất ức chế Janus Kinase); không có thuốc đặc hiệu điều trị ARDS do các nguyên nhân khác.
- Điều trị bổ trợ: số lượng bằng chứng thử nghiệm ngẫu nhiên có đối chứng trực tiếp liên quan quần thể COVID19 còn rất ít; sử dụng các thủ thuật huy động, nằm sấp và phong bế thần kinh cơ được báo cáo nhiều hơn trên quần thể ARDS do COVID19 hơn quần thể ARDS không do COVID19. 7,11
- Kết cục chăm sóc tích cực: kéo dài thời gian thở máy trên bệnh nhân COVID19 được báo cáo; kết cục tử vong tương tự 7,8,11
- Kết cục lâu dài: không có khác biệt về tỷ lệ tàn tật trong 6 tháng; tương tự với chất lượng cuộc sống, tâm lý và chức năng nhận thức trong 6 tháng; những người sống sót sau COVID19 có tỷ lệ trở lại làm việc tăng lên trong 6 tháng và 1 năm được báo cáo.
Bảng 2: Định nghĩa Berlin đối với hội chứng suy hô hấp cấp:
- Thời gian: trong 1 tuần kể từ khi có biểu hiện lâm sàng hoặc các triệu chứng hô hấp mới xuất hiện hay trầm trọng hơn.
- Hình ảnh ngực: (như Xquang ngực hoặc CT scan): các đám mờ 2 bên phổi không được giải thích đầy đủ do tràn dịch, xẹp thùy phổi hay xẹp phổi hoặc các nốt u cục.
- Nguồn gốc phù: suy hô hấp không được giải thích đầy đủ do suy tim hoặc quá tải dịch; cần đánh giá khách quan (như siêu âm tim) để loại trừ phù thủy tĩnh nếu không có yếu tố nguy cơ.
- Thở Oxy (nếu độ cao hơn 1000m, phải tính yếu tố điều chỉnh, sử dụng tỷ lệ giữa áp lực riêng phần của oxy trong máu động mạch [Pa02] và phân lượng oxy hít vào [FiO2] là: [PaO2/FiO2× áp suất khí quyển/760)])
- Nhẹ: 200 mmHg >Pa02/Fi02 ≤300 mmHg với áp lực dương cuối kỳ thở ra hoặc áp lực đường thở dương liên tục ≥5 cm H2O (có thể được vận chuyển không xâm lấn trong nhóm suy hô hấp cấp nhẹ)
- Trung bình: 100 mm Hg > PaO2/FiO2 ≤200 mm Hg với áp lực dương cuối kỳ thở ra ≥5 cm H2O
- Nặng: PaO2/FiO2 ≤ 100 mmHg với áp lực dương cuối kỳ thở ra ≥5 cm H2O
Nhờ sự phát triển của chăm sóc lâm sàng và tăng nhận thức ARDS là gánh nặng toàn cầu, xem xét một số khía cạnh của định nghĩa hiện tại hội chứng ARDS, có thể giải thích hữu ích trong định nghĩa ARDS cập nhật và mang tính kịp thời. Hình 1 tóm tắt tiêu chuẩn ARDS đã phát triển thế nào qua thời gian và những tiêu chuẩn này sẽ phát triển ra sao trong tương lai.
Tiêu chuẩn chụp Xquang ngực cho ARDS được công nhận có độ tin cậy dưới mức tối ưu qua các nghiên cứu quan sát và không được công nhận trên bối cảnh lâm sàng. Trong các cơ sở nghiên cứu, những công cụ được phát triển để cải thiện độ tin cậy trong chẩn đoán ARDS. Đánh giá Xquang về thang điểm phù phổi, sử dụng đánh giá trực quang 4 góc phần tư đông đặc và đậm độ thâm nhiễm, đã được chứng minh tốt qua các nghiên cứu quan sát, có độ tin cậy và chẩn đoán chính xác cao ARDS. Một thang điểm đánh giá trực quan tương tự đã chứng minh tương quan với kết cục lâm sàng quan trọng như tỷ lệ tử vong và thời gian nằm tại đơn vị hồi sức tích cực. Công nghệ trí tuệ nhân tạo (sử dụng mạng lưới thần kinh phức hợp sâu có thể được dạy để nhận biết những liên kết trên hình ảnh học), như Công cụ xác định ARDS là một công cụ nữa chứng minh xác định chính xác đông đặc 2 phế trường phù hợp với ARDS trong bối cảnh nghiên cứu nhưng yêu cầu phải có sự công nhận trước khi áp dụng vào lâm sàng.
Siêu âm đang nổi lên như một công cụ an toàn, tiết kiệm chi phí, làm tại giường để đánh giá ARDS mặc dù cần phải đào tạo trước khi siêu âm được triển khai như một công cụ chẩn đoán hình ảnh thâm nhiễm phổi.
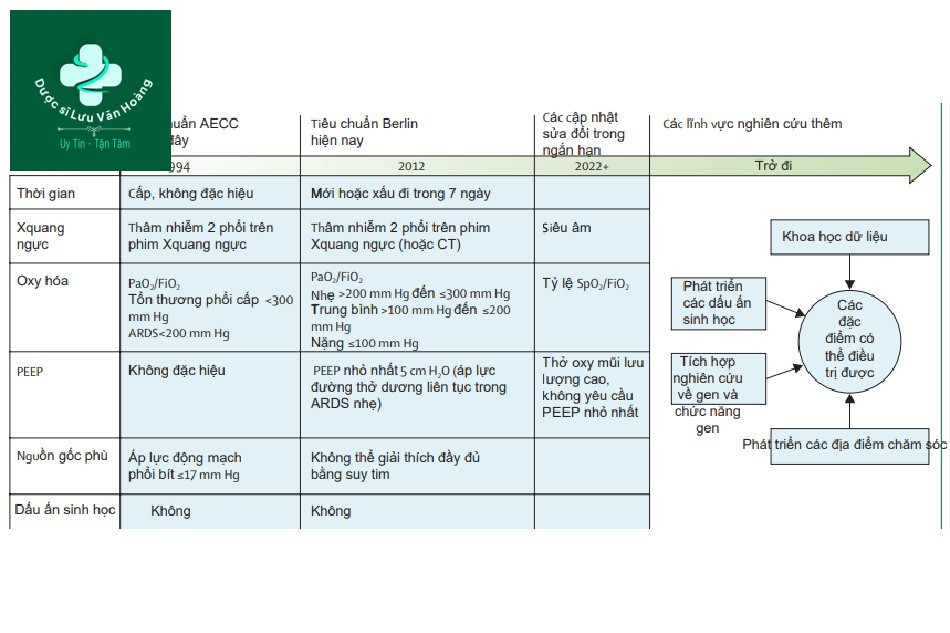
Đồng thuận tiêu chuẩn ARDS đầu tiên là tại AECC năm 1994, tiếp theo là Tiêu chuẩn đồng thuận Berlin năm 2012. Tiêu chuẩn ARDS đang được sửa đổi và các thay đổi tiềm năng được mô tả trong hình. Tương lai của ARDS trong thời đại y học chính xác phấn đấu hướng đến các đặc điểm có thể điều trị được. AEEC: Tiêu chuẩn đồng thuận Mỹ-Âu. Pa02=áp suất riêng phần oxy trong máu động mạch. FiO2=phân suất oxy hít vào. SpO2=độ bão hòa oxy. ARDS=hội chứng suy hô hấp cấp. PEEP=áp lực dương cuối kỳ thở ra.
Tỷ lệ giữa độ bão hòa oxy đo bằng oximetry và phân lượng oxy hít vào (Sp02/Fi02) là một phương pháp thay thế đầy hấp dẫn đối với tỷ lệ giữa áp suất riêng phần oxy động mạch và FiO2 (PaO2/FiO2) do tính khả dụng và an toàn. Các công cụ tại giường đơn giản có thể hữu ích trong bối cảnh hạn chế nguồn lực và bên ngoài đơn vị hồi sức tích cực truyền thống. Bằng chứng từ các phân tích hồi cứu hỗ trợ khả năng của tỷ lệ Sp02/ Fi02 để dự đoán kết cục bệnh nhân ARDS. Trong bối cảnh nguồn lực hạn chế, trong đó thở máy, phân tích khí máu và Xquang ngực không sẵn có, cải biên Kigali sử dụng tỷ lệ Sp02/Fi02 và siêu âm phổi được đề xuất và hữu ích nhằm đánh giá ARDS. Ngoài ra cải biên Kigali loại bỏ yêu cầu áp lực dương cuối thì thở ra (PEEP) vì có thể không có máy thở.
Siêu âm phổi và tỷ lệ Sp02/Fi02 có những hạn chế để trở thành công cụ chẩn đoán ARDS. Siêu âm phổi có thể đánh giá quá cao ARDS. Vercesi và các đồng nghiệp, báo cáo tỷ lệ cao dương tính giả khi so sánh cải biên Kigali với tiêu chuẩn Berlin ARDS trong một nghiên cứu quan sát đơn trung tâm tại Hà Lan. Tỷ lệ dương tính giả cao được cho là do độ nhạy của siêu âm phổi trong xác định thâm nhiễm mô kẽ và các thay đổi đông đặc phổi. Ngoài ra, định lượng oxy máu động mạch có thể làm chênh lệch khi xác định giảm oxy máu ẩn dấu do màu sắc da. Cần có những nghiên cứu tiền cứu sâu hơn để xác định ngưỡng Sp02/Fi02 tối ưu cho mức độ nghiêm trọng, sẽ giải thích được sự khác biệt trong chủng tộc và nguồn gốc dân tộc.
Yêu cầu thông khí áp lực dương có nghĩa là nhiều bệnh nhân suy hô hấp giảm oxy máu cấp không do tim và thâm nhiễm 2 phế trường không thể đáp ứng định nghĩa ARDS, mặc dù có những đặc điểm sinh học tương tự với những bệnh nhân có đặc điểm thông khí áp lực dương này. Cho tăng thở oxy mũi lưu lượng cao, có thể làm giảm PEEP là một lợi ích sinh lý, người ta quan tâm đến thở oxy mũi lưu lượng cao trong định nghĩa ARDS trong tương lai. Một sửa đổi đối với thở oxy qua mũi lưu lượng cao trong định nghĩa ARDS sẽ cho phép chẩn đoán bệnh nhân ARDS và tạo điều kiện thuận lợi bổ sung vào các thử nghiệm lâm sàng tại một thời điểm sớm hơn trong diễn tiến lâm sàng của ARDS. Có nhiều hạn chế tiềm tàng của bản sửa đổi này. Ví dụ, trong một nghiên cứu tiền cứu đơn trung tâm trên 148 bệnh nhân, Pa02/Fi02 được chứng minh thay đổi đáng kể sau khi chuyển hỗ trợ hô hấp từ thở oxy qua mũi lưu lượng cao sang thở máy xâm lấn. Hơn thế nữa, Ranieri và các đồng nghiệp cho thấy các bệnh nhân đáp ứng đầy đủ tiêu chuẩn ARDS thở oxy mũi lưu lượng cao chuyển sang thở máy xâm lấn có thể có tỷ lệ tử vong thấp hơn những bệnh nhân thở máy không xâm lấn mà chuyển sang thở máy xâm lấn.
Không có dấu ấn sinh học ARDS được khuyến cáo trên thực hành lâm sàng. The Berlin Task Force đã xem xét các dấn ấn sinh học đưa vào bản sửa đổi ARDS trước đó nhưng chúng thiếu độ nhạy và độ đặch hiệu để trở thành công cụ chẩn đoán. Bos và các đồng nghiệp hiện nay đã xem xét các dấu ấn sinh học tiềm năng có thể đưa vào tiêu chuẩn chẩn đoán ARDS. Các dấu ấn tổn thương nội mô bao gồm đánh giá dịch từ một bộ lọc trao đổi nhiệt ẩm, tuy nhiên kỹ thuật này cần phê chuẩn với những kết cục quan trọng ARDS.
Ngày càng có nhiều sự thừa nhận những hạn chế của một định nghĩa hội chứng, phớt lờ sự không đồng nhất đáng kể về sinh lý và sinh học trong ARDS, đã thúc đẩy tập trung vào mô hình mới trong đó xác định các đặc điểm sinh học có thể nhận dạng và điều trị được. Do đó, các quần thể bệnh nhân có thể xác định những đặc điểm điều trị được chứ không phải một định nghĩa hội chứng ARDS trong tương lai. Công trình tiên phong của Calfee và đồng nghiệp đã xác định các kiểu hình sinh học có thể đáp ứng điều trị khác nhau. Nghiên cứu PHIND (NCT04009330) mục tiêu đánh giá khả năng thử nghiệm tại điểm chăm sóc để xác định các kiểu hình có triển vọng này tại giường. Các kiểu hình ARDS cũng xác định bằng mô hình máy học nhờ sử dụng thông tin lâm sàng sẵn có thường xuyên, chứng minh đây là công cụ hữu ích để áp dụng vào hệ thống y tế điện tử nhằm phân loại bệnh nhân theo thời gian thực. Các kiểu hình sinh học, cùng với những dữ liệu nổi bật trong các nghiên cứu gen và kiểu hình miễn dịch, có thể cung cấp các đặc điểm có thể điều trị trong ARDS và có cơ sở để đưa vào tiêu chuẩn ARDS trong tương lai. Viện sức khỏe quốc gia Anh gần đây đưa lời kêu gọi tài trợ đơn đăng ký thành lập tổ hợp ARDS, Viêm phổi và Nhiễm trùng huyết nhằm tìm các điểm không đồng nhất và các cơ chế cốt lõi của tình trạng bệnh hiểm nghèo này. Sáng kiến này là bước tiến quan trọng với ARDS theo y học chính xác. Các kiểu hình sinh học này và những đặc điểm có thể điều trị cũng có thể xuất hiện ngoài ARDS và phổ biến đối với các hội chứng lâm sàng khác trên những bệnh nhân nguy kịch.
Điều trị ARDS
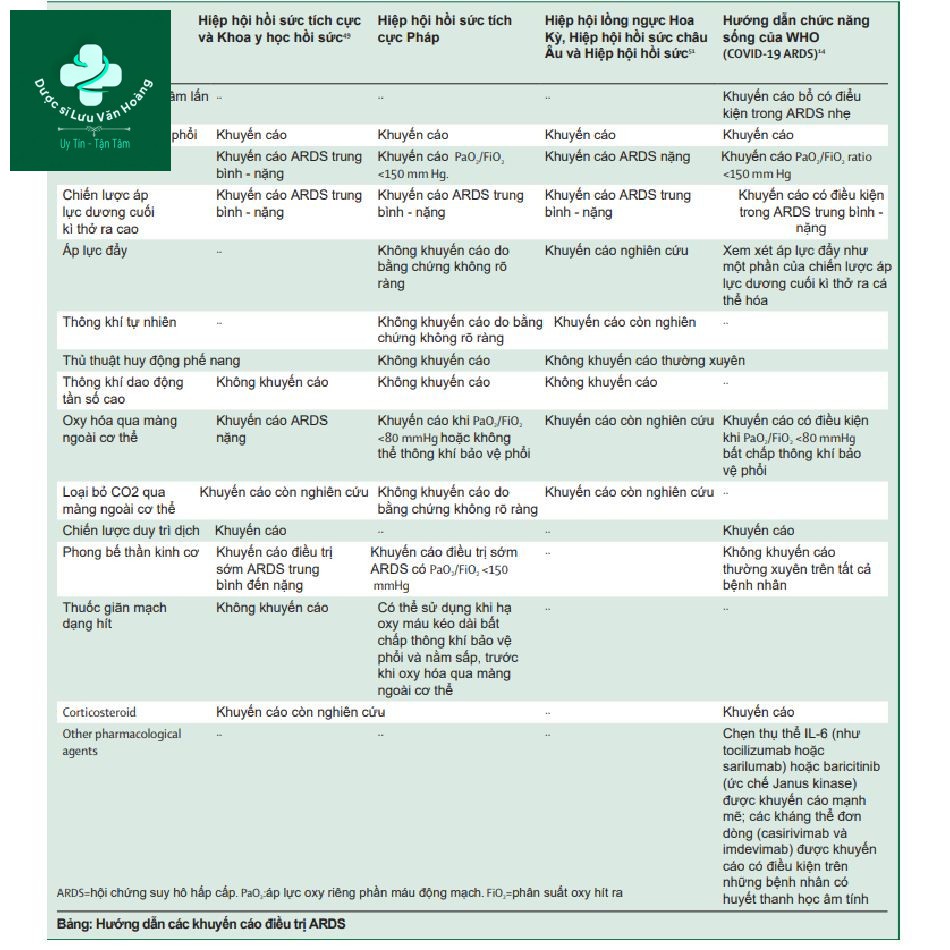
Bảng tổng kết các hướng dẫn dựa trên y học chứng cứ điều trị ARDS được công bố tại Khoa hồi sức tích cực Anh và Hiệp hội hồi sức tích cực, Hiệp hội hồi sức tích cực Pháp, cùng sự đồng hành của hiệp hội lồng ngực Hoa Kỳ, hiệp hội hồi sức tích cực châu Âu và Hiệp hội y học hồi sức và các hướng dẫn sống của WHO đối với ARDS do COVID19. Một báo cáo gần đây của chuyên gia tại Anh xem xét điều trị hỗ trợ bệnh nhân ARDS do COVID19 nên tuân theo các hướng dẫn ARDS dựa trên chứng cứ đã có. Ở đây chúng tôi cân nhắc bằng chứng theo chiến lược thông khí, nằm sấp, hỗ trợ ngoài cơ thể, phong bế thần kinh cơ và corticoide trong điều trị ARDS. Các hướng tương lai trong can thiệp ARDS cũng được thảo luận (hình 2).
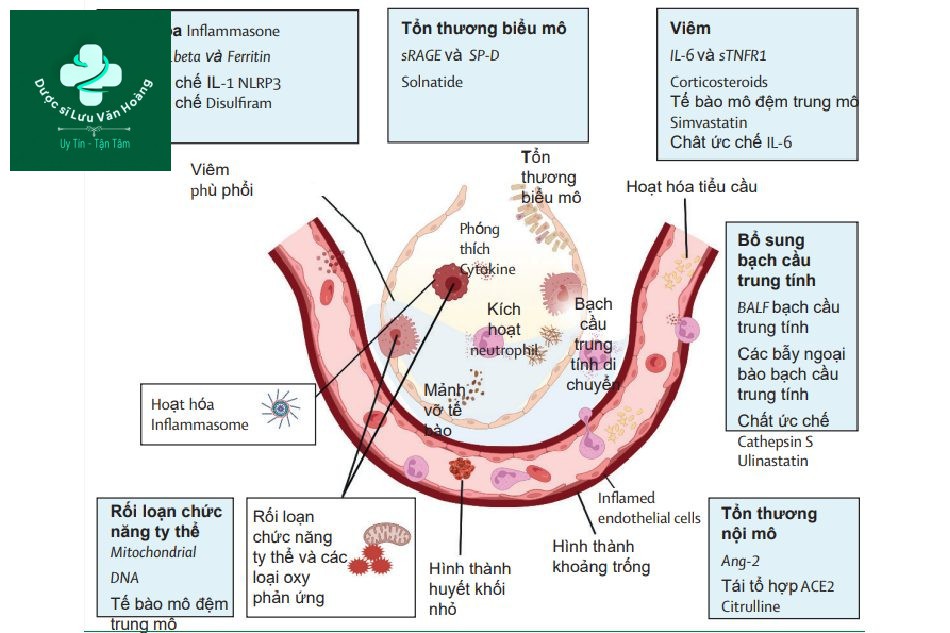
Các đặc điểm có thể điều trị được xác định bằng các dấu ấn sinh học (in nghiêng), phù hợp với cơ chế sinh lý bệnh cơ bản và có thể nhắm trúng đích bằng các liệu pháp đặc hiệu hoặc can thiệp. Biomarkers được mô tả là các dấu ấn sinh học (ví dụ thu được từ các mẫu mô sinh học). Các dấu ấn sinh học thay thế gồm hình ảnh học, sinh lý và dữ liệu lâm sàng, khi chúng phản ánh lại quá trình sinh lý bệnh cơ bản có thể đáp ứng với điều trị. Mô hình sinh lý bệnh mô tả ở đây có thể không tính đến mức độ phức tạp và tương tác qua lại giữa các cơ chế sinh lý bệnh và đáp ứng cá thể hóa trên từng bệnh nhân. Do tích hợp nhiều phương pháp thu thập thông tin (như đặc điểm lâm sàng, hình ảnh học, sinh lý, các xét nghiệm sinh học và dữ liệu về gen) có thể xác định thêm những kiểu hình phụ nhằm dự đoán thuận lợi đáng tin cậy hơn với liệu pháp hoặc can thiệp. BALF = dịch rửa phế quản-phế nang.
Các chiến lược thông khí
Thông khí bảo vệ phổi (như thể tích khí lưu thông <6 ml/ kg, cân nặng dự đoán và áp lực cao nguyên ≤30 mmHg) là khuyến cáo chính dựa trên những kết quả từ thử nghiệm ARMA mang tính bước ngoặt, cho thấy giảm tỷ lệ tử vong và tăng số ngày không thở máy. Các thử nghiệm ngẫu nhiên có đối chứng (RCTs) của chiến lược thông khí mới tiếp tục củng cố lợi ích thông khí bảo vệ phổi. Các thử nghiệm lâm sàng nghiên cứu chiến lược thông khí thay thế không cho thấy lợi ích nào nữa so với thông khí bảo vệ phổi. Thông khí giải phóng áp lực đường thở là một phương thức thông khí kiểm soát áp lực cải tiến, cung cấp áp lực cao kéo dài không liên tục, theo chu kỳ thời gian giải phóng áp lực thấp. Đa phân tích thông khí giải phóng áp lực đường thở trong suy hô hấp hạ oxy máu cấp (330 bệnh nhân trong 5 nghiên cứu, 3 trong 5 nghiên cứu là trên bệnh nhân ARDS) cho thấy tỷ lệ tử vong trong bệnh viện, số ngày không thông khí và kéo dài thời gian nằm phòng hồi sức tích cực. Tuy nhiên, các nghiên cứu tiến hành đến nay có những hạn chế về phương pháp luận và cần một thử nghiệm lâm sàng mạnh mẽ để giải thích vai trò của thông khí giải phóng áp lực đường thở trong ARDS.
Các khuyến cáo theo hướng dẫn dùng PEEP cao trên bệnh nhân ARDS trung bình đến nặng. Một mạng lưới đa phân tích gần đây Bayesian đánh giá chiến lược PEEP và thủ thuật huy động phế nang trong ARDS trung bình đến nặng. Kết quả chính của phân tích này là chiến lược PEEP cao không có thủ thuật huy động phế nang phổi có nhiều khả năng có lợi hơn so với chiến lược PEEP thấp (xác suất lợi ích về tỷ lệ tử vong là 99%), trong khi đó kéo dài thủ thuật huy động phế nang bằng PEEP cao có thể gây tổn hại so với PEEP cao mà không huy động phế nang (xác suất tăng tỷ lệ tử vong 99%). Sự không đồng nhất trong cá thể hóa bệnh nhân đáp ứng với PEEP được ghi nhận, và ngày càng có nhiều quan tâm cá thể hóa chiến lược PEEP, mặc dù đến nay điều này không mang lại lợi ích thêm so với các chiến lược thông khí thông thường.
Áp lực đẩy (ví dụ áp lực cao nguyên trừ áp lực cuối kì thở ra) có thể là công cụ dự đoán độc lập bệnh nhân ARDS sống sót. Amato và đồng nghiệp cho thấy áp lực đẩy là yêu tố trung gian chính cho những lợi ích của PEEP và chiến lược thể tích khí lưu thông. Một giới hạn cao hơn 15 cmH20 đối với áp lực đẩy được khuyến cáo, trên đó gây stress phổi. Ngược lại, 2 thử nghiệm lâm sàng bây giờ đã cho thấy tăng tỷ lệ tử vong trong bối cảnh áp lực đẩy thấp (≤15 cm H2O), xem xét áp lực đẩy không hữu ích như mong đợi ban đầu dự đoán tỷ lệ tử vong.
Các thử nghiệm lâm sàng tiến hành nghiên cứu chiến lược PEEP nhắm trúng đích tới áp lực đẩy (gồm thử nghiệm STAMINA NCT04972318) sẽ bổ sung thông tin quan trọng về vấn đề này.
Một khái niệm mới được áp dụng trong bối cảnh ARDS là công suất cơ học. Công suất cơ học là lượng năng lượng truyền từ máy thở đến hệ hô hấp mỗi đơn vị thời gian và được xác định bằng hiệu ứng kết hợp của thể tích khí lưu thông, áp lực đẩy, tần số thở, lưu lượng khí hít vào và PEEP, cũng như các yếu tố quyết định tính chất cơ học của phổi (ví dụ độ đàn hồi của hệ hô hấp và sức đề kháng của đường thở). Công suất cơ học được tính như sau: Công suất cơ học (J/phút) = 0.098 x Thể tích khí lưu thông x tần số hở x [PEEP + (0.5 x áp lực đẩy) + (áp lực đỉnh – áp lực cao nguyên)]. Công suất cơ học có thể là yếu tố thúc đẩy thông khí bảo vệ phổi tốt hơn, so với các thông số máy thở riêng lẻ, bởi vì nó xem xét cân bằng các thông số này trên một tổng thể. Phân tích lại thử nghiệm lâm sàng và thông tin quan sát đã chỉ ra công suất cơ học liên quan đến kết cục tử vong. Trong một phân tích hồi cứu, trên 8207 bệnh nhân, tăng nguy cơ tử vong một cách nhất quán đã chỉ ra công suất cơ học cao hơn 17 J/phút. Sự phức tạp để giải thích công suất cơ học làm giới hạn sử dụng trên lâm sàng mặc dù gần đây Costa và đồng nghiệp đã phát hiện các biến thành phần của công suất cơ học dự đoán được tỷ lệ tử vong nhiều nhất, trên thực tế là áp lực đẩy và tần số thở. Vì các biến này có thể dễ dàng tính được ngay tại giường, lợi ích bổ sung của công suất cơ học vẫn chưa chắc chắn.
Tính không đồng nhất của hiệu quả điều trị rất rõ ràng trong các nghiên cứu chiến lược thở máy điều trị ARDS và cho thấy có thể có các kiểu hình (hoặc các đặc điểm điều trị được) theo hướng thở máy cá thể hóa. Costa và đồng nghiệp nhận thấy các bệnh nhân có độ giãn nở hệ hô hấp thấp có thể hưởng lợi nhiều hơn từ thể tích khí lưu thông và áp lực đẩy thấp, trong khi đó bệnh nhân có độ giãn nỡ hệ hô hấp cao được dự đoán lợi ích cao hơn tần số hô hấp thấp. Trong một phân tích lại thử nghiệm EPVent-2 nghiên cứu PEEP có hướng dẫn qua thực quản trong ARDS, có sự khác biệt về tỷ lệ tử vong phụ thuộc độ nặng của bệnh như xác định trong thang điểm APACHE II. Tăng viêm và các kiểu hình phụ giảm viêm của ARDS cũng được báo cáo là đáp ứng với chiến lược PEEP khác nhau. Những kết quả từ thử nghiệm LIVE, nghiên cứu thở máy cá thể hóa phù hợp với hình thái phổi trên bệnh nhân ARDS, nhấn mạnh nhu cầu điều chỉnh kiểu hình với các chiến lược thông khí trên từng bệnh nhân. Trong nghiên cứu này, trên bệnh nhân thở máy không phù hợp với kiểu hình phổi, cho thấy tỷ lệ tử vong tăng đáng kể.
Nằm sấp
Nằm sấp trên bệnh nhân ARDS cải thiện oxy hóa, tăng huy động phế nang tiềm năng và giảm các vùng phế giãn quá mức, do đó đảm bảo thông khí phổi đồng đều hơn và nguy cơ thở máy do tổn thương phổi. Dữ liệu từ thử nghiệm ngẫu nhiên có đối chứng đa trung tâm PROSEVA, bệnh nhân ARDS nặng phải thở máy, được định nghĩa là tỷ lệ Pa02/Fi02 <150 mmHg sau thời gian ổn định ban đầu tối thiểu 12h, nên được thông khí trong tư thế nằm sấp ít nhất 16h mỗi ngày cho đến khi lâm sàng cải thiện. Thông khí nằm sấp nên làm sớm và lý tưởng nhất là 36h sau khi đáp ứng các tiêu chuẩn. Đáng chú ý, thông khí nằm sấp nên làm cùng với chiến lược thông khí bảo vệ phổi và thường dùng trên những bệnh nhân thở PEEP cao. Nằm sấp liên quan cải thiện tỷ lệ tử vong trong 28 ngày (16% so với 33%, p<0.0001), kéo dài trong 90 ngày (24% so với 41%, p<0.0001). Thu thập bằng chứng từ các thử nghiện lâm sàng đã làm trước PROSEVA không ủng hộ áp dụng tư thế nằm sấp phổ biến trong ARDS ít nặng. Bất chấp bằng chứng lợi ích trong thử nghiệm PROSAVA, nghiên cứu quan sát quốc tế tiền cứu APRONET nhận thấy chỉ 1/3 bệnh nhân ARDS nặng được điều trị nằm sấp. Tỷ lệ nằm sấp thấp một phần được giải thích do những lo ngại các biến cố bất lợi như tắt ống nội khí quản, loét tỳ đè và mất thông tĩnh mạch. Trong bối cảnh ARDS do COVID19, nằm sấp được thực hiện 1 cách an toàn và rộng rãi cho bệnh nhân thở máy. Trong bối cảnh COVID19, sử dụng nằm sấp được mở rộng trên bệnh nhân tỉnh táo không thở máy, nhưng vẫn còn kết quả mâu thuẫn từ các thử nghiệm gần đây. Thời gian nằm sấp trong các nghiên cứu này đã rút ngắn hơn so với thời gian được cho là có lợi trên bệnh nhân dùng an thần và liệt phải thở máy xâm lấn, và thường giới hạn trên bệnh nhân bình thường. Không có bằng chứng sử dụng nằm sấp trên bệnh nhân tỉnh táo không đặt ống nội khí quản có suy hô hấp hạ oxy máu cấp do COVID19 và một thử nghiệm lâm sàng nên được tiến hành để trả lời câu hỏi này. Vai trò của nằm sấp hỗ trợ oxy hóa qua màng ngoài cơ thể (ECMO) cũng vẫn không chắc chắn và là một chủ đề đang diễn ra trong các thử nghiệm lâm sàng (NCT4139733 và NCT04607551).
Phong bế thần kinh cơ
Các hướng dẫn trước đây đưa ra khuyến cáo yếu về phong bế thần kinh cơ trên bệnh nhân ARDS trung bình – nặng, mặc dù những giới hạn về phương pháp luận trong các bằng chứng hiện có được lưu ý. Gần đây hơn, thử nghiệm ROSE (phong bế thần kinh cơ giai đoạn sớm trong ARDS) nghiên cứu vai trò của phong bế thần kinh cơ với thuốc an thần sâu so với chăm sóc thông thường bằng an thần nhẹ trên bệnh nhân ARDS trung bình – nặng. Thử nghiệm đã ngưng vì vô ích (kết quả thu được từ 1006 bệnh nhân) và cho thấy không có khác biệt tỷ lệ tử vong trong 90 ngày. Trên cơ sở bằng chứng này, sử dụng thường xuyên phong bế thần kinh cơ liên tục không được khuyến cáo trong một nhóm bệnh nhân ARDS không được lựa chọn. Thử nghiệm ROSE không đánh giá chính xác rối loạn đồng bộ máy thở và 17% bệnh nhân trong nhóm chứng điều trị phong bế thần kinh cơ trong 48h đầu, vì thế có những bệnh nhân vẫn thu được lợi ích từ phong bế thần kinh cơ để điều trị rối loạn đồng bộ thở máy. Hơn thế nữa, giảm số lượng bệnh nhân nằm sấp và ECMO trong thử nghiệm ROSE, phong bế thần kinh cơ có tương tác để tạo điều kiện thuận lợi mang lại lợi ích cho can thiệp này vẫn chưa được hiểu rõ.
Hỗ trợ ngoài cơ thể
Trong kỷ nguyên thông khí bảo vệ phổi, 2 nghiên cứu ngẫu nhiên có đối chứng đánh giá vai trò của ECMO tĩnh – tĩnh mạch trên bệnh nhân ARDS nặng. Thử nghiệm CESAR là một thử nghiệm ngẫu nhiên có đối chứng đa trung tâm so sánh điều trị thông thường ARDS so với giới thiệu đến 1 trung tâm ECMO để xem xét điều trị. Những bệnh nhân ngẫu nhiên giới thiệu làm ECMO, chỉ 76% (68/90 bệnh nhân) được làm. Trong nhóm ngẫu nhiên giới thiệu làm ECMO, cải thiện kết cục chính của chất lượng cuộc sống được nhìn thấy sau 6 tháng. Thử nghiệm CESAR có nhiều hạn chế đáng kể trong phương pháp luận. Tuy nhiên, các hạn chế này được giải quyết nhờ thử nghiệm EOLIA, là một thử nghiệm ngẫu nhiên có đối chứng quốc tế so sánh ECMO với điều trị thông thường, xem ECMO như 1 phương pháp cứu mạng nếu cần. Mặc dù kết cục chính của tỷ lệ tử vong bao gồm hiệu quả lợi ích điều trị tiềm năng (nguy cơ tương đối [RR] 0.76, 95% Cl 0.55-1.04, p=0,09), không có ý nghĩa thống kê. Một phân tích sâu Bayesian cho thấy có khả năng mang lại lợi ích rất cao nếu dùng ECMO sớm. Hơn thế nữa, trong một phân tích gộp dữ liệu bệnh nhân cá thể hóa tiếp theo gồm thử nghiệm ngẫu nhiên có đối chứng CESAR và EOLIA, điều trị chính xác được cải thiện (dữ liệu gộp 429 bệnh nhân) và lợi ích tỷ lệ tử vong có ý nghĩa thống kê trong 90 ngày được chứng minh trong nhóm ECMO (RR 0.75, 95% Cl0.6-0,94, p=0,.013). Cùng với đó, từ những dữ liệu cơ bản này, bệnh nhân ARDS nặng (định nghĩa là Pa02/Fi02<80 mmHg >6h hoặc suy hô hấptăng CO2 nặng [ví dụ pH<7.25 với PaC02 ≥60 mmHg >6 h]) được khuyến cáo điều trị ECMO. Đáng chú ý, bệnh nhân điều trị ECMO nhìn chung có chiến lược điều trị tương tự với thử nghiệm EOLIA. Cung cấp ECMO rất phức tạp và đặc điểm tổ chức của các trung tâm ECMO phải phù hợp với những đặc điểm tổ chức trong thử nghiệm EOLIA hoặc tuân thủ các tiêu chuẩn trong trung tâm ECMO do các nhóm chuyên gia quy định.
Bằng chứng về lợi ích của ECMO được ngoại suy trong quần thể COVID19 và ECMO được thực hiện với tỷ lệ tử vong tương tự ECMO nói chung sử dụng trong population of patients with non-COVID-19 ARDS.83 A recent large comparative effectiveness study showed một nghiên cứu đoàn hệ trên 7345 bệnh nhân mắc COVID19 khắp 5 quốc gia. 844 bệnh nhân điều trị bằng ECMO và một phân tích trên những bệnh nhân có Pa02/Fi02 <80 mmHg chứng minh ECMO có liên quan giảm tỷ lệ tử vong so với điều trị thông thường (RR 0.78, 95% Cl 0.75-0.82). Mặc dù xác nhận trong các thử nghiệm ngẫu nhiên có đối chứng, những kết quả này mang lại sự yên tâm sử dụng ECMO trong 1 quần thể bệnh nhân chọn lọc mắc COVID19 nặng. Loại CO2 ngoài cơ thể đã được quan tâm trong các cơ sở nghiên cứu để tạo điều kiện thở máy với thể tích khí lưu thông thấp. Thử nghiệm REST, nghgieen cứu loại CO2 ngoài cơ thể trên bệnh nhân suy hô hấp hạ oxy máu cấp cho thấy không có sự khác biệt về tử vong trong 90 ngày và tăng tỷ lệ mắc các biến cố bất lợi, như xuất huyết nhiều trên lâm sàng, trong nhóm loại CO2 ngoài cơ thể. Trên cơ sở này, sử dụng phương pháp thải trừ CO2 ngoài cơ thể để điều trị ARDS không được khuyến cáo ngoài các thử nghiệm ngẫu nhiên có đối chứng.
Điều trị bằng Corticosteroid
Vai trò của corticosteroide trong điều trị ARDS vẫn còn tranh luận lâu dài. Steroide có tác dụng kháng viêm mạnh có thể mang lại lợi ích trong ARDS. Một bước tiến đáng kể trong đại dịch COVID19 đang cho thấy lợi ích khi điều trị bệnh nhân COVID19 nặng bằng corticosteroide. Corticosteroide hiện nay là tiêu chuẩn chăm sóc bệnh nhân ARDS do COVID19 và có sự quan tâm mới về vai trò của steroide trong ARDS không do COVID19. Trước đại dịch COVID19, nhiều nghiên cứu thực hiện để hiểu hơn vai trò của corticosteroide trong ARDS. Thật không may liệu pháp steroide rất khác nhau giữa các nghiên cứu (ví dụ loại, liều lượng và thời gian dùng khác nhau) và có sự khác biệt trong quần thể bệnh nhân nghiên cứu (ví dụ như ARDS sớm vs muộn và một số nghiên cứu làm xong trước khi thông khí bảo vệ phổi). Gần đây nhất, thử nghiệm DEXA-ARDS nghiên cứu dexam[1]ethasone liều cao (20mg 1 lần mỗi ngày trong 5 ngày) sau đó là liều thấp (10mg 1 lần mỗi ngày trong 5 ngày) trên bệnh nhân ARDS trung bình – nặng. Trong nhóm dexamethasone, số ngày không thở máy tăng lên (giữa các nhóm khác nhau 4.8 ngày, 95% Cl 2.57-7.03, p<0.0001) và giảm tỷ lệ tử vong trong 60 ngày (21% vs 36%; giữa nhóm khác 15.3%, 95% Cl -25.9 – 4.9, p=0.0047). Một đa phân tích sau đó (999 bệnh nhân từ 9 thử nghiệm ngẫu nhiên có đối chứng trong ARDS không do COVID19) cho thấy lợi ích tử vong khi dùng corticosteroide (RR 0.71, 95% Cl 0.54-0.92). Có bằng chứng liên quan tăng đường huyết nhưng không phải bằng chứng chắc chắn ủng hộ mối quan ngại về các biến cố bất lợi khác gồm suy yếu thần kinh cơ, xuất huyết tiêu hóa hoặc nhiễm trùng. Đáng chú ý, một thử nghiệm sớm nghiên cứu methylprednisolone trong ARDS kéo dài có liên quan tăng nguy cơ tử vong muộn (60 ngày và 180 ngày) khi bắt đầu dùng steroide sau 14 ngày.
Đánh giá sai tỷ lệ biến cố dự đoán có thể kiểm soát và hiệu quả điều trị (dùng để tính toán kích cỡ mẫu) ngày càng được công nhận là phổ biến trong các thử nghiệm ngẫu nhiên có đối chứng ARDS và có thể góp phần vào bằng chứng không chắc chắn liên quan corticosteroide trong ARDS. Sử dụng phương pháp Bayesian, Saha và đồng nghiệp chỉ ra bằng chứng dùng corticosteroide kéo dài trong ARDS rất có ích và hỗ trợ ưu tiên trong các thử nghiệm tương lai nghiên cứu corticosteroide trên bệnh nhân ARDS không do COVID19.
Các hướng điều trị trong tương lai can thiệp ARDS
Nhiều thử nghiệm lâm sàng điều trị bằng thuốc trên bệnh nhân ARDS chưa mang lại hiệu quả. Các thuốc cụ thể vẫn chưa mang lại kết quả như prostaglandin dạng hít, statin, asprin, surfactant, protein C phản ứng và Sivelestat. Các thuốc khác gồm chất chủ vận beta2 và yêu tố tăng trưởng keratinocyte, là dữ liệu tiền lâm sàng đầy hứa hẹn, có khả năng gây hại tiềm năng.
Một liệu pháp mới đáng chú ý trong ARDS là tế bào đệm trung mô. Các tế bào đa năng, kết dính, dẻo này có thể thu được từ nhiều nguồn như tủy xương, dây rốn hoặc mô mỡ và có tác dụng điều hòa miễn dịch theo nhiều hướng, bù đắp và kháng khuẩn. Các thử nghiệm ngẫu nhiên có đối chứng nghiên cứu tế bào đệm trung mô trong ARDS và COVID19 đã ủng hộ sự an toàn của chúng, tuy nhiên chưa xác định tính hiệu quả. Mặc dù nhiều con đường hấp dẫn trong đa liệu pháp nhắm trúng đích ARDS, tế bào đệm trung mô được biết có thể đáp ứng vi môi trường sinh học và cũng có thể là vấn đề hiệu quả điều trị không thống nhất trong các kiểu hình bệnh nhân khác nhau.
Sự quan tâm các kiểu hình sinh học và các đặc điểm có thể điều trị trên bệnh nhân ARDS, có thể đáp ứng khác nhau với từng liệu pháp can thiệp, đã ủng hộ những kết quả đầy hứa hẹn từ tái phân tích những thử nghiệm lâm sàng trước đó. Trong một tái phân tích thử nghiệm HARP-2 (simvastatin dành cho ARDS) những bệnh nhân có kiểu hình tăng viêm với sivastatin được nhận thấy cải thiện đáng kể tỷ lệ sống sót sau 28 ngày.
Hình 2 chứng minh các liệu pháp can thiệp có thể phù hợp với đặc điểm có thể điều trị trong kỷ nguyên tương lai của y học chính xác ARDS. Cần có nghiên cứu chuyển dịch liê tục để xác định phương pháp điều trị mới. Cũng có vai trò tiếp cận cá thể hóa với can thiệp hiện có trong ARDS và các bộ dữ liệu sẵn có góp phần chứng minh tính hữu ích xác định quần thể đáp ứng nhanh nhất.
Cùng với xác định gần đây các kiểu hình sinh học và những đặc điểm có thể điều trị được, lợi ích của những thử nghiệm nền tảng đáp ứng trong việc xây dựng điều trị hiệu quả COVID19 đã được thể hiện rõ ràng. Xây dựng trên nền tảng này thử nghiệm I-SPY COVID19 xây dựng một thử nghiệm nền tảng giai đoạn 2 nhằm nghiên cứu những cách điều trị COVID19 mới. Để tận dụng các tiến bộ này, người ta nhận thấy tầm quan trọng khi bắt đầu một thử nghiệm nền tảng pha 2 y học chính xác quốc tế, có thể kết hợp những đặc điểm có thể điều trị được, để kiểm tra các cách điểu trị mới trên bệnh nhân ARDS. Kết hợp giữa cộng đồng khoa học toàn cầu (gồm các chuyên gia trong ARDS, y học chính xác và thiết kế thử nghiệm thích ứng) để thúc đẩy chương trình nghiên cứu này về y học chính xác trong ARDS về sau.
Kết cục của bệnh nhân ARDS
Nghiên cứu AN TOÀN PHỔI là nghiên cứu quan sát lớn nhất về dịch tễ, mô hình quan sát và kết cục lâm sàng ARDS, thực hiện xong trên 29144 bệnh nhân điều trị ở 459 phòng hồi sức tích cực trên 50 quốc gia khắp 6 lục địa. 23% bệnh nhân thở máy mắc ARDS. Bệnh nhân ARDS có thời gian thở máy trung bình 8 ngày, nằm tại phòng hồi sức trung bình 10 ngày và nằm viện trung bình 17 ngày. Tỷ lệ tử vong trong 28 ngày là 35% và tăng hạ oxy máu nặng với hơn 40% bệnh nhân ARDS nặng. Xem xét sự khác nhau về địa kinh tế, PROVENT-iMiC (một nghiên cứu tiền cứu quốc tế đa trung tâm trên bệnh nhân thở máy tại phòng hồi sức ở các nước châu Á có thu nhập trung bình) cho thấy tỷ lệ bệnh nhân bắt đầu thở máy thấp hơn (7%) so với nghiên cứu AN TOÀN PHỔI. Thực hành thở máy tương tự nhau nhưng có sự khác biệt trong kết cục bao gồm tỷ lệ tử vong tăng cao (45%), rút ngắn thời gian nằm viện (trung bình 4 ngày) và rút ngắn thời gian nằm ở ICU (trung bình 5 ngày) hơn nghiên cứu AN TOÀN PHỔI. Chênh lệch có thể liên quan khác biệt về kinh tế địa lý trong từng trường hợp hoặc liên quan nguồn lực sẵn có. Tương tự, tỷ lệ tử vong tăng quá mức trên bệnh nhân ARDS được thể hiện ở các quốc gia thu nhập thấp và trung bình khác.
Kết cục bệnh nhân trong các thử nghiệm lâm sàng đưa ra góc nhìn khác về kết cục ARDS. Một đánh giá hệ thống tỷ lệ tử vong trong 28 ngày trong các nhóm chứng thử nghiệm lâm sàng ARDS cho thấy tỷ lệ tử vong là 29% (từ 26 thử nghiệm trên 2766 bệnh nhân trong giai đoạn 2016-2020). Sự chênh lệch giữa kết cục bệnh nhân ARDS trong thử nghiệm ngẫu nhiên có đối chứng và các nghiên cứu quan sát được ghi nhận; thử nghiệm ngẫu nhiên có đối chứng hạn chế hơn trong lựa chọn bệnh nhân và thông khí bảo vệ phổi thường làm nghiêm ngặt hơn. Hơn thế nữa, sự không thống nhất kết cục trong các thử nghiệm lâm sàng (ví dụ Juschten và đồng nghiệp cho thấy tỷ lệ tử vong khoảng 10-67% trong 1 đánh giá hệ thống 67 nghiên cứu ngẫu nhiên có đối chứng từ năm 2000-2019) và điều này có thể hạn chế kết quả thử nghiệm với bối cảnh lâm sàng.
Mặc dù dữ liệu từ thời kỳ trước COVID19 cho thấy một số bệnh nhân ARDS tử vong do suy hô hấp không hồi phục (ước tính thay đổi dựa vào định nghĩa nhưng được chứng minh <1% và <9%). ARDS có 1 kết quả trực tiếp và có thể đo lường được tỷ lệ tử vong. So với bệnh nhân nằm ở ICU không mắc ARDS, bệnh nhân ARDS tăng tỷ lệ tử vong 15%. Trong bối cảnh ARDS liên quan nhiễm trùng huyết, tỷ lệ tử vong được cho là 37%. Trong một nghiên cứu đoàn hệ hồi cứu trên 127 bệnh nhân ARDS, rối loạn chức năng phổi được chứng minh là nguyên nhân hàng đầu gây tử vong 28% (các nguyên nhân khác được báo cáo gồm nhiễm trùng huyết 17% và rối loạn chức năng tim 10%).
Xu hướng dịch tễ và kết cục trên bệnh nhân ARDS luôn biến động. Trong bối cảnh đại dịch COVID19, ước tính tỷ lệ mắc ARDS lớn hơn đáng kể so với các báo cáo trước đây, và kết cục thay đổi theo thời gian và tùy bối cảnh lâm sàng. Sự khác biệt về dân tộc và chủng tộc trong dịch tễ học và kết cục COVID19 đã rõ ràng. Liệu có thực hành nào ngoại suy những liệu pháp được chấp thuận mang lại lợi ích trong ARDS do COVID19 với ARDS do nguyên nhân khác, thậm chí khi khoảng trống bằng chứng cho các liệu pháp này tồn tại trong các nguyên nhân khác gây suy hô hấp cấp, vẫn chưa giải thích thỏa đáng. Hơn thế nữa, COVID19 có tác động khôn lường với hệ thống chăm sóc y tế, đặc biệt các dich vụ về hô hấp và hồi sức.Thay đổi trong thực hành lâm sàng như vậy có thể thay đổi dịch tễ học và kết cục ARDS, trong tương lai các nghiên cứu quan sát ARDS dựa trên quần thể lớn sẽ phải tìm hiểu các điều không chắc chắn trong thời kỳ hậu COVID19.
Di chứng ARDS
Các vấn đề mới và tồi tệ hơn trong tình trạng sức khỏe thể chất, nhận thức hoặc tinh thần thì thường gặp trên bệnh nhân sống sót sau ARDS. Ở đây, chúng tôi bàn về bằng chứng liên quan di chứng lâu dài với ARDS không do COVID19, tiếp theo là bằng chứng mới nổi trong ARDS. Các dấu hiệu thường thấy ở những người sống sót sau ARDS không do COVID19 gồm triệu chứng hô hấp (khó thở, ho khan và ho đám) và giảm khả năng gắng sức. Triệu chứng hô hấp thường không tương thích với mức độ suy giảm chức năng phổi hoặc mức độ bất thường trên Xquang. Những người sống sót sau ARDS tiếp tục trải qua một loạt các rối loạn thể chất liên quan di chứng của bệnh nguy kịch (hẹp khí quản, rối loạn chức năng dây thanh âm, hủy răng và sẹo liên quan các can thiệp). Tỷ lệ rối loạn căng thẳng hậu chấn thương là cao trên bệnh nhân sống sót sau ARDS với tỷ lệ được báo cáo lên đến 1/4 bệnh nhân sau 8 năm. Các triệu chứng tâm thần dai dẳng như căng thẳng và lo âu được báo cáo chiếm 1/2 bệnh nhân. Những người sống sót sau ARDS được chứng minh suy giảm chức năng nhận thức, gồm chức năng điều hành, giải thích bằng lời nói và suy giảm sự chú ý.
Do gánh nặng về các triệu chứng thể chất, tinh thần và nhận thức trên những người sống sót sau ARDS, người ta thấy giảm chất lượng cuộc sống đáng kể, giảm cơ hội việc làm và giảm hòa nhập xã hội.
Kamdar và cộng sự chứng minh 44% những người có việc làm trước đó sống sót sau ARDS bị mất việc sau 1 năm và 5 năm là 30% không bao giờ đi làm lại được. Su và đồng nghiệp chứng minh 1/5 những người sống sót sau ARDS trở lại làm việc nhưng hầu như như không thể duy trì công việc. Trong một nghiên cứu khác, Brown và đồng nghiệp cho thấy phần trăm những người sống sót sau ARDS sống độc lập tại nhà trong 6 tháng giảm từ mức sống cơ bản 91% xuống còn 45% trong 6 tháng. Sử dụng các nguồn lực y tế gia tăng ở những người sống sót sau ARDS, tỷ lệ nhập viện trở lại tăng đến 40% bệnh nhân sống sót, trên 1/3 số bệnh nhân đó nhập ICU. Những người sống sót sau ARDS thường có nguy cơ cao tử vong trong suốt quá trình diễn tiến đợt cấp, nhưng nguy cơ tử vong kéo dài trong dài hạn. Vào năm đầu, tỷ lệ tử vong tăng lên 11%, tăng 20-34% trong 5 năm sau. Trong một so sánh bệnh nhân suy hô hấp hạ oxy máu cấp (nhiều người trong đó có khả năng mắc ARDS) với những người trưởng thành không nhập viện, bệnh nhân suy hô hấp hạ oxy máu tăng gấp 1.9 lần tỷ lệ tử vong muộn. Nguy cơ tử vong muộn chủ yếu do các biến cố cấp tính, mặc dù khoảng 30% nguy cơ tử vong liên quan suy hô hấp hạ oxy máu.
Các báo cáo kết cục lâu dài trên bệnh nhân sống sót sau ARDS do COVID19 đang xuất hiện và cung cấp bằng chứng tình trạng suy giảm thể chất, tinh thần và nhận thức. Bằng chứng bệnh phổi kẽ kéo dài trên bệnh nhân ARDS liên quan COVID19 phải thở máy được báo cáo, nhưng vẫn chưa rõ ràng về sự liên quan của bằng chứng này với quần thể bệnh nhân ARDS không do COVID19. Đáng chú ý, một số nghiên cứu chỉ ra chất lượng cuộc sống liên quan sức khỏe tốt hơn và gia tăng tỷ lệ quay lại làm việc trên bệnh nhân ARDS do COVID19 so với quần thể ARDS không do COVID19. Tuy nhiên, bệnh nhân ARDS do COVID19 tự báo cáo tình trạng khuyết tật thấp và nâng cao chất lượng cuộc sống liên quan sức khỏe trước khi nhập ICU và do đó có khả năng cải thiện sau bệnh hiểm nghèo cao hơn so với những bệnh nhân ARDS không do COVID19. Khi điều chỉnh các yếu tố gây nhiễu tiềm ẩn lúc ban đầu, Hodgson và đồng nghiệp chứng minh tỷ lệ mắc khuyết tật mới, chức năng tâm lý và chức năng nhận thức thì tương tự nhau trong 6 tháng giữa bệnh nhân bệnh nặng mắc hoặc không mắc COVID19. Sự xuất hiện của COVID19 lâu dài, các hậu quả lâu dài của COVID19 trên chức năng cơ quan (bao gồm bệnh phổi kẽ và di chứng tim mạch) làm dấy lên mối lo ngại về toàn bộ tỷ lệ mắc bệnh trên bệnh nhân sống sót sau ARDS liên quan COVID19.
Xác định các biện pháp can thiệp, gồm thời gian chăm sóc tích cực sau hồi sức, nâng cao khả năng hồi phục sau cơn nguy kịch, được công nhận như là biện pháp ưu tiên hàng đầu trên bệnh nhân và người chăm sóc họ. Trong 1 thống kê tại các bệnh viện Anh làm thủ thuật hồi sức tích cực, 74% cung cấp các dịch vụ theo dõi ngoại trú cho bệnh nhân sống sót sau bệnh nặng và 18% cung cấp các chương trình phục hồi chức năng. Trên thế giới, các báo cáo theo dõi sau xuất viện khỏi khoa hồi sức tích cực khác nhau đáng kể và không có cách tiếp cận thống nhất về thực hiện các dịch vụ này. Những người sống sót sau hồi sức tích cực được báo cáo có lợi ích nhờ chương trình phục hồi tại phòng hồi sức và hỗ trợ như nhau, nhưng đến nay không có can thiệp dựa trên bằng chứng cải thiện kết cục lâu dài trên bệnh nhân ARDS. Tình trạng sống sót sau hồi sức vẫn là một lĩnh vực nghiên cứu tích cực với các thử nghiệm lâm sàng đang diễn ra nghiên cứu các can thiệp tiềm năng xảy ra khi nằm tại khoa chăm sóc đặc biệt sau hồi sức và làm theo cách tiếp cận trực tiếp hoặc thực tế với chương trình hỗ trợ phục hồi. Quan trọng hơn hết là các thử nghiệm lâm sàng ARDS trong tương lai cũng nên bao gồm những kết cục lâu dài đa chiều.
Tóm lại
ARDS là một hội chứng lâm sàng được định nghĩa là suy hô hấp giảm oxy máu cấp kèm theo thâm nhiễm 2 bên phế trường trên phim phổi. Chúng ta đang bước vào thời kỳ hậu đại dịch, bối cảnh dịch tễ học của ARDS chưa chắc chắn; tuy nhiên, bệnh nhân ARDS tiếp tục có tỷ lệ mắc và tỷ lệ tử vong đáng kể trong ngắn và dài hạn. Tiêu chuẩn ARDS đang được sửa đổi và xem xét những hạn chế có thể làm sáng tỏ. Bằng chứng dựa trên chăm sóc hỗ trợ tối ưu và các can thiệp trên ARDS tiếp tục được nghiên cứu để giải quyết các lĩnh vực không chắc chắn. Vì chúng ta đang bước vào kỷ nguyên y học chính xác trong các bệnh hiểm nghèo, tương lai điều trị ARDS phấn đấu theo hướng xác định những kiểu hình sinh học và các đặc điểm có thể điều trị cũng như điều trị can thiệp cá thể hóa.
Contributors
EAG prepared the first draft of the manuscript and figures. DFM and CMO’K reviewed and contributed to subsequent versions of the manuscript. All authors have reviewed and approved the final version.
Declaration of interests
EAG declares funding from the Wellcome Trust for work on a study investigating acute respiratory distress syndrome (ARDS) and COVID-19 and scholarship support from the American Thoracic Society to attend an American Thoracic Society meeting. DFM declares grants as an investigator in ARDS and COVID-19 studies from Wellcome Trust, the National Institute for Health and Care Research (NIHR), Innovate UK, the Medical Research Council, Novavax, and the Northern Ireland Health and Social Care Research and Development Fund; consultancy fees unrelated to this work from Bayer, GlaxoSmithKline, Boehringer Ingelheim, Novartis, and Eli Lilly; and payments from GlaxoSmithKline as an educational seminar speaker. DFM is a member of the data and safety monitoring board for Vir Biotechnology and Faron Pharmaceuticals; has a patent for a novel treatment for an inflammatory disease; is a director of research for the Intensive Care Society and director of the Efficacy and Mechanism Evaluation programme for the Medical Research Council and NIHR; declares a spouse who has received grants from Wellcome Trust and the Northern Ireland Health and Social Care Research and Development Fund; consultancy fees from INSMED and from the California Institute for Regenerative Medicine, unrelated to this Series paper. CMO’K declares grants as an investigator on studies related to ARDS and COVID-19 from Wellcome Trust and the Northern Ireland Health and Social Care Research and Development Fund; consultancy fees from INSMED, unrelated to this work, and fees for participation in grant panels for the Californian Institute of Regenerative Medicine, unrelated to this Series paper. CMO’K declares a spouse who has received grants from Wellcome Trust, the Northern Ireland Health and Social Care Research and Development Fund, NIHR, Innovate UK, the Medical Research Council, and Novavax; consultancy fees unrelated to this work from Bayer, GlaxoSmithKline, Boehringer Ingelheim, Novartis, and Eli Lilly; payments from GlaxoSmithKline as an educational seminar speaker; is a member of the data and safety monitoring board for Vir Biotechnology, Inc, and Faron Pharmaceuticals; has a patent for a novel treatment for an inflammatory disease; is a director of research for the Intensive Care Society and Director of the Efficacy and Mechanism Evaluation programme for the Medical Research Council and NIHR.
Acknowledgments
Figures included in this manuscript were created with BioRender.
Tài liệu tham khảo
- Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin definition. JAMA 2012; 307: 2526–33.
- Ferguson ND, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med 2012; 38: 1573–82.
- Shaver CM, Bastarache JA. Clinical and biological heterogeneity in acute respiratory distress syndrome: direct versus indirect lung injury. Clin Chest Med 2014; 35: 639–53.
- Huppert LA, Matthay MA, Ware LB. Pathogenesis of acute respiratory distress syndrome. Semin Respir Crit Care Med 2019; 40: 31–39.
- Thille AW, Esteban A, Fernández-Segoviano P, et al. Comparison of the Berlin definition for acute respiratory distress syndrome with autopsy. Am J Respir Crit Care Med 2013; 187: 761–67.
- Brown SM, Peltan ID, Barkauskas C, et al. What does acute respiratory distress syndrome mean during the COVID-19 pandemic? Ann Am Thorac Soc 2021; 18: 1948–50.
- Ferrando C, Suarez-Sipmann F, Mellado-Artigas R, et al. Clinical features, ventilatory management, and outcome of ARDS caused by COVID-19 are similar to other causes of ARDS. Intensive Care Med 2020; 46: 2200–11.
- Brault C, Zerbib Y, Kontar L, et al. COVID-19- versus non-COVID- 19-related acute respiratory distress syndrome: differences and similarities. Am J Respir Crit Care Med 2020; 202: 1301–04.
- Bain W, Yang H, Shah FA, et COVID-19 versus non-COVID-19 acute respiratory distress syndrome: comparison of demographics, physiologic parameters, inflammatory biomarkers, and clinical outcomes. Ann Am Thorac Soc 2021; 18: 1202–10.
- Vijayakumar B, Tonkin J, Devaraj A, et al. CT lung abnormalities after COVID-19 at 3 months and 1 year after hospital Radiology 2022; 303: 444–54.
- Sjoding MW, Admon AJ, Saha AK, et al. Comparing clinical features and outcomes in mechanically ventilated patients with COVID-19 and acute respiratory distress Ann Am Thorac Soc 2021; 18: 1876–85.
- Sinha P, Calfee CS, Cherian S, et al. Prevalence of phenotypes of acute respiratory distress syndrome in critically ill patients with COVID-19: a prospective observational Lancet Respir Med 2020; 8: 1209–18.
- Cui N, Jiang C, Yang C, Zhang L, Feng Comparison of deep vein thrombosis risks in acute respiratory distress syndrome caused by COVID-19 and bacterial pneumonia: a retrospective cohort study. Thromb J 2022; 20: 27.
- Living guidance for clinical management of COVID-19.Nov 23, 2021. https://www.who.int/publications/i/item/WHO-2019- nCoV-clinical-2021-2 (accessed July 7, 2022).
- Hodgson CL, Higgins AM, Bailey MJ, et al. Comparison of 6- month outcomes of survivors of COVID-19 versus non-COVID-19 critical Am J Respir Crit Care Med 2022; 205: 1159–68.
- Latronico N, Peli E, Calza S, et al. Physical, cognitive and mental health outcomes in 1-year survivors of COVID-19-associated Thorax 2022; 77: 300–03.
- Bossuyt PM, Reitsma JB, Linnet K, Moons KG. Beyond diagnostic accuracy: the clinical utility of diagnostic tests. Clin Chem 2012; 58: 1636–43.
- Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet 1967; 2: 319–23.
- Bernard GR, Artigas A, Brigham KL, et The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994; 149: 818–24.
- Brower RG, Matthay MA, Morris A, Schoenfeld D, Taylor Thompson B, Wheeler A. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342: 1301–08.
- Pham T, Pesenti A, Bellani G, et Outcome of acute hypoxaemic respiratory failure: insights from the LUNG SAFE Study.Eur Respir J 2021; 57: 2003317.
- Bellani G, Laffey JG, Pham T, et Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA 2016; 315: 788–800.
- Zimatore C, Pisani L, Lippolis V, et Accuracy of the radiographic assessment of lung edema score for the diagnosis of ARDS. Front Physiol 2021; 12: 672823.
- Mason SE, Dieffenbach PB, Englert JA, et al. Semi-quantitative visual assessment of chest radiography is associated with clinical outcomes in critically ill Respir Res 2019; 20: 218.
- Sjoding MW, Taylor D, Motyka J, et Deep learning to detect acute respiratory distress syndrome on chest radiographs: a retrospective study with external validation. Lancet Digit Health 2021; 3: e340–48.
- Leopold SJ, Ghose A, Plewes KA, et al. Point-of-care lung ultrasound for the detection of pulmonary manifestations of malaria and sepsis: an observational study. PLoS One 2018; 13:
- Pisani L, De Nicolo A, Schiavone M, et al. Lung ultrasound for detection of pulmonary complications in critically ill obstetric patients in a resource-limited Am J Trop Med Hyg 2020; 104: 478–86.
- Bass CM, Sajed DR, Adedipe AA, West Pulmonary ultrasound and pulse oximetry versus chest radiography and arterial blood gas analysis for the diagnosis of acute respiratory distress syndrome: a pilot study. Crit Care 2015; 19: 282.
- Riviello ED, Kiviri W, Twagirumugabe T, et al. Hospital incidence and outcomes of the acute respiratory distress syndrome using the Kigali modification of the Berlin Am J Respir Crit Care Med 2016; 193: 52–59.
- Kwizera A, Kateete DP, Ssenyonga R, et Acute respiratory distress syndrome in an African intensive care unit setting: a prospective study of prevalence and outcomes. Ann Am Thorac Soc 2022; 19: 691–94.
- Vercesi V, Pisani L, van Tongeren PSI, et al. External confirmation and exploration of the Kigali modification for diagnosing moderate or severe Intensive Care Med 2018; 44: 523–24.
- Xirouchaki N, Magkanas E, Vaporidi K, et al. Lung ultrasound in critically ill patients: comparison with bedside chest Intensive Care Med 2011; 37: 1488–93.
- Valbuena VSM, Seelye S, Sjoding MW, et al. Racial bias and reproducibility in pulse oximetry among medical and surgical inpatients in general care in the Veterans Health Administration 2013- 19: multicenter, retrospective cohort BMJ 2022; 378: e069775.
- Parke RL, Bloch A, McGuinness Effect of very-high-flow nasal therapy on airway pressure and end-expiratory lung impedance in healthy volunteers. Respir Care 2015; 60: 1397–403.
- Matthay MA, Thompson BT, Ware The Berlin definition of acute respiratory distress syndrome: should patients receiving high- flow nasal oxygen be included? Lancet Respir Med 2021; 9: 933–36.
- Hultström M, Hellkvist O, Covaciu L, et Limitations of the ARDS criteria during high-flow oxygen or non-invasive ventilation: evidence from critically ill COVID-19 patients. Crit Care 2022; 26: 55.
- Ranieri VM, Tonetti T, Navalesi P, et High-flow nasal oxygen for severe hypoxemia: oxygenation response and outcome in patients with COVID-19. Am J Respir Crit Care Med 2022; 205: 431–39.
- Bos LDJ, Laffey JG, Ware LB, et al. Towards a biological definition of ARDS: are treatable traits the solution? Intensive Care Med Exp 2022; 10:8
- Bastarache JA, McNeil JB, Plosa EJ, et al. Standardization of methods for sampling the distal airspace in mechanically ventilated patients using heat moisture exchange filter Am J Physiol Lung Cell Mol Physiol 2021; 320: L785–90.
- McNeil JB, Shaver CM, Kerchberger VE, et al. Novel method for noninvasive sampling of the distal airspace in acute respiratory distress Am J Respir Crit Care Med 2018; 197: 1027–35.
- Maslove DM, Tang B, Shankar-Hari M, et Redefining critical illness. Nat Med 2022; 28: 1141–48.
- Calfee CS, Delucchi K, Parsons PE, Thompson BT, Ware LB, Matthay Subphenotypes in acute respiratory distress syndrome: latent class analysis of data from two randomised controlled trials. Lancet Respir Med 2014; 2: 611–20.
- Calfee CS, Delucchi KL, Sinha P, et al. Acute respiratory distress syndrome subphenotypes and differential response to simvastatin: secondary analysis of a randomised controlled Lancet Respir Med 2018; 6: 691–98.
- Famous KR, Delucchi K, Ware LB, et al. Acute respiratory distress syndrome subphenotypes respond differently to randomized fluid management strategy. Am J Respir Crit Care Med 2017; 195: 331–38.
- Maddali MV, Churpek M, Pham T, et al. Validation and utility of ARDS subphenotypes identified by machine-learning models using clinical data: an observational, multicohort, retrospective analysis. Lancet Respir Med 2022; 10: 367–77.
- Du M, Garcia JGN, Christie JD, et Integrative omics provide biological and clinical insights into acute respiratory distress syndrome. Intensive Care Med 2021; 47: 761–71.
- Roussel M, Ferrant J, Reizine F, et al. Comparative immune profiling of acute respiratory distress syndrome patients with or without SARS-CoV-2 Cell Rep Med 2021; 2: 100291.
- Reddy K, Calfee CS, McAuley Acute respiratory distress syndrome subphenotypes beyond the syndrome: a step toward treatable traits? Am J Respir Crit Care Med 2021; 203: 1449–51.
- Griffiths MJD, McAuley DF, Perkins GD, et Guidelines on the management of acute respiratory distress syndrome. BMJ Open Respir Res 2019; 6: e000420.
- Papazian L, Aubron C, Brochard L, et Formal guidelines: management of acute respiratory distress syndrome. Ann Intensive Care 2019; 9: 69.
- Fan E, Del Sorbo L, Goligher EC, et al. An official American Thoracic Society/European Society of Intensive Care Medicine/ Society of Critical Care Medicine Clinical Practice guideline: mechanical ventilation in adult patients with acute respiratory distress Am J Respir Crit Care Med 2017; 195: 1253–63.
- Griffiths M, Meade S, Summers C, et al. RAND appropriateness panel to determine the applicability of UK guidelines on the management of acute respiratory distress syndrome (ARDS) and other strategies in the context of the COVID-19
- Thorax 2022; 77: 129–35.
- Amato MBP, Meade MO, Slutsky AS, et al. Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 2015; 372: 747–55.
- Costa ELV, Slutsky AS, Brochard LJ, et al. Ventilatory variables and mechanical power in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 2021; 204: 303–11.
- Beitler JR, Walkey The staying power of pressure- and volume- limited ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med 2021; 204: 247–49.
- Hodgson CL, Cooper DJ, Arabi Y, et al. Maximal recruitment open lung ventilation in acute respiratory distress syndrome (PHARLAP). A phase II, multicenter randomized controlled clinical Am J Respir Crit Care Med 2019; 200: 1363–72.
- Ferguson ND, Cook DJ, Guyatt GH, et al. High-frequency oscillation in early acute respiratory distress N Engl J Med 2013; 368: 795–805.
- Young D, Lamb SE, Shah S, et al. High-frequency oscillation for acute respiratory distress N Engl J Med 2013; 368: 806–13.
- Carsetti A, Damiani E, Domizi R, et al. Airway pressure release ventilation during acute hypoxemic respiratory failure: a systematic review and meta-analysis of randomized controlled Ann Intensive Care 2019; 9: 44.
- Dianti J, Tisminetzky M, Ferreyro BL, et Association of positive end-expiratory pressure and lung recruitment selection strategies with mortality in acute respiratory distress syndrome: a systematic review and network meta-analysis. Am J Respir Crit Care Med 2022; 205: 1300–10.
- Goligher EC, Kavanagh BP, Rubenfeld GD, et al. Oxygenation response to positive end-expiratory pressure predicts mortality in acute respiratory distress syndrome. A secondary analysis of the LOVS and ExPress Am J Respir Crit Care Med 2014; 190: 70–76.
- Beitler JR, Sarge T, Banner-Goodspeed VM, et Effect of titrating positive end-expiratory pressure (PEEP) with an esophageal pressure-guided strategy vs an empirical high PEEP-Fio2 strategy on death and days free from mechanical ventilation among patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA 2019; 321: 846–57.
- Cavalcanti AB, Suzumura ÉA, Laranjeira LN, et al. Effect of lung recruitment and titrated positive end-expiratory pressure (PEEP) vs low PEEP on mortality in patients with acute respiratory distress syndrome: a randomized clinical JAMA 2017; 318: 1335–45.
- Chiumello D, Carlesso E, Brioni M, Cressoni M. Airway driving pressure and lung stress in ARDS patients. Crit Care 2016; 20:
- McNamee JJ, Gillies MA, Barrett NA, et al. Effect of lower tidal volume ventilation facilitated by extracorporeal carbon dioxide removal vs standard care ventilation on 90-day mortality in patients with acute hypoxemic respiratory failure: the REST randomized clinical trial. JAMA 2021; 326: 1013–23.
- Gattinoni L, Tonetti T, Cressoni M, et Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med 2016; 42: 1567–75.
- Coppola S, Caccioppola A, Froio S, et Effect of mechanical power on intensive care mortality in ARDS patients. Crit Care 2020; 24: 246.
- Guérin C, Papazian L, Reignier J, Ayzac L, Loundou A, Forel Effect of driving pressure on mortality in ARDS patients during lung protective mechanical ventilation in two randomized controlled trials. Crit Care 2016; 20: 384.
- Serpa Neto A, Deliberato RO, Johnson AEW, et Mechanical power of ventilation is associated with mortality in critically ill patients: an analysis of patients in two observational cohorts. Intensive Care Med 2018; 44: 1914–22.
- Zhang Z, Zheng B, Liu N, Ge H, Hong Mechanical power normalized to predicted body weight as a predictor of mortality in patients with acute respiratory distress syndrome. Intensive Care Med 2019; 45: 856–64.
- Sarge T, Baedorf-Kassis E, Banner-Goodspeed V, et al. Effect of esophageal pressure-guided positive end-expiratory pressure on survival from acute respiratory distress syndrome: a risk-based and mechanistic reanalysis of the EPVent-2 Am J Respir Crit Care Med 2021; 204: 1153–63.
- Constantin J-M, Jabaudon M, Lefrant J-Y, et al. Personalised mechanical ventilation tailored to lung morphology versus low positive end-expiratory pressure for patients with acute respiratory distress syndrome in France (the LIVE study): a multicentre, single- blind, randomised controlled Lancet Respir Med 2019; 7: 870–80.
- Guérin C, Albert RK, Beitler J, et al. Prone position in ARDS patients: why, when, how and for whom. Intensive Care Med 2020; 46: 2385–96.
- Guérin C, Reignier J, Richard J-C, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368: 2159–68.
- Guérin C, Beuret P, Constantin JM, et al. A prospective international observational prevalence study on prone positioning of ARDS patients: the APRONET (ARDS Prone Position Network) Intensive Care Med 2018; 44: 22–37.
- Alhazzani W, Parhar KKS, Weatherald J, et Effect of awake prone positioning on endotracheal intubation in patients with COVID-19 and acute respiratory failure: a randomized clinical trial. JAMA 2022; 327: 2104–13.
- Ehrmann S, Li J, Ibarra-Estrada M, et al. Awake prone positioning for COVID-19 acute hypoxaemic respiratory failure: a randomised, controlled, multinational, open-label meta-trial. Lancet Respir Med 2021; 9: 1387–95.
- Moss M, Huang DT, Brower RG, et al. Early neuromuscular blockade in the acute respiratory distress syndrome. N Engl J Med 2019; 380: 1997–2008.
- Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled Lancet 2009; 374: 1351–63.
- Combes A, Hajage D, Capellier G, et Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome. N Engl J Med 2018; 378: 1965–75.
- Goligher EC, Tomlinson G, Hajage D, et Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome and posterior probability of mortality benefit in a post hoc bayesian analysis of a randomized clinical trial. JAMA 2018; 320: 2251–59.
- Combes A, Peek GJ, Hajage D, et ECMO for severe ARDS: systematic review and individual patient data meta-analysis. Intensive Care Med 2020; 46: 2048–57.
- Camporota L, Meadows C, Ledot S, et Consensus on the referral and admission of patients with severe respiratory failure to the NHS ECMO service. Lancet Respir Med 2021; 9: e16–17.
- Combes A, Brodie D, Bartlett R, et al. Position paper for the organization of extracorporeal membrane oxygenation programs for acute respiratory failure in adult patients. Am J Respir Crit Care Med 2014; 190: 488–96.
- Urner M, Barnett AG, Bassi GL, et al. Venovenous extracorporeal membrane oxygenation in patients with acute COVID-19 associated respiratory failure: comparative effectiveness BMJ 2022; 377: e068723.
- Horby P, Lim WS, Emberson JR, et al. Dexamethasone in hospitalized patients with COVID-19. N Engl J Med 2021; 384: 693–704.
- Angus DC, Derde L, Al-Beidh F, et Effect of hydrocortisone on mortality and organ support in patients with severe COVID-19: the REMAP-CAP COVID-19 corticosteroid domain randomized clinical trial. JAMA 2020; 324: 1317–29.
- Sterne JAC, Murthy S, Diaz JV, et al. Association between administration of systemic corticosteroids and mortality among critically ill patients with COVID-19: a meta-analysis. JAMA 2020; 324: 1330–41.
- Chaudhuri D, Sasaki K, Karkar A, et al. Corticosteroids in COVID-19 and non-COVID-19 ARDS: a systematic review and meta-analysis. Intensive Care Med 2021; 47: 521–37.
- Villar J, Ferrando C, Martínez D, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled Lancet Respir Med 2020; 8: 267–76.
- Steinberg KP, Hudson LD, Goodman RB, et al. Efficacy and safety of corticosteroids for persistent acute respiratory distress syndrome. N Engl J Med 2006; 354: 1671–84.
- Saha R, Assouline B, Mason G, Douiri A, Summers C, Shankar-Har M. The impact of sample size misestimations on the interpretation of ARDS trials: systematic review and meta-analysis. Chest 2022; published online May 26. https://doi.org/10.1016/j. chest.2022.05.018.
- Fuller BM, Mohr NM, Skrupky L, Fowler S, Kollef MH, Carpenter The use of inhaled prostaglandins in patients with ARDS: a systematic review and meta-analysis. Chest 2015; 147: 1510–22.
- McAuley DF, Laffey JG, O’Kane CM, et al. Simvastatin in the acute respiratory distress syndrome. N Engl J Med 2014; 371: 1695–703.
- Truwit JD, Bernard GR, Steingrub J, et al. Rosuvastatin for sepsis- associated acute respiratory distress syndrome. N Engl J Med 2014; 370: 2191–200.
- Toner P, Boyle AJ, McNamee JJ, et al. Aspirin as a treatment for acute respiratory distress syndrome: a randomised placebo controlled clinical trial. Chest 2021; 161: 1275–84.
- Willson DF, Truwit JD, Conaway MR, Traul CS, Egan The adult calfactant in acute respiratory distress syndrome trial. Chest 2015; 148: 356–64.
- Liu KD, Levitt J, Zhuo H, et Randomized clinical trial of activated protein C for the treatment of acute lung injury. Am J Respir Crit Care Med 2008; 178: 618–23.
- Cornet AD, Groeneveld AB, Hofstra JJ, et al. Recombinant human activated protein C in the treatment of acute respiratory distress syndrome: a randomized clinical PLoS One 2014; 9: e90983.
- Iwata K, Doi A, Ohji G, et al. Effect of neutrophil elastase inhibitor (sivelestat sodium) in the treatment of acute lung injury (ALI) and acute respiratory distress syndrome (ARDS): a systematic review and meta-analysis. Intern Med 2010; 49: 2423–32.
- Gates S, Perkins GD, Lamb SE, et Beta-Agonist Lung injury TrIal-2 (BALTI-2): a multicentre, randomised, double-blind, placebo- controlled trial and economic evaluation of intravenous infusion of salbutamol versus placebo in patients with acute respiratory distress syndrome. Health Technol Assess 2013; 17: v–vi, 1–87.
- Matthay MA, Brower RG, Carson S, et al. Randomized, placebo- controlled clinical trial of an aerosolized β₂-agonist for treatment of acute lung Am J Respir Crit Care Med 2011; 184: 561–68.
- McAuley DF, Cross LM, Hamid U, et Keratinocyte growth factor for the treatment of the acute respiratory distress syndrome (KARE): a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Respir Med 2017; 5: 484–91.
- Gorman E, Millar J, McAuley D, O’Kane Mesenchymal stromal cells for acute respiratory distress syndrome (ARDS), sepsis, and COVID-19 infection: optimizing the therapeutic potential. Expert Rev Respir Med 2021; 15: 301–24.
- Matthay MA, Calfee CS, Zhuo H, et al. Treatment with allogeneic mesenchymal stromal cells for moderate to severe acute respiratory distress syndrome (START study): a randomised phase 2a safety trial. Lancet Respir Med 2019; 7: 154–62.
- Bellingan G, Jacono F, Bannard-Smith J, et Safety and efficacy of multipotent adult progenitor cells in acute respiratory distress syndrome (MUST-ARDS): a multicentre, randomised, double-blind, placebo-controlled phase 1/2 trial. Intensive Care Med 2022; 48: 36–44.
- Dilogo IH, Aditianingsih D, Sugiarto A, et al. Umbilical cord mesenchymal stromal cells as critical COVID-19 adjuvant therapy: a randomized controlled trial. Stem Cells Transl Med 2021; 10: 1279–87.
- Lanzoni G, Linetsky E, Correa D, et Umbilical cord mesenchymal stem cells for COVID-19 acute respiratory distress syndrome: a double-blind, phase 1/2a, randomized controlled trial. Stem Cells Transl Med 2021; 10: 660–73.
- Monsel A, Hauw-Berlemont C, Mebarki M, et al. Treatment of COVID-19-associated ARDS with mesenchymal stromal cells: a multicenter randomized double-blind trial. Crit Care 2022; 26: 48.
- Dutra Silva J, Su Y, Calfee CS, et al. Mesenchymal stromal cell extracellular vesicles rescue mitochondrial dysfunction and improve barrier integrity in clinically relevant models of ARDS. Eur Respir J 2021; 58:
- McKelvey MC, Abladey AA, Small DM, et al. Cathepsin S contributes to lung inflammation in acute respiratory distress syndrome. Am J Respir Crit Care Med 2022; 205: 769–82.
- Mehta P, Samanta R, Wick K, et Elevated ferritin is associated with systemic inflammation, inflammasome activation and mortality in acute respiratory distress syndrome (ARDS). ERJ Open Res 2022; 8 (suppl 8): 118.
- Boyle AJ, Ferris P, Bradbury I, et Baseline plasma IL-18 may predict simvastatin treatment response in patients with ARDS: a secondary analysis of the HARP-2 randomised clinical trial. Crit Care 2022; 26: 164.
- Calfee CS, Liu KD, Asare AL, et Clinical trial design during and beyond the pandemic: the I-SPY COVID trial. Nat Med 2022; 28: 9–11.
- Beitler JR, Thompson BT, Baron RM, et al. Advancing precision medicine for acute respiratory distress syndrome. Lancet Respir Med 2022; 10: 107–20.
- Pisani L, Algera AG, Serpa Neto A, et al. Epidemiological characteristics, ventilator management, and clinical outcome in patients receiving invasive ventilation in intensive care units from 10 Asian middle-income countries (PRoVENT-iMiC): an international, multicenter, prospective study. Am J Trop Med Hyg 2021; 104: 1022–33.
- Azevedo LCP, Park M, Salluh JIF, et Clinical outcomes of patients requiring ventilatory support in Brazilian intensive care units: a multicenter, prospective, cohort study. Crit Care 2013; 17: R63.
- Gupta E, Hossen S, Grigsby MR, et al. Risk factors for the development of acute respiratory distress syndrome in mechanically ventilated adults in Peru: a multicenter observational Crit Care 2019; 23: 398.
- Saha R, Assouline B, Mason G, Douiri A, Summers C, Shankar-Hari M. Impact of differences in acute respiratory distress syndrome randomised controlled trial inclusion and exclusion criteria: systematic review and meta-analysis. Br J Anaesth 2021; 127: 85–101.
- Pais FM, Sinha P, Liu KD, Matthay MA. Influence of clinical factors and exclusion criteria on mortality in ARDS observational studies and randomized controlled trials. Respir Care 2018; 63: 1060–69.
- Juschten J, Tuinman PR, Guo T, et al. Between-trial heterogeneity in ARDS Intensive Care Med 2021; 47: 422–34.
- Bosch NA, Lee M-M, LeSieur MN, Law AC, Walkey AJ. Death due to irreversible hypoxemic respiratory failure in ARDSnet clinical trials. J Crit Care 2022; 67: 85–87.
- Ketcham SW, Sedhai YR, Miller HC, et al. Causes and characteristics of death in patients with acute hypoxemic respiratory failure and acute respiratory distress syndrome: a retrospective cohort study. Crit Care 2020; 24:
- Torres LK, Hoffman KL, Oromendia C, et Attributable mortality of acute respiratory distress syndrome: a systematic review, meta- analysis and survival analysis using targeted minimum loss-based estimation. Thorax 2021; 76: 1176–85.
- Auriemma CL, Zhuo H, Delucchi K, et Acute respiratory distress syndrome-attributable mortality in critically ill patients with sepsis. Intensive Care Med 2020; 46: 1222–31.
- Ingraham NE, Vakayil V, Pendleton KM, et al. Recent trends in admission diagnosis and related mortality in the medically critically ill. J Intensive Care Med 2022; 37: 185–94.
- Wick KD, McAuley DF, Levitt JE, et Promises and challenges of personalized medicine to guide ARDS therapy. Crit Care 2021;25: 404.
- Tzotzos SJ, Fischer B, Fischer H, Zeitlinger Incidence of ARDS and outcomes in hospitalized patients with COVID-19: a global literature survey. Crit Care 2020; 24: 516.
- Johnson SW, Garcia MA, Sisson EKQ, et al. Hospital variation in management and outcomes of acute respiratory distress syndrome due to COVID-19. Crit Care Explor 2022; 10:
- Magesh S, John D, Li WT, et Disparities in COVID-19 outcomes by race, ethnicity, and socioeconomic status: a systematic review and meta-analysis. JAMA Netw Open 2021; 4: e2134147.
- Romano SD, Blackstock AJ, Taylor EV, et Trends in racial and ethnic disparities in COVID-19 hospitalizations, by region— United States, March–December 2020. MMWR Morb Mortal Wkly Rep 2021; 70: 560–65.
- Arabi YM, Azoulay E, Al-Dorzi HM, et al. How the COVID-19 pandemic will change the future of critical care. Intensive Care Med 2021; 47: 282–91.
- Herridge MS, Tansey CM, Matté A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med 2011; 364: 1293–304.
- Wilcox ME, Patsios D, Murphy G, et Radiologic outcomes at 5 years after severe ARDS. Chest 2013; 143: 920–26.
- Davydow DS, Desai SV, Needham DM, Bienvenu OJ. Psychiatric morbidity in survivors of the acute respiratory distress syndrome: a systematic Psychosom Med 2008; 70: 512–19.
- Hashem MD, Hopkins RO, Colantuoni E, et al. Six-month and 12-month patient outcomes based on inflammatory subphenotypes in sepsis-associated ARDS: secondary analysis of SAILS-ALTOS trial. Thorax 2022; 77: 22–30.
- Needham DM, Dinglas VD, Bienvenu OJ, et al. One year outcomes in patients with acute lung injury randomised to initial trophic or full enteral feeding: prospective follow-up of EDEN randomised trial. BMJ 2013; 346:
- Brown SM, Wilson EL, Presson AP, et al. Understanding patient outcomes after acute respiratory distress syndrome: identifying subtypes of physical, cognitive and mental health outcomes. Thorax 2017; 72: 1094–103.
- Kamdar BB, Huang M, Dinglas VD, et al. Joblessness and lost earnings after acute respiratory distress syndrome in a 1-year national multicenter study. Am J Respir Crit Care Med 2017; 196: 1012–20.
- Kamdar BB, Sepulveda KA, Chong A, et Return to work and lost earnings after acute respiratory distress syndrome: a 5-year prospective, longitudinal study of long-term survivors. Thorax 2018; 73: 125–33.
- Su H, Hopkins RO, Kamdar BB, et al. Association of imbalance between job workload and functional ability with return to work in ARDS survivors. Thorax 2022; 77: 123–28.
- Ruhl AP, Huang M, Colantuoni E, et al. Healthcare utilization and costs in ARDS survivors: a 1-year longitudinal national US multicenter Intensive Care Med 2017; 43: 980–91.
- Dinglas VD, Aronson Friedman L, Colantuoni E, et al. Muscle weakness and 5-year survival in acute respiratory distress syndrome Crit Care Med 2017; 45: 446–53.
- Prescott HC, Sjoding MW, Langa KM, Iwashyna TJ, McAuley Late mortality after acute hypoxic respiratory failure. Thorax 2017; 73: 618–25.
- Eberst G, Claudé F, Laurent L, et Result of one-year, prospective follow-up of intensive care unit survivors after SARS-CoV-2 pneumonia. Ann Intensive Care 2022; 12: 23.
- Zangrillo A, Belletti A, Palumbo D, et al. One-year multidisciplinary follow-up of patients with COVID-19 requiring invasive mechanical ventilation. J Cardiothorac Vasc Anesth 2022; 36: 1354–63.
- Heesakkers H, van der Hoeven JG, Corsten S, et al. Clinical outcomes among patients with 1-year survival following intensive care unit treatment for COVID-19. JAMA 2022; 327: 559–65.
- Hodgson CL, Higgins AM, Bailey MJ, et al. The impact of COVID-19 critical illness on new disability, functional outcomes and return to work at 6 months: a prospective cohort Crit Care 2021; 25: 382.
- Stewart I, Jacob J, George PM, et al. Interstitial lung damage following COVID-19 hospitalisation: an interim analysis of the UKILD Post-COVID study. medRxiv 2022: published online March 16. https://doi.org/10.1101/2022.03.10.22272081 (preprint).
- McGroder CF, Zhang D, Choudhury MA, et al. Pulmonary fibrosis 4 months after COVID-19 is associated with severity of illness and blood leucocyte telomere Thorax 2021; 76: 1242–45.
- Yang C, Zhao H, Tebbutt SJ. A glimpse into long COVID and Lancet Respir Med 2022; published online June 10. https://doi.org/10.1016/S2213-2600(22)00217-X.
- Xie Y, Xu E, Bowe B, Al-Aly Z. Long-term cardiovascular outcomes of COVID-19. Nat Med 2022; 28: 583–90.
- George M, Hernandez C, Smith S, et al. Nursing research priorities in critical care, pulmonary, and sleep: international Delphi survey of nurses, patients, and Ann Am Thorac Soc 2020; 17: 1–10.
- Connolly B, Milton-Cole R, Adams C, et Recovery, rehabilitation and follow-up services following critical illness: an updated UK national cross-sectional survey and progress report. BMJ Open 2021; 11: e052214.
- Bakhru RN, Davidson JF, Bookstaver RE, et Implementation of an ICU recovery clinic at a tertiary care academic center. Crit Care Explor 2019; 1: e0034.
- Cook K, Bartholdy R, Raven M, et al. A national survey of intensive care follow-up clinics in Australia. Aust Crit Care 2020; 33: 533–37.
- McPeake J, Boehm LM, Hibbert E, et al. Key components of ICU recovery programs: what did patients report provided benefit? Crit Care Explor 2020; 2:
- McPeake J, Iwashyna TJ, Boehm LM, et al. Benefits of peer support for intensive care unit survivors: sharing experiences, care debriefing, and altruism. Am J Crit Care 2021; 30: 145–49.
- Schofield-Robinson OJ, Lewis SR, Smith AF, McPeake J, Alderson P. Follow-up services for improving long-term outcomes in intensive care unit (ICU) Cochrane Database Syst Rev 2018; 11: CD012701.
- Connolly B, Salisbury L, O’Neill B, et al. Exercise rehabilitation following intensive care unit discharge for recovery from critical Cochrane Database Syst Rev 2015; 2015: CD008632.

