Y tế - Sức Khỏe
Điều bác sĩ hồi sức cấp cứu cần biết về CMV ở bệnh nhân suy giảm miễn dịch tại ICU
Lượt dịch: NT ΗΝ
Tải PDF tại đây
Trong những thập kỷ gần đây, số lượng người bị suy giảm miễn dịch đã gia tăng do những tiến bộ trong điều trị ức chế miễn dịch cho bệnh ung thư và bệnh tự miễn, sự gia tăng số ca ghép tạng đặc, cũng như kéo dài thời gian sống của bệnh nhân mắc bệnh ác tính. Các bệnh nhiễm trùng cơ hội là nguyên nhân hàng đầu gây bệnh tật và tử vong ở nhóm đối tượng này. Trong số đó, virus CMV là một trong những virus thường gặp nhất ở bệnh nhân bị suy giảm miễn dịch qua trung gian tế bào, và khi lan rộng, virus này có thể gây rối loạn chức năng cơ quan và gây tử vong.
Ngày càng có nhiều bệnh nhân suy giảm miễn dịch nguy cơ cao được nhập vào các đơn vị điều trị tích cực (ICU), và việc quản lý CMV ở nhóm bệnh nhân này đặt ra nhiều thách thức mà bác sĩ hồi sức cần nhận biết. Tình trạng rối loạn chức năng cơ quan liên quan đến CMV có thể là nguyên nhân làm cho bệnh nhân nhập ICU hoặc tiến triển trong quá trình nằm viện tại ICU, và thường liên quan đến tỷ lệ tử vong cao. Hơn nữa, CMV không chỉ gây tác động trực tiếp lên tế bào, mà còn có tác động gián tiếp làm tăng nguy cơ nhiễm trùng thứ phát do các mầm bệnh khác và các rối loạn đe dọa tính mạng khác như bệnh huyết khối vi mạch. Việc hiểu rõ các biểu hiện lâm sàng của nhiễm CMV ở bệnh nhân suy giảm miễn dịch đang trong tình trạng nguy kịch là rất quan trọng để lựa chọn xét nghiệm chẩn đoán phù hợp và bắt đầu điều trị kịp thời. Các biểu hiện này khác nhau tùy thuộc vào tình trạng suy giảm miễn dịch nền. Tuy nhiên, bệnh nhân nguy kịch thường có tình trạng bệnh lý phức tạp, khiến việc xác định các triệu chứng và dấu hiệu là do nhiễm CMV hay do nguyên nhân khác trở nên khó khăn. Thêm vào đó, mặc dù xét nghiệm PCR dịch cơ thể có thể cho kết quả nhanh chóng và chính xác, nhưng lại không phân biệt được rõ ràng giữa nhiễm CMV và bệnh CMV (sự xâm lấn virus đang sao chép vào mô).
Nhiễm CMV ở bệnh nhân suy giảm miễn dịch trong tình trạng nguy kịch vì vậy đặt ra thách thức lớn đối với bác sĩ hồi sức.
Sinh lý bệnh của nhiễm CMV
CMV là một loại virus DNA sợi kép thuộc họ beta-herpesvirus ở người (HHV-5) và có tính đặc hiệu loài rất cao. Virus này lây truyền qua nước bọt, quan hệ tình dục, truyền qua nhau thai, cho con bú, truyền máu, ghép tạng, ghép tế bào gốc tạo máu. CMV chủ yếu nhiễm vào tế bào biểu mô các tuyến và niêm mạc, và virus có thể vẫn được phát hiện trong dịch tiết một thời gian sau khi nhiễm. Ngoài ra, CMV cũng có thể nhiễm vào các tế bào nội mô, nguyên bào sợi và các tế bào chuyên biệt khác, dẫn đến rối loạn chức năng cơ quan. Các bạch cầu mang virus và tế bào nội mô lưu hành trong máu giúp CMV lan rộng đến nhiều cơ quan đích.
Nhiễm CMV nguyên phát kích hoạt nhiều phản ứng miễn dịch, từ đó thiết lập khả năng miễn dịch lâu dài. Một đáp ứng miễn dịch sớm, mạnh mẽ và đặc hiệu với CMV của tế bào T là yếu tố then chốt để kiểm soát sự sao chép của virus và ngăn ngừa bệnh CMV. Trong những trường hợp suy giảm miễn dịch tế bào nghiêm trọng, CMV có thể tái hoạt động và gây bệnh CMV nặng.
Các định nghĩa về nhiễm CMV và bệnh CMV
Nhiễm CMV: Phân lập virus qua cấy hoặc phát hiện protein virus hoặc acid nucleic trong bất kỳ dịch cơ thể hoặc mẫu mô nào, bất kể có triệu chứng hay không.
Nhiễm CMV nguyên phát: Lần đầu phát hiện nhiễm CMV ở một bệnh nhân không có bằng chứng phơi nhiễm CMV trước đó.
Nhiễm CMV tái phát: Nhiễm CMV mới ở một bệnh nhân đã có bằng chứng nhiễm CMV trước đó nhưng không phát hiện virus trong ít nhất 4 tuần liên tiếp trong quá trình theo dõi chủ động.
CMV tái hoạt động: Nhiễm CMV do cùng chủng virus đã gây ra nhiễm trùng ban đầu ở một bệnh nhân đã có huyết thanh dương tính trước đó.
Tái nhiễm CMV: Phát hiện một chủng CMV mới khác biệt với chủng đã gây ra nhiễm trùng ban đầu.
Nhiễm CMV dai dẳng: Sự tồn tại hoặc tăng hơn 1 log10 trong nồng độ DNA CMV trong máu (từ tải lượng virus đỉnh trong tuần đầu tiên đến tải lượng virus đỉnh sau ≥ 2 tuần điều trị thuốc kháng virus với liều thích hợp).
Nhiễm CMV kháng trị: Sự xuất hiện của biến đổi di truyền ở virus làm giảm độ nhạy đối với một hoặc nhiều loại thuốc kháng virus.
Bệnh CMV:
- Hội chứng CMV: Phát hiện CMV trong máu bằng cách phân lập virus, nuôi cấy nhanh, xét nghiệm kháng nguyên hoặc acid nucleic + ít nhất 2 trong các yếu tố sau:
- Sốt ≥ 38°C ít nhất 2 ngày
- Mệt mỏi hoặc uể oải mới xuất hiện hoặc tăng lên
- Giảm bạch cầu hoặc giảm bạch cầu hạt trong 2 mẫu xét nghiệm riêng biệt, cách nhau ít nhất 24 giờ
- ≥5% lympho bất thường
- Giảm tiểu cầu
- Tăng men AST hoặc ALT lên gấp đôi giới hạn bình thường
- CMV tổn thương cơ quan đích: Nhiễm CMV xâm lấn mô gây tổn thương cơ quan trực tiếp được chứng minh bằng sự hiện diện của các dấu hiệu và triệu chứng lâm sàng đặc hiệu của cơ quan bị tổn thương cùng với việc phát hiện CMV trong mô qua các kỹ thuật mô bệnh học, miễn dịch hóa mô bệnh học, kỹ thuật lai DNA, phân lập virus hoặc nuôi cấy nhanh.
- Bệnh CMV dai dẳng: Không có dấu hiệu cải thiện, tình trạng các dấu hiệu và triệu chứng trở nên nặng hơn hoặc tiến triển thành bệnh lý cơ quan đích sau ít nhất 2 tuần điều trị thuốc kháng virus với liều thích hợp.
CMV tái hoạt hóa ở những bệnh nhân nặng không suy giảm miễn dịch
Nhiều nghiên cứu trong những thập kỷ gần đây đã đánh giá sự tái hoạt động của CMV ở bệnh nhân ICU, được ghi nhận lên đến 30% những người có huyết thanh dương tính với CMV trước đó. Phần lớn các nghiên cứu này chỉ tập trung vào bệnh nhân trước đó có miễn dịch bình thường, người ta cho rằng tình trạng bệnh nặng tạo ra một trạng thái thuận lợi cùng với suy giảm miễn dịch tế bào mắc phải tại ICU, làm tăng nguy cơ tái hoạt động CMV. Nhiễm trùng huyết, hội chứng suy hô hấp cấp tính và Covid-19 nặng được xác định là các yếu tố nguy cơ. Dữ liệu gần đây cho thấy tái hoạt động CMV trong máu xảy ra ở 20% bệnh nhân Covid-19 nguy kịch, tăng lên đến 41.7% ở các trường hợp có viêm phổi do Aspergillus liên quan đến Covid-19, trong đó suy giảm miễn dịch từ trước khi nhiễm Covid-19 là yếu tố nguy cơ chính. Tuy nhiên, một số nghiên cứu khác chỉ báo cáo tái hoạt động CMV phổi có ý nghĩa lâm sàng ở 6% bệnh nhân Covid-19 được thở máy. Hiện vẫn chưa hiểu rõ liệu tái hoạt động CMV ở những bệnh nhân này là do trực tiếp tác động của virus Covid, các liệu pháp miễn dịch được sử dụng hay do thời gian thở máy kéo dài.
Các nghiên cứu quan sát, phân tích tổng hợp đã liên kết tái hoạt động CMV với kết cục xấu hơn ở bệnh nhân nguy kịch, bao gồm thời gian thở máy kéo dài, thời gian nằm ICU lâu hơn và tỷ lệ từ vong cao hơn. Các cơ chế được đề xuất bao gồm tác động gây tổn thương cơ quan của CMV trong phổi, rối loạn điều hòa miễn dịch do phản ứng CMV quá mức, và sự biến đổi miễn dịch do sự sao chép của virus, làm tăng nguy cơ nhiễm trùng thứ phát ở bệnh nhân. Tuy nhiên, vai trò gây bệnh của CMV trong nhóm bệnh nhân này vẫn còn chưa rõ ràng; ba thử nghiệm lâm sàng đã không cho thấy lợi ích lâm sàng từ việc điều trị kháng virus dự phòng hoặc can thiệp sớm mặc dù có giảm tỷ lệ tái hoạt động CMV ở những bệnh nhân này. Hơn nữa, tái hoạt động CMV có thể tự khỏi trong vòng 2-3 tuần, với bằng chứng hạn chế về bệnh CMV xâm lấn cơ quan đích trong các nghiên cứu gần đây.
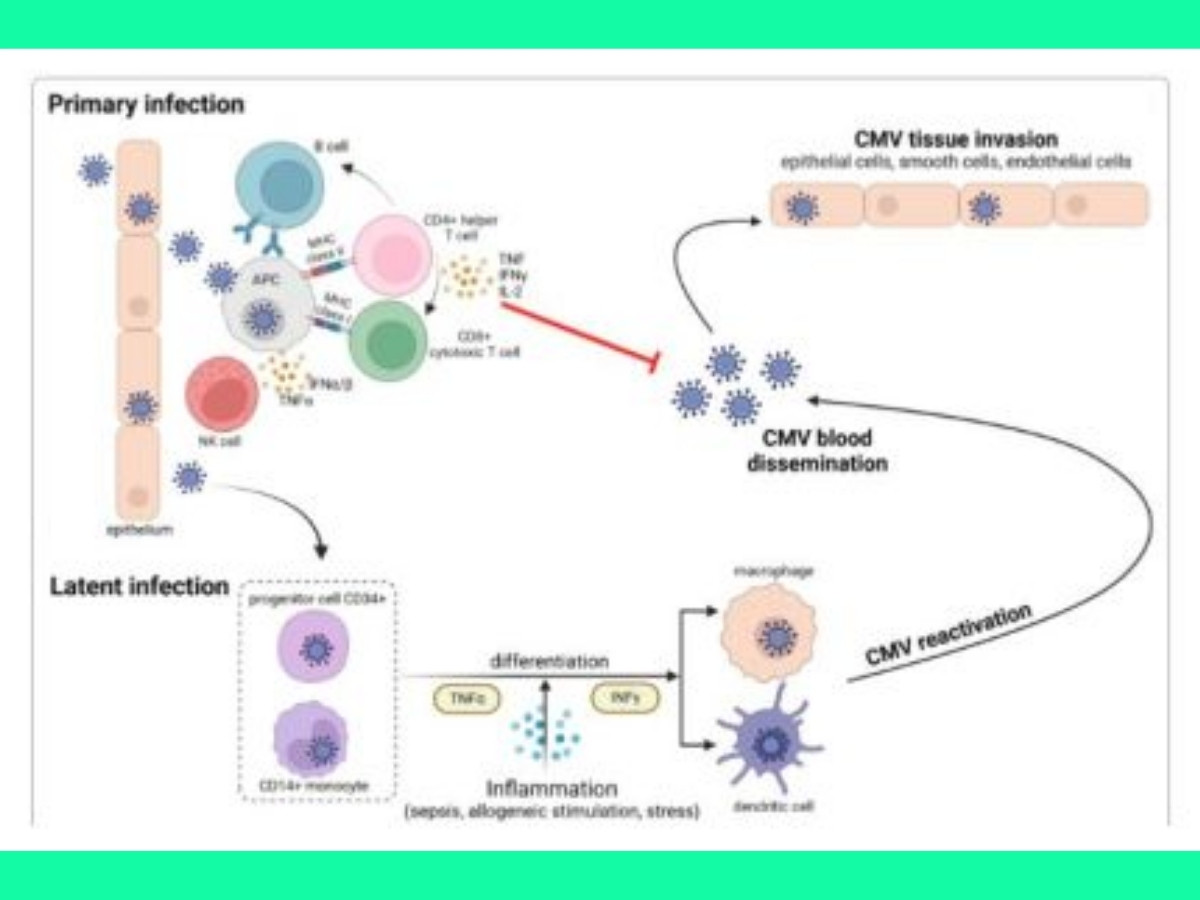
Nhiễm CMV và bệnh CMV ở bệnh nhân nguy kịch bị suy giảm miễn dịch
Tỷ lệ
Tái hoạt động CMV thường gặp hơn và gây hại nhiều hơn ở những bệnh nhân suy giảm miễn dịch từ trước, những người thường gặp phải tình trạng tổn thương cơ quan và bệnh CMV xâm lấn cơ quan đích, có thể là nguyên nhân làm cho bệnh nhân nhập ICU hoặc phát sinh trong quá trình nằm ICU. Tuy nhiên, dữ liệu cụ thể về bệnh nhân nhập ICU với nhiễm CMV và bệnh CMV còn hạn chế, phần lớn dữ liệu lâm sàng và kết quả điều trị hiện nay đều lấy từ môi trường ngoài ICU.
Một nghiên cứu hồi sức tại một trung tâm trên 178 bệnh nhân nguy kịch mắc bệnh ác tính huyết học và có kết quả PCR CMV dương tính trong máu và/hoặc các dịch cơ thể khác nhau trong thời gian nằm ICU cho thấy 44 bệnh nhân (24.7%) phát triển bệnh CMV, trong đó một số trường hợp liên quan đến nhiều cơ quan. Bệnh CMV có mối liên hệ đáng kể với tải lượng virus, ghép tế bào gốc tạo máu và thở máy, trong khi cả tải lượng virus CMV và việc sử dụng thuốc vận mạch đều có liên quan độc lập đến tỷ lệ tử vong tại bệnh viện. Trong một nghiên cứu hồi sức tương tự bao gồm 364 bệnh nhân huyết học nằm ICU, 10.4% trải qua tái hoạt động CMV, với hơn một nửa biểu hiện tổn thương cơ quan. Một nghiên cứu khác báo cáo rằng tái hoạt động CMV trong các mẫu dịch rửa phế quản thường gặp ở bệnh nhân ICU bị viêm phổi cộng đồng nặng và có suy giảm miễn dịch trước đó so với những bệnh nhân có miễn dịch bình thường. Hơn nữa, bệnh ác tính huyết học hoặc ghép tạng đặc trước đó có liên quan độc lập đến tái hoạt động herpesvirus ở bệnh nhân ICU nặng do covid-19. Nhiễm CMV có triệu chứng cũng đã được ghi nhận ở 39.4% bệnh nhân ghép thận trong thời gian nằm ICU.
Một nghiên cứu đa trung tâm gần đây đã xác định viêm phổi do CMV là một dạng bệnh CMV xâm lấn cơ quan đích, thường gặp nhất ở bệnh nhân ICU suy giảm miễn dịch (62%), tiếp theo là bệnh lý đường tiêu hóa (34.6%), với gần 10% bệnh nhân bị tổn thương đa cơ quan. Hai phần ba số bệnh nhân này cần sử dụng thuốc vận mạch và thở máy xâm nhập, với tỷ lệ tử vong lên đến 60%, thay đổi tùy theo nguyên nhân suy giảm miễn dịch và cơ quan bị ảnh hưởng. Mặc dù việc xác định chính xác tác động của CMV tổn thương cơ quan đích lên kết quả lâm sàng là một thách thứ do thường đi kèm với các tình trạng bệnh lý khác, CMV tổn thương cơ quan đích thường phản ánh sự thiếu tụt tế bào T tiềm ẩn, góp phần làm tăng tỷ lệ tử vong trong nhóm bệnh nhân này.
Bệnh lý ác tính huyết học
Ghép tế bào gốc tạo máu (allogenic HSCT) vẫn là một yếu tố nguy cơ chính đối với nhiễm CMV. Mức độ nguy cơ thay đổi tùy theo các yếu tố khác nhau, chẳng hạn như tình trạng huyết thanh học, với nguy cơ thấp nhất ở các cặp người hiến và người nhận đều âm tính, và nguy cơ cao nhất là ở người nhận dương tính, với tỷ lệ nhiễm và mắc bệnh CMV lần lượt tới 35% và 5%. Ghép máu cuống rốn làm tăng nguy cơ nhiễm CMV so với các nguồn tế bào gốc khác, trong khi tỷ lệ mắc bệnh CMV là tương đương giữa người hiến tạng haploidentical và người hiến phù hợp HLA, cũng như không phụ thuộc vào phác đồ điều trị tiền ghép tủy có hoặc không triệt tiêu tủy. Việc sử dụng corticosteroid để điều trị các biến chứng sau HSCT có liên quan đến nguy cơ nhiễm CMV cao nhất.
Các liệu pháp dự phòng và điều trị sớm đã làm giảm tỷ lệ mắc bệnh CMV từ 20% – 30% xuống còn dưới 5% – 10% trong vòng 100 ngày đầu sau ghép. Tuy nhiên, bệnh CMV khởi phát muộn đang ngày càng trở nên thường gặp hơn. Bệnh lý đường tiêu hóa vẫn thường gặp ở giai đoạn sớm, trong khi viêm phổi chiếm ưu thế trong các biểu hiện tổn thương cơ quan ở giai đoạn muộn. Các nghiên cứu tại ICU báo cáo tỷ lệ tái hoạt động CMV ở 7-15% bệnh nhân ghép tế bào gốc tạo máu dị gen (HSCT), với tỷ lệ tử vong cao hơn ở những bệnh nhân có tái hoạt động CMV so với những người không tái hoạt động. Ngoài ra, HSCT đã được xác định là yếu tố nguy cơ độc lập đối với CMV tổn thương cơ quan đích và tỷ lệ tử vong cao ở những bệnh nhân nguy kịch mắc các bệnh ác tính huyết học.
Ở những bệnh nhân ghép tế bào gốc tự thân, tỷ lệ nhiễm CMV tương đương với những người ghép dị gen (30-50% ở bệnh nhân dương tính huyết thanh), mặc dù bệnh CMV vẫn hiếm gặp (< 1%). Một số phương pháp điều trị và việc sử dụng tế bào gốc CD34+ được chọn lọc đã có liên quan đến nguy cơ cao hơn của tái hoạt động CMV có triệu chứng.
Bệnh nhân mắc các bệnh ác tính huyết học nhưng không ghép tế bào gốc cũng có nguy cơ cao nhiễm và mắc bệnh CMV, do tình trạng suy giảm miễn dịch gây ra bởi chính khối u ác tính hoặc bởi các phương pháp điều trị. Thuốc alemtuzumab và các chất ức chế PI3K như idelalisib có liên quan đến nguy cơ cao nhiễm CMV ở bệnh nhân mắc bệnh bạch cầu lympho mạn tính, với tỷ lệ nhiễm lần lượt là 4-29% và 6%. Nhiễm CMV cũng đã được ghi nhận ở bệnh nhân điều trị bằng rituximab, mặc dù thường được dùng phối hợp với các thuốc làm suy giảm tế bào T khác. Bệnh CMV cũng đã được báo cáo trong một số trường hợp bệnh nhân được điều trị bằng liệu pháp CAR-T cell.
Ở bệnh nhân nguy kịch mắc bệnh ác tính huyết học, tỷ lệ tái hoạt động CMV dao động từ 9-13%, nguy nhân suy giảm miễn dịch phổ biến nhất gây viêm phổi CMV và bệnh CMV lan tỏa, đồng thời là nhóm bệnh nhân có tỷ lệ tử vong cao nhất.
Bệnh lý ác tính
Hóa trị ức chế tế bào thường gây suy giảm tế bào lympho và tế bào NK cell, trong khi môi trường vi mô của khối u mang tính ức chế miễn dịch càng làm suy giảm thêm chức năng của miễn dịch tế bào. Mặc dù có những yếu tố này, bệnh CMV vẫn hiếm gặp ở nhóm bệnh nhân này, chiếm dưới 10% số bệnh nhân suy giảm miễn dịch nhập ICU với bệnh CMV xâm lấn cơ quan đích. Tuy nhiên, sự gia tăng tỷ lệ mắc ung thư cùng với việc sử dụng liệu pháp miễn dịch và các liệu pháp điều trị đích có thể làm tăng nguy cơ nhiễm và mắc bệnh CMV trong nhóm đối tượng này.
Bệnh nhân ghép tạng đặc
CMV là một nguy cơ đáng kể sau ghép tạng đặc, đặc biệt là ở những người nhận âm tính huyết thanh từ người hiến dương tính, trong khi người nhận dương tính có nguy cơ trung bình và các cặp người hiến-nhận đều âm tính có nguy cơ thấp nhất. Việc điều trị dự phòng và điều trị tiền triệu chứng đã làm giảm tỷ lệ mắc bệnh CMV xuống còn 10-30% ở nhóm nguy cơ cao và 5-15% ở nhóm nguy cơ trung bình, với sự thay đổi đáng kể tùy theo loại cơ quan được ghép. Tuy nhiên, bệnh CMV khởi phát muộn ngày càng thường gặp hơn, thường xuất hiện 3-6 tháng sau khi kết thúc giai đoạn dự phòng.
Các yếu tố nguy cơ chính ở bệnh nhân ghép tạng đặc bao gồm thải ghép, điều trị làm suy giảm tế bào lympho như alemtuzumab, hoặc sử dụng thuốc ức chế miễn dịch liều cao kéo dài, trong khi các thuốc ức chế mTQR lại có liên quan đến nguy cơ nhiễm CMV thấp hơn.
Ở bệnh nhân ghép thận nhập ICU, tỷ lệ nhiễm CMV có triệu chứng lên đến 39.4% với việc sửdụng thymoglobulin và thời điểm xuất hiện trong vòng 6 tháng đầu sau ghép là những yếu tố nguy cơ chính phát triển bệnh CMV.
Khi bệnh CMV xâm lấn cơ quan đích, mặc dù tổn thương đường tiêu là thường gặp nhất, nhưng ghép tạng đặc là nguyên nhân suy giảm miễn dịch thường gặp thứ hai ở bệnh nhân nguy kịch mắc viêm phổi CMV, và đã có tỷ lệ báo cáo cao (55%) về phân lập CMV từ mẫu dịch hô hấp ở bệnh nhân ghép thận trong ICU có biến chứng nhiễm trùng.
Nhiễm HIV
Bệnh do CMV liên quan đến nhiễm HIV xảy ra ở những bệnh nhân bị suy giảm miễn dịch nặng, đặc biệt là những người có số lượng tế bào T CD4+ ≤ 50/mm³. Trong trường hợp này, tái hoạt động của virus là cơ chế chính. Tỷ lệ mắc bệnh do CMV có tổn thương cơ quan ở người sống chung với HIV đã giảm từ 20% xuống còn 3-5% sau khi điều trị thuốc kháng virus và hiện nay bệnh này rất hiếm gặp ở những bệnh nhân kiểm soát được sự nhân lên của HIV. Tuy nhiên, tại những khu vực có khả năng tiếp cận ART hạn chế, CMV vẫn là nguyên nhân chính gây bệnh tật và tử vong. Việc điều trị bằng corticosteroid, chẳng hạn trong viêm phổi do Pneumocystic, làm tăng nguy cơ tái hoạt động của CMV.
Khoảng 30-35% người sống chung với HIV có số lượng tế bào TCD4 < 100/mm³ có thể phát hiện được DNA CMV trong máu. Các nghiên cứu tại khoa ICU đã báo cáo tỷ lệ thậm chí còn cao hơn và xác định nhiễm CMV là một yếu tố nguy cơ độc lập đối với tử vong trong bệnh viện ở nhóm bệnh nhân này. Tuy nhiên, không khuyến cáo dự phòng thường quy vì sự hồi phục miễn dịch do ART giúp kiểm soát tình trạng có DNA CMV trong máu. Viêm võng mạc là bệnh CMV tổn thương cơ quan đích thường gặp nhất (chiếm 85% các trường hợp), tiếp theo là các bệnh lý đường tiêu hóa. Viêm phổi do CMV hiếm gặp, mặc dù virus này thường được phát hiện trong các mẫu dịch rửa phế quản – phế nang (BAL), thường đi kèm với các vi sinh vật cơ hội khác – những tác nhân có khả năng cao hơn gây ra các triệu chứng hô hấp. Tuy nhiên, xuất huyết phế nang liên quan đến CMV đã được ghi nhận ở những bệnh nhân có số lượng tế bào TCD4+ < 50/mm³.
Có tới một phần ba người sống chung với HIV bị nhiễm CMV có triệu chứng có thể cần nhập khoa ICU chủ yếu do các triệu chứng hô hấp hoặc thần kinh liên quan đến CMV. Trong những trường hợp này, tỷ lệ tử vong có thể lên tới 47%, và việc phải thở máy là một yếu tố nguy cơ độc lập đối với tử vong trong vòng 30 ngày.
Thuốc ức chế miễn dịch
Ở những bệnh nhân mắc các bệnh lý hệ thống, tỷ lệ nhiễm CMV thấp (2%), nhưng tăng mạnh (lên đến 40%) ở những bệnh nhân đang điều trị tấn công (với corticosteroid liều cao hoặc kéo dài [> 0.5 mg/kg/ngày], bao gồm cả methylprednisolone truyền tĩnh mạch liều cao, và/hoặc các thuốc ức chế miễn dịch như cyclophosphamide, mycophenolate và/hoặc azathioprine. Lupus ban đỏ hệ thống là bệnh nền thường gặp nhất, tiếp theo là viêm da cơ và viêm mạch. Một số nghiên cứu tại khoa ICU đã báo cáo về việc phát hiện CMV trong đường hô hấp ở 23% bệnh nhân mắc bệnh lý thấp đang điều trị bằng corticosteroid và bị suy hô hấp cấp; tuy nhiên, sự hiện diện thường gặp của P. jirovecii trong mẫu bệnh phẩm đó khiến việc xác định vai trò gây bệnh của CMV gặp nhiều khó khăn.
Bệnh ruột viêm (IBD), đặc biệt là những người điều trị viêm loét đại tràng không đáp ứng với corticosteroid, có tỷ lệ tái hoạt CMV ở đường tiêu hóa lên đến 35%. Việc phân biệt giữa một đợt bùng phát cấp tính của IBD và viêm đại tràng do CMV có thể là một thách thức. Những bệnh nhân trước đó có hệ miễn dịch bình thường, nhưng được sử dụng corticosteroid (liều cao hoặc truyền tĩnh mạch) hoặc các thuốc ức chế miễn dịch khác trong thời gian dài có thể xuất hiện tình trạng tái hoạt CMV trong thời gian nằm ICU. Tuy nhiên, tỷ lệ mắc CMV tổn thương cơ quan đích ở nhóm bệnh nhân này có thể thấp và tiên lượng thường tốt hơn so với những người mắc bệnh ác tính hoặc đã ghép tạng.
Suy giảm miễn dịch nguyên phát
Bệnh do CMV ảnh hưởng đến những bệnh nhân mắc các dạng suy giảm miễn dịch tiên phát liên quan đến tế bào T, có thể kèm theo hoặc không kèm theo khiếm khuyết tế bào NK, bao gồm nhiều dạng suy giảm miễn dịch kết hợp. Mặc dù hầu hết các trường hợp xảy ra ở trẻ em, một số trường hợp khởi phát ở người lớn với biểu hiện đầu tiên là do bệnh CMV tổn thương cơ quan đích cũng đã được báo cáo. Do đó, những người lớn bị bệnh CMV nặng mà không rõ nguyên nhân, suy giảm miễn dịch nên được khảo sát để phát hiện các dạng suy giảm miễn dịch tiên phát. Dạng suy giảm miễn dịch tiên phát thường gặp nhất ở người lớn là CVID, đặc trưng với sự suy giảm sản xuất globulin miễn dịch. Tuy nhiên, một số bệnh nhân CVID cũng có thể biểu hiện mức độ nào đó của suy giảm miễn dịch tế bào, với tỷ lệ mắc hội chứng CMV hoặc CMV có tổn thương cơ quan đích là 7.6%. Phần lớn bệnh nhân CVID cũng mắc các rối loạn viêm hoặc tự miễn, cần điều trị thuốc ức chế miễn dịch, điều này có thể làm tăng nguy cơ nhiễm hoặc mắc bệnh do CMV.
Biểu hiện bệnh CMV
Viêm phổi CMV
Viêm phổi CMV, còn được gọi là viêm phổi do CMV, là dạng nghiêm trọng nhất của CMV tổn thương cơ quan đích, chủ yếu ảnh hưởng đến bệnh nhân ghép tế bào gốc tạo máu và người nhận ghép phổi. Triệu chứng lâm sàng thường không đặc hiệu, các biểu hiện hình ảnh học thường gặp bao gồm các vùng kính mờ và các nốt nhỏ. Khoảng 50% các trường hợp cần phải nhập khoa ICU, và đây vẫn là dạng CMV tổn thương cơ quan đích thường gặp và nguy hiểm nhất trong môi trường ICU. Khoảng một phần ba số bệnh nhân này cần thở máy xâm nhập khi chẩn đoán, điều này làm tăng nguy cơ tử vong một cách độc lập, với tỷ lệ tử vong lên đến 60% mặc dù đã được điều trị thuốc kháng virus.
Chẩn đoán chủ yếu dựa vào xét nghiệm qPCR, vì CMV thường nhiễm vào tế bào phế nang trong viêm phổi CMV điển hình và cũng có thể ảnh hưởng đến tế bào mô đệm hoặc đại thực bào cư trú. Tuy nhiên, việc chẩn đoán viêm phổi CMV rất phức tạp, vì tải lượng virus CMV dương tính trong dịch rửa phế quản (BAL) có thể phản ánh nhiễm trùng hô hấp mà chưa chắc đã có sự xâm lấn mô. Việc tái hoạt động CMV ở phổi đã được ghi nhận ở 45% bệnh nhân suy giảm miễn dịch mắc viêm phổi cộng đồng nặng nhập ICU. Ở bệnh nhân mắc bệnh lý ác tính huyết học cần thở máy do viêm phổi, tái hoạt động CMV ở phổi xảy ra ở khoảng 11% và có liên quan độc lập đến tử vong tại ICU nếu được phát hiện sớm sau khi đặt nội khí quản, mặc dù chỉ có rất ít trường hợp đáp ứng tiêu chuẩn cho viêm phổi CMV có khả năng xảy ra. Tải lượng DNA CMV cao hơn trong mẫu BAL tương quan với khả năng cao hơn của viêm phổi CMV, mặc dù chưa có ngưỡng chính xác nào được thiết lập. Ở người nhận ghép tế bào gốc tạo máu, tải lượng DNA CMV trong mẫu BAL không liên quan đáng kể đến nhiễm trùng đồng thời. Do đó, việc đánh giá toàn diện bao gồm xác suất trước khi xét nghiệm, các biểu hiện lâm sàng tương ứng, và tải lượng DNA CMV trong BAL là rất cần thiết để chẩn đoán. Việc xác định các thể virus trong tế bào BAL có thể hỗ trợ chẩn đoán, nhưng xét nghiệm này có độ nhạy thấp và không được thực hiện thường quy tại nhiều trung tâm do hạn chế về chuyên môn.
Điều quan trọng là CMV đã được công nhận là nguyên nhân gây viêm phổi liên quan đến thở máy ở bệnh nhân ICU có miễn dịch bình thường khi phải thở máy kéo dài, được xác nhận bằng bằng chứng mô bệnh học. Chẩn đoán này cần được xem xét ở những bệnh nhân có suy giảm miễn dịch mắc phải tại ICU, chẳng hạn như do sử dụng corticosteroid liều cao hoặc kéo dài hoặc các liệu pháp ức chế miễn dịch, những người có biểu hiện lâm sàng phù hợp và tải lượng virus CMV cao trong mẫu dịch rửa phế quản (BAL).
Bệnh lý thần kinh trung ương do CMV
Sự xâm nhập của CMV vào hệ thần kinh trung ương hiếm gặp, chủ yếu ở người nhiễm HIV, với khoảng một nửa số trường hợp phải nhập ICU. Thỉnh thoảng, viêm não do CMV xảy ra ở bệnh nhân suy giảm miễn dịch không phải AIDS trong ICU. Triệu chứng thường gặp nhất là viêm não lan tỏa, đôi khi xuất hiện dưới dạng viêm não thất. Ở người nhận ghép tế bào gốc tạo máu, bệnh lý CNS do CMV thường xuất hiện muộn sau ghép, điển hình ở những người có tái phát CMV trong máu nhiều lần và trải qua nhiều đợt điều trị dự phòng, dẫn đến bệnh CMV kháng trị. Sự xâm nhập của CMV vào tủy sống, biểu hiện dưới dạng viêm tủy cắt ngang hoặc bệnh lý đa rễ dây thần kinh cũng được ghi nhận.
Hình ảnh học chẩn đoán có thể cho thấy tổn thương tăng tín hiệu lan tỏa trên MRI chuỗi T2, trong khi các kết quả dịch não tủy (CSF) thường không đặc hiệu. qPCR để phát hiện DNA của CMV trong dịch não tủy có độ nhạy cao, nhưng có thể xảy ra dương tính giả, với giá trị dự đoán dương tính được báo cáo thấp đến 50%. Kết quả cần được diễn giải cẩn thận, đặc biệt nếu mẫu dịch não tùy bị nhiễm máu ở bệnh nhân có CMV DNA trong máu, hoặc nếu có khả năng các nguyên nhân khác gây bệnh lý thần kinh trung ương. Tỷ lệ tử vong trong bệnh lý thần kinh trung ương do CMV vẫn cao, dao động từ 40% đến 90%.
Bệnh đường tiêu hóa do CMV
Tổn thương đường tiêu hóa là thể thường gặp nhất của bệnh do CMV tổn thương cơ quan đích ở bệnh nhân suy giảm miễn dịch không do ghép phổi và không nhiễm HIV, và là nguyên nhân thường gặp thứ hai của CMV tổn thương cơ quan đích tại khoa ICU. Khoảng một phần ba bệnh nhân mắc bệnh CMV đường tiêu hóa có thể bị ảnh hưởng, với biểu hiện lâm sàng rất đa dạng. Viêm thực quản là dạng thường gặp nhất của bệnh lý đường tiêu hóa trên, có thể dao động từ viêm nhẹ đến loét nặng và nôn ra máu, trong khi viêm đại tràng – dạng chính của bệnh lý đường tiêu hóa dưới thường biểu hiện bằng tiêu chảy. Viêm ruột có thể gây ra các biến chứng nghiêm trọng như xuất huyết, hoặc hiếm gặp hơn là thủng ruột.
Các phát hiện qua nội soi không đặc hiệu và có thể giống hoặc liên quan đến các tình trạng khác như bệnh thải ghép, nhiễm adenovirus hoặc nhiễm Clostridioides difficile. Việc chẩn đoán dựa vào các thay đổi mô bệnh học được xác định qua sinh thiết, mặc dù các bao vùi CMV có thể không xuất hiện lên đến 20% các trường hợp. Hóa mô miễn dịch hoặc lai tại chỗ trên mẫu sinh thiết giúp cải thiện độ nhạy chẩn đoán và hiện được xem là tiêu chuẩn. Mặc dù xét nghiệm qPCR trên mẫu sinh thiết đường tiêu hóa có thể cho kết quả dương tính giả, nhưng tải lượng DNA cao làm tăng khả năng mắc bệnh CMV đường tiêu hóa. Đáng chú ý, có tới một phần ba bệnh nhân bị CMV đường tiêu hóa không có CMV DNA trong máu, ngay cả trong những trường hợp nặng.
Viêm gan do CMV
Viêm gan do CMV chủ yếu xảy ra ở bệnh nhân ghép gan, ảnh hưởng đến khoảng 2-5% các trường hợp, thường là bệnh lý khu trú tại gan. Ở các bệnh nhân suy giảm miễn dịch khác, tổn thương gan thường là một phần của bệnh CMV lan tỏa. Biểu hiện lâm sàng dao động từ tăng nhẹ bilirubin và/hoặc men gan cho đến những trường hợp hiếm gặp khác như suy gan tối cấp; viêm gan ứ mật là bệnh cảnh thường gặp nhất.
Viêm võng mạc CMV
Viêm võng mạc CMV là thể thường gặp nhất của bệnh CMV tổn thương cơ quan đích ở những bệnh nhân nhiễm HIV giai đoạn tiến triển. Ở những bệnh nhân ghép tạng, viêm võng mạc do CMV hiếm gặp và xảy ra đồng thời với tổn thương CMV ở các cơ quan khác trong khoảng 40% các trường hợp. Gần một nửa số ca bệnh không có triệu chứng, viêm võng mạc do CMV đã được xác định ở bệnh nhân ICU bị suy giảm miễn dịch. Do đó, cần tiến hành khám mắt đối với các bệnh nhân ICU có nguy cơ cao bị nhiễm CMV huyết hoặc CMV tổn thương cơ quan đích, đặc biệt khi có triệu chứng về thị giác hoặc ở những bệnh nhân không tỉnh táo.
Ức chế tủy do CMV
CMV có liên quan đến hiện tượng suy tủy thông qua việc nhiễm vào các tế bào tạo máu và tế bào mô đệm, cũng như qua các cơ chế trung gian miễn dịch. Tình trạng giảm tế bào máu do CMV đã được báo áo ở các bệnh nhân nguy kịch mắc bệnh lý huyết học ác tính và có tái hoạt CMV. Tuy nhiên, việc xác định bằng mô bệnh học về sự hiện diện của CMV trong tủy xương là một thách thức, và cần xem xét các nguyên nhân tiềm ẩn khác gây suy tủy – chẳng hạn như độc tính do thuốc, nhiễm trùng huyết, thải ghép, hoặc tái phát bệnh lý huyết học ác tính.
Hội chứng CMV
Hội chứng CMV (Bảng 1) là biểu hiện thường gặp nhất của bệnh do CMV ở bệnh nhân ghép tạng đặc, chiếm đến 40-60% các trường hợp. Tuy nhiên, việc chẩn đoán ở các bệnh nhân nguy kịch gặp nhiều khó khăn, do không thể loại trừ hoàn toàn các nguyên nhân khác gây ra các triêu chứng lâm sàng đi kèm với nhiễm CMV, chẳng hạn như nhiễm trùng huyết hoặc độc tính do thuốc.
Chẩn đoán nhiễm/bệnh CMV
Có nhiều công cụ chẩn đoán hiện có để phát hiện nhiễm và bệnh do CMV. Mặc dù xét nghiệm chuyển đổi huyết thanh từng được sử dụng rộng rãi, nhưng giá trị lâm sàng của nó hiện vẫn chưa rõ ràng, đặc biệt ở các bệnh nhân nguy kịch. Phương pháp qPCR giúp phát hiện DNA của CMV trong máu hoặc các dịch cơ thể khác, đã trở thành phương pháp ưu tiên nhờ tốc độ và độ nhạy cao. Tuy nhiên, việc xác định ngưỡng tải lượng virus để cho thấy nhiễm trùng đang hoạt động và cần điều trị là một thách thức. Một kết quả PCR dương tính đơn lẻ không đủ để khẳng định nhiễm trùng đang hoạt động, do đó việc làm qPCR nhiều lần – theo dõi sự thay đổi tài lượng virus theo thời gian là một phương pháp có giá trị.
Ngoài ra, khả năng mắc bệnh CMV tổn thương cơ quan đích trước khi xét nghiệm và sự hiện diện của các dấu hiệu hoặc triệu chứng lâm sàng gợi ý cũng cần được xem xét khi quyết định điều trị thuốc kháng virus, vì điều trị quá mức có thể gây độc tính hoặc kháng thuốc.
Nuôi cấy virus hiện nay hiếm khi được thực hiện.
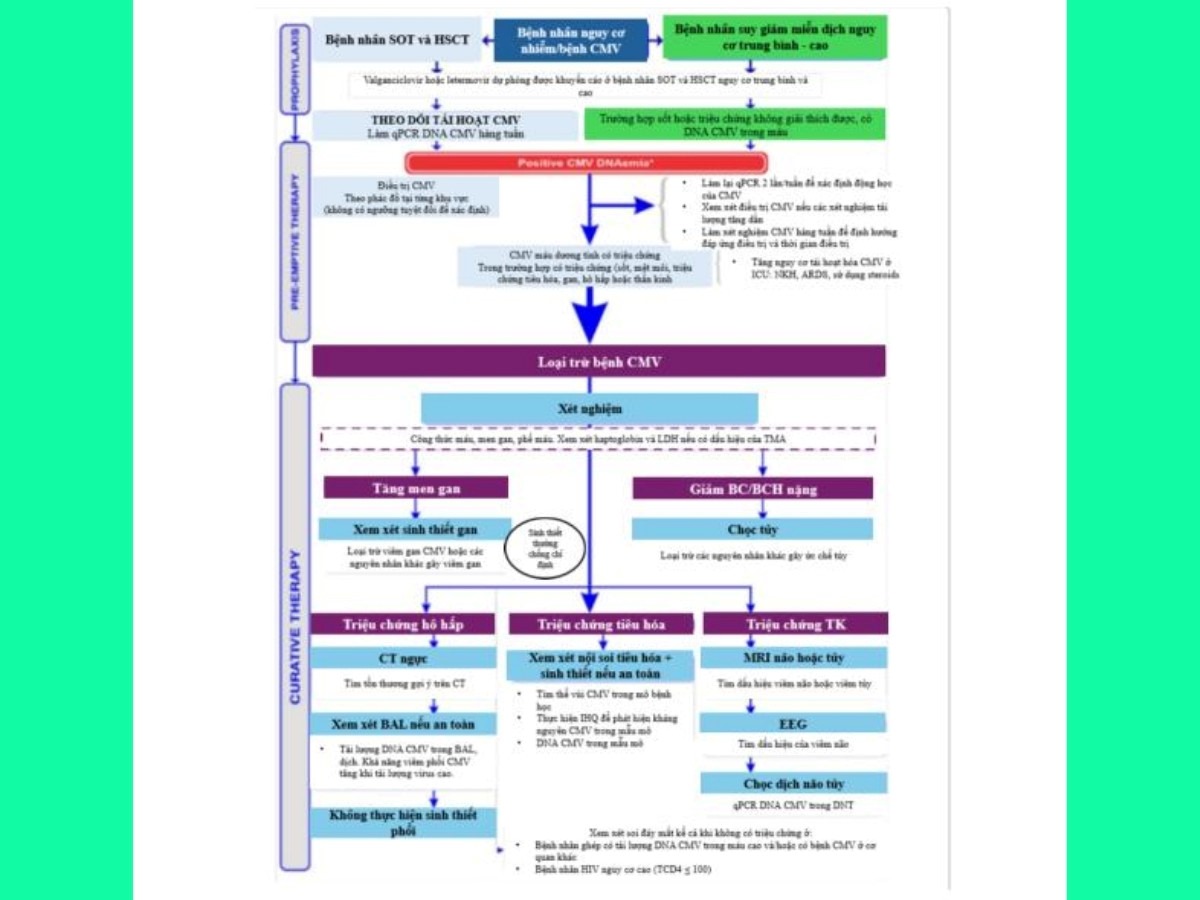
Điều trị và phòng ngừa nhiễm bệnh do CMV ở bệnh nhân suy giảm miễn dịch tại ICU
Điều trị
Việc điều trị nhiễm CMV ở các bệnh nhân nguy kịch bị suy giảm miễn dịch có thể gặp nhiều khó khăn do độc tính tiềm ẩn của thuốc và các bệnh lý đi kèm. Ganciclovir tiêm tĩnh mạch là thuốc kháng virus hàng đầu được sử dụng cho các trường hợp bệnh CMV nặng, trong khi foscarnet và cidofovir là các lựa chọn hàng thứ hai do nguy cơ gây độc thận. Tuy nhiên, foscarnet có thể được cân nhắc là lựa chọn điều trị hàng đầu ở những bệnh nhân bị giảm tế bào máu nghiêm trọng. Đối với các trường hợp bệnh CMV kháng trị, cần đánh giá các yếu tố như tình trạng ức chế miễn dịch quá mức, nồng độ thuốc kháng virus dưới ngưỡng điều trị, hoặc tình trạng kháng ganciclovir.
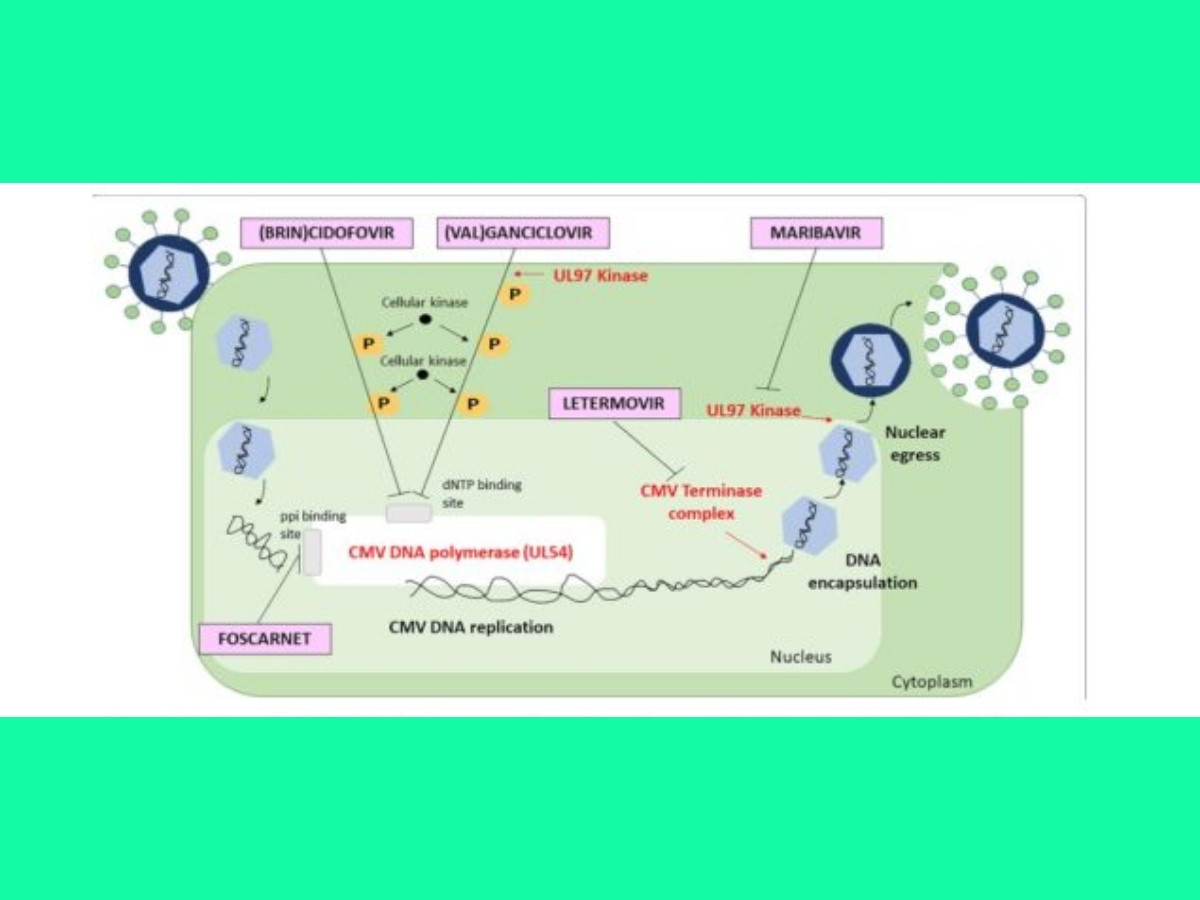
Theo các hướng dẫn hiện hành, foscarnet vẫn là lựa chọn ưu tiên cho các trường hợp nhiễm CMV kháng thuốc, mặc dù maribavir đã cho thấy kết quả đầy hứa hẹn, đặc biệt ở những bệnh nhân suy thận. Trong một thử nghiệm lâm sàng pha 3 gần đây, maribavir đã đạt hiệu quả tốt hơn trong việc làm sạch virus CMV và kiểm soát triệu chứng trong 8 tuần, so với valganciclovir/ganciclovir, foscarnet hoặc cidofovir, với ít tác dụng phụ hơn như tổn thương thận cấp và giảm bạch cầu hạt. Tuy nhiên, maribavir không phù hợp để điều trị viêm võng mạc hoặc viêm não do khả năng ngấm kém vào hệ thần kinh trung ương.
Mặc dù không được khuyến cáo là phương pháp điều trị chính, letermovir đã được sử dụng cho bệnh nhân ghép tạng đặc và ghép tế bào gốc tạo máu không dung nạp hoặc kháng với các thuốc kháng virus khác, với kết quả không đồng nhất. Trong một nghiên cứu quan sát đa trung tâm trên bệnh nhân ghép tạng, letermovir chỉ cho kết quả thuận lợi ở những bệnh nhân có CMV DNA dưới 1000 IU/mL. Do rào cản kháng thuốc thấp và hiệu quả hạn chế ở tải lượng virus cao, letermovir có vẻ phù hợp hơn cho dự phòng sau điều trị nhiễm CMV kháng trị, hơn là sử dụng như điều trị chính.
Thời gian điều trị nên được cá thể hóa dựa trên mức độ cải thiện triệu chứng và mức tải lượng virus, thường kéo dài cho đến khi CMV DNA trong máu không còn phát hiện được hoặc giảm xuống dưới một ngưỡng xác định trước, với thời gian tối thiểu là 2 tuần. Nên xét nghiệm CMV DNA hàng tuần để đánh giá đáp ứng.
Đối với các tình trạng nguy hiểm đến tính mạng như viêm phổi do CMV hoặc bệnh nhân thiếu gammaglobumin máu, có thể cần liệu pháp hỗ trợ bằng immunoglobulin tiêm tĩnh mạch hoặc globulin miễn dịch đặc hiệu với CMV.
Sau khi ngừng điều trị thuốc kháng virus, bệnh nhân cần được theo dõi lâm sàng và xét nghiệm DNA CMV hàng tuần để phát hiện tái phát, đặc biệt ở những bệnh nhân vẫn còn các yếu tố nguy cơ như giảm bạch cầu lympho, đang dùng thuốc ức chế miễn dịch liều cao hoặc phục hồi tế bào T chậm. Việc theo dõi đáp ứng của tế bào T đặc hiệu với CMV cũng có thể giúp đánh giá nguy cơ tái phát.
Tài liệu tham khảo
Fernández S, Castro P, Azoulay E. What intensivists need to know about cytomegalovirus infection in immunocompromised ICU patients. Intensive Care Med. 2025 Jan;51(1):39-61. doi: 10.1007/s00134-024-07737-5. Epub 2025 Jan 7. PMID: 39774866.

