Y tế - Sức Khỏe
TÌM HIỂU VỀ CÁC NHÓM THUỐC CHỐNG ĐÔNG MÁU HIỆN NAY
CÁC THUỐC CHỐNG HUYẾT KHỐI
Lê Bảo Trung
Drugs for the heart
Applied therapeutics- the clinical use of drug 11th 2018
I. Quá trình hình thành huyết khối và sự thuyên tắc
1. Quá trình hình thành huyết khối
Thông thường, các màng nội mô mạch máu nguyên vẹn sẽ đẩy lùi tiểu cầu và ức chế hình thành huyết khối bằng cách tiết ra các chất gây ức chế quá trình này. Khi màng nội mô bị tổn thương (ví dụ như sự bong mảng xơ vữa chẳng hạn) làm cho các chất dưới nội mô tiếp xúc với máu và từ đó kích hoạt quá trình hình thành cục máu đông ngay tại vị trí tổn thương.
Ngay khi có sự tổn thương nội mô mạch máu, các collagen dưới nội mô, phospholipid tiếp xúc với máu và gây kết dính tiểu cầu lên bề mặt tổn thương. Yếu tố Von Willebrand (vWF) đóng vai trò như một cầu nối gây kết dính tiểu cầu lại với nhau thông qua Glycoprotein I (GLP I) trên bề mặt tiểu cầu. Những tiểu cầu bị kết dính trở nên hoạt hóa, thay đổi kích thước, tiết ra nhiều chất như adenosine diphosphate và thromboxan A2. Những chất này lại kích thích sự kết tập tiểu cầu.
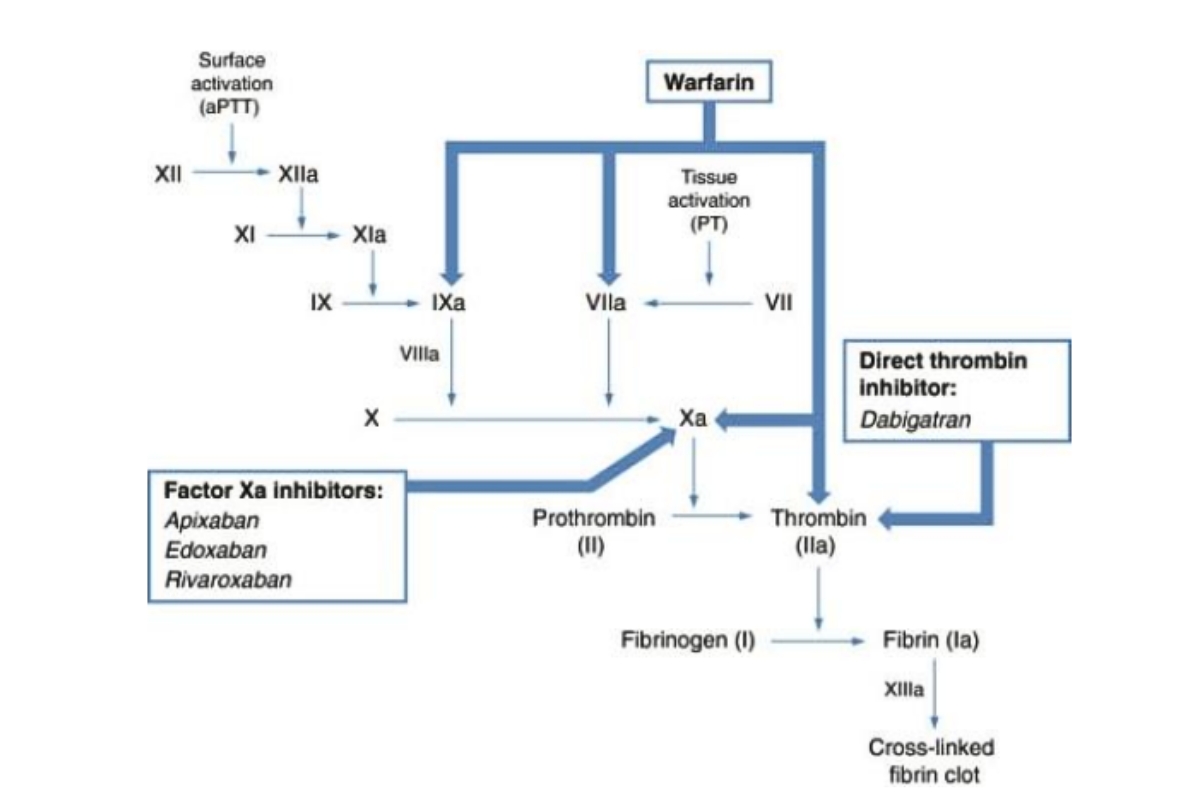
Đồng thời với sự kết tập tiểu cầu, tổn thương nội mô còn gây kích hoạt quá trình đông máu theo con đường ngoại sinh bằng cách tiết ra yếu tố mô (TF- Tissua Factor). Cụ thể con đường tiếp theo được mô tả trong hình 1.2 mà kết quả cuối cùng là đưa tới sự hình thành thrombin. Trong khi đó, con đường đông máu nội sinh cũng được hoạt hóa bởi yếu tố XII tiếp xúc với các thành phần nội mô của mạch máu tổn thương. Quá trình này tiếp diễn bởi sự kích hoạt một loạt các yếu tố và cuối cùng đưa đến sự hình thành thrombin.
Hai con đường đông máu: nội sinh và ngoại sinh giao nhau ở vị trí hoạt hóa yếu tố X thành Xa. Yếu tố Xa chuyển yếu tố II (prothombin thành thrombin). Thrombin chuyển Fibrinogen thành Fibrin. Fibrin đóng vai trò làm cho cục máu đông trở nên vững chắc hơn so với khối kết tập tiểu cầu đơn thuần.
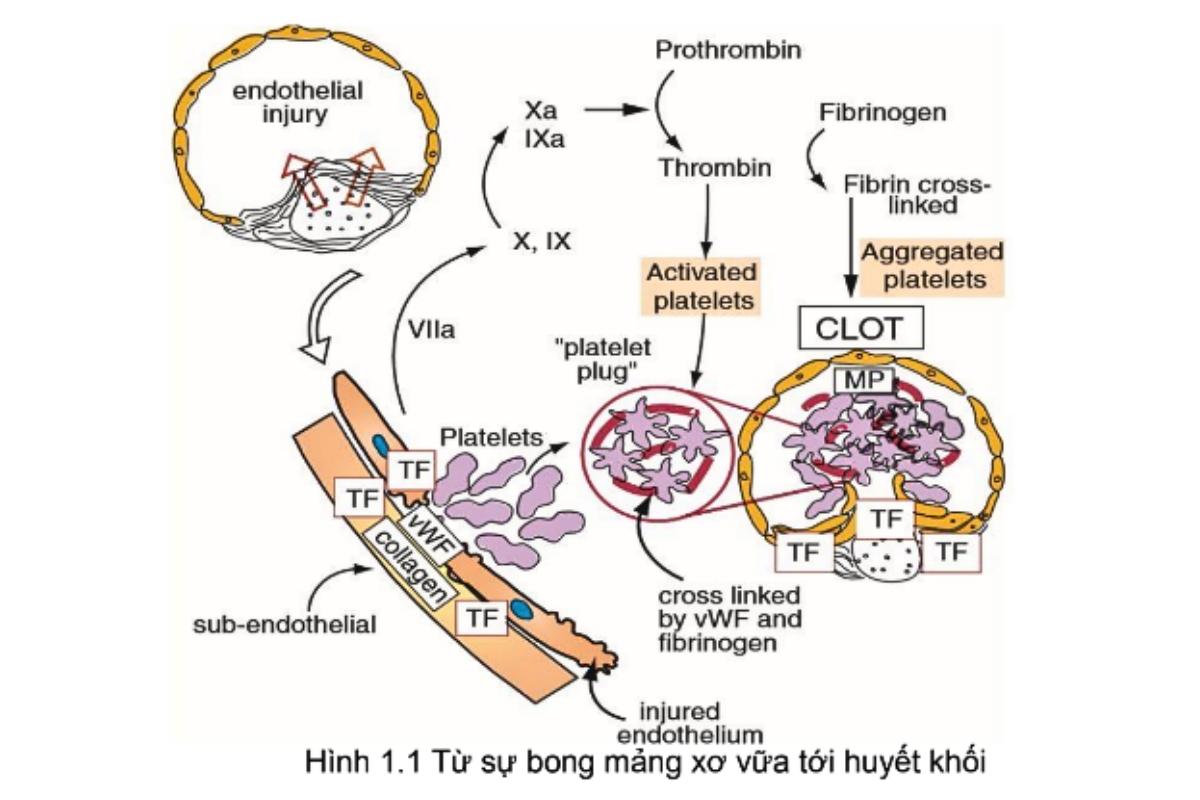
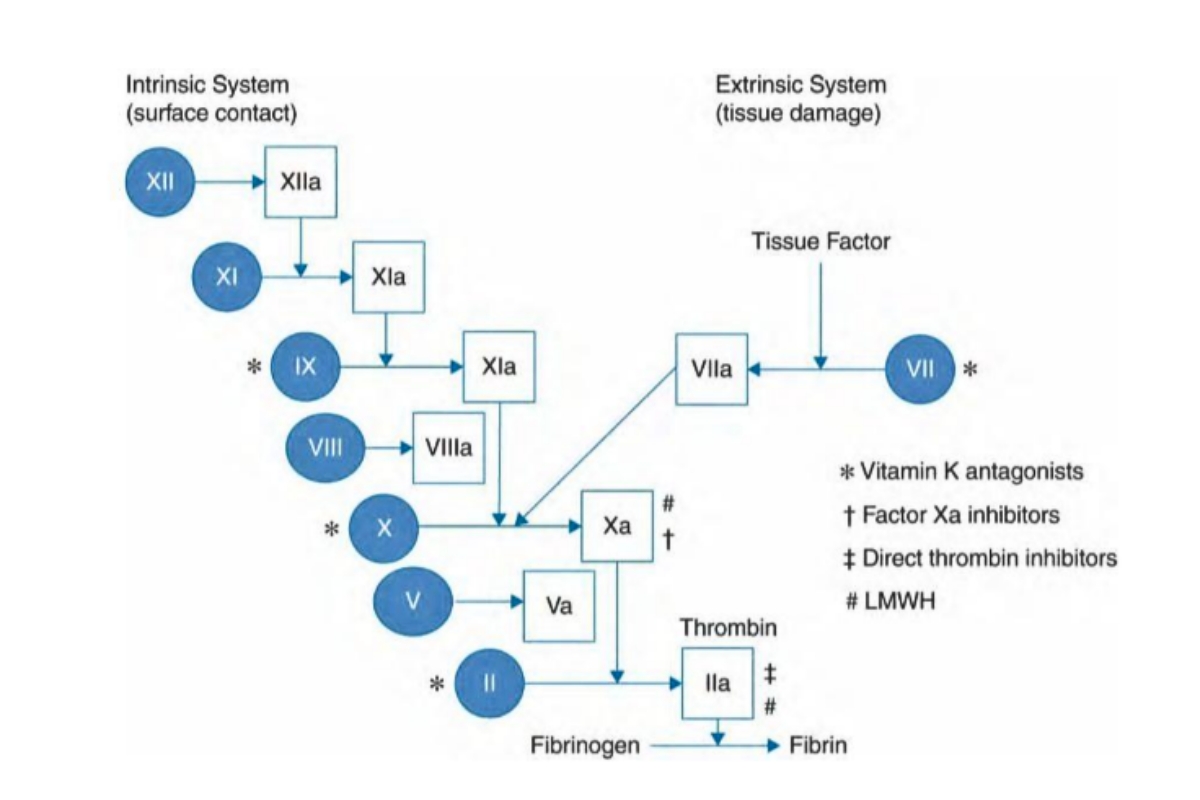
Ta có thể thấy 2 con đường này gặp nhau tại vị trí chuyển yếu tố X thành Xa. Những vị trí đánh dấu * là nơi các thuốc kháng vitamin K tác động vào. Nguyên nhân sẽ được nêu kĩ hơn trong phần nói về thuốc kháng Vitamin K. Tương tự là các dấu hiệu khác đánh dấu các vị trí tác động của các loại thuốc lên con đường đông máu.
Huyết khối thường được phân loại dựa vào vị trí và thành phần của nó. Huyết khối động mạch thường chứa thành phần chủ yếu là tiểu cầu, mặc dù chúng cũng có thành phần fibrin và leukocyte nữa. Huyết khối động mạch hình thành trong điều kiện máu chảy nhanh và hình thành chủ yếu từ sự bong mảng xơ vữa. Trong khi huyết khối tĩnh mạch chủ yếu được tìm thấy trong tuần hoàn tĩnh mạch lại chứa thành phần chủ yếu là hồng cầu và fibrin. Huyết khối tĩnh mạch có phần đầu nhỏ là khối tiểu cầu hình thành khi có sự tổn thương thành tĩnh mạch sau phẫu thuật hoặc chấn thương. Các khu vực ứ đọng, chảy chậm ngăn chặn sự pha loãng các yếu tố đông máu được kích hoạt nên kéo theo là đuôi huyết khối gồm fibrin và hồng cầu. Hiểu được sự khác biệt trong tính chất của huyết khối dẫn tới từng tình trạng thuyên tắc cụ thể sẽ giúp bác sĩ lâm sàng đưa ra chỉ định loại thuốc chống huyết khối có hiệu quả cho bệnh nhân (chẳng hạn như dựa vào tính chất huyết khối tĩnh mạch, ta hiểu rằng aspirin va các thuốc chống kết tập tiểu cầu khác sẽ cho ít hiệu quả lên loại huyết khối chỉ chứa hầu như fibrin và hồng cầu này).
2. Sự thuyên tắc
Bình thường, cục huyết khối sẽ không trôi nổi tự do trong mạch máu mà gắn với thành mạch ở vị trí tổn thương. Luôn có các yếu tố ức chế sự hình thành cục máu đông trong máu để khu trú huyết khối chỉ nằm tại vị trí tổn thương. Những yếu tố này được liệt kê trong bảng 1.1. Cộng với sự tham gia của hệ thống tiêu sợi huyết của cơ thể, hai quá trình này ngăn cản sự đông máu quá mức. Tuy vậy, có những yếu tố bất lợi chẳng hạn như sự thay đổi áp lực dòng máu (vd: huyết áp tâm thu, tâm trương chênh cao) có thể gây ra sự đứt gãy trong cấu trúc huyết khối. Các phần đứt gãy tự do trong máu theo dòng chảy và kẹt lại ở nơi các mạch máu có đường kính nhỏ mà hệ quả là sự tắc mạch.
| Yếu tố ức chế hình thành huyết khối | Mục tiêu |
| Antithrombin | Ức chế IIa, IXa, Xa |
| Protein S | Cofactor nhằm hoạt hóa protein C |
| Protein C | Bất hoạt Va và VIIIa |
| Chất ức chế con đường yếu tố mô (TF) | Ức chế hoạt hóa VIIa |
| Plasminogen | Chuyển hóa thành plasmin |
| Plasmin | Ly giải huyết khối |
Bảng 1.1 Cơ chế hoạt động của các yếu tố ức chế hình thành huyết khối
II. Các thuốc chống huyết khối
Dựa vào cơ chế của các quá trình tham gia vào sự hình thành huyết khối trên. Người ta điều chế ra các loại thuốc đánh vào các vị trí khác nhau của quá trình này. Dưới đây trình bày về cơ chế tác dụng và chỉ định của một số nhóm thuốc thường được sử dụng nhất.
THUỐC CHỐNG KẾT TẬP TIỂU CẦU
I. Vai trò của tiểu cầu trong các bệnh lý tim mạch
Tiểu cầu đóng một vai trò then chốt trong sinh lý bệnh học của AMI nói chung và các bệnh tim mạch nói riêng. Chúng ta biết rằng theo thuyết hình thành huyết khối, khi mảng xơ vữa bị bong ra, các yếu tố mô (TF) sẽ tiếp xúc trực tiếp với máu dẫn tới kích hoạt yếu tố đông máu mà kết quả là tạo ra thrombin. Thrombin kích hoạt, làm thay đổi hình dạng, tăng tập trung, tăng kết dính tiểu cầu tại vị trí tổn thương đồng thời chuyển fibrinogen thành fibrin. Sự kết hợp giữa khối tiểu cầu kết dính và các sợi fibrin bao phủ lên vị trí tổn thương trở thành phần “đầu” của huyết khối, trong khi phần “đuôi” trôi nổi trong mạch máu với thành phần là các sợi fibrin và hồng cầu. ngoài ra tiểu cầu khi hoạt hóa còn tiết ra chất ức chế yếu tố hoạt hóa plasminogen–I (PAI) gây đề kháng với thuốc tiêu sợi huyết, tiết Thromboxan A2(TXA2) gây co mạch. Trên tiểu cầu có rất nhiều loại recepter và từ đó có thể bị kích hoạt, chẳng hạn như recepter gắn với Thromboxan A2(TXA2), thụ thể P2Y12 gắn với Adenosine diphosphate (ADP), recepter GpIIb/IIIa… Từ đây chúng ta đã phát triển nhiều loại thuốc chống kết tập tiểu cầu đánh vào khả năng hoạt hóa tiểu cầu thông qua các recepter này (hình 1.3)
II. Aspirin
1. Tác dụng của Aspirin
Tác dụng của Aspirin là ức chế Cyclooxygenase (COX) (từ đó ức chế sản xuất TXA2 của tiểu cầu). TXA2 như đã biết gây kích hoạt các tiểu cầu khác đồng thời gây co mạch. Tác dụng ức chế COX trên tiểu cầu này là VĨNH VIỄN và KHÔNG THỂ TÁI LẬP LẠI cho tới khi thế hệ tiểu cầu mới được sinh ra mà không chịu tác động của aspirin, kéo dài khoảng 8-10 ngày. Cũng phải lưu ý rằng COX này là COX-1, nên nó ức chế luôn cả sản xuất PGI-2 (yếu tố bao vệ dạ dày). Vì thế aspirin vừa có lợi ích về tim mạch vừa có tác dụng có hại lên dạ dày. Ngoài ra, aspirin tác dụng rất yếu lên COX-2 nên khi sử dụng liều thấp, aspirin vừa có tác dụng ức chế TXA2 mà vẫn cho phép tiết prostacyclin. Aspirin cũng có những tác dụng ngoài tiểu cầu. Nó ức chế hoạt hóa COX ở nội mô mạch máu, từ đó làm giảm sự hình thành của TXA2 và chất ức chế kết tập prostacyclin.
Lưu ý rằng, khác với trên tiểu cầu, COX ở mạch máu sẽ được tái tổng hợp sau vài tiếng đồng hồ. Xuất huyết tiêu hóa cao xuất hiện ở 2/1000 bệnh nhân được điều trị aspirin mỗi năm, đồng thời có tăng nhẹ nguy cơ xuất huyết não. Tuy nhiên, trong dự phòng thứ phát MI, aspirin có hiệu quả gấp 100 lần trong dự phòng các biến cố tim mạch khi so với những nguy cơ chảy máu (mặc dù sự đề kháng aspirin có thể giới hạn con số này). Nguy cơ chảy máu của aspirin liên quan tới liều dùng của nó. Nguy cơ chảy máu tăng gấp đôi khi so sánh giữa liều <100mg/ngày và <200mg/ngày.
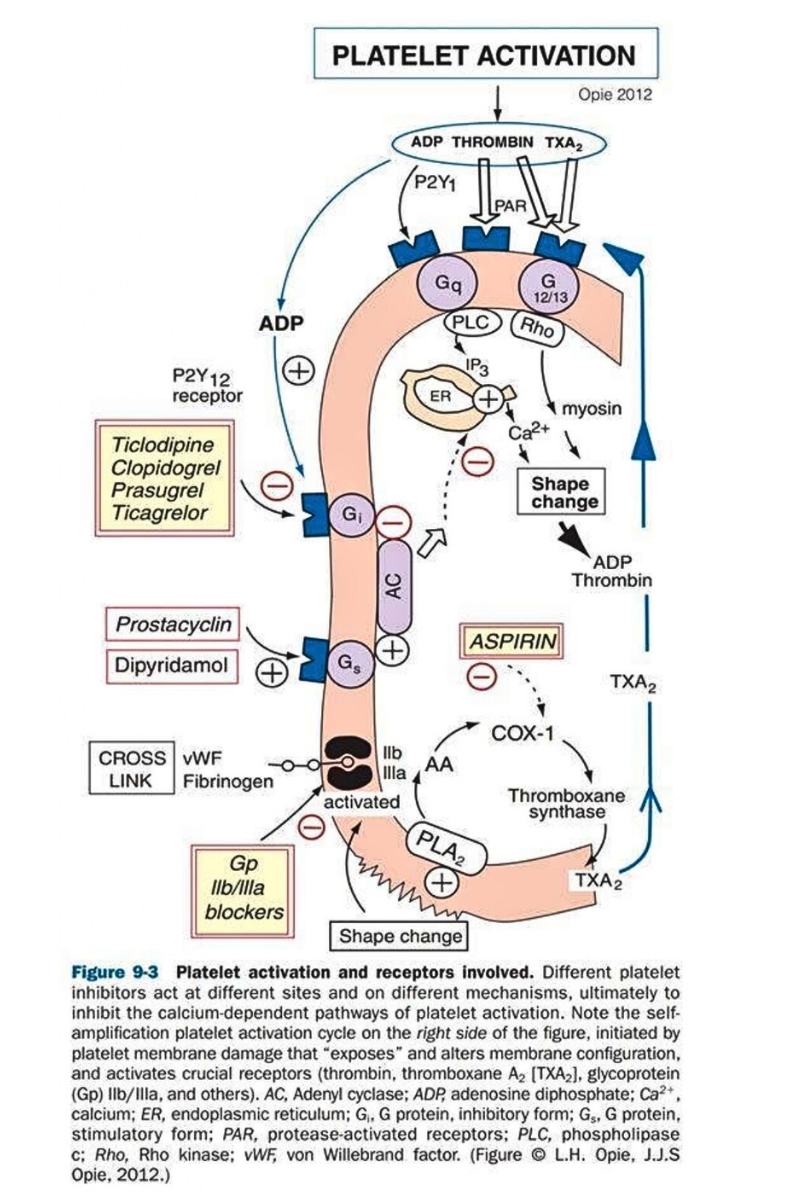
2. Sự thiếu đáp ứng (đề kháng) với Aspirin
Thuật ngữ “đề kháng” thường được sử dụng nhưng định nghĩa còn lỏng lẻo và còn gây tranh cãi. Ở những bệnh nhân có huyết khối động mạch, khoảng 5% đến 20% hoặc hơn có sự tái phát các bệnh lý mạch máu khi theo dõi thời gian dài mặc dù đã được điều trị aspirin với liều đầy đủ. “sự đề kháng” aspirin xuất hiện ở khoảng 16% bệnh nhân prio-MI và liên quan tới tỷ lệ tử vong, tái nhồi máu hoặc tái nhập viện gấp 4 lần trong vòng 12 tháng. Sự đáp ứng thuốc này không phải kiểu “tất cả hoặc không gì cả”. Khi định nghĩa đề kháng aspirin là sự thất bại trong việc ức chế sản xuất thromboxan bằng chứng là có nồng độ cao các sản phẩm chuyển hóa của TXA2 trong nước tiểu, khi này, nguy cơ MI tăng gấp đôi. Nếu định nghĩa dựa vào test chức năng tiểu cầu và khi chứng minh được sự thiếu đáp ứng aspirin thì nguy cơ tử vong, đột quỵ, MI tăng gấp 3 lần.
Có rất nhiều lý do dẫn tới sự thiếu đáp ứng này, chẳng hạn như sự sản xuất TXA2 theo con đường khác mà không cần COX, COX không được ức chế hoàn toàn bởi aspirin, những con đường hoạt hóa tiểu cầu khác mà không cần TXA2. Clopidogerl có thể được xem là một thuốc thay thế hoặc là thêm vào, tuy nhiên những bệnh nhân đề kháng với aspirin cũng có thể giảm đáp ứng với clopidogrel.
3. Sử dụng Aspirin trên lâm sàng
Bởi tiểu cầu đóng một vai trò vô cùng quan trọng trong các bệnh lý mạch máu nên có rất nhiều chỉ định lâm sàng cho aspirin. Một phân tích trên 135.000 bệnh nhân trên 287 nghiên cứu đã xác nhận tác dụng dự phòng của aspirin trên bệnh nhân đã có MI trước đó, trong đau ngực do gắng sức hay đau ngực không ổn định, sau đột quỵ, hoặc sau các phẫu thuật bắc cầu động mạch vành. Các nghiên cứu cũng cho thấy tác dụng tương đương ở cả nam và nữ.
Vấn đề quan trọng là phải cân bằng được các yếu tố lợi ích và nguy cơ. Khi sử dụng aspirin trong dự phòng thứ phát, sự cân bằng nghiêng mạnh về lợi ích trong khi dùng với mục đích dự phòng tiên phát thì cần có sự đánh giá cẩn thận.
Dự phòng thứ phát. Tất cả những bệnh nhân có bệnh lý tim mạch đầu tiên nên được xem xét sử dụng aspirin, nhằm giảm tới 1⁄4 nguy cơ xuất hiện trở lại các biến cố tim mạch sau đó. Ở bệnh nhân đau thắt ngực ổn định đang dùng chẹn beta, aspirin 75mg/ngày làm giảm tỷ lệ AMI hoặc đột tử tới 34% khi so với giả dược, 46% với đau thắt ngực không ổn định, 53% với bệnh nhân nong mạch vành, 25% với bệnh nhân prior MI, 22% ở bệnh nhân TIA hoặc prior stroke, 23% ở bệnh nhân có bệnh động mạch ngoại biên.
Dự phòng tiên phát. Với những khuyến cáo trước đây được hỗ trợ bởi phân tích tổng hợp trên 30.000 đối tượng mà chỉ định aspirin chỉ ở trên nhóm có nguy cơ cao. Trong một thử nghiệm nhỏ nhưng được thiết kế rất tốt trên 1276 bệnh nhân đái tháo đường có bệnh mạch máu ngoại biên được theo dõi trong 8 năm cho thấy aspirin thất bại trong việc dự phòng các biến cố tim mạch bao gồm tử vong do bệnh tim và đột quỵ. Nghiên cứu lớn nhất về aspirin liều thấp (≤300mg) trên 186.425 bệnh nhân từ 2003-2008 với một nhóm không dùng liều thấp aspirin. Sau thời gian theo dõi trung bình là 5.7 năm, với 1,6 triệu người được quan sát. Nhóm sử dụng aspirin có tỉ lệ xuất huyết não là 5.58/1000 trong khi nhóm không dùng aspirin là 3.6/1000. Chú ý, việc tăng sử dụng PPIs làm giảm nguy cơ chảy máu. Vấn đề chính của nghiên cứu trên đó là “liều thấp” trong nghiên cứu lên tận 300mg trong khi chúng tôi khuyến cáo thấp hơn nhiều. Các guideline mới hiện nay không khuyến cáo sử dụng aspirin như một thuốc dự phòng nguy cơ tim mạch trên những bệnh nhân không có bệnh tim mạch trước đó do hiệu quả không rõ ràng mà lại làm tăng nguy cơ chảy máu, nhất là ở bệnh nhân già ngoại trừ dự phòng huyết khối ở những bênh nhân rung nhĩ có nguy cơ thấp (theo thang điểm CHA2DS2-VASc).
Aspirin dự phòng ung thư. Chúng tôi thay đổi quan điểm của mình trước đây rằng việc dùng aspirin dự phòng ở người khỏe mạnh là không cần thiết. Với những nghiên cứu hiện tại, chúng tôi đã tính toán được có một ưu thế vượt trội trong phòng ngừa ung thư đường tiêu hóa khi so với nguy cơ xuất huyết ở những bệnh nhân có nguy cơ tim mạch thấp. Với anh sáng từ phân tích Rothwell gần đây trên 51 thử nghiệm, chúng tôi đồng ý với tác giả của Lancet rằng việc sử dụng aspirin để dự phòng ung thư là rất được khuyến cáo, lợi ích cao hơn nhiều so với nguy cơ. Khi chưa có một phác đồ rõ ràng nào để sử dụng, ta có thể dùng liều thấp 75mg có lẽ là trên những bên nhân sinh trước những năm 50 cho phép cả lợi ích chống và trì hoãn ung thư. Chúng tôi vẫn lo ngại về việc sử dụng aspirin ở bệnh nhân già với chức năng thận giảm, tuy nhiên hiện chưa có dữ liệu gì về việc dùng aspirin ở các mức độ khác nhau của CKD. Trên thực hành lâm sàng, aspirin liều dưới 100mg vẫn được kê ở những bệnh nhân có CKD nặng.
Aspirin chỉ định cho bệnh lý tim mạch. Khi xảy ra sự tiêu fibrin, kể cả do thuốc tiêu sợi huyết hay do hệ thống chống đông của cơ thể, có một nghịch lý là có sự tăng thrombin tại chỗ và tăng kết tập tiểu cầu và có thể gây tái nhồi máu. Vì vậy, trong hội chứng vành cấp, bao gồm cả AMI đã dùng tiêu sợi huyết hay PCI tiên phát, đau thắt ngực không ổn định, aspirin nên được dùng cả trong pha cấp lẫn sau đó, và nó là một phần của của liệu pháp 3 thuốc chống kết tập tiểu cầu. Liều nạp của Aspirin là 162-325mg/ngày và 81-325 mg/ngày trong các ngày sau đó. Các nghiên cứu rộng so sánh liều hàng ngày 300-325mg/ngày với 75- 100mg/ngày cho thấy không có sự khác biệt trên nguy cơ chảy máu và kết cục. Aspirin với tác dụng chống viêm. Mặc dù thang điểm Framingham là một hướng dẫn rất tốt nhưng nó lại không xem yếu tố viêm có vai trò trong thúc đẩy bệnh mạch máu. Chúng ta có thể xem xét sử dụng aspirin ở những bệnh nhân có C-reactive protein cao để dự phòng tiên phát. Tuy nhiên, lợi ích của việc này vẫn cần được chứng minh thêm.
Những chỉ định khác.
(1) Bệnh động mạch ngoại biên (PAD). Các nghiên cứu hiện tại đã chứng minh hiệu quả giảm tỉ lệ bệnh tật và tử vong của aspirin trên bệnh nhân PAD. Mặc dù aspirin không đẩy lùi tình trạng xơ vữa nhưng lại có vai trò ức chế tiểu cầu nhằm hạn chế huyết khối gây ra từ sự bong mảng xơ vữa. Aspirin được khuyến cáo với liều 75-162 mg/ngày ở bệnh nhân PAD.
(2)Sau phẫu thuật bắc cầu động mạch vành, aspirin nên được dùng trong vòng 48 giờ sau phẫu thuật, giúp giảm tỷ lệ tử vong xuống 2/3 và tiếp tục dùng vô thời hạn.
(3) Dự phòng đột quỵ não ở bệnh nhân rung nhĩ, khi wafarin chống chỉ định hoặc điểm CHADS-VASc nhỏ hơn 2.
(4) với bệnh nhân có shunt động tĩnh mạch, aspirin làm giảm nguy cơ huyết khối.
(5) dự phòng đột quỵ ở bệnh nhân hẹp động mạch não, liều cao aspirin (325-1300mg/ngày) tốt hơn wafarin.
(6) Trong pha cấp điều trị TIAs hoặc đột quỵ nhỏ, aspirin là một phần của liệu pháp toàn diện (với clopidogel, statin, hạ áp, chống đông nếu có chỉ định).
Aspirin liều thấp và hiệu quả của nó. Về mặt lý thuyết, liệu pháp này có thể đảm bảo tác dụng đồng thời giảm nguy cơ xuất huyết tiêu hóa. Các nghiên cứu gợi ý khoảng liều là 75-150mg/ngày. Các nghiên cứu trên non-STEMI cho thấy liều tối ưu là 75-100mg. Liều 80mg/ngày đã đủ để ức chế hoàn toàn tác dụng của COX. Liều 30mg/ngày cho thấy có hiệu quả dự phòng TIAs tốt hơn so với liều cao hơn nhưng những enpoint khác thì chưa được đánh giá. Cần sử dụng aspirin với liều cao hơn (160mg) ngay khi khởi phát AMI hay đau thắt ngực không ổn định.
Chống chỉ định của aspirin. Không dụng nạp, xuất huyết tiêu hóa, loét dạ dày, hoặc các nguy cơ chảy máu khác tới từ đường tiêu hóa hoặc đường tiết niệu- sinh dục. Hemophilia không có chống chỉ định tuyệt đối. Cần theo dõi uric acid, creatinin (do aspirin làm chậm đào thải). Những chống chỉ định khác: gout, thiếu máu thiếu sắt, táo bón, xung quanh phẫu thuật. Lưu ý, Aspirin cùng với những loại thuốc NSAIDs khác có thể gây khởi phát cơn hen cấp trên bệnh nhân tiền căn hen phế quản.
Tương tác thuốc. Kết hợp với wafarin làm tăng nguy cơ chảy máu, đặc biệt với aspirin liều cao. Những thuốc tác dụng lên COX-1 khi dùng kèm làm giảm tác dụng tim mạch của aspirin. Aspirin và ACEi có thể có tác dụng đối ngược lên huyết động học ở thận, do aspirin thì ức chế còn ACEi lại thúc đẩy sản xuất các PGs giãn mạch. Tuy vậy khi sử dụng ACEi kéo dài ở bệnh nhân suy tim, sau nhồi máu cơ tim, hoặc dự phòng nguy cơ cao thì nó vẫn giữ lợi ích khi dùng kèm aspirin.
Điều trị xuất huyết tiêu hóa do aspirin. ở những bệnh nhân có loét đã lành, aspirin + PPI làm giảm nguy cơ tái xuất huyết hơn là đổi sang clopidogrel. Có thể dùng clopidogrel từ đầu để tránh hoặc giảm bớt tỉ lệ xuất huyết tiêu hóa do aspirin hay không? Các bằng chứng không trực tiếp cho thấy rằng gần 1000 bệnh nhân phải được điều trị trong 1 năm với clopidogrel thay cho aspirin để tránh nguy cơ chảy máu thì số tiền phải bỏ ra thêm là 1 triệu đô la.
III. Clopidogel
Clopidogrel là một thuốc được chỉ định rộng rãi với vai trò chống kết tập tiểu cầu nhờ khả năng ức chế receptor P2Y12 (một thụ thể khác trên bề mặt tiểu cầu) (hình 1.2). Clopidogrel an toàn hơn đáng kể khi so với Ticagrelor với tỷ lệ độc với tủy xương thấp (0.8%). Không có nghiên cứu nào đánh giá nguy cơ xuất huyết tiêu hóa của clopidogrel nhưng nó đã được chứng minh là thấp hơn so với aspirin. Clopidogrel làm giảm nguy cơ biến cố tim mạch đồng thời lại có khả năng dung nạp cao hơn Ticagrelor (Ít chảy máu đường tiêu hóa và ít tác dụng phụ hơn). Cũng như aspirin, có sự đề kháng với clopidogrel.
1. Tính chất dược lý
Clopidogrel là dạng thuốc tiền chất và đòi hỏi phải được oxy hóa ở gan hoặc bởi isoenzymes cytochrome CYP3A4 and 2C19 đường tiêu hóa. Clopidogrel khởi phát tác dụng lên tiểu cầu chỉ sau vài giờ với liều duy nhất nhưng cần 3-7 ngày để đạt khả năng ức chế ổn định. Trước khi thực hiện PCI, sử dụng clopidogrel liều nạp 600mg đường uống nhằm đạt khả năng ức chế tiểu cầu chỉ sau 2 giờ khi so với 24-48 giờ khi dùng liều 300mg. Cả 2 liều đều đạt khả năng ức chế tiểu cầu cao hơn Ticlopidine.
Dược động học Clopidogrel không tuyến tính và thay đổi nhiều, có sự giảm thanh thải đáng kể khi sử dụng liều lặp lại.
Khi ngừng thuốc, cần khoảng 5 ngày để thế hệ tiểu cầu mới sinh ra và làm giảm sự chảy máu. Vì thế, tạm ngừng 5 ngày được khuyến cáo trước phẫu thuật bắc cầu động mạch vành.Không cần chỉnh liều ở người già và bệnh nhân rối loạn chức năng thận.
2. Tác dụng phụ
Giảm bạch cầu trung tính (0.02% so với 2.4% của ticlopidine). Làm tăng nguy cơ chảy máu nhưng không làm tăng nguy cơ xuất huyết não. Chống chỉ định khi có chảy máu đang tiến triển.
3. Test gene
Clopidogrel là một tiền chất đòi hỏi phải kích hoạt chuyển hóa bằng cytochrome P450 gan. Các alen CYP2C19 * 2 là một biến thể di truyền phổ biến và có liên quan tới sự tăng tỷ lệ các biến cố thiếu máu cục bộ và huyết khối stent sau PCI. Các biến thể di truyền này và một số khác được phát hiện trong gần 30% số cá thể Tây u và khoảng 40% của những người châu Á và người da đen. Prasugrel hoặc Ticargrelor có thể dùng để thay thế trong trường hợp này.
4. Tương tác thuốc
Mặc dù có những lo ngại khả năng cạnh tranh làm giảm tác dụng của clopidogrel bởi omeprazole hay atorvastatin nhưng chưa có nghiên cứu lâm sàng nào so sánh với giả dược để đánh giá.
5. Những thuốc ức chế P2Y12 khác so với clopidogrel
Trong các thuốc chẹn P2Y12, ticagrelor có một số ưu điểm so với prasugrel (đòi hỏi phải hoạt hóa ở gan, do đó ticagrelor tránh được vấn đề ảnh hưởng của các biến thể di truyền gan không phát sinh) (hình 1.3). Trong trường hợp chảy máu quá mức, ticagrelor có thể dễ dàng đảo ngược hơn với thời gian tác dụng ngắn hơn (3-4 ngày) so với (5-10 ngày) đối với prasugrel. Hơn nữa, ticagrelor có dữ liệu thử nghiệm mạnh với khả năng giảm tỉ lệ tử vong trong ACS trong thư nghiệm PLATO. Prasugrel cho phép ức chế tiểu cầu hiệu quả hơn so với clopidogrel ở những bệnh nhân có tiểu cầu còn lại phản ứng cao, nhưng không có thay đổi gì về kết cục.
6. Chỉ định, liều và cách dùng
Clopidogrel được chỉ định trong:
(1) Giảm các biến cố tim mạch do xơ vữa ở bệnh nhân có tiền sử đột quỵ mới, MI mới, bệnh động mạch ngoại biên.
(2) ACS dù PCI hay không hoặc phẫu thuật bắc cầu động mạch vành. Liều
nạp 600mg là được khuyến cáo hơn cả. Có thể dùng liều nạp 300mg ở bệnh nhân dùng tiêu sợi huyết (hoặc ở bệnh nhân PCI sau khi dùng tiêu sợi huyết mà nhỏ hơn 24 giờ). xem xét không dùng liều nạp ở người già trên 75 tuổi. Liều duy trì là 75mg/ngày trong ít nhất 12 tháng để dự phòng huyết khối do stent vành phủ thuốc (DES), tất nhiên là dùng cùng với aspirin.
Nên duy trì bao lâu sau PCI? Các tiêu chuẩn hiện tại khuyến cáo duy trì ít nhất 1 năm cho DES và 1 tháng cho loại không phủ thuốc. Một nghiên cứu quan sát thấy rằng có sự tăng các biến cố tim mạch bất lợi sau trung bình 278 ngày dừng thuốc.
(3) Clopidogrel thường được dùng thay thế aspirin ở PAD bởi tính an toàn của nó. Tuy nhiên hiệu quả của nó trên bệnh nhân PAD thì vẫn chưa được nghiên cứu. trong một nghiên cứu so sánh với aspirin. Clopidogrel liều 75 mg/ngày cho thấy làm giảm nguy cơ tim mạch 25% so với aspirin. Nó cho hiệu quả rõ ràng nhất ở nhóm bn có PAD. Vì vậy có thể clopidogrel thực sự thích hợp cho bệnh nhân PAD mặc dù vẫn cần thêm các nghiên cứu mới trong tương lai.
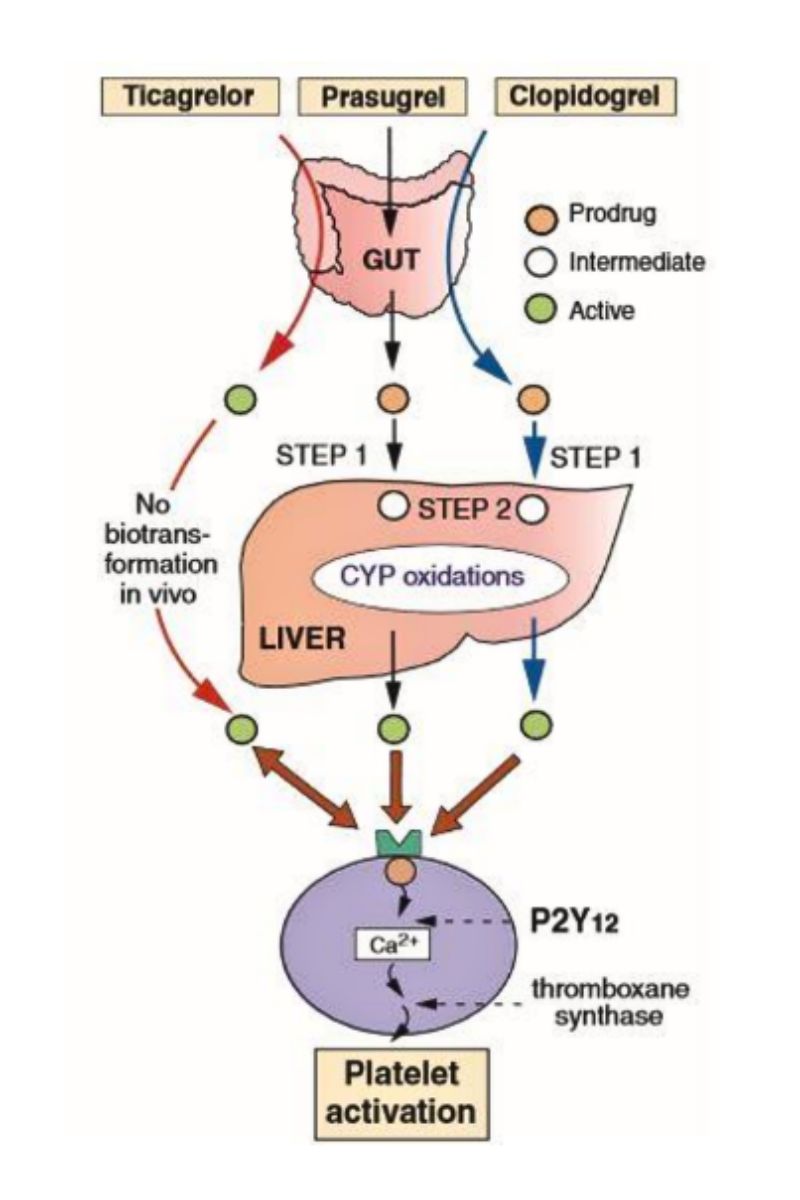
IV. Liệu pháp chống kết tập tiểu cầu kép
1. Aspirin-Clopidogrel.
Có thể thấy aspirin và clopidogrel tác động vào các vị trí khác nhau trên tiểu cầu, vì thế liệu pháp kết hợp có thể cho hiệu quả cao hơn trên bệnh nhân nguy cơ cao. Các dữ liệu nghiên cứu cho thấy lợi ích của liệu pháp kháng tiểu cầu kép trong tình trạng tổn thương mạch vành cấp tính, khi thực hiện các quy trình can thiệp vành, đặt stent.
Trong một thử nghiệm OASIS-7 trên 17.263 bệnh nhân được can thiệp PCI được dùng liệu pháp kháng kết tập tiểu cầu kép với liều Clopidogrel gấp đôi trong 7 ngày (600mg liều nạp và 150mg/ngày) làm giảm biến cố tim mạch và huyết khối stent sau 30 ngày so với nhóm dùng liều clopidogrel thấp ( nạp 300mg và duy trì 75mg/ngày).Liệu pháp kháng kết tập tiểu cầu kép làm giảm 27% nguy cơ tử vong, MI và đột quỵ sau 1 năm.
Liệu pháp chống kết tập tiểu cầu kép ko cho thấy hiệu quả gì hơn so vs aspirin đơn độc ở bệnh nhân PAD nên hiện tại clopidogel chỉ được xem như là 1 thuốc thay thế aspirin chứ ko khuyên dùng kết hợp.
2.Sử dụng trong rung nhĩ có nguy cơ đột quỵ cao
Hiện nay tối ưu nhất vẫn là những thuốc ức chế thrombin trực tiếp mới hoặc các thuốc ức chế yếu tố Xa. Với những bệnh nhân có TIAs trước đó hoặc đột quỵ nhỏ, thử nghiệm cho thấy liệu pháp kháng kết tập tiểu cầu kép làm tăng nguy cơ chảy máu mà không cho thấy sự cải thiện kết cục. Vì thế ở những trường hợp này nếu cần chỉ nên dùng 1 loại kháng kết tập tiểu cầu (aspirin là ưu tiên).
V. Các loại thuốc chống kết tập tiểu cầu mới: Prasugrel, Ticagrelor
Prasugrel
Prasugel là loại thuốc mới thuộc nhóm thienopyridine (thế hệ đầu tiên là ticlopidine, thế hệ thứ 2 là clopidogrel) với tác dụng ức chế không hồi phục và không cạnh tranh thụ thể P2Y12 tại cùng vị trí với clopidogrel. Prasugrel là tiền chất và không thể phát hiện trong huyết tương nếu dùng đường uống. Nó nhanh chóng được oxy hóa ở ruột và chuyển hóa ở gan thành dạng hoạt động. Prasugel có khả năng ức chế kết tập tiểu cầu mạnh gấp 9 lần so với clopidogrel 600mg với thời gian khởi phát tác dụng trong vòng 1 giờ.
Một thử nghiệm so sánh Prasugrel (60mg liều nạp và 10mg/ngày liều duy trì) và clopidogel (300mg nạp và 75mg/ngày duy trì) ở bệnh nhân PCI sau 6-15 tháng cho thấy prasugrel làm giảm kết cục tử vong do tim mạch, MI, đột quỵ từ 12% xuống 9%, giảm tỉ lệ huyết khối stent từ 2.4%-1.1%.
FDA đã cảnh báo tác dụng phụ gây chảy máu nghiêm trọng của prasugrel. Điều này có thể khắc phục bằng cách dừng sử dụng prasugrel và thay thế nó bằng một loại khác, đặc biệt là trong một vài tuần đầu tiên sau STEMI. Đã có bằng chứng cho thấy việc chuyển sang clopidogrel (trong liệu pháp kháng kết tập tiểu cầu kép với aspirin) sau 7 ngày đầu dùng prasugrel vẫn giữ được hiệu quả chống huyết khối mà lại giảm nguy cơ xuất huyết so với nhóm chứng dùng cố định prasugrel. Bệnh nhân dưới 60kg, hay có tiền sử đột quỵ, TIAs thì nên tránh sử dụng prasugrel.
Ticagrelor
Ticagrelor thuộc về một phân nhóm mới, cyclopentyl- triazolopyrimidine. Nó có tác dụng ức chế không cạnh tranh recepter P2Y12 với thời gian bán thải khoảng 12 giờ. Giống Prasugrel, Ticagrelor có thời gian khởi phát và tác dụng kéo dài hơn clopidogrel nhưng khi ngừng thuốc thì thời gian để tiểu cầu hồi phục lại nhanh hơn. Ngoài ra, nó không cần hoạt hóa ở gan.
Ticagrelor cũng cho thấy hiệu quả trong các thử nghiệm trên bệnh nhân STEMI được PCI tiên phát với liều nạp 180 mg và 90mg/ngày liều duy trì khi so sánh với clopidogrel. Khuyến cáo xuống thang xuống clopidogrel tương tự prasugrel ở bệnh nhân có nguy cơ chảy máu cao.
Tác dụng phụ của Ticagrelor là tăng tỷ lệ chảy máu không liên quan tới bắc cầu động mạch vành tăng acid uric không triệu chứng, ngưng thất (khoảng 3 giây hoặc hơn tăng lên, ngừng nút xoang cũng có thể gặp, vì thế phải cẩn thận ở bệnh nhân bệnh lý nút xoang tiến triển, block AV 2-3), khó thở (khó thở khá phổ biến, lên tới 14% ở giai đoạn bắt đầu điều trị nhưng thường chỉ là tạm thời và không đáng ngại tới mức phải dừng điều trị). Cơ chế của khó thở và ngừng thất chưa được hiểu rõ.
Không sử dụng ticagrelor liều trên 100mg/ngày khi kết hợp với Aspirin do làm giảm tác dụng của liệu pháp (thử nghiệm chỉ trên người Nam Mĩ).
Hiện tại các khuyến cáo ko dùng tircagrelor cho nhóm bn PAD để làm giảm biến cố tim mạch kể cả đơn độc hay kết hợp vì chưa cho thấy hiệu quả nào từ nhóm này (aspirin là ưu tiên).
WARFARIN
Warfarin (Coumarin, Coumadin, Panwarfin) là loại thuốc chống đông đường uống được sử dụng phổ biến nhất. Warfarin cũng có ít tác dụng phụ ngoại trừ biến chứng do chống đông quá mức là chảy máu, có thể gây xuất huyết não nghiêm trọng. Sự chuyển hóa của warfarin cũng bị ảnh hưởng bởi nhiều loại thuốc khác.
I. Cơ chế tác dụng
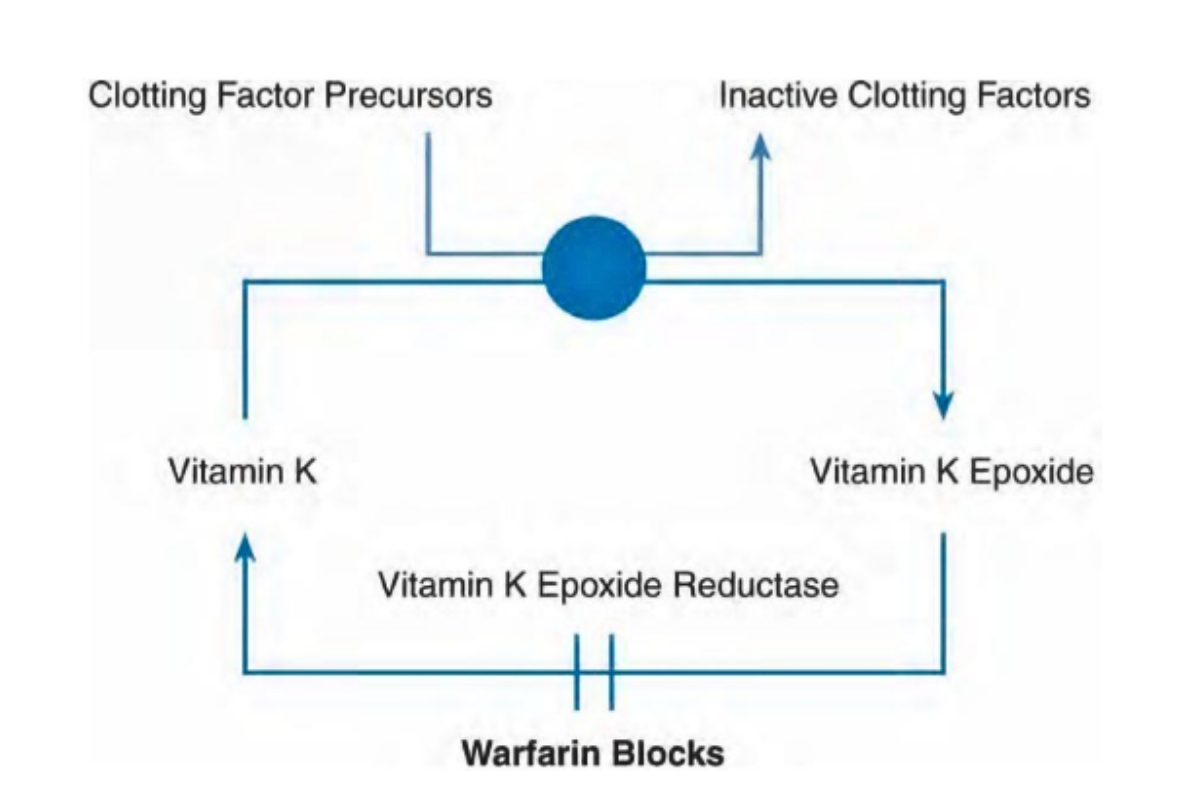
Vitamin K đóng vai trò là cofactor cần thiết cho sự xúc tác chuyển các yếu tố đông máu II, VII, IX, X ở dạng tiền chất thành dạng hoạt động ở gan. Vitamin K sau khi tham gia vào quá trình chuyển đổi của các yếu tố đông máu thì trở thành dạng vitamin K epoxide (không hoạt động). Ở người bình thường, vitamin K epoxide có thể chuyển về dạng vitamin K dạng hoạt động. Warfarin tác dụng bằng cách ngăn cản vitamin K ở dạng không hoạt động thành dạng hoạt động nhờ đó làm giảm lượng các chất chống đông phụ thuộc vitamin K. Bởi các yếu tố đông máu còn lại có thời gian bán thải là 8-60 giờ nên phải sau thời gian này, warfarin mới có tác dụng mạnh nhất (khoảng 2- 7 ngày). Đồng thời cũng phải mất một thời gian sau khi ngừng thuốc hay tiêm vitamin K thì khả năng đông máu mới trở lại do phải mất thời gian tổng hợp yếu tố đông máu mới.
II. Dược động học
Warfarin được hấp thu rất nhanh và hoàn toàn ở đường tiêu hóa trên nhờ cơ chế khuếch tán thụ động. Sinh khả dụng gần 100%. 99% warfarin đường uống gắn với protein trong huyết tương với thời gian bán thải là 37 giờ. Thể tích phân phối của warfarin là khoảng 12.5% trọng lượng cơ thể. Lượng phân phối nhỏ này phù hợp với sự gắn kết rộng rãi của warfarin với albumin. Warfarin bị chuyển hóa ở gan thành dạng không hoạt động rồi đào thải qua phân và nước tiểu.
III. Vấn đề giá thành
Do tầm quan trọng của câu hỏi: “khi nào thì sử dụng warfarin hay các thuốc chống đông thế hệ mới ở bệnh nhân rung nhĩ không có van nhân tạo?” Một trong những yếu tố quyết định đó là giá thành của chúng. Dabigatran (một NOAC) giúp nâng cao chất lượng sống trung bình 4.7 năm so với 3.9 năm của warfarin. Dabigatran nâng cao chất lượng sống thêm 0.36 năm so với warfarin với giá 9000 đô la. Nâng tổng chi phí lên khoảng 25000 đô la.
IV. Liều dùng
Quy trình khởi đầu chuẩn là dùng warfarin 5mg/ngày trong vòng 5 ngày đầu, check INR hàng ngày cho tới khi đạt ngường mục tiêu. Sau đó check lại mỗi 3 lần mỗi tuần. Liều khởi đầu thấp hơn nên được áp dụng cho bệnh nhân già và những người có nguy cơ cao xuất huyết (bao gồm cả sử dụng aspirin trước đó). Yếu tố gen khác biệt là lý do mà người châu Á cần một liều thấp hơn và liều cao hơn ở người da đen. Trong vấn đề chuyển loại thuốc, Warfarin nên được dùng ít nhất 4 ngày trước khi ngừng heparin. Do warfarin cần thời gian để chỉnh liều và đạt tác dụng, cần phải gối heparin trước để đảm bảo chống huyết khối. Có thể ngừng heparin sau khi đã đạt mục tiêu INR 2 ngày. Không sử dụng một liều cao ban đầu vì có thể gây tăng INR cao quá mức. Bệnh nhân có bệnh lý gan hoặc suy tim cần được sử dụng với liều thấp hơn. Liều dùng duy trì thay đổi từ 1-5mg/ngày, thậm chí lên đến 20mg/ngày. Sự kháng warfarin chủ yếu là do yếu tố di truyền. Đó là lý do phải chỉnh liều trên từng cá thể theo INRs.
V. Mục tiêu
Hiệu quả của warfarin được đánh giá bởi PT. PT kéo dài gây ra bởi sự thiếu hụt yếu tố II, V, VII, X, cũng như nồng độ thấp fibrinogen và nồng độ cao heparin. Nó phản ánh hiệu quả của con đường đông máu ngoại sinh và con đường đông máu chung nhưng không đánh giá được con đường đông máu nội sinh. PT đo lường bằng cách thêm canxi và thromboplastin vào mẫu huyết tương đã loại bỏ tiểu cầu. thời gian cục máu đông hình thành được xác địn bằng thiết bị tự động để đánh giá. PT bình thường là khoảng 12 giây. Tuy vậy thromboplastin sử dụng trong đo lường PT được trích xuất từ các nguồn khác nhau và dẫn tới kết quả PT không được chuẩn hóa. Để đảm bảo tính chuẩn hóa, người ta đưa ra một loại thromboplastin tham chiếu để làm tiêu chuẩn cho loại thromboplastin đang được dùng trong phòng xét nghiệm (người ta sẽ ghi rõ độ nhạy ISI của loại thromboplastin đó). Giá trị ISI này sẽ được dùng để chuyển đổi PT đo được thành chỉ số INR được chuẩn hóa quốc tế theo công thức dưới:
INR = (PT bệnh nhân/PT trung bình bình thường)ISI
INR hiện nay được xem là tiêu chuẩn để theo dõi bệnh nhân dùng warfarin. Trong thực hành lâm sàng nói chung, mục tiêu INR thường là 2-3, đây là ngưỡng phù hợp cho hầu hết các bệnh lý đòi hỏi dự phòng/điều trị huyết khối. Liệu pháp cường độ cao với mục tiêu INR 2.5-3.5 có thể cần thiết ở bệnh nhân rung nhĩ có van nhân tạo cơ học và một số tình trạng thuyên tắc nhất định. Ở người châu Á, có tỉ lệ cao hơn mắc xuất huyết não, ngường INR thấp hơn có thể cần thiết.
Một khi đã thiết lập việc dùng warfarin ổn định. Cần theo dõi INR mỗi 4-6 tuần. Quan trọng là, sự đáp ứng với warfarin dễ bị thay đổi do chế độ ăn uống, sử dụng rượu và tương tác với các loại thuốc khác.
Vấn đề giảm liều. Liều warfarin có thể phải giảm xuống khi có sự xuất hiện suy tim sung huyết, tổn thương gan do bất kì nguồn nào, bao gồm uống rượu, rối loạn chức năng thận (làm tăng phân số thuốc tự do trong máu), chế độ ăn (làm thiếu hụt vitamin K). Ngộ độc giáp làm tăng dị hóa vitamin K, vì vậy cần giảm liều warfarin, trong khi bệnh phù niêm lại có tác dụng ngược lại. Cũng nên giảm liều ở người già do có sự tăng đáp ứng với warfarin theo tuổi. ở người có chế độ ăn giàu vitamin K (vd ăn nhiều rau xanh như súp lơ xanh) làm giảm hiệu quả warfarin. Một số chế độ ăn khác cũng gây ảnh hưởng tới sự khó khăn trong kiểm soát INR.
VI. Tương tác thuốc
Warfarin tương tác với gần 80 loại thuốc. Nó bị ức chế bởi barbiturates hay phenyltoin. Allopurinol, aminodarone, cephalosporins có tiềm năng gây ức chế vitamin K. Nhiều loại kháng sinh như metronidazol hay co-trimoxazole làm giảm sự thoái giáng warfarin ở gan đồng thời tăng tác dụng chống đông của nó.
Thuốc chống ngưng tập tiểu cầu như aspirin, clopidogrel, NSAIDs có thể làm tăng nguy cơ chảy máu.
Nguyên tắc là không để bệnh nhân sử dụng bất kì một thuốc nào khi đang dùng warfarin mà không tham khảo ý kiến bác sĩ. Khi nghi ngờ cần phải kiểm tra INR thường xuyên hơn.
VII. Chống chỉ định
Chống chỉ định bào gồm: 3 tháng đầu thai kì, đột quỵ mới, tăng huyết áp không kiểm soát, xơ gan, có điểm chảy máu đường tiêu hóa hoặc sinh dục, loét dạ dày- tá tràng, viêm dạ dày, trào ngược dạ dày thực quản, viêm đại-trực tràng, viêm bàng quang. Nếu chống đông là cực kì cần thiết, cần phải đánh giá cẩn thận lợi ích và nguy cơ. Tuổi già không phải là chống chỉ định mặc dù người già dễ chảy máu.
VIII. Warfarin với bệnh nhân suy thận
Theo dõi cẩn thận và chỉnh liều (trong một nghiên cứu nhỏ, cần giảm khoảng 25% khi creatinin còn 47 mL/min).
IX. Warfarin với phụ nữ mang thai
Warfarin chống chỉ định với 3 tháng đầu thai kì do khả năng gây quái thai và 2 tuần trước sinh bởi nguy cơ cao băng huyết. để thay thế, sử dụng UHF (heparin không phân đoạn) (FDA không khuyến cáo LMWH-heparin trọng lượng phân tử thấp) tròn 3 tháng đầu thai kì, warfarin trong quý thứ 2 cho đến khoảng 38 tuần sau đó lại đổi sang heparin. Ngừng heparin 12 tiếng trước khi đưa vào phòng đẻ. Tái sử dụng lại heparin sau sinh cùng với warfarin trong 4-5 ngày. Heparin dùng trong quý thứ 3 có thể phải tăng liều do tăng protein gắn với heparin.
X. Biến chứng và những lưu ý
Biến chứng phổ biến nhất là chảy máu với tăng nguy cơ xuất huyết não, đặc biệt là ở người già. Phát hiện này đã đẩy nhanh xu hướng chuyển sang sử dụng các thuốc ức chế thrombin trực tiếp. Biến chứng chảy máu có nguy cơ xuất hiện cao nhất trong 1-3 tháng đầu tiên dùng thuốc, cao gấp 10 lần thời gian sau đó. Mặc dù hiếm gặp nhưng biến chứng hoại tử da do warfarin khá nghiêm trọng. Hoại tử da có thể xuất hiện vào khoảng ngày thứ 3-8 của liệu pháp, nhất là khi dùng liều cao sau khi làm cầu nối tim phổi. Cách bảo vệ duy nhất là dùng liều warfarin thấp hơn kết hợp heparin và tăng liều trở lại sau một vài tuần. Nguyên nhân của hoại tử da do warfarin là chưa rõ ràng. Ở những bệnh nhân dùng thuốc kéo dài có thể có biến chứng gãy xương do loãng xương, rõ ràng hơn ở nam giới.
XI. Quá liều Warfarin
- Nếu cao nhưng INR < 9 mà không có chảy máu có thể quản lý bằng cách bỏ qua một liều và bắt đầu dùng lại với liều thấp.
- Nếu INR > 9 hoặc <9 nhưng có chảy máu, dùng 3-5g đường uống vitamin K có thể làm giảm INR trong 24-48 giờ. Sử dụng đường tiêm dưới da cho hiệu quả khó dự đoán nên tránh dùng. Thay vào đó sử dụng đường tĩnh mạch (5-10mg trong 30 phút) cho trường hợp cấp cứu. ở bệnh nhân có van nhân tạo, Vitamin K nên tránh dùng do nguy cơ huyết khối van tim, cho dù đó là xuất huyết não nguy hiểm tính mạng. So sánh giữa huyết tương tươi đông lạnh (FFP) và vitamin K ở bệnh nhân van tim cơ học có quá liều nhẹ đến vừa cho thấy FFP đáp ứng nhanh hơn (chỉ trong 6 giờ). Ở bệnh nhân không đáp ứng với vitamin K hoặc chảy máu nguy hiểm tính mạng, có thể sử dụng (1) khối yếu tố đông máu nhóm prothombin gồm yếu tố II, IX, X hoặc (2) FFP (15mL/kg).
Đảo ngược tình trạng tăng INR hoặc chảy máu ở bệnh nhân dùng wafarin
| Điều kiện | Can thiệp |
| Mục tiêu INR 5 Chảy máu không đáng kế hoặc không có nguy cơ chảy máu | Liều thấp hơn hoặc bỏ qua liều tiếp theo |
| INR ≥ 5 hoặc <9 VÀ Chảy máu không đáng kể hoặc không có nguy cơ chảy máu |
|
| INR ≥ 9 Chảy máu không đáng kê VÀ/HOẶC Nguy cơ chảy máu thấp-trung bình |
|
| Chảy máu nghiêm trọng với INR bất kỳ VÀ/HOẶC Nguy cơ chảy máu cao |
|
Bảng 1.3. Xử lí tình trạng tăng INR khi dùng warfarin
XII. Chỉ định warfarin
1. Huyết khối tĩnh mạch (DVT)
Với bệnh nhân DVT, cần sử dụng sớm warfarin kết hợp với heparin tĩnh mạch hoặc LMWH. Sau đó, tiếp tục dùng chống đông đơn độc trong ít nhất 3 tháng tiếp theo. Ngưỡng INR 2-3 được xem là an toàn hơn ngưỡng cao hơn. Việc duy trì INR 1.5-2 dài hạn cho thấy làm giảm các biến cố tái phát. Việc kéo dài điều trị nên được xem xét ở bệnh nhân có tình trạng huyết khối tĩnh mạch tái phát hoặc có yếu tố nguy cơ như thiếu antiprothombin- III, protein C, protein S, tăng dai dẳng Tự kháng thể antiphospholipid hoặc bệnh ác tính. Với thuyên tắc phổi, LMWH hoặc UFH được khuyến cáo, theo sau là warfarin được uống kéo dài khoảng 6 tháng nếu không tái phát. Nếu có tái phát, cần xem xét điều trị kéo dài vô thời hạn.
2. Rung nhĩ
Rung nhĩ và thuyên tắc do huyết khối có tỷ lệ song hành cao và nguy cơ còn cao hơn nữa trên nền bệnh nhân suy tim sung huyết, rối loạn chức năng thất trái (LV), tăng huyết áp, tuổi già, tiểu đường, TIA, có tiền sử thuyên tắc huyết khối trước đó, MI trước đó, bệnh động mạch ngoại biên, xơ vữa động mạch, và tiền sử đột quỵ. Việc điều trị cần phải dựa vào thang điểm CHA2DS-VASc. Lợi ích của warfarin là vượt xa so với nguy cơ chảy máu. Những chỉ định duy nhất không cần tới warfarin là: (1) bệnh nhân rung nhĩ trẻ tuổi (<65 tuổi) không có yếu tố nguy cơ; (2) bệnh chảy máu di truyền; và (3) bệnh nhân già với nguy cơ chảy máu cao, lúc này cần phải đánh giá qua thang điểm nguy cơ chảy máu HAS-BLED hoặc ATRIA. Việc khử rung làm tăng nguy cơ thuyên tắc khi thực hiện ở bệnh nhân rung nhĩ sau 48 giờ khởi phát, vì thế cần sử dụng chống đông 3 tuần trước khi thực hiện khử rung (khuyến cáo mạnh). Siêu âm qua thực quản có thể dùng để tìm và phát hiện huyết khối ở nhĩ, nếu không có huyết khối thì được phép khử rung và không chắc chắn thời điểm khởi phát. Ở hầu hết bệnh nhân, việc sử dụng chống đông khi trở về nhịp xoang nên được duy trì kéo dài. Những bệnh nhân rung nhĩ kịch phát sẽ có nguy cơ cao đột quỵ tương tự như bệnh nhân AF dai dẳng.
Rung nhĩ kịch phát
Lựa chọn điều trị có thể là không can thiệp ở bệnh nhân rung nhĩ đơn độc cho tới warfarin ở những bệnh nhân già với nguy cơ đột quỵ cao. Trong tương lai, các loại thuốc antithrombin mới sẽ được ưa dùng hơn do làm giảm nguy cơ đột quỵ.
Rung nhĩ có bằng chứng của nhồi máu não cấp
Mặc dù chống đông là bắt buộc cho trường hợp này, cần phải loại trừ xuất huyết não trên phim CT hoặc MRI. Ở những case nhồi máu não rộng, warfarin nên được trì hoãn khoảng 1 tuần để cho phép sự tiến triển đầy đủ diễn ra.
Rung nhĩ: đề xuất
Có những bằng chứng mạnh cho việc sử dụng chống đông với mục tiêu INR 2-3 ở bệnh nhân “nguy cơ cao”, những bệnh nhân mà warfarin sẽ cho lợi ích cao hơn aspirin (CHADS2 > 1). Việc không dùng aspirin và chống đông chỉ nên xem xét ở những bệnh nhân có nguy cơ thấp (0 hay 1 điểm).
Rung nhĩ ở bệnh nhân già
Sự kết hợp thường gặp và đòi hỏi phải đánh giá cẩn thận cân bằng giữa lợi ích và nguy cơ.
Table 2 Scoring systems for assessing the risk of stroke (CHA2DS2-VASc) and bleeding (HAS-BLED) In patients with atrial fibrillation 5
| CHA2DS2-VASc | Score | HAS-BLED | Score |
| Congestive heart failure | 1 | Hypertension (systolic blood pressure >160 mm Hg) | 1 |
| Hypertension | 1 | Abnormal renal and liver function (1 point each) | 1 or 2 |
| Age ≥75 years old | 2 | Stroke | 1 |
| Diabetes mellitus | 1 | Bleeding tendency/predisposition | 1 |
| Stroke/transient ischaemic attack/thromboembolism | 2 | Labile INRs (if on warfarin) | 1 |
| Vascular disease (prior myocardial infarction, peripheral artery | 1 | Elderly (e.g. age >65 years old) disease, or aortic plaque) | 1 |
| Age 65-74 years old | 1 | Drugs or alcohol (1 point each) | 1 or 2 |
| Sex category (i.e. female sex) | 1 | ||
| Maximum score | 9 | Maximum score | 9 |
Bảng 1.3 thang điểm CHA2DS-VASc và HAS-BLED
3. Hẹp 2 lá hoặc trào ngược van 2 lá
Ở bệnh nhân có bệnh lý van 2 lá, nguy cơ thuyên tắc huyết khối cao nhất khi có rung nhĩ, đặc biệt khí có nhĩ trái giãn, hoặc có tiền sử thuyên tắc trước đó. Chống đông là một chỉ định rất quan trọng ở những bệnh nhân này với bất kì tình trạng nào trong số kia. Ngược lại, chống đông không chỉ định cho bệnh nhân hẹp van 2 lá với nhịp xoang. Bít tiểu nhĩ trái qua da cùng thiết bị watchman là phương pháp tiếp cận mới. So với những trường hợp thực hiện bít tiểu nhĩ và trường hợp dùng warfarin với CHADS2 1 điểm hoặc hơn, việc thực hiện thử thuật mang lại hiệu quả không kém so với warfarin trong phòng ngừa đột quỵ, thuyên tắc hệ thống và tử vong do tim mạch. Tuy vậy nó lại có nguy cơ biến chứng cao hơn đáng kể, chủ yếu là tràn dịch màng ngoài tim và thuyên tắc khí gây đột quỵ. Những biến chứng có thể giảm bới bằng cách thực hiện thủ thuật chuẩn chỉ và kinh nghiệm.
4. Bệnh cơ tim giãn
Bệnh lý này có một nguy cơ đáng kể gây thuyên tắc hệ thống, đặc biệt nếu có AF. Mặc dù chống đông có mang lại những hiệu quả nhưng vấn đề cân bằng lợi ích-nguy cơ vẫn còn được tiếp tục thử nghiệm thêm. Ở bệnh nhân suy tim, aspirin có hiệu quả tương đương warfarin. Vì thế chúng tôi không khuyến cáo dùng chống đông ở những bệnh nhân không có nguy cơ huyết khối nào thêm hoặc bằng chứng của huyết khối.
5. Hội chứng nhịp nhanh-nhịp chậm
Hội chứng nhịp nhanh nhịp chậm có thể là hậu quả của rung nhĩ và huyết khối. Chống đông nên được xem xét, đặc biệt là nếu có bệnh tim thực thể, chẳng hạn như bệnh thiếu máu cơ tim cục bộ, tăng huyết áp, bệnh cơ tim.
6. Khuyết tật vách liên nhĩ
Ở những bệnh nhân già với khuyết tật vách liên nhĩ và tăng áp phổi, chống đông là một khuyến cáo mạnh như một phương pháp dự phòng huyết khối động mạch phổi hoặc, hiếm hơn là tắc mạch nghịch thường.
7. Warfarin và van tim nhân tạo
Warfarin được khuyến cáo ở bệnh nhân dùng van nhân tạo cơ học, với mục tiêu INR thường là 2.5-3.5. tuy nhiên các phân tích đã đề xuất ngưỡng INR cao hơn (3-4.5) với van động mạch chủ cơ học ở ngưỡng dưới và van 2 lá ở ngưỡng cao hơn của mục tiêu INR. ở những bệnh nhân van sinh học, nguy cơ huyết khối cao nhất sau 6-12 tuần, đây là thời điểm bắt buộc dùng warfarin. Sau đó, aspirin có thể được sử dụng và ngừng liệu pháp chống đông nếu không có chỉ định khác. Có bằng chứng mạnh ủng hộ việc tiếp tục dùng warfarin khi van 2 lá sinh học có kèm theo rung nhĩ, nhĩ trái lớn, hoặc suy thất trái. Ở những bệnh nhân với van động mạch chủ sinh học thì nguy cơ là thấp hơn và aspirn dùng trong 6-12 tuần là phù hợp.
8. Warfarin và bệnh thận mạn (CKD) mức độ trung bình: liên quan đến bệnh ống thận
CKD liên quan đến việc duy trì warfafin với liều thấp hơn và giảm sự ổn định của thuốc chống đông, đòi hỏi phải được quản lý chặt chẽ hơn. Ở những bệnh nhân CKD giai đoạn 3 kèm rung nhĩ làm tăng gấp đôi các biến cố bất lợi, bao gồm cả tăng chảy máu. Việc chỉnh liều warfarin so với aspirin và liều warfarin rất thấp làm giảm đột quỵ và thuyên tắc hệ thống tới 76%, không làm tăng nguy cơ chảy máu. Tuy nhiên, lưu ý rằng CKD giai đoạn 3 thì dabigatran hoặc rivaroxaban cũng có thể được sử dụng. Apixaban có vẻ an toàn hơn mặc dùng không có nghiên cứu so sánh rõ ràng.
Bệnh ống thận liên quan tới warfarin: là một mô tả mới ở những trường hipwj tăng INR trên 3 nhanh sau liều warfarin bắt đầu. Điều này, nếu được xác nhận, đặc biệt trên bệnh nhân CKD- những bệnh nhân mà thường có sự tăng creatinin máu không rõ lý do và tăng tốc độ tiến triển CKD. INR nên được giữ dưới 3 ở tất cả bệnh nhân CKD sau khi dùng warfarin.
Thuốc chống đông pha cấp: Heparin
Heparin được xem là xương sống của liệu pháp chống đông, là một mucopolysaccharide không đồng nhất với cơ chế tác dụng rất phức tạp lên quá trình đông máu và mạch máu. Trong cơ thể, heparin có nguồn gốc từ tế bào mast (gan, phổi, thận,tim). Heparin có tính acid cao nên khi ngộ độc có thể sử dụng các chất kiềm mang điện tích dương (như protamin) để trung hòa. Các chế phẩm bán trên thị trường hiện nay được chiết xuất từ phổi bò hoặc niêm mạc ruột lợn.
I. Cơ chế tác dụng
Trong phần cơ chế đông máu, chúng ta đã nhắc tới những yếu tố chống đông của cơ thể, trong đó có antithrombin. Antithrombin tác dụng bằng cách gắn bền chặt vào các yếu tố IIa, IXa, Xa, Xia, XIIa (những yếu tố của con đường đông máu nội sinh) và ức hoạt chúng. Phản ứng này diễn ra mạnh gấp 1000 lần khi có mặt heparin. Liều tác dụng của heparin rất khó để dự đoán bởi việc chiết xuất nó trải qua rất nhiều công đoạn và độ mạnh của nó khác nhau theo từng mẻ sản phẩm. Đó là lý do rất khó chỉnh liều heparin và đòi hỏi phải được theo dõi cẩn thận.
II. Phân loại
Khi nhắc đến heparin, thường thì đó là UFH (heparin không phân đoạn) có trọng lượng 5000-30.000 KDA. Còn LMWH (heparin trọng lượng phân tử thấp) là những UFH đã trải qua thủy phân và trùng hợp để tạo thành những đoạn heparin ngắn và chuyên biệt hơn. LMWH có những ưu điểm và nhược điểm so với UFH và chi tiết về nó sẽ được nói rõ hơn ở riêng một phần sau.
III. Xét nghiệm để đánh giá hiệu quả heparin
Có thể thấy heparin tác động lên các yếu tố đông máu nội sinh và thrombin. Vì vậy aPTT, một xét nghiệm phản ánh quá trình đông máu nội sinh được sử dụng để theo dõi heparin và các thuốc ức chế thrombin trực tiếp đường tiêm. Test được thực hiện bằng cách thêm các yếu tố hoạt hóa bề mặt (kaolin hoặc micronized silica), một phần của thuốc thử thromboplastin (phospholipid; yếu tố 3 tiểu cầu thay thế), và canxi vào mẫu huyết tương.
Thông thường, kết quả sẽ rơi vào khoảng 24-36 giây.
Cũng như PT, aPTT có một sự sai lệch tùy vào loại thuốc thử thromboplastin. Tuy nhiên, hệ thống chuẩn hóa INR không được phát triển cho aPTT. Mục tiêu dùng heaparin là đưa aPTT lên cao gấp 1.5 đến 2 lần ngưỡng bình thường. Tuy nhiên tiêu chuẩn này sẽ sớm bị loại bỏ do tính thiếu thống nhất của kết quả. Thay vào đó, aPTT phải được hiệu chỉnh theo từng lô thuốc và từng máy đo khác nhau, các lô thuốc thử này sẽ được xác định mức độ tương ứng với liều heparin điều trị ở 0.3-0.7 đơn vị quốc tế/mL bởi thuốc ức chế Xa. Các thuốc ức chế thrombin trực tiếp cũng sử dụng mốc aPTT tương tự.
IV. Chỉ định của UFH
1. Trong nhồi máu cơ tim cấp
Heparin được sử dụng cùng thuốc tiêu sợi huyết hoặc can thiệp vành qua da tiên phát. Trong ACS, UFH là tiêu chuẩn tham khảo, nhưng bây giờ chủ yếu là sử dụng LMWH, fondaparinux và bivalirudin. Tái nhồi máu có thể xuất hiện sau khi ngừng heparin tĩnh mạch thường là hậu quả của tác dụng nảy ngược (heparin rebound). Heparin nên được dừng ngay sau các thủ tục can thiệp.
Trong dự phòng và điều trị huyết khối tĩnh mạch sâu, heparin dưới da đã bị thay thế bằng LMWH hoặc fondaparinux.
2. Chống đông trong thời kỳ thai nghén
UFH có thể được sử dụng, tuy nhiên nó có thể gây loãng xương nếu dùng liều cao hơn 20.000 IU/ngày trong nhiều hơn 5 tháng. Thuốc thay thế là fondaparinux hoặc LMWH.
V. Kiểm soát liều heparin tĩnh mạch
Khi heparin được dùng sau liệu pháp tiêu sợi huyết ở bệnh nhân ACS, cần phải kiểm soát thật cẩn thận liều của nó. Heparin có thể được pha trong dịch muối đẳng trương hoặc dextrose. Liều khuyến cáo là 50-70 IU/Kg, không quá 5000 IU, sau đó là 12-15 IU/Kg/giờ (tối đa 1000 IU). Chỉnh liều để đạt mục tiêu aPTT 1.5-2.5 lần ngưỡng trên bình thường hoặc 50- 75 giây với theo dõi ởi 6,12, và 24 giờ. AHA-ACC khuyến cáo một liều cẩn trọng hơn là bolus 60 IU/kg (không quá 4000 IU) và liều truyền tĩnh mạch là 12 IU/kg/giờ với mục tiêu aPTT là 60-80 giây.
Mục tiêu aPTT cao hơn làm tăng nguy cơ xuất huyết não mà không làm tăng tiên lượng sống cho bệnh nhân một chút nào. Nếu aPTT cao gấp 3 lần ngưỡng kiểm soát, liều truyền tĩnh mạch có thể giảm đi một nửa, nếu là gấp 2-3 lần ngưỡng kiểm soát, nên giảm liều tĩnh mạch đi 25%. Nếu gấp 1.5 đến 2 lần, có thể không cần chỉnh liều. nếu aPTT thấp hơn 1.5 lần ngưỡng kiểm soát, có thể tăng liều thêm 25% với tối đa là 2500IU/giờ. Hạn chế của aPTT là nó có thể khác nhau ở các trung tâm khác nhau do sự thiếu quy chuẩn của thuốc thử. ACT thì được ưu tiên dùng để đánh giá hơn nếu đặt catheter.
VI. Tác dụng phụ và những thứ cần lưu ý
HIT ( Giảm tiểu cầu do heparin) và hội chứng huyết khối xuất hiện ở khoảng 3-5% bệnh nhân sau khi dùng UFH từ 5 ngày trở lên. Với LMWH thấp hơn nhiều, ít hơn 1%. Một hệ thống thang điểm lâm sàng dùng để đánh giá sự liên quan này: “Tiểu cầu giảm 50% hoặc hơn (giảm tiểu cầu), 5-10 ngày sau khi bắt đầu UFH, có huyết khối mới xuất hiện, và các nguyên nhân giảm tiểu cầu khác được loại trừ”. Hầu hết HIT xảy ra trong thời gian đang dùng heparin những có khoảng 5% xuất hiện sau khi đã ngừng liệu pháp (HIT muộn).
HIT là một hội chứng do miễn dịch qua trung gian tế bào và có thể gây chết người, trong đó tiểu cầu cầu gắn với globulin miễn dịch heparin gây ra giảm tiểu cầu và huyết khối. Nên ngừng ngày heparin hoặc LMWH nếu nghi ngờ. Hãy thay thế loại chống đông khác nếu cần thiết và hầu hết bệnh nhân sẽ được điều trị vói thuốc ức chế thrombin hoặc heparinoid và sau đó là bắt đầu với warfarin khi tiểu cầu trở về bình thường.
Liệu pháp HIT. ở Mĩ, Những bệnh nhân nghi ngờ HIT hoặc đã chẩn đoán HIT mà cần PCI, argatroban (thuốc ức chế thrombin trực tiếp, 240mcg/kg bolus theo sau là 20mcg/kg/phút truyền tĩnh mạch) có thể cover can thiệp, kể cả khi không dùng thêm thuốc ức chế GpIIb/IIIa. Một sự thay thế khác trong ACS là fondaparinux hoặc bivalirudin. Heparinoid danaparoid cũng là một lựa chọn nhưng nó có sự chồng chéo với heparin.
Hiệp hội huyết học Anh khuyến cáo: Tất cả những bệnh nhân điều trị với bất kì loại heparin nào kéo dài cần phải định lượng tiểu cầu trong ngày đầu tiên và mỗi 2-4 ngày sau đó.
Ngoài ra heparin cũng làm tăng nguy cơ chảy máu ở những bệnh nhân viêm nội tâm mạc nhiễm khuẩn bán cấp hoặc ở những bệnh nhân có rối loạn huyết học như hemophilia, bệnh gan, hoặc loét đường tiêu hóa trên, đường sinh dục. Chỉ có một cửa sổ hẹp cho việc điều trị heparin kết hợp với liệu pháp tiêu sợi huyết. Một số bệnh nhân có sự đề kháng heparin, và những bệnh nhân đó đòi hỏi một liều heparin cao hơn đồng thời phải được theo dõi aPTT mỗi 4 tiếng 1 lần.
Quá liều heparin được xử trí bằng cách ngừng thuốc và nếu cần thiết, phải sử dụng protamine sulfat (check dị ứng trước với cá hồi) với dung dịch 1% liều truyền tĩnh mạch rất chậm, không quá 50mg trong bất kì khoảng 10 phút nào.
Heparin trọng lượng phân tử thấp
LMWHs có trọng lượng khoảng 1/3 trọng lượng Heparin, và kích thước của nó cũng không đồng nhất. LMWHs có sinh khả dụng cao hơn và thời gian bán thải kéo dài hơn so với heparin tiêu chuẩn. LMWHs cũng ức chế yếu tố Xa tuy nhiên khả năng ức chế thrombin của nó kém hơn UFH. Nhờ đó tác dụng phụ gây xuất huyết của LMWHs giảm đi nhưng không bị đảo ngược hoàn toàn bởi protamine (do vẫn còn tác dụng lên yếu tố Xa). LMWHs dùng dưới da với liều điều chỉnh dễ dàng hơn nhiều so với UFH, nguy cơ HIT thấp hơn, tuy nhiên vẫn cần theo dõi lượng tiểu cầu và nên ngừng nếu tiểu cầu < 100.000/mm2.
LMWH trong hội chứng vành cấp
Enoxaparin là một LMWH rất phổ biến. Nghiên cứu cho thấy enoxaparin liều 0.5-0.75 mg/kg đường tĩnh mạch ở bệnh nhân PCI ít gây chảy máu hơn UFH, và liều 0.75mg/kg cho hiệu quả ức chế yếu tố Xa cao hơn mức liều thấp hơn. Không cần thiết phải chỉnh liều enoxaparin ở bệnh nhân rối loạn chức năng thận khi sử dụng liều bolus ở bệnh nhân PCI. Nghiên cứu cũng chứng minh việc chuyển đổi từ UFH sang LMWH làm tăng nguy cơ chảy máu.
Lựa chọn LMWHs hay UFH?
LMWH thường được ưa dùng hơn UFH bởi tính tiện dụng, giá thường rẻ hơn, không cần theo dõi aPTT quá cẩn thận, tránh được vấn đề nhiễm trùng tại vị trí truyền tĩnh mạch, cho hiệu quả cao hơn. Việc không có một thuốc giải độc hoàn toàn là một nhược điểm tiềm năng, đặc biệt là trong bối cảnh cấp cứu như PCI cho một trường hợp ACS có nguy cơ cao.

