Y tế - Sức Khỏe
QUY LUẬT 48 GIỜ ĐẦU TRONG RUNG NHĨ
QUY LUẬT 48 GIỜ ĐẦU TRONG RUNG NHĨ
BS. Lê Bảo Trung
Group Cập Nhật Kiến Thức Y Khoa
Xem và tải PDF, TẠI ĐÂY.
Giới thiệu
Trong các khuyến cáo về rung nhĩ từ trước khuyến cáo của ESC 2020 vẫn ủng hộ quan điểm rằng, một cơn rung nhĩ mới khởi phát trong vòng 48 giờ thì việc shock điện chuyển nhịp, thậm chí không cần chống đông dự phòng hay siêu âm tim qua thực quản (TEE) trước được coi là an toàn về mặt nguy cơ huyết khối [11; 12]. Vậy ‘quy luật 48 giờ’ này tới từ đâu? Nó thực sự an toàn không? Có thể áp dụng trong mọi trường hợp không? Khuyến cáo mới về quản lý rung nhĩ từ ESC 2020 đã đánh giá lại giá trị của quy luật này. Bài viết nhằm mục đích phân tích làm rõ hơn những thay đổi xoay quanh quy luật 48 giờ trong cập nhật mới của ESC 2020.
Mối liên quan giữa thời gian và nguy cơ huyết khối trong rung nhĩ
Tất cả các bệnh nhân rung nhĩ dù cho thuộc type nào (rung nhĩ cơn, dai dẳng, mạn tính,…) đều tăng nguy cơ thuyên tắc huyết khối. Tuy vậy, tỷ lệ hình thành huyết khối không hẳn giống nhau giữa các type. Một số nghiên cứu gợi ý rằng rung nhĩ kịch phát có nguy cơ huyết khối thấp hơn rung nhĩ dai dẳng hay mạn tính. Một phân tích tổng hợp năm 2015 dựa trên 12 nghiên cứu với tổng số bệnh nhân là 90,996 đã cho thấy tỷ lệ tử vong do mọi nguyên nhân cũng như tử vong do thuyên tắc huyết khối cao hơn ở nhóm rung nhĩ không kịch phát (dai dẳng, mạn tính) khi so với rung nhĩ kịch phát [7]. Một nghiên cứu khác ở Nhật Bản (không nằm trong phân tích tổng hợp trên) so sánh giữa 1588 bệnh nhân rung nhĩ kịch phát và 1716 bệnh nhân rung nhĩ dai dẳng cũng cho thấy nhóm rung nhĩ kịch phát có tỷ lệ nhồi máu não/ tắc mạch hệ thống thấp hơn bất kể bệnh nhân có dùng chống đông hay không [16]. Một phân tích tổng hợp khác cũng cho kết luận rằng loại rung nhĩ có giá trị tiên đoán nguy cơ huyết khối độc lập trên bệnh nhân không dùng chống đông [18]. Tuy vậy, khuyến cáo của ESC năm 2020 đã khẳng định rằng, việc điều trị rung nhĩ không dựa vào phân loại rung nhĩ và cần sử dụng chống đông càng sớm càng tốt cho bệnh nhân rung nhĩ [10].
Vậy có sự khác biệt như thế nào về nguy cơ huyết khối thay đổi theo thời gian khi cơn rung nhĩ kéo dài? Không có nhiều nghiên cứu để phân tích vấn đề này cũng như đảm bảo tính chính xác bởi rất khó để xác định được thời điểm khởi phát của rung nhĩ trên bệnh nhân. Điều này cũng làm cho kết quả các nghiên cứu trở nên không đồng nhất. Nghiên cứu ASSERT đánh giá trên 2580 người không có tiền sử rung nhĩ trong 2.5 năm. Kết quả cho thấy, những người xuất hiện cơn rung nhĩ kéo dài hơn 6 phút thì có nguy cơ thuyên tắc huyết khối cao hơn so với những người không có cơn rung nhĩ hoặc cơn ngắn hơn 6 phút (hazard ratio 1.76; 95% CI, 0.99 – 3.11; p = 0.05) [9]. Trong khi đó, một nghiên cứu khác công bố năm 2017 thực hiện trên 2455 bệnh nhân lại cho thấy phải là cơn rung nhĩ kéo dài hơn 24 giờ mới làm tăng nguy cơ đột quỵ và thuyên tắc mạch hệ thống (HR hiệu chỉnh 3.24, 95% CI 1.51-6.95) [17].
Siêu âm qua thực quản là phương pháp hiệu quả trong phát hiện huyết khối nhĩ trái. Tuy nhiên chúng không thường được chỉ định cho những bệnh nhân rung nhĩ kịch phát đến sớm (<48 giờ). Tuy nhiên, một nghiên cứu cho thấy có tới 4% bệnh nhân rung nhĩ khởi phát <48 giờ phát hiện huyết khối nhĩ trái qua siêu âm thực quản khi không được dùng chống đông [13]. Một nghiên cứu siêu âm qua thực quản khác cho thấy ở những bệnh nhân rung nhĩ khởi phát dưới 72 giờ, tỷ lệ phát hiện huyết khối nhĩ trái lên đến 14% [8]. Và chúng ta biết rằng, phát hiện huyết khối trong nhĩ trái là chống chỉ định của chuyển nhịp rung nhĩ.
Trong khi tiếp tục chờ đợi các nghiên cứu lớn trong tương lai, nhiều chuyên gia vẫn đồng thuận rằng cơn rung nhĩ kéo dài hơn 24 giờ sẽ làm tăng đáng kể nguy cơ thuyên tắc huyết khối và chắc chắn nguy cơ huyết khối sẽ tăng lên theo thời gian tồn tại của cơn rung nhĩ.
Bản thân việc chuyển nhịp cũng là một yếu tố nguy cơ hình thành huyết khối?
Kể cả khi đã được chứng minh không có huyết khối trong nhĩ trái, chúng ta cũng hoàn toàn không đảm bảo rằng việc chuyển nhịp là an toàn. Các cơ chế được đưa ra cho hiện tượng này là khi tái lập nhịp xoang sau chuyển nhịp, tốc độ dòng máu luân chuyển trong tiểu nhĩ trái chậm xuống đáng kể và điều này thúc đẩy hình thành huyết khối mới gây tắc mạch sau đó, đặc biệt là trên những bệnh nhân có thêm các yếu tố thuận lợi khác cho sự hình thành huyết khối [8].
Lịch sử của ‘quy luật 48 giờ’
Năm 1997, Weigner và cộng sự đã công bố một nghiên cứu tiến cứu trên 375 bệnh nhân nhập viện vì rung nhĩ có triệu chứng khởi phát dưới 48 giờ để đánh giá mối liên quan giữa chuyển nhịp và nguy cơ huyết khối ở bệnh nhân rung nhĩ [19]. Có tổng cộng 357 bệnh nhân chuyển về nhịp xoang trong thời gian nằm viện trong đó 250 bệnh nhân (66,7%) là tự về nhịp xoang mà không cần can thiệp thuốc hay shock điện. Kết quả cho thấy chỉ có 3 bệnh nhân (chiếm 0.8%) xuất hiện các biến cố thuyên tắc huyết khối: một trường hợp nhồi máu não, một có cơn đau thắt ngực thoáng qua và một có tắc mạch ngoại biên. Cả 3 trường hợp đều có tiền sử rung nhĩ hoặc thuyên tắc huyết khối trước đây, tất cả đều có chức năng tâm thu thất trái bình thường và không có ai trong số đó được shock điện chuyển nhịp. Theo đó, các tác giả đã kết luận rằng shock điện chuyển nhịp rung nhĩ mới khởi phát trong 48 giờ là an toàn. Kết quả này cũng được ủng hộ bởi một số nghiên cứu khác khi cho tỷ lệ biến cố thuyên tắc huyết khối tương đồng (0-0.9%) ở bệnh nhân rung nhĩ được shock điện chuyển nhịp trong vòng 48 giờ [4; 6].
Để phân tích sâu hơn, hãy xem xét thử nghiệm Fin-CV trên 3143 bệnh nhân rung nhĩ mới khởi phát trong vòng 48 giờ tại 3 bệnh viện với tổng cộng 7660 lần chuyển nhịp (bằng thuốc hoặc bằng shock điện, trong đó shock điện chiếm 88%), trong đó có 5116 lần chuyển nhịp thành công mà không sử dụng chống đông trước, trong và sau chuyển nhịp [2]. Kết quả cho thấy tỷ lệ thuyên tắc huyết khối sau chuyển nhịp là thấp với tổng cộng 38 ca (chiếm 0.7%) xuất hiện các biến cố thuyên tắc huyết khối (31 ca là đột quỵ não, 1 ca vừa đột quỵ vừa có thuyên tắc mạch hệ thống, 4 ca có cơn đau thắt ngực sau chuyển nhịp, 2 ca thuyên tắc phổi) trong vòng 30 ngày. Tuy vậy, khi phân tích sâu hơn, kết quả ghi nhận thấy tỷ lệ huyết khối cao vượt trội một cách khó chấp nhận ở một số nhóm bệnh nhân như nhóm suy tim kèm đái tháo đường (9.8%), trong khi nhóm suy tim mà không có đái tháo đường là 1.4%. Ngoài ra yếu tố tuổi tác cũng cho thấy sự khác biệt lớn khi nhóm dưới 60 tuổi có tỷ lệ thuyên tắc huyết khối là 0.2% trong khi nhóm từ 60 tuổi là 1.0%. Trong mối liên quan tới thời gian khởi phát, các phân tích dưới nhóm cũng cho thấy, kể cả khi được chuyển nhịp trong vòng 48 giờ, vẫn có sự khác biệt về nguy cơ huyết khối ở nhóm trong vòng 12 giờ (0.3%) và nhóm sau 12 giờ (1.1%) [14].
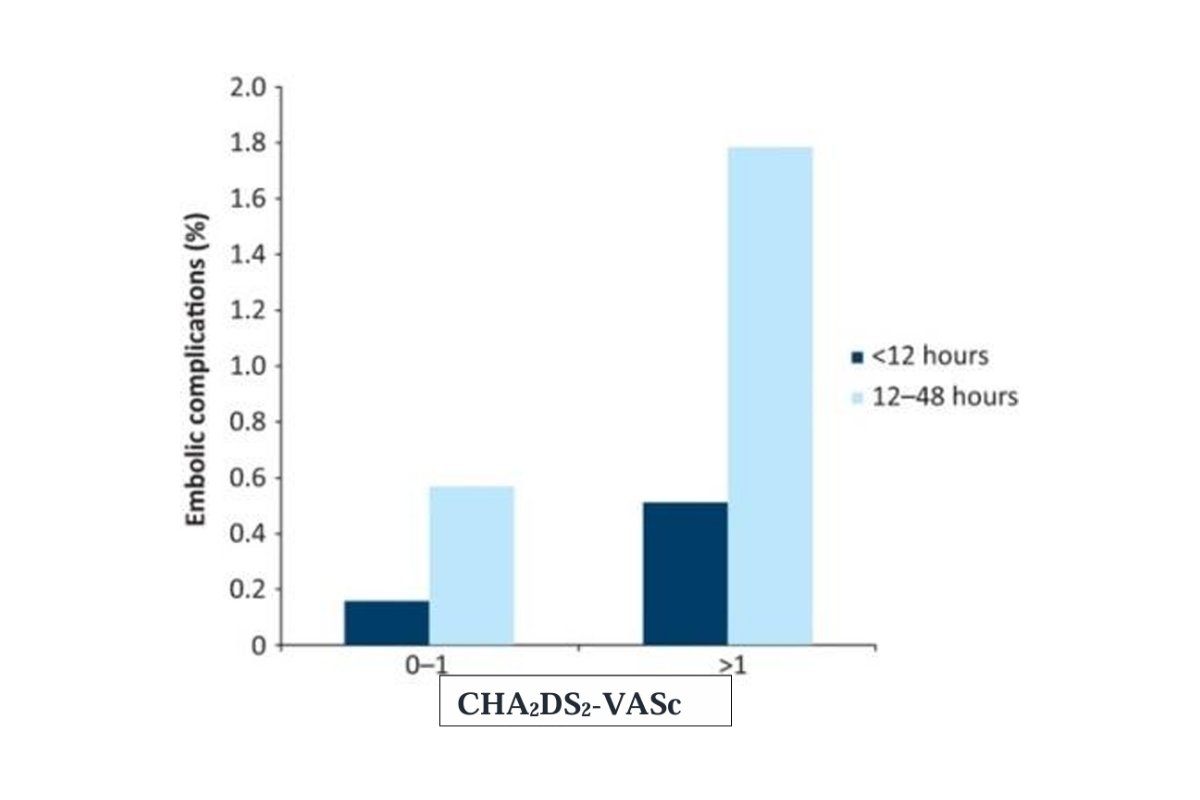
Vai trò của thang điểm CHA2DS2-VASc trong quyết định chuyển nhịp cấp cứu
Không có gì ngạc nhiên khi thử nghiệm Fin-CV kể trên cho thấy thang điểm CHA2DS2-VASc có giá trị dự đoán cao cho nguy cơ thuyên tắc huyết khối trong bối cảnh cấp tính. Nghiên cứu cho thấy nguy cơ thuyên tắc huyết khối tăng gấp 10 lần (0.35%-3.5%) khi so sánh 2 nhóm với điểm CHA2DS2-VASc ≤ 2 và nhóm > 5 điểm ở những bệnh nhân khởi phát triệu chứng <48 giờ.
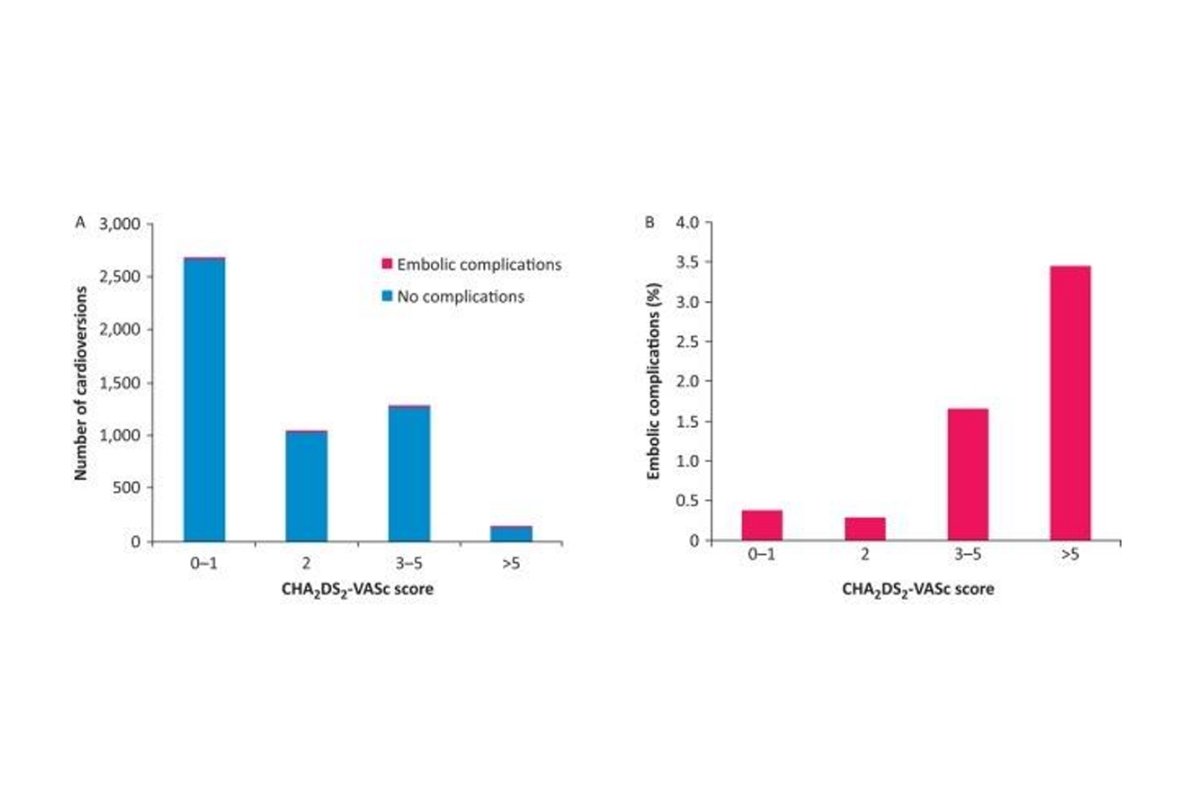
Một phân tích tổng hợp và tổng quan hệ thống được thực hiện dựa trên các nguyên tắc PRISMA (Preferred Reporting Items for Systematic Reviews and Meta Analyses) và CHARMS (Checklist for Critical Appraisal and Data Extraction for Systematic Reviews of Prediction Modelling Studies) với tổng cộng 20 nghiên cứu được đưa vào phân tích nhằm đánh giá hiệu quả của sử dụng chống đông đường uống sau chuyển nhịp ở bệnh nhân rung nhĩ và cuồng nhĩ khởi phát dưới 48 giờ với kết quả cho thấy [20]:
- Tất cả 9 trường hợp có biến cố tắc mạch trong phân tích tiên phát đều khởi phát <48 giờ, chuyển nhịp bằng shock điện, và đều có điểm CHA2DS2 VASc ≥2.
- Không có biến cố tắc mạch nào xảy ra sau 30 ngày chuyển nhịp trong tổng số 783 bệnh nhân không sử dụng chống đông trong phân nhóm hồi cứu.
- Phân tích thì 2 kết luận nguy cơ xảy ra biến cố thuyên tắc huyết khối tăng lên ở bệnh nhân có CHADS2 ≥1 hoặc CHA2DS2-VASc ≥2 (RR = 2.25, 95% CI 1.25–4.04; I2 = 0%).
Kết quả của phân tích trên cho thấy không có đủ bằng chứng để ủng hộ cho việc sử dụng chống đông đường uống thường quy sau chuyển nhịp rung nhĩ và cuồng nhĩ mới khởi phát <48 giờ. Nhưng cũng khiến chúng ta phải đặt câu hỏi về tính an toàn của việc chuyển nhịp rung nhĩ đến sớm. Đối với bạn, những tỷ lệ trên có là an toàn không? Các chuyên gia kết luận rằng, những đối tượng có nguy cơ cao với CHA2DS2-VASc ≥2 nên được cân nhắc sử dụng chống đông sau chuyển nhịp. Khuyến cáo của các hiệp hội tim mạch Hoa Kỳ và Châu Âu đều đồng thuận việc tiếp tục sử dụng chống đông sau chuyển nhịp rung nhĩ cho những bệnh nhân có CHA2DS2-VASc ≥2 [10; 11].
Vai trò của chống đông quanh thời gian chuyển nhịp
Từ những dữ kiện trên, chúng ta hiểu rằng những bệnh nhân có nguy cơ cao không nên được chuyển nhịp, ít nhất là cho tới khi họ được sử dụng chống đông đầy đủ. Tất nhiên ngoại trừ bối cảnh cấp cứu mà việc chuyển nhịp ngay lập tức là cần thiết. Những guideline từ AHA 2014 và ESC 2016 vẫn cho rằng việc chuyển nhịp rung nhĩ mới khởi phát trong vòng 48 giờ là an toàn và có thể không cần chống đông hay siêu âm tim qua thực quản [11; 12]. Từ khuyến cáo ESC 2020, một thay đổi cho thấy sự tiếp cận đã trở nên thận trọng hơn. ESC khuyến cáo khởi động điều trị dự phòng huyết khối theo thang điểm CHA2DS2-VASc ngay ở mọi bệnh nhân được phát hiện rung nhĩ bất kể thời gian khởi phát và tiếp tục duy trì chống đông kéo dài ở những bệnh nhân nguy cơ cao bất kể hình thức chuyển nhịp, sự duy trì nhịp xoang và loại rung nhĩ (ví dụ như ‘khởi phát lần đầu’, mới khởi phát) [10].
Chiến lược ‘wait-and-see’
Chiến lược ‘wait-and-see’ trong rung nhĩ là gì? Đó là chiến lược điều trị chống đông dự phòng huyết khối và kiểm soát tần số cho bệnh nhân rung nhĩ mới khởi phát trong 48 giờ thay vì chuyển nhịp sớm (trừ trường hợp bắt buộc). Chiến lược này dựa trên cơ sở là đa số (70%) các cơn rung nhĩ mới khởi phát sẽ tự tái lập về nhịp xoang sau 24 giờ [5]. Một số nghiên cứu RCT đã cho thấy chiến lược này không hề thua kém chiến lược chuyển nhịp sớm trong việc tái lập nhịp xoang khi đánh giá sau 4 tuần trên những bệnh nhân rung nhĩ có triệu chứng mới khởi phát [1; 15]. Chiến lược tỏ ra có lợi vì sẽ giảm tỷ lệ bệnh nhân phải chuyển nhịp cùng những biến chứng của nó cùng tác dụng phụ của thuốc chống loạn nhịp, giãn cơ.
Tuy nhiên cũng có những phản biện xung quanh lợi ích của chiến lược này như gia tăng chi phí điều trị, lo ngại về sự tăng lên của nguy cơ huyết khối khi để cơn rung nhĩ kéo dài (với dẫn chứng là nghiên cứu Fin-CV chứng minh nguy cơ huyết khối đã tăng lên kể cả khi so sánh nhóm trên và dưới 12 giờ), nghi ngại vì thời gian đánh giá chất lượng sống chỉ sau 4 tuần – quá ngắn với diễn tiến bệnh của rung nhĩ, lo ngại về việc trì hoãn chuyển nhịp sẽ làm mất cơ hội của bệnh nhân (theo các tác giả này, khoa cấp cứu là nơi rất lý tưởng để test sự đáp ứng của bệnh nhân với các loại thuốc đường uống, nhất là nhóm IC như propafenon, Fleicainide, từ đó tạo tiền đề để kê đơn cho bệnh nhân tiếp tục dùng trong tương lai mà thậm chí không cần phải nhập viện, đỡ phiền phức và chi phí cho bệnh nhân, đây là chiến lược ‘pill in-pocket’) [3].
Dựa trên sự cân bằng giữa nguy cơ huyết khối, và sự thật rằng rung nhĩ cơn tự tái lập nhịp xoang sau 24h gần 70 nhưng chỉ 17% trong 24 giờ tiếp theo và chỉ 3% sau 48 giờ [5], ESC 2020 gợi ý có thể áp dụng chiến lược ‘wait-and-see’ trong 24 giờ đầu (ESC 2020 gọi là ‘wait-and-watch’) [10].
Tài liệu tham khảo
- Doyle B., Reeves M. (2011). “Wait and see” approach to the emergency department cardioversion of acute atrial fibrillation. Emerg Med Int, 2011, pp. 545023.
- Airaksinen KE Juhani, Grönberg Toni, Nuotio Ilpo, et al. (2013). Thromboembolic complications after cardioversion of acute atrial fibrillation: the FinCV (Finnish CardioVersion) study. Journal of the American College of Cardiology, 62(13), pp. 1187-1192.
- Botto Giovanni Luca, Tortora Giovanni (2020). Is delayed cardioversion the better approach in recent-onset atrial fibrillation? Yes. 15(1), pp. 1-4.
- Crijns Harry JGM, Weijs Bob, Fairley Anna-Meagan, et al. (2014). Contemporary real life cardioversion of atrial fibrillation: Results from the multinational RHYTHM-AF study. International journal of cardiology, 172(3), pp. 588-594.
- Danias Peter G., Caulfield Todd A., Weigner Marilyn J., et al. (1998). Likelihood of Spontaneous Conversion of Atrial Fibrillation to Sinus Rhythm. Journal of the American College of Cardiology, 31(3), pp. 588-592.
- Gallagher Mark M, Hennessy Brian J, Edvardsson Nils, et al. (2002). Embolic complications of direct current cardioversion of atrial arrhythmias: association with low intensity of anticoagulation at the time of cardioversion. Journal of the American College of Cardiology, 40(5), pp. 926-933.
- Ganesan Anand N, Chew Derek P, Hartshorne Trent, et al. (2016). The impact of atrial fibrillation type on the risk of thromboembolism, mortality, and bleeding: a systematic review and meta-analysis. European heart journal, 37(20), pp. 1591 1602.
- Grimm Richard A., Stewart William J., Maloney James D., et al. (1993). Impact of electrical cardioversion for atrial fibrillation on left atrial appendage function and spontaneous echo contrast: Characterization by simultaneous transesophageal echocardiography. Journal of the American College of Cardiology, 22(5), pp. 1359-1366.
- Healey Jeff S, Connolly Stuart J, Gold Michael R, et al. (2012). Subclinical atrial fibrillation and the risk of stroke. New England Journal of Medicine, 366(2), pp. 120-129.
- Hindricks Gerhard, Potpara Tatjana, Dagres Nikolaos, et al. (2020). 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). European heart journal.
- January Craig T, Wann L Samuel, Alpert Joseph S, et al. (2014). 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Heart Rhythm Society. Journal of the American College of Cardiology, 64(21), pp. e1-e76.
- Kirchhof Paulus, Benussi Stefano, Kotecha Dipak, et al. (2016). 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J, 37(38), pp. 2893-2962.
- Kleemann Thomas, Becker Torsten, Strauss Margit, et al. (2009). Prevalence of Left Atrial Thrombus and Dense Spontaneous Echo Contrast in Patients With Short-Term Atrial Fibrillation < 48 Hours Undergoing Cardioversion: Value of Transesophageal Echocardiography to Guide Cardioversion. Journal of the American Society of Echocardiography, 22(12), pp. 1403-1408.
- Nuotio Ilpo, Hartikainen Juha EK, Grönberg Toni, et al. (2014). Time to cardioversion for acute atrial fibrillation and thromboembolic complications. J Jama, 312(6), pp. 647-649.
- Pluymaekers Nikki AHA, Dudink Elton AMP, Luermans Justin GLM, et al. (2019). Early or delayed cardioversion in recent-onset atrial fibrillation. 380(16), pp. 1499-1508.
- Takabayashi Kensuke, Hamatani Yasuhiro, Yamashita Yugo, et al. (2015). Incidence of stroke or systemic embolism in paroxysmal versus sustained atrial fibrillation: the Fushimi Atrial Fibrillation Registry. Stroke, 46(12), pp. 3354 3361.
- Van Gelder Isabelle C, Healey Jeff S, Crijns Harry JGM, et al. (2017). Duration of device-detected subclinical atrial fibrillation and occurrence of stroke in ASSERT. European heart journal, 38(17), pp. 1339-1344.
- Vanassche Thomas, Lauw Mandy N, Eikelboom John W, et al. (2015). Risk of ischaemic stroke according to pattern of atrial fibrillation: analysis of 6563 aspirin-treated patients in ACTIVE-A and AVERROES. European heart journal, 36(5), pp. 281-288.
- Weigner Marilyn J, Caulfield Todd A, Danias Peter G, et al. (1997). Risk for clinical thromboembolism associated with conversion to sinus rhythm in patients with atrial fibrillation lasting less than 48 hours. Annals of internal medicine, 126(8), pp. 615-620.
- Wong Brenton M, Perry Jeffrey J, Cheng Wei, et al. (2021). Thromboembolic events following cardioversion of acute atrial fibrillation and flutter: a systematic review and meta-analysis. Canadian Journal of Emergency Medicine, pp. 1-12.