Y tế - Sức Khỏe
Hướng dẫn đặc biệt về dinh dưỡng lâm sàng ở bệnh nhận có bệnh thận cấp tính hoặc bệnh thận mạn tính
Tác giả: Enrico Fiaccadori
Biên dịch: Bác sĩ Lê Nguyễn Quang Thái
vnras.com/drug – Để tải file PDF của bài viết Hướng dẫn đặc biệt về dinh dưỡng lâm sàng ở bệnh nhận có bệnh thận cấp tính hoặc bệnh thận mạn tính, xin vui lòng click vào link ở đây.
Khái lược
AKD – bao gồm tình trạng tổn thương thận cấp tính (Acute Kidney Injury- AKI) và bệnh thận mạn tính (Chronic Kidney Disease-CKD) rất phổ biến ở những BN nội viện, từ các khoa Thận, Nội, Ngoại cho đến đơn vị ICU, gây ra những biến chứng về rối loạn chuyển hóa và dinh dưỡng.
Hơn nữa, trong những trường hợp liệu pháp thay thế thận (Kidney Replacement Therapy – KRT) được bắt đầu, dù với bất kỳ phương thức nào thì cũng sẽ gây ra tác động đối với tình trạng dinh dưỡng, sự cân bằng cơ chất cũng như quá trình điều trị dinh dưỡng là những yếu tố không thể xem nhẹ.
Hướng dẫn này nhằm cung cấp các khuyến nghị dựa trên bằng chứng về dinh dưỡng lâm sàng trên bệnh nhân AKD và CKD nhập viện. Do sự chưa đồng nhất đáng kể của quần thể bệnh nhân này cũng như sự thiếu hụt của các chứng cứ chất lượng cao nên khuyến cáo này được coi là cơ bản của các bằng chứng và trong hầu hết các trường hợp ý kiến của chuyên gia, được tổng hợp và đồng thuận để cập nhật hai Hướng dẫn trước của ESPEN về Dinh dưỡng đường Tiêu hóa (Enteral-2006) và Tĩnh Mạch (Parenteral-2009) trên bệnh nhân trưởng thành có suy thận. Các trường hợp bệnh nhân CKD ổn định (tức là được kiểm soát protein trong chế độ ăn hoặc chế độ ăn giảm đạm, có hoặc không việc bổ sung acid amin/ketoanalogue ở bệnh nhân CKD ngoại trú giai đoạn IV và V), dinh dưỡng trong ghép thận, và bệnh thận trẻ em sẽ không được đề cập trong khuyến cáo hiện tại.
Mở đầu
Khuyến cáo hiện tại này là bản cập nhật và mở rộng của 2 khuyến cáo trước đó của ESPEN về Dinh dưỡng đường tiêu hóa 2006 [1] và Dinh dưỡng đường tĩnh mạch 2009 [2] trên bệnh nhân suy thận mạn và được soạn thảo bởi một nhóm các chuyên gia thuộc nhiều lĩnh vực (Thận học, ICU, các chuyên gia Nội khoa khác) dựa trên phương pháp nghiên cứu mới được định nghĩa theo quy trình thao tác chuẩn về khuyến cáo và đồng thuận của ESPEN [3].
Mục tiêu của nghiên cứu này là phát triển các hướng dẫn về dinh dưỡng cho BN nội trú có tình trạng tổn thương thận cấp (AKI/AKD) và/hoặc bệnh thận mạn (CKD) có hoặc không suy giảm chức năng thận (Kidney Failure – KF). Khuyến cáo này không áp dụng cho các BN ngoại trú có bệnh thận mạn từ giai đoạn 1-5 đã điều trị ổn định và bệnh nhân ngoại trú có lọc thận chu kỳ. Bất thường về chức năng thận, thường được đề cập đến trong y văn một cách rộng rãi với thuật ngữ là tổn thương thận cấp (AKI/AKD) hoặc bệnh thận mạn (CKD), rất phổ biến ở những bệnh nhân nhập viện ở các cơ sở lâm sàng khác nhau, bao gồm khoa Thận và khoa Nội, khoa Ngoại – phẫu thuật và đơn vị Hồi sức tích cực (ICU). Trên khía cạnh về dinh dưỡng, cách tiếp cận với những bệnh nhân này khi nhập viện là rất phức tạp vì các đối tượng không có sự đồng nhất, với các đặc điểm trao đổi chất, chuyển hóa và nhu cầu dinh dưỡng rất khác nhau.
Trong tất cả các khoa lâm sàng, tình trạng AKI/AKD và CKD (đặc biệt là từ giai đoạn 3 đến giai đoạn 5), cũng như các phương pháp điều trị, có thể có các ảnh hưởng nghiêm trọng đối với tình trạng dinh dưỡng và chuyển hóa cơ chất. Hơn nữa, trong trường hợp bắt đầu với liệu pháp thay thế thận (KRT) với bất kể phương thức nào được chỉ định (chạy thận nhân tạo ngắt quãng thông thường; liệu pháp thay thế thận ngắt quãng kéo dài PIKRT), hoặc liệu pháp thay thế thận liên tục (CKRT), tác động của các liệu pháp này đối với tình trạng dinh dưỡng, sự cân bằng các cơ chất và quá trình điều trị dinh dưỡng là rất đáng quan tâm.
Khuyến cáo hiện tại nhằm đưa ra các khuyến nghị dựa trên các bằng chứng trên các bệnh nhân AKI/AKD và CKD nội trú. Do chưa thu thập đầy đủ các chứng cứ có chất lượng cao nên khuyến cáo này được coi là cơ bản của các bằng chứng và trong hầu hết các trường hợp ý kiến của chuyên gia, được tổng hợp và đồng thuận theo một quy trình tiêu chuẩn. Các trường hợp bệnh nhân CKD ổn định (tức là được kiểm soát protein trong chế độ ăn hoặc chế độ ăn giảm đạm, có hoặc không việc bổ sung acid amin/ketoanalogue ở bệnh nhân CKD ngoại trú giai đoạn IV và V), dinh dưỡng trong ghép thận, và bệnh thận trẻ em sẽ không được đề cập trong khuyến cáo hiện tại. Như sẽ được thảo luận sâu hơn ở phần sau đây, danh pháp năm 2012 của KDIGO cho bệnh nhân AKI/AKD [4] và danh pháp năm 2012 cho bệnh nhân CKD [5], được cập nhật gần đây năm 2019 bởi Hội nghị đồng thuận KDIGO sẽ được đề cập trong bài viết này.
Phương pháp
Các khía cạnh chung và quá trình phát triển của khuyến cáo
Khuyến cáo này được tổng hợp từ các chứng cứ cơ bản và sự đồng thuận của các chuyên gia theo quy trình thao tác chuẩn về phát triển hướng dẫn của ESPEN [3]. Trên cơ sở này, khái niệm “Dinh dưỡng lâm sàng nhằm mục đích phòng ngừa và điều trị suy dinh dưỡng trên nền bệnh lý” đã được tập trung và tiếp cận một cách toàn diện, không tách biệt giữa dinh dưỡng qua đường tiêu hóa (EN) và dinh dưỡng qua đường tĩnh mạch (PN) như trong hướng dẫn trước đây của ESPEN cho người trưởng thành có suy chức năng thận, và bao gồm sàng lọc và đánh giá tình trạng dinh dưỡng, tư vấn, bổ sung dinh dưỡng đường uống (ONS), cũng như dinh dưỡng qua đường tiêu hóa và đường tĩnh mạch [7]. Do đó, khuyến cáo hiện tại là một bản cập nhật và sửa đổi hai hướng dẫn ESPEN hiện có trước đó về Dinh dưỡng đường tiêu hóa trong cho bệnh nhân suy chức năng thận năm 2006 [1] và Dinh dưỡng qua đường tĩnh mạch ở bệnh nhân suy chức năng thận năm 2009 [2]. Hai khuyến cáo trước đây được tổng hợp bởi 7 chuyên gia thuộc nhiều chuyên ngành khác nhau (Thận học, ICU, Nội khoa) đến từ 3 quốc gia Châu Âu (Ý, Thụy Điển, Bỉ) dựa trên quy trình thao tác chuẩn về khuyến cáo và đồng thuận của ESPEN [3]. Các chuyên gia trong nhóm đã tuyên bố xung đột lợi ích theo nguyên tắc của Ủy ban quốc tế về biên tập tạp chí y học. Chi phí cho nghiên cứu này hoàn toàn do ESPEN đài thọ, không có sự tài trợ từ bất kỳ tổ chức lợi nhuận nào. Các quy trình thao tác chuẩn theo hướng dẫn mới của ESPEN [3] dựa trên phương pháp đã được quy định bởi Association of Scientific Medical Societies of Germany, The Scottish Intercollegiate Guidelines Netword (SIGN) và The Center for Evidence-based Medicine at the University of Oxford. Theo đó, một cách tiếp cận tuần tự được thiết lập, bao gồm cấu trúc các câu hỏi lâm sàng theo hệ thống PICO (Bệnh nhân, Can thiệp, Kiểm soát, Kết quả), có hệ thống tìm kiếm tài liệu, với việc đánh giá các hướng dẫn/đồng thuận và xác định các từ khóa cụ thể. Các câu hỏi lâm sàng non-PICO cũng được cấu trúc, với các khái niệm cơ bản và tổng quát liên quan đến bệnh thận cấp và bệnh thận mạn tính, định nghĩa về hội chứng suy
giảm chức năng thận, phân loại AKI/AKD và CKD, phương thức điều trị thay thế thận (Kidney Replacement Therapy – KRT), và chỉ định. Mỗi câu hỏi dẫn đến một hoặc nhiều khuyến nghị/công bố và các bài bình luận liên quan. Các chủ đề khác nhau liên quan đến dinh dưỡng trên bệnh nhân nhập viện với AKI/AKD hoặc CKD được đề cập đến, chẳng hạn như nền tảng trao đổi chất khi chức năng thận suy giảm, sự trao đổi chất ảnh hưởng của AKI/AKD, AKI trên nền CKD có hoặc không có KRT, CKD và CKD có KRT, sàng lọc bệnh nhân có nguy cơ, đánh giá tình trạng dinh dưỡng, chỉ định và thời điểm hỗ trợ dinh dưỡng, đường nuôi ăn, nhu cầu về các chất đa lượng và vi lượng, dinh dưỡng đặc hiệu cho từng bệnh lý, kết hợp liệu pháp dinh dưỡng với KRT, cũng như theo dõi tình trạng dinh dưỡng và điều trị dinh dưỡng. Các bằng chứng hiện có đã được phân loại, cũng như các khuyến nghị và công bố đã được phát triển và thống nhất trong một quá trình đồng thuận nhiều giai đoạn. Mức độ mạnh của chứng cứ được lựa chọn trong bài viết này được cung cấp theo phân loại mức chứng cứ của SIGN (NICE 2012), trong đó xếp hạng bằng chứng từ 1++ cho các nghiên cứu có chất lượng và độ tin cậy cao (phân tích tổng hợp, đánh giá hệ thống các thử nghiệm ngẫu nhiên có đối chứng – RCT hoặc RCT với sai số rất nhỏ) đến mức bằng chứng thấp được xếp hạng 4 cho trường hợp lấy ý kiến chuyên gia [3].
| 1++ | Các phân tích tổng hợp chất lượng cao, các đánh giá hệ thống về
RCT hoặc RCT với nguy cơ sai số rất thấp |
| 1+ | Các phân tích tổng hợp được tiến hành tốt, các đánh giá hệ thống
hoặc RCT với nguy cơ sai số thấp |
| 1– | Các phân tích tổng hợp, các đánh giá hệ thống hoặc RCT có nguy cơ
sai số cao |
|
2++ |
Các đánh giá có hệ thống chất lượng cao về nghiên cứu bệnh chứng hoặc đoàn hệ.
Các nghiên cứu đoàn hệ hoặc bệnh chứng chất lượng cao với nguy cơ gây nhiễu hoặc sai số rất thấp và khả năng mối quan hệ là quan hệ nhân quả ở mức cao. |
|
2+ |
Các nghiên cứu đoàn hệ hoặc bệnh chứng được tiến hành tốt với nguy cơ gây nhiễu hoặc sai số vừa phải và khả năng mối quan hệ là
quan hệ nhân quả ở mức vừa phải. |
|
2– |
Các nghiên cứu bệnh chứng hoặc nghiên cứu đoàn hệ có nguy cơ gây nhiễu hoặc sai số cao và nguy cơ đáng kể là mối quan hệ không
có quan hệ nhân quả. |
| 3 | Các nghiên cứu không phải nghiên cứu phân tích, ví dụ: báo cáo ca
bệnh, báo cáo hàng loạt ca bệnh. |
| 4 | Ý kiến chuyên gia. |
Bảng 1. Định nghĩa mức độ mạnh của chứng cứ [3].
Chiến lược tìm kiếm thông tin
Các tác giả đã tìm kiếm bằng những từ khóa trên các cơ sở dữ liệu của PubMed và Cochrane để tìm các nghiên cứu và tổng quan hệ thống được xuất bản cho đến ngày 1 tháng 1 năm 2020. Chỉ các bài báo về các nghiên cứu ở bệnh nhân người lớn được xuất bản bằng tiếng Anh hoặc với phần tóm tắt bằng tiếng Anh mới được xem xét. RCT, phân tích tổng hợp và đánh giá hệ thống cũng được tìm kiếm thủ công cho các nghiên cứu không có trong tìm kiếm cơ sở dữ liệu ban đầu.
Chiến lược phân tích tổng hợp
Về chủ đề đang nói đến trong guideline này không có dữ liệu nào được thực hiện bằng cách phân tích tổng hợp bài bản.
Chất lượng của các chứng cứ
Việc phân loại tài liệu thành các cấp độ bằng chứng được thực hiện theo hệ thống thang điểm SIGN, như được minh họa trong Bảng 1.
Độ mạnh của chứng cứ và phân loại các khuyến nghị
Mức độ của chứng cứ được chuyển sang các khuyến cáo, từ thiết kế nghiên cứu và chất lượng nghiên cứu cũng như tính nhất quán và tính phù hợp với lâm sàng (bảng 3) [3]. Trong đó, mức khuyến nghị thấp nhất tương ứng với kinh nghiệm thực hành lâm sàng (GPP) dựa trên ý kiến chuyên gia và phản ánh quan điểm đồng thuận của các chuyên gia. Như trong các khuyến cáo khác của ESPEN [8], phương pháp tiếp cận này phản ánh những cố gắng, nỗ lực đưa ra các khuyến nghị tốt nhất có thể trên cơ sở các dữ liệu có sẵn và kinh nghiệm lâm sàng của các chuyên gia, bởi do dữ liệu từ các nghiên cứu RCT không có sẵn hoặc không đầy đủ. Các khuyến nghị được xây dựng mức độ dưới dạng “mạnh” (“sẽ”) hoặc “có điều kiện” (“nên/có thể”) hoặc không nên can thiệp, dựa trên sự cân nhắc giữa lợi ích và nguy cơ của các can thiệp (bảng 3) [3]. Trong trường hợp không thống nhất, các khuyến nghị dựa trên cả bằng chứng có sẵn và dựa trên đánh giá của các chuyên gia, bao gồm tính nhất quán, mức độ liên quan lâm sàng và tính hợp lệ của chứng cứ [8]. Các khuyến nghị được phân loại theo độ mạnh của sự đồng thuận (bảng 4) [3].
Bảng 3. Định nghĩa về độ mạnh, đáng tin cậy của khuyến cáo
| A | Ít nhất một phân tích tổng hợp, đánh giá hệ thống hoặc RCT được xếp hạng là 1++ và áp dụng trực tiếp cho quần thể mục tiêu; hoặc một cơ sở bằng chứng chủ yếu bao gồm các nghiên cứu được đánh giá là 1+, áp dụng trực tiếp cho quần thể mục tiêu và chứng minh
tính nhất quán tổng thể của các kết quả. |
| B | Một cơ sở bằng chứng bao gồm các nghiên cứu được đánh giá là 2++, áp dụng trực tiếp cho quần thể mục tiêu; hoặc một cơ sở bằng chứng bao gồm các nghiên cứu được đánh giá là 2+, áp dụng trực tiếp cho quần thể mục tiêu và chứng minh tính nhất quán tổng thể của các kết quả; hoặc chứng minh tính nhất quán tổng thể của các kết quả; hoặc bằng chứng ngoại suy từ các nghiên cứu được xếp hạng là
1++ hoặc 1+ |
| 0 | Bằng chứng cấp độ 3 hoặc 4; hoặc bằng chứng ngoại suy từ các
nghiên cứu được xếp hạng là 2++ hoặc 2+ |
| GPP | Điểm thực hành tốt/Đồng thuận của chuyên gia: Đề xuất thực hành lâm sàng tốt nhất dựa trên kinh nghiệm lâm sàng của nhóm chuyên
gia phát triển khuyến cáo. |
Bảng 4. Phân loại mức độ đồng thuận
| Đồng thuận mạnh | Đồng ý > 90% số chuyên gia tham dự |
| Đồng thuận | Đồng ý > 75 – 90% số chuyên gia tham dự |
| Thỏa thuận đa số | Đồng ý > 50 – 75% số chuyên gia tham dự |
| Không đồng thuận | Đồng ý < 50% số chuyên gia tham dự |
Quy trình đồng thuận
Nhóm chuyên gia đã chuẩn bị một dự thảo hướng dẫn với tổng số 32 khuyến nghị và tám công bố được cả nhóm và Ban biên tập của ESPEN chấp thuận, sau đó là bước bắt đầu của thủ tục đồng thuận, bằng cách cung cấp bản thảo cho các thành viên ESPEN với lần đầu tiên bỏ phiếu trực tuyến diễn ra giữa khoảng thời gian từ ngày 21/02 cho đến ngày 15/03/2020. Kết quả của cuộc bỏ phiếu trực tuyến này là sự đồng thuận mạnh (đồng thuận > 90%) đối với 26 trong số các khuyến nghị và bảy trong số các công bố và sự đồng thuận (đồng thuận > 75% – 90%) đối với sáu trong số các khuyến nghị và một công bố. Phản hồi thu được trong cuộc bỏ phiếu trực tuyến được sử dụng để sửa đổi và cải thiện các đề xuất nhằm đạt được mức độ đồng thuận cao hơn tại cuộc họp đồng thuận cuối cùng. Do đại dịch COVID-19, một Hội nghị đồng thuận theo kế hoạch đã bị hủy bỏ và được thay thế bằng một cuộc bỏ phiếu trực tuyến lần thứ hai, trong đó các khuyến nghị và công bố có mức đồng thuận bằng hoặc thấp hơn 90% và những nội dung có thay đổi đáng kể do nhận xét của cuộc bỏ phiếu trực tuyến đầu tiên, được bình chọn lại một lần nữa. Lần bình chọn trực tuyến lần 2 diễn ra vào giữa khoảng thời gian từ ngày 15/05 cho đến ngày 07/06/2020. Chín khuyến nghị và một công bố đã được đưa vào cuộc bỏ phiếu trực tuyến lần thứ hai. Bốn khuyến nghị và công bố đạt mức đồng thuận > 90% (đồng thuận mạnh), năm khuyến nghị đạt mức đồng thuận > 75 – 90% (đồng thuận).
Định nghĩa và những thuật ngữ
Tất cả các định nghĩa và thuật ngữ được sử dụng trong khuyến cáo hiện tại phù hợp với thuật ngữ ESPEN khuyến nghị gần đây [9].
Liệu pháp dinh dưỡng y học bao gồm việc sử dụng các chế phẩm bổ sung dinh dưỡng đường uống, đường tiêu hóa (EN) và tĩnh mạch (PN), và thay thế thuật ngữ “dinh dưỡng nhân tạo”.
Cân nặng thực tế là trọng lượng cơ thể đo được trong thời gian nằm viện; cân nặng lý tưởng là trọng lượng liên quan đến chiều cao để có chỉ số khối cơ thể (BMI) là 23 kg/m2; cân nặng hiệu chỉnh thường được sử dụng ở người béo phì và được tính bằng: (trọng lượng cơ thể thực tế – trọng lượng cơ thể lý tưởng)x0.33 + cân nặng lý tưởng. Thông qua bài viết này, cân nặng tham chiếu được sử dụng là trọng lượng khô của cơ thể trước khi nhập viện đối với bệnh nhân bình thường và thừa cân. Đối với bệnh nhân béo phì, thì cân nặng lý tưởng để đạt BMI = 25 kg/m2 nên được xét đến.
Dinh dưỡng với năng lượng đầy đủ được định nghĩa là khi cung cấp 70- 110% so với mục tiêu năng lượng hay nhu cầu; nuôi dưỡng kém là khi năng lượng < 70% so với nhu cầu và nuôi dưỡng thừa là khi năng lượng nạp vào > 110% so với nhu cầu. Nuôi ăn dinh dưỡng là việc cung cấp tối thiểu các chất dinh dưỡng để bảo tồn chức năng bình thường của biểu mô ruột và ngăn chặn sự chuyển vị của vi khuẩn.
Chế độ ăn ít protein hoặc điều trị dinh dưỡng bảo tồn đối với bệnh nhân CKD hoặc AKI/AKD là kiểm soát protein nạp vào ở mức ≤ 0.7 g/kg/ngày.
Các định nghĩa sau đây được trình bày chi tiết trong Bảng 5-7. AKI là sự giảm đột ngột độ lọc cầu thận (GFR), biểu hiện rõ ràng bằng sự gia tăng creatinin huyết thanh hoặc thiểu niệu trong vòng 48 giờ đến 7 ngày, với mức độ nghiêm trọng (giai đoạn) của AKI được xác định bằng mức độ nghiêm trọng của sự gia tăng creatinin huyết thanh hoặc thiểu niệu [4]. Hiện không có tiêu chí được chấp thuận cho các dấu hiệu tổn thương thận trong trường hợp AKI, như khi được định nghĩa cho CKD (ví dụ: protein niệu). Người ta thường chấp nhận rằng tiêu chuẩn về lượng nước tiểu cho AKI chỉ áp dụng trong các đơn vị ICU, trong khi việc xác định AKI và mức độ nghiêm trọng của nó từ thời điểm thay đổi nồng độ creatinin huyết thanh nói chung được coi là chấp nhận được ở tất cả các cơ sở lâm sàng khác. AKI được phân loại thành 3 giai đoạn (bảng 6), dựa trên khuyến cáo của KDIGO [4]. AKD theo định nghĩa bao gồm cả AKI nhưng cũng bao gồm các rối loạn được đặc trưng bởi các dấu hiệu tổn thương thận, chẳng hạn như tiểu máu, mủ hoặc tắc nghẽn đường tiết niệu, trong đó tốc độ giảm GFR không nhanh như ở AKI. Chẩn đoán AKD bao gồm các dấu hiệu tổn thương thận hoặc giảm eGFR < 60ml/phút/1.73m2 da ≤ 3 tháng và không phân loại mức độ nặng [6]. Dường như AKD không có AKI phổ biến hơn AKI. CKD được định nghĩa dựa trên sự mất dần dần chức năng của thận và/hoặc sự hiện diện của các dấu hiệu và/hoặc bằng chứng hình ảnh học/mô học của bệnh thận (ví dụ: protein niệu, siêu âm thận gợi ý bệnh lý thận, sinh thiết thận cho kết quả bệnh lý, v.v…) kéo dài theo năm tháng. CKD trong giai đoạn ban đầu hầu như luôn không có triệu chứng và thường được phát hiện trên xét nghiệm máu định kỳ bằng cách tăng creatinin huyết thanh hoặc sự hiện diện của protein/máu trong nước tiểu [5]. Các giai đoạn của CKD được đề cập trong bảng 7. Suy chức năng thận – KF, đặc trưng cho giai đoạn 5 của CKD, có hoặc không có liệu pháp thay thế thận – KRT. Cần phải hiểu rằng trong nhiều trường hợp, AKI/AKD có thể xảy ra trên tình trạng CKD trước đó (AKI/AKD trên nền CKD).
Bảng 5. Định nghĩa của KDIGO về AKI (tổn thương thận cấp), AKD (Bệnh thận cấp tính) và CKD (bệnh thận mạn tính)
| Tổn thương thận cấp – Acute Kidney Injury (AKI) | ≤ 7 ngày | Giảm đột ngột chức năng thận xảy ra trong khoảng thời gian hàng giờ – ngày (dưới 7 ngày)
Tiêu chuẩn:
|
| Bệnh thận cấp tính – Acute Kidney Disease (AKD) | 7 ngày – 3 tháng | Tổn thương cấp tính hoặc bán cấp tính và/hoặc mất chức năng thận xảy ra trong khoảng thời gian từ 7 đến 90 ngày sau khi xảy ra AKI. |
| Bệnh thận mạn tính – Chronic Kidney Disease (CKD) | > 3 tháng | Bất thường về cấu trúc hoặc chức năng của thận ≥ 90 ngày có hoặc không giảm eGFR
Tiêu chuẩn:
|
Bảng 6. Phân độ của KDIGO về tổn thương thận cấp
| Acute Kidney Injury |
Serum Creatinine |
Urine Output |
| Stage 1 | 1.5 – 1.9mg/dLa x baseline or ≥ 0.3mg/dLa above baseline | < 0.5ml/kg/h for 6-12h |
| Stage 2 | 2.0 – 2.9mg/dLa x baseline | < 0.5ml/kg/h for > 12h |
|
Stage 3 |
≥ 3.0mg/dLa x baseline, ≥ 4.0mg/dLa, or initiation of renal replacement therapy | < 0.3ml/kg/h of anuria for ≥ 12h |
Đổi đơn vị sang µmol/L, nhân với 88.4
Bảng 7. Phân độ của KDIGO về bệnh thận mạn
Các khía cạnh tổng quát (Non-Pico Question)
Tác động của AKI/AKD và CKD lên sự trao đổi cơ chất ?
Tuyên bố 1: Suy giảm chức năng thận có tác động tiêu cực đến quá trình chuyển hóa carbohydrate, protein và lipid gây ra tác động tiền viêm và có tác động chính đến hệ thống chống oxy hóa
Mức độ đồng thuận: đồng thuận mạnh (100%)
Bàn luận:
Suy giảm nghiêm trọng chức năng thận (giảm độ lọc cầu thận), đặc biệt là AKI/AKD và các giai đoạn về sau của CKD diễn tiến đến KF, không chỉ ảnh hưởng đến chuyển hóa nước, chất điện giải và thăng bằng toan kiềm mà còn tạo ra những thay đổi toàn bộ trong “nội môi”, cùng với những thay đổi rõ rệt về chuyển hóa protein, acid amin, carbohydrate và lipid [10]. Ngoài ra, nó thúc đẩy các hoạt động tiền viêm và gây ra tác động tiêu cực đến quá trình chống oxy hóa. AKI/AKD, đặc biệt là trong Hồi sức tích cực – ICU, hiếm khi đại diện cho các quá trình bệnh lý đơn thuần. Những thay đổi về chuyển hóa ở những bệnh nhân này được nhận định là do bệnh nền và/hoặc bệnh lý đi kèm gây ra, bởi sự rối loạn chức năng cơ quan cũng như bị ảnh hưởng bởi cách thức và cường độ của liệu pháp thay thế thận – KRT [10]. Các bất thường về chuyển hóa nghiêm trọng liên quan đến AKI/AKD cụ thể như sau:
- Dị hóa protein
- Thay đổi chuyển hóa của các acid amin
- Đề kháng insulin ngoại vi
- Giảm phân giải lipid và làm giảm quá trình thanh thải chất béo
- Sự suy yếu của hệ thống chống oxy hóa
- Khởi đầu tình trạng viêm
- Suy giảm miễn dịch
Dị hóa protein là dấu hiệu chuyển hóa của AKI/AKD, đặc biệt là trong tình trạng bệnh nặng tại ICU. Sự trao đổi chất có lúc bất thường và không giống nhau của các acid amin, một số acid amin không thiết yếu (như là tyrosine) trở nên cần thiết một cách có điều kiện và những thay đổi của các acid amin bên trong và bên ngoài màng tế bào, cũng như việc sử dụng các acid amin ngoại sinh. Tình trạng tăng đường huyết, do đề kháng insulin ở ngoại vi và do kích hoạt quá trình tân tạo glucose ở gan. Ngược lại với tình trạng ở những bệnh nhân CKD ổn định và những người khỏe mạnh, sự gia tăng hình thành glucose không bị ảnh hưởng bởi sự cung cấp chất dinh dưỡng bên ngoài. Đề kháng insulin, được định nghĩa là tình trạng tăng đường huyết mặc dù nồng độ insulin cao, điều này có thể liên quan đến tăng nguy cơ biến chứng ở những bệnh nhân nặng với AKI/AKD; thay đổi trong chuyển hóa lipid diễn ra và đặc trưng bởi tăng triglycerid máu do ức chế phân giải lipid. Sau cùng có thể dẫn đến giảm thanh thải các hạt chất béo ngoại sinh sau khi sử dụng lipid đường tĩnh mạch hoặc đường tiêu hóa [10].
Thêm vào tình trạng đó là tình trạng tăng đáp ứng viêm và khả năng miễn dịch bị suy giảm. Nồng độ trong huyết tương của các vitamin tan trong nước bị giảm đi và sự hoạt hóa của vitamin D bị suy giảm, góp phần gây ra cường cận giáp thứ phát. Hậu quả là các Vitamin E, A cùng với Selen sẽ giảm thấp và có suy giảm chức năng rõ rệt của hệ thống chống oxy hóa.
Cần nói thêm rằng với tình trạng CKD đã có từ trước, đặc biệt là ở hầu hết các giai đoạn sớm, có thể đã gây ra các mức độ khác nhau của thay đổi chuyển hóa bao gồm tình trạng oxy hóa hệ thống và đáp ứng viêm ở mức thấp. Chức năng thận ngày càng tồi tệ hơn ở bệnh nhân CKD (cũng như là AKI/AKD trên nền CKD) có thể dẫn đến những thay đổi về chuyển hóa thậm chí còn tồi tệ hơn và hậu quả là những thay đổi trong hệ cơ xương, mô mỡ và thành phần cơ thể.
Có phải tình trạng AKI/AKD hay CKD là một yếu tố nguy cơ độc lập của suy dinh dưỡng ?
Tuyên bố 2: AKI/AKD và/hoặc CKD có hoặc không tình trạng suy giảm chức năng thận làm tăng nguy cơ suy dinh dưỡng bởi nó gây ra tình trạng rối loạn chuyển hóa và giảm dung nạp các chất dinh dưỡng.
Mức đồng thuận: đồng thuận mạnh (100%)
Bàn luận:
Cơ chế bệnh sinh của suy dinh dưỡng ở bệnh nhân nhập viện với AKI/AKD và/hoặc CKD có hoặc không suy giảm chức năng thận (KF) rất phức tạp và liên quan đến nhiều yếu tố và cơ chế khác nhau trên từng cá thể bệnh nhân được xét đến [10,11]. Trong trường hợp AKI/AKD hoặc AKI/AKD trên nền CKD, đặc biệt là trong ICU, sự mất cấp tính chức năng cân bằng nội môi của thận đóng một vai trò trung tâm trong việc làm cho rối loạn chuyển hóa tồi tệ hơn, là điển hình của tình trạng bệnh nặng (Hình 1) [10]. Trọng tâm của quá trình này là sự đề kháng insulin [12], thường được quan sát thấy ở bệnh nhân AKI và liên quan chặt chẽ đến nguy cơ làm tăng tỷ lệ tử vong [13], và phóng thích các chất trung gian tiền viêm/oxy hóa vào hệ tuần hoàn [14]. Trên thực tế, AKI hiện được xem là hệ quả của quá trình viêm khu trú ở thận ban đầu, sau đó nhanh chóng lan sang các cơ quan/hệ thống khác [15]; khi chuyển hóa carbohydrate, protein và lipid cùng bị thay đổi sẽ làm mất cân bằng nội môi, đây là 1 trong những biểu hiện hệ thống của hội chứng viêm “liên quan đến” thận [16]. Hầu hết các cơ chế dẫn đến suy dinh dưỡng nêu trên cũng có thể được dùng cho những bệnh nhân nội viện mắc bệnh cấp tính với AKI/AKD trên nền CKD hoặc KF không nằm tại ICU. Thực tế, trên những bệnh nhân CKD có hoặc không suy giảm chức năng thận (KF) có suy dinh dưỡng hầu hết đặc trưng bởi tình trạng mất protein và năng lượng dự trữ do rối loạn chuyển hóa [17]. Vài yếu tố lâm sàng và chuyển hóa (bảng 8) cũng có thể gây ảnh hưởng xấu đến tình trạng dinh dưỡng và khối nạc cơ thể [18,19], dẫn đến suy yếu [20]. Ngoài việc nạp vào không đủ chất dinh dưỡng do tự ý, một số yếu tố khác như nhiễm toan chuyển hóa, đề kháng insulin, viêm mạn tính, thay đổi hệ vi sinh vật đường ruột (rối loạn sinh học đường ruột), nhiễm trùng và oxy hóa do stress cũng góp phần vào tiến trình suy dinh dưỡng. Ngoài ra, các yếu tố liên quan đến bản thân việc điều trị CKD, chẳng hạn như những hạn chế về chế độ ăn uống không phù hợp hoặc chạy thận nhân tạo, có thể đóng một vai trò nào đó. Và sau cùng là tạo nên vòng xoắn bệnh lý giữa suy dinh dưỡng và các biến chứng của nó (Hình 1) [17].
![Hướng dẫn đặc biệt về dinh dưỡng lâm sàng ở bệnh nhận có bệnh thận cấp tính hoặc bệnh thận mạn tính 4 Hình 1. Vòng xoắn bệnh lý của Suy dinh dưỡng trên bệnh nhân CKD [17].](https://www.vnras.com/drug/wp-content/uploads/2022/08/huong-dan-dac-biet-ve-dinh-duong-lam-sang-o-benh-nhan-co-benh-than-cap-tinh-hoac-benh-than-man-tinh-anh-1.jpg) Hình 1. Vòng xoắn bệnh lý của Suy dinh dưỡng trên bệnh nhân CKD [17].Bảng 8. Nguyên nhân và cơ chế gây suy dinh dưỡng protein năng lượng [17].
Hình 1. Vòng xoắn bệnh lý của Suy dinh dưỡng trên bệnh nhân CKD [17].Bảng 8. Nguyên nhân và cơ chế gây suy dinh dưỡng protein năng lượng [17].
|
Chán ăn:
Rối loạn điều tiết các chất trung gian kích thích ăn Kích thích acid amin vùng dưới đồi Nhiễm độc ure Hạn chế trong chế độ ăn không phù hợp Bệnh lý đường tiêu hóa Sa sút tinh thần Gặp khó khăn trong chuẩn bị thức ăn Điều kiện kinh tế – xã hội thấp |
| 2. Tăng dị hóa | Tăng tiêu hao năng lượng
Tình trạng viêm mạn tính Tăng tiết các cytokine tiền viêm Thay đổi chuyển hóa của adiponectin và resistin Thay đổi hormon Đề kháng insulin Tăng hoạt động của glucocorticoid |
| 3. Toan chuyển hóa | Tăng phân giải protein, oxy hóa BCAA, đề kháng insulin và IGF-1 |
| 4. Giảm hoạt động thể
lực |
Giảm sức cơ, giảm vận động tự chủ, giảm hiệu suất vận động |
| 5. Giảm đồng hóa | Giảm dung nạp dinh dưỡng (ăn kém)
Đề kháng insulin, GH/IGF-1 Thiếu hụt Testosterone Hormon tuyến giáp giảm |
| 6. Bệnh nền và lối sống | Bệnh nền (đái tháo đường, suy tim, bệnh tim thiếu máu cục bộ, bệnh mạch máu ngoại vi)
Lối sống tĩnh tại, ít vận động |
| 7. Lọc máu | Mất acid amin và protein do thẩm tách
Các quá trình viêm liên quan đến lọc máu Tăng dị hóa do lọc máu Mất chức năng thận còn lại |
KRT là gì và những phương thức nào hiện được sử dụng trong bệnh nhân nội viện với AKI/AKD hoặc CKD có giảm chức năng thận (KF) ?
Thuật ngữ KRT (Kidney Replacement Therapy) hiện được sử dụng để bao gồm tất cả các các phương thức được sử dụng để thay thế chức năng thận (đặc biệt là chức năng lọc hoặc chức năng của cầu thận) ở bệnh nhân AKI/AKD hoặc CKD với KF. KRT cho khả năng thanh thải các chất tan (như là creatinine, urê, chất điện giải, và các “độc tố urê huyết”) tùy thuộc về trọng lượng phân tử của chúng, loại bỏ dịch dư thừa và duy trì trạng thái thăng bằng toan kiềm và cân bằng điện giải. Tuy nhiên, chức năng bài tiết và tái hấp thu của ống thận cũng như chức năng nội tiết của thận bình thường đều không được thay thế bằng KRT được. Hơn nữa, độ thanh thải chất tan, ngay cả trong trường hợp KRT tối ưu, cũng thấp hơn đáng kể so với thận bình thường, vì nó chỉ đạt khoảng 10- 20% độ thanh thải sinh lý của các chất như urê hoặc creatinin, và thậm chí ít hơn trong trường hợp chất tan có khối lượng phân tử lớn hơn. Cuối cùng, một số chất có lợi, và đặc biệt là một số chất dinh dưỡng đa lượng hoặc vi lượng phân tử thấp, như acid amin hoặc vitamin tan trong nước cũng có thể bị mất, vì chúng dễ dàng bị loại bỏ trong quá trình KRT. Các nguyên tắc cơ bản của việc loại bỏ chất tan bằng KRT là khuếch tán và đối lưu (Hình 2). Sự khuếch tán là sự di chuyển của các chất tan từ một khu vực có nồng độ cao đến khu vực có nồng độ thấp qua màng bán thấm. Sự dịch chuyển được tiếp tục cho đến khi đạt được trạng thái cân bằng. Trong trường hợp của đối lưu, dung môi (ví dụ: nước) mang các chất hòa tan qua màng (lực kéo chất tan); chất lỏng được loại bỏ bằng đối lưu (một quá trình được gọi là siêu lọc) cùng với các chất tan. Màng bán thấm có thể là tự nhiên, nếu là nhân tạo thì máu của bệnh nhân được bơm bằng máy trong bộ lọc theo chu trình bên ngoài cơ thể. Trong trường hợp còn lại, màng duy nhất có sẵn cho mục đích này là màng bụng và dòng máu được cấp bởi hệ vi tuần hoàn màng bụng. Do chênh lệch thẩm thấu tại các mao mạch, dịch sẽ được loại bỏ khi đưa vào khoang phúc mạc các dịch ưu trương (glucose ưu trương hoặc icodextrin). Dựa trên những nguyên tắc này, KRT có thể được chia thành
KRT ngoài cơ thể (Hemodialysis – Chạy thận nhân tạo hay Thẩm tách máu và/hoặc Hemofiltration – Siêu lọc) và KRT trong cơ thể (thẩm phân phúc mạc, tức PD). Khuếch tán và đối lưu thường được kết hợp và tiến hành đồng thời cả trong chạy thận nhân tạo và trong lọc màng bụng – PD. Chạy thận nhân tạo – Hemodialysis (thường mỗi lần khoảng 4 giờ, ba lần một tuần) là phương pháp điều trị tiêu chuẩn cho bệnh nhân CKD ở giai đoạn suy chức năng phải điều trị thay thế thận, trong khi các bệnh nhân lọc màng bụng chỉ chiếm một phần nhỏ. Hiện nay, có nhiều phương pháp thay thế khác trên những bệnh nhân nặng có AKI/AKD. Tất cả phương pháp trên đều dựa trên sự khuếch tán hoặc đối lưu hoặc sự kết hợp của cả hai, nhưng hiệu quả (độ thanh thải) và thời gian sẽ khác nhau đáng kể ở từng phương pháp. Do đó, việc lựa chọn phương pháp điều trị phụ thuộc vào đặc điểm của bệnh nhân và chủ yếu dựa trên đánh giá lâm sàng về nhu cầu lọc máu (ví dụ tốc độ dị hóa), lượng dịch cần loại bỏ và tình trạng huyết động của bệnh nhân. Chỉ một số ít bệnh nhân nặng với AKI/AKD có thể lọc được với thời gian tương đối ngắn, điển hình là lịch chạy thận nhân tạo thông thường được sử dụng thường quy cho bệnh nhân KF. Các phương thức KRT kéo dài hơn (từ 8 đến 12 giờ một ngày đến 24 giờ một ngày, tức là liên tục) thường phù hợp hơn nếu xét đến huyết động. Ở các nước phương Tây và Mỹ, PD thường không được chỉ định cho bệnh nhân nặng trong ICU. Do đó, trong trường hợp bệnh nhân nặng tại ICU thì KRT ngoài cơ thể được xem là tiêu chuẩn vàng, và thường được phân loại dựa trên thời gian của nó [21]. Mỗi phương thức của KRT tại ICU (ngắt quãng, ngắt quãng kéo dài và lọc máu liên tục) đều có những ưu và nhược điểm, tùy thuộc vào từng bệnh nhân. Đối với các bệnh nhân AKI/AKD không nằm tại ICU, chạy thận nhân tạo ngắt quãng là phương thức KRT được sử dụng phổ biến nhất.
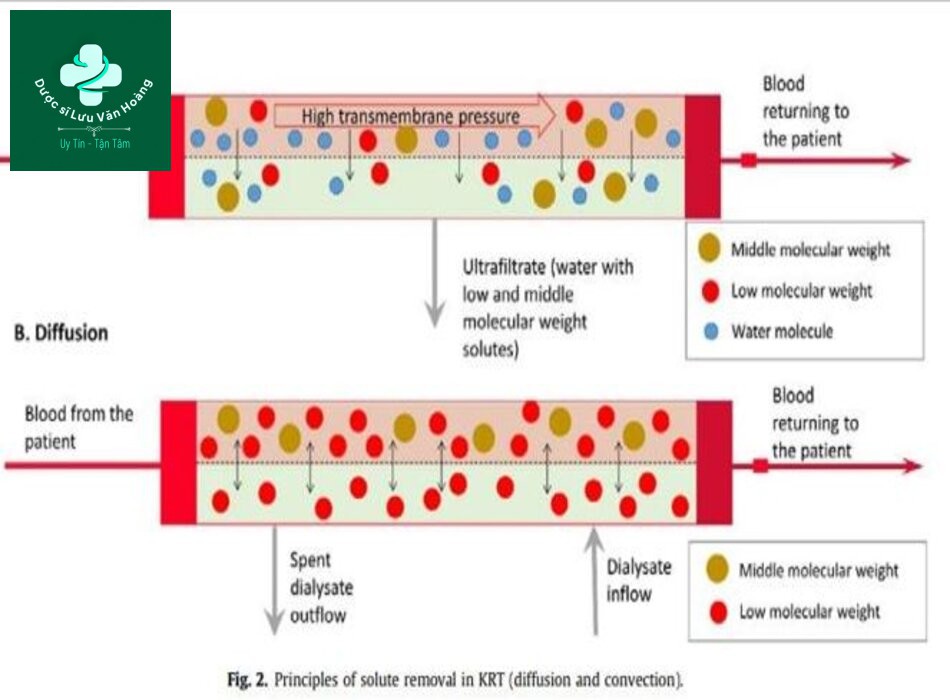 Hình 2. Nguyên tắc của khuếch tán và đối lưu trong KRT.
Hình 2. Nguyên tắc của khuếch tán và đối lưu trong KRT.
Các phương thức lọc của KRT
Chạy thận nhân tạo ngắt quãng là phương thức KRT ngoài cơ thể phổ biến nhất ở bệnh nhân CKD tiến triển trong giai đoạn KF, nhưng cũng có thể chỉ định trên bệnh nhân AKI/AKD hoặc AKI trên CKD miễn là tình trạng huyết động ổn định. Chạy thận nhân tạo thường ba lần một tuần trong khoảng 3 – 4 giờ/lần. Lọc máu ngắt quãng cũng được chỉ định ở những bệnh nhân KF đang KRT mạn tính mà dễ bị tụt áp*, với cơ chế đối lưu. Tuy nhiên, trong hầu hết các trường hợp này*, chạy thận nhân tạo và lọc máu được kết hợp trong cùng một phiên KRT (hemodiafiltration). Trong ICU, cách lọc kéo dài được ưu tiên hơn, như lọc máu liên tục CKRT (hay CRRT) hoặc Lọc máu ngắt quãng kéo dài (Prolonged Intermittment Kidney Replacement Therapy – PIKRT, hay PIRRT). Thuật ngữ PIKRT (hay PIRRT) là sự kết hợp ưu điểm của cả 2 phương pháp KRT ngắt quãng và liên tục trên cơ sở thời gian thực hiện và tần suất điều trị [21].
Ưu điểm của các phương thức KRT kéo dài như CKRT (CRRT) hay PIKRT (PIRRT) đó là giúp cho tình trạng huyết động ổn định hơn, giảm loại bỏ các chất tan, đáp ứng với rút dịch tốt hơn, do đó ưu tiên chỉ định trên bệnh nhân AKI có tình trạng huyết động không ổn định [22]. Và lợi ích của 2 phương pháp này là như nhau.
Lọc màng bụng
Ngoài các phương pháp KRT ngoài cơ thể nói ở trên thì lọc màng bụng (PD) được chỉ định ở một số bệnh nhân nội viện. Ở các nước phương Tây, bệnh nhân tại ICU hiếm khi được làm PD, nhưng PD thường gặp ở các bệnh nhân nhập viện mà trước đó được lọc màng bụng liên tục (CAPD, một phương thức PD thủ công hàng ngày của bệnh nhân tại nhà) hoặc thẩm phân phúc mạc tự động (APD, một phương thức PD, sử dụng bằng một máy đơn giản, thường ở nhà và vào ban đêm). PD dựa trên sự trao đổi chất tan giữa các mao mạch phúc mạc với dịch thẩm tách và sau đó được dẫn lưu ra ngoài. Dung dịch PD chứa glucose hoặc một loại đường khác để loại bỏ dịch. Tuy nhiên, dextrose được hấp thụ theo thời gian, do đó có thể gây ra cân bằng glucose dương khoảng 400 kcal/ngày.
Các khuyến cáo
Chỉ định dinh dưỡng:
Điều trị với dinh dưỡng có cải thiện kết cục điều trị không và bệnh nhân được lợi ích gì từ điều trị dinh dưỡng ?
Khuyến cáo 1 (Grade GPP): Nên quan tâm đến dinh dưỡng lâm sàng cho các bệnh nhân nội viện có AKI/AKD, AKD trên nền CKD, CKD có hoặc không KF
Mức đồng thuận: mạnh (100%)
Khuyến cáo 2 (Grade GPP): Dinh dưỡng lâm sàng nên bắt đầu sau 48 nhập viện trên bệnh nhân ICU có AKI/AKD, AKI trên nền CKD và CKD có hoặc không KF
Mức đồng thuận: mạnh (100%)
Bàn luận:
Bệnh nhân suy thận mạn, đặc biệt là có suy chức năng thận đang lọc thận mạn tính hoặc không, đều có nguy cơ rất cao rối loạn dinh dưỡng tiến triển [11], giảm dần protein và năng lượng dự trữ [23], với tốc độ tăng cùng với mức độ suy chức năng thận [23]. Trong một phân tích tổng hợp, tỷ lệ suy dinh dưỡng theo công cụ đánh giá tình trạng dinh dưỡng SGA (Subjective Global Assessment) hoặc thang điểm MIS (Malnutrition-inflammatory Score) chiếm tỉ lệ từ 11 – 54% ở bệnh nhân CKD không lọc máu giai đoạn 3-5 và từ 28 – 54% ở bệnh nhân chạy thận nhân tạo mạn tính [24]. Trên cơ sở đó, cho thấy rằng tất cả các bệnh nhân nội trú đều có nguy cơ suy dinh dưỡng. Vì lý do đạo đức, không có nghiên cứu nào đề cập trực tiếp đến ảnh hưởng của việc bỏ đói bệnh nhân KF nội viện. Các dữ liệu về hỗ trợ dinh dưỡng trong AKI rất khan hiếm và chủ yếu ở dạng các nghiên cứu chất lượng thấp từ những năm 1980, được tóm tắt trong các đánh giá gần đây [10,25,26]. Suy chức năng thận không gây ảnh hưởng nhiều đến nhu cầu dinh dưỡng, mà chủ yếu do khởi phát bệnh nền và biến chứng dẫn đến rối loạn chuyển hóa dinh dưỡng, do đó khuyến nghị về dinh dưỡng lâm sàng cho bệnh nhân AKI, CKD nặng có KF và bệnh nhân tại ICU là như nhau [8]. Dựa vào các khuyến nghị trước đó của ESPEN [1,2], thời điểm 48 giờ được chọn làm mốc để bắt đầu dinh dưỡng sớm cho bệnh nhân nặng [8,27] và chúng tôi thấy điều này phù hợp cho bệnh nhân AKI/AKD hay CKD có KF tại ICU.
Khuyến cáo 3 (Grade A): Các bệnh nhân AKI/AKD hoặc CKD có hoặc không KF không nguy kịch có tình trạng suy dinh dưỡng, nếu không đạt đủ nhu cầu với chế độ ăn thì cần bổ sung thêm ONS (Oral Nutritional Supplements: dinh dưỡng bổ sung đường miệng)
Mức đồng thuận: mạnh (100%)
Bàn luận:
Các bệnh nhân AKI/AKD hoặc CKD có hoặc không KF nội viện không nguy kịch, dinh dưỡng hỗ trợ được chỉ định trên những bệnh nhân suy dinh dưỡng hoặc có nguy cơ suy dinh dưỡng [1,28,29]. ONS, đặc biệt là những sản phẩm cao năng lượng và giàu protein, nếu được cung cấp hai lần/ngày ít nhất sau ăn 1 giờ có thể bổ sung lên đến 10-12 kcal/kg/ngày và 0.3-0.5g protein/kg/ngày so với lượng mà một bệnh nhân 70 kg tự ăn, do đó dễ đạt được mục tiêu về nhu cầu dinh dưỡng [23]. Theo chúng tôi được biết, không có nghiên cứu nào được công bố về chủ đề này ở những bệnh nhân không nguy kịch nội viện với AKI/AKD hoặc CKD có hoặc không có KF. Tuy nhiên, bằng chứng ở bệnh nhân nội viện có nhiều bệnh nền (được định nghĩa là hai hoặc nhiều bệnh mạn tính đi kèm) cho thấy rằng ONS có thể cải thiện tình trạng dinh dưỡng và chúng tôi suy đoán rằng bằng chứng này cũng có thể áp dụng cho bệnh nhân có AKI/AKD hoặc CKD có hoặc không có KF mà có nhiều bệnh nền đi kèm. Trong một nghiên cứu RCT với 200 bệnh nhân nội viện từ các khoa nội, ONS kết hợp với vật lý trị liệu giúp tăng năng lượng và lượng protein mà không gây ảnh hưởng đến tiêu thụ thực phẩm tại viện, đồng thời duy trì khối nạc trong quá trình phục hồi và ba tháng sau khi xuất viện [30]. Trong một RCT lớn khác (n = 445) bệnh nhân nhập viện, ONS cung cấp cải thiện đáng kể tình trạng dinh dưỡng, đánh giá thông qua albumin huyết thanh, folate hồng cầu, nồng độ vitamin B12, và giảm tần suất nhập viện bất thường (không theo lịch hẹn) trong sáu tháng sau khi xuất viện [31]. Trong nhiều nghiên cứu RCT khác thì ONS cũng cho kết quả tương tự, trong đó ONS giúp cải thiện tình trạng dinh dưỡng (đánh giá bằng trọng lượng cơ thể và chức năng) [32,33], giảm biến chứng [32] và tỉ lệ tử vong [34,35].
Bên cạnh đó, nhiều nghiên cứu RCTs trên bệnh nhân KF ngoại trú cho thấy ONS có thể cải thiện tình trạng dinh dưỡng cũng như chất lượng cuộc sống và hoạt động thể chất [28,36-46]. Trong một nghiên trên bệnh nhân CKD chạy thận nhân tạo với albumin huyết thanh thấp thì việc cung cấp ONS có liên quan đến cải thiện tỷ lệ sống còn [43]. Một thử nghiệm lâm sàng trên bệnh nhân CKD có suy dinh dưỡng đang chạy thận nhân tạo cho thấy ONS tiêu chuẩn giúp cải thiện nồng độ albumin huyết thanh và transthyretin độc lập với tình trạng viêm, và sự gia tăng transthyretin có ảnh hưởng tích cực đến sự sống còn [47].
Khuyến cáo 4 (Grade A): Dinh dưỡng qua đường tĩnh mạch bổ sung cho những bệnh nhân bị suy dinh dưỡng nội viện không nguy kịch với CKD có KF đang chạy thận nhân tạo (Intradialytic Parenteral Nutrition – IDPN) hoặc những bệnh nhân tương tự nếu có nguy cơ suy dinh dưỡng mà không đáp ứng hoặc không dung nạp với ONS hoặc dinh dưỡng qua đường tiêu hóa (Enteral Nutrition – EN).
Mức đồng thuận: mạnh (91.7%) Bàn luận:
IDPN (Intradialytic Parenteral Nutrition) là một phương thức dinh dưỡng qua đường tĩnh mạch (Parenteral Nutrition – PN) chỉ định cho bệnh nhân KF đang chạy thận nhân tạo mạn tính. Nó dựa trên việc sử dụng các chất dinh dưỡng đa lượng và vi lượng ngoài cơ thể trong quá trình chạy thận nhân tạo, ba lần một tuần trong 3 đến 4 giờ [48]. Mặc dù đường tiêu hóa là ưu tiên để bổ
sung dinh dưỡng, thì việc bổ sung dinh dưỡng qua đường tĩnh mạch trong khi chạy thận nhân tạo là an toàn và thuận tiện cho những người không thể dung nạp dinh dưỡng qua đường miệng hoặc đường ruột. Nhiều nghiên cứu, bao gồm một số RCT, cho thấy sự cải thiện dinh dưỡng khi sử dụng IDPN ở bệnh nhân KF đang chạy thận nhân tạo có tình trạng suy dinh dưỡng năng lượng-protein rõ rệt [1,47,49-51]. Do không vượt trội hơn ONS và giới hạn thời gian (chạy thận nhân tạo thường là 4 giờ, ba lần một tuần), IDPN là một lựa chọn hợp lý cho những bệnh nhân không đáp ứng hoặc không thể tiếp cận các phương pháp điều trị khuyến nghị, nhưng việc chỉ định rộng rãi IDPN trước khi tư vấn và ONS là không được khuyến cáo [52].
Khuyến cáo 5 (Grade A): Nếu các bệnh nhân AKI/AKD, CKD, CKD có KF không thể đạt mục tiêu 70% nhu cầu dinh dưỡng bằng đường miệng thì EN*, PN hay EN kết hợp PN sẽ được chỉ định, bất kể tình trạng nặng hoặc không.
Mức đồng thuận: mạnh (95.7%)
Chú thích (*): EN, hay Enteral Nutrition, nghĩa là dinh dưỡng qua đường tiêu hóa, bằng cách đưa thức ăn trực tiếp vào dạ dày hoặc ruột thông qua sonde hoặc đường miệng (uống).
Bàn luận (Khuyến cáo 1-5):
Chỉ định EN nếu lượng ăn vào (có hoặc không ONS) không dung nạp đủ ít nhất 70% nhu cầu hàng ngày [1,8]. Đạt mục tiêu về dinh dưỡng là rất quan trọng trong việc ngăn ngừa sụt cân và mất khối cơ. Tuy nhiên, môi trường chăm sóc tại bệnh viện có nhiều yếu tố có thể gây khó khăn cho việc tự ăn uống của bệnh nhân [53], bao gồm tình trạng chán ăn, chậm làm rỗng dạ dày, khó nuốt. Trong những trường hợp này thì việc chỉ định EN hoặc PN có thể làm tăng lượng dinh dưỡng nạp vào [54,55]. Không có nghiên cứu cụ thể nào về tác dụng của hỗ trợ dinh dưỡng hoặc so sánh EN và PN ở những bệnh nhân nội viện (không phải bệnh nặng) có AKI/AKD, CKD hoặc CKD với KF. Một số RCT đã so sánh tác động của hỗ trợ dinh dưỡng trên kết cục điều trị của những bệnh nhân nội trú tại các khoa Nội. Một phân tích tổng hợp của 27 thử nghiệm lâm sàng gần đây cho thấy việc tăng năng lượng và protein sẽ có lợi đối với cân nặng ở những bệnh nhân có EN khi so với nhóm chứng [56]. Có một số nghiên cứu quan sát đã so sánh ảnh hưởng giữa EN và PN đối với kết cục của bệnh nhân (không phải bệnh nặng) thuộc khối Nội [57]. Trong một nghiên cứu quan sát (với n = 1831) cho thấy dinh dưỡng lâm sàng có liên quan đến giảm nguy cơ biến chứng và nhiễm trùng. Đặc biệt, những bệnh nhân được điều trị EN thì biến chứng do nhiễm trùng và không do nhiễm trùng thấp hơn đáng kể so với những bệnh nhân được điều trị PN [57]. Trong chăm sóc đặc biệt, các bằng chứng cho thấy EN giảm nguy cơ biến chứng hơn so với PN [8]. Bên cạnh đó, một nghiên cứu trên bệnh nhân nặng không suy dinh dưỡng có AKI thì việc trì hoãn PN có ưu điểm hơn khi không dung nạp hoặc không thể sử dụng EN [58,59]. Việc nuôi ăn ban đầu cẩn thận và tăng dần liều lượng giúp phòng ngừa hội chứng nuôi ăn lại, đặc biệt trên những bệnh nhân suy dinh dưỡng nặng hoặc có ăn kém trước và trong khi nhập viện [8].
Đánh giá tình trạng dinh dưỡng
Tất cả các bệnh nhân AKI/AKD và/hoặc CKD nội viện nên được tầm soát suy dinh dưỡng ?
Khuyến cáo 6 (Grade GPP): Tất cả bệnh nhân AKI/AKD và/hoặc CKD có hoặc không có KF nội viện, đặc biệt là bệnh nhân nhập ICU hơn 48 giờ, nên được tầm soát suy dinh dưỡng
Mức đồng thuận: mạnh (95.7%)
Bàn luận:
Bệnh nhân AKI/AKD và/hoặc CKD nội viện được đánh giá tình trạng dinh dưỡng với một số công cụ sàng lọc tình trạng dinh dưỡng hiện có, trong đó bộ công cụ MUST – Malnutrition Universal Screening Tool, có độ nhạy thấp [60], có lẽ do sự phức tạp và nhiều yếu tố tác động của suy dinh dưỡng trên nhóm bệnh nhân này. MUST có thể sàng lọc tình trạng thiếu ăn cấp tính nhưng lại bỏ qua một số yếu tố nguy cơ quan trọng của KF như chán ăn và thiếu hụt dinh dưỡng [61,62]. Bộ công cụ NRS-2002 (Nutritional Risk Screening 2002) có thể đánh giá đầy đủ tình trạng suy dinh dưỡng theo SGA cũng như dự đoán diễn tiến xấu của kết cục điều trị [65,66]. Do chưa rõ về các nghiên cứu so sánh độ tin cậy của các công cụ sàng lọc hiện có ở những bệnh nhân này nên chúng tôi kết luận rằng tất cả các công cụ sàng lọc được coi là có giá trị như nhau, cho đến khi các nghiên cứu so sánh độ tin cậy được tiến hành. Các triệu chứng liên quan đến dinh dưỡng có vai trò quan trọng trong việc dự đoán nguy cơ suy dinh dưỡng trên bệnh nhân thận, và trong số đó thì chán ăn có giá trị tiên lượng cao nhất [67,68]. Gần đây, một công cụ sàng lọc dinh dưỡng mới cho bệnh nhân thận (Renal iNUT – Renal inpatient Nutritional screening Tool) được phát triển dành riêng cho bệnh nhân nội viện với AKI/AKD và hoặc CKD, hoặc CKD với KF trên KRT [60], có độ nhạy và độ đặc hiệu và giá trị tiên đoán dương tốt hơn so với SGA. Ngoài thành phần nền tảng của MUST, Renal iNUT còn bao gồm các câu hỏi về sự thèm ăn, chế độ ăn uống, sử dụng chế phẩm dinh dưỡng bổ sung và các chi tiết về cân nặng của bệnh nhân thận (mục tiêu về cân nặng khô hoặc cân nặng khi không phù). Tuy nhiên, liệu Renal iNut có thể là một công cụ thích hợp để sàng lọc bệnh nhân thận nội viện hay không thì cần được đánh giá thêm.
Đánh giá tình trạng dinh dưỡng trên bệnh nhân AKI/AKD hoặc CKD như thế nào ?
Khuyến cáo 7 (Grade GPP): Cho đến khi một công cụ đánh giá tình trạng dinh dưỡng riêng biệt được chấp thuận, bất kỳ bệnh nhân nội viện nào có AKI/AKD hoặc CKD có hoặc không KF có nguy cơ suy dinh dưỡng nên được đánh giá tổng thể tình trạng dinh dưỡng.
Mức đồng thuận: mạnh (91.3%)
Bàn luận:
Đánh giá tổng thể tình trạng dinh dưỡng bao gồm tiền sử bệnh nhân, ghi nhận về sụt cân không chủ ý hoặc giảm hoạt động thể lực trước khi nhập viện
hoặc nhập ICU, khám sức khỏe, đánh giá tổng quan về thành phần cơ thể, khối cơ và sức cơ.
Chưa có sự thống nhất về áp dụng một công cụ duy nhất để đánh giá tình trạng dinh dưỡng nên chẩn đoán suy dinh dưỡng cần được thực hiện dựa trên lâm sàng và thăm khám [3]. Nhiều công cụ đã được đề xuất để đánh giá tình trạng suy dinh dưỡng ở bệnh nhân nội trú nhưng hầu hết đều có những hạn chế, đặc biệt là khi áp dụng cho bệnh nhân thận [69] và nhất là bệnh nhân trong ICU [10].
Trọng lượng cơ thể và BMI, trừ khi quá thấp (ví dụ: BMI < 18.5 kg/m2), là các công cụ đánh giá tình trạng dinh dưỡng kém hiệu quả trên bệnh nhân nội trú có AKI/AKD, và/hoặc CKD có KF hoặc không. Điều này do việc đo kích thước cơ thể không thể hiện được tình trạng quá tải dịch ở những bệnh nhân này và không thể phân biệt được mỡ từ khối cơ dự trữ [10]. Thừa cân hay béo phì không phải là hiếm ở bệnh nhân AKI hoặc CKD với KF, có tình trạng giảm hoặc mất khối nạc hay khối cơ xương mặc dù có chỉ số BMI bình thường hoặc thừa cân (ví dụ: suy mòn cơ trên nền béo phì) [70,71].
SGA đã được sử dụng khá rộng rãi ở bệnh nhân AKI để chẩn đoán rối loạn dinh dưỡng và dự đoán kết cục xấu [72]. SGA cũng đã được sử dụng để xác định suy dinh dưỡng trên bệnh nhân KF nội viện đang chạy thận nhân tạo mạn tính [73]. Suy dinh dưỡng nặng theo SGA tại ICU cũng liên quan đến tỷ lệ tử vong muộn (sáu tháng sau khi xuất viện) ở bệnh nhân AKI [74]. Mặc dù vậy, SGA không được sử dụng rộng rãi và khó áp dụng trong ICU.
Tuy albumin huyết thanh có độ nhạy như một công cụ sàng lọc và tiên lượng nhưng nó lại không cho thấy được bản chất phức tạp của vấn đề dinh dưỡng trong điều trị bệnh nhân AKI và CKD. Nồng độ albumin là kết quả của quá trình tổng hợp, phân hủy, phân bố và trao đổi giữa bên trong và ngoài thành mạch, cũng như lượng albumin mất đi [75]. Bên cạnh đó, albumin là một chất phản ứng ngược trong giai đoạn cấp, tức là trong giai đoạn bệnh cấp tính sẽ giảm tổng hợp albumin dẫn đến nồng độ trong huyết thanh thấp. Không nên xem xét giá trị albumin một cách đơn độc mà còn phải khám và đánh giá trên lâm sàng thật kỹ lưỡng [76].
Đánh giá khối nạc, khối cơ và sức cơ như thế nào ?
Khuyến cáo 8 (Grade B): Đánh giá thành phần cơ thể nên được ưu tiên hơn các phép đo nhân trắc học khi chẩn đoán và theo dõi suy dinh dưỡng ở bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF.
Mức đồng thuận: mạnh (95.7%)
Bàn luận:
Do những bệnh nhân nặng bị mất khối cơ xương nghiêm trọng và tăng dần trong vài ngày đầu ở ICU [8,77,78] nên việc theo dõi thành phần cơ thể trong thời gian nằm viện là rất quan trọng. Xác định sớm tình trạng mất cơ rất quan trọng vì đây có thể là nguyên nhân chính gây ra chậm cai máy thở và là một yếu tố được sử dụng rộng rãi để tiên lượng về tỷ lệ tử vong và bệnh tật khi nhập viện [79], phục hồi chức năng [80,81] và tàn tật sau khi xuất viện [82,83]. Tuy nhiên, vấn đề chính ở đây là việc thiếu các công cụ tại giường để đánh giá khối cơ, tác động của thừa dịch và sự di chuyển đột ngột của dịch khi sử dụng các công cụ thông thường. Do những hạn chế trên dẫn đến tài liệu nghiên cứu về vai trò của thành phần cơ thể ở bệnh nhân bệnh thận nội viện rất khan hiếm. Một nghiên cứu trên 31 bệnh nhân nặng với AKI bằng phương pháp phân tích trở kháng điện sinh học (Bioelectric Impedance Analysis – BIA) quan sát được: các phép đo được thực hiện sau KRT ghi nhận giảm khoảng 5% khối nạc so với các phép đo được thực hiện trước KRT, cho thấy BIA không đáng tin cậy khi bệnh nhân quá thừa dịch [84]. Trong một nghiên cứu khác, phân tích BIA chỉ đề cập đến tổng lượng dịch và lượng mỡ thừa, nên khó phát hiện được sự thay đổi khối nạc trong cơ thể [85]. Đo hấp thụ tia X năng lượng kép (Dual Energy X-ray Absorptiometry – DEXA), chụp cắt lớp vi tính (CT) và chụp cộng hưởng từ (MRI) được coi là các kỹ thuật tiêu chuẩn tham chiếu để đánh giá khối cơ xương và thành phần cơ thể [86] nhưng không được sử dụng thường xuyên để đánh giá tình trạng dinh dưỡng trong ICU nói riêng hay bệnh nhân nhập viện nói chung [86]. Với độ tin cậy tốt, việc sử dụng siêu âm để đánh giá khối cơ gần đây được nghiên cứu ở những bệnh nhân nhập viện với AKI và CKD có KF đang chạy thận nhân tạo, là một phương pháp thay thế tiềm năng [87,88]. Siêu âm cơ là một kỹ thuật không xâm lấn, dễ áp dụng ngay cả ở những bệnh nhân khó hợp tác, hiệu quả kinh tế, an toàn và không đòi hỏi đội ngũ chuyên trách cũng như không cần tiếp xúc với tia X [87,89-91]. Bên cạnh đó, phương pháp siêu âm cơ dường như ít bị ảnh hưởng khi có hiện tượng dịch di chuyển đột ngột (giữa nội – ngoại bào, giữa mô kẽ và lòng mạch) ở bệnh nhân AKI và bệnh nhân CKD có KF đang chạy thận nhân tạo mạn tính [87,92]. Nhiều nghiên cứu kiểm chứng đã bác bỏ CT ở bệnh nhân AKI nặng, cho thấy không có khác biệt tương quan có ý nghĩa, với độ chính xác có một chút sai lệch nhỏ [88]. Vì thiếu giá trị để xác định khối cơ ở ngưỡng thấp bằng siêu âm, chúng tôi đề xuất siêu âm có giá trị để theo dõi khối cơ trong quá trình phục hồi và để đánh giá hiệu quả của vật lý trị liệu và dinh dưỡng. Chụp CT đã được sử dụng trong ICU để đánh giá khối cơ xương (mức đốt sống L3), nhưng chỉ hữu ích trên những bệnh nhân được chụp CT bụng vì các nguyên nhân khác [93]. Giảm khối cơ, khảo sát bằng CT lúc nhập viện, tiên lượng kéo dài thời gian nằm viện và nguy cơ tử vong [94] cũng như liên quan đến nguy cơ tăng biến chứng và tỉ lệ tử vong trong 30 ngày ở bệnh nhân ICU khi đo tại thời điểm rút nội khí quản [95]. Tuy nhiên hiện nay thì sử dụng CT cho mục đích nghiên cứu bị hạn chế.
Tóm lại, trong số các kỹ thuật đã được kiểm chứng hiện nay, siêu âm có vẻ hứa hẹn và dễ thực hiện trong ICU cũng như các khoa điều trị trong bệnh viện. Đối với những bệnh nhân chụp CT bụng, đánh giá khối cơ xương tại vị trí đốt sống thắt lưng thứ 3 có thể là một công cụ chẩn đoán và tiên lượng có giá trị.
Khuyến cáo 9 (Grade B): Đánh giá sức cơ của bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF bằng cách đo sức cơ bàn tay (sức nắm).
Mức đồng thuận: mạnh (95.7%)
Bàn luận (khuyến cáo 8 & 9):
Ngoài suy dinh dưỡng, các yếu tố khác như bệnh viêm đa dây thần kinh do bệnh nặng, bệnh về cơ do mắc bệnh nặng và bệnh teo cơ gây ra bởi sự bất động (nằm lâu) có thể làm tăng nguy cơ tiến triển thành hội chứng rối loạn chức năng thần kinh cơ trong và sau khi nằm tại ICU, bao gồm một dạng suy nhược cơ nghiêm trọng điển hình trên bệnh nhân nặng, hay còn gọi là suy nhược do nằm ICU lâu ngày (ICU-acquired weakness) [96]. Giảm khả năng vận động trước nhập viện có liên quan đến tăng tỷ lệ tử vong tại bệnh viện bất kể tuổi tác, bệnh đi kèm, mức độ bệnh và loại hình nhập vào ICU [97]. Ở những bệnh nhân từ 70 tuổi trở lên [98], thói quen sinh hoạt, vận động trước khi nhập ICU có ảnh hưởng mạnh mẽ đến khả năng vận động giai đoạn sau ICU. Tình trạng vận động trước đó, sự giảm vận động trong ICU và khả năng vận động sau nhập ICU được quyết định bởi nhiều yếu tố theo thời gian.
Trong ICU, công cụ được khuyến nghị để đánh giá sức cơ là thang điểm MRC – Medical Research Council (thang điểm từ 0 – 5). Tổng điểm MRC < 48 trên 12 nhóm cơ (hoặc MRC trung bình < 4 cho mỗi nhóm cơ) được xem là ngưỡng để xác định tình trạng suy nhược do nằm ICU lâu ngày [99-101]. Tuy nhiên, đánh giá điểm MRC ở bệnh nhân ICU tốn nhiều thời gian và cần được tập huấn, đào tạo. Đo sức sơ bàn tay (sức nắm) được xem như một phương pháp chẩn đoán đơn giản và dễ dàng cho suy nhược do nằm ICU lâu ngày và có thể nhận biết các rối loạn trước khi có những thay đổi về các thông số của thành phần cơ thể, giúp can thiệp dinh dưỡng được thực hiện sớm hơn và có thể ảnh hưởng đến tiên lượng của bệnh nhân [101,102]. Chưa có nghiên cứu nào về sử dụng thang điểm MRC ở những bệnh nhân bị KF nặng. Mặt khác, sức nắm bàn tay được sử dụng trên những bệnh nhân này để đánh giá sức cơ. Trong một nhóm thuần tập chỉ gồm các bệnh nhân KF nội viện có nguy cơ suy dinh dưỡng, cho thấy các giá trị đo sức nắm của bàn tay nằm trong khoảng có suy mòn cơ [60]. Trong một nghiên cứu khác, sức nắm bàn tay thấp hơn 10kg tại thời điểm xuất viện và thấp hơn 15kg một tháng sau khi xuất viện có liên quan đến nguy cơ tử vong [74]. Ở những bệnh nhân có KF đang chạy thận nhân tạo, sức nắm bàn tay có tương quan với số bệnh đồng mắc và điểm MIS [92,103]. Mặc dù có những ứng dụng đầy hứa hẹn, chúng tôi không khuyến khích sử dụng sức nắm bàn tay vì nó cũng có một số hạn chế. Một hạn chế quan trọng đó là sự hợp tác của của bệnh nhân. Bên cạnh đó, vẫn chưa có sự thống nhất tuyệt đối về cách đo, lực kế cầm tay phải được hiệu chỉnh tốt và điều chỉnh theo kích thước tay để có các phép đo chính xác và cuối cùng là thiếu các giá trị tham chiếu làm tiêu chuẩn cho sức nắm bàn tay [104].
Xác định tình trạng suy dinh dưỡng trên bệnh nhân AKI/AKD và/hoặc bệnh nhân CKD có hoặc không KF như thế nào ?
Tuyên bố 3: Chưa có tiêu chuẩn nào được thống nhất và phê chuẩn để xác định suy dinh dưỡng trên bệnh nhân AKI/AKD và/hoặc bệnh nhân CKD có hoặc không KF. Các nghiên cứu để công nhận GLIM – bộ tiêu chuẩn đã được ESPEN chứng thực, trên bệnh nhân thận cần được thực hiện
Mức đồng thuận: mạnh (100%)
Bàn luận:
Sinh lý bệnh của rối loạn dinh dưỡng ở bệnh nhân bệnh thận rất phức tạp, liên quan đến việc giảm lượng ăn vào và rối loạn quá trình đồng hóa các chất dinh dưỡng cũng như tình trạng tăng dị hóa liên quan đến tình trạng bệnh tật và bệnh nền. Chưa có sự thống nhất về cách định nghĩa các rối loạn này và các định nghĩa hiện có dựa vào các nghiên cứu trên bệnh nhân CKD ổn định được quản lý ngoại trú. Vấn đề chúng tôi tranh luận ở đây là một số định nghĩa này có thể không dùng để chẩn đoán cho bệnh nhân nội trú, đặc biệt là AKI.
The International Society of Renal Nutrition and Metabolism (ISRNM) [28], đã đưa ra thuật ngữ “suy dinh dưỡng protein-năng lượng” để chỉ “tình trạng cơ thể giảm dự trữ protein và năng lượng (tức là khối nạc cơ thể và dự trữ mỡ), có thể xảy ra trên bệnh nhân AKI hoặc CKD với bất kỳ nguyên nhân nào và có liên quan đến giảm khả năng vận động, vốn có liên quan đến tình trạng stress chuyển hóa” [28]. Mặc dù định nghĩa này tương ứng về mặt sinh lý ở bệnh nhân nội viện, các tiêu chuẩn được khuyến nghị để chẩn đoán nó có thể không hoàn toàn phù hợp với tình trạng bệnh nhân KF nằm viện và chúng tôi tham khảo các phần 2.2 và 2.3 ở trên về các hạn chế của các công cụ chẩn đoán. Vả lại, tiêu chuẩn chẩn đoán suy dinh dưỡng protein – năng lượng do rối loạn ở ba trong bốn tiêu chuẩn dinh dưỡng vẫn thiếu sự công nhận từ bên ngoài hay ngay trong nội bộ, mặc dù đã được chứng minh là có thể dự đoán tỷ lệ tử vong dài hạn, ít nhất là ở bệnh nhân chạy thận nhân tạo mạn tính [105].
Các hiệp hội dinh dưỡng lâm sàng lớn trên toàn thế giới đã tham gia vào Global Leadership Initiative on Malnutrition (GLIM), và thiết lập một quyết định đồng thuận cho chẩn đoán suy dinh dưỡng ở người lớn không phụ thuộc vào căn nguyên, từ các cơ sở lâm sàng khác nhau [76]. Tiêu chuẩn GLIM gồm mô hình hai bước để sàng lọc nguy cơ suy dinh dưỡng (với các công cụ như NRS-2002, MUST, và dạng ngắn gọn của công cụ đánh giá tình trạng dinh dưỡng ở người già đó là MNA-SF) và đánh giá chẩn đoán suy dinh dưỡng. Đánh giá bao gồm 5 tiêu chí: 3 tiêu chuẩn về kiểu hình, đó là: sụt cân không tự ý, BMI thấp (<20kg/m2 nếu < 70 tuổi hoặc < 22kg/m2 nếu > 70 tuổi) và giảm khối cơ (bằng DEXA, BIA, CT hoặc MRI với các tiêu chuẩn tương ứng của chúng), và 2 tiêu chuẩn căn nguyên: ăn kém hoặc giảm đồng hóa, và gánh nặng bệnh tật/tình trạng viêm (tình trạng bệnh nặng cấp tính hoặc bệnh mạn tính có liên quan). Chẩn đoán suy dinh dưỡng cần ít nhất một tiêu chuẩn kiểu hình và một tiêu chuẩn căn nguyên. Cho đến nay chưa có nghiên cứu nào công nhận việc áp dụng các tiêu chuẩn này ở bệnh nhân bệnh thận nội viện. Hạn chế của việc sử dụng BMI ở bệnh nhân thừa dịch có thể dẫn đến đánh giá thấp tình trạng suy dinh dưỡng trong trường hợp này (bệnh nhân thừa dịch sẽ làm cho BMI không giảm hoặc giảm ít nên dễ bị bỏ qua nguy cơ suy dinh dưỡng nếu chỉ dùng BMI), do đó cần đặc biệt chú ý khi sử dụng tiêu chuẩn này trong bộ tiếp cận của GLIM với các bệnh nhân nhập viện có AKI/AKD và/hoặc CKD có hoặc không KF.
Thuật ngữ “suy mòn” được sử dụng để mô tả một hội chứng liên quan đến các tình trạng bệnh mạn tính, bao gồm CKD và CKD có KF, với đặc trưng chủ yếu là mất khối cơ. Mất khối mỡ cũng có thể xuất hiện nhưng không phải là điều kiện cần để chẩn đoán [106]. Các biểu hiện lâm sàng của suy mòn bao gồm sụt cân sau khi đã hiệu chỉnh tăng cân do giữ nước và chán ăn. Sinh lý bệnh của nó tương tự như định nghĩa ISRNM về suy dinh dưỡng protein năng lượng, trong đó suy mòn được đề xuất cho hầu hết các giai đoạn nặng của suy dinh dưỡng protein năng lượng [28,107]. Society of Sarcopenia, Cachexia and Wasting Disorders đã đưa ra tiêu chuẩn chẩn đoán tương tự như suy dinh dưỡng protein năng lượng, vì cả hai đều dựa vào các xét nghiệm sinh hóa máu, các phép đo cơ thể và khối cơ và lượng dinh dưỡng nạp vào, với ngưỡng gây suy mòn thấp hơn so với suy dinh dưỡng protein năng lượng. Tuy nhiên, như đã đề cập ở trên, các tiêu chí này có thể không hoàn toàn phù hợp với tình trạng cấp tính, đặc biệt là trong ICU.
Sarcopenia là một hội chứng lão khoa phức tạp liên quan đến mất khối cơ và chức năng vận động [76]. Sarcopenia được xác định là nguyên phát hoặc thứ phát. Trong trường hợp nguyên phát, đó là hậu quả duy nhất của quá trình lão hóa trong khi thứ phát có căn nguyên từ nhiều yếu tố và cả 2 trường hợp nguyên phát lẫn thứ phát là nguyên nhân gây ra suy giảm hoạt động thể chất, thay đổi hệ thống nội tiết, sự hiện diện của các bệnh mạn tính hoặc cấp tính, tình trạng viêm, đề kháng insulin, và thiếu dinh dưỡng [108]. Nhiều định nghĩa có hiệu lực cho sarcopenia đã được đề xuất trong thập kỷ qua [76,108–111]. Trong mọi trường hợp, các đánh giá đáng tin cậy về sức cơ và chức năng của cơ có thể khó đạt được trong môi trường nội viện, đặc biệt là ở bệnh nhân nặng.
Thời điểm và đường nuôi ăn (cách thức nuôi ăn)
Đường nuôi ăn nào phù hợp nhất và nên bắt đầu khi nào ?
Đối với câu hỏi PICO này, chúng tôi tham khảo khuyến nghị 8.1 của hướng dẫn ESPEN cho bệnh nhân nội viện có nhiều bệnh [29] và khuyến nghị 4 và 5 của hướng dẫn ESPEN cho bệnh nhân nặng [8].
Hỗ trợ dinh dưỡng sớm (tức là được cung cấp dinh dưỡng trong vòng < 48 giờ kể từ khi nhập viện) nên được thực hiện ở bệnh nhân nội viện đa bệnh so với việc hỗ trợ dinh dưỡng muộn hơn, vì có thể làm giảm suy mòn và cải thiện khả năng tự chăm sóc của bệnh nhân.
Grade B – Mức đồng thuận: mạnh (95%) [29]
Nếu không thể dung nạp qua đường miệng, nên thực hiện/bắt đầu EN sớm (trong vòng 48 giờ) ở bệnh nhân nặng hơn là trì hoãn EN.
Grade B – Mức đồng thuận: mạnh (100%) [8]
Nếu không thể dung nạp qua đường miệng, nên thực hiện/bắt đầu EN sớm (trong vòng 48 giờ) ở những bệnh nhân nặng hơn là PN sớm.
Grade A – Mức đồng thuận: mạnh (100%) [8] Bàn luận:
Như đã thảo luận ở trên trong phần 1, những bệnh nhân không phải bệnh nặng với AKI/AKD và/hoặc CKD có hoặc không KF là nhóm có nguy cơ cao tiến triển suy dinh dưỡng và mất khối cơ, và nên được điều trị dinh dưỡng khi cần thiết. Theo hiểu biết của chúng tôi, không có nghiên cứu nào được công bố về thời gian bắt đầu điều trị như vậy trên những bệnh nhân thận nội viện không phải bệnh nặng. Tuy nhiên, bằng chứng cho thấy rằng ở bệnh nhân nội trú đa bệnh (được định nghĩa là hai hoặc nhiều bệnh đi kèm mãn tính) có thể được hưởng lợi từ việc hỗ trợ dinh dưỡng sớm trong thời gian nhập viện để tránh tình trạng dinh dưỡng trở nên tồi tệ hơn với các kết cục xấu tiếp theo [29]. Trong một RCT trên 200 bệnh nhân nội trú cao tuổi [30], hỗ trợ dinh dưỡng sớm và phục hồi chức năng có thể làm giảm tình trạng mất khối cơ trong thời gian nằm viện và giúp lấy lại khối nạc cơ thể trở lại giá trị ban đầu trong vòng 12 tháng sau khi xuất viện. Trong một nghiên cứu khác [112], EN sớm có liên quan đến việc giảm tỷ lệ nhiễm trùng và khả năng tự chăm sóc tốt hơn.
Thời điểm bắt đầu và cách cho ăn tốt nhất ở những bệnh nhân nặng là một vấn đề đã tranh luận trong nhiều năm. Khi so sánh EN sớm với EN muộn (bao gồm sáu nghiên cứu ở bệnh nhân ICU [113-118] và bốn nghiên cứu bao gồm bệnh nhân không ICU [119-122]) và EN sớm so với PN (bao gồm sáu nghiên cứu ở bệnh nhân ICU [123-128] và bảy nghiên cứu bao gồm cả bệnh nhân không ICU [129-135]), hướng dẫn của ESPEN ở những bệnh nhân nặng cho thấy giảm các biến chứng của nhiễm trùng khi EN sớm. Bên cạnh đó, EN sớm cũng liên quan đến thời gian nằm viện và nằm ICU ngắn hơn so với PN sớm [8].
Với các hướng dẫn của ESPEN và ESICM [8,27], chúng tôi đề nghị chống chỉ định EN ở những bệnh nhân bị bệnh nặng với AKI/AKD và/hoặc CKD có hoặc không KF khi: sốc không kiểm soát được, giảm oxy máu và nhiễm toan không kiểm soát, xuất huyết tiêu hóa trên chưa kiểm soát được, thể tích dịch hút dạ dày >500 ml/6 giờ, thiếu máu cục bộ ở ruột, tắc ruột, hội chứng khoang bụng (tăng áp lực ổ bụng) và rò tiêu hóa cung lượng cao mà không có đường vào cho ăn xa lỗ rò.
Chỉ định dinh dưỡng tĩnh mạch khi nào ?
Đối với câu hỏi PICO này, chúng tôi tham khảo các khuyến nghị 6 và 7 của ESPEN hướng dẫn cho bệnh nhân nặng [8].
Trong trường hợp có chống chỉ định dinh dưỡng qua đường miệng và đường tiêu hóa, nên thực hiện dinh dưỡng qua đường tĩnh mạch trong vòng 3-7 ngày.
Grade B – Mức đồng thuận: đồng thuận (89%) [8].
Dinh dưỡng tĩnh mạch (PN) sớm và tăng dần nên được cung cấp trong trường hợp chống chỉ định dinh dưỡng qua đường tiêu hóa (EN) trên bệnh nhân suy dinh dưỡng nặng.
Grade 0 – Mức đồng thuận: mạnh (95%)
Bàn luận:
Một phân tích tổng hợp của các nghiên cứu so sánh dinh dưỡng qua đường tiêu hóa với đường tĩnh mạch độc lập với thời gian [136], cho thấy dinh dưỡng qua đường tiêu hóa giảm rõ rệt các đợt nhiễm trùng so với dinh dưỡng qua đường tĩnh mạch (RR 0.64, 95% CI 0.48-0.87, P = 0.004, I2 = 47%). Không có sự khác biệt khi nuôi tương tự về mức năng lượng (calories) giữa EN và PN (hầu hết các nghiên cứu gần đây), cho thấy rằng nuôi thừa năng lượng có thể đóng vai trò trong các biến chứng nhiễm trùng của PN. Tuy nhiên, xét trên các hậu quả xấu của suy dinh dưỡng và mất khối cơ, và dựa trên sự đồng thuận của các chuyên gia thì trong trường hợp bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF có nguy cơ cao suy dinh dưỡng hoặc suy dinh dưỡng nặng và không thể sử dụng EN thì việc khởi đầu PN nên được xem xét cẩn thận và cân đối để chống nguy cơ của nuôi dưỡng thừa và nuôi ăn lại.
EN có liên quan đến cải thiện kết cục điều trị so với PN hay không ?
Tuyên bố 4: Như trong các cơ sở lâm sàng khác (bệnh nhân đa bệnh nội viện, bệnh nhân ICU) thì EN là con đường cho ăn sinh lý nhất so với PN, và nhìn chung có liên quan đến với tỉ lệ nhiễm trùng thấp hơn cũng như thời gian nằm tại ICU và thời gian nằm viện ngắn hơn.
Mức đồng thuận: mạnh (100%)
Bàn luận:
Như trong các cơ sở lâm sàng khác, cách cho ăn phụ thuộc nhiều hơn vào chức năng đường tiêu hóa hơn là sự hiện diện của tình trạng suy giảm chức năng thận. Trước đây, những bệnh nhân bị bệnh nặng với AKI/AKD chủ yếu được nuôi dưỡng qua đường tĩnh mạch, trong khi hiện nay đường ruột là lựa chọn hàng đầu cho liệu pháp dinh dưỡng lâm sàng. An toàn và hiệu quả của hỗ trợ dinh dưỡng chỉ sử dụng EN đã được đánh giá trong một nghiên cứu quan sát trên 182 bệnh nhân nặng với AKI, không có bằng chứng nào cho thấy AKI có liên quan đến sự gia tăng nhất quán các biến chứng tiêu hóa, cơ học hoặc chuyển hóa trong EN [137]. Trong các cơ sở lâm sàng khác, bằng chứng ủng hộ EN thay vì PN được củng cố nhiều hơn. Trong một phân tích tổng hợp các nghiên cứu so sánh EN và PN trong ICU độc lập với thời gian, EN có thể giảm đáng kể nguy cơ nhiễm trùng do ICU [136]. Trong khi các nghiên cứu khác ở bệnh nhân nặng [123–128] và không ICU [129–133], EN sớm cho thấy giảm các biến chứng nhiễm trùng, thời gian nằm tại ICU và thời gian nằm viện ngắn hơn so với PN.
Liệu EN có an toàn so với PN trên bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF nội viện có suy giảm chức năng thận ?
Tuyên bố 5: Không có bằng chứng nào cho thấy có liên hệ giữa việc giảm chức năng thận với sự gia tăng các biến chứng tiêu hóa, cơ học hoặc chuyển hóa trong khi sử dụng EN ở bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF.
Mức đồng thuận: mạnh (100%)
Bàn luận:
EN đại diện cho biện pháp đầu tiên và quan trọng nhất để hỗ trợ và phục hồi chức năng đường tiêu hóa, đặc biệt là ở những bệnh nhân nặng [8]. Tuy nhiên, thường không thể đáp ứng đủ nhu cầu dinh dưỡng chỉ với EN đơn độc, do đó việc bổ sung một hoặc nhiều chất dinh dưỡng bằng đường tĩnh mạch là cần thiết. EN nên bắt đầu ở mức thấp và nên tăng từ từ (trong nhiều ngày) cho đến khi đạt đủ nhu cầu. Hiện tại không có bằng chứng rõ ràng liên quan đến tỷ lệ mắc và mức độ nặng của hội chứng nuôi ăn lại ở bệnh nhân thận nội viện: tuy nhiên, điện giải và phốt pho trong huyết tương phải được theo dõi nghiêm ngặt [1]. Hiện có rất ít thử nghiệm lâm sàng có hệ thống về EN trên bệnh nhân bệnh thận nhập viện. Nghiên cứu quan sát lớn nhất cho đến nay đã đánh giá tính an toàn và hiệu quả của hỗ trợ dinh dưỡng chỉ dùng qua ống sonde mũi dạ dày bằng công thức chuẩn hoặc công thức bệnh lý dành riêng cho bệnh nhân KF đang chạy thận nhân tạo ở 182 bệnh nhân AKI, [137]. Không tìm thấy bằng chứng nào cho thấy AKI có liên quan đến sự gia tăng nghiêm trọng các biến chứng tiêu hóa, cơ học hoặc chuyển hóa khi chọn EN. Lượng dư dịch vị cao ở bệnh nhân AKI thường cao hơn so với những người có chức năng thận bình thường, nhưng nói chung, EN an toàn và hiệu quả [137].
Nhu cầu năng lượng
Xác định nhu cầu năng lượng như thế nào ?
Khuyến cáo 10: Ở những bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF nội viện cần điều trị dinh dưỡng lâm sàng, nên sử dụng phương pháp đo nhiệt lượng gián tiếp (Indirect Calorimetry – IC) để đánh giá mức tiêu hao năng lượng để đưa ra liệu pháp can thiệp dinh dưỡng (định lượng calo) và tránh nuôi ăn thiếu hoặc quá mức.
Grade B – Mức đồng thuận: mạnh (95.7%)
Lưu ý rằng các phương trình dự đoán và công thức dựa trên trọng lượng có thể có sự sai lệch đáng kể và không chính xác, đặc biệt là ở những bệnh nhân thận, không có IC, đối với những bệnh nhân không bị bệnh nặng có AKI/AKD và/hoặc CKD có hoặc không KF đang điều trị ở khoa lâm sàng và không ăn chế độ ăn ít protein, chúng tôi tham khảo các khuyến nghị 4.2 và 4.3a và 4.3b theo hướng dẫn của ESPEN cho bệnh nhân nội khoa nhiều bệnh nền [29].
Đối với bệnh nhân CKD không bị bệnh nặng với KF (không có KRT) đang điều trị ở khoa lâm sàng/khoa thận không có yếu tố stress và tiếp tục phác đồ chế độ ăn ít protein đã thiết lập trước đó trong thời gian nằm viện, lượng 30-35 kcal/kg/ngày đã được chỉ định trong các hướng dẫn trước đây của ESPEN [1,2] được xác nhận.
Bàn luận:
Việc xác định chính xác nhu cầu protein và năng lượng là rất quan trọng trong bệnh cảnh lâm sàng này bởi vì cả việc nuôi ăn thừa và thiếu đều có khả năng dẫn đến kết cục điều trị xấu [10,138].
Tiêu chuẩn vàng để đo nhu cầu calo của từng cá nhân được thể hiện bằng phương pháp đo nhiệt lượng gián tiếp, một phương pháp không xâm lấn cho phép đánh giá mức tiêu thụ năng lượng khi nghỉ ngơi (REE) dựa trên các phép đo tiêu thụ oxy và sản xuất carbon dioxide trong khí thở ra [139]. Ở những bệnh nhân nặng, REE được đo bằng phương pháp đo nhiệt lượng gián tiếp thường được xem như là cho y lệnh về dinh dưỡng. Thật không may, phép đo nhiệt lượng gián tiếp không được sử dụng rộng rãi trong công việc thường ngày của bệnh viện [139].
Phương pháp đo nhiệt lượng gián tiếp cho biết thông tin về tốc độ chuyển hóa có liên quan đến lâm sàng như trong một nghiên cứu lâm sàng trên 124 bệnh nhân ICU bị AKI nặng cho thấy tình trạng tăng chuyển hóa là 62% và giảm chuyển hóa là 14% [140].
Đã có sự đồng thuận toàn cầu về tầm quan trọng của việc sử dụng phương pháp đo nhiệt lượng gián tiếp để đánh giá REE. Cả hướng dẫn của Châu Âu [8] và Hoa Kỳ [141] đều đưa ra các khuyến cáo hỗ trợ cho việc sử dụng phương pháp đo nhiệt lượng gián tiếp như một công cụ tiêu chuẩn vàng. Điều này phần lớn được hỗ trợ bởi thực tế là các phương trình và công thức nhằm ước tính REE phần lớn không phù hợp, do đó có nguy cơ cho ăn thiếu và thừa đáng kể về mặt lâm sàng, điều này đã được chứng minh rõ ràng ngay cả trong bối cảnh của AKI và KRT [140,142,143].
Một nghiên cứu can thiệp theo thời gian trên bệnh nhân ICU với AKI có KRT dưới dạng CKRT (lọc máu liên tục) đã chứng minh rằng một máy đo chuyển hóa có thể cải thiện việc cung cấp năng lượng cũng như làm tăng lượng protein [144]. Khi ảnh hưởng đến sự cân bằng nitơ là dương sẽ giúp tăng tỷ lệ sống sót [145].
Trong khi các phương trình dự đoán và công thức dựa trên trọng lượng được công bố đã cung cấp các ước tính hợp lệ về nhu cầu năng lượng ở cấp độ quần thể, cả hai phương pháp đều có sai số đáng kể và không chính xác khi áp dụng cho từng bệnh nhân [142,143,146,147], đòi hỏi người làm lâm sàng phải thực hiện một mức độ đánh giá lâm sàng đáng kể, để cá nhân hóa nhu cầu năng lượng. Do đó, người làm lâm sàng cần nhận thức được những hạn chế của việc sử dụng các công cụ dự đoán như vậy để đo các giá trị REE.
Các hướng dẫn trước đây trên bệnh nhân AKI của ICU đã khuyến nghị lượng calo không protein từ 20-30 kcal/kg/ngày [1,2,148], hoặc tổng lượng calo từ 20-30 kcal/kg/ngày [4,149,150]. Những hướng dẫn này bao gồm nhu cầu năng lượng trung bình ở cấp độ quần thể và có thể được sử dụng làm điểm bắt đầu chung khi không có phương pháp đo nhiệt lượng gián tiếp. Tuy nhiên, trong nhiều trường hợp, nó không được đề cập đến nếu thực tế, cân nặng trước khi phát bệnh hoặc cân nặng lý tưởng nên được xem xét để tính toán. Cần cân nhắc rằng bệnh nhân AKI thường xuyên bị quá tải dịch và có sự di chuyển đột ngột của dịch liên quan đến KRT, thậm chí còn khó khăn hơn để xác định trọng lượng cơ thể tham chiếu được sử dụng để ước tính tiêu hao năng lượng bằng cách sử dụng các phương trình dự đoán. Về vấn đề này, một nghiên cứu gần đây trên 205 bệnh nhân nặng trong đó REE được đo bằng phương pháp đo nhiệt lượng gián tiếp được so sánh với phương trình Harris-Benedict được tính toán với ba cân nặng tham chiếu khác nhau (cân nặng thực tế, cân nặng lý tưởng và cân nặng ước đoán), kết luận rằng số calo được tính bằng phương trình Harris- Benedict, bất kể trọng lượng cơ thể tham chiếu nào được sử dụng, không thể thay thế kết quả đo nhiệt lượng gián tiếp [151]. Chỉ có hai nghiên cứu quan sát được thực hiện ở những bệnh nhân nặng với AKI, so sánh về mức tiêu hao năng lượng bằng việc xác định nhiệt lượng gián tiếp với mức tiêu hao năng lượng được ước tính của các công thức dựa trên trọng lượng cơ thể hoặc phương trình dự đoán, bao gồm cả phương trình Harris-Benedict [142,143]. Cả hai nghiên cứu đều đồng ý rằng các phương pháp tính toán tiêu hao năng lượng này có độ chính xác thấp, giới hạn đồng thuận rộng và thường đánh giá thấp hơn mức tiêu hao năng lượng thực tế, tùy thuộc vào cân nặng được sử dụng để tính toán. Do đó, mặc dù là một cách rất đơn giản để dự đoán mức tiêu hao năng lượng, nhưng cách tiếp cận này có khả năng làm tăng nguy cơ nuôi ăn thừa và thiếu ở bệnh nhân ICU có AKI.
Từ việc xem xét các tài liệu, hiện tại, không thể xác định và do đó cũng không thể khuyến nghị rằng phương pháp nào để dự đoán nhu cầu năng lượng là tốt nhất về mặt đưa đến kết cục điều trị tốt hơn ở bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF nội viện. Do không có bằng chứng chắc chắn, việc tham khảo các hướng dẫn gần đây của ESPEN trên bệnh nhân nặng [8] và trên bệnh nhân nội khoa nhiều bệnh nền [29] có thể tạo điều kiện thuận lợi cho việc thực hành hàng ngày của người làm lâm sàng vì các hướng dẫn này không loại trừ bệnh nhân bị bệnh thận.
Khuyến cáo 11: Phép đo nhiệt lượng gián tiếp có thể được thực hiện trong quá trình CKRT, lưu ý những hạn chế nội tại của phương pháp. Nên ưu tiên khoảng thời gian tối thiểu là 2 giờ sau khi chạy thận ngắt quãng để cải thiện độ chính xác của phép đo
Grade 0 – Mức đồng thuận: đồng thuận (78.3%)
Bàn luận:
Các khuyến nghị hiện có từ các chuyên gia cho rằng không nên thực hiện phép đo nhiệt lượng gián tiếp trong KRT, do KRT có thể can thiệp vào cân bằng CO2 [139]. Tuy nhiên, gần đây hơn, các nghiên cứu điều tra việc đo nhiệt lượng gián tiếp cho thấy không có sự khác biệt về REE ở bệnh nhân có hoặc không CKRT [144,152-154]. Thử nghiệm MECCIAS gần đây đã chỉ ra rằng ảnh hưởng của sự thay đổi CO2 trong quá trình CKRT lên REE là nhỏ nhất và phép đo nhiệt lượng gián tiếp trong quá trình CKRT nên được ưu tiên hơn vì hiệu quả của nó đối với năng lượng tiêu thụ [154]. Trong phép đo nhiệt lượng gián tiếp, giá trị REE được tính toán từ việc tiêu thụ O2 và sản sinh CO2 (phương trình Weir), và cả hai khí này cũng được trao đổi trong tuần hoàn ngoài cơ thể [155]. Tuy nhiên, trong quá trình KRT, một lượng đáng kể CO2 (26 ml/phút) được loại bỏ trong dịch thải trong quá trình CKRT, đại diện cho 14% VCO2 trung bình thở ra [155], do đó phép đo VCO2 không thể phản ánh chính xác lượng sản sinh nội sinh CO2, hạn chế việc giải thích chính xác REE đo được dựa trên IC.
Khuyến cáo 12: Bất cứ khi nào tình trạng lâm sàng của bệnh nhân thay đổi, nên đo lại nhiệt lượng gián tiếp.
Grade GPP – Mức đồng thuận: mạnh (100%)
Bàn luận cho khuyến cáo 12:
Liệu chỉ một lần đo nhiệt lượng gián tiếp khi bắt đầu hồi phục có đủ để điều chỉnh các nhu cầu dinh dưỡng trong thời gian ở ICU hay không vẫn là một câu hỏi mở. Trong một nghiên cứu trên bệnh nhân bị AKI, không có sự khác biệt nào được quan sát thấy giữa các phép đo năng lượng được thực hiện khi bắt đầu ở ICU và trong vòng một tuần, cũng như trong vòng 48 giờ, mặc dù ở đại đa số bệnh nhân (68%) sự khác biệt lớn hơn ± 10% đo được có thể có liên quan về mặt lâm sàng [142]. Một nghiên cứu hồi cứu trên 1171 bệnh nhân nặng cho thấy sự khác biệt giữa các ngày có ý nghĩa thống kê, tuy nhiên, sự khác biệt này mất đi ý nghĩa sau khi loại trừ hai ngày đầu nhập viện [156]. Một bài báo của chuyên gia về phép đo nhiệt lượng gián tiếp ở bệnh nhân nặng [139] nói rằng năng lượng tiêu hao của bệnh nhân nặng là rất dao động và phụ thuộc vào giai đoạn và mức độ nặng của bệnh, điều trị và thời gian nằm tại giường kéo dài. Khái niệm tương tự cũng phù hợp với bệnh nhân AKI [1,2]. Vì vậy, khuyến cáo rằng bất cứ khi nào tình trạng lâm sàng của bệnh nhân thay đổi, nên lặp lại phép đo nhiệt lượng gián tiếp. Nếu không có phương pháp đo nhiệt lượng gián tiếp, thì việc tính toán REE từ VCO2 thu được từ máy thở đã được chứng minh là chính xác hơn các phương trình ở những bệnh nhân nặng không điều trị CKRT [157] nhưng ít chính xác hơn so với phương pháp đo nhiệt lượng gián tiếp [139]. Tuy nhiên, cho đến nay chưa có nghiên cứu nào như vậy được thực hiện ở những bệnh nhân nặng với AKI.
Nói chung, chúng tôi tham khảo Tuyên bố 2 từ ESPEN Guideline về dinh dưỡng lâm sàng trong ICU [8].
Nếu không thể đo nhiệt lượng, sử dụng VO2 (tiêu thụ oxy) từ catheter động mạch phổi hoặc VCO2 (carbon dioxide sản sinh) lấy từ máy thở sẽ cho đánh giá tốt hơn về mức tiêu hao năng lượng so với các phương trình dự đoán.
Mức đồng thuận: đồng thuận (82%)
Nếu không có phương pháp đo nhiệt lượng gián tiếp, thì việc tính toán REE chỉ từ các giá trị VCO2 thu được từ máy thở (REE – VCO2*8.19) đã được chứng minh là chính xác hơn các phương trình [157], nhưng kém hơn so với phép đo nhiệt lượng gián tiếp [139]. Ngoài ra, VO2 được tính từ catheter động mạch phổi là một lựa chọn khả thi khác [158].
Thế nào là mức năng lượng tối ưu để tránh nuôi ăn thiếu hoặc thừa ?
Vì không có sự thay đổi đáng kể nào của quá trình chuyển hóa năng lượng liên quan đến AKI, và cũng vì các tác động liên quan nhiều đến tiêu hao năng lượng thường là do yếu tố mạn tính (như bệnh đái tháo đường, cường cận giáp nặng và viêm) hoặc tình dị hóa cấp tính của các bệnh đi kèm và biến chứng [8,159,160], và do không có nghiên cứu chất lượng cao nào khảo sát việc cung cấp năng lượng ở bệnh nhân AKI/AKD và/hoặc CKD có hoặc không KF nội viện, chúng tôi tham khảo khuyến nghị 11.1 trong hướng dẫn của ESPEN cho bệnh nhân đa bệnh nằm viện [29] và các khuyến nghị 8 và 16-19 trong hướng dẫn của ESPEN cho bệnh nhân nặng [8].
Ở những bệnh nhân nội trú đa bệnh với ăn kém và tình trạng dinh dưỡng kém, cần đạt được ít nhất 75% nhu cầu năng lượng và protein để giảm nguy cơ đưa đến kết cục điều trị bất lợi.
Grade B – Mức đồng thuận: mạnh (100%) [29]
Dinh dưỡng với năng lượng thấp (không vượt quá 70% EE) nên được thực hiện trong giai đoạn đầu của pha cấp.
Grade B – Mức đồng thuận: mạnh (100%) [8]
Sau ngày thứ ba, lượng calo cung cấp có thể tăng lên đến 80-100% năng lượng tiêu thụ.
Grade 0 – Mức đồng thuận: mạnh (100%) [8]
Để tránh nuôi ăn quá nhiều, EN và PN đầy đủ giai đoạn sớm sẽ không được sử dụng cho những bệnh nhân nặng mà nên được chỉ định trong vòng ba đến bảy ngày.
Grade A – Mức đồng thuận: mạnh (100%) [8]
Nếu sử dụng phương pháp đo nhiệt lượng gián tiếp, chế độ dinh dưỡng đúng nhu cầu hơn là dinh dưỡng với năng lượng thấp có thể được thực hiện dần dần sau giai đoạn đầu của pha cấp.
Grade 0 – Mức đồng thuận: mạnh (95%) [8]
Nếu sử dụng các phương trình dự đoán để ước tính nhu cầu năng lượng, thì dinh dưỡng năng lượng thấp (dưới 70% nhu cầu ước tính) nên được ưu tiên hơn so với dinh dưỡng đầy đủ trong tuần đầu tiên ở ICU.
Grade B – Mức đồng thuận: mạnh (95%) [8] Bàn luận:
Tỷ lệ năng lượng trên nitơ tối ưu chưa được xác định trong AKI. Một nghiên cứu theo thời gian về tác động của việc tăng tỷ lệ calo trên nitơ ở những bệnh nhân bị bệnh nặng với AKI (40 kcal/ kg/ngày so với 30 kcal/kg/ngày) cho thấy rằng cách tiếp cận này không liên quan đến việc cải thiện cân bằng nitơ; thay vào đó, quan sát thấy các biến chứng chuyển hóa nghiêm trọng hơn của liệu pháp dinh dưỡng lâm sàng (tăng đường huyết, tăng triglycerid máu) và cân bằng dịch dương hơn [161].
Có 3 nghiên cứu RCT được thực hiện ở những bệnh nhân nặng để xem xét tác động của các mức cung cấp năng lượng khác nhau trên các tạng khác như là một kết cục phụ [162-164]. Không có nghiên cứu nào cho thấy bất kỳ tác động tích cực nào trong những ngày không KF hoặc các kết cục khác của thận, ngoài việc cân bằng dịch tăng trong khi nuôi ăn đủ [162].
Một thiết kế nghiên cứu RCT về các mức độ dung nạp protein khác nhau ở những bệnh nhân nặng với AKI có CKRT được cung cấp trung bình 89% nhu cầu năng lượng đo được trong toàn bộ thời gian nghiên cứu cho thấy rằng những bệnh nhân đạt được cân bằng nitơ dương trong quá trình nghiên cứu có kết quả điều trị tốt hơn, cho thấy rằng tác động của lượng protein ăn vào có thể quan trọng hơn tác động của năng lượng ăn vào; tuy nhiên, không có dữ liệu về các biến chứng chuyển hóa [145]. Trong cùng một nghiên cứu, EN cũng liên quan đến kết quả tốt hơn so với PN. Trong một RCT khác gần đây hơn, với nuôi ăn đầy đủ nhu cầu, được tính bằng cách sử dụng 25-35 kcal/cân nặng lý tưởng đã hiệu chỉnh/ngày được cung cấp bằng PN, được chứng mình là không có lợi ích trong việc phục hồi chức năng thận hoặc tỷ lệ AKI; thay vào đó là có khả năng hồi phục chậm ở bệnh nhân AKI giai đoạn hai [59]. Bên cạnh đó, không tìm thấy sự cải thiện trong cân bằng nitơ, trong khi sự hình thành urê tăng lên, có thể kéo dài thời gian của KRT [59].
Ở những bệnh nhân nặng, đạt tiêu hao năng lượng thực tế không nên là mục tiêu trong 72 giờ đầu tiên. Bởi vì trong giai đoạn đầu của bệnh nặng, năng lượng nội sinh được sản sinh ra là 500-1400 kcal/ngày, cho ăn đầy đủ sớm cộng với lượng này có thể gây ra cho ăn quá mức [165]. Thật không may, vẫn chưa thể đánh giá sự sản sinh dinh dưỡng nội sinh này, khi mà đánh giá sản sinh dinh dưỡng nội sinh sẽ rất hữu ích để điều chỉnh sớm dinh dưỡng điều trị và ngăn ngừa các tác động có hại của tình trạng suy dinh dưỡng (tăng thời gian nằm viện, thời gian thở máy và tỷ lệ nhiễm trùng), có khả năng được quan sát thấy khi sử dụng dinh dưỡng từ ngoại sinh cộng với nội sinh [166]. Mặt khác, lượng hấp thụ dưới 50% có thể dẫn đến tình trạng thiếu calo nghiêm trọng và cạn kiệt năng lượng dự trữ, giảm khối nạc cơ thể và gia tăng biến chứng nhiễm trùng [167,168]. Gần đây, một nghiên cứu quan sát lớn bao gồm 1171 bệnh nhân [156] đã xác nhận rằng cả nuôi ăn thiếu và thừa đều có hại và lượng calo tối ưu là từ 70 đến 100% năng lượng tiêu thụ.
Tổng hợp lại, thời gian, đường nuôi ăn và mục tiêu caloric/protein không còn được coi là ba vấn đề khác nhau, mà nên được tích hợp vào một cách tiếp cận toàn diện hơn. Sau khi xác định thời gian và đường nuôi ăn, mục tiêu năng lượng/protein nên đạt được từ từ và không trước 48 giờ đầu tiên để tránh thừa dinh dưỡng (nuôi ăn quá mức). Sự tiến triển này nên được sắp xếp theo một quy trình cục bộ để ngăn chặn sự gia tăng mạnh và quá nhanh. Liệu pháp dinh dưỡng điều trị được coi là đạt mục tiêu khi đạt được hơn 70% REE, nhưng không quá 100% [8]. Những điểm chính để bắt đầu dinh dưỡng điều trị là:
- Dinh dưỡng bằng đường miệng càng sớm càng tốt trong khi cân nhắc các nguy cơ xảy ra biến chứng (ví dụ: hít sặc)
- EN sớm với tốc độ thấp và tăng dần trong vòng 48 giờ nếu không thể thực hiện dinh dưỡng bằng đường uống trong khi cân nhắc nguy cơ biến chứng;
- Xác định điểm khởi đầu tối ưu và liều lượng (bổ sung) PN dựa trên nguy cơ xảy ra biến chứng từ đường miệng hoặc EN, tình trạng bệnh cấp tính, và tình trạng thiếu/suy dinh dưỡng trước đó.
Sự phối hợp tối ưu năng lượng từ carbohydrate và lipid cho dinh dưỡng điều trị ?
Khuyến cáo 13: Ở những bệnh nhân nhập viện với AKI/AKD và/hoặc CKD có hoặc không KF cần điều trị dinh dưỡng, có thể phối hợp lượng lipid và carbohydrate để tăng lượng lipid và giảm cung cấp carbohydrate dựa trên việc sử dụng cơ chất được đánh giá bằng phương pháp đo nhiệt lượng gián tiếp.
Grade 0 – Mức đồng thuận: mạnh (91,3%)
Bàn luận:
Bệnh nhân nhập viện với AKI/AKD và/hoặc CKD có hoặc không KF có biểu hiện tình trạng tăng chuyển hóa. Thận có vai trò quan trọng trong quá trình tạo glucose, thanh thải insulin và hấp thu glucose [10,138]. Do đó, giảm quá trình oxy hóa glucose được mong đợi ở bệnh nhân AKI, đặc biệt là những bệnh nhân nặng với sự mất cân bằng phóng thích các hormone dị hóa và giải phóng quá mức các cytokine tiền viêm. Sự biến đổi chuyển hóa lipid trong AKI phức tạp hơn. Suy giảm phân giải lipid là một hiện tượng đã biết ở AKI, một tình trạng đặc trưng bởi sự giảm hoạt động của lipoprotein lipase và triglycerid lipase ở gan và làm chậm quá trình thanh thải nhũ dịch béo ra khỏi máu [10]. Bằng chứng hiện có gần đây nhất cho thấy rằng những bệnh nhân nặng với AKI thì việc oxy hóa carbohydrate ít hơn nhiều (56,7%) và tăng oxy hóa lipid hơn (150,7%) so với kỳ vọng [169]. Một phát hiện tương tự đã được mô tả trong một nghiên cứu trước đó [170].
Hầu hết tất cả các công thức EN và PN chuẩn hiện có đều chứa một tỷ lệ cao năng lượng từ carbohydrate, ngay cả trong các loại sữa công thức đã bao gồm lipid. Sự phân phối chất dinh dưỡng đa lượng không từ protein này có thể không thích hợp cho bệnh nhân nội viện có KF. Tuy nhiên, tác động có thể có của sự mất cân bằng này đối với tình trạng dinh dưỡng, bệnh tật và tử vong vẫn chưa được xác định rõ.
KRT có thể tác động như thế nào đến sự cân bằng năng lượng bởi khả năng cung cấp các cơ chất năng lượng (citrate, lactate, glucose) ?
Khuyến cáo 14: Đối với bệnh nhân đang điều trị KRT, tổng năng lượng cung cấp bởi lượng calo cộng thêm dưới dạng citrate, lactate và glucose từ các dung dịch lọc HD/HF nên được tính toán để xác định tổng năng lượng cung cấp hàng ngày để tránh cho ăn quá nhiều.
Grade B – Mức đồng thuận: mạnh (100%) Bàn luận:
Một số giải pháp thường được sử dụng trong quy trình HD/HF (dịch lọc máu và dịch thay thế) có thể cung cấp cơ chất năng lượng ở dạng:
- Chất kháng đông vùng Citrate (3 kcal/g) sử dụng ACD-A (2.2% xitrat), TSC (4% trinatri citrat), hoặc các dung dịch citrate được pha loãng gần đây hơn (citrate 12 hoặc 18 mmol/l)
- Glucose (3.4 kcal/g) từ ACD-A (2.45% dextrose) và dịch thay thế và dịch lọc (0 – 110 mg/dl)
- Lactate (3.62 kcal/g), dùng làm chất đệm
Trong những năm gần đây, chống đông bằng citrate trong KRT đã được chứng minh là một giải pháp thay thế an toàn và hiệu quả so với các phác đồ chống đông thông thường, thường dựa trên heparin không phân đoạn [22,171,172]. Citrate được loại bỏ một phần khỏi máu bởi KRT, và tải citrate cho bệnh nhân phụ thuộc vào sự cân bằng giữa tổng liều dùng trong tuần hoàn ngoài cơ thể và lượng citrate được loại bỏ qua bộ lọc trong quá trình KRT [173]. Citrate đến hệ tuần hoàn được chuyển hóa chủ yếu ở gan, cũng như ở thận và cơ xương [171]. Citrate là anion của acid tricarboxylic (acid xitric), là chất chuyển hóa trung gian của chu trình Krebs. Do đó, citrate không cần insulin để đi vào tế bào, nơi nó có thể được chuyển hóa để tạo ra năng lượng và bicarbonate (tương ứng là 0.59 kcal/mmol citrate và 3mmol bicarbonate/mmol citrate).
Năng lượng tăng có thể đáng kể, tùy thuộc vào loại và vận tốc dịch lọc được sử dụng, với một nghiên cứu báo cáo lên đến 1300 kcal/ngày khi sử dụng nhiều dịch thay thế lactate và chống đông bằng ACD-A [174]. Nhiều thay đổi trong mức tăng năng lượng đã được ghi nhận trong ba nghiên cứu hiện có về vấn đề này, tùy thuộc vào hàm lượng lactate của dịch thay thế và loại chất chống đông máu (115-1300 kcal/ngày) [174-176]. Nghiên cứu gần đây nhất được công bố về chủ đề này xác nhận có khả năng làm tăng năng lượng thêm đáng kể, đặc biệt với việc chỉ định lọc máu liên tục qua đường tĩnh mạch (CVVH) làm phương thức KRT. Bằng cách sử dụng chất chống đông citrate dưới dạng ACD- A và dịch thay thế dựa trên bicarbonate với glucose 110 mg/dl, nghiên cứu báo cáo lượng phân phối trung bình hàng ngày là 513 kcal (citrate 218 kcal, glucose 295 kcal). Mặt khác, việc sử dụng dịch thay thế không chứa glucose cũng nên được tính đến, vì nó có thể góp phần làm tăng lượng glucose mất đi thực sự vì lượng glucose thất thoát trong dịch thải không được thay thế [177].
Để có thể tránh một phần cung cấp thừa năng lượng do KRT bằng cách sử dụng các dung dịch có nồng độ citrate thấp hơn, bicarbonate làm chất đệm và các dung dịch citrate không phải ACD-A với liều lượng thấp hơn và không có glucose [21]. Ngoài ra, các phương thức PIKRT khuếch tán, chẳng hạn như thẩm tách máu chậm hiệu quả thấp (Subtained Low-efficiency Dialysis – SLED), dễ dàng cho phép tăng loại bỏ citrate bằng chính phương pháp điều trị [22,171], chỉ với một lượng năng lượng hạn chế (100-300 kcal/ngày) được tính vào năng lượng nạp vào theo chỉ định của bệnh nhân.
Nhu cầu năng lượng trên bệnh nhân AKI/AKD và/hoặc CKD hoặc CKD có hoặc không KF không bắt đầu điều trị KRT so với những bệnh nhân có điều trị với KRT ?
Khuyến cáo 15: Không cần tính lượng REE bổ sung vào REE đã được tính toán sẵn để bù đắp cho KRT vì không có sự khác biệt giữa bệnh nhân không điều trị KRT so với bệnh nhân điều trị KRT.
Grade B – Mức đồng thuận: mạnh (100%)
Bàn luận:
Không có sự thay đổi lớn nào của quá trình chuyển hóa năng lượng liên quan đến AKI, vì các tác động liên quan hơn đến tiêu hao năng lượng thường là do các bệnh cấp tính đi kèm và các biến chứng [8,170]. Ở những bệnh nhân thở máy, không tìm thấy sự khác biệt nào của REE do sự xuất hiện của AKI [178]. Ngay cả trường hợp suy đa cơ quan, mức tiêu hao năng lượng của những bệnh nhân nặng không vượt quá 130% mức tiêu hao năng lượng được ước tính [2]. Các bằng chứng khan hiếm hiện có cho thấy rằng ngay cả KRT cũng không phải là nguyên nhân làm tăng nhu cầu năng lượng ở bệnh nhân KF. Một nghiên cứu quan sát ở bệnh nhân CKD với KF không tìm thấy sự khác biệt về REE trong cùng một nhóm bệnh nhân trước khi bắt đầu lọc máu (chạy thận nhân tạo và PD) và một tháng sau khi chạy thận nhân tạo hoặc bắt đầu PD [179]; theo cách tương tự, những bệnh nhân nặng với AKI đang điều trị KRT có REE tương tự được đo bằng phương pháp đo nhiệt lượng gián tiếp so với những bệnh nhân AKI không KRT [142]. Chỉ có một nghiên cứu quan sát cho thấy sự khác biệt giữa REE của bệnh nhân AKI trước khi bắt đầu KRT và sau năm ngày lọc máu [180]. Tuy nhiên, nghiên cứu có tỷ suất bỏ cuộc cao (24 bệnh nhân được đánh giá tại thời điểm năm ngày trong số 124 người đăng ký).
Nhu cầu Protein
Tác động tiềm tàng của KRT đối với sự cân bằng protein ở bệnh nhân AKI hoặc AKI trên CKD hoặc CKD với KF so với những bệnh nhân tương tự không KRT ? KRT có làm tăng nhu cầu protein không ?
Tuyên bố 6: KRT có thể gây ảnh hưởng tiêu cực đến sự cân bằng protein bằng cách gây ra sự thất thoát acid amin và peptite/protein. Do đó, nhu cầu protein có thể tăng lên ở những bệnh nhân đang điều trị với KRT.
Mức đồng thuận: mạnh (100%)
Bàn luận:
Các liệu pháp thay thế thận như CKRT hoặc PIKRT như SLED đã trở thành phương thức điều trị được lựa chọn ở những bệnh nhân AKI nặng. Các phương thức KRT chuyên sâu này, do lịch trình kéo dài và loại màng được sử dụng, có thể gây ảnh hưởng tiêu cực đến sự cân bằng protein bằng cách gây thất thoát acid amin và peptite/protein (lần lượt lên đến 15-20g/ngày và 5-10g/ngày) [10,144,181-187]. Các yếu tố liên quan đến chỉ định KRT sẽ xác định bao nhiêu acid amin sẽ bị mất bao gồm phương thức của KRT (liên tục hoặc gián đoạn và đối lưu, khuếch tán hoặc cả hai), tốc độ dòng chảy của máu và dịch thẩm tách, tốc độ dịch thải, cũng như tính chất của màng của bộ lọc được sử dụng [144,188]. Bên cạnh đó, vì acid amin là những chất có trọng lượng phân tử thấp với hệ số sàng gần 1.0, nên nhiều acid amin như cysteine, arginine, alanine và glutamine có thể dễ dàng được lọc từ máu vào dịch thải [183,184]. Hiện tại, với sự gia tăng hiệu quả của các phương thức KRT sẵn có, cho phép tốc độ dòng chảy của máu cao hơn và tăng khả năng loại bỏ dịch thải, có thể ước tính rằng sự thất thoát acid amin thực tế của bệnh nhân CKRT nhiều hơn so với những gì được báo cáo trong các nghiên cứu trước đó [181-184]. Một nghiên cứu trên tám bệnh nhân (4 người bị sốc tim và 4 người bị nhiễm trùng huyết) báo cáo rằng lượng acid amin mất trung bình hàng ngày là 3.8g/ngày ở bệnh nhân nhiễm trùng và 7.4g/ngày ở bệnh nhân bị sốc tim khi đang CVVH [182], trong khi một nghiên cứu gần đây hơn ở những bệnh nhân nặng có CVVH báo cáo sự mất acid amin trung bình là 13.4g/ngày, dao động từ 11.8 đến 17.4 g/ngày [189].
Xác định nhu cầu protein ở bệnh nhân thận như thế nào ? Lượng protein cao có cải thiện kết cục so với lượng protein tiêu chuẩn hay không ?
Tuyên bố 7: Nhu cầu protein chủ yếu được xác định trên bệnh nền, tuy nhiên, KRT kéo dài có thể gây ảnh hưởng tiêu cực về cân bằng protein.
Mức đồng thuận: mạnh (100%)
Tuyên bố 8: Không có sự khác biệt đáng kể về nhu cầu protein giữa ICU, bệnh nhân phẫu thuật và bệnh nội khoa cấp tính có AKI/AKD và/hoặc CKD có hoặc không KF vì tất cả các tình trạng này được đặc trưng bởi dị hóa protein.
Mức đồng thuận: mạnh (91.3%)
Khuyến cáo 16: Ở những bệnh nhân nhập viện với AKI/AKD và/hoặc CKD có hoặc không KF đang được điều trị dinh dưỡng lâm sàng, việc chỉ định lượng protein tốt nhất là theo tốc độ dị hóa protein thay vì chỉ sử dụng các yếu tố dự báo được chuẩn hóa theo trọng lượng cơ thể (xem khuyến cáo 18).
Grade GPP – Mức đồng thuận: đồng thuận (86.4%)
Khuyến cáo 17: Cần tránh nuôi ăn quá nhiều để đạt được cân bằng nitơ dương hoặc giảm thiểu sự cân bằng nitơ âm hiện có.
Grade B – Mức đồng thuận: mạnh (95.7%)
Khuyến cáo 18: Lượng protein nạp vào được chỉ định theo:
- Bệnh nhân CKD nội viện không có tình trạng nặng hoặc cấp tính: nuôi protein ở mức 0.6-0.8g/kg BW/ngày
- Bệnh nhân CKD và KF nội viện có KRT ngắt quãng thông thường mạn tính mà không có bệnh cấp tính/nguy kịch: ≥ 1.2 g/kg BW/ ngày
- Bệnh nhân AKI, AKI trên nền CKD nội viện không có bệnh cấp tính/nguy kịch: 0.8-1.0g /kg BW/ngày
- Bệnh nhân AKI, AKI trên nền CKD, CKD nội viện có tình trạng bệnh cấp tính/nguy kịch, không KRT: bắt đầu với 1.0 g/kg
- BW/ngày, và tăng dần lên đến 1.3 g/kg BW/ngày nếu dung nạp được
- Bệnh nhân nặng với AKI hoặc AKI trên CKD hoặc CKD với KF có KRT ngắt quãng thông thường: 1.3-1.5 g/kg/ngày
- Bệnh nhân bị bệnh nặng với AKI hoặc AKI trên nền CKD hoặc CKD có KF khi CKRT hoặc PIKRT: 1.5g/kg/ngày lên đến 1.7 g/kg/ngày
Nếu có thể, cân nặng trước khi nhập viện hoặc cân nặng thường có được ưu tiên dùng hơn so với cân nặng (BW) lý tưởng. Cân nặng thực tế không nên được xem xét cho một chỉ định về lượng protein nạp vào.
Grade 0 – Mức đồng thuận: đồng thuận (82.6%)
Bàn luận cho tuyên bố 7 & 8 và khuyến cáo 16 – 18:
Nhu cầu protein được xác định bởi stress do viêm của bệnh cấp tính/nguy kịch. Những bệnh nhân nặng với tình trạng viêm và bất động toàn thân bị dị hóa mạnh và được đặc trưng bởi sự phân hủy protein trong cơ nhiều vùng và tổng hợp protein bị suy giảm, dẫn đến cân bằng nitơ âm tính [10]. Do đó, nhu cầu protein có thể tăng lên đáng kể. Cung cấp lượng protein tăng lên có thể hạn chế thất thoát nitơ, mặc dù nó không thể đảo ngược tình trạng dị hóa [145,161,186].
Thay vào đó, có sự khác biệt với những bệnh nhân có AKI không phức tạp, chẳng hạn như tắc nghẽn đường tiết niệu hoặc thuốc gây độc với thận hoặc bệnh thận do thuốc cản quang, trong trường hợp không có tình trạng bệnh cấp tính/nguy kịch. Trong những điều kiện không dị hóa này, bệnh nhân có thể ổn định về mặt chuyển hóa và không cần tăng chế độ protein. Tuy nhiên, việc ước tính tốc độ dị hóa protein có thể giúp hiểu rõ hơn về tình trạng dị hóa của bệnh nhân và giúp hướng dẫn chỉ định dinh dưỡng.
Lượng protein tối ưu ở những bệnh nhân KRT nội viện, đặc biệt là ở những bệnh nhân nặng với AKI vẫn chưa rõ ràng. Cần phải định lượng đủ để làm giảm sự mất khối cơ trong khi cung cấp các acid amin cần thiết cho đáp ứng của pha cấp. Nhu cầu protein ở bệnh nhân AKI hoặc AKI trên nền CKD hoặc CKD chưa bắt đầu điều trị KRT nội viện có thể phụ thuộc chủ yếu vào bệnh nền, bệnh cấp tính đi kèm và biến chứng hơn là do giảm chức năng thận. Xét theo sự tăng thất thoát acid amin, bệnh nhân điều trị với KRT có thể cần lượng protein cao hơn [10,190].
Tổng lượng nitơ mất đi ở một bệnh nhân CKRT đặc trưng có thể vào khoảng 25g/ngày [184,186] càng làm trầm trọng thêm tình trạng cân bằng nitơ âm tính. Giá trị tốc độ dị hóa protein chuẩn là 1.2-2.1g/kg/ngày đo được bằng phương pháp đo quang urê (urea kinetic method) ở các nhóm nhỏ bệnh nhân mắc AKI với nhiều phương thức KRT khác nhau và điều trị dinh dưỡng (phương thức kéo dài, liên tục và ngắt quãng) [142,161,191-195]. Hiện có rất ít dữ liệu về ảnh hưởng của lượng protein cao đối với sự cân bằng nitơ ở những bệnh nhân đang điều trị KRT. Lượng protein nạp vào lên đến 2.5g/kg/ngày, ít nhất là trong các nghiên cứu không ngẫu nhiên, dẫn đến cân bằng nitơ gần dương hoặc dương nhẹ [145,186]. Trong một nghiên cứu không ngẫu nhiên về bệnh nhân AKI đang điều trị CKRT với liều bổ sung protein cao hơn trong chế độ ăn uống 2.5g/kg/ngày so với một nhóm bệnh nhân được chăm sóc tiêu chuẩn 1.2g/kg/ngày với cùng nhận được lượng calo bằng nhau [185], bệnh nhân được
nuôi với lượng protein cao hơn có nhiều khả năng đạt được cân bằng nitơ dương tại mọi thời điểm trong quá trình theo dõi (53.6% so với 36.7%; p < 0.05) và có xu hướng giảm cân bằng nitơ âm tính tổng thể hơn, nhưng cần tăng “liều” CKRT do tình trạng tăng sản sinh nitơ có trong urê trong máu. Trong một nghiên cứu chi tiết về chuyển hóa [193], báo cáo rằng bệnh nhân AKI được nuôi 2.0g protein/kg đã cải thiện cân bằng nitơ so với những bệnh nhân được nuôi 1.5g protein/kg. Điều thú vị ở đây là việc tăng lượng calo từ 10 đến 15 kcal/kg đến 30 kcal/kg có lợi cho những bệnh nhân có lượng protein thấp hơn (0.6- 0.8g/kg) nhưng không có lợi trên nhóm bệnh nhân được nuôi tăng protein. Những bệnh nhân được nuôi ăn thừa (40-60 tổng kcal/kg) đã tăng tốc độ dị hóa protein chuẩn và làm xấu đi sự cân bằng nitơ. Cân bằng nitơ dương có liên quan đến việc cải thiện khả năng sống còn của bệnh nhân nặng với AKI [144]. Bổ sung protein đến mục tiêu 2.0g/kg/ngày có thể là mong muốn ở những bệnh nhân điều trị CKRT hoặc PIKRT kéo dài với cân bằng nitơ âm. Một lưu ý quan trọng liên quan đến việc cho y lệnh về protein là nó thường được chuẩn hóa theo trọng lượng cơ thể của bệnh nhân. Xem xét rằng những bệnh nhân nặng với AKI thường xuyên bị quá tải dịch, việc xác định trọng lượng cơ thể tham chiếu để sử dụng cho chỉ định về lượng protein là một vấn đề tế nhị. Trọng lượng cơ thể khác nhau sẽ dẫn đến ước tính nhu cầu protein khác nhau, điều này có thể giải thích một phần cho phạm vi rộng của các giá trị tốc độ dị hóa protein chuẩn được tìm thấy trong các nghiên cứu trước đây. Một nghiên cứu gần đây cho thấy ước tính nhu cầu protein dựa trên trọng lượng cơ thể ở những bệnh nhân nặng với AKI đã ước lượng quá cao nhu cầu protein ở những bệnh nhân đang điều trị KRT, trong khi đó ước lượng thấp hơn ở những bệnh nhân không điều trị KRT [142]. Trong khi trường hợp đầu tiên (ước lượng quá cao nhu cầu protein trên BN KRT) có thể làm tăng sản sinh urê và nhu cầu về KRT, trường hợp thứ hai (ước lượng protein thấp ở BN không KRT) có thể góp phần làm tăng sự mất khối cơ. Bất chấp những khó khăn về kỹ thuật có thể xảy ra trong quá trình lấy nước tiểu và dịch lọc máu trong 24 giờ, việc tính toán tốc độ dị hóa protein ở những bệnh nhân điều trị KRT nội viện là rất quan trọng.
Có nên chỉ định giảm protein ở những bệnh nhân nặng nhập viện với AKI và/hoặc CKD có hoặc không KF để trì hoãn việc bắt đầu KRT ?
Khuyến cáo 19: Không nên chỉ định giảm protein để tránh hay trì hoãn KRT trên bệnh nhân nội viện với AKI, AKI trên nền CKD, hoặc CKD với KF.
Grade A – Mức đồng thuận: mạnh (95.5%) Bàn luận:
Khi có sự gia tăng dị hóa protein liên quan đến giảm thanh thải sản phẩm của nitơ do giảm chức năng thận, việc bổ sung quá nhiều protein có thể dẫn đến tích lũy thêm các sản phẩm cuối cùng của quá trình chuyển hóa protein và acid amin, và do đó, làm tăng giá trị nitơ trong urê trong máu (BUN). Tuy nhiên, sự dị hóa protein ở bệnh nhân AKI chỉ bị ảnh hưởng một phần bởi lượng protein ăn vào, tức là giảm lượng protein ăn vào không ảnh hưởng đến tốc độ dị hóa protein [85]. Một phân tích tổng hợp gần đây không tìm thấy sự khác biệt về kết quả giữa thời điểm bắt đầu KRT (sớm và muộn) [196]. Do đó, việc chỉ định protein trong bệnh cảnh lâm sàng này nên được dựa trên tình trạng dị hóa của bệnh nhân, và không nên giảm lượng protein để trì hoãn việc bắt đầu KRT.
Xét về hàm lượng tương đối thấp của protein có trong công thức chuẩn đường tiêu hóa (40-60g protein/L), các công thức đặc hiệu cho bệnh (thận) có chứa 70-80g protein/L có thể được ưu tiên hơn, chủ yếu để giảm quá tải dịch; trong một số trường hợp, việc bổ sung acid amin qua đường tĩnh mạch được khuyến khích để đạt được mục tiêu nhu cầu protein bằng dinh dưỡng qua đường tiêu hóa [1,2,137].
Nên xem xét áp dụng cách tiếp cận bảo tồn (giảm protein) trong tình huống nào ?
Khuyến cáo 20: Phương pháp tiếp cận điều trị bảo tồn bao gồm các chế độ ăn hạn chế protein vừa phải, chỉ có thể được xem xét trong trường hợp bệnh nhân AKI hoặc CKD ổn định về mặt chuyển hóa, không có bất kỳ tình trạng dị hóa/bệnh nặng nào và không trải qua KRT (xem khuyến cáo 18).
Grade GPP – Mức đồng thuận: đồng thuận (87%) Bàn luận
Trong một số tình trạng không dị hóa với giảm chức năng thận cấp tính (chẳng hạn như AKI đơn độc do thuốc, AKI do thuốc cản quang và một số tình trạng của AKI sau thận) hoặc ở những bệnh nhân CKD ổn định về chuyển hóa, điều trị bảo tồn có thể giúp điều chỉnh phosphate, natri, kali, rối loạn thăng bằng toan kiềm, cũng như làm giảm sự tích tụ của các chất thải nitơ, chẳng hạn như urê. Thay vào đó, khi có tình trạng dị hóa, điều trị bảo tồn có thể chỉ điều chỉnh một phần các chất điện giải, sự mất cân bằng dịch hoặc thăng bằng toan kiềm nhưng luôn làm xấu đi sự cân bằng nitơ; trong hầu hết các trường hợp như vậy, nên bắt đầu KRT.
Bệnh nhân CKD điều trị bảo tồn có nên duy trì chế độ ăn ít protein hơn trong thời gian nằm viện ?
Khuyến cáo 21: Bệnh nhân trước đây duy trì kiểm soát protein khẩu phần (gọi là chế độ ăn hạn chế protein) không nên duy trì chế độ ăn này nếu bệnh cấp tính là lý do vào viện.
Grade GPP – Mức đồng thuận: mạnh (100%)
Bàn luận:
Như đã thảo luận ở trên, nhập viện do bệnh nặng hoặc cấp tính hoặc phẫu thuật lớn thường được đặc trưng bởi tình trạng tiền viêm và tăng dị hóa protein, do đó tiếp tục hạn chế protein trong chế độ ăn uống là không thích hợp. Nhu cầu protein ở bệnh nhân nhập viện phải được xác định theo bệnh nền đã gây ra nhập viện nhiều hơn là do tình trạng suy thận căn bản. Ngược lại, bệnh nhân CKD có thể tiếp tục chế độ ăn uống có kiểm soát protein trong thời gian nhập viện miễn là không có tình trạng dị hóa protein. Bên cạnh đó, lượng dinh dưỡng ăn vào phải bao gồm đầy đủ các acid amin thiết yếu và nhu cầu năng lượng [197], và nhiễm toan chuyển hóa phải được ngăn ngừa hoặc điều chỉnh thỏa đáng [198]. Nếu không được kiểm soát tốt như đã đề cập ở trên, bệnh nhân CKD sẽ có nguy cơ cao cân bằng nitơ âm và do đó bị mất khối cơ, ngay cả trong tình trạng không dị hóa ổn định về mặt chuyển hóa. Cuối cùng nhưng không kém phần quan trọng, cần kiểm soát tối ưu quá trình chuyển hóa glucose để thực hiện hạn chế protein an toàn về mặt dinh dưỡng [199].
Nhu cầu về các vi chất dinh dưỡng
Có nên bổ sung các nguyên tố vi lượng và vitamin ?
Khuyến cáo 22: Do tăng nhu cầu trong quá trình KF và bệnh nặng, và mất lượng dịch thải lớn trong quá trình KRT, cần theo dõi và bổ sung các nguyên tố vi lượng. Cần tăng cường chú ý đến selen, kẽm và đồng.
Grade B – Mức đồng thuận: mạnh (100%)
Khuyến cáo 23: Do tăng nhu cầu trong quá trình KF và bệnh nặng, và mất lượng dịch thải lớn trong quá trình KRT, cần theo dõi và bổ sung các vitamin tan trong nước. Cần đặc biệt chú ý đến vitamin C, folate (B9) và thiamine (B1).
Grade B – Mức đồng thuận: mạnh (100%)
Bàn luận cho khuyến cáo 22 và 23:
Trong diễn tiến bệnh nặng, vitamin và các nguyên tố vi lượng có thể tác động đến việc điều hòa miễn dịch, làm lành vết thương và có thể có đặc tính chống oxy hóa [200,201]. Mặc dù liều lượng vi chất dinh dưỡng tối ưu ở những bệnh nhân nặng vẫn còn là vấn đề tranh cãi, nhưng có vẻ rằng sự khởi đầu của KRT dưới dạng CKRT ở những bệnh nhân có AKI hoặc AKI trên nền CKD hoặc CKD có KF có ảnh hưởng tiêu cực đến mức vi chất dinh dưỡng trong huyết thanh là khá rõ ràng [202,203]. Cơ chế thải trừ của các phương thức lọc máu cơ bản cùng với sự hấp phụ của các loại màng lọc có thể làm tăng nguy cơ thiếu hụt vitamin và nguyên tố vi lượng, nhưng vẫn còn thiếu các phương pháp dinh dưỡng chuyên dụng và cụ thể [204]. Ở những bệnh nhân điều trị CKRT, đã mô tả sự giảm nồng độ folate, vitamin C, E, thiamine, kẽm và selen trong huyết thanh, có thể là do hậu quả của việc tăng cường sử dụng trong bệnh nặng và mất thứ phát sau CKRT [202,205-207]. Cụ thể, báo cáo về sự mất hàng ngày trong dịch thải khoảng 68 mg vitamin C, 0.3 mg folate và 4 mg vitamin B1 (thiamine) [206,207]. Trong một nghiên cứu quan sát trên 77 bệnh nhân CKD kèm KF đang chạy thận nhân tạo mạn tính, kẽm, thiamin và vitamin B6 là những vi chất dinh dưỡng bị thiếu nhiều nhất (lần lượt là 44,1%, 24,7% và 35,1%) [208]. Trong một thử nghiệm ngẫu nhiên trên bệnh nhân chạy thận nhân tạo mạn tính [209], nồng độ selen và kẽm trong huyết thanh ở 150 bệnh nhân chạy thận nhân tạo mạn tính không được điều chỉnh về mức bình thường bằng cách bổ sung điều độ (lên đến 75µg selen/ngày và 50mg kẽm/ngày), cho thấy tăng nhu cầu ở những bệnh nhân này. Khuyến cáo hiện tại là lượng selen và các vi chất dinh dưỡng khác bị mất trong dịch thải nên được thay thế vào [210,211] và những bệnh nhân này sẽ cần một lượng bổ sung nhiều hơn dựa vào PN chuẩn [207,212]. Liều tối ưu vẫn chưa được biết, nhưng liều lượng 100mg/ngày đã được đề xuất cho vitamin C [213]. Sự thất thoát lớn trong dịch thải của một số nguyên tố vi lượng, nhưng đặc biệt là đồng đã được chứng minh là đã thất thoát rất nhiều so với lượng dinh dưỡng nạp vào [207]. Gần đây một trường hợp tử vong do thiếu đồng đã được công bố [212]. Khi cần phải CKRT trong hơn hai tuần, nên xác định lượng đồng trong máu. Có đề nghị dùng qua đường tĩnh mạch khoảng 3 mg đồng/ngày để ngăn ngừa sự thiếu hụt (dựa trên xác định lặp lại ở bệnh nhân chạy thận nhân tạo) [214]. Kết luận, do những hạn chế trong xét nghiệm máu và thiếu bằng chứng về lợi ích lâm sàng có được từ việc bổ sung vi chất dinh dưỡng, việc bổ sung vi chất dinh dưỡng cần được hướng dẫn bởi nồng độ của chúng trong huyết thanh và lượng thất thoát do KRT.
Dinh dưỡng đặc trưng theo bệnh lý
Việc sử dụng công thức dành riêng cho bệnh thận (EN hoặc PN) có làm giảm biến chứng và tăng cung cấp dinh dưỡng so với công thức tiêu chuẩn không ?
Khuyến cáo 24: Không có công thức đường tiêu hóa hoặc đường tĩnh mạch đặc hiệu nào dành cho bệnh nhân suy giảm chức năng thận nên được sử dụng thường xuyên ở mọi bệnh nhân bị AKI, AKI trên nền CKD, hoặc CKD có KF so với các công thức chuẩn. Thay vào đó, việc sử dụng chúng phải được cá thể hóa (xem khuyến cáo 26).
Grade B – Mức đồng thuận: đồng thuận (87.5%)
Khuyến cáo 25: Việc lựa chọn công thức EN hoặc PN thích hợp nhất nên được thực hiện dựa trên tỷ lệ năng lượng và protein để cung cấp liều lượng chính xác nhất trong thực hành lâm sàng.
Grade B – Mức đồng thuận: mạnh (91.3%)
Khuyến cáo 26: Ở một số bệnh nhân bị mất cân bằng dịch và điện giải, các công thức EN hoặc PN “thận” đậm đặc với hàm lượng điện giải thấp hơn có thể được ưu tiên hơn các công thức tiêu chuẩn.
Grade GPP – Mức đồng thuận: mạnh (95.7%) Bàn luận cho khuyến cáo 24 – 26:
Đánh giá gần đây nhất về chủ đề này, bao gồm tài liệu cho đến tháng 12 năm 2013, không cho thấy bất kỳ lợi ích nào đã được chứng minh trong việc sử dụng công thức đường ruột dành riêng cho bệnh ở những bệnh nhân bị bệnh nặng [141]. Tuy nhiên, các công thức được thiết kế cho bệnh nhân KF đậm đặc hơn và tất cả chúng đều có hàm lượng natri, kali và phốt pho thấp hơn.
Do đó, chúng có thể có lợi cho việc đạt được mục tiêu protein ở những bệnh nhân có nhu cầu protein cao hơn, cũng như ở những bệnh nhân có rối loạn điện giải (ví dụ tăng kali máu) và/hoặc quá tải dịch.
Việc bổ sung omega-3 hoặc các nhũ dịch béo giàu omega-3 qua PN có làm cải thiện kết cục điều trị không ?
Khuyến cáo 27: Không có đủ bằng chứng ủng hộ cho việc sử dụng thường xuyên các acid béo không bão hòa đa nối đôi (PUFA) như omega-3 hoặc các chế phẩm PN được làm giàu omega-3 (PUFA) ở bệnh nhân nhập viện với AKI, AKI trên nền CKD hoặc CKD với KF.
Grade GPP – Mức đồng thuận: mạnh (95.8%) Bàn luận:
Vai trò của omega-3 PUFA ở những bệnh nhân thận và giảm chức năng thận nội viện tại thời điểm này vẫn chưa được biết rõ. Mặc dù có dữ liệu thực nghiệm thú vị [215,216], hiện không có RCT nào ủng hộ cho khuyến cáo sử dụng omega-3 PUFA cho bệnh nhân AKI/AKD và/hoặc CKD nhập viện có hoặc không có KF [10]. Tuy nhiên, các nhũ dịch lipid truyền tĩnh mạch với omega-3 PUFA được ESPEN khuyến cáo cho những bệnh nhân nặng do tác dụng chống viêm và điều hòa miễn dịch của chúng và những khuyến cáo này không loại trừ bệnh nhân bị
AKI [8].
Việc bổ sung glutamine có làm cải thiện kết cục điều trị ?
Khuyến cáo 28: Ở những bệnh nhân nặng với AKI, AKI trên nền CKD, hoặc CKD với KF, không dùng glutamine đường tiêm liều cao.
Grade A – Mức đồng thuận: mạnh (100%) Bàn luận:
Mặc dù lượng glutamine mất đi khoảng 1.2g/ngày đã được ghi nhận trong quá trình CKRT [217], và các nghiên cứu với lực mẫu thấp trước đó cho thấy một số lợi ích của L-glutamine bằng đường tĩnh mạch chỉ khi được tóm tắt trong một phân tích tổng hợp [218], bằng chứng quan trọng nhất liên quan đến glutamine là nghiên cứu REDOX [219,220] cho thấy liều cao tiêm tĩnh mạch hoặc qua EN của alanyl-glutamine dường như có hại ở nhóm bệnh nhân bị KF nặng. Bên cạnh đó, một thử nghiệm quan trọng khác, thử nghiệm MetaPlus [221] cho kết quả tương tự trên một quần thể bệnh nhân nặng.
Theo dõi
Việc đạt và duy trì mức đường huyết trong giới hạn bình thường (80-110 mg) có làm cải thiện kết cục không?
Khuyến cáo 29: Mức đường huyết phải được duy trì trong khoảng 140-180 mg/dl ở bệnh nhân AKI, AKI trên nền CKD, hoặc CKD với KF nội viện
Grade A – Mức đồng thuận: mạnh (95.5%)
Khuyến cáo 30: Không theo đuổi việc kiểm soát đường huyết chặt chẽ (80-110 mg/dl) vì tăng nguy cơ hạ đường huyết
Grade A – Mức đồng thuận: mạnh (100%)
Bàn luận cho khuyến cáo 29 và 30:
Trong bối cảnh lâm sàng này, bệnh nhân có nhiều nguy cơ bị cả tăng và hạ đường huyết [138]. Tình trạng đề kháng insulin rất phổ biến ở bệnh nhân AKI và có liên quan đến tăng nguy cơ tử vong [222]. Nồng độ glucose trong máu cao có thể được coi là một trong những yếu tố độc lập dự báo tử vong tốt nhất trong bối cảnh lâm sàng này [222]. Mặt khác, vì insulin cũng được chuyển hóa qua thận, suy giảm chức năng thận như là một yếu tố dẫn đến hạ đường huyết. Một nghiên cứu quan sát ở những bệnh nhân nặng bị chấn thương được điều trị bằng insulin để đạt được mục tiêu 70-149 mg/dl, cho thấy hạ đường huyết (<60 mg/dl) trong 76% trường hợp có KF đồng thời (AKI hoặc CKD với KF), so với 35% ở bệnh nhân có chức năng thận bình thường [223]. Trong trường hợp hạ đường huyết nặng (<40mg/dl), tỷ lệ phần trăm tương ứng là 29% và 0%, [223]. Tương tự, sự thay đổi đường huyết tăng lên ở bệnh nhân KF [223]. Về vấn đề này, việc sử dụng các phác đồ cụ thể đạt mục tiêu các giá trị đường huyết cao hơn cho bệnh nhân AKI, AKI trên nền CKD, hoặc CKD với KF, độc lập với KRT, có thể góp phần làm giảm tỷ lệ hạ đường huyết ở nhóm bệnh nhân này [224]. Hơn nữa, sự đóng góp của quá trình tạo glucose ở thận cũng rất quan trọng, đóng góp khoảng 30% tổng lượng glucose trong cơ thể [225,226]. Sự liên quan của thận trong chuyển hóa insulin và điều hòa glucose giải thích sự tăng tỷ lệ hạ đường huyết khi có AKI hoặc CKD với KF, sự giảm nhu cầu insulin ở bệnh nhân đái tháo đường bị CKD, cũng như tăng nguy cơ hạ đường huyết trong AKI [138]. Như là một yếu tố bổ sung làm phức tạp thêm việc kiểm soát đường huyết ở bệnh nhân AKI trong ICU, một số giải pháp thường được sử dụng trong quy trình HD/HF (dịch lọc và dịch thay thế) có thể cung cấp cơ chất năng lượng ở dạng citrate, glucose và lactate) như đã được thảo luận. Liên quan đến kết quả các tác động có lợi có thể có trên thận, các chiến lược nhằm kiểm soát đường huyết chặt chẽ hơn không được ủng hộ [227-231].
Nhu cầu điện giải
Ở những bệnh nhân nhập viện với AKI, AKI trên nền CKD, hoặc CKD với KF đang KRT, liệu việc theo dõi các chất điện giải (chủ yếu là phosphate, kali và magie) có cải thiện kết cục lâm sàng không ?
Khuyến cáo 31: Các bất thường về điện giải thường gặp ở bệnh nhân AKI, AKI trên CKD, hoặc CKD với KF nhận KRT và nên được theo dõi chặt chẽ.
Grade A – Mức đồng thuận: mạnh (100%) Bàn luận:
Rối loạn điện giải thường gặp ở bệnh nhân nội viện và, mặc dù tỷ lệ chính xác vẫn còn chưa rõ ràng, một tỷ lệ mắc tích lũy lên đến 65% đã được báo cáo, đặc biệt là ở những bệnh nhân nặng [232]. Trong bối cảnh lâm sàng được xét đến trong hướng dẫn này, các rối loạn điện giải được báo cáo phổ biến nhất là hạ natri máu, tăng kali máu, tăng phosphate máu, hạ calci máu, và hầu hết chúng thường cải thiện khi bắt đầu KRT. Tuy nhiên, KRT, và đặc biệt là các phương thức KRT chuyên sâu nhất như CKRT và PIKRT thường được sử dụng trong ICU, có thể có các rối loạn điện giải khác, do hiệu quả nội tại cao của các phương pháp điều trị trong việc loại bỏ chất điện giải [233,234].
Các bất thường trong thử nghiệm thường gặp liên quan đến KRTs tích cực/kéo dài bao gồm hạ phosphate máu, hạ kali máu và hạ kali máu [235,236]. Hạ phosphate máu, được định nghĩa là nồng độ phosphate huyết thanh < 0.81 mmol/l và thường được phân loại là nhẹ, trung bình và nặng (tương ứng < 0.81, 0.61 và 0.32 mmol/l), có tỷ lệ phổ biến được báo cáo lên đến 60-80% số bệnh nhân ICU [237,238]. Do mối liên quan giữa giảm phosphate máu với suy hô hấp nặng dần và tăng nguy cơ kéo dài thời gian cai máy thở, rối loạn nhịp tim và kéo dài thời gian nằm viện và tác động tiêu cực toàn bộ đến kết cục của bệnh nhân, giảm phosphate máu đặc biệt quan trọng ở những bệnh nhân nặng [239-241]. Sự cân bằng photphat được duy trì thông qua sự tương tác phức tạp giữa sự hấp thu và bài tiết phosphate; ở những bệnh nhân nội viện, cơ chế điều hòa này thường xuyên bị gián đoạn, dẫn đến tăng nguy cơ hạ phosphate máu do ba cơ chế chính: ăn không đủ và/hoặc giảm hấp thu ở ruột, tái phân bố và mất phosphate [242]. Ở những bệnh nhân bị KF, việc bắt đầu KRT có thể là một yếu tố nguy cơ đáng kể hơn nữa đối với giảm phosphate máu [232]. Cuối cùng, trong bối cảnh lâm sàng này, việc bắt đầu song song chế độ dinh dưỡng điều trị, đặc biệt là khi năng lượng từ carbohydrate được ưu tiên, có thể là một yếu tố thêm vào sự tiến triển của chứng giảm phosphate máu như một phần của hội chứng nuôi ăn lại: gồm một loạt các triệu chứng phức tạp và rối loạn điện giải máu liên quan đến việc bổ sung lại dinh dưỡng bằng đường uống hoặc đường tĩnh mạch sau một thời gian thiếu năng lượng nạp vào, cấp tính hoặc mạn tính [243]. Trong quá trình điều trị KRT kéo dài, tỷ lệ giảm phosphate huyết có thể tăng lên 80%, đặc biệt khi áp dụng chiến lược lọc máu tích cực và các giải pháp KRT không phosphate tiêu chuẩn [[235,244-249] 2017]. Hạ kali máu là một biến chứng thông thường khác được quan sát thấy ở bệnh nhân nội viện, với tỷ lệ dao động từ 12 đến 20% [250,251], với các giá trị được báo cáo tăng lên đến khoảng 25% ở bệnh nhân KF bắt đầu điều trị KRT kéo dài [235]. Nguy cơ hạ kali máu tỷ lệ thuận với liều lọc máu và có thể tăng lên khi sử dụng các dung dịch thay thế hoặc dịch lọc máu có nồng độ kali thấp, cũng như do cùng tồn tại với việc cung cấp không đủ kali hoặc các bệnh đi kèm của bệnh nhân (ví dụ: tiêu chảy, nhiễm kiềm chuyển hóa, điều trị lợi tiểu) [235,244]. Cuối cùng, hạ magie máu, thường được định nghĩa là mức magie huyết thanh < 0.7 mmol/l và thường được phân loại là nhẹ, trung bình và nặng (tương ứng giữa 0.64-0.76, từ 0.4 đến 0.63 và < 0.4 mmol/l), đã được báo cáo lên đến 12% bệnh nhân nhập viện với tỷ lệ mắc bệnh khoảng 60- 65% trong số bệnh nhân nặng [252,253]. Ngoài những nguyên nhân phổ biến nhất (như tiêu chảy, hội chứng kém hấp thu, sử dụng thuốc ức chế bơm proton mạn tính và thuốc lợi tiểu, tăng calci máu và tăng thể tích dịch), gần đây người ta còn chú ý đến việc tăng thất thoát magie trong quá trình KRT [254]. Đặc biệt, sự khởi phát và đợt cấp của hạ magie máu trong quá trình CKRT không những liên quan đến cơ chế thải trừ dựa trên cơ sở của điều trị lọc máu (thanh thải bằng khuếch tán hoặc đối lưu) mà còn liên quan đến lượng magie ion hóa được tạo thành bởi citrate khi sử dụng chống đông vùng citrate và magie bị mất trong dịch thải dưới dạng phức hợp magnesium-citrate [246,255-258].
Hạ phosphate máu, hạ kali máu và hạ magie máu trong quá trình KRT ở bệnh nhân AKI, AKI trên nền CKD, hoặc CKD với KF có thể ngăn ngừa được bằng cách sử dụng các dung dịch HD/HF được làm giàu phosphate, kali và magie không ?
Khuyến cáo 32: Nên sử dụng các dịch lọc máu có chứa kali, phosphate và magie để ngăn ngừa rối loạn điện giải trong quá trình KRT.
Grade B – Mức đồng thuận: mạnh (100%)
Bàn luận:
Không khuyến cáo bổ sung chất điện giải qua đường tĩnh mạch ở bệnh nhân đang điều trị CKRT. Về vấn đề này, do các tác động lâm sàng có thể nghiêm trọng và các rủi ro liên quan đến việc bổ sung ngoại sinh, việc ngăn ngừa sự thay đổi các chất điện giải liên quan đến KRT bằng cách điều chỉnh thành phần dịch KRT có thể là chiến lược điều trị thích hợp nhất và dễ dàng hơn [259-261]. Ngày nay, các dung dịch KRT trên thị trường được làm giàu phosphate, kali và magie, có thể được sử dụng một cách an toàn làm dịch lọc máu và dịch thay thế, được phổ biến rộng rãi và chúng cũng có thể được sử dụng trong khi tiến hành dùng chất chống đông vùng citrate. Cách tiếp cận này có thể ngăn ngừa sự khởi đầu của hạ phosphate máu, hạ kali máu và hạ magie máu. Việc áp dụng các giải pháp KRT có chứa phosphate đã được báo cáo là một chiến lược an toàn và hiệu quả để ngăn ngừa hạ phosphate máu liên quan đến CKRT, hạn chế nhu cầu bổ sung ngoại sinh [242,262-264]. Theo cách tương tự, sự khởi phát của hạ kali máu trong quá trình CKRT đã được giảm thiểu thành công bằng cách sử dụng các loại dịch thay thế và/hoặc dịch lọc có nồng độ kali 4 mEq/l [265]. Liên quan đến magie, mặc dù phần lớn các dung dịch KRT ban đầu được đặc trưng bởi nồng độ magie thấp để điều chỉnh tình trạng tăng magie máu liên quan đến KF, với sự khuếch tán của chất chống đông vùng citrate, có thể chỉ định sử dụng dịch lọc và dịch thay thế có nồng độ magie tăng lên để ngăn ngừa hạ magie máu liên quan đến KRT [255,263].
Kết luận
Bệnh nhân nội viện với AKI/AKD hoặc CKD có hoặc không có KF là một nhóm đối tượng rất không đồng nhất với nhu cầu dinh dưỡng và khả năng hấp thụ dinh dưỡng khác nhau. Tuy nhiên, vì tất cả những bệnh nhân này đều có nguy cơ cao bị suy dinh dưỡng, tình trạng dinh dưỡng cần được đánh giá kỹ lưỡng. Ngoài ra, những nhu cầu về dinh dưỡng cần được đánh giá thường xuyên theo các khía cạnh định lượng và định tính của chúng, được cá thể hóa và phối hợp với KRT một cách thận trọng, để tránh cả việc nuôi ăn thiếu và thừa. Dù cho mức độ không đồng nhất cao trong quần thể bệnh nhân được xét đến cũng như những khó khăn về phương pháp luận và sự ít ỏi của các chứng cứ chất lượng cao, thì các tài liệu cũng đã được xem xét nhằm xác định các khía cạnh quan trọng phù hợp nhất của hỗ trợ dinh dưỡng trong các cơ sở lâm sàng khác nhau của bệnh nhân AKI/AKD hoặc CKD có hoặc không có KF nội viện. Các khuyến cáo và tuyên bố thực tiễn đã được phát triển, nhằm mục đích xác định các đề nghị cho thực hành lâm sàng hàng ngày trong việc cá nhân hóa hỗ trợ dinh dưỡng ở đối tượng bệnh nhân này. Các nhóm tài liệu khan hiếm hoặc không có bằng chứng cũng đã được xác định, do đó cần thêm các nghiên cứu cơ bản hoặc nghiên cứu lâm sàng.
Quỹ tài trợ
Hướng dẫn hiện tại không nhận bất kỳ khoản tài trợ nào.
Xung đột lợi ích
Chưa ghi nhận.
Tài liệu tham khảo
- Cano N, Fiaccadori E, Tesinsky P, Toigo G, Druml W, Kuhlmann M, et al. ESPEN guidelines on enteral nutrition: adult renal failure. Clin Nutr 2006;25: 295-310.
- Cano NJ, Aparicio M, Brunori G, Carrero JJ, Cianciaruso B, Fiaccadori E, et al. ESPEN Guidelines on Parenteral Nutrition: adult renal failure. Clin Nutr 2009;28:401-14.
- Bischoff S, Singer P, Koller M, Barazzoni R, Cederholm T, van Gossum A. Standard operating procedures for ESPEN guidelines and consensus papers. Clin Nutr 2015;34:1043- 51.
- Kidney Disease Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO clinical practice guideline for acute kidney injury. Kidney Int 2012;2:1-138.
- Kidney Disease Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int 2013:1-150.
- Levey AS, Eckardt K-U, Doman NM, Christiansen SL, Hoom EJ, Ingelfinger JR, et al. Nomenclature for kidney function and disease: report of a kidney disease: improving global outcomes (KDIGO) consensus conference. Kidney Int 2020;97:1117-29.
- Preiser J, Schneider S. ESPEN disease-specific guideline framework. Clin Nutr 2011;30:549-52.
- Singer P, Blaser AR, Berger MM, Alhazzani W, Calder PC, Casaer MP, et al. ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr 2019;38:48-79.
- Cederholm T, Barazzoni R, Austin P, Ballmer P, Biolo G, Bischoff SC, et al. ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr 2017;36:49-64.
- Fiaccadori E, Regolisti G, Maggiore U. Specialized nutritional support interventions in critically ill patients on renal replacement therapy. Curr Opin Clin Nutr Metab Care 2013;16:217-24.
- Carrero JJ, Stenvinkel P, Cuppari L, Ikizler TA, Kalantar-Zadeh K, Kaysen G, et al. Etiology of the protein-energy wasting syndrome in chronic kidney disease: a consensus statement from the international society of renal nutrition and metabolism (ISRNM). J Ren Nutr 2013;23:77-90.
- Mehta R. Glycemic control and critical illness: is the kidney involved? J Am Soc Nephrol 2007;18:2623-7.
- Basi S, Pupim L, Simmons E, Sezer M, Shyr Y, Freedman S, et al. Insulin resistance in critically ill patients with acute renal failure. Am J Physiol Ren Physiol 2005;289:F259-64.
- Simmons E, Himmelfarb J, Sezer M, Chertow G, Mehta R, Paganini E, et al. Plasma cytokine levels predict mortality in patients with acute renal failure. Kidney Int 2004;65:1357- 65.
- Grams M, Rabb H. The distant organ effects of acute kidney injury. Kidney Int 2012;81:942-8.
- Himmelfarb J, Ikizler T. Acute kidney injury: changing lexicography, definitions, and epidemiology. Kidney Int 2007;71:971-6.
- Sabatino A, Regolisti G, Karupaiah T, Sahathevan S, Sadu Singh BK, Khor BH, et al. Protein-energy wasting and nutritional supplementation in patients with end-stage renal disease on hemodialysis. Clin Nutr 2017;36:663-71.
- Obi Y, Qader H, Kovesdy CP, Kalantar-Zadeh K. Latest consensus and update on protein-energy wasting in chronic kidney disease. Curr Opin Clin Nutr Metab Care 2015;18:254-62.
- Wang XH, Mitch WE. Mechanisms of muscle wasting in chronic kidney disease. Nat Rev Nephrol 2014;10:504-16.
- Johansen K, Dalrymple L, Delgado C, Kaysen G, Kornak J, Grimes B, et al. Association between body composition and frailty among prevalent hemodialysis patients: a US renal data system special study. J Am Soc Nephrol 2014;25:381-9.
- Nystrom EM, Nei AM. Metabolic support of the patient on continuous renal replacement therapy. Nutr Clin Pract 2018;33:754-66.
- Fiaccadori E, Regolisti G, Cademartiri C, Cabassi A, Picetti E, Barbagallo M, et al. Efficacy and safety of a citrate-based protocol for sustained lowefficiency dialysis in AKI using standard dialysis equipment. Clin J Am Soc Nephrol 2013;8:1670-8.
- Ikizler TA, Cano NJ, Franch H, Fouque D, Himmelfarb J, Kalantar-Zadeh K, et al. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney Int 2013;84:1096-107.
- Carrero JJ, Thomas F, Nagy K, Arogundade F, Avesani CM, Chan M, et al. Global prevalence of protein-energy wasting in kidney disease: a metaanalysis of contemporary observational studies from the international society of renal nutrition and metabolism. J Ren Nutr 2018;28:380-92.
- Li Y, Tang X, Zhang J, Wu T. Nutritional support for acute kidney injury. Cochrane Database Syst Rev 2012:Cd005426.
- Joannidis M, Druml W, Forni LG, Groeneveld ABJ, Honore PM, Hoste E, et al. Prevention of acute kidney injury and protection of renal function in the intensive care unit: update 2017 : expert opinion of the Working Group on Prevention, AKI section, European Society of Intensive Care Medicine. Intensive Care Med 2017;43:730-49.
- Reintam Blaser A, Starkopf J, Alhazzani W, Berger MM, Casaer MP, Deane AM, et al. Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive Care Med 2017;43:380-98.
- Fouque D, Kalantar-Zadeh K, Kopple J, Cano N, Chauveau P, Cuppari L, et al. A proposed nomenclature and diagnostic criteria for protein-energy wasting in acute and chronic kidney disease. Kidney Int 2008;73:391-8.
- Gomes F, Schuetz P, Bounoure L, Austin P, Ballesteros-Pomar M, Cederholm T, et al. ESPEN guidelines on nutritional support for polymorbid internal medicine patients. Clin Nutr 2018;37:336-53.
- Hegerova P, D edkov a Z, Sobotka L. Early nutritional support and physio- therapy improved long-term self-sufficiency in acutely ill older patients. Nutrition 2015;31:166-70.
- Gariballa S, Forster S, Walters S, Powers H. A randomized, double-blind, placebo- controlled trial of nutritional supplementation during acute illness. Am J Med 2006;119:693- 9.
- Starke J, Schneider H, Alteheld B, Stehle P, Meier R. Short-term individual nutritional care as part of routine clinical setting improves outcome and quality of life in malnourished medical patients. Clin Nutr 2011;30: 194-201.
- Volkert D, Hübsch S, Oster P, Schlierf G. Nutritional support and functional status in undernourished geriatric patients during hospitalization and 6- month follow-up. Aging 1996;8:386-95.
- Potter J, Roberts M, McColl J, Reilly J. Protein energy supplements in unwell elderly patients–A randomized controlled trial. J Parenter Enter Nutr 2001;25:323-9.
- Schuetz P, Fehr R, Baechli V, Geiser M, Deiss M, Gomes F, et al. Individualised nutritional support in medical inpatients at nutritional risk: a randomised clinical trial. Lancet 2019;393:2312-21.
- Allman MA, Stewart PM, Tiller DJ, Horvath JS, Duggin GG, Truswell AS. Energy supplementation and the nutritional status of hemodialysis patients. Am J Clin Nutr 1990;51:558-62.
- Eustace JA, Coresh J, Kutchey C, Te PL, Gimenez LF, Scheel PJ, et al. Randomized double-blind trial of oral essential amino acids for dialysisassociated hypoalbuminemia. Kidney Int 2000;57:2527-38.
- Hiroshige K, Sonta T, Suda T, Kanegae K, Ohtani A. Oral supplementation of branched- chain amino acid improves nutritional status in elderly patients on chronic haemodialysis. Nephrol Dial Transplant 2001;16:1856-62.
- Sharma M, Rao M, Jacob S, Jacob CK. A controlled trial of intermittent enteral nutrient supplementation in maintenance hemodialysis patients. J Ren Nutr 2002;12:229-37.
- Leon JB, Albert JM, Gilchrist G, Kushner I, Lerner E, Mach S, et al. Improving albumin levels among hemodialysis patients: a community-based randomized controlled trial. Am J Kidney Dis 2006;48:28-36.
- Moretti HD, Johnson AM, Keeling-Hathaway TJ. Effects of protein supplementation in chronic hemodialysis and peritoneal dialysis patients. J Ren Nutr 2009;19:298-303.
- Stratton R, Bircher G, Fouque D, Stenvinkel P, de Mutsert R, Engfer M, et al. Multinutrient oral supplements and tube feeding in maintenance dialysis: a systematic review and meta-analysis. Am J Kidney Dis 2005;46:387-405.
- Lacson Jr E, Wang W, Zebrowski B, Wingard R, Hakim RM. Outcomes associated with intradialytic oral nutritional supplements in patients undergoing maintenance hemodialysis: a quality improvement report. Am J Kidney Dis 2012;60:591-600.
- Cheu C, Pearson J, Dahlerus C, Lantz B, Chowdhury T, Sauer PF, et al. Association between oral nutritional supplementation and clinical outcomes among patients with ESRD. Clin J Am Soc Nephrol 2013;8:100-7.
- Weiner DE, Tighiouart H, Ladik V, Meyer KB, Zager PG, Johnson DS. Oral intradialytic nutritional supplement use and mortality in hemodialysis patients. Am J Kidney Dis 2014;63:276-85.
- Tomayko E, Kistler B, Fitschen P, Wilund K. Intradialytic protein supplementation reduces inflammation and improves physical function in maintenance hemodialysis patients. J Ren Nutr 2015;25:276-83.
- Cano NJ, Fouque D, Roth H, Aparicio M, Azar R, Canaud B, et al. Intradialytic parenteral nutrition does not improve survival in malnourished hemodialysis patients: a 2-year multicenter, prospective, randomized study. J Am Soc Nephrol 2007;18:2583-91.
- Sabatino A, Regolisti G, Antonucci E, Cabassi A, Morabito S, Fiaccadori E. Intradialytic parenteral nutrition in end-stage renal disease: practical aspects, indications and limits. J Nephrol 2014;27:377-83.
- Guarnieri G, Faccini L, Lipartiti T, Ranieri F, Spangaro F, Giuntini D, et al. Simple methods for nutritional assessment in hemodialyzed patients. Am J Clin Nutr 1980;33:1598- 607.
- Navarro JF, Mora C, Leon C, Martin-Del Rio R, Macia ML, Gallego E, et al. Amino acid losses during hemodialysis with polyacrylonitrile membranes: effect of intradialytic amino acid supplementation on plasma amino acid concentrations and nutritional variables in nondiabetic patients. Am J Clin Nutr 2000;71:765-73.
- Marsen TA, Beer J, Mann H. Intradialytic parenteral nutrition in maintenance hemodialysis patients suffering from protein-energy wasting. Results of a multicenter, open, prospective, randomized trial. Clin Nutr 2017;36:107-17.
- Anderson J, Peterson K, Bourne D, Boundy E. Effectiveness of intradialytic parenteral nutrition in treating protein-energy wasting in hemodialysis: a rapid systematic review. J Ren Nutr 2019;29:361-9.
- Schuetz P. Food for thought: why does the medical community struggle with research about nutritional therapy in the acute care setting? BMC Med 2017;15:38.
- Bounoure L, Gomes F, Stanga Z, Keller U, Meier R, Ballmer P, et al. Detection and treatment of medical inpatients with or at-risk of malnutrition: suggested procedures based on validated guidelines. Nutrition 2016;32:790-8.
- Schuetz P. Eat your lunch!” – controversies in the nutrition of the acutely, non-critically ill medical inpatient. Swiss Med Wkly 2015;145:w14132.
- Gomes F, Baumgartner A, Bounoure L, Bally M, Deutz N, Greenwald J, et al. Association of nutritional support with clinical outcomes among medical inpatients who are malnourished or at nutritional risk: an updated systematic review and meta-analysis.
- JAMA Netw Open 2019;2:e1915138. [57] Jie B, Jiang Z, Nolan M, Efron D, Zhu S, Yu K, et al. Impact of nutritional support on clinical outcome in patients at nutritional risk: a multicenter, prospective cohort study in Baltimore and Beijing teaching hospitals. Nutrition 2010;26:1088- 93.
- Casaer MP, Mesotten D, Hermans G, Wouters PJ, Schetz M, Meyfroidt G, et al. Early versus late parenteral nutrition in critically ill adults. N Engl J Med 2011;365:506-17.
- Gunst J, Vanhorebeek I, Casaer MP, Hermans G, Wouters PJ, Dubois J, et al. Impact of early parenteral nutrition on metabolism and kidney injury. J Am Soc Nephrol 2013;24:995- 1005.
- Jackson HS, MacLaughlin HL, Vidal-Diez A, Banerjee D. A new renal inpatient nutrition screening tool (Renal iNUT): a multicenter validation study. Clin Nutr 2018:2297- 303.
- Bergstrom J. Anorexia in dialysis patients. Semin Nephrol 1996;16:222 € e9.
- Kalantar-Zadeh K, Block G, McAllister C, Humphreys M, Kopple J. Appetite and inflammation, nutrition, anemia, and clinical outcome in hemodialysis patients. Am J Clin Nutr 2004;80:299-307.
- Kondrup J, Allison S, Elia M, Vellas B, Plauth M. ESPEN guidelines for nutrition screening 2002. Clin Nutr 2003;22:415e21.
- Kondrup J, Rasmussen H, Hamberg O, Stanga Z. Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr 2003;22:321-36.
- Borek P, Chmielewski M, Małgorzewicz S, De˛bska Slizien A. Analysis of outcomes of the NRS 2002 in patients hospitalized in nephrology wards.78 Nutrients 2017;9:287. 78
- Müller M, Dahdal S, Saffarini M, Uehlinger D, Arampatzis S. Evaluation of nutrition risk screening score 2002 (NRS) assessment in hospitalized chronic kidney disease patient. PloS One 2019;14:e0211200.
- Burrowes J, Larive B, Chertow G, Cockram D, Dwyer J, Greene T, et al. Selfreported appetite, hospitalization and death in haemodialysis patients: findings from the hemodialysis (HEMO) study. Nephrol Dial Transplant 2005;20:2765-74.
- Young V, Balaam S, Orazio L, Bates A, Badve S, Johnson D, et al. Appetite predicts intake and nutritional status IN patients receiving peritoneal dialysis. J Ren Care 2016;42:126-31.
- Carrero J, Chen J, Kovesdy C, Kalantar-Zadeh K. Critical appraisal of biomarkers of dietary intake and nutritional status in patients undergoing dialysis. Semin Dial 2014;27:586- 9.
- Cordeiro A, Qureshi A, Stenvinkel P, Heimbürger O, Axelsson J, Bar any P, et al. Abdominal fat deposition is associated with increased inflammation, protein-energy wasting and worse outcome in patients undergoing haemodialysis. Nephrol Dial Transplant 2010;25:562-8.
- Gracia-Iguacel C, Qureshi A, Avesani C, Heimbürger O, Huang X, Lindholm B, et al. Subclinical versus overt obesity in dialysis patients: more than meets the eye. Nephrol Dial Transplant 2013;28(Suppl 4):iv175-81.
- Fiaccadori E, Lombardi M, Leonardi S, Rotelli CF, Tortorella G, Borghetti A. Prevalence and clinical outcome associated with preexisting malnutrition in acute renal failure: a prospective cohort study. J Am Soc Nephrol 1999;10: 581-93.
- Tan SK, Loh YH, Choong HL, Suhail SM. Subjective global assessment for nutritional assessment of hospitalized patients requiring haemodialysis: a prospective cohort study. Nephrology 2016;21:944-9.
- Xavier SP, Goes CR, Bufarah MN, Balbi AL, Ponce D. Handgrip strength and weight predict long-term mortality in acute kidney injury patients. Clinical nutrition ESPEN 2017;17:86-91.
- Jeejeebhoy K. Nutritional assessment. Gastroenterol Clin N Am 1998;27: 347-69.
- Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyere O, Cederholm T, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019;48:16-31.
- Puthucheary ZA, Rawal J, McPhail M, Connolly B, Ratnayake G, Chan P, et al. Acute skeletal muscle wasting in critical illness. JAMA 2013;310:1591-600.
- Koukourikos K, Tsaloglidou A, Kourkouta L. Muscle atrophy in intensive care unit patients. Acta Inf Med : AIM : J Soc Med Inform Bosnia Herzegovina : casopis Drustva za medicinsku informatiku BiH. 2014;22:406-10.
- Puthucheary Z, Montgomery H, Moxham J, Harridge S, Hart N. Structure to function: muscle failure in critically ill patients. J Physiol 2010;588:4641-8.
- Hiesmayr M. Nutrition risk assessment in the ICU. Curr Opin Clin Nutr Metab Care 2012;15:174-80.
- Wieske L, Dettling-Ihnenfeldt DS, Verhamme C, Nollet F, van Schaik IN, Schultz MJ, et al. Impact of ICU-acquired weakness on post-ICU physical functioning: a follow-up study. Crit Care 2015;19:196.
- Puthucheary ZA, Hart N. Skeletal muscle mass and mortality – but what about functional outcome? Crit Care 2014;18:110.
- Weijs PJ, Looijaard WG, Dekker IM, Stapel SN, Girbes AR, Oudemans-van Straaten HM, et al. Low skeletal muscle area is a risk factor for mortality in mechanically ventilated critically ill patients. Crit Care 2014;18:R12.
- Ismael S, Savalle M, Trivin C, Gillaizeau F, D’Auzac C, Faisy C. The consequences of sudden fluid shifts on body composition in critically ill patients. Crit Care 2014;18:R49.
- Ganesan MV, Annigeri RA, Shankar B, Rao BS, Prakash KC, Seshadri R, et al. The protein equivalent of nitrogen appearance in critically ill acute renal failure patients undergoing continuous renal replacement therapy. J Ren Nutr 2009;19:161-6.
- Buckinx F, Landi F, Cesari M, Fielding RA, Visser M, Engelke K, et al. Pitfalls in the measurement of muscle mass: a need for a reference standard. J Cachexia Sarcopenia Muscle 2018;9:269-78.
- Sabatino A, Regolisti G, Bozzoli L, Fani F, Antoniotti R, Maggiore U, et al. Reliability of bedside ultrasound for measurement of quadriceps muscle thickness in critically ill patients with acute kidney injury. Clin Nutr 2017;36: 1710-5.
- Sabatino A, Regolisti G, di Mario F, Ciuni A, Palumbo A, Peyronel F, et al. Validation by CT scan of quadriceps muscle thickness measurement by ultrasound in acute kidney injury. J Nephrol 2020;33:109-17.
- Connolly B, MacBean V, Crowley C, Lunt A, Moxham J, Rafferty GF, et al. Ultrasound for the assessment of peripheral skeletal muscle architecture in critical illness: a systematic review. Crit Care Med 2015;43:897-905.
- Regolisti G, Maggiore U, Sabatino A, Gandolfini I, Pioli S, Torino C, et al. Interaction of healthcare staff’s attitude with barriers to physical activity in hemodialysis patients: a quantitative assessment. PloS One 2018;13: e0196313.
- Battaglia Y, Ullo I, Massarenti S, Esposito P, Prencipe M, Ciancio G, et al. Ultrasonography of quadriceps femoris muscle and subcutaneous fat tissue and body composition by BIVA in chronic dialysis patients. Nutrients 2020;12:1388.
- Sabatino A, Regolisti G, Delsante M, Di Motta T, Cantarelli C, Pioli S, et al. Noninvasive evaluation of muscle mass by ultrasonography of quadriceps femoris muscle in End-Stage Renal Disease patients on hemodialysis. Clin81 Nutr 2019;38:1232-9.
- Braunschweig CA, Sheean PM, Peterson SJ, Gomez Perez S, Freels S, Troy KL, et al. Exploitation of diagnostic computed tomography scans to assess the impact of nutrition support on body composition changes in respiratory failure patients. J Parenter Enter Nutr 2014;38:880-5.
- Looijaard W, Denneman N, Broens B, Girbes ARJ, Weijs PJM, Oudemans-van Straaten HM. Achieving protein targets without energy overfeeding in critically ill patients: a prospective feasibility study. Clin Nutr 2019;38(6): 2623-31.
- Fuchs G, Thevathasan T, Chretien YR, Mario J, Piriyapatsom A, Schmidt U, et al. Lumbar skeletal muscle index derived from routine computed tomography exams predict adverse post-extubation outcomes in critically ill patients. J Crit Care 2018;44:117-23.
- Jolley SE, Bunnell AE, Hough CL. ICU-acquired weakness. Chest 2016;150: 1129e40.
- Zampieri FG, Bozza FA, Moralez GM, Mazza DD, Scotti AV, Santino MS, et al. The effects of performance status one week before hospital admission on the outcomes of critically ill patients. Intensive Care Med 2017;43:39-47.
- Ferrante LE, Pisani MA, Murphy TE, Gahbauer EA, Leo-Summers LS, Gill TM. Functional trajectories among older persons before and after critical illness. JAMA Intern Med 2015;175:523-9.
- Hermans G, Van den Berghe G. Clinical review: intensive care unit acquired weakness. Crit Care 2015;19:274.
- Stevens RD, Marshall SA, Cornblath DR, Hoke A, Needham DM, de Jonghe B, et al. A framework for diagnosing and classifying intensive care unitacquired weakness. Crit Care Med 2009;37:S299-308.
- Parry SM, Berney S, Granger CL, Dunlop DL, Murphy L, El-Ansary D, et al. A new two-tier strength assessment approach to the diagnosis of weakness in intensive care: an observational study. Crit Care 2015;19:52.
- Ali NA, O’Brien Jr JM, Hoffmann SP, Phillips G, Garland A, Finley JC, et al. Acquired weakness, handgrip strength, and mortality in critically ill patients. Am J Respir Crit Care Med 2008;178:261-8.
- Bakkal H, Dizdar O, Erdem S, Kulakoglu S, Akcakaya B, Kat ırcılar Y, et al. The relationship between hand grip strength and nutritional status determined by malnutrition inflammation score and biochemical parameters in hemodialysis patients. J Ren Nutr 2020;30(6):548-55. https://doi.org/10.1053/j.jrn.2020.01.026.
- Bauer JM, Sieber CC. Sarcopenia and frailty: a clinician’s controversial point of view. Exp Gerontol 2008;43:674-8.
- Moreau-Gaudry X, Jean G, Genet L, Lataillade D, Legrand E, Kuentz F, et al. A simple protein-energy wasting score predicts survival in maintenance hemodialysis patients. J Ren Nutr 2014;24:395-400.
- Evans W, Morley J, Argiles J, Bales C, Baracos V, Guttridge D, et al. Cachexia: a new definition. Clin Nutr 2008;27:793-9.
- Slee A, McKeaveney C, Adamson G, Davenport A, Farrington K, Fouque D, et al. Estimating the prevalence of muscle wasting, weakness, and sarcopenia in hemodialysis patients. J Ren Nutr 2019:313-21.
- Fielding RA, Vellas B, Evans WJ, Bhasin S, Morley JE, Newman AB, et al. Sarcopenia: an undiagnosed condition in older adults. Current consensus definition: prevalence, etiology, and consequences. International working group on sarcopenia. J Am Med Dir Assoc 2011;12:249-56.
- Cruz-Jentoft AJ, Baeyens JP, Bauer JM, Boirie Y, Cederholm T, Landi F, et al. Sarcopenia: European consensus on definition and diagnosis: report of the European working group on sarcopenia in older people. Age Ageing 2010;39:412-23.
- Muscaritoli M, Anker S, Argiles J, Aversa Z, Bauer J, Biolo G, et al. Consensus definition of sarcopenia, cachexia and pre-cachexia: joint document elaborated by special interest groups (SIG) “Cachexia-Anorexia in chronic wasting diseases” and “nutrition in geriatrics”. Clin Nutr 2010;29:154-9.
- Studenski S, Peters K, Alley D, Cawthon P, McLean R, Harris T, et al. The FNIH sarcopenia project: rationale, study description, conference recommendations, and final estimates. J Gerontol A Biol Sci Med Sci 2014;69: 547-58.
- Zheng T, Zhu X, Liang H, Huang H, Yang J, Wang S. Impact of early enteral nutrition on short term prognosis after acute stroke. J Clin Neurosci 2015;22: 1473e6.
- Jolliet P, Pichard C, Biolo G, Chiolero R, Grimble G, Leverve X, et al. Enteral nutrition in intensive care patients: a practical approach. Clin Nutr 1999;18: 47-56.
- Minard G, Kudsk K, Melton S, Patton J, Tolley E. Early versus delayed feeding with an immune-enhancing diet in patients with severe head injuries. J Parenter Enter Nutr 2000;24:145-9.
- Peck M, Kessler M, Cairns B, Chang Y, Ivanova A, Schooler W. Early enteral nutrition does not decrease hypermetabolism associated with burn injury. J Trauma 2004;57:1143-8.
- Nguyen N, Fraser R, Bryant L, Burgstad C, Chapman M, Bellon M, et al. The impact of delaying enteral feeding on gastric emptying, plasma cholecystokinin, and peptide YY concentrations in critically ill patients. Crit Care Med 2008;36:1469-74.
- Moses V, Mahendri N, John G, Peter J, Ganesh A. Early hypocaloric enteral nutritional supplementation in acute organophosphate poisoning–A prospective randomized trial. Clin Toxicol 2009;47:419-24.
- Chourdakis M, Kraus M, Tzellos T, Sardeli C, Peftoulidou M, Vassilakos D, et al. Effect of early compared with delayed enteral nutrition on endocrine function in patients with traumatic brain injury: an open-labeled randomized trial. J Parenter Enter Nutr 2012;36:108- 16.83
- Pupelis G, Selga G, Austrums E, Kaminski A. Jejunal feeding, even when instituted late, improves outcomes in patients with severe pancreatitis and peritonitis. Nutrition 2001;17:91-4.
- Malhotra A, Mathur A, Gupta S. Early enteral nutrition after surgical treatment of gut perforations: a prospective randomised study. J Postgrad Med 2004;50:102-6.
- Kaur N, Gupta M, Minocha V. Early enteral feeding by nasoenteric tubes in patients with perforation peritonitis. World J Surg 2005;29:1023-7.
- Barlow R, Price P, Reid T, Hunt S, Clark G, Havard T, et al. Prospective multicentre randomised controlled trial of early enteral nutrition for patients undergoing major upper gastrointestinal surgical resection. Clin Nutr 2011;30:560-6.
- Bakker O, van Brunschot S, van Santvoort H, Besselink M, Bollen T, Boermeester M, et al. Early versus on-demand nasoenteric tube feeding in acute pancreatitis. N Engl J Med 2014;371:1983-93.
- Lam N, Tien N, Khoa C. Early enteral feeding for burned patients–an effective method which should Be encouraged in developing countries. Burns 2008;34:192-6.
- Altintas N, Aydin K, Türkoglu M, Abbasoglu O, Topeli A. Effect of enteralversus parenteral nutrition on outcome of medical patients requiring mechanical ventilation. Nutr Clin Pract 2011;26:322-9.
- Justo Meirelles C, de Aguilar-Nascimento J. Enteral or parenteral nutrition in traumatic brain injury: a prospective randomised trial. Nutr Hosp 2011;26: 1120-4.
- Harvey S, Parrott F, Harrison D, Bear D, Segaran E, Beale R, et al. Trial of the route of early nutritional support in critically ill adults. N Engl J Med 2014;371:1673-84.
- Reignier J, Boisrame-Helms J, Brisard L, Lascarrou J, Ait Hssain A, Anguel N, et al. Enteral versus parenteral early nutrition in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2). Lancet 2018;391:133-43.
- Bozzetti F, Braga M, Gianotti L, Gavazzi C, Mariani L. Postoperative enteral versus parenteral nutrition in malnourished patients with gastrointestinal cancer: a randomised multicentre trial. Lancet 2001;358:1487-92.
- Gupta R, Patel K, Calder P, Yaqoob P, Primrose J, Johnson C. A randomised clinical trial to assess the effect of total enteral and total parenteral nutritional support on metabolic, inflammatory and oxidative markers in patients with predicted severe acute pancreatitis (APACHE II > or = 6). Pancreatology 2003;3:406-13.
- Eckerwall G, Axelsson J, Andersson R. Early nasogastric feeding in predicted severe acute pancreatitis: a clinical, randomized study. Ann Surg 2006;244: 959-65.
- Petrov M, Kukosh M, Emelyanov N. A randomized controlled trial of enteral versus parenteral feeding in patients with predicted severe acute pancreatitis shows a significant reduction in mortality and in infected pancreatic complications with total enteral nutrition. Dig Surg 2006;23:336-44.
- Sun J, Mu X, Li W, Tong Z, Li J, Zheng S. Effects of early enteral nutrition on immune function of severe acute pancreatitis patients. World J Gastroenterol 2013;19:917-22.
- Boelens P, Heesakkers F, Luyer M, van Barneveld K, de Hingh I, Nieuwenhuijzen G, et al. Reduction of postoperative ileus by early enteral nutrition in patients undergoing major rectal surgery: prospective, randomized, controlled trial. Ann Surg 2014;259:649-55.
- Aiko S, Yoshizumi Y, Sugiura Y, Matsuyama T, Naito Y, Matsuzaki J, et al. Beneficial effects of immediate enteral nutrition after esophageal cancer surgery. Surg Today 2001;31:971-8.
- Elke G, van Zanten AR, Lemieux M, McCall M, Jeejeebhoy KN, Kott M, et al. Enteral versus parenteral nutrition in critically ill patients: an updated systematic review and meta- analysis of randomized controlled trials. Crit Care 2016;20:117.
- Fiaccadori E, Maggiore U, Giacosa R, Rotelli C, Picetti E, Sagripanti S, et al. Enteral nutrition in patients with acute renal failure. Kidney Int 2004;65: 999-1008.
- Fiaccadori E, Sabatino A, Morabito S, Bozzoli L, Donadio C, Maggiore U, et al. Hyper/hypoglycemia and acute kidney injury in critically ill patients. Clin Nutr 2016;35:317- 21.
- Oshima T, Berger MM, De Waele E, Guttormsen AB, Heidegger CP, Hiesmayr M, et al. Indirect calorimetry in nutritional therapy. A position paper by the ICALIC study group. Clin Nutr 2017;36:651-62.
- Goes CR, Balbi AL, Ponce D. Evaluation of factors associated with hypermetabolism and hypometabolism in critically ill AKI patients. Nutrients 2018;10:505.
- McClave S, Taylor B, Martindale R, Warren M, Johnson D, Braunschweig C, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: society of critical care medicine (SCCM) and American society for parenteral and enteral nutrition (A.S.P.E.N.). J Parenter Enter Nutr 2016;40:159-211.
- Sabatino A, Theilla M, Hellerman M, Singer P, Maggiore U, Barbagallo M, et al. Energy and protein in critically ill patients with AKI: a prospective, multicenter observational study using indirect calorimetry and protein catabolic rate. Nutrients 2017;9:802.
- de Goes CR, Berbel-Bufarah MN, Sanches AC, Xavier PS, Balbi AL, Ponce D. Poor agreement between predictive equations of energy expenditure and measured energy expenditure in critically ill acute kidney injury patients. Ann Nutr Metab 2016;68:276-84.
- Scheinkestel CD, Kar L, Marshall K, Bailey M, Davies A, Nyulasi I, et al. Prospective randomized trial to assess caloric and protein needs of critically Ill, anuric, ventilated patients requiring continuous renal replacement therapy. Nutrition 2003;19:909-16.
- Scheinkestel CD, Adams F, Mahony L, Bailey M, Davies AR, Nyulasi I, et al. Impact of increasing parenteral protein loads on amino acid levels and balance in critically ill anuric patients on continuous renal replacement therapy. Nutrition 2003;19:733-40.
- Boullata J, Williams J, Cottrell F, Hudson L, Compher C. Accurate determination of energy needs in hospitalized patients. J Am Diet Assoc 2007;107: 393-401.
- Miles J. Energy expenditure in hospitalized patients: implications for nutritional support. Mayo Clin Proc 2006;81:809-16.
Brown RO, Compher C, Directors ASfPaENBo A.S.P.E.N. Clinical guidelines: nutrition support in adult acute and chronic renal failure. J Parenter Enter Nutr 2010;34:366- 77. - Palevsky P, Liu K, Brophy P, Chawla L, Parikh C, Thakar C, et al. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury. Am J Kidney Dis 2013;61:649-72.
- Fliser D, Laville M, Covic A, Fouque D, Vanholder R, Juillard L, et al. A European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy. Nephrol Dial Transplant 2012;27: 4263-72.
- Picolo MF, Lago AF, Menegueti MG, Nicolini EA, Basile-Filho A, Nunes AA, et al. Harris-benedict equation and resting energy expenditure estimates in critically ill ventilator patients. Am J Crit Care 2016;25:e21-9.
- Goes CR, Vogt BP, Sanches ACS, Balbi AL, Ponce D. Influence of different dialysis modalities in the measurement of resting energy expenditure in patients with acute kidney injury in ICU. Clin Nutr 2017;36:1170-4.
- Wu C, Wang X, Yu W, Li P, Liu S, Li J, et al. Short-term consequences of continuous renal replacement therapy on body composition and metabolic status in sepsis. Asia Pac J Clin Nutr 2016;25:300-7.
- Jonckheer J, Demol J, Lanckmans K, Malbrain M, Spapen H, De Waele E. MECCIAS trial: metabolic consequences of continuous veno-venous hemofiltration on indirect calorimetry.
- Clin Nutr 2020;39(12):3797-803. https:// doi.org/10.1016/j.clnu.2020.04.017.
- Jonckheer J, Spapen H, Debain A, Demol J, Diltoer M, Costa O, et al. CO 2 and O 2 removal during continuous veno-venous hemofiltration: a pilot study. BMC Nephrol 2019;20:222.
- Zusman O, Theilla M, Cohen J, Kagan I, Bendavid I, Singer P. Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort study. Crit Care 2016;20:367.
- Stapel SN, de Grooth HJ, Alimohamad H, Elbers PW, Girbes AR, Weijs PJ, et al. Ventilator-derived carbon dioxide production to assess energy expenditure in critically ill patients: proof of concept. Crit Care 2015;19:370.
- Cobean R, Gentilello L, Parker A, Jurkovich G, Maier R. Nutritional assessment using a pulmonary artery catheter. J Trauma 1992;33:452-6.
- Avesani C, Kamimura M, Cuppari L. Energy expenditure in chronic kidney disease patients. J Ren Nutr 2011;21:27e30.
- Rodrigues C, Santos J, Quinto B, Marrocos M, Teixeira A, Rodrigues C, et al. Impact of metabolic syndrome on resting energy expenditure in patients with chronic kidney disease. Clinical nutrition ESPEN 2016;15:107-13.
- Fiaccadori E, Maggiore U, Rotelli C, Giacosa R, Picetti E, Parenti E, et al. Effects of different energy intakes on nitrogen balance in patients with acute renal failure: a pilot study. Nephrol Dial Transplant 2005;20:1976-80.
- Arabi Y, Tamim H, Dhar G, Al-Dawood A, Al-Sultan M, Sakkijha M, et al. Permissive underfeeding and intensive insulin therapy in critically ill patients: a randomized controlled trial. Am J Clin Nutr 2011;93:569-77.
- Rice T, Wheeler A, Thompson B, Steingrub J, Hite R, Moss M, et al. Initial trophic vs full enteral feeding in patients with acute lung injury: the EDEN randomized trial. JAMA 2012;307:795-803.
- Singer P, Anbar R, Cohen J, Shapiro H, Shalita-Chesner M, Lev S, et al. The tight calorie control study (TICACOS): a prospective, randomized, controlled pilot study of nutritional support in critically ill patients. Intensive Care Med 2011;37:601-9.
- Tappy L, Schwarz J, Schneiter P, Cayeux C, Revelly J, Fagerquist C, et al. Effects of isoenergetic glucose-based or lipid-based parenteral nutrition on glucose metabolism, de novo lipogenesis, and respiratory gas exchanges in critically ill patients. Crit Care Med 1998;26:860-7.
- Iapichino G, Radrizzani D, Armani S, Noto A, Spanu P, Mistraletti G. Metabolic treatment of critically ill patients: energy balance and substrate disposal. Minerva Anestesiol 2006;72:533-41.
- Dvir D, Cohen J, Singer P. Computerized energy balance and complications in critically ill patients: an observational study. Clin Nutr 2006;25:37-44.
- Villet S, Chiolero R, Bollmann M, Revelly J, Cayeux RNM, Delarue J, et al. Negative impact of hypocaloric feeding and energy balance on clinical outcome in ICU patients. Clin Nutr 2005;24:502-9.
- Hellerman M, Sabatino A, Theilla M, Kagan I, Fiaccadori E, Singer P. Carbohydrate and lipid prescription, administration, and oxidation in critically ill patients with acute kidney injury: a post hoc analysis. J Ren Nutr 2019;29: 289-94.
- Schneeweiss B, Graninger W, Stockenhuber F, Druml W, Ferenci P, Eichinger S, et al. Energy metabolism in acute and chronic renal failure. Am J Clin Nutr 1990;52:596-601.
- Morabito S, Pistolesi V, Tritapepe L, Fiaccadori E. Regional citrate anticoagulation for RRTs in critically ill patients with AKI. Clin J Am Soc Nephrol 2014;9:2173-88.
- Fiaccadori E, Pistolesi V, Mariano F, Mancini E, Canepari G, Inguaggiato P, et al. Regional citrate anticoagulation for renal replacement therapies in patients with acute kidney injury: a position statement of the Work Group “Renal Replacement Therapies in Critically Ill Patients” of the Italian Society of Nephrology. J Nephrol 2015;28:151-64.
- Jonckheer J, Vergaelen K, Spapen H, Malbrain M, De Waele E. Modification of nutrition therapy during continuous renal replacement therapy in critically ill pediatric patients: a narrative review and recommendations. Nutr Clin Pract 2019;34:37-47.
- Balik M, Zakharchenko M, Otahal M, Hruby J, Polak F, Rusinova K, et al. Quantification of systemic delivery of substrates for intermediate metabolism during citrate anticoagulation of continuous renal replacement therapy. Blood Purif 2012;33:80-7.
- Balik M, Zakharchenko M, Leden P, Otahal M, Hruby J, Polak F, et al. Bioenergetic gain of citrate anticoagulated continuous hemodiafiltration–a comparison between 2 citrate modalities and unfractionated heparin. J Crit Care 2013;28:87-95.
- New AM, Nystrom EM, Frazee E, Dillon JJ, Kashani KB, Miles JM. Continuous renal replacement therapy: a potential source of calories in the critically ill. Am J Clin Nutr 2017;105:1559-63.
- Stevenson JM, Heung M, Vilay AM, Eyler RF, Patel C, Mueller BA. In vitro glucose kinetics during continuous renal replacement therapy: implications for caloric balance in critically ill patients. Int J Artif Organs 2013;36: 861-8.
- Faisy C, Guerot E, Diehl J, Labrousse J, Fagon J. Assessment of resting energy expenditure in mechanically ventilated patients. Am J Clin Nutr 2003;78: 241-9.
- de Oliveira MC, Bufarah MNB, Ponce D, Balbi AL. Poor agreement between indirect calorimetry and predictive formula of rest energy expenditure in pre-dialytic and dialytic chronic kidney disease. Clinical nutrition ESPEN 2018;28:136-40.
- Goes CR, Sanches AC, Balbi A, Ponce D. Daily variability of resting energy expenditure in acute kidney injury patients on dialysis. J Bras Nefrol 2017;39:15-22.
- Frankenfield DC, Badellino MM, Reynolds HN, Wiles 3rd CE, Siegel JH, Goodarzi S. Amino acid loss and plasma concentration during continuous hemodiafiltration. J Parenter Enter Nutr 1993;17:551-61.
- Davenport A, Roberts NB. Amino acid losses during continuous high-flux hemofiltration in the critically ill patient. Crit Care Med 1989;17:1010-4.
- Davies SP, Reaveley DA, Brown EA, Kox WJ. Amino acid clearances and daily losses in patients with acute renal failure treated by continuous arteriovenous hemodialysis. Crit Care Med 1991;19:1510-5.
- Maxvold NJ, Smoyer WE, Custer JR, Bunchman TE. Amino acid loss and nitrogen balance in critically ill children with acute renal failure: a prospective comparison between classic hemofiltration and hemofiltration with dialysis. Crit Care Med 2000;28:1161-5.
- Bellomo R, Seacombe J, Daskalakis M, Farmer M, Wright C, Parkin G, et al. A prospective comparative study of moderate versus high protein intake for critically ill patients with acute renal failure. Ren Fail 1997;19:111-20.
- Bellomo R, Tan HK, Bhonagiri S, Gopal I, Seacombe J, Daskalakis M, et al. High protein intake during continuous hemodiafiltration: impact on amino acids and nitrogen balance. Int J Artif Organs 2002;25:261-8.
- Zappitelli M, Juarez M, Castillo L, Coss-Bu J, Goldstein SL. Continuous renal replacement therapy amino acid, trace metal and folate clearance in critically ill children. Intensive Care Med 2009;35:698-706.
- Btaiche IF, Mohammad RA, Alaniz C, Mueller BA. Amino Acid requirements in critically ill patients with acute kidney injury treated with continuous renal replacement therapy. Pharmacotherapy 2008;28:600-13.
- Sn S, Rj DB, Pj T, Mg V, Arj G, Hm O-vS. Amino acid loss during continuous venovenous hemofiltration in critically ill patients. Blood Purif 2019;48: 321-9.
- Cano NJ, Saingra Y, Dupuy AM, Lorec-Penet AM, Portugal H, Lairon D, et al. Intradialytic parenteral nutrition: comparison of olive oil versus soybean oilbased lipid emulsions. Br J Nutr 2006;95:152-9.
- Chima CS, Meyer L, Hummell AC, Bosworth C, Heyka R, Paganini EP, et al. Protein catabolic rate in patients with acute renal failure on continuous arteriovenous hemofiltration and total parenteral nutrition. J Am Soc Nephrol 1993;3:1516-21.
- Marshall MR, Golper TA, Shaver MJ, Alam MG, Chatoth DK. Urea kinetics during sustained low-efficiency dialysis in critically ill patients requiring renal replacement therapy. Am J Kidney Dis 2002;39:556-70.
- Macias WL, Alaka KJ, Murphy MH, Miller ME, Clark WR, Mueller BA. Impact of the nutritional regimen on protein catabolism and nitrogen balance in patients with acute renal failure. J Parenter Enter Nutr 1996;20:56-62.
- Leblanc M, Garred LJ, Cardinal J, Pichette V, Nolin L, Ouimet D, et al. Catabolism in critical illness: estimation from urea nitrogen appearance and creatinine production during continuous renal replacement therapy. Am J Kidney Dis 1998;32:444-53.
- Kritmetapak K, Peerapornratana S, Srisawat N, Somlaw N, Lakananurak N, Dissayabutra T, et al. The impact of macro-and micronutrients on predicting outcomes of critically ill patients requiring continuous renal replacement therapy. PloS One 2016;11:e0156634.
- Li Y, Li H, Zhang D. Timing of continuous renal replacement therapy in patients with septic AKI: a systematic review and meta-analysis. Medicine 2019;98:e16800.
- Kopple J, Monteon F, Shaib J. Effect of energy intake on nitrogen metabolism in nondialyzed patients with chronic renal failure. Kidney Int 1986;29: 734-42.
- Williams B, Hattersley J, Layward E, Walls J. Metabolic acidosis and skeletal muscle adaptation to low protein diets in chronic uremia. Kidney Int 1991;40:779-86.
- Hoffer L, Taveroff A, Schiffrin A. Metabolic adaptation to protein restriction in insulin- dependent diabetes mellitus. Am J Physiol 1997;272:E59-67.
- Prelack K, Sheridan RL. Micronutrient supplementation in the critically ill patient: strategies for clinical practice. J Trauma 2001;51:601-20.
- Berger M. Do micronutrient deficiencies contribute to mitochondrial failure in critical illness? Curr Opin Clin Nutr Metab Care 2020;23:102-10.
- Ostermann M, Summers J, Lei K, Card D, Harrington D, Sherwood R, et al. Micronutrients in critically ill patients with severe acute kidney injury – a prospective study. Sci Rep 2020;10:1505.
- Vanek VW, Borum P, Buchman A, Fessler TA, Howard L, Jeejeebhoy K, et al.A.S.P.E.N. position paper: recommendations for changes in commercially available parenteral multivitamin and multi-trace element products. Nutr Clin Pract 2012;27:440-91.
- Tucker BM, Safadi S, Friedman AN. Is routine multivitamin supplementation necessary in US chronic adult hemodialysis patients? A systematic review. J Ren Nutr 2015;25:257-64.
- Bellomo R, Parkin G, Boyce N. Acute renal failure in the critically ill: management by continuous veno-venous hemodiafiltration. J Crit Care 1993;8: 140-4.
- Story DA, Ronco C, Bellomo R. Trace element and vitamin concentrations and losses in critically ill patients treated with continuous venovenous hemofiltration. Crit Care Med 1999;27:220-3.
- Berger MM, Shenkin A, Revelly JP, Roberts E, Cayeux MC, Baines M, et al. Copper, selenium, zinc, and thiamine balances during continuous venovenous hemodiafiltration in critically ill patients. Am J Clin Nutr 2004;80: 410-6.
- Dizdar O, Yıldız A, Gul C, Gunal A, Ersoy A, Gundogan K. The effect of hemodialysis, peritoneal dialysis and renal transplantation on nutritional status and serum micronutrient levels in patients with end-stage renal disease; multicenter, 6-month period, longitudinal study. J Trace Elem Med Biol 2020;60:126498.
- Tonelli M, Wiebe N, Thompson S, Kinniburgh D, Klarenbach S, Walsh M, et al. Trace element supplementation in hemodialysis patients: a randomized controlled trial. BMC Nephrol 2015;16:52.
- Casaer MP, Mesotten D, Schetz MR. Bench-to-bedside review: metabolism and nutrition. Crit Care 2008;12:222.
- Wiesen P, Van Overmeire L, Delanaye P, Dubois B, Preiser JC. Nutrition disorders during acute renal failure and renal replacement therapy. J Parenter Enter Nutr 2011;35:217- 22.
- Ben-Hamouda N, Charriere M, Voirol P, Berger MM. Massive copper and selenium losses cause life-threatening deficiencies during prolonged continuous renal replacement. Nutrition 2017;34:71-5.
- Chiolero R, Berger MM. Nutritional support during renal replacement therapy. Contrib Nephrol 2007;156:267-74.
- Kobashigawa J, Dadhania D, Bhorade S, Adey D, Berger J, Bhat G, et al. Report from the American Society of Transplantation on frailty in solid organ transplantation. Am J Transplant : Off J Am Soc Transplant Am Soc Transplant Surgeon 2018:984-94.
- Spite M, Claria J, Serhan C. Resolvins, specialized proresolving lipid mediators, and their potential roles in metabolic diseases. Cell Metabol 2014;19: 21-36.
- Hassan I, Gronert K. Acute changes in dietary omega-3 and omega-6 polyunsaturated fatty acids have a pronounced impact on survival following ischemic renal injury and formation of renoprotective docosahexaenoic acidderived protectin D1. J Immunol 2009;182:3223-32.
- Chua H, Baldwin I, Fealy N, Naka T, Bellomo R. Amino acid balance with extended daily diafiltration in acute kidney injury. Blood Purif 2012;33: 292-9.
- Wischmeyer P, Dhaliwal R, McCall M, Ziegler T, Heyland D. Parenteral glutamine supplementation in critical illness: a systematic review. Crit Care 2014;18:R76.
- Heyland D, Wischmeyer P, Day A. Glutamine and antioxidants in critically ill patients. N Engl J Med 2013;369:401-9.
- Heyland D, Elke G, Cook D, Berger M, Wischmeyer P, Albert M, et al. Glutamine and antioxidants in the critically ill patient: a post hoc analysis of a large-scale randomized trial. J Parenter Enter Nutr 2015;39:401-9.
- van Zanten A, Sztark F, Kaisers U, Zielmann S, Felbinger T, Sablotzki A, et al. High- protein enteral nutrition enriched with immune-modulating nutrients vs standard high-protein enteral nutrition and nosocomial infections in the ICU: a randomized clinical trial. JAMA 2014;312:514-24.
- Basi S, Pupim LB, Simmons EM, Sezer MT, Shyr Y, Freedman S, et al. Insulin resistance in critically ill patients with acute renal failure. Am J Physiol Ren Physiol 2005;289:F259-64.
- Dickerson R, Hamilton L, Connor K, Maish G, Croce M, Minard G, et al. Increased hypoglycemia associated with renal failure during continuous intravenous insulin infusion and specialized nutritional support. Nutrition 2011;27:766-72.
- Dickerson R, Lynch A, Maish G, Croce M, Minard G, Brown R. Improved safety with intravenous insulin therapy for critically ill patients with renal failure. Nutrition 2014;30:557- 62.
- Cersosimo E, Garlick P, Ferretti J. Renal glucose production during insulininduced hypoglycemia in humans. Diabetes 1999;48:261-6.
- Meyer C, Dostou J, Gerich J. Role of the human kidney in glucose counterregulation. Diabetes 1999;48:943-8.
- Brunkhorst FM, Engel C, Bloos F, Meier-Hellmann A, Ragaller M, Weiler N, et al. Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 2008;358:125-39.
- Finfer S, Chittock D, Li Y, Foster D, Dhingra V, Bellomo R, et al. Intensive versus conventional glucose control in critically ill patients with traumatic brain injury: long-term follow-up of a subgroup of patients from the NICESUGAR study. Intensive Care Med 2015;41:1037-47.
- Preiser J, Devos P, Ruiz-Santana S, Melot C, Annane D, Groeneveld J, et al. A prospective randomised multi-centre controlled trial on tight glucose control by intensive insulin therapy in adult intensive care units: the glucontrol study. Intensive Care Med 2009;35:1738-48.
- Marik P, Preiser J. Toward understanding tight glycemic control in the ICU: a systematic review and metaanalysis. Chest 2010;137:544-51.
- Griesdale D, de Souza R, van Dam R, Heyland D, Cook D, Malhotra A, et al. Intensive insulin therapy and mortality among critically ill patients: a metaanalysis including NICE- SUGAR study data. CMAJ (Can Med Assoc J) 2009;180:821-7.
- Jung S, Kim H, Park S, Jhee J, Yun H, Kim H, et al. Electrolyte and mineral disturbances in septic acute kidney injury patients undergoing continuous renal replacement therapy. Medicine 2016;95:e4542.
- Macedo E, Mehta R. Continuous dialysis therapies: core curriculum 2016. Am J Kidney Dis 2016;68:645-57.
- Maynar Moliner J, Honore P, Sanchez-Izquierdo Riera J, Herrera Guti errez M, Spapen H. Handling continuous renal replacement therapy-related adverse effects in intensive care unit patients: the dialytrauma concept. Blood Purif 2012;34:177-85.
- Bellomo R, Cass A, Cole L, Finfer S, Gallagher M, Lo S, et al. Intensity of continuous renal-replacement therapy in critically ill patients. N Engl J Med 2009;361:1627-38.
- Finkel K, Podoll A. Complications of continuous renal replacement therapy. Semin Dial 2009;22:155-9.
- Suzuki S, Egi M, Schneider A, Bellomo R, Hart G, Hegarty C. Hypophosphatemia in critically ill patients. J Crit Care 2013;28(536):e9. 19.
- Geerse D, Bindels A, Kuiper M, Roos A, Spronk P, Schultz M. Treatment of hypophosphatemia in the intensive care unit: a review. Crit Care 2010;14: R147.
- Yang Y, Zhang P, Cui Y, Lang X, Yuan J, Jiang H, et al. Hypophosphatemia during continuous veno-venous hemofiltration is associated with mortality in critically ill patients with acute kidney injury. Crit Care 2013;17: R205.
- Schwartz A, Gurman G, Cohen G, Gilutz H, Brill S, Schily M, et al. Association between hypophosphatemia and cardiac arrhythmias in the early stages of sepsis. Eur J Intern Med 2002;13:434.
- Demirjian S, Teo B, Guzman J, Heyka R, Paganini E, Fissell W, et al. Hypophosphatemia during continuous hemodialysis is associated with prolonged respiratory failure in patients with acute kidney injury. Nephrol Dial Transplant 2011;26:3508-14.
- Pistolesi V, Zeppilli L, Fiaccadori E, Regolisti G, Tritapepe L, Morabito S. Hypophosphatemia in critically ill patients with acute kidney injury on renal replacement therapies. J Nephrol 2019:895-908.
- Boot R, Koekkoek K, van Zanten A. Refeeding syndrome: relevance for the critically ill patient. Curr Opin Crit Care 2018;24:235-40.
- Palevsky P, Zhang J, O’Connor T, Chertow G, Crowley S, Choudhury D, et al. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008;359:7- 20.
- Park J, Lee H, Kee Y, Park S, Oh H, Han S, et al. High-dose versus conventional-dose continuous venovenous hemodiafiltration and patient and kidney survival and cytokine removal in sepsis-associated acute kidney injury: a randomized controlled trial. Am J Kidney Dis 2016;68:599-608.
- Morimatsu H, Uchino S, Bellomo R, Ronco C. Continuous veno-venous hemodiafiltration or hemofiltration: impact on calcium, phosphate and magnesium concentrations. Int J Artif Organs 2002;25:512-9.
- Song Y, Seo E, Yoo Y, Jo Y. Phosphate supplementation for hypophosphatemia during continuous renal replacement therapy in adults. Ren Fail 2019;41:72-9.
- Sun Z, Ye H, Shen X, Chao H, Wu X, Yang J. Continuous venovenous hemofiltration versus extended daily hemofiltration in patients with septic acute kidney injury: a retrospective cohort study. Crit Care 2014;18:R70.
- Albino B, Balbi A, Abr~ ao J, Ponce D. Dialysis complications in acute kidney injury patients treated with prolonged intermittent renal replacement therapy sessions lasting 10 versus 6 hours: results of a randomized clinical trial. Artif Organs 2015;39:423-31.
- Eliacik E, Yildirim T, Sahin U, Kizilarslanoglu C, Tapan U, Aybal-Kutlugun A, et al. Potassium abnormalities in current clinical practice: frequency, causes, severity and management. Med Princ Pract 2015;24:271-5.
- Crop M, Hoorn E, Lindemans J, Zietse R. Hypokalaemia and subsequent hyperkalaemia in hospitalized patients. Nephrol Dial Transplant 2007;22: 3471-7.
- Tong G, Rude R. Magnesium deficiency in critical illness. J Intensive Care Med 2005;20:3-17.
- Upala S, Jaruvongvanich V, Wijarnpreecha K, Sanguankeo A. Hypomagnesemia and mortality in patients admitted to intensive care unit: a systematic review and meta-analysis. QJM 2016;109:453-9.
- Di Mario F, Regolisti G, Greco P, Maccari C, Superchi E, Morabito S, et al. Prevention of hypomagnesemia in critically ill patients with acute kidney injury on continuous kidney replacement therapy: the role of early supplementation and close monitoring. J Nephrol 2020. https://doi.org/10.1007/ s40620-020-00864-4. In press.
- Zakharchenko M, Los F, Brodska H, Balik M. The effects of high level magnesium dialysis/substitution fluid on magnesium homeostasis under regional citrate anticoagulation in critically ill. PloS One 2016;11:e0158179.
- Brain M, Anderson M, Parkes S, Fowler P. Magnesium flux during continuous venovenous haemodiafiltration with heparin and citrate anticoagulation. Crit Care Resusc 2012;14:274-82.
- Strobl K, Harm S, Weber V, Hartmann J. The role of ionized calcium and magnesium in regional citrate anticoagulation and its impact on inflammatory parameters. Int J Artif Organs 2017;40:15-21.
- Klein C, Moser-Veillon P, Schweitzer A, Douglass L, Reynolds H, Patterson K, et al. Magnesium, calcium, zinc, and nitrogen loss in trauma patients during continuous renal replacement therapy. J Parenter Enter Nutr 2002;26: 77-92.
- Agarwal B, Walecka A, Shaw S, Davenport A. Is parenteral phosphate replacement in the intensive care unit safe? Ther Apher Dial 2014;18:31-6.
- Shajahan A, Ajith Kumar J, Gireesh Kumar K, Sreekrishnan T, Jismy K. Managing hypophosphatemia in critically ill patients: a report on an underdiagnosed electrolyte anomaly. J Clin Pharm Therapeut 2015;40:353-4.
- Martin K, Gonz alez E, Slatopolsky E. Clinical consequences and management of hypomagnesemia. J Am Soc Nephrol 2009;20:2291-5.
- Broman M, Carlsson O, Friberg H, Wieslander A, Godaly G. Phosphate-containing dialysis solution prevents hypophosphatemia during continuous renal replacement therapy. Acta Anaesthesiol Scand 2011;55:39-45.
- Godaly G, Carlsson O, Broman M. Phoxilium reduces hypophosphateaemia and magnesium supplementation during continuous renal replacement therapy. Clin Kidney J 2016;9:205-10.
- Pistolesi V, Zeppilli L, Polistena F, Sacco M, Pierucci A, Tritapepe L, et al. Preventing continuous renal replacement therapy-induced hypophosphatemia: an extended clinical experience with a phosphate-containing solution in the setting of regional citrate anticoagulation. Blood Purif 2017;44:8-15.
- Uchino S, Bellomo R, Ronco C. Intermittent versus continuous renal replacement therapy in the ICU: impact on electrolyte and acid-base balance. Intensive Care Med 2001;27:1037-43.98