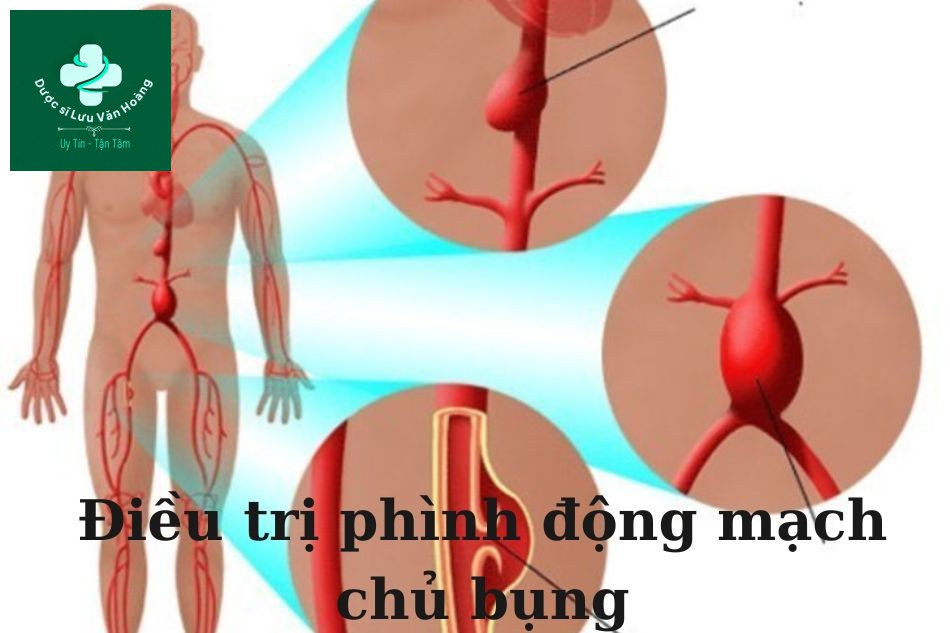
Y tế - Sức Khỏe
Điều trị phình động mạch chủ bụng – Bác sĩ Huỳnh Phạm Hoàng Nam
nhathuocluuanh. Điều trị phình động mạch chủ bụng
Để tải file PDF, hãy click TẠI ĐÂY.
Andres Schanzer, M.D., and Gustavo S. Oderich, M.D.
Dịch: Bác sĩ. Huỳnh Phạm Hoàng Nam
Bệnh nhân nam 64 tuổi đến bác sĩ gia đình để khám bệnh thường quy thì phát hiện một khối sờ thấy được, nằm giữa thượng vị và có mạch đập. Bệnh nhân khai không đau bụng và không đau lưng, có thể dễ dàng leo lên 2 bậc cầu thang. Tiền sử bản thân kiểm soát tốt tăng huyết áp và tăng cholesterol máu. Gia đình bệnh nhân không ai mắc bệnh phình mạch. Bệnh nhân hút 1 gói thuốc lá (20 điếu) mỗi ngày từ 16 tuổi đến giờ. Siêu âm bụng phát hiện túi phình động mạch chủ bụng dưới thận đường kính lớn nhất 5.7 cm. Nên đánh giá thêm gì và điều trị thế nào ca này?
Vấn đề lâm sàng
PHÌNH ĐỘNG MẠCH CHỦ BỤNG được định nghĩa là đường kính động mạch chủ ít nhất 3cm. Tại Hoa Kỳ, tỷ lệ mắc ước tính khoảng 1.4% trong độ tuổi 50-84, hoặc 1.1 triệu người trưởng thành; tỷ lệ mắc ở phụ nữ thấp hơn đàn ông và những người da đen và châu Á mắc phình động mạch chủ thấp hơn người da Trắng. Các yếu tố thúc đẩy bệnh gồm tuổi cao, tiền sử gia đình có người mắc, trước đây hoặc hiện tại hút thuốc lá, tăng cholesterone máu, tăng huyết áp; đái tháo đường thì giảm nguy cơ mắc bệnh phình mạch. Nguy hiểm nhất là nguy cơ vỡ túi phình gây tử vong do xuất huyết. Do đó, mục tiêu điều trị là can thiệp túi phình trước khi vỡ. Mặc dù có nhiều yếu tố ảnh hưởng đến thời gian và lựa chọn phương pháp can thiệp, tiên lượng độc lập quan trọng nhất gây vỡ là đường kính túi phình, với nguy cơ tăng lên theo độ lớn của túi phình. Trong một nghiên cứu quan sát tiền cứu ở những bệnh nhân phình động mạch chủ bụng mà không đủ điều kiện để tiến hành phẫu thuật, nguy cơ vỡ là 1% mỗi năm ở nam khi đường kính túi phình là 5-5.9 cm và 14.1% ở nam mỗi năm khi đường kính túi phình ít nhất 6cm; tỷ lệ tương ứng ở nữ là 3.9% và 22.3% mỗi năm. Theo các chuyên gia đầu ngành về mạch máu, thời điểm chẩn đoán là cực kỳ quan trọng để cân nhắc các nguy cơ và thuận lợi theo dõi so với can thiệp có chọn lọc. Thời gian và ngưỡng can thiệp cũng như lựa chọn phương pháp điều trị sẽ bàn ngay sau đây.
Các chiến lược điều trị và bằng chứng
Thời gian can thiệp
ĐIỀU TRỊ PHÌNH ĐỘNG MẠCH CHỦ BỤNG
- Các nguy cơ phình động mạch chủ bụng là tuổi cao, giới nam, tiền sử gia đình, trước đây hoặc hiện tại hút thuốc lá, tăng cholesterol máu và tăng huyết áp. Nguy cơ thấp ở bệnh nhân đái tháo đường.
- Khuyến cáo can thiệp ở nam có đường kính động mạch chủ lớn nhất là 5.5cm hoặc cao hơn và ở nữ có đường kính động mạch chủ lớn nhất là 5cm hoặc cao hơn.
- Kết quả từ các thử nghiệm ngẫu nhiên, có đối chứng chứng minh rằng can thiệp nội mạch động mạch chủ bụng (EVAR) liên quan giảm nguy cơ biến chứng chu phẫu và tử vong so với can thiệp mổ mở ổ bụng.
- Ưu điểm sớm của EVAR so với phẫu thuật mổ mở là duy trì từ 2-3 năm kể từ thời gian tiến hành can thiệp. Không có lợi ít sống còn lâu dài.
- Mặc dù EVAR liên quan tăng nguy cơ tái can thiệp, hầu hết những can thiệp này là xâm lấn nội mạch tối thiểu. Trong suốt cuộc đời của bệnh nhân, mổ mở liên quan tăng nguy cơ tái can thiệp mở ổ bụng.
- Theo dõi lâu dài bằng hình ảnh siêu âm kép (duplex) hoặc chụp cắt lớp vi tính mạch máu khuyến cáo nên làm trên bệnh nhân can thiệp bằng EVAR.
Các thử nghiệm ngẫu nhiên cho thấy không có lợi ích sống còn khi phẫu thuật qua theo dõi chặt chẽ đối với phình động mạch chủ bụng có đường kính dưới 5.5cm, đã ủng hộ quan điểm cho rằng đây là đường kính ngưỡng thích hợp để can thiệp và theo dõi các túi phình có đường kính < 5.5cm sẽ an toàn và tiết kiệm chi phí. Mặc dù ngưỡng can thiệp trong các nhóm theo dõi ở những thử nghiệm này cũng bao gồm sự tiến triển nhanh chóng của túi phình (định nghĩa tốc độ phát triển là >1cm mỗi năm), nhưng do thiếu các dữ liệu nghiêm ngặt để ủng hộ can thiệp dựa trên cơ sở diễn tiến nhanh của túi phình. Một hạn chế quan trọng nhất trong các nghiên cứu này là ngưỡng 5.5 cm dựa trên phần lớn bệnh nhân tham gia nghiên cứu là đàn ông da Trắng, do đó tính khái quát ở nữ và các chủng tộc hay dân tộc khác chưa rõ ràng. Do kích thước bẩm sinh của động mạch chủ nhỏ hơn và tỷ lệ vỡ túi phình động mạch chủ bụng cao hơn ở phụ nữ, hầu hết các chuyên gia cũng như các hướng dẫn khuyến cáo là đường kính <5cm là ngưỡng thích hợp để can thiệp ở phụ nữ.
Theo dõi và điều trị
Bệnh nhân có túi phình động mạch chủ bụng nhỏ đường kính 3-3.9 cm nên được theo dõi bằng siêu âm kép mỗi 3 năm, trong khi đó những bệnh nhân có đường kính túi phình từ 4-4.9cm nên theo dõi mỗi năm 1 lần và những bệnh nhân có kích thước túi phình 5cm hoặc lớn hơn nên theo dõi mỗi 6 tháng. Dừng hút thuốc lá được khuyến cáo giảm nguy cơ tiến triển và vỡ túi phình. Các thuốc statin, chẹn beta và thuốc hạ áp có thể chỉ định để giảm nguy cơ tim mạch, nhưng chúng chưa được chứng minh có thể giảm phát triển túi phình và nên được kê đơn với mục đích điều trị bệnh cụ thể và không dùng thường quy.
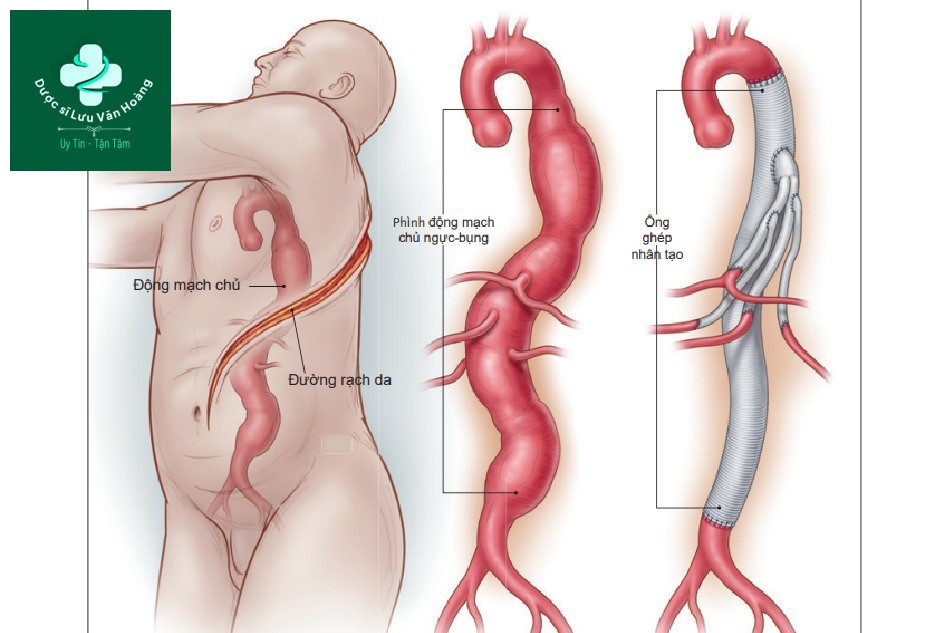
Trong số những bệnh nhân có túi phình đủ lớn để can thiệp, các hướng điều trị có thể là can thiệp mổ hở hoặc can thiệp nội mạch động mạch chủ (EVAR). Can thiệp mổ hở cần rạch 1 đường giữa qua ổ bụng hoặc sau phúc mạc để bộc lộ động mạch chủ bụng và động mạch chậu, sẽ được kẹp lại. Trong quá trình phẫu thuật, đoạn động mạch chứa túi phình được thay thế bằng ống ghép nhân tạo dạng ống hoặc hai nhánh (hình 1). Trong thủ thuật EVAR, túi phình được giữ nguyên và dòng máu được định tuyến lại thông qua đặt một giá đỡ (stent graft) dựa vào ống thông catheter, do đó tránh được túi khí và không cần thiết phải làm tắc động mạch chủ tạm thời (hình 2). Thông thường, một modun giá đỡ 2 nhánh được neo giữ bên dưới động mạch thận trong một đoạn động mạch chủ bình thường và kéo dài thành đoạn bình thường ở mỗi động mạch chậu chung. Sự phù hợp về giải phẫu với EVAR yêu cầu đủ các vùng bịt kín, được định nghĩa là các vùng không có túi phình, động mạch có thành song song trên và dưới túi phình, nơi mà giá đỡ có thể chống lại và bịt kín vào thành động mạch. Các yêu cầu cần có nữa là đường kính phù hợp của động mạch đùi và động mạch chậu để thích hợp đưa các dụng cụ vào và không xảy ra co thắt mạch quá mức hoặc các mảng xơ vữa nặng, cả 2 đều làm tăng nguy cơ thuyên tắc (embolisation). Từ khi EVAR ra đời vào năm 1991, nhiều phình động mạch chủ bụng được can thiệp ở Hoa Kỳ gia tăng đáng kể, và hơn 80% những bệnh nhân hiện nay được can thiệp bằng EVAR. Nhiều tổ chức đã cho phép sử dụng rộng rãi EVAR như lựa chọn điều trị hàng đầu trên bệnh nhân có cấu trúc giải phẫu phù hợp, không phụ thuộc tuổi tác hoặc nguy cơ lâm sàng, loại bỏ can thiệp mổ mở với bệnh nhân có cấu trúc giải phẫu không phù hợp với EVAR.
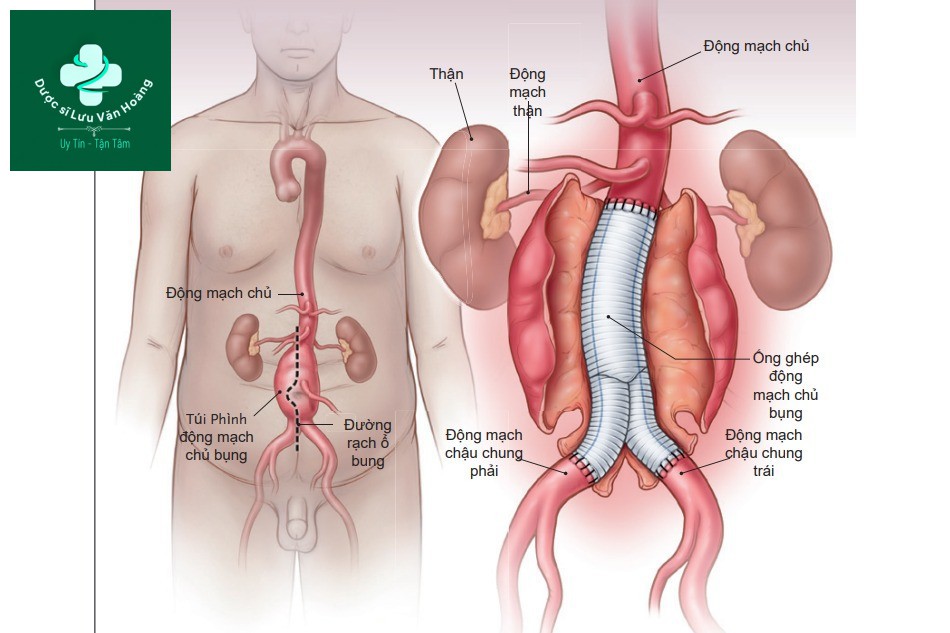
Trong thủ thuật này, tiến hành mở ổ bụng, động mạch chủ được kẹp phía trên và dưới túi phình, và một
ống ghép nhân tạo được khâu vào vị trí túi phình.
Hướng dẫn phương pháp điều trị dựa trên bằng chứng
Ba thử nghiệm ngẫu nhiên có đối chứng lớn nhất cho đến nay, trong đó kết cục của can thiệp mổ mở có chọn lọc so với kết cục của EVAR đã mang lại kết quả nhất quán. Tất cả 3 thử nghiệm đều cho thấy tỷ lệ mắc và tỷ lệ tử vong trong 30 ngày thấp đáng kể đối với EVAR so với can thiệp mổ hở (0.5 với 1.7% vs. 3.0 với 4.7%). Khả năng hồi phục nhanh hơn trên bệnh nhân tiến hành EVAR (thời gian nằm viện trung bình tại trung tâm chăm sóc y tế là 2 ngày so với 7 ngày khi mổ mở). Tuy nhiên, lợi ích sống sót trong thời gian ngắn giảm khi theo dõi, do đó ở những bệnh nhân sống sót sau 2-3 năm, tỷ lệ sống còn liên quan 2 thủ thuật là như nhau, và vẫn phải duy trì theo dõi 8-10 năm. Tỷ lệ tái can thiệp sau EVAR tăng cao hơn so với tỷ lệ quan sát được khi mổ hở, nhưng hầu hết các thủ thuật theo dõi được thực hiện thông qua catheter; nhìn chung, chi phí thực hiện EVAR cao hơn so với mổ hở.
Dữ liệu từ kinh nghiệm lâm sàng tại Hoa Kỳ đã hỗ trợ các bằng chứng trong những thử nghiệm này. Trong một phân tích ghép điểm dựa trên xu hướng bao gồm hơn 44.000 người thụ hưởng dịch vụ Medicare đã tiến hành can thiệp động mạch chủ bụng từ năm 2001 đến năm 2004, tỷ lệ tử vong trong 30 ngày là 1.2% sau EVAR và 4.8% sau mổ hở (P<0.001). Sau 5 năm theo dõi, tỷ lệ tử vong do tất cả nguyên nhân đều như nhau trong 2 nhóm, với đường cong sống sót đều hội tụ ở năm thứ 3. Tái can thiệp liên quan hồi phục thường gặp hơn ở những bệnh nhân làm EVAR (9.0% vs. 1.7%; P><0.001). Tuy nhiên, phẫu thuật có các biến chứng liên quan vết mổ hay mở ổ bụng chẳng hạn như thoát vị vết mổ hoặc tắc ruột, có tần suất xảy ra nhiều hơn ở bệnh nhân mổ hở (9.7% vs. 4.1%; P><0.001). Lựa chọn phương pháp can thiệp nên đưa ra từ quyết định chung và bao gồm cả sự phù hợp về giải phẫu của bệnh nhân, nguy cơ phẫu thuật và sẵn sàng tuân thủ yêu cầu suốt đời trong việc theo dõi hàng năm bằng hình ảnh cận lâm sàng. Sự phù hợp giải phẫu được định nghĩa là mỗi thiết bị EVAR là 1 phần của lộ trình phê duyệt theo qui định; thiếu tuân thủ các hướng dẫn về giải phẫu liên quan đến mỗi thiết bị sẽ mang lại kết cục xấu. Nhiều hướng dẫn khuyến cáo nên theo dõi bằng hình ảnh cận lâm sàng suốt đời sau khi làm EVAR để xác định và điều trị các biến chứng có liên quan động mạch chủ hay các thiết bị khác, như chảy máu dai dẳng trong túi phình (như endoleak – còn dòng động mạch trong túi phình) hoặc phì đại túi thừa động mạch chủ. Theo dõi hình ảnh sau can thiệp nhằm xác định các biến chứng nghiêm trọng và dự phòng tử vong do vỡ túi phình. Các cận lâm sàng hình ảnh học này bao gồm chụp mạch máu cắt lớp vi tính (CT)><0.001). Sau 5 năm theo dõi, tỷ lệ tử vong do tất cả nguyên nhân đều như nhau trong 2 nhóm, với đường cong sống sót đều hội tụ ở năm thứ 3. Tái can thiệp liên quan hồi phục thường gặp hơn ở những bệnh nhân làm EVAR (9.0% vs. 1.7%; P<0.001). Tuy nhiên, phẫu thuật có các biến chứng liên quan vết mổ hay mở ổ bụng chẳng hạn như thoát vị vết mổ hoặc tắc ruột, có tần suất xảy ra nhiều hơn ở bệnh nhân mổ hở (9.7% vs. 4.1%; P<0.001).
Lựa chọn phương pháp can thiệp nên đưa ra từ quyết định chung và bao gồm cả sự phù hợp về giải phẫu của bệnh nhân, nguy cơ phẫu thuật và sẵn sàng tuân thủ yêu cầu suốt đời trong việc theo dõi hàng năm bằng hình ảnh cận lâm sàng. Sự phù hợp giải phẫu được định nghĩa là mỗi thiết bị EVAR là 1 phần của lộ trình phê duyệt theo qui định; thiếu tuân thủ các hướng dẫn về giải phẫu liên quan đến mỗi thiết bị sẽ mang lại kết cục xấu. Nhiều hướng dẫn khuyến cáo nên theo dõi bằng hình ảnh cận lâm sàng suốt đời sau khi làm EVAR để xác định và điều trị các biến chứng có liên quan động mạch chủ hay các thiết bị khác, như chảy máu dai dẳng trong túi phình (như endoleak – còn dòng động mạch trong túi phình) hoặc phì đại túi thừa động mạch chủ. Theo dõi hình ảnh sau can thiệp nhằm xác định các biến chứng nghiêm trọng và dự phòng tử vong do vỡ túi phình. Các cận lâm sàng hình ảnh học này bao gồm chụp mạch máu cắt lớp vi tính (CT) trong tháng đầu sau khi làm EVAR, theo dõi dưới sự hướng dẫn của siêu âm kép hàng năm. Trên một số bệnh nhân, siêu âm có thể không khả thi (như bệnh nhân có thể trạng lớn), vì thế có thể chụp mạch máu CT hoặc MRI. Những nguy cơ tiếp xúc với bức xạ và sử dụng chất cản quang chứa iode nên trao đổi với bệnh nhân.
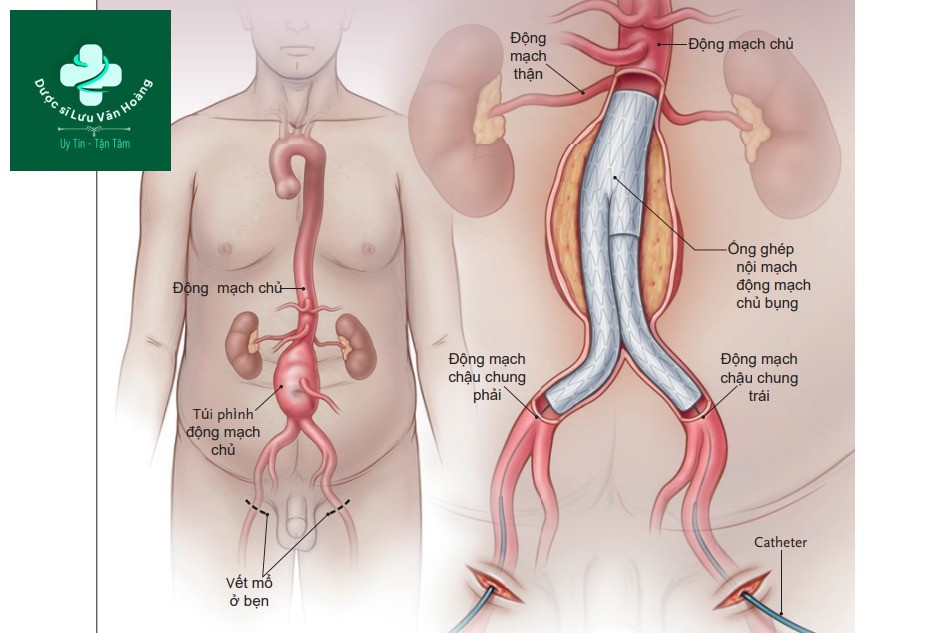
Tiếp cận động mạch đùi dưới da hoặc vết rạch nhỏ ở bẹn để bộc lộ động mạch đùi nhằm mục đích đưa
giá đỡ (stent graft) vào, dưới hướng dẫn của Xquang để loại trừ dòng máu đến túi phình.
Mặc dù nguy cơ ung thư suốt đời do tiếp xúc bức xạ liều thấp thì thấp hơn nhiều ở bệnh nhân > 65 tuổi so với những bệnh nhân trẻ tuổi, ảnh hưởng khi tiếp xúc với phóng xạ với nhiều nghiên cứu CT chưa được đánh giá trong dịch tễ học quy mô lớn. Những nguy cơ gây độc thận do chất cản quang thấp hơn ở bệnh nhân có độ lọc cầu thận ước tính trên 30 ml/ph/1.73 m2 diện tích bề mặt cơ thể.
Vỡ túi phình động mạch chủ sau EVAR được ghi nhận chiếm 5.4% bệnh nhân. Nhu cầu tái can thiệp nhằm duy trì loại trừ túi phình khỏi vòng tuần hoàn và đề phòng vỡ muộn đã được báo cáo trong giai đoạn theo dõi sớm, giữa kỳ và lâu dài và không cố định theo thời gian, vì thế nên theo dõi suốt đời. Ngược lại, với mổ hở, theo dõi suốt đời lại không quan trọng do độ bền của can thiệp lâu hơn và ít nhu cầu tái can thiệp. Sau mổ hở, hầu hết các bác sĩ ngoại khoa về mạch máu sẽ theo dõi bệnh nhân cho đến khi họ hoàn toàn trở về trạng thái bình thường sau phẫu thuật. Sau đó, bệnh nhân thường chỉ nhận ra khi một vấn đề mới phát sinh, bởi vì vỡ túi phình sau can thiệp mổ hở là cực kỳ hiếm gặp.
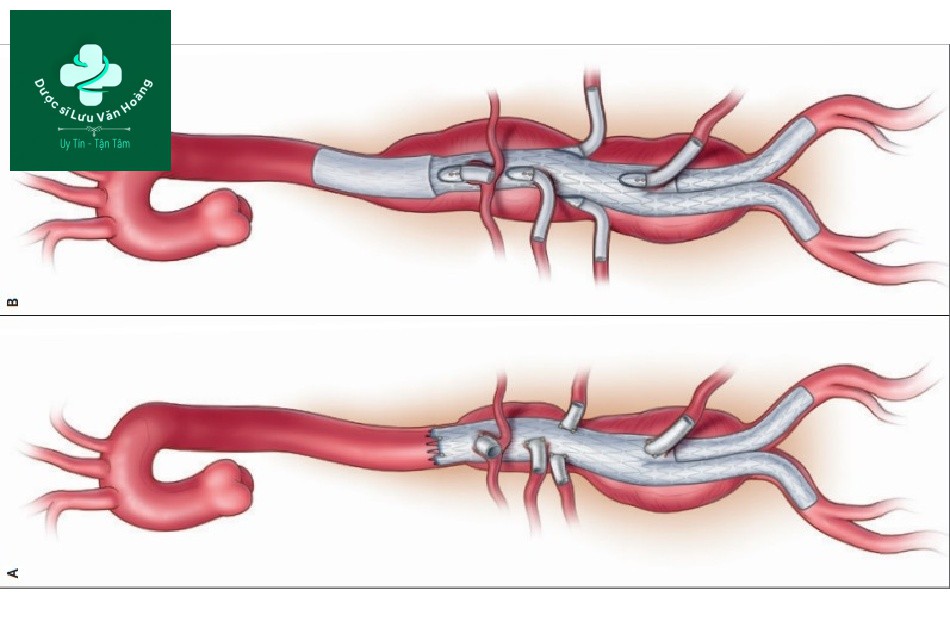
Can thiệp nội mạch có lỗ thủng (hình A) và có nhánh (hình B) của một phức hợp phình động mạch chủ ngực-bụng.
Các lĩnh vực chưa rõ ràng
Không rõ tại sao những thử nghiệm liên tục chứng minh lợi ích sống sót sớm đáng kể mà EVAR mang lại, so vớ mổ mở, lại không duy trì quá 2-3 năm. Những lý do hợp lý là nguy cơ tim mạch tiềm ẩn, tuân thủ kém với các khuyến cáo theo dõi điều trị (có thể do tư vấn không đầy đủ hoặc hiểu không đúng các khuyến cáo), tăng tình trạng viêm kéo dài do xuất hiện một túi phình nguyên vẹn, dẫn đến các biến cố tim mạch (một kết cục cần phải nghiên cứu), áp suất túi khí dai dẵng mà không có endoleak (còn dòng động mạch trong túi phình) có thể xác định nhờ hình ảnh học, và các lỗi thiết bị.
Hình 3. Can thiệp nội mạch phức hợp phình động mạch chủ ngực-bụng. Can thiệp nội mạch có lỗ thủng (hình A) và có nhánh (hình B) của một phức hợp phình động mạch chủ ngực-bụng.
Mặc dù sự mòn của giá đỡ (stent graft) giải thích một vài hư hỏng của dụng cụ, nhưng nhiều trường hợp hư hỏng có thể giải thích là do đặt không phù hợp – đó là, stent đặt ở bệnh nhân có cấu trúc giải phẫu không phù hợp với hướng dẫn sử dụng. Giải phẫu không phù hợp được báo cáo ở 18-63% bệnh nhân tiến hành EVAR và rõ ràng có liên quan kết cục nghèo nàn. Nếu vẫn áp dụng rộng rãi kỹ thuật này trên bệnh nhân có cấu trúc giải phẫu không phù hợp, những lợi ích ngắn hạn sẽ bị thay thế bằng tăng tỷ lệ điều trị thất bại, tăng chi phí tái can thiệp và vỡ túi phình tiềm năng bất kỳ thời gian nào trong quá trình theo dõi.
Các công nghệ nội mạch mới đang mở rộng phát triển để sử dụng thích hợp EVAR trên những bệnh nhân có khiếm khuyết cấu trúc giải phẫu với các thiết bị thương mại hiện có (mà được thiết kế để đặt bên dưới động mạch thận). Các công nghệ này yêu cầu sự kết hợp nội mạch của các nhánh bên động mạch chủ, như động mạch thận và động mạch mạc treo, với sử dụng các giá đỡ được thiết kế đặt biệt có các lỗ mở bằng vải (đệm tăng cường) hoặc các nhánh bên (nhánh có hướng).
Bộc lộ khoang ngực và bụng, phân chia cơ hoành, kẹp qua động mạch chủ phía trên và dưới túi phình, khâu một ống ghép nhân tạo đặt vào túi phình, với sự kết hợp của động mạch thân tạng, động mạch mạc treo tràng trên, động mạch thận trái và động mạch thận phải.
Sau khi ghép giá đỡ động mạch chủ, các stent bắc cầu được đặt vào giữa các lỗ thủng hoặc các nhánh và mỗi mạch máu mục tiêu. Cả 2 dạng can thiệp nội mạch động mạch chủ ở các lỗ thủng và các nhánh – từ vòm động mạch chủ, xuyên qua đoạn nội tạng và đến động mạch chậu – đã được áp dụng tại các trung tâm lớn khắp thế giới chuyên điều trị phình động mạch phức tạp. Nhìn chung, các lỗ thủng tăng cường được ưu tiên trên bệnh nhân phình động mạch chủ có vị trí chủ yếu trong ổ bụng (như phình động mạch chủ bên thận) (hình 3A), trong khi đó can thiệp nội mạch qua các nhánh ưu tiên dùng trên bệnh nhân phình động mạch chủ mở rộng vào lồng ngực (hình 3B), nơi có khoảng trống rộng hơn giữa giá đỡ động mạch chủ và nhánh bên. Không giống EVAR dưới thận, mà có thể theo dõi thường quy bằng cách siêu âm kép ổ bụng, EVAR các lỗ thủng và nhánh (FB-EVAR) thường phải chụp CT mạch máu nhằm mục đích xác định hình ảnh giá đỡ mở rộng vào ngực, mà siêu âm không thể làm được.
Can thiệp mổ hở phức hợp phình động mạch chủ là thủ thuật khá thách thức, đòi hỏi bộc lộ rộng vết mổ và thời gian kéo dài hơn thiếu máu cục bộ cơ quan đích trong quá trình kẹp động động mạch chủ (hình 4). Vì lý do này, nguy cơ mắc bệnh và tỷ lệ tử vong tăng lên đáng kể so với can thiệp động mạch chủ bụng dưới thận. Hiện nay không có các thử nghiệm ngẫu nhiên so sánh giữa mổ hở và FB-EVAR trên bệnh nhân phình động mạch chủ phức hợp. Các nghiên cứu quan sát tiền cứu đơn trung tâm và đa trung tâm đã chứng minh tỷ lệ thấp các biến chứng và tử vong với FB-EVAR so với các nghiên cứu đoàn hệ có tính lịch sử đã được báo cáo mổ hở. Ví dụ, theo một nghiên cứu của Hiệp hội động mạch chủ Hoa Kỳ, tỷ lệ tử vong trong 30 ngày là 1.1% trên tổng số 893 bệnh nhân làm FB[1]EVAR điều trị phình động mạch chủ bên thận hoặc ngực-bụng, trong khi đó nhiều nghiên cứu lớn, đơn trung tâm đánh giá can thiệp mổ hở phình động mạch chủ ngực-bụng, tỷ lệ tử vong trong 30 ngày dao động từ 7-16%. Trong khi chờ thêm dữ liệu để biết tính hiệu quả của các thiết bị FB-EVAR, quyền truy cập vào các thiết bị này vẫn bị giới hạn ở vài trung tâm tại Hoa Kỳ, nơi mà các nghiên cứu miễn trừ thiết bị được chấp thuận do Cục quản lý thực phẩm và thuốc đang được tiến hành (xem ClinicalTrial.gov numbers, NCT02050113 and NCT02089607).
Các hướng dẫn
Các hướng dẫn điều trị phì động mạch chủ bụng đều được công bố bởi Hiệp hội phẫu thuật mạch máu (SVS) và Hiệp hội phẫu thuật mạch máu châu Âu (ESVS). Cả 2 tài liệu đều có mức chứng cứ B (trung bình, SVS) hoặc mức C (thấp, ESVS), độ 2 (yếu) khuyến cáo can thiệp có lựa chọn túi phình có đường kính 5.5cm hoặc lớn hơn. Với kích thước bẩm sinh của động mạch chủ ở phụ nữ, các hiệp hội đưa ra mức chứng cứ B (trung bình, SVS), mức C (thấp, ESVS), mức 2 (yếu) khuyến cáo điều trị có chọn lọc các túi phình có đường kính 5cm hoặc lớn hơn ở phụ nữ. Mặc dù các hướng dẫn không bao gồm một khuyến cáo về những lợi ích của mổ hở so với EVAR, các hướng dẫn của ESVS khuyến cáo can thiệp bằng EVAR trong hầu hết bệnh nhân có giải phẫu phù hợp và khả thi kéo dài sự sống (> 2 năm). Cả 2 hướng dẫn đều không có điều trị đặc hiệu được chấp thuận có thể làm chậm lại tốc độ giãn túi phình.
Người ta thừa nhận thiếu dữ liệu trong các nghiên cứu ngẫu nhiên để đánh giá kết cục và tiết kiệm chi phí sàng lọc những người thân bậc 1 (ba, mẹ, anh/chị/em ruột) mắc phình động mạch chủ, cả 2 hướng dẫn SVS và ESVS khuyến cáo sàng lọc siêu âm 1 lần những người thân bậc 1 nam và nữ (mức chứng cứ C, thấp), khuyến cáo mức 2, yếu), mặc dù các hiệp hội phân biệt tuổi tác để sàng lọc (nam 65 tuổi và nữ 50 tuổi). Nhận thấy phù hợp với hướng dẫn của SVS, các trung tâm cung cấp dịch vụ chăm sóc và hỗ trợ y tế đã đưa ra gói bảo hiểm sàng lọc siêu âm 1 lần ở nam và nữ có tiền sử gia đình mắc bệnh phình động mạch chủ như 1 phần trong dịch vụ khám sức khỏe của họ “chào mừng đến với trung tâm y khoa” (đàn ông từ 65-75 tuổi cũng được bảo hiểm nếu họ hút >100 điếu thuốc trong suốt cuộc đời); chúng tôi đồng ý với các khuyến cáo trong hướng dẫn SVS. Hiện nay hầu hết các khuyến cáo sàng lọc từ nhóm chuyên trách dịch vụ dự phòng Hoa Kỳ đều nhất quán với những hướng dẫn này ở nam, nhưng trong trường hợp không có đủ dữ liệu, dịch vụ dự phòng khuyến cáo nên sàng lọc ở phụ nữ có người thân bậc 1 bị phình động mạch chủ.
Kết luận và khuyến cáo
Bệnh nhân phình động mạch chủ bụng dưới thận có đường kính lớn hơn 5.5cm là ngưỡng can thiệp. Chụp mạch máu CT với lát cắt mỏng (1-2mm) vùng bụng và chậu được chỉ định để xác định cấu trúc giải phẫu của bệnh nhân có phù hợp với thủ thuật EVAR không và đánh giá thêm sau mổ nguy cơ phẫu thuật. Nếu giải phẫu có thể can thiệp bằng thiết bị EVAR thường quy, hầu hết cách tiếp cận điều trị phù hợp dựa vào đánh giá nguy cơ phẫu thuật và mong muốn của bệnh nhân, nên giải thích cho bệnh nhâ nhằm đưa ra quyết định chung. Trên bệnh nhân có nguy cơ phẫu thuật cao, EVAR là lựa chọn hàng đầu vì giảm tỷ lệ mắc bệnh và tử vong so với mổ mở. Nếu xác định được nguy cơ phẫu thuật trên bệnh nhân thấp hoặc trung bình, lựa chọn EVAR hoặc mổ mở đều hợp lý. Chúng tôi ưa chuộng dùng EVAR nếu bệnh nhân cam kết theo dõi suốt đời bằng hình ảnh cận lâm sàng nếu không sẽ tiến hành mổ mở, giáo dục bệnh nhân về mối quan hệ giữa không tuân thủ theo dõi và tăng nguy cơ bệnh tật và tử vong trong thời gian ngắn và nguy cơ tốn nhiều tời gian hồi phục. Chúng tôi cũng khuyến cáo bất kỳ người thân bậc 1 nào của bệnh nhân 65 tuổi trở lên nên đi tầm soát bằng siêu âm kiểm tra động mạch chủ.
Tài liệu tham khảo
- Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg 2018; 67(1): 2.e2-77.e2.
- Kent KC, Zwolak RM, Egorova NN, et al. Analysis of risk factors for abdominal aortic aneurysm in a cohort of more than 3 million individuals. J Vasc Surg 2010; 52: 539-48.
- Summers KL, Kerut EK, Sheahan CM, Sheahan MG III. Evaluating the preva[1]lence of abdominal aortic aneurysms in the United States through a national screening database. J Vasc Surg 2021; 73: 61-8.
- Chan WK, Yong E, Hong Q, et al. Sys[1]tematic review and meta-analysis of the prevalence of abdominal aortic aneurysm in Asian populations. J Vasc Surg 2021; 73(3): 1069.e1-1074.e1.
- Lederle FA, Johnson GR, Wilson SE, et al. Prevalence and associations of ab[1]dominal aortic aneurysm detected through screening. Ann Intern Med 1997; 126: 441-9.
- Brown PM, Zelt DT, Sobolev B. The risk of rupture in untreated aneurysms: the impact of size, gender, and expansion rate. J Vasc Surg 2003; 37: 280-4.
- Lederle FA, Wilson SE, Johnson GR, et al. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med 2002; 346: 1437- 44.
- The UK Small Aneurysm Trial Partici[1]pants. Mortality results for randomised controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet 1998; 352: 1649-55.
- Filardo G, Powell JT, Martinez MA-M, Ballard DJ. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev 2015; 2: CD001835.
- Sharp MA, Collin J. A myth exposed: fast growth in diameter does not justify precocious abdominal aortic aneurysm repair. Eur J Vasc Endovasc Surg 2003; 25: 408-11.
- Sweeting MJ, Thompson SG, Brown LC, Powell JT; RESCAN collaborators. Meta-analysis of individual patient data to examine factors affecting growth and rupture of small abdominal aortic aneu[1]rysms. Br J Surg 2012; 99: 655-65.
- Brown LC, Powell JT. Risk factors for aneurysm rupture in patients kept under ultrasound surveillance. Ann Surg 1999; 230: 289-97.
- Wanhainen A, Verzini F, Van Herzeele I, et al. Editor’s choice — European Soci[1]ety for Vascular Surgery (ESVS) 2019 clin[1]ical practice guidelines on the manage[1]ment of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg 2019; 57: 8-93.
- Chaikof EL, Brewster DC, Dalman RL, et al. SVS practice guidelines for the care of patients with an abdominal aortic an[1]eurysm: executive summary. J Vasc Surg 2009; 50: 880-96.
- Volodos NL, Karpovich IP, Troyan VI, et al. Clinical experience of the use of self[1]fixing synthetic prostheses for remote en[1]doprosthetics of the thoracic and the ab[1]dominal aorta and iliac arteries through the femoral artery and as intraoperative endoprosthesis for aorta reconstruction. Vasa Suppl 1991; 33: 93-5.
- Parodi JC, Palmaz JC, Barone HD. Transfemoral intraluminal graft implan[1]tation for abdominal aortic aneurysms. Ann Vasc Surg 1991; 5: 491-9.
- Lederle FA, Freischlag JA, Kyriakides TC, et al. Outcomes following endovascu[1]lar vs open repair of abdominal aortic an[1]eurysm: a randomized trial. JAMA 2009; 302: 1535-42.
- Buck DB, van Herwaarden JA, Schermerhorn ML, Moll FL. Endovascular treatment of abdominal aortic aneurysms. Nat Rev Cardiol 2014; 11: 112-23.
- Dua A, Kuy S, Lee CJ, Upchurch GR Jr, Desai SS. Epidemiology of aortic aneu[1]rysm repair in the United States from 2000 to 2010. J Vasc Surg 2014; 59: 1512-7.
- Greenhalgh RM, Brown LC, Powell JT, Thompson SG, Epstein D, Sculpher MJ. Endovascular versus open repair of abdominal aortic aneurysm. N Engl J Med 2010; 362: 1863-71.
- De Bruin JL, Baas AF, Buth J, et al. Long-term outcome of open or endovas[1]cular repair of abdominal aortic aneu[1]rysm. N Engl J Med 2010; 362: 1881-9.
- Schermerhorn ML, O’Malley AJ, Jhaveri A, Cotterill P, Pomposelli F, Landon BE. Endovascular vs. open repair of abdomi[1]nal aortic aneurysms in the Medicare population. N Engl J Med 2008; 358: 464- 74.
- Schanzer A, Greenberg RK, Hevelone N, et al. Predictors of abdominal aortic aneurysm sac enlargement after endovas[1]cular repair. Circulation 2011; 123: 2848- 55.
- Moll FL, Powell JT, Fraedrich G, et al. Management of abdominal aortic aneu[1]rysms clinical practice guidelines of the European Society for Vascular Surgery. Eur J Vasc Endovasc Surg 2011; 41: Suppl 1: S1-S58.
- Brenner DJ, Hall EJ. Computed tomography — an increasing source of radiation exposure. N Engl J Med 2007; 357: 2277-84.
- Einstein AJ, Moser KW, Thompson RC, Cerqueira MD, Henzlova MJ. Radia[1]tion dose to patients from cardiac diagnostic imaging. Circulation 2007; 116: 1290-305.
- Davenport MS, Perazella MA, Yee J, et al. Use of intravenous iodinated con[1]trast media in patients with kidney disease: consensus statements from the American College of Radiology and the National Kidney Foundation. Kidney Med 2020; 2: 85-93.
- Schermerhorn ML, Buck DB, O’Malley AJ, et al. Long-term outcomes of abdom[1]inal aortic aneurysm in the Medicare population. N Engl J Med 2015; 373: 328- 38.
- Schanzer A, Messina LM, Ghosh K, et al. Follow-up compliance after endo[1]vascular abdominal aortic aneurysm re[1]pair in Medicare beneficiaries. J Vasc Surg 2015; 61(1): 16.e1-22.e1.
- O’Donnell TFX, Deery SE, Boitano LT, et al. Aneurysm sac failure to regress after endovascular aneurysm repair is associ[1]ated with lower long-term survival. J Vasc Surg 2019; 69: 414-22.
- Deery SE, Ergul EA, Schermerhorn ML, et al. Aneurysm sac expansion is in[1]dependently associated with late mortal[1]ity in patients treated with endovascular aneurysm repair. J Vasc Surg 2018;67:157- 64.
- Holt PJE, Karthikesalingam A, Patter[1]son BO, et al. Aortic rupture and sac ex[1]pansion after endovascular repair of ab[1]dominal aortic aneurysm. Br J Surg 2012; 99:1657-64.
- AbuRahma AF, Campbell J, Stone PA, et al. The correlation of aortic neck length to early and late outcomes in endovascu[1]lar aneurysm repair patients. J Vasc Surg 2009;50:738-48.
- Abbruzzese TA, Kwolek CJ, Brewster DC, et al. Outcomes following endovascu[1]lar abdominal aortic aneurysm repair (EVAR): an anatomic and device-specific analysis. J Vasc Surg 2008;48:19-28.
- Aburahma AF, Campbell JE, Mousa AY, et al. Clinical outcomes for hostile versus favorable aortic neck anatomy in endovascular aortic aneurysm repair us[1]ing modular devices. J Vasc Surg 2011;54: 13-21.
- Pitoulias GA, Valdivia AR, Hahtaporn[1]sawan S, et al. Conical neck is strongly associated with proximal failure in stan[1]dard endovascular aneurysm repair. J Vasc Surg 2017;66:1686-95.
- Simons JP, Crawford AS, Flanagan CP, et al. Evolution of fenestrated/branched endovascular aortic aneurysm repair com[1]plexity and outcomes at an organized cen[1]ter for the treatment of complex aortic disease. J Vasc Surg 2021;73(4):1148.e2- 1155.e2.
- Tenorio ER, Oderich GS, Kölbel T, et al. Multicenter global early feasibility study to evaluate total endovascular arch repair using three-vessel inner branch stent[1]grafts for aneurysms and dissections. J Vasc Surg 2021 April 16 (Epub ahead of print).
- Verscheure D, Haulon S, Tsilimparis N, et al. Endovascular treatment of post type A chronic aortic arch dissection with a branched endograft: early results from a retrospective international multicenter study. Ann Surg 2021;273:997-1003.
- Dake MD, Fischbein MP, Bavaria JE, et al. Evaluation of the Gore TAG thoracic branch endoprosthesis in the treatment of proximal descending thoracic aortic an[1]eurysms. J Vasc Surg 2021 April 30 (Epub ahead of print).
- Nordon IM, Hinchliffe RJ, Holt PJ, Loftus IM, Thompson MM. Modern treat[1]ment of juxtarenal abdominal aortic an[1]eurysms with fenestrated endografting and open repair — a systematic review. Eur J Vasc Endovasc Surg 2009;38:35-41.
- Oderich GS, Farber MA, Schneider D, et al. Final 5-year results of the United States Zenith Fenestrated prospective mul[1]ticenter study for juxtarenal abdominal aortic aneurysms. J Vasc Surg 2021;73(4): 1128.e2-1138.e2.
- Farber MA, Oderich GS, Timaran C, Sanchez LA, Dawson Z. Results from a prospective multicenter feasibility study of Zenith p-Branch stent graft. J Vasc Surg 2019;70(5):1409.e3-1418.e3.
- Schneider DB, Matsumura JS, Lee JT, Peterson BG, Chaer RA, Oderich GS. Pro[1]spective, multicenter study of endovascu[1]lar repair of aortoiliac and iliac aneurysms using the Gore Iliac Branch Endoprosthe[1]sis. J Vasc Surg 2017;66:775-85.
- Coselli JS, LeMaire SA, Preventza O, et al. Outcomes of 3309 thoracoabdomi[1]nal aortic aneurysm repairs. J Thorac Car[1]diovasc Surg 2016;151:1323-37.
- Wong DR, Parenti JL, Green SY, et al. Open repair of thoracoabdominal aortic aneurysm in the modern surgical era: con[1]temporary outcomes in 509 patients. J Am Coll Surg 2011;212:569-81.
- Rigberg DA, McGory ML, Zingmond DS, et al. Thirty-day mortality statistics underestimate the risk of repair of thora[1]coabdominal aortic aneurysms: a state[1]wide experience. J Vasc Surg 2006;43:217- 23.
- Kärkkäinen JM, Sandri GA, Tenorio ER, et al. Prospective assessment of health[1]related quality of life after endovascular repair of pararenal and thoracoabdomi[1]nal aortic aneurysms using fenestrated[1]branched endografts. J Vasc Surg 2019; 69(5):1356.e6-1366.e6.
- Schanzer A, Beck AW, Eagleton M, et al. Results of fenestrated and branched endovascular aortic aneurysm repair after failed infrarenal endovascular aortic an[1]eurysm repair. J Vasc Surg 2020;72:849- 58.
- Motta F, Oderich GS, Tenorio ER, et al. Fenestrated-branched endovascular aortic repair is a safe and effective option for octogenarians in treating complex aortic aneurysm compared with nonoctogenari[1]ans. J Vasc Surg 2021;74(2):353.e1-362.e1.
- Estrera AL, Sandhu HK, Charlton-Ouw KM, et al. A quarter century of organ pro[1]tection in open thoracoabdominal repair. Ann Surg 2015;262:660-8.
- Latz CA, Cambria RP, Patel VI, et al. Durability of open surgical repair of type I-III thoracoabdominal aortic aneurysm. J Vasc Surg 2019;70:413-23.
- Björck M, Earnshaw JJ, Acosta S, et al. Editor’s choice — European Society for Vascular Surgery (ESVS) 2020 clinical practice guidelines on the management of acute limb ischaemia. Eur J Vasc Endovasc Surg 2020;59:173-218.
- Shreibati JB, Baker LC, Hlatky MA, Mell MW. Impact of the Screening Ab[1]dominal Aortic Aneurysms Very Efficient[1]ly (SAAAVE) Act on abdominal ultrasonog[1]raphy use among Medicare beneficiaries. Arch Intern Med 2012;172:1456-62.
- Owens DK, Davidson KW, Krist AH, et al. Screening for abdominal aortic an[1]eurysm: US Preventive Services Task Force recommendation statement. JAMA 2019; 322:2211-8.