Tổng số phụ: 470,000₫
Y tế - Sức Khỏe
Các nguyên lý quan trọng của laser khi dùng trên da
CHƯƠNG 3: CÁC NGUYÊN LÝ QUAN TRỌNG CỦA LASER
Biên dịch: Bs. Trương Tấn Minh Vũ
Để tải file PDF Các nguyên lý quan trọng của laser, hãy click tại đây.
Lý thuyết nâng cao về quang nhiệt chọn lọc
Trong “Chương 1” chúng ta đã xem xét lý thuyết quan trọng nhất liên quan đến laser là lý thuyết về quá trình quang nhiệt có chọn lọc. Tuy nhiên, trong thực tế, có những trường hợp không theo lý thuyết quang nhiệt chọn lọc và thậm chí đôi khi nó còn sai lệch so với lý thuyết quang nhiệt chọn lọc [1]. Tiếp theo, chúng ta sẽ xem xét ba lý thuyết nâng cao được phát triển từ lý thuyết quang nhiệt chọn lọc (Bảng 3.1).
Nhiệt động học chọn lọc
Nhiệt động học chọn lọc (Thermal kinetic selectivity, TKS) là một lý thuyết được áp dụng để xác định độ dài xung khi các mô đích lớn và nhỏ cùng tồn tại [2].
Vì độ dài xung tỷ lệ với bình phương đường kính, các mô lớn sẽ có TRT dài hơn (T2) và các mô nhỏ sẽ có TRT (T1) ngắn hơn (T1 <T2). Nếu độ dài xung (PD) nằm giữa TRT của các mô lớn và nhỏ (T1 <PD <T2), các mô lớn sẽ bị tổn thương vì các mô lớn (PD <T2) là TRT> PD. Vấn đề là với các mô nhỏ. Trường hợp các mô nhỏ (T1 <PD),
Bảng 3.1 Lý thuyết nâng cao về quá trình quang nhiệt chọn lọc
| 1 | Nhiệt động học chọn lọc |
| 2 | Lý thuyết mở rộng về quá trình quang nhiệt chọn lọc |
| 3 | Quang nhiệt chọn lọc dưới tế bào |
TRT <PD, theo lý thuyết về quang nhiệt chọn lọc, các mô xung quanh sẽ bị tổn thương và có tác dụng phụ. Tuy nhiên, trong thực tế, tác dụng phụ không xảy ra; đúng hơn, các mô nhỏ được bảo tồn mà không bị bất kỳ tác động nào (Hình 3.1).
Khi TRT <PD, nếu độ dài xung đủ dài, nhiệt độ của các mô nhỏ không tăng lên nữa mà hạ nhiệt trong quá trình chiếu xạ. Tại sao hiện tượng lại sai lệch với thuyết quang nhiệt chọn lọc? Có ba cách để mất nhiệt trong các mô: dẫn nhiệt, đối lưu nhiệt do dòng máu gây ra và bức xạ nhiệt [3].
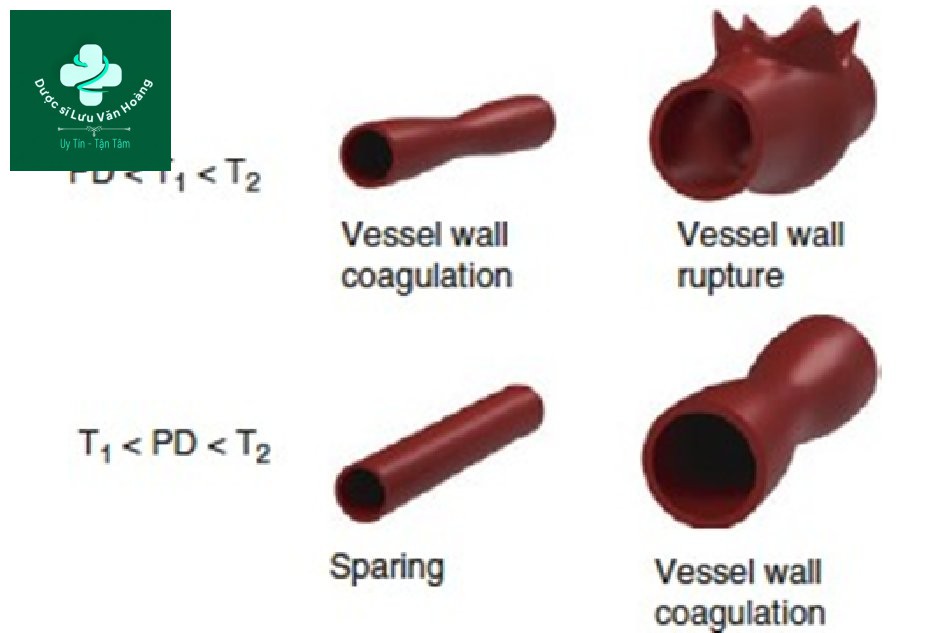
Hình 3.1 Hai mạch máu trên da (1 và 2), T1 và T2: thời gian giãn nhiệt (TRT) tương ứng là 1 và 2 Độ dài xung PD.
Dẫn nhiệt, sự truyền nhiệt ra môi trường xung quanh, là phương pháp tản nhiệt chính. Tuy nhiên, nếu độ dài xung đủ dài, mô nhỏ sẽ nguội đi do hai hiện tượng sau (đối lưu nhiệt và bức xạ nhiệt). Nó giống như là nước được đổ từ từ xuống một cái xô có lỗ. Ví dụ, trong quá trình điều trị các mô lớn như trong liệu pháp mạch máu, các mô nhỏ như melanosome cho thấy không sự thay đổi. Ngoài ra, trong quá trình triệt lông bằng laser, ngay cả khi không làm lạnh biểu bì, độ dài xung dài hơn TRT của biểu bì (1–10 ms) chẳng hạn như 30 ms không làm tổn thương biểu bì. TKS cũng được áp dụng cho nhiều tình huống khác nhau.
Vậy TKS xảy ra ở khoảng độ dài xung nào? Tôi tin rằng TKS xảy ra ở xung dài có độ dài khoảng mili giây. Đặc biệt, tôi nghĩ đó là hiện tượng xảy ra trong hiệu ứng quang nhiệt dưới 100°C.
Chúng ta hãy nghĩ lại về độ dài xung trong các mô lớn và nhỏ. Trong trường hợp (T1 <PD <T2), các mô lớn được điều trị trong khi các mô nhỏ được bảo tồn. Mặt khác, nếu độ dài xung (PD) ngắn hơn TRT của các mô lớn và nhỏ (PD <T1 <T2), cả mô lớn và mô nhỏ sẽ bị tổn thương vì TRT> PD. Trong trường hợp này, nhiệt độ của các mô lớn có thể tăng đến nhiệt độ quá cao, gây ra các tác dụng phụ [2]. Do đó, (T1 <PD <T2) an toàn hơn (PD <T1 <T2). Sau đó, làm thế nào để chúng ta điều trị các mô nhỏ? Sau khi loại bỏ các mô lớn đầu tiên với PD <T2, độ dài xung phải giảm xuống, ít hơn TRT của mô nhỏ (PD <T1), và các mô nhỏ có thể được loại bỏ tuần tự.
Kết luận, trong khoảng độ dài xung dài mili giây, sẽ an toàn khi loại bỏ các mô lớn trước và các mô nhỏ sau đó.
Lý thuyết mở rộng về quá trình quang nhiệt chọn lọc
Phần lớn những gì được mô tả trong “Chương 1” dựa trên giả định rằng mô đích và thể nhiễm sắc trùng nhau. Tuy nhiên, trên thực tế, mô đích và thể nhiễm sắc không trùng nhau [1]. Một ví dụ là triệt lông bằng laser. Các mô đích của quá trình triệt lông bằng laser lần lượt là tế bào mầm lông và tế bào gốc nang lông trong bầu lông và phình lông, và thể nhiễm sắc tương ứng là chất nền lông và thân lông. Tế bào mầm lông và tế bào gốc nang lông không có melanin.
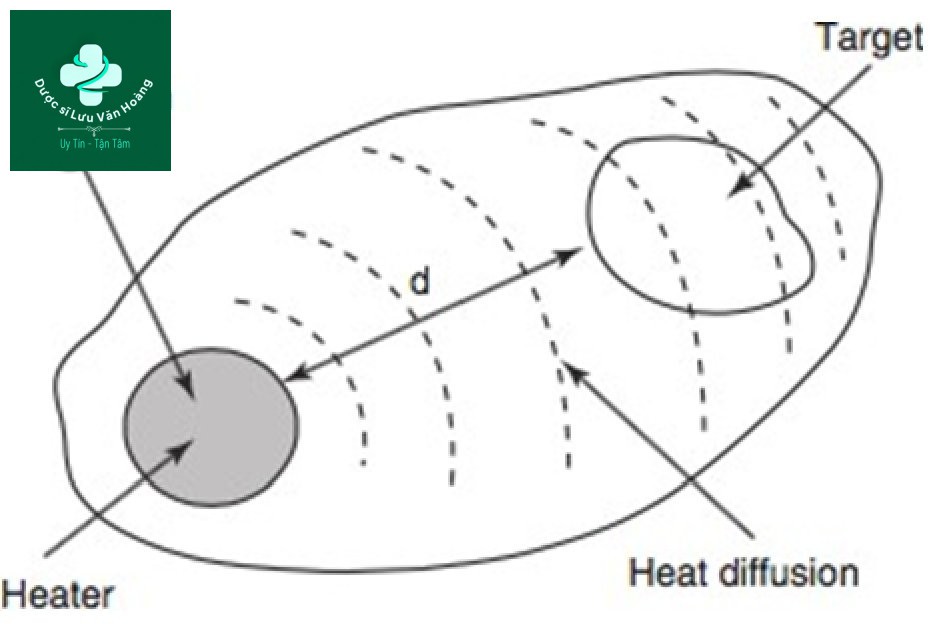
Hình 3.2 Cấu trúc chung của mô đích sinh học với chia tách không gian giữa mục tiêu và bộ phận hấp thụ (bộ gia nhiệt).
Lý thuyết mở rộng về quang nhiệt chọn lọc (lý thuyết mở rộng) là lý thuyết làm tổn thương các mô đích khi thể nhiễm sắc và mô đích không trùng với nhau. Trong ví dụ nêu trên về triệt lông bằng laser, việc chiếu tia laser làm tăng nhiệt độ của sợi lông, thể nhiễm sắc, và nhiệt độ được truyền đến các tế bào gốc nang lông thông qua sự khuếch tán nhiệt và các tế bào bị phá hủy. Lý thuyết mở rộng là một nguyên lý gây tổn thương gián tiếp mô đích thông qua sự khuếch tán nhiệt trong một thể nhiễm sắc sinh nhiệt (bộ gia nhiệt) (Hình 3.2). Do đó, thời gian giãn nhiệt (TRT) được mô tả trong quá trình quang nhiệt chọn lọc không áp dụng cho lý thuyết mở rộng, mà thay vào đó là thời gian tổn thương nhiệt (thermal damage time, TDT) được áp dụng. TDT được định nghĩa là thời gian từ vùng thể nhiễm sắc sinh nhiệt (bộ gia nhiệt) đến nhiệt độ mà lớp ngoài cùng của mô đích bị hư hại thông qua sự khuếch tán nhiệt. Theo định nghĩa, TDT dài hơn TRT (TDT> TRT) và độ dài xung phải ở giữa TDT và TRT (TDT ≥ PD> TRT).
Điều kiện để lý thuyết mở rộng được áp dụng là gì? Một tài liệu laser mô tả rằng lý thuyết mở rộng áp dụng cho “cấu trúc mục tiêu hấp thụ không đồng nhất” [3]. Ba thể nhiễm sắc chính của da là melanin, hemoglobin và nước. Vì nước đồng nhất ở da, lý thuyết mở rộng không được áp dụng, nhưng melanin và hemoglobin có thể không đồng nhất.
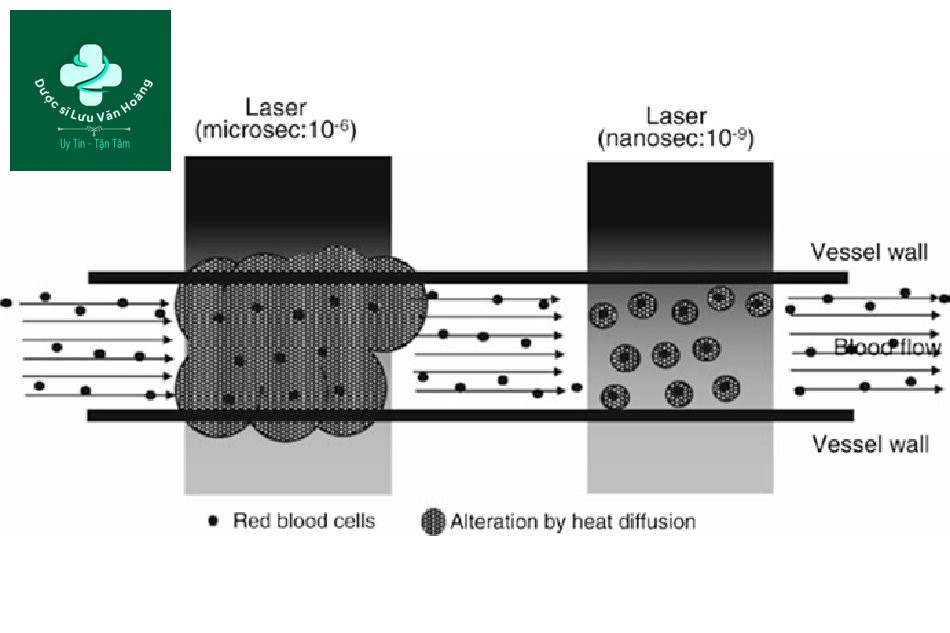
Hình 3.3 Một sơ đồ cho thấy sự khác biệt trong việc điều trị các tổn thương mạch máu giữa laser xung dài (micro giây) và ngắn (nano giây). Các tia laser xung nano giây có thể làm tổn thương các tế bào hồng cầu, nhưng không làm tổn thương thành mạch, do đó không hiệu quả ở các tổn thương mạch máu. Tuy nhiên, các tia laser xung micro giây có thể làm tổn thương không chỉ các tế bào hồng cầu mà còn cả các thành mạch.
Ví dụ, RBC trong mạch máu là đồng nhất, nhưng mạch máu được cấu tạo bởi máu và tế bào nội mô mạch máu, do đó toàn bộ mạch máu không đồng nhất. Chiếu tia laser Q-switch 532 nm với độ dài xung 10 ns nhắm vào RBC có TRT từ 2–5 µs có thể làm hỏng RBC nhưng sẽ không hiệu quả trong việc điều trị mạch máu (Hình 3.3). Do đó, điều trị mạch máu chỉ có thể thực hiện được bằng cách chiếu tia PDL với thời gian xung tương ứng với TDT (hoặc TRT của toàn bộ mạch máu) trong đó nhiệt được truyền đến thành mạch, không phải với độ dài xung tương ứng với thể nhiễm sắc (hemoglobin và RBC). Trong trường hợp các mạch có TRT từ 1,2–4,8 ms, PDL 585 nm 450 µs tương ứng với micro giây thay vì đơn vị nano giây nên được sử dụng để đạt được hiệu quả mong muốn. Cũng áp dụng tương tự cho melanin. Melanin trong các melanosome có thể đồng nhất, nhưng các melanocyte hoặc keratinocyte với melanosome, hoặc lớp đáy nơi các tế bào sừng nằm không đồng nhất.
Vì vậy, lý thuyết mở rộng được áp dụng để triệt lông bằng laser, điều trị mạch máu và điều trị sắc tố bằng cách sử dụng tia laser xung dài.
Quang nhiệt chọn lọc dưới tế bào
Quang nhiệt chọn lọc dưới tế bào là một lý thuyết được biết đến bằng cách nghiên cứu một phương pháp được gọi là “laser
toning”, một phương pháp được sử dụng trong phòng khám tư. Trước đây, laser bị chống chỉ định trong điều trị nám da vì chúng làm trầm trọng thêm tình trạng nám 6]. Tuy nhiên, sau khi sử dụng “laser toning” để điều trị nám tại phòng khám tư ở Đông Á, đã có những nghiên cứu tích cực về “laser toning”.
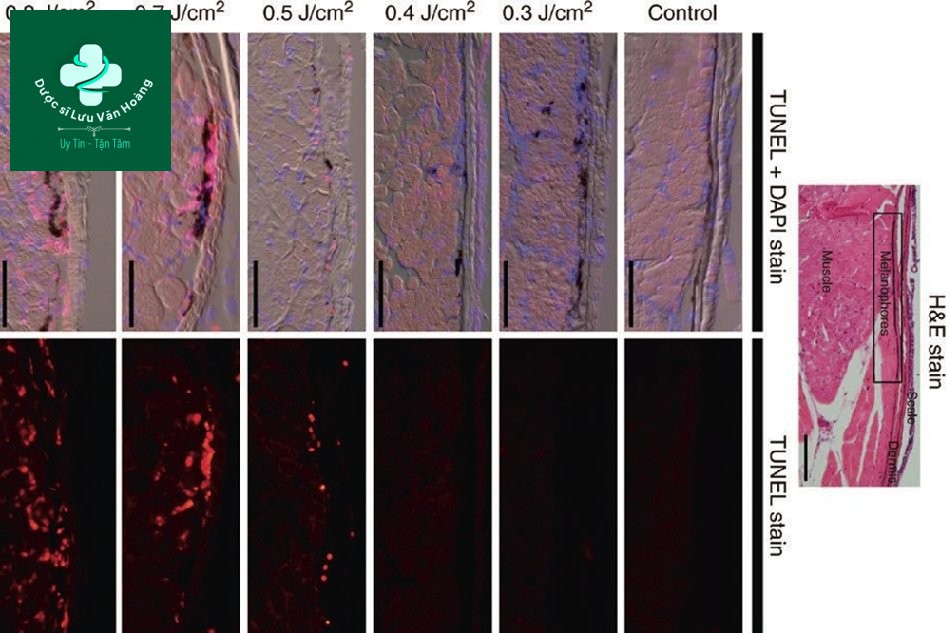
Để tìm hiểu nguyên lý của laser toning, Kim et al. đã chiếu tia laser Q-switched Nd: YAG 1064 nm lên cá ngựa vằn và quan sát sự thay đổi qua kính hiển vi và sinh thiết [7]. Họ quan sát thấy những thay đổi trong các melanosome bằng cách chiếu xạ với mật độ năng lượng từ 0,3 đến 0,9 J/cm2 với kích thước điểm 7 mm và độ dài xung 5–7 ns. Các melanosome bị phá vỡ ngay cả ở 0,3 J/cm2, nhưng mật độ năng lượng cần ít nhất 0,4 J/cm2 để thấy rõ ràng sự phá vỡ của các melanosome (Hình 3.4).
Hình 3.5 cho thấy kết quả nhuộm; màu xanh có nghĩa là nhân bình thường và màu đỏ có nghĩa là tế bào apoptotic, tức là các tế bào sẽ sớm chết. Dưới 0,4 J/cm2, nhân và tế bào đều bình thường, nhưng trên 0,5 J / cm2, tế bào apoptotic được ghi nhận mặc dù nhân bình thường.
Tổng hợp lại, những kết quả này cho thấy ở 0,4 J/cm2, chỉ có các melanosome bị phá vỡ và các tế bào không bị tổn thương. Nói cách khác, có một “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn thương các tế bào”.

Hình 3.4 Những thay đổi ở các melanosome trong tế bào melanophore trong sọc đen của cá ngựa vằn sau 5 ngày chiếu laser Q-Switched Nd: YAG. Ở mức năng lượng 0,4 và 0,9 J/cm2, hầu hết các melanosome trong vùng chiếu đều biến mất vào ngày thứ 5 và vùng được điều trị không có sắc tố. Ngược lại, một số đốm sắc tố vẫn còn ở mức năng lượng 0,3 J/cm2.
Ví dụ, laser toning trong điều trị nám không ảnh hưởng đến tế bào hắc tố hay tế bào sừng và không gây tác dụng phụ và nó có hiệu quả trong điều trị nám bằng cách chỉ loại bỏ các melanosome có trong tế bào hắc tố và tế bào sừng.
Sau 2 tháng, tất cả các melanosome đều hồi phục bất kể mật độ năng lượng.
Lý thuyết quang nhiệt chọn lọc dưới tế bào ban đầu tương ứng với lý thuyết quang nhiệt chọn lọc vì TRT của các melanosome là 250–1000 ns, và độ dài xung của laser Q- Switch Nd: YAG là <10 ns, là cùng đơn vị nano giây. Tuy nhiên, trước đây, bằng cách sử dụng hiệu ứng quang cơ của laser Q- switched, việc điều trị phá vỡ tế bào (TRT tế bào hắc tố là 1–30 µs) được định nghĩa là lý thuyết về quang nhiệt có chọn lọc. Do đó, “lý thuyết chỉ phá vỡ các melanosome mà không làm tổn thương tế bào” chỉ được định nghĩa là “lý thuyết về quá trình quang nhiệt chọn lọc dưới tế bào”.
Chúng ta hãy nghĩ về phương pháp chiếu tia nhiều lần, một trong những thông số của laser. “Laser toning” thường được thực hiện bằng cách chiếu hơn 1000 tia vào mặt ở tần số 10 Hz. Tại sao lại chiếu rất nhiều tia ở tần số 10 Hz? Mặc dù không được giới thiệu trong bài này, nhưng poster của Giáo sư Ilhwan Kim tại hội nghị lần thứ 60 của hiệp hội da liễu Hàn Quốc vào năm 2008 đề xuất chiếu xạ từng tia (một xung) [8]. Ngoài ra, nếu có “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn hại các tế bào”, thì liệu một tia có đủ không? Vì vậy, tôi thực hiện cái gọi là one shot toning nơi nám được bắn từng tia một.
Thực chất của thuyết quang nhiệt chọn lọc dưới tế bào là gì? Có một “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn hại các tế bào”. Nói cách khác, có một khái niệm về một cửa sổ trị liệu. Khái niệm là nó không hiệu quả ở năng lượng thấp và có tác dụng phụ ở năng lượng cao và có đủ năng lượng sẽ hiệu quả mà không có tác dụng phụ.
Nếu chúng ta đi xuống một bước nữa so với khái niệm này, sẽ không có “mức năng lượng chỉ làm tổn thương tế bào mà không ảnh hưởng đến các tế bào xung quanh?” Vì vậy, đối với các phương pháp điều trị đốm nâu hoặc PIH mà không bị viêm, tôi sử dụng năng lượng cao hơn cho one shot toning. Cũng sẽ có một “mức năng lượng phá vỡ không chỉ các tế bào mà còn các mạch máu xung quanh”. Đó là lý do tại sao chấm xuất huyết xảy ra trong quá trình điều trị hình xăm và ABNOM.
Hình 3.5 TUNEL và nhuộm 4′,6-diamidino-2- phenylindole trên da cá ngựa vằn 1 ngày sau khi chiếu xạ tia laser Q-Switched Nd: YAG 1064-nm.
Phương pháp nhuộm 4 ′, 6- Diamidino-2-phenylindole (xanh lam) cho thấy không có sự khác biệt về sự phân bố và số lượng nhân bình thường trong các mẫu bị chiếu tia laser với các năng lượng khác nhau. Ngược lại, nhuộm TUNEL (đỏ) cho thấy quá trình apoptosis xảy ra sau khi chiếu tia laser và với sự phụ thuộc rõ ràng vào năng lượng chiếu tia laser. Ở mật độ năng lượng 0,5 J/cm2, các tế bào apoptotic được giới hạn ở phần trên của biểu bì. Ở mật độ năng lượng 0,7 và 0,9 J / cm2, quá trình apoptosis lan rộng trong toàn bộ lớp bì và lớp cơ.
Vậy, mức nào là năng lượng tiêu chuẩn cho “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn hại tế bào”, “mức năng lượng chỉ làm tổn thương tế bào mà không ảnh hưởng đến các tế bào xung quanh” và “mức năng lượng không chỉ phá vỡ tế bào mà còn cả các mạch máu xung quanh ”. Sau khi xem xét các mức năng lượng cho các tổn thương sắc tố trong các tài liệu khác nhau, tôi kết luận rằng:
“Trong laser Q-Switched Nd:YAG 1064 nm, mật độ năng lượng 4 J/cm2 và 6 J/cm2 với kích thước điểm 4 mm sẽ là năng lượng tiêu chuẩn cho một lần bắn.”
Vì vậy, tôi khuyến nghị rằng với một one shot toning, laser phải được sử dụng dưới 4 J/cm2 đối với nám, đây là “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn thương các tế bào”. Và đối với điều trị đốm nâu hoặc PIH không có viêm, nên sử dụng mức năng lượng từ 4 đến 6 J/cm2, đây là “mức năng lượng chỉ làm tổn thương tế bào mà không ảnh hưởng đến các tế bào xung quanh”. Và đối với điều trị hình xăm hoặc nevi tế bào hắc tố, mức năng lượng phải trên 6 J/cm2, đây là “mức năng lượng có thể phá vỡ không chỉ các tế bào mà còn các mạch máu xung quanh”.
Tính mật độ năng lượng cho melanosome
Tính toán thực tế “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn hại các tế bào”. Mức nhiệt độ mà tại đó các melanosome vỡ ra và xuất hiện hiệu ứng quang âm vẫn chưa được biết, nhưng mức nhiệt độ tại đó các melanosome đông tụ thì đã được biết. Bởi vì laser Q-Switch Nd: YAG 1064 nm tồn tại không chỉ trong vùng nhiệt giới hạn mà còn ở vùng stress, tôi tin rằng melanosome bị vỡ ngay cả ở nhiệt độ mà melanosome bị đông tụ (xem “Chương 2”).
Tính mật độ năng lượng cần thiết để đông tụ melanosome dựa trên các tài liệu của Anderson và cộng sự. [9]. Mặc dù nhiệt độ đông tụ khác nhau giữa các tài liệu laser, các bài báo của Anderson et al. xem như 75°C là nhiệt độ tại đó các melanosome đông tụ với nhiệt độ da là 35°C.
D0= ρSΔT/fα,αd<1
D0 — liều chiếu xạ với laser (J/cm2)
ρ — mật độ (≒ 1,1 g / cm3)
S – nhiệt dung riêng (≒ 4,2 J/g°C)
ΔT – sự thay đổi nhiệt độ
f – hệ số giảm dần
α – hệ số hấp thụ
d – kích thước trung bình mục tiêu.
Trong trường hợp bước sóng 1064 nm, độ xuyên sâu quang học dài hơn kích thước của melanosome, tương ứng với αd <1, có: 1.70 x 1012 nm-3.48 (cm-1) cho da
Hệ số hấp thụ cũng khác nhau giữa các tài liệu laser, nhưng nếu chúng ta thay thế 1064 nm trong công thức của hệ số hấp thụ trong một tài liệu, hệ số hấp thụ là 49,7 cm-1 [10]. Cuối cùng, không có tài liệu hoặc bài báo nào cho thấy các giá trị hệ số giảm dần, nhưng hãy thay thế 0,9 vì hệ số giảm dần là 0,5 ở 351 nm và 0,8 ở 700 nm.
Kết quả cho thấy 4,1 J/cm2 ở bước sóng 1064 nm. Nói cách khác, các melanosome đông tụ ở mật độ năng lượng 4,1 J/cm2 của
laser 1064 nm. Điều này tương tự như “mức năng lượng chỉ có thể phá vỡ các melanosome mà không làm tổn hại tế bào”, là mức năng lượng dưới 4 J/cm2, như đã đề cập trước đó.
Để tham khảo, khi hệ số giảm dần là 0,65 ở bước sóng 532 nm, mật độ năng lượng cần thiết để đông tụ các melanosome là 0,51 J/cm2.
Lựa chọn các thông số
Sự khó khăn trong việc xác định các thông số
Ít nhất ba thông số phải được lựa chọn tương ứng để bổ sung thuyết quang nhiệt chọn lọc [11]. Ba thông số này thường được gọi là “ba thông số” của lý thuyết quang nhiệt chọn lọc: bước sóng, độ dài xung và mật độ năng lượng. Đầu tiên, nên chọn bước sóng được hấp thụ nhiều bởi thể nhiễm sắc hơn các mô xung quanh. Độ sâu của thể nhiễm sắc cũng cần được tính đến khi chọn bước sóng. Thứ hai, độ dài xung phải nhỏ hơn hoặc bằng TRT của mô đích để hạn chế tổn thương nhiệt cho các mô xung quanh. Thứ ba, mật độ năng lượng phải gây ra tổn thương nhiệt đủ cho mô đích và phá hủy nó. Vì mỗi trong 3 thông số này phải được lựa chọn nên có rất nhiều trường hợp. Ví dụ, nếu có ba tùy chọn về bước sóng, độ dài xung và mật độ năng lượng tương ứng, thì có 27 trường hợp (3 × 3 × 3 = 27). Vì bước sóng được xác định khi mua thiết bị laser, thực tế có chín trường hợp (1 × 3 × 3 = 9). Chín trường hợp, dù chưa đến 27, không phải là lựa chọn dễ dàng. Ví dụ, giả sử rằng có số trường hợp từ 1–9, trong đó 1–4 không hiệu quả, 5 có hiệu quả, và tác dụng phụ xảy ra trong 6–9. Xác suất có hiệu quả mà không có tác dụng phụ là khoảng 10%. Do đó, việc xác định các thông số của tia laser không hề đơn giản.
Hiệu quả vs An toàn?
Bác sĩ sử dụng laser phải xác định ba hoặc sáu thông số. Tuy nhiên, quyết định cuối cùng là lựa chọn hiệu quả hoặc an toàn (mật độ năng lượng). Chọn hiệu quả làm tăng khả năng xảy ra tác dụng phụ và chọn an toàn làm tăng khả năng không có hiệu quả. Chúng ta sẽ chọn cái nào? Hiệu quả so với an toàn?
Một số người thích so sánh việc thực hành cá nhân với tập võ thuật, và giống như những người mới tập và bậc thầy võ thuật, sẽ có những người mới học và bậc thầy trong các bác sĩ sử dụng laser. Sự khác biệt giữa người mới và người thành thạo trong bác sĩ laser là gì? Tôi nghĩ nếu các tia laser giống nhau, không có sự khác biệt về hiệu ứng giữa người mới và người thành thạo. Bởi vì nếu tia laser được chiếu với công suất cao thì sẽ cho hiệu quả ở cả người mới và người thành thạo. Tuy nhiên, có sự khác biệt về xác suất xảy ra các phản ứng phụ đối với người mới và người thành thạo. Tôi nghĩ “bác sĩ laser bậc thầy” là người tạo ra các hiệu quả tương tự với tác dụng phụ tối thiểu.
Vì vậy, tôi tin rằng để trở thành một “bậc thầy”, sự an toàn phải được lựa chọn hơn là hiệu quả. Tất nhiên, an toàn mà không hiệu quả cũng là điều không mong muốn. Qua đào tạo và kinh nghiệm, các thông số an toàn và hiệu quả sẽ được tìm thấy.
Độc giả sẽ có thể chạm tới trọng tâm của thủ thuật laser nếu họ chú trọng nhiều hơn đến tính an toàn hơn là tính hiệu quả khi đọc cuốn sách này.
Bước sóng
Hệ số hấp thụ
Phương pháp đo hệ số hấp thụ như sau. Ánh sáng có bước sóng đơn sắc, như laser, được chiếu xạ và đi qua một khối thuỷ tinh đục có chứa thể nhiễm sắc. Ánh sáng còn lại được đo bằng máy dò. Tỷ số giữa cường độ ánh sáng (I0) trước khi chiếu xạ vào khối thuỷ tinh mục tiêu và cường độ ánh sáng còn lại khi qua mục tiêu (I) là tỷ lệ hấp thụ (Hình 3.6) [13].
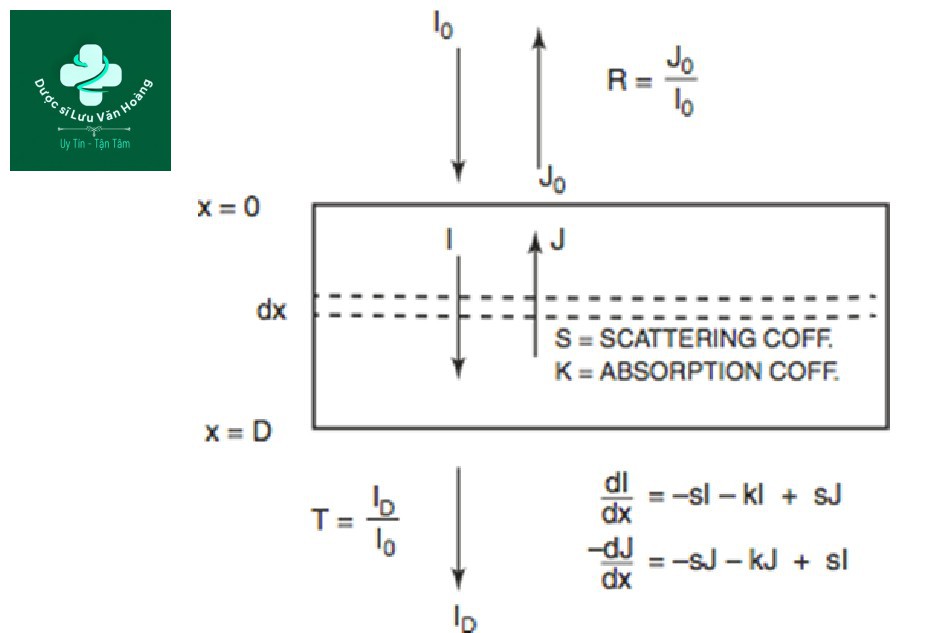
Hình 3.6 Mô hình Kubelka – Munk để truyền bức xạ trong môi trường hấp thụ, đục.
Tỷ lệ hấp thụ này giảm theo hàm của chỉ số tự nhiên (xem “Chương 1”).
Tỷ lệ hấp thụ bao gồm độ sâu mục tiêu (chiều dài L) và các yếu tố khác với độ sâu mục tiêu. Các yếu tố khác với độ sâu mục tiêu có thể được xác định là hệ số hấp thụ (µa). Dựa trên cường độ ánh sáng trong đó µaL bằng 1.
Hệ số hấp thụ là (1/chiều dài) và đơn vị là cm− 1. Do đó, định nghĩa của hệ số hấp thụ có thể được định nghĩa là khả năng hoặc xác suất các photon của một bước sóng cụ thể bị hấp thụ trên một đơn vị chiều dài [1].
Nếu hệ số hấp thụ = 1/length được hiểu theo cách khác, thì có thể hiểu là “các photon xuyên sâu ít ở tia laser có hệ số hấp thụ cao và các photon xuyên sâu nhiều ở tia laser có hệ số hấp thụ thấp.” Các ví dụ bao gồm laser CO2 có hệ số hấp thụ nước cao và laser Nd: YAG có hệ số hấp thụ nước thấp. Laser CO2 có hệ số hấp thụ cao sẽ đi vào nông và làm bay hơi lớp thượng bì làm bong da, nhưng laser Nd:YAG có hệ số hấp thụ thấp sẽ truyền nhiệt vào sâu lớp bì nên có thể gây bỏng sâu với năng lượng cao.
Hệ số hấp thụ được biết là thay đổi bởi hai biến số [14]. Đầu tiên, hệ số hấp thụ thay đổi tùy thuộc vào thể nhiễm sắc. Thứ hai, hệ số hấp thụ thay đổi tùy theo bước sóng. Do đó, một đường cong hấp thụ được tạo ra (Hình 3.7). Ví dụ, laser ruby 694 nm được phát hiện có khả năng được hấp thụ cao trong melanin và hấp thụ thấp trong hemoglobin và laser Nd:YAG 1064 nm được phát hiện có được hấp thụ thấp trong melanin, hemoglobin và nước. Kết luận, hệ số hấp thụ phụ thuộc vào hai biến số là bước sóng và thể nhiễm sắc.
Tuy nhiên, hệ số hấp thụ không phải là hằng số đối với mỗi thể nhiễm sắc. Ngay cả với cùng một thể nhiễm sắc, hệ số hấp thụ phụ thuộc vào mật độ của thể nhiễm sắc [2].
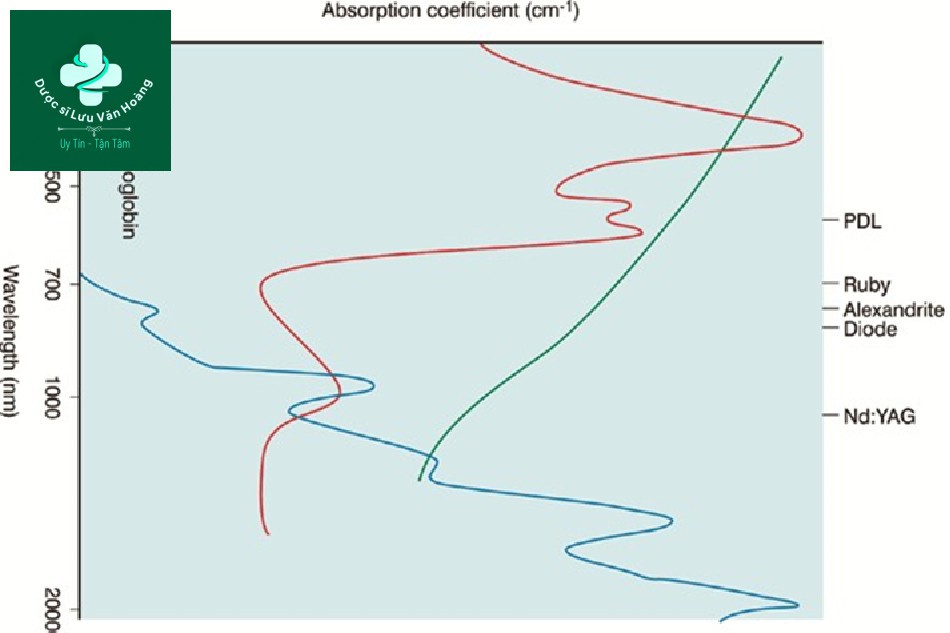
Hình 3.7 Phổ hấp thụ. Phổ hấp thụ không đồng nhất của thể nhiễm sắc cho phép quá trình quang nhiệt có chọn lọc hoạt động.
Do đó, ngay cả khi các thể nhiễm sắc có cùng hệ số hấp thụ, hệ số hấp thụ thay đổi tùy theo mật độ. Thể nhiễm sắc mà chúng ta giả định là mục tiêu là mục tiêu đơn lẻ nhưng thực tế thể nhiễm sắc là nhóm các mục tiêu. Ví dụ, khi điều trị sắc tố, mục tiêu đơn lẻ là melanosome, nhưng mật độ melanosome khác nhau ở mỗi tế bào hắc tố chứa melanosome, và mật độ tế bào hắc tố cũng khác nhau trong mỗi đốm nâu mà các tế bào hắc tố tập hợp lại. Do đó, mặc dù có cùng các melanosome là các mục tiêu, các đốm nâu sáng màu có hệ số hấp thụ thấp, trong khi các đốm nâu sậm màu có hệ số hấp thụ cao. Đó là lý do tại sao chúng tôi biết theo kinh nghiệm rằng chúng tôi nên chiếu xạ “các tổn thương tối màu yếu và các tổn thương sáng màu mạnh”.
Từ những điều này, chúng ta có thể rút ra hai kết luận:
- Các tổn thương khác nhau có mật độ khác nhau, do đó năng lượng phải được kiểm soát khác nhau. Nói cách khác, chúng ta nên chiếu tia “các tổn thương tối màu yếu và các tổn thương sáng màu mạnh”.
- Không có thông số tuyệt đối.
Độ sâu xâm nhập quang học
Da có thể được coi như một môi trường đục được tạo thành từ các vật chất nhỏ như máu, melanin, bilirubin và collagen [1]. Khi các photon gặp các vật chất này, hiện tượng tán xạ xảy ra do hình dạng hoặc kích thước của vật chất, đặc biệt là sự khác biệt về chiết suất. Tuy nhiên, ở bước sóng trên 2500 nm và dưới 250 nm, hệ số hấp thụ của nước và melanin tương ứng cao hơn hệ số tán xạ, dẫn đến không có hiện tượng tán xạ [14]. Sự tán xạ chỉ xảy ra trong khoảng 250 đến 2500 nm. (Tất nhiên, ngay cả ở bước sóng này, các melanosome và hemoglobin cũng được hấp thụ.) Sự tán xạ xảy ra chủ yếu ở lớp bì. Collagen là nguyên nhân chính gây ra hiện tượng tán xạ. Khi ánh sáng đi vào da, sự tán xạ tăng lên và số lượng photon được hấp thụ giảm. Khi hệ số hấp thụ tăng, độ xuyên sâu quang học giảm. Độ sâu xâm nhập quang học cũng giảm theo hệ số tán xạ.
Do đó, mô tả chính xác hơn về công thức (xem “hệ số hấp thụ”) sẽ là:
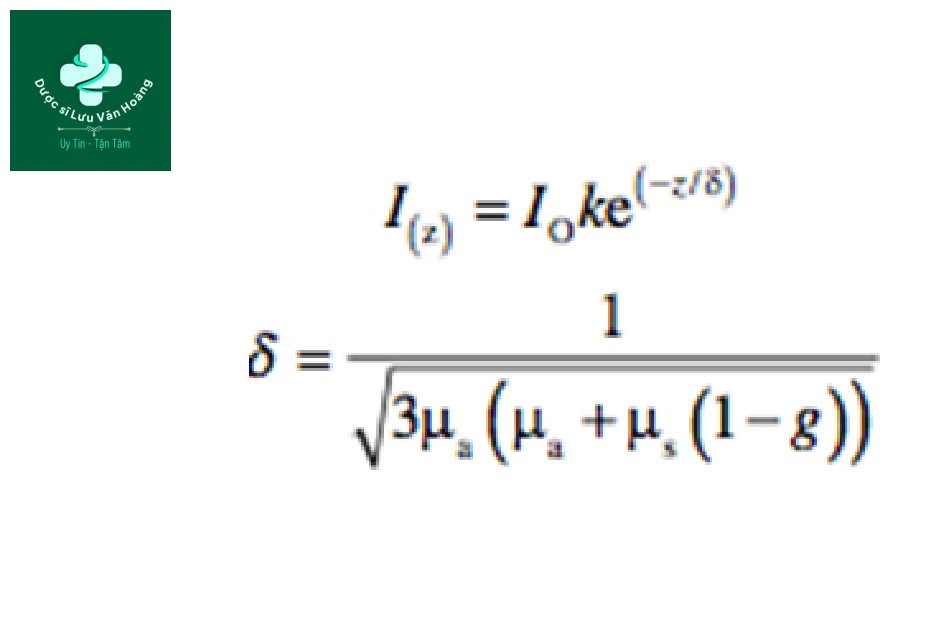
I (z): mật độ năng lượng bề mặt ở độ sâu z.
k: hằng số tính tán xạ ngược.
δ: độ xâm nhập quang học phụ thuộc vào bước sóng hoặc độ sâu của ánh sáng hoặc độ sâu mà tại đó có sự suy giảm còn 37% giá trị trên bề mặt (37% = 1/e, trong đó e = 2,7, cơ số của logarit tự nhiên).
g: hệ số dị hướng (giá trị của “trung bình” hướng của các photon bị tán xạ). g = 0,9 đối với da.
µa: hệ số hấp thụ.
µs: hệ số tán xạ.
Độ sâu xâm nhập quang học giảm khi hệ số hấp thụ và hệ số tán xạ tăng [14]. Sự tán xạ có thể dễ dàng quan sát trong cuộc sống thực. Khi chúng ta dùng tay che mặt trời, có thể nhìn thấy “màu đỏ” có bước sóng dài và ít bị tán xạ qua bàn tay trong khi không thể nhìn thấy “màu xanh”. Nguyên tắc tương tự cũng được áp dụng cho hiện tượng hoàng hôn màu đỏ rực.
Đặc biệt, hệ số tán xạ có ảnh hưởng đến độ sâu xâm nhập nhiều hơn hệ số hấp thụ. Trong vùng ánh sáng khả kiến, xảy ra 100 lần tán xạ trước khi một photon bị hấp thụ [1], và trong trường hợp ánh sáng đỏ, độ dài di chuyển trung bình cho đến khi hấp thụ là 50 µm. Chiều dài di chuyển trung bình do tán xạ là 5 mm, gấp khoảng 100 lần [16].
Tán xạ ngược
Sự tán xạ có thể xảy ra theo mọi hướng [17]. Người ta lầm tưởng rằng có nhiều tán xạ ngược hơn, nhưng trong trường hợp tán xạ Mie, tán xạ thuận được biết là tán xạ chính [16]. Khi hiện tượng tán xạ ngược xảy ra, nhiều photon tích tụ trên bề mặt da và năng lượng tích luỹ trên bề mặt cao hơn dự định. Do đó, bước sóng ngắn hơn tích lũy nhiều năng lượng hơn bước sóng dài hơn. Hãy giả định những điều sau để hiểu rõ. Giả sử rằng bốn photon trong số mười photon được hấp thụ ở 0,1 mm tương ứng với độ dày của lớp biểu bì và các photon ở độ sâu 0,2 mm tính từ bề mặt bị tán xạ ngược dẫn đến thêm một photon hấp thụ ở 0,1 mm. Trong trường hợp này, ở độ sâu 0,1 mm, có bốn photon tạo ra mật độ năng lượng 4 J/cm2, nhưng do tán xạ ngược nên có tổng cộng năm photon dẫn đến năng lượng tăng lên 5 J/cm2. Kết quả là tia laser có bước sóng ngắn hơn tích luỹ nhiều năng lượng hơn năng lượng thực tế trên bề mặt da. Ví dụ, ngay cả khi cả hai laser 532 và 755 nm được chiếu với cùng một mức năng lượng, thì laser 532 nm cho thấy sự tích luỹ năng lượng thực tế cao hơn trên bề mặt da, dẫn đến tăng khả năng xảy ra tác dụng phụ.
Ngoài ra, do tán xạ ngược, độ xuyên sâu “thực” là sâu hơn độ sâu xâm nhập quang học (OPD) [1]. Giả sử bốn trong số mười photon xuyên qua ở độ sâu 2 mm và hai xuyên qua ở 2,5 mm, với laser Nd: YAG 1064 nm. Độ xuyên sâu là độ sâu mà tại đó các photon giảm xuống còn e-1, tức là độ sâu mà tại đó mười photon trở thành bốn photon. OPD theo định nghĩa là sâu 2 mm, nhưng nếu hai photon còn lại vượt qua độ sâu 2,5 mm bị tán xạ ngược trở lại điểm 2,5 mm, thì có bốn photon ở 2,5 mm. Do đó, độ xuyên sâu “thực” là 2,5 mm. Độ xuyên sâu thực sâu hơn OPD.
Nếu không xảy ra hiện tượng hấp thụ thì độ xuyên sâu thực sẽ sâu hơn. Trong trường hợp mô sắc tố, tất cả các photon từ bước sóng 532 nm được hấp thụ trong mô sắc tố, dẫn đến độ xuyên sâu nông (Hình 3.8).
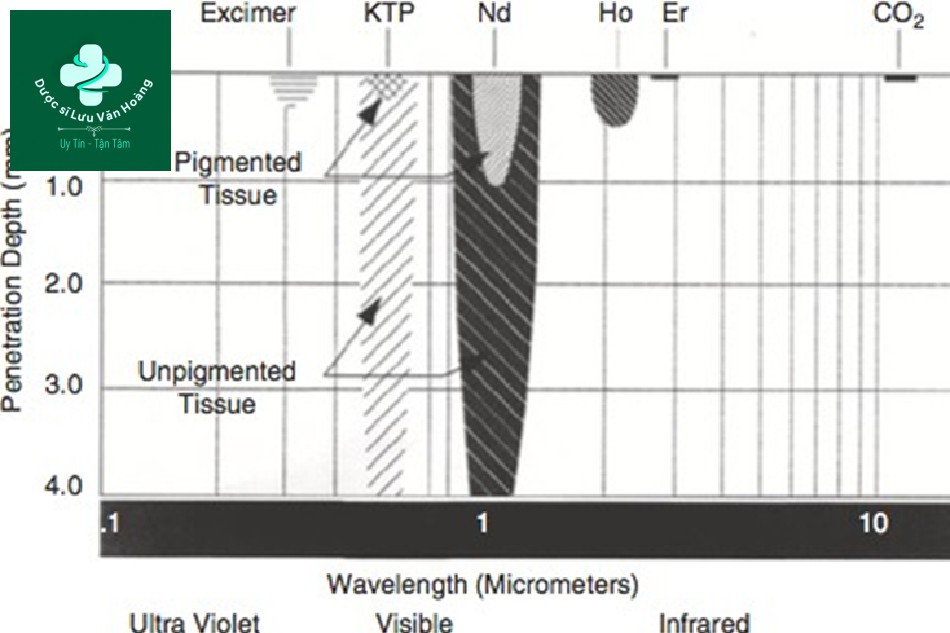
Hình 3.8 Độ xuyên sâu của tia laser với mô có sắc tố / không có sắc tố.
Tuy nhiên, trong trường hợp không có mô sắc tố, sự hấp thụ sẽ không xảy ra và độ xuyên sâu thực trở nên sâu hơn.
Tóm lại, OPD là một giá trị cố định được tính toán về mặt toán học hoặc vật lý. Tuy nhiên, trên thực tế, OPD sâu hơn và có thể thay đổi tùy thuộc vào sự hiện diện của mô hấp thụ cũng như lượng collagen.
Ngoài ra, khi điều trị ở lớp bì (điều trị mạch máu, triệt lông và xóa hình xăm), xử lý sắc tố trong lớp biểu bì và sau đó điều trị ở lớp bì cho phép các bác sĩ laser điều trị các phần sâu hơn của da (Hình 3.8). Do đó, một quy trình theo thứ tự rất hữu ích khi điều trị ở lớp bì.
Độ dài xung
Thời gian giãn nhiệt
Có ba cách để mất nhiệt trong các mô: dẫn nhiệt, đối lưu nhiệt do máu và bức xạ nhiệt [3]. Hai hiện tượng sau chỉ có ý nghĩa trong trường hợp xung dài, và trong khoảng độ dài xung ngắn, dẫn nhiệt, truyền nhiệt ra môi trường xung quanh, là cách tản nhiệt chính. Công thức của độ xuyên sâu nhiệt do dẫn nhiệt như sau [19]:
Ztherm (t)=√4kt
Ztherm (t) – độ xuyên sâu nhiệt
k – độ dẫn nhiệt
t – thời gian.
Công thức về thời gian giãn nhiệt được tính theo công thức cho độ xuyên sâu nhiệt. Lý thuyết về quang nhiệt có chọn lọc phát biểu rằng “nếu một lượng nhỏ năng lượng ánh sáng được chiếu xạ trong một thời gian ngắn, thì năng lượng ánh sáng mà mô đích nhận được chỉ được sử dụng để tăng nhiệt độ của mô đích và không truyền nhiệt cho các mô xung quanh”. Do đó, độ xuyên sâu nhiệt không được lớn hơn đường kính mục tiêu của mô đích và phải bằng hoặc ngắn hơn (đường kính mục tiêu ≥ độ xuyên sâu nhiệt). Do đó, thời gian giãn nhiệt có thể được định nghĩa là thời gian của độ xuyên sâu nhiệt khi độ xuyên sâu nhiệt và đường kính mô đích là bằng nhau. Thay đổi thời gian giãn nhiệt bằng cách sử dụng công thức cho độ xuyên sâu nhiệt dẫn đến công thức thời gian giãn nhiệt (TRT).
τ= δ/gκ
δ — độ xuyên sâu quang cho các lớp hấp thụ đồng nhất.
κ — độ khuếch tán nhiệt, một đại lượng dựa trên độ dẫn nhiệt và nhiệt dung riêng của môi trường.
g — hằng số dựa trên hình dạng của mục tiêu (phẳng, hình trụ hoặc hình cầu).
Xem xét khái niệm của δ trong công thức này. Trong “Chương 1”, δ là đường kính của mô đích, nhưng định nghĩa ban đầu là độ xuyên sâu quang học đối với các lớp hấp thụ đồng nhất [14]. Tại sao định nghĩa này lại xuất hiện?
Khi tia laser được chiếu vào mục tiêu nhỏ (đường kính mục tiêu <OPD, αd <1) thì tất cả các photon có thể đi qua nó [9]. Nhưng khi mô đích rất lớn (đường kính mục tiêu> OPD, αd> 1), các photon chỉ chiếu một phần của mô đích (Hình 3.9). Tại thời điểm này, chiều dài của phần mô đích bị ảnh hưởng bởi tia laser là OPD. Nói cách khác, khi “đường kính mục tiêu <OPD”, độ xuyên sâu nhiệt bằng đường kính của mô đích. Nhưng khi “đường kính mục tiêu > OPD”, độ xuyên sâu nhiệt không bằng đường kính mà bằng OPD (độ xuyên sâu nhiệt = độ xuyên sâu quang). Thêm nữa, trong cả hai trường hợp, độ dẫn nhiệt (k) phải giống nhau để áp dụng công thức của độ xuyên sâu nhiệt. Nói cách khác, mô đích bị ảnh hưởng bởi tia laser phải là một mô đồng nhất.

Hình 3.9 Mối quan hệ giữa các mô đích và OPD. Trái (đường kính mục tiêu <OPD, αd <1), Phải (đường kính mục tiêu> OPD, αd> 1).
Để tóm tắt các phần chung trong cả hai tình huống, trước tiên, nhiệt phải được tạo ra trong OPD. Thứ hai, các mô đích phải đồng nhất. Do đó, δ được định nghĩa như sau: “độ xuyên sâu quang đối với các lớp hấp thụ đồng nhất”.
Vì định nghĩa của δ có hai tiền đề nên có hai khái niệm về TRT [1]. Đầu tiên, vì OPD khác nhau tùy theo bước sóng, TRT có thể thay đổi tùy theo bước sóng. Thứ hai, da có nhiều thành phần và thể nhiễm sắc khác nhau, nhưng về tính dẫn nhiệt, da là một mô đồng nhất có cùng độ khuếch tán nhiệt. Trong chất lỏng và hầu hết các mô, độ khuếch tán nhiệt là 1,4 × 10−7 m2 s [19] hoặc 1,3 × 10−3 cm2/s tùy thuộc vào tài liệu [1]. Tại thời điểm này, yếu tố xác định độ xuyên sâu nhiệt là thời gian, tức là độ dài xung. Do đó, TRT có thể thay đổi tùy theo độ dài xung.
TRT xác định bằng bước sóng
TRT có thể thay đổi tùy theo bước sóng. Trong trường hợp thể nhiễm sắc nằm ở khắp nơi trên da, chẳng hạn như nước, OPD không phụ thuộc vào cấu trúc da (lớp biểu bì, lớp đáy, melanosomes, v.v.) mà phụ thuộc vào bước sóng [1]. Ví dụ, laser 1540 nm có hệ số hấp thụ nước thấp và xuyên sâu, với OPD vài trăm micromet. Như vậy, TRT là vài trăm giây. Ngược lại, laser CO2 có hệ số hấp thụ cao đối với nước có OPD nông với TRT nhỏ hơn 1 ms. Laser Er: YAG thậm chí có hệ số hấp thụ nước cao hơn so với laser CO2, với TRT là 1 µs. Do đó, OPD càng nông thì TRT càng ngắn. Đối với nước, TRT thay đổi tùy theo bước sóng. Do đó, khi mô tả TRT của nước, cần đề cập đến cả bước sóng và laser, chẳng hạn như “<1 ms trong laser CO2” hoặc “1 µs trong laser Er: YAG.”
TRT xác định bằng cấu trúc da
TRT có thể phụ thuộc vào cấu trúc da. Ví dụ: các melanosome có TRT là 347,2 ns với kích thước 1 µm, và lớp đáy của biểu bì nơi các tế bào sừng có melanosomes có TRT là 0,1 ms với độ dày 10 µm, và lớp biểu bì với tổng các tế bào sừng có melanosomes có TRT là 10 ms với độ dày 100 µm.
Tại sao TRT thay đổi theo cấu trúc da? Trong trường hợp của laser Q-Switch, nhiệt chỉ giới hạn ở melanosome, tức là, phân bố không đồng đều. Do đó, sau khi tia laser được chiếu, nhiệt sẽ được truyền đến lớp trên của biểu bì, trong khi các melanosome và lớp đáy nguội đi. Mặt khác, trong trường hợp laser xung dài, ví dụ, khi được chiếu xạ với 10 ms, nhiệt của các melanosome được truyền đến lớp đáy hoặc toàn bộ lớp biểu bì với độ dài xung tương đối dài hơn so với laser Q-switched, dẫn đến phân bố nhiệt đồng đều. Do đó, mặc dù không đồng nhất về mặt mô học, nhưng sự phân bố nhiệt là đồng đều. Vì vậy, ngay cả ở cùng một bước sóng, việc điều chỉnh độ dài xung có thể thay đổi TRT và thay đổi mục tiêu mong muốn. Một ví dụ là laser xung dài đơn vị mili giây được dùng điều trị sắc tố biểu bì, mạch máu và triệt lông.
Hiện tượng này có thể được giải thích bằng lý thuyết mở rộng nói trên về quá trình quang nhiệt có chọn lọc. Tình huống áp dụng lý thuyết mở rộng là khi mô không đồng nhất, nhưng khi phân bố nhiệt là đồng đều.
Trong Bảng 3.2 (được đề cập trong “Chương 1”), chúng ta có thể thấy rằng TRT thay đổi tùy thuộc vào cấu trúc da hoặc bước sóng của tia laser. Ngoài ra, một điều nữa cần suy nghĩ trong bảng này là không có TRT cho melanin và hemoglobin, cả hai đều là thành phần của ba thể nhiễm sắc chính. Tại sao như vậy? Tôi nghĩ, thứ nhất là do melanin và hemoglobin có TRT quá ngắn nên chưa thể tạo ra tia laser có đồ dài xung phù hợp với TRT này. Thứ hai, lý thuyết được áp dụng cho điều trị bằng laser trong thực tế không phải là quá trình quang nhiệt chọn lọc mà là lý thuyết mở rộng về quá trình quang nhiệt chọn lọc.
Bảng 3.2 TRT cần nhớ TRT cần nhớ
| Melanosome | <1 µs (250–1000 ns) |
| Sắc tố hình xăm | 20 ns ~ 3 ms |
| Melanocyte | 1–30 µs |
| Lớp đáy | 0.4 ms |
| Biểu bì | 2ms (1–10ms) |
| Mao mạch | 4,5 ms (100 µm: 100 µm tương ứng với kích thước của mạch máu nhỏ nhất có
thể nhìn thấy) |
| Nang lông | 40 ms (10–100 ms) |
| Nước | <1 ms trong laser CO2, 1
µs trong Er: YAG |
Bảng 3.2 cho thấy rằng TRT của melanocyte là 1–30 µs, nhưng tương tự như vậy, laser với độ dài xung này vẫn chưa có. Vì vậy, hiện tại, chúng ta không thể xử lý các tế bào phù hợp với TRT như melanocyte và chỉ có thể xử lý các lớp tế bào như lớp đáy. Tuy nhiên, có thể xử lý tế bào bằng hiệu ứng cơ quang mà không cần áp dụng TRT.
Kích thước điểm
Quy tắc ngón tay cái trong kích thước điểm
Hãy xem lại cách điều chỉnh kích thước điểm khi điều trị lớp bì. Ví dụ, vì các mạch máu nằm ở các độ sâu khác nhau của lớp bì, OPD sâu hơn được ưu tiên hơn. Nếu vậy, kích thước điểm nên được tăng lên để OPD trở nên sâu hơn. Nhưng ngay cả với cùng một mật độ năng lượng, kích thước điểm lớn hơn đòi hỏi nhiều photon hơn để chiếu xạ, do đó, đòi hỏi năng lượng cao hơn. Nhưng vì mỗi máy laser có giới hạn về năng lượng, nó không thể duy trì một mật độ năng lượng nhất định ngoài một kích thước điểm nhất định. Vì vậy, điều cần thiết để tìm một kích thước điểm phù hợp. Kích thước điểm nên lớn như thế nào?
Một tài liệu laser đề xuất “quy tắc ngón tay cái về kích thước điểm” nên bằng khoảng mười lần độ sâu mục tiêu, “dựa trên độ sâu của mô đích” [2]. Ví dụ, độ sâu của tổn thương biểu bì là 0,1 mm nên kích thước điểm nên là 1 mm. Độ sâu của bớt rượu vang (PWS), hình xăm và lông lần lượt là 1, 2 và 3 mm, vì vậy kích thước điểm tương ứng phải là 10, 20 và 30 mm. Tuy nhiên, tôi nghĩ rằng kích thước điểm được trình bày trong tài liệu này là quá lớn. Tôi nghĩ rằng kích thước điểm tối đa gấp 5 lần độ sâu mục tiêu. Ví dụ, trong trường hợp triệt lông bằng laser, vì kích thước điểm 10 mm được cho là đủ để triệt lông, 15 mm, gấp 5 lần độ sâu 3 mm, có lẽ là kích thước tối đa. Tiến sĩ Minho Lee đề xuất “Quy tắc một nửa” vì ở kích thước điểm nhỏ hơn 10 mm, một nửa kích thước điểm tương ứng với độ sâu mục tiêu (hai lần độ sâu mục tiêu) và mục tiêu ở độ sâu này có thể được xử lý. Mặt khác, Ross et al. nói rằng kích thước điểm phải lớn hơn OPD ít nhất bốn lần [22].
Hiệu ứng kích thước điểm
Hãy xem xét kỹ hơn hiệu ứng kích thước điểm được mô tả trong “Chương 1”.
Trong “Chương 1”chúng tôi cho rằng có một kích thước điểm lớn 1 cm2 và một kích thước điểm nhỏ 0,5 cm2, lần lượt 10 và 5 photon được bắn ra, và một photon nằm trong khu vực bên ngoài OPD. Tám photon sẽ được hấp thụ ở kích thước điểm lớn và 3 ở kích thước điểm nhỏ (Hình 3.10). Mật độ năng lượng là số lượng photon trên một đơn vị diện tích, do đó mật độ năng lượng của laser là 10 J/cm2 ở cả hai kích thước điểm, nhưng bên trong da, mật độ năng lượng khác nhau (tương ứng là 8 J/cm2 và 6 J/m2). Nói cách khác, kích thước điểm càng lớn thì năng lượng thực tế trên da càng cao. Lý do của điều này là vì các photon bị lệch khỏi hướng tia và do đó không bị hấp thụ là một “hằng số” và mật độ năng lượng là một “tỷ lệ”.
Tóm lại, năng lượng trong da tương đối thấp ở kích thước điểm nhỏ và tương đối cao ở kích thước điểm lớn. Vì vậy, chúng ta nên làm gì khi chuyển đổi kích thước điểm trong cùng mật độ năng lượng? Giảm kích thước điểm ở cùng mật độ năng lượng sẽ dẫn đến năng lượng hấp thụ thấp hơn, không gây tác dụng phụ, nhưng ít hiệu quả hơn. Nếu kích thước điểm được tăng lên, năng lượng thực tế trở nên cao hơn năng lượng ban đầu, do đó có khả năng cao xảy ra tác dụng phụ. Vì vậy, khi tăng kích thước điểm, nên giảm mật độ năng lượng.
Vậy, chúng ta nên làm gì để có được năng lượng đồng đều trong da ở các kích thước điểm khác nhau? Hình 3.11 cho thấy số lượng photon được chuyển đổi thành mật độ năng lượng từ Hình 3.10. Trước tiên, ở 10 J/cm2 của tay cầm, mật độ năng lượng trong da là 8 J/cm2 đối với kích thước điểm lớn và 6 J/cm2 đối với kích thước điểm nhỏ. Để tạo ra năng lượng tương đương trên da với kích thước điểm nhỏ, cần tăng mật độ năng lượng
của tay cầm. Để tạo ra cùng một năng lượng 8 J/cm2 trên da với kích thước điểm nhỏ, năng lượng phải được nâng lên trên năng lượng ban đầu của tay cầm là 10 J/cm2, ví dụ, nó phải được nâng lên 12 J/cm2. Điều quan trọng cần lưu ý là sự tán xạ xảy ra chủ yếu ở lớp bì. Sự tán xạ không xảy ra ở lớp biểu bì. Năng lượng của kích thước điểm lớn trong lớp biểu bì là 10 J/cm2 nhưng năng lượng của kích thước điểm nhỏ là 12 J/cm2.
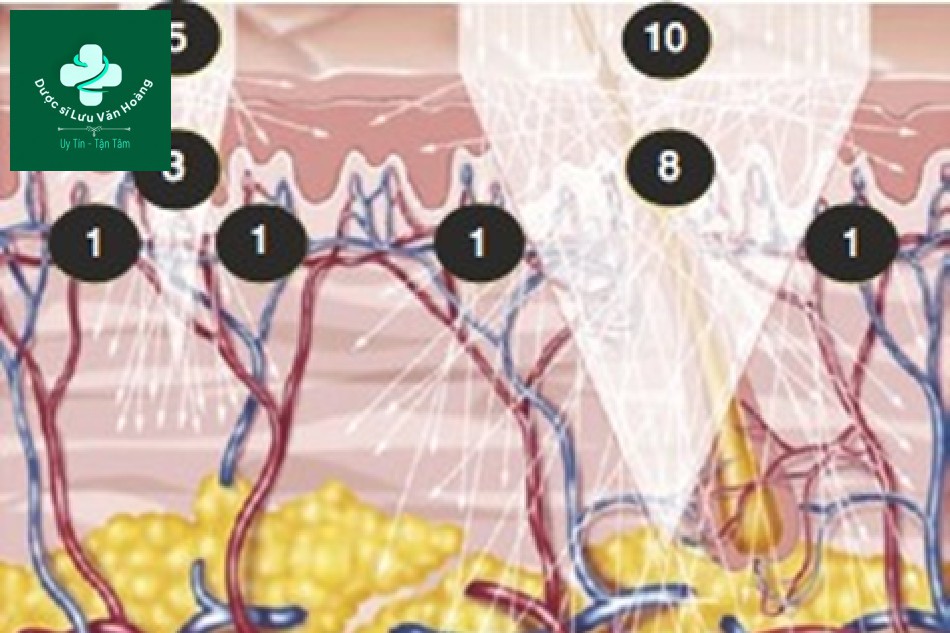
Hình 3.10 Số lượng photon theo kích thước điểm. Khi giả sử rằng kích thước điểm là 1 cm2, 0,5 cm2 và mật độ năng lượng là 10 J/cm2 thì số lượng photon được giả thiết lần lượt là 10 và 5.
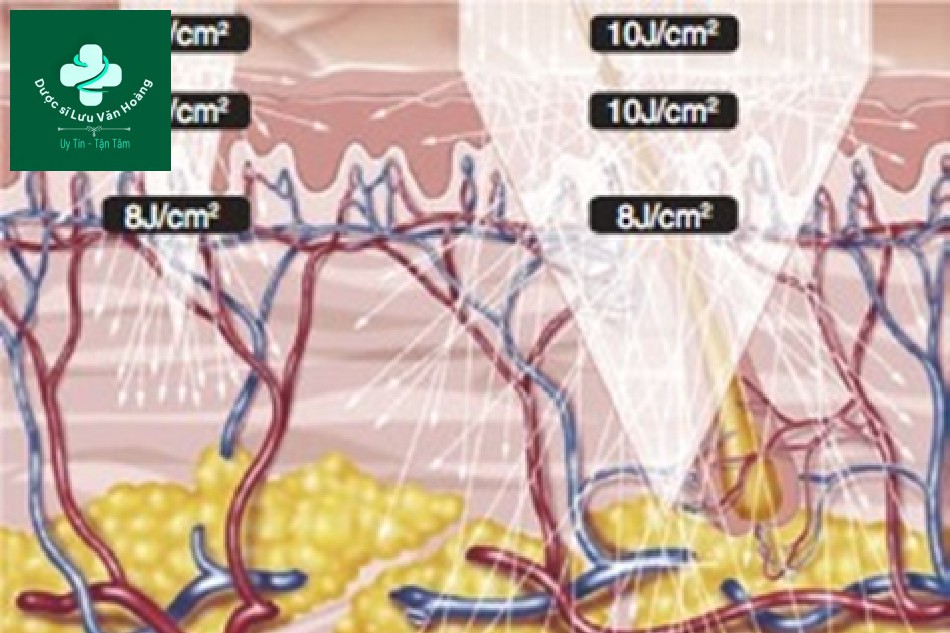
Hình 3.11 Số lượng các photon được chuyển đổi thành mật độ năng lượng từ Hình 3.10. Giá trị của “kích thước điểm nhỏ” là giá trị giả định của mật độ năng lượng cần thiết cho lớp biểu bì và tay cầm khi điều chỉnh mật độ năng lượng của lớp bì thành 8 J/cm2.
Nói cách khác, kích thước điểm nhỏ có năng lượng ở biểu bì tương đối cao so với kích thước điểm lớn và có nhiều khả năng gây ra tác dụng phụ trên lớp biểu bì. Vì vậy, để tạo ra hiệu quả tương tự ở lớp bì, tăng kích thước điểm là một phương pháp để bảo vệ lớp biểu bì.
Hiệu ứng kích thước đỉểm có thể được tóm tắt như sau.
- Kích thước điểm càng lớn thì độ thâm nhập của tia laser càng sâu.
- Khi tăng kích thước điểm ở cùng một mật độ năng lượng, thì phải giảm bớt mật độ năng lượng.
- Khi điều trị lớp bì, nên sử dụng kích thước
điểm lớn để bảo vệ lớp biểu bì.
Lee et al. đã sử dụng laser Nd: YAG xung dài và laser alexandrite xung dài và quan sát sự thay đổi nhiệt độ của biểu bì và bì khi kích thước vết điểm và mật độ năng lượng tương ứng là 5, 8, 10 mm và 26, 30, 36 J/cm2 [24]. Kết quả cho thấy rằng sự chênh lệch nhiệt độ biểu bì không lớn với sự thay đổi kích thước điểm, nhưng nhiệt độ biểu bì tăng khi tăng mật độ năng lượng. Mặt khác, ở lớp bì cũng như ở lớp biểu bì, mật độ năng lượng càng cao thì nhiệt độ của lớp bì càng cao. Nhưng người ta quan sát thấy rằng kích thước điểm càng lớn so với mật độ năng lượng thì nhiệt độ càng cao. Điều này phù hợp với hiệu ứng kích thước điểm được mô tả trước đó.
Vậy, hiệu ứng kích thước điểm có thể được sử dụng cho những loại điều trị nào? Hiệu ứng kích thước điểm có thể được sử dụng điều trị các mục tiêu nằm trong lớp bì. Ví dụ, kích thước điểm lớn được khuyến khích cho điều trị mạch máu, triệt lông, trẻ hóa không xâm lấn, tổn thương sắc tố lớp bì,… Trong số này, chúng tôi sẽ đánh giá hiệu ứng kích thước điểm được áp dụng như thế nào khi thực hiện xóa xăm.
Có rất nhiều thách thức trong việc xóa hình xăm bằng laser nhưng chúng ta hãy xem xét một số vấn đề. Đầu tiên, tia laser phải xâm nhập sâu nhất có thể vì sắc tố hình xăm có thể nằm ở lớp rất sâu của lớp bì. Thứ hai, khi hình xăm được xăm lại hai lần hoặc ba lần, bóng nước hoặc sẹo có thể xảy ra ngay cả khi vết xăm nhẹ. Thứ ba, có thể xảy ra hiện tượng sậm màu nghịch lý. Sậm màu nghịch lý dùng để chỉ hiện tượng các sắc tố hình xăm màu trắng, hồng đào, hồng, đỏ chuyển thành màu đen khi được điều trị bằng laser, gây khó khăn cho việc điều trị và tăng số lần điều trị [3]. Điều này được biết là xảy ra thường xuyên trong các hình xăm bán vĩnh viễn, do sự thay đổi hóa học từ oxit sắt màu đỏ (Fe2O3) sang oxit sắt đen (FeO). Ngoài ra, titanium dioxide, được sử dụng cho các hình xăm màu trắng hoặc màu sáng, cũng được biết đến là nguyên nhân. Beute et al. tìm thấy các hiện tượng sau đây trong quá trình điều trị hình xăm màu xanh lam, xanh lục và đỏ bằng laser Q-switched 532 nm [25]. Nghịch lý sậm màu xuất hiện ở trung tâm của chum tia trong khi hình xăm bị xóa ở bên ngoài của chum tia. Năng lượng yếu ở bên ngoài chum tia do tán xạ và chùm tia Gaussian. Do đó, điều trị xóa hình xăm bằng năng lượng thấp có thể sẽ ít xảy ra hiện tượng sậm màu nghịch lý hơn.
Cân nhắc 3 điểm nêu trên với hiệu ứng kích thước điểm, trong xóa xăm bằng laser, cần điều trị vùng da với kích thước điểm lớn để loại bỏ các sắc tố hình xăm sâu và bảo vệ lớp thượng bì. Năng lượng thấp nên được sử dụng trước tiên để giữ cho da an toàn khỏi các hình xăm chồng lấp hoặc hiện tượng sậm màu nghịch lý. Và sau đó, năng lượng nên được tăng từ từ. Kết luận, kích thước điểm lớn phải được sử dụng trước tiên và năng lượng phải được tăng tuần tự từ mức năng lượng thấp [1].
Cụ thể, tôi điều trị hình xăm như sau: chọn điểm kết thúc lâm sàng là “làm trắng ngay lập tức với chấm xuất huyết rõ rệt” và sử dụng tia laser Q-switched Nd: YAG 1064-nm với kích thước điểm 8 mm, 2,6 J/cm2. Lý do tôi sử dụng 2,6 J/cm2 là vì laser Q-switched Nd: YAG của tôi có năng lượng tối đa là 2,6 J/cm2 tại kích thước điểm 8 mm. Chỉ chiếu tia một lần và nếu điểm kết thúc lâm sàng không xảy ra, hãy giảm kích thước điểm xuống 7 mm và năng lượng tăng lên mức tối đa là 3,4 J/cm2. Sau đó, năng lượng được tăng lên bằng cách giảm kích thước điểm: kích thước điểm 6 mm, 4,6 J/cm2 → kích thước điểm 5 mm, 5,5 J/cm2 → kích thước điểm 5 mm, 6,6 J/cm2. Khi thấy được điểm kết thúc lâm sàng, toàn bộ hình xăm xăm được xử lý bằng năng lượng tương ứng. Trong lần điều trị tiếp theo, năng lượng tương tự được kiểm tra lại, và nếu không thể quan sát được điểm kết thúc lâm sàng, thì kích thước điểm sẽ giảm và năng lượng được tăng lên. Lý do của việc giảm dần kích thước điểm là vì có sự giới hạn về năng lượng có thể được nâng lên ở một kích thước điểm nhất định.
Mật độ năng lượng
Mục tiêu của điều trị bằng laser là tăng nhiệt độ một cách chọn lọc của một thể nhiễm sắc cụ thể và cuối cùng gây ra sự thay đổi nhiệt độ của mô đích.
Mối quan hệ giữa mật độ năng lượng và độ dài xung
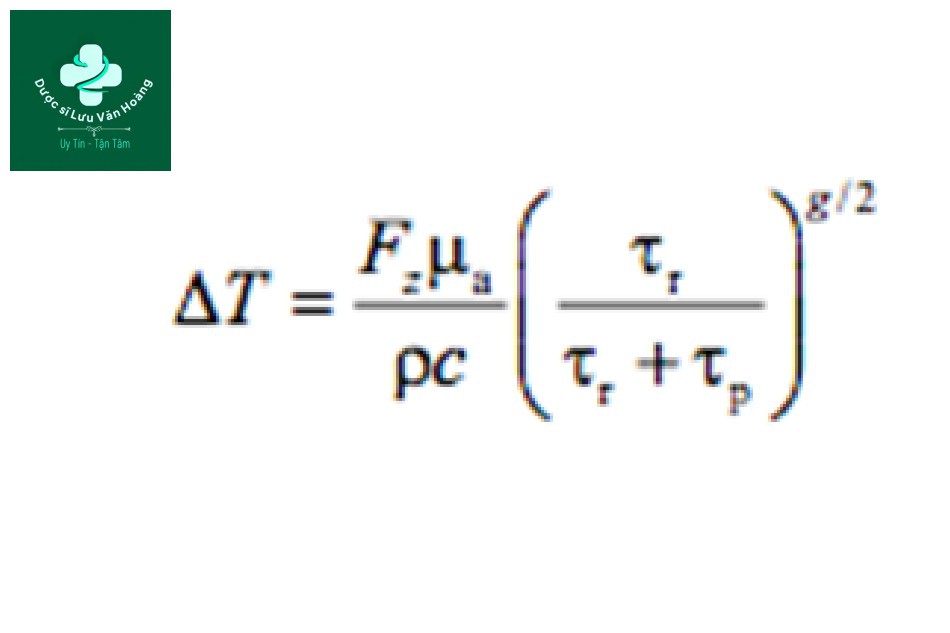
ΔT: biến đổi nhiệt độ của mục tiêu
µa: hệ số hấp thụ
Fz: mật độ năng lượng cục bộ dưới bề mặt
ρ: mật độ
c: nhiệt dung riêng
g: hệ số hình học (một cho mặt phẳng, hai cho hình trụ và ba cho hình cầu)
τp: độ dài xung laser
τr: thời gian giãn nhiệt của mục tiêu (TRT)
Phương trình trên áp dụng cho nhiệt độ. Từ phương trình trên, chúng ta có thể thấy rằng “chiếu xạ vùng sậm màu yếu, vùng sáng màu mạnh” được đề cập trước đây là đúng. Nói cách khác, nếu hệ số hấp thụ (µa) cao, thì phải chiếu tia mật độ năng lượng thấp (Fz) để đạt được mức tăng nhiệt độ của
mục tiêu mong muốn. Ngược lại, nếu hệ số hấp thụ thấp, thì phải chiếu tia mật độ năng lượng cao để đạt được mức tăng nhiệt độ của mục tiêu mong muốn.
Còn độ dài xung? Mối quan hệ giữa mật độ năng lượng và độ dài xung là gì? Phương trình trên cho thấy độ dài xung (τp). Tuy nhiên, vì nó là một phần của mẫu số dưới hàm số mũ, nên thoạt nhìn rất khó để biết được mối tương quan. Nhưng nếu đặt các con số vào phương trình, bạn có thể thấy rằng độ dài xung và nhiệt độ có liên quan nghịch với nhau. Ngược lại, mật độ năng lượng và độ dài xung tỷ lệ thuận với nhau nếu nhiệt độ như nhau.
Trafeli et al. đã sử dụng laser alexandrite xung dài 755 nm để đo mật độ năng lượng của các điểm kết thúc lâm sàng giống nhau, tức là cùng nhiệt độ, tùy thuộc vào độ dài xung [26]. Dựa trên kết quả và số liệu của bài báo này, có thể rút ra hai kết luận. Đầu tiên, độ dài xung và mật độ năng lượng tỷ lệ thuận với nhau. Nói cách khác, để thấy được hiệu quả tương tự, nên tăng mật độ năng lượng để tăng độ dài xung và giảm mật độ năng lượng để rút ngắn độ dài xung. Thứ hai, độ dài xung và mật độ năng lượng tỷ lệ thuận với nhau, nhưng không có sự khác biệt đáng kể về mật độ năng lượng. Do đó, nếu có một điểm kết thúc lâm sàng thích hợp với mật độ năng lượng cụ thể tại một độ dài xung nhất định, thì không cần phải điều chỉnh mật độ năng lượng cho dù độ dài xung giảm hay tăng. Tất nhiên, để thực hiện thủ thuật một cách an toàn, tốt hơn nên giảm bớt mật độ năng lượng khi giảm độ dài xung.
Làm mát biểu bì trong điều trị sắc tố biểu bì
Một điểm cần nhớ trong bài này là tốt hơn hết là không nên làm mát lớp biểu bì trong quá trình điều trị biểu bì.
Bảng 3.3 Giá trị giả thiết nếu giả sử nhiệt độ da bình thường là 35°C, chênh lệch nhiệt độ do làm mát biểu bì là -10°C và nhiệt độ mục tiêu là 75°C, và tích của mật độ năng lượng và hệ số hấp thụ là sự chênh lệch nhiệt độ (ΔT )
| Mật độ năng lượng | Mô đích (µa = 10) | Mô bình thường (µa = 1) |
| 5 J/cm2 (với DCD) | (5 × 10) + 35 − 10 = 75°C | (5 × 1) + 35 − 10 = 30°C |
| 4 J/cm2 (không DCD) | (4 × 10) + 35 = 75°C | (4 × 1) + 35 = 39°C |
(mật độ năng lượng × hệ số hấp thụ) + nhiệt độ bình thường – nhiệt độ làm mát = nhiệt độ cuối cùng
Bảng 3.3 là bảng được tính toán bằng cách thiết lập các giá trị ảo. Giả sử rằng nhiệt độ bình thường của da là 35°C, chênh lệch nhiệt độ do làm mát biểu bì là -10°C và nhiệt độ mục tiêu là 75°C, và tích của mật độ năng lượng và hệ số hấp thụ là sự chênh lệch nhiệt độ (ΔT), nhiệt độ cuối cùng là [(mật độ năng lượng × hệ số hấp thụ) + nhiệt độ thường – nhiệt độ làm mát = nhiệt độ cuối].
Làm mát biểu bì sẽ làm giảm nhiệt độ bằng cùng một sự chênh lệch nhiệt độ (ΔT) cho cả tổn thương sắc tố biểu bì và mô bình thường xung quanh. Các mô bình thường có nhiệt độ thấp hơn bình thường, do đó không có khả năng xảy ra tác dụng phụ, nhưng các tổn thương sắc tố cũng sẽ có nhiệt độ thấp và không thể thấy được hiệu quả mong muốn. Để thấy được hiệu quả, cần phải tăng mật độ năng lượng (5 J/cm2) khi làm mát biểu bì, để nhiệt độ của tổn thương sắc tố biểu bì cao hơn (75°C), và có hiệu quả mong muốn. Nhiệt độ của mô xung quanh thấp hơn nhiệt độ bình thường (30°C), dẫn đến an toàn. Mặt khác, khi không làm lạnh biểu bì, nhiệt độ của tổn thương sắc tố biểu bì giống như có làm mát biểu bì, nhưng nhiệt độ của mô xung quanh cao hơn trường hợp có làm mát biểu bì (39°C).
Do đó, mặc dù kết quả là như nhau, vì nhiệt độ của mô xung quanh giảm khi làm mát biểu bì và nhiệt độ của mô xung quanh tăng khi không làm mát biểu bì, nên việc làm mát biểu bì dường như là đáng mong đợi. Tuy nhiên, cả 30°C và 39°C đều không gây ra vấn đề cho da. Mật độ năng lượng là vấn đề còn hơn nhiệt độ. Trong Bảng 3.3, sự khác biệt về mật độ năng lượng dường như là nhỏ, nhưng nếu máy laser là công suất thấp không thể tăng mật độ năng lượng quá 4 J/cm2, thì độ dài xung phải được tăng lên để tạo ra 5 J/cm2. Và bởi vì độ dài xung không thể giảm, các mô nhỏ rất khó điều trị. Do đó, làm mát biểu bì không có ý nghĩa trong các tổn thương sắc tố biểu bì vì làm mát biểu bì có nhiều nhược điểm hơn là ưu điểm.
Phương trình Arrhenius
Khi photon của laser cuối cùng gặp được thể nhiễm sắc, nhiệt độ tăng lên. Như trong “Chương 2”, khi nhiệt độ tăng lên, các hiện tượng như plasma, sóng xung kích, bóng khí và phản lực xảy ra trong hiệu ứng quang cơ. Trong hiệu ứng quang nhiệt, xảy ra đông tụ, hóa hơi, cacbon hóa và nóng chảy. Trong số các hiện tượng này, phương trình Arrhenius được áp dụng dưới 100°C, không xảy ra hiện tượng hóa hơi. Tiếp theo, hãy xem xét công thức Arrhenius.
2N2O5 (g) → 4NO2 (g) + O2 (g)
Tốc độ phản ứng= k [N2O5]n
k: hằng số tốc độ.
Khi N2O2 được chuyển thành NO2 và O2, tốc độ thay đổi tỷ lệ với nồng độ của N2O2 và hằng số tốc độ (k). Nói cách khác, tốc độ thay đổi của một chất cao hơn ở nồng độ cao hơn. Một biến số khác với nồng độ của một chất được định nghĩa là một hằng số tốc độ (k). Hằng số tốc độ này không phụ thuộc vào nồng độ và các nhà vật lý nhận thấy rằng nó thay đổi theo nhiệt độ của vật liệu và chất xúc tác. Vì chúng tôi không sử dụng chất xúc tác [27], hãy tập trung vào nhiệt độ. Tính toán vật lý hằng số tốc độ, phương trình được biểu thị như sau:
K = Ae-Ea/RT
k: hằng số tốc độ của phản ứng
A: hằng số, phụ thuộc vào phản ứng
Ea: năng lượng hoạt hóa
R: hằng số mol khí
T: nhiệt độ
Vì phương trình trên rất khó hiểu khi được vẽ dưới dạng đồ thị, nên nó được biểu diễn bằng cách sử dụng hàm logarit và phương trình như “y = ax + b”. Công thức Arrhenius ban đầu là công thức xác định năng lượng hoạt hóa (E) tương ứng với hệ số góc (a) và hệ số tần số (A) tương ứng với giao điểm trục y (b) bằng cách đo các hằng số tốc độ theo hai nhiệt độ (Kích hoạt các yếu tố năng lượng và tần số được gọi là hằng số Arrhenius [19]).
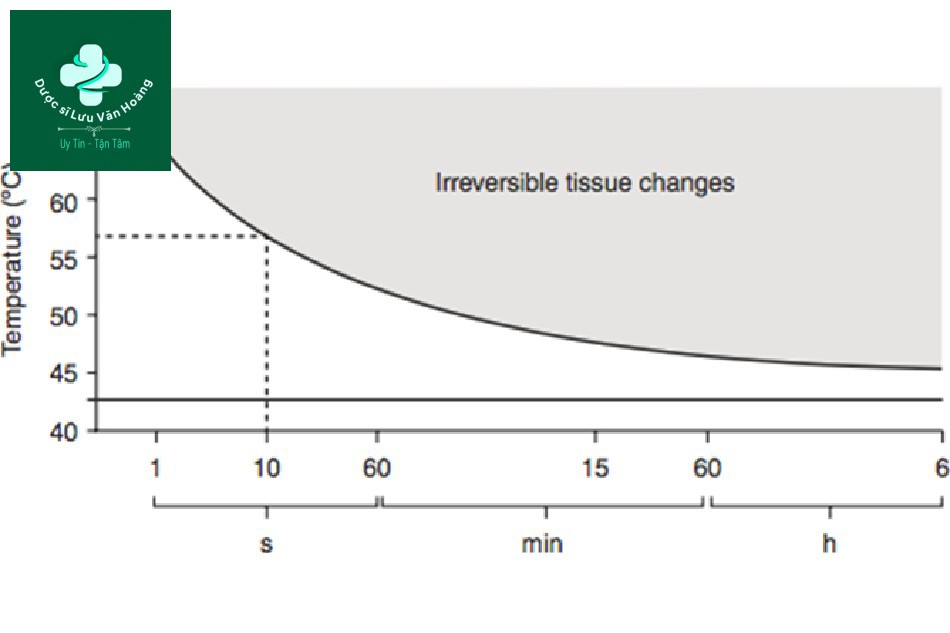
Hình 3.12 Ảnh hưởng của nhiệt độ và thời gian tiếp xúc đến sự phá hủy không thể phục hồi của các mô.
Tuy nhiên, vì chúng ta chỉ cần biết mối quan hệ giữa nhiệt độ và mô da, chúng ta có thể tóm tắt ý nghĩa của công thức Arrhenius như sau:
Thứ nhất, nhiệt độ càng cao, tốc độ phản ứng càng nhanh. Nói cách khác, vật liệu thay đổi nhanh ở nhiệt độ cao hơn. Ngược lại, vật liệu thay đổi chậm ở nhiệt độ thấp hơn. Thứ hai, có những cái được gọi là năng lượng hoạt hóa. Nói cách khác, nếu có một ngưỡng và ngưỡng này không bị vượt quá, thì sự thoái hóa mô không xảy ra. Chúng ta hãy xem xét kỹ hơn hai kết luận này.
Trước tiên, hãy tìm hiểu về nhiệt độ và thời gian. Hình 3.12 vẽ biểu đồ của công thức Arrhenius dưới dạng một hàm của nhiệt độ theo thời gian, không phải tốc độ. Để biến tính mô, không chỉ nhiệt độ mà thời gian cũng rất quan trọng. Ví dụ, sự thoái hóa mô xảy ra ở hơn 10 giây ở 57°C, nhưng không xảy ra ở 5 giây ở 57°C. Ngoài ra, sự thoái hóa mô xảy ra ở 1 giây ở 65°C nhưng không xảy ra ở 0,5 giây. Không có nhiệt độ tuyệt đối cho sự thoái hóa hoặc đông tụ của mô. Thời gian cũng như nhiệt độ phải được xem xét. Được biết, khi nhiệt độ giảm 5°C thì thời gian yêu cầu cần gấp mười lần [1].
Bởi vì nhiệt độ thay đổi theo thời gian, nhiệt độ tại đó sự thoái hóa mô xảy ra là 50– 70°C ở một số tài liệu và 57–65°C hoặc 60°C ở một số tài liệu khác [16, 29]. Để ngăn ngừa sự nhầm lẫn này, Pearce và Thomsen đã định nghĩa nhiệt độ tới hạn (Tcrit) là nhiệt độ mà 100% tổn hại xảy ra trong 1 giây [1]. Nhiệt độ tới hạn của mô người được biết là từ 60 đến 85°C tùy thuộc vào các mô.
Bảng 3.4 Hai phương pháp trẻ hóa không xâm lấn
| Phương pháp | Thời gian và nhiệt độ | Cửa sổ trị liệu | Hạn chế |
| A | Thời gian ngắn và nhiệt
độ cao |
Hẹp | Đau, tác dụng phụ |
| B | Thời gian dài và nhiệt độ
thấp |
Rộng | Thời gian thực
hiện dài |
Theo công thức Arrhenius, có hai phương pháp gây ra hiện tượng đông tụ (Bảng 3.4). Phương pháp thứ nhất sử dụng nhiệt độ cao trong thời gian ngắn (A), và phương pháp thứ hai là sử dụng nhiệt độ thấp trong thời gian dài (B). Cái nào tốt hơn? Điều này sẽ được giải thích chi tiết trong “Chương 9”.
HI+HI → H2 +I2
Thứ hai, năng lượng hoạt hóa là gì? Để HI và HI phản ứng và chuyển thành H2 và I2, cần một năng lượng nhất định (Hình 3.13). Sự thay đổi không diễn ra trừ khi năng lượng này bị vượt qua. Nói cách khác, năng lượng hoạt hóa là cần thiết để thay đổi chất phản ứng thành sản phẩm. Ngược lại, nếu không vượt quá năng lượng hoạt hóa, các chất phản ứng không có khả năng tạo ra sản phẩm. Nói cách khác, có một ngưỡng. Ví dụ, sự thoái hóa mô xảy ra ở 57°C trong hơn 10 s (Hình 3.12). Nhìn vào 45 và 55°C ở 10 giây, 55°C cao hơn 45°C, nhưng nó chưa vượt quá ngưỡng 57°C, vì vậy không có sự thay đổi ở cả 45 và 55°C. Nó có thể được coi là một hiện tượng tất cả hoặc không, nhưng hiện tượng này xảy ra do sự thoái hóa mô tiến triển nhanh chóng khi ngưỡng bị vượt qua do tính chất hàm mũ của nó [1].
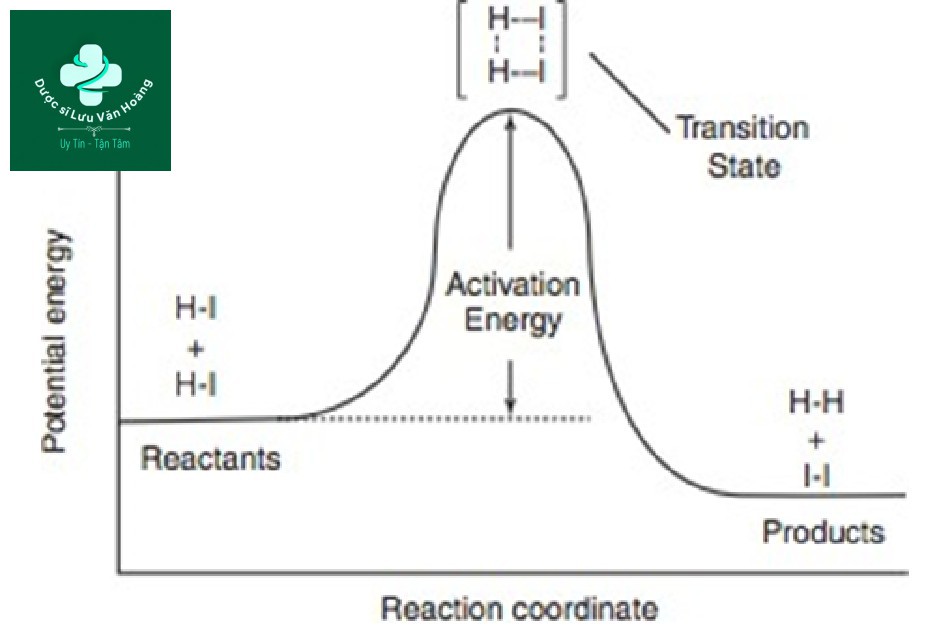
Hình 3.13 Biểu đồ thế năng để phân hủy HI
Một ví dụ cụ thể là, trong quá trình trẻ hóa không xâm lấn, bắn 100 tia mỗi tuần với kỹ thuật genesis sẽ không hiệu quả vì thời gian quy trình quá ngắn và nó không vượt quá ngưỡng. Thay vào đó, 10.000 tia trong một lần điều trị sẽ có hiệu quả vì nó vượt quá ngưỡng.
Tần số
Mô hình quang nhiệt học
Các mô hình quang nhiệt học đã được phát triển để xác định các thông số laser thích hợp [31]. Mô hình quang nhiệt học được chia thành ba giai đoạn theo thứ tự của các phản ứng mô do laser gây ra. Đầu tiên là giai đoạn quang học, nơi các photon được hấp thụ bởi mô đích. Để tia laser được mô đích hấp thụ có chọn lọc, cần chọn bước sóng có hệ số hấp thụ trong mô đích cao hơn so với mô xung quanh. Như vậy, giai đoạn quang học là giai đoạn chọn bước sóng. Bên cạnh đó, vì OPD được xác định theo bước sóng, độ sâu của mô đích cũng cần được xem xét ở giai đoạn này.
Thứ hai là giai đoạn nhiệt nơi các photon chuyển thành nhiệt. Để giảm thiểu thiệt hại cho mô xung quanh, giai đoạn nhiệt cần được xác định theo lý thuyết về quang nhiệt chọn lọc để mô đích không truyền nhiệt sang mô xung quanh. Như vậy, giai đoạn nhiệt là giai đoạn lựa chọn độ dài xung.
Thứ ba là quá trình biến tính mô. Khi nhiệt được tác động vào mô đích, các đặc tính quang học của mô sẽ thay đổi. Ví dụ, sau khi chiếu xạ IPL trên các đốm nâu, sự chuyển sậm màu sẽ được kiểm tra để xác định xem mật độ năng lượng có phù hợp hay không (điểm kết thúc lâm sàng). Giai đoạn này tương ứng với quá trình biến tính mô. Do đó, thứ tự lựa chọn các thông số laser như sau. Đầu tiên, chọn bước sóng. Tiếp theo, xác định độ dài xung. Cuối cùng, quan sát phản ứng của mô để kiểm soát mật độ năng lượng.
Bước sóng → độ dài xung → kích thước điểm → mật độ năng lượng.
Tôi nghĩ rằng kích thước điểm nên được thêm vào các thứ tự chọn ba thông số laser này. Kích thước điểm phải được thêm vào trước mật độ năng lượng. Khi thực hiện điều trị bằng laser, việc xác định kích thước điểm là điều cần thiết, đặc biệt là khi điều trị lớp bì, vì mật độ năng lượng thay đổi theo kích thước điểm (hiệu ứng kích thước điểm). Do đó, các thông số laser cần được xác định theo thứ tự bước sóng, độ dài xung, kích thước điểm và mật độ năng lượng.
Quá trình thoái hóa mô
Chúng ta hãy xem xét kỹ hơn quá trình thoái hóa mô. Quá trình thoái hóa mô xảy ra sau vài chục đến hàng trăm mili giây sau khi chiếu tia laser. Trong quá trình biến tính mô, hệ số hấp thụ của hầu hết các mô được tăng lên từ ba đến bốn lần. Ví dụ, sau khi chiếu xạ IPL trên đốm nâu, đốm nâu chuyển sang màu đen, có hệ số hấp thụ cao hơn đốm nâu ban đầu. Ngoài ra, điều trị mạch máu bằng laser Nd: YAG xung dài dẫn đến hình thành cục máu đông trong máu đỏ. Điều này cũng trông sậm màu hơn và hệ số hấp thụ được tăng lên.
Sau quá trình thoái hóa mô, hệ số hấp thụ của mô đích được tăng lên, đồng thời tăng tỷ lệ hệ số hấp thụ của mô đích với mô xung quanh. Do đó, mô đích có thể được điều trị một cách chọn lọc hơn. Ví dụ, một tia laser kết hợp, chiếu tia PDL 595 nm trước, tiếp theo là laser Nd: YAG 1064 nm, sử dụng nguyên tắc của quá trình thoái hóa mô [16]. Ngoài ra, có thể chiếu tia laser lặp lại ngay sau tia ban đầu (phương pháp chồng xung, lặp lại).
Chuỗi xung
Phương pháp xung lặp lại có thể được chia thành hai: chuỗi xung đồng nhất và chuỗi xung không đồng nhất [31]. Chuỗi xung đồng nhất là một phương pháp chiếu xạ xung với cùng độ dài xung và mật độ năng lượng giống nhau trong cùng một khoảng thời gian. Với phương pháp này, nhiệt độ tăng dần khi chiếu xạ xung lặp lại (Hình 3.14). Trong chuỗi xung không đồng nhất, xung đầu tiên là mạnh và xung tiếp theo là yếu để duy trì nhiệt độ không đổi trong tổng độ dài xung (Hình 3.15). Chuỗi xung không đồng nhất là lý tưởng, nhưng chúng đòi hỏi tính toán chính xác do đó máy laser phải được cài đặt trước, không phải do người vận hành điều chỉnh. Chúng tôi sẽ tập trung vào chuỗi xung đồng nhất mà người vận hành có thể kiểm soát.
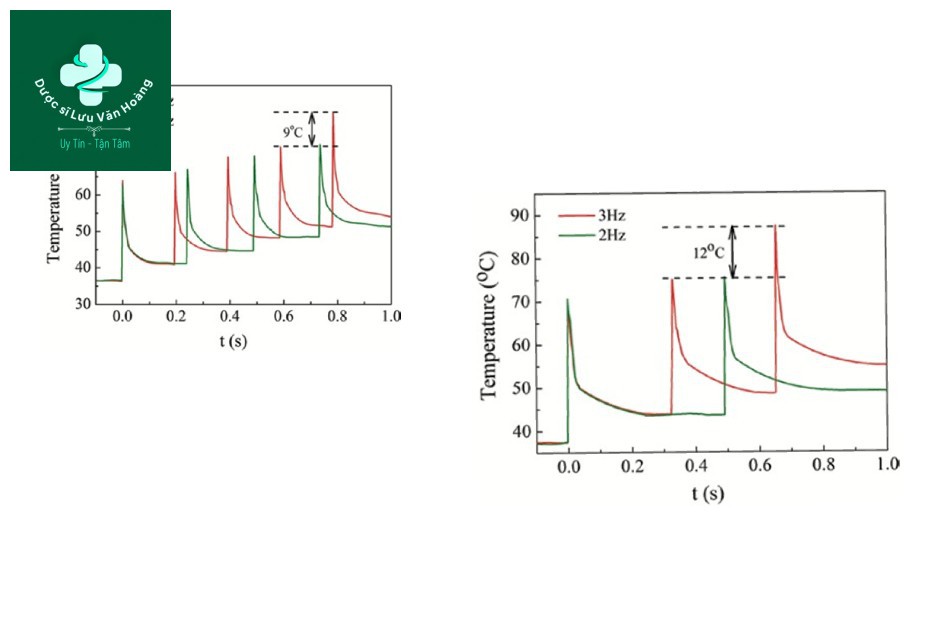
Jia et al. áp dụng chuỗi xung đồng nhất và chiếu xạ lặp lại laser Q-switched Nd: YAG 1064-nm trên ống thủy tinh mao dẫn có đường kính trong 1 mm và dày 0,1 mm để đo sự thay đổi nhiệt độ [32]. Các thông số là kích thước điểm 2 mm và độ dài xung 0,3 ms (genesis mode). Kết quả như sau. Khi nhiệt độ đông máu khoảng 73°C, nhiệt độ da vượt quá nhiệt độ đông máu khi chiếu tia bốn lần ở 30 J/cm2, 4 Hz, và nhiệt độ da vượt quá nhiệt độ đông máu khi chiếu tia hai lần ở 40 J/cm2, 2 Hz (Hình 3.16).
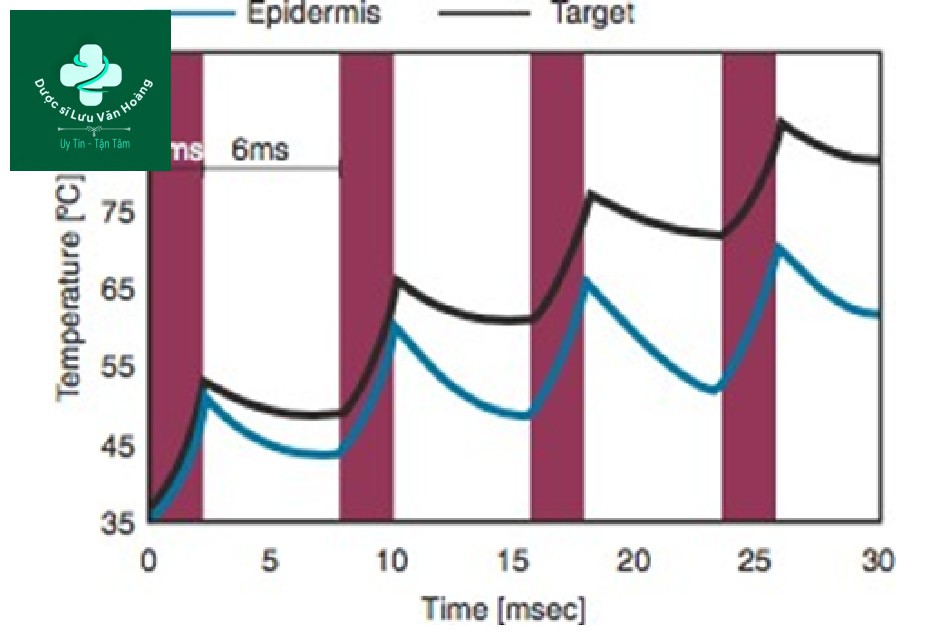
Hình 3.14 Sự thay đổi nhiệt độ của mô đích và biểu bì theo chuỗi xung đồng nhất.
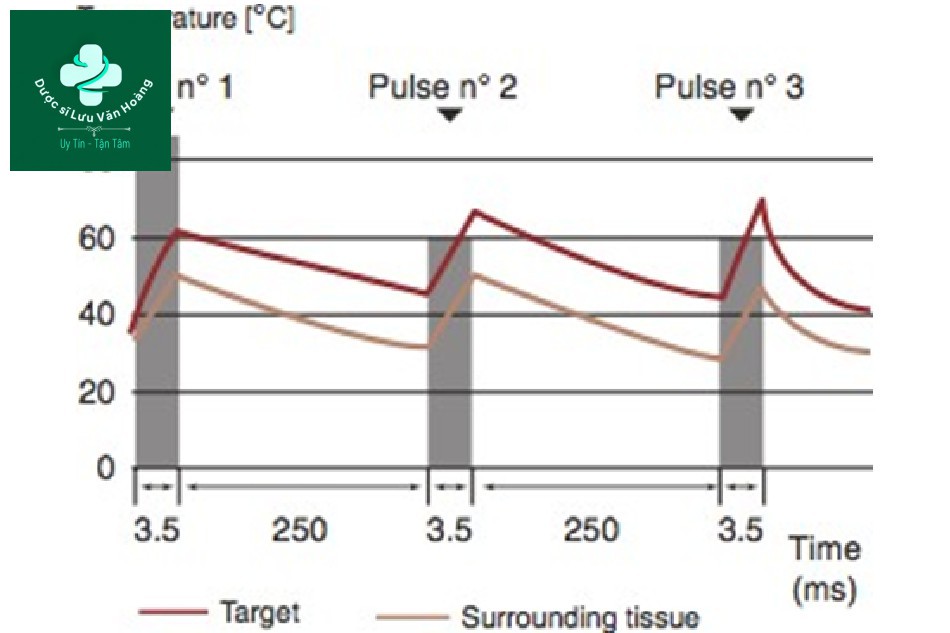
Hình 3.15 Thay đổi nhiệt độ ở các mô đích và xung quanh theo chuỗi xung không đồng đều.
Từ kết quả của bài báo này, có thể thấy rằng khi được chiếu tia nhiều lần với một chuỗi xung đồng nhất, sự tăng nhiệt độ thay đổi phụ thuộc vào ba thông số: mật độ năng lượng, tần số và số lượng xung.
Vậy làm thế nào chúng ta có thể thực sự điều chỉnh ba thông số này? Tiếp theo, hãy xem cách sử dụng quá trình thoái hóa mô trong điều trị mạch máu và cách điều chỉnh ba thông số.
Quá trình thoái hóa mô trong điều trị mạch máu
Quá trình thoái hóa mô có thể được sử dụng trong điều trị mạch máu không? Đầu tiên, hãy xem xét các hiện tượng trong mạch máu trong quá trình thoái hóa mô. Việc chiếu tia laser vào máu tạo ra MetHb và cục máu đông trong quá trình thoái hóa mô. Đặc biệt, đường cong hấp thụ của cục máu đông tăng lên trên đường cong hấp thụ của máu ban đầu. Có thể chiếu tia nhiều lần lên cục đông vì đường cong hấp thụ không dịch chuyển sang bên phải như metHb (dịch chuyển màu sắc hoặc dịch chuyển đỏ [14], xem “Chương 6”) mà tăng lên trên. Các phương pháp điển hình là phương pháp chồng xung nhiều lần PDL 585-nm tại cùng một điểm và phương pháp đa xung của IPL.
Hình 3.16 Đáp ứng nhiệt của mẫu máu trong 1 giây ở (a) 30 và (b) 40 J/cm2.
Tuy nhiên, cần thận trọng khi sử dụng laser Nd: YAG xung dài 1064 vì việc sử dụng phương pháp chồng xung có thể gây bỏng do hệ số hấp thụ tăng nhanh do sự xuất hiện của metHb.
Myhill et al. chiếu tia IPL nhiều lần trên da lợn sống và quan sát thấy sự thay đổi nhiệt độ da [33]. Một nhóm được chiếu lặp lại bức xạ 16 J/cm2 với khoảng nghỉ 8 s và nhóm còn lại với công suất 18 J/cm2 khoảng nghỉ 9 s. Lý do cho khoảng thời gian nghỉ 8 và 9 s này là để làm mát da hoàn toàn sau khi chiếu IPL và loại trừ tích tụ nhiệt do chiếu tia nhiều lần. Kết quả đo nhiệt độ cho thấy ngay cả sau khi chiếu tia nhiều lần, nhiệt độ ngay trước khi chiếu tia laser trở lại nhiệt độ ban đầu tương đối ổn định, nhưng nhiệt độ tối đa tăng dần khi chiếu tia nhiều lần. Lý do tại sao nhiệt độ tăng dần ngay cả khi IPL được chiếu xạ lặp lại với khoảng nghỉ 8-9 s, một khoảng thời gian tương đối dài, cho thấy rằng các yếu tố khác tồn tại ngoài MetHb và cục máu đông. Myhill et al. ước tính rằng hệ số hấp thụ tăng lên khi mạch máu giãn nở, lượng máu tăng và nồng độ hemoglobin tăng do tổn thương mạch máu dưới đông máu ở nhiệt độ thấp mà quá trình đông máu không thể xảy ra.
Tóm lại, có thể thấy rằng hệ số hấp thụ bị thay đổi do (1) MetHb, (2) cục máu đông, và
(3) lưu lượng máu tăng lên trong quá trình thoái hóa mô. Vậy nhiệt độ của mô thay đổi như thế nào khi hệ số hấp thụ thay đổi?
MetHb và cục máu đông được hình thành trong phương pháp xung lặp lại hoặc hệ số hấp thụ tăng khi lưu lượng máu tăng. Trong cùng một mật độ năng lượng, nhiệt độ tăngkhi hệ số hấp thụ tăng. Li et al. đo sự thay đổi nhiệt độ bằng cách chiếu xạ lặp lại tia laser Q-switch Nd: YAG 1064 nm với độ dài xung 0,3 ms trên ống mao dẫn chứa máu (Hình 3.17) [34]. Kết quả cho thấy trong quá trình chiếu tia lặp lại, nhiệt độ tăng liên tục nhưng nhiệt độ tăng nhanh hơn do quá trình thoái hóa mô sau khi hình thành cục máu đông.
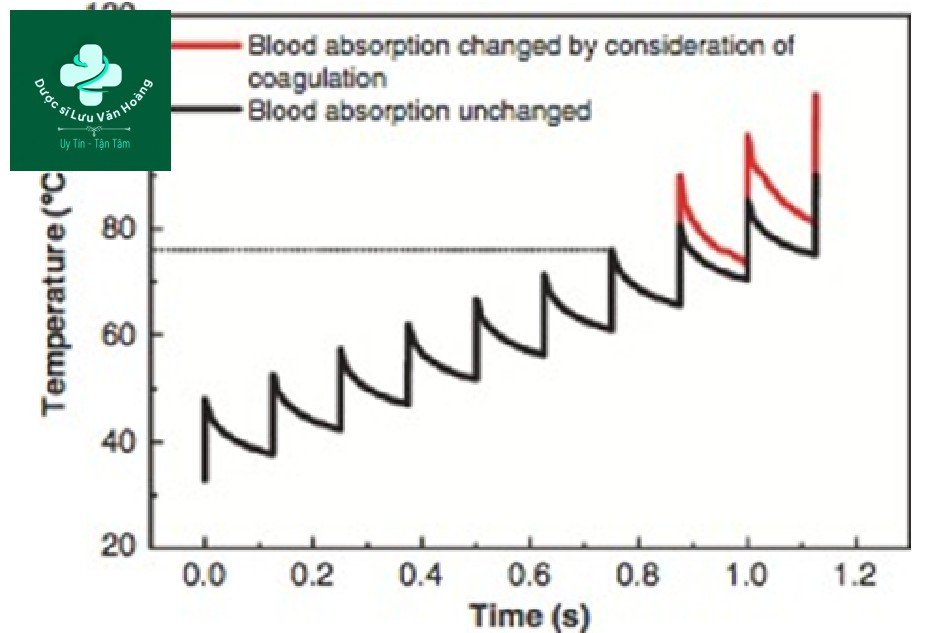
Hình 3.17 Sự thay đổi nhiệt độ trung bình của tàu mục tiêu với mật độ năng lượng là 53 J / cm2 và tần số xung là 8 Hz.
Việc chiếu tia lặp lại lên mạch máu ban đầu dẫn đến nhiệt độ tăng lên ổn định nhưng sau quá trình thoái hóa mô, nhiệt độ tăng lên nhanh chóng. Đặc biệt, vì MetHb làm tăng hệ số hấp thụ của nó lên ba lần, một laser hồng ngoại gần như laser Q-switched Nd: YAG 1064 nm chịu sự thay đổi nhiệt độ nhanh chóng trong quá trình thoái hóa mô so với laser mạch máu có bước sóng 500-600 nm. Hiện tượng này có thể được sử dụng cho phương pháp xung lặp lại, nhưng phải cẩn thận vì sự thay đổi nhiệt độ đột ngột có thể gây ra tác dụng phụ nếu nhiệt độ vượt qua ngưỡng gây tổn thương và tăng quá ngưỡng sống sót (xem trong “Chương 9”).
Phương pháp xung lặp lại
Tiếp theo, chúng ta sẽ xem xét cụ thể phương pháp xung lặp lại sử dụng cục máu đông và tăng lưu lượng máu.
Theo các bài báo của Jia et al. và Li et al., bằng cách sử dụng bước sóng 1064 nm và chiếu xạ lặp lại với độ dài xung 0,3 ms, nhiệt độ máu có thể được tăng dần. Thiết bị laser Q-Switch Nd:YAG 1064-nm của tôi không thể tăng năng lượng trên 100 J/cm2 với độ dài xung 0,3 ms, kích thước điểm 2 mm. Tôi tin rằng cần có mật độ năng lượng ít nhất 150 J/cm2, vì vậy tôi đã thử phương pháp xung lặp lại bằng cách sử dụng laser Nd: YAG xung dài thay vì laser Q-switch Nd: YAG. Hiện tại, các thông số tôi sử dụng là kích thước điểm 2 mm, 0,3 ms, 150 J/cm2, 3 Hz và 3–4 lần chiếu. Phương pháp này có thể được sử dụng để điều trị các mạch máu nhỏ có TRT dưới 5 ms, không hiệu quả bằng laser Nd:YAG xung dài thông thường. Vì các mạch máu có TRT từ 5 ms trở lên đã có thể được điều trị bằng laser Nd: YAG xung dài nên chúng không được đưa vào nhóm điều trị.
Tôi đặt tên cho phương pháp tăng dần nhiệt độ bằng cách chiếu tia lặp lại với chuỗi xung đồng nhất là “phương pháp xung lặp lại” để dễ hiểu hơn. Mặc dù tôi chưa có đủ trình độ về kỹ thuật này, tôi có thể điều trị không chỉ các mạch máu tương ứng với TRT từ 5 ms trở lên mà còn một số mạch máu có TRT từ 5 ms trở xuống bằng phương pháp xung lặp lại với laser Nd: YAG xung dài. Một ưu điểm khác là ban xuất huyết xảy ra ở PDL 585 nm không xảy ra trong phương pháp xung lặp lại bằng laser Nd: YAG xung dài.
Nhược điểm của phương pháp xung lặp lại sử dụng laser Nd: YAG xung dài như sau. Thứ nhất, bệnh nhân khó chịu do đau, và thứ hai, điểm kết thúc lâm sàng khó thấy do kích thước mạch máu nhỏ. Thứ ba, ngay cả khi số lượng xung là bốn hoặc năm, chỉ cần một
xung nữa là có thể bị bỏng. Thứ tư, thời gian thủ thuật lâu vì mạch máu cần phải chiếu tia từng cái một. Thứ năm, mặc dù tôi chưa thử, nhưng đỏ bừng mặt do các tĩnh mạch máu nhỏ không dễ dàng nhìn thấy bằng kính lúp, có khả năng không hiệu quả hoặc dễ gây tác dụng phụ.
Vậy phương pháp xung lặp lại chỉ áp dụng cho điều trị mạch máu? Không thể áp dụng phương pháp xung lặp lại để điều trị sắc tố? Điều này sẽ được giải thích chi tiết trong “Chương 7”
Chiến lược
Có ba chiến lược để tăng nhiệt độ một cách chọn lọc chỉ trong một khu vực về mặt không gian (Bảng 3.5) [14]. Đầu tiên, quang nhiệt có chọn lọc, thứ hai, làm mát biểu bì và thứ ba, quang nhiệt phân đoạn. Chúng ta hãy xem xét lần lượt ba chiến lược này.
Phương pháp đầu tiên là lý thuyết về quá trình quang nhiệt chọn lọc. Sự khác biệt về hệ số hấp thụ được sử dụng để tăng nhiệt độ của mô đích trong khi bảo vệ mô xung quanh.
Bảng 3.5 Chiến lược điều trị bằng laser
| Tăng nhiệt độ chọn lọc theo không gian | |
| 1 | Quang nhiệt chọn lọc
A.Hệ số hấp thụ (bước sóng), mật độ thể nhiễm sắc B. Độ dài xung (nhiệt động học chọn lọc) |
| 2 | Làm mát biểu bì |
| 3 | Quang nhiệt phân đoạn |
ΔT: độ tăng nhiệt độ của mục tiêu
µa: hệ số hấp thụ
Fz: mật độ năng lượng cục bộ dưới bề mặt
ρ: mật độ
c: nhiệt dung riêng
g: hệ số hình học (một cho mặt phẳng, hai cho hình trụ và ba cho hình cầu)
τp: độ dài xung laser
τr: thời gian giãn nhiệt của mục tiêu (TRT)
Các biến trong công thức này bao gồm mật độ năng lượng, hệ số hấp thụ, TRT, độ dài xung, hệ số hình học, mật độ và nhiệt dung riêng. Thoạt nhìn, bạn có thể nghĩ rằng việc điều trị có thể được thực hiện bằng cách điều chỉnh mật độ năng lượng hoặc độ dài xung, nhưng thực tế không phải vậy. Ví dụ, giả sử có một đốm nâu 5 mm và mô bình thường bao quanh đốm nâu. Nếu tia laser được chiếu với kích thước điểm 10 mm, tại điểm chiếu sẽ có sự thay đổi nhiệt độ của đốm nâu (ΔT ở đốm nâu) và sự thay đổi nhiệt độ của mô bình thường (ΔT ở mô bình thường). Không có sự khác biệt giữa mật độ năng lượng và độ dài xung trong cùng một vị trí. Sự khác biệt giữa hai mô là gì? Đầu tiên là hệ số hấp thụ và thứ hai là TRT. Nói cách khác, chỉ có đốm nâu mới có thể được điều trị chọn lọc bằng cách sử dụng chênh lệch hệ số hấp thụ melanin giữa đốm nâu và mô bình thường hoặc chênh lệch mật độ giữa đốm nâu và mô bình thường. Ngoài ra, nhiệt động học chọn lọc có thể được sử dụng để điều trị chọn lọc từng điểm một trong khi giảm tuần tự từ độ dài xung dài đến độ dài xung ngắn.
Phương pháp thứ hai là làm mát biểu bì. Ví dụ, trong triệt lông bằng laser, cả nhiệt độ của melanin biểu bì và lông lớp bì đều tăng lên. Khi làm mát biểu bì cưỡng bức làm giảm nhiệt độ biểu bì, nhiệt độ của lông lớp bì sẽ tăng lên một cách chọn lọc.
Phương pháp thứ ba là quang nhiệt phân đoạn. Phương pháp này là phương pháp xử lý chọn lọc chỉ một phần không gian từ lần chiếu xạ đầu tiên. Laser sử dụng quang nhiệt phân đoạn là laser phân đoạn sử dụng Er: Glass hoặc laser CO2. Nhưng liệu quá trình quang nhiệt phân đoạn chỉ có thể thực hiện được với laser phân đoạn? Phương pháp quang nhiệt phân đoạn không chỉ hiệu quả với laser phân đoạn đắt tiền mà còn với phương pháp pin-hole, bắn một lần 1 tia bằng tia laser CO2 thông thường.
Loại chiến lược nào nên được áp dụng trong từng tình huống? Đầu tiên, lý thuyết về quang nhiệt chọn lọc chủ yếu áp dụng cho các tình huống ngang. Phương pháp này được áp dụng khi mô đích và mô cạnh tranh
nằm theo chiều ngang. Ví dụ, phương pháp này được sử dụng để điều trị các sắc tố biểu bì như đốm nâu. Thứ hai, làm mát biểu bì được áp dụng trong các tình huống thẳng đứng. Ví dụ, nó được áp dụng khi điều trị các tổn thương lớp bì như liệu pháp mạch máu, triệt lông và trẻ hóa không xâm lấn. Phương pháp thứ ba có thể áp dụng cho mọi trường hợp.
Ngược lại, tình huống nào mà các phương pháp này có thể gây ra vấn đề? Đầu tiên, trong lý thuyết quang nhiệt chọn lọc, các vấn đề nảy sinh khi hệ số hấp thụ tương tự hoặc độ dài xung tương tự. Ví dụ, rất khó điều trị khi da nguyên thuỷ sậm màu do đó sự khác biệt về hệ số hấp thụ của da nguyên thuỷ và đốm nâu là không lớn. Ngược lại, việc điều trị gặp nhiều khó khăn khi đốm nâu nhẹ và vùng da nguyên thủy có màu sáng do đó sự khác biệt về hệ số hấp thụ của da nguyên thuỷ và đốm nâu không lớn. Thứ hai, trong việc làm mát biểu bì, các vấn đề có thể phát sinh nếu làm mát biểu bì kém. Bác sĩ dung laser phải luôn kiểm tra máy làm mát. Thứ ba, trong quang nhiệt phân đoạn, các vấn đề nảy sinh khi tia laser phân đoạn quá dày đặc. Trong trường hợp này, việc tái tạo từ mô bình thường tới mô được chiếu xạ phân đoạn không dễ dàng và có thể gây ra tác dụng phụ.
Tài liệu tham khảo
- Goldman MP (2006) Cutaneous and cosmetic laser surgery. Mosby Elsevier, Philadelphia, PA
- Goldman MP (2013) Lasers and energy devices for the skin. Taylor & [S.I]
- Allemann IB, Goldberg DJ (2011) Basics in dermatological laser Karger Medical and Scienti c Publishers
- Altshuler GB, Anderson RR, Manstein D, Zenzie HH, Smirnov MZ (2001) Extended theory of selective photothermolysis. Lasers Surg Med 29(5):416–432
- Watanabe S (2008) Basics of laser application to Arch Dermatol Res 300(Suppl 1):S21–S30
- Se YJ, Sung EC, Bak H, Choi JH, Kim I-H (2008) New melasma treatment by collimated low fluence Q-switched Nd: YAG laser. Korean J Dermatol 46(9):1163– 1170
- Kim JH, Kim H, Park HC, Kim IH (2010) Subcellular selective photothermolysis of melanosomes in adult zebrafish skin following 1064-nm Q-switched Nd:YAG laser J Invest Dermatol 130(9):2333–2335
- Kim JH, Jeong SY, Shin JB, Park H, Kim IH (2008) Subcellular selective photothermolysis in zebrafish: an electron microscopic evidence after Q-switched Nd:YAG laser ablation. Korean J Dermatol 46(20):187
- Anderson RR, Parrish JA (1983) Selective photother- molysis: precise microsurgery by selective absorption of pulsed Science 220(4596):524–527
- Jacques SL (1998) Melanosome absorption Oregon Medical Laser Center; 7
- Stratigos A, Dover JS (2000) Overview of lasers and their properties. Dermatol Ther 13(1):2–16
- Anderson RR, Parrish JA (1981) The optics of human J Investig Dermatol 77(1):13–19
- Lee W (2008) Principles of IPL and its uses (Korean). Seoul, MDworld
- Keyvan N (2012) Lasers in dermatology and Springer-Verlag, London
- James WD, Elston D, Berger T (2011) Andrew’s diseases of the skin E-book: clinical Elsevier Health Sciences
- Raulin C, Karsai S (2011) Laser and IPL technology in dermatology and aesthetic Heidelberg, New York
- Niemz M (2019) Laser-tissue interactions. Springer International Publishing
- (2000) Laryngoscope 110(S95):31–37
- Niemz MH (2007) Laser-tissue Springer, New York
- Kauvar A, Hruza G (2005) Principles and practices in cutaneous laser surgery. CRC Press
- Kang WH (2013) Treatment strateties for pigmentation disorders in skin (Korean). Hansol Medical, Seoul
- Ross EV, Ladin Z, Kreindel M, Dierickx C (1999) Theoretical considerations in laser hair removal. Dermatol Clin 17(2):333–355. viii
- Gold MH (2007) Lasers and light sources for the removal of unwanted Clin Dermatol 25(5):443–453
- Lee JH, Park SR, Jo JH, Park SY, Seo YK, Kim SM (2014) Comparison of epidermal/dermal damage between the long- pulsed 1064 nm Nd:YAG and 755 nm alexandrite lasers under relatively high fluence conditions: quantitative and histological Photomed Laser Surg 32(7):386–393
- Lee C, Bae E, Park J, Lim S (2009) Permanent makeup removal using Q- switched Nd: YAG Clin Exp Dermatol 34(8):e594–e5e6
- Trafeli JP, Kwan JM, Meehan KJ, Domankevitz Y, Gilbert S, Malomo K et al (2007) Use of a long-pulse alexandrite laser in the treatment of superficial pigmented Dermatol Surg 33(12):1477–1482
- Lee JS (2011) Deep chemistry (Korean). Korea foundation for the advancement of science & creativity, Seoul
- Berlien H-P (2003) Applied laser medicine. Springer Science & Business Media
- Ortiz AE, Goldman MP, Fitzpatrick RE (2014) Ablative CO2 lasers for skin tightening: traditional versus Dermatol Surg 40(Suppl 12):S147–S151
- Hoenig S (2001) Basic training in Springer Science & Business Media
- Mordon S, Brisot D, Fournier N (2003) Using a “non uniform pulse sequence” can improve selective coagulation with a Nd:YAG laser (1.06 microm) thanks to Met- hemoglobin absorption: a clinical study on blue leg veins. Lasers Surg Med 32(2):160– 170
- Jia H, Chen B, Li D (2017) Dynamic optical absorption characteristics of blood after slow and fast heating. Lasers Med Sci 32(3):513– 525
- Myhill J, Bäumler W, Hennings L, Bearden ED, Buckmiller LM, Sha rstein G (2008) The interaction of broadband intense pulsed light (IPL) and skin during a multi-pulse Med Laser Appl 23(2):71–78
- Li D, Li R, Jia H, Chen B, Wu W, Ying Z (2017) Experimental and numerical investigation on the transient vascular thermal response to multi-pulse Nd:YAG Lasers Surg Med 49(9):852–865.

 Antibio Pro
Antibio Pro