Y tế - Sức Khỏe
Chapter 14. TIẾP CẬN LÂM SÀNG SHOCK – Ths. Bs HỒ HOÀNG KIM – EDICU – BV NGUYỄN TRI PHƯƠNG
Một trong những đặc điểm dễ nhận biết của tình trạng lâm sàng được gọi là “sốc” là tên của nó, không có bất kỳ giá trị khoa học hoặc bệnh lý nào, và được chia sẻ bởi các thực thể phi lâm sàng xa xôi như các hoạt động quân sự (“sốc và kinh hoàng”). Việc sử dụng thuật ngữ này trong lâm sàng có thể bắt nguồn từ năm 1731, khi một bác sĩ phẫu thuật người Pháp tên là Henri LeDran công bố kinh nghiệm của mình với các vết thương do súng bắn và sử dụng thuật ngữ “chock” để mô tả các vết thương thường dẫn đến tử vong (1). Trong bản dịch tiếng Anh luận văn sau đó của LeDran, “sốc” đã bị dịch sai thành chỉ quá trình lâm sàng của các vết thương thay vì chính các vết thương. Sau đó, “sốc lâm sàng” trở thành từ đồng nghĩa với tình trạng đe dọa tính mạng và xấu đi nhanh chóng. Tuy nhiên, sốc là hậu quả của nhiều thực thể bệnh lý và việc tìm ra điểm chung có thể là một thách thức.
Chương này là chương đầu tiên trong một loạt các chương dành riêng cho sốc lâm sàng và cố gắng trình bày một quan điểm thống nhất về sốc, bao gồm sốc là gì, cách phân loại, cách biểu hiện và cách xử lý. Tiếp theo là ba chương dành riêng cho các hội chứng sốc chính: tức là sốc giảm thể tích, sốc tim và sốc nhiễm trùng. Nói một cách đơn giản, đây là những tình trạng khó khăn nhất mà bạn sẽ gặp phải trong ICU.
SHOCK LÂM SÀNG LÀ GÌ?
Định nghĩa về sốc lâm sàng đã có nhiều lần lặp lại, bao gồm cả mô tả đầy màu sắc trong trích dẫn mở đầu của Samuel Gross, một trong những người khổng lồ của ngành phẫu thuật vào thế kỷ 19, người đã đưa mô tả về sốc này vào sách giáo khoa phổ biến của mình (a). Một định nghĩa cập nhật và cải tiến về sốc sẽ nêu rằng sốc là một rối loạn tuần hoàn đe dọa tính mạng được đặc trưng bởi việc sử dụng oxy của tế bào không đầy đủ (2). Sốc có thể là kết quả của việc oxy hóa mô không đủ hoặc quá trình xử lý oxy không đầy đủ của ty thể, nhưng kết quả là như nhau; tức là có sự thiếu hụt trong sản xuất ATP oxy hóa. Hậu quả lâm sàng của sự rối loạn này là rối loạn chức năng ở một hoặc nhiều cơ quan quan trọng, có thể tiến triển thành suy đa cơ quan và tử vong.
Các đặc điểm lâm sàng
Biểu hiện lâm sàng của sốc thường bao gồm các triệu chứng sau:
- Giảm huyết áp, thường dẫn đến hạ huyết áp, được định nghĩa là huyết áp tâm thu <90 mm Hg hoặc huyết áp trung bình <70 mm Hg (2). (Xem phần tiếp theo để biết thêm về hạ huyết áp trong sốc lâm sàng.)
- Tăng nồng độ lactat huyết tương (>2 mmol/L), được coi là bằng chứng về tình trạng suy giảm sử dụng O2 của tế bào (mặc dù có những giải thích khác, như được mô tả trong Chương 9)
- Các dấu hiệu lâm sàng của rối loạn chức năng cơ quan, thường bắt đầu là thiểu niệu (lượng nước tiểu <0,5 mL/kg mỗi giờ) và thay đổi tinh thần – tri giác (ví dụ, kích động, lú lẫn hoặc suy giảm ý thức), và có thể tiến triển liên quan đến bất kỳ và tất cả các cơ quan chính.
- Trong trường hợp “sốc lưu lượng thấp: low-flow shock”, da có thể mát lạnh khi chạm vào và có thể có những thay đổi tím tái ở các chi xa. Sự tiến triển của tình trạng lưu lượng thấp có thể gây ra chứng xanh tím không đều được gọi là “da lốm đốm” hoặc bệnh mạng lưới livedo.
Hạ Huyết áp
Hạ huyết áp là một trong những tiêu chuẩn lâm sàng để chẩn đoán sốc lâm sàng, nhưng độ tin cậy của hạ huyết áp như một dấu hiệu của sốc lâm sàng vẫn còn đang nghi ngờ. Ví dụ, các nghiên cứu lâm sàng đã chỉ ra rằng huyết áp có thể bình thường khi có bằng chứng về tình trạng oxy hóa mô không đủ (sử dụng nồng độ lactat hoặc độ bão hòa O2 tĩnh mạch trung tâm) (3). Hơn nữa (như bất kỳ ai đã dành thời gian trong ICU có thể xác minh), hạ huyết áp không phải lúc nào cũng đi kèm với bằng chứng về việc sử dụng O2 không đủ trong các mô. Do những quan sát như thế này, “một số hướng dẫn đồng thuận đã khuyến nghị rằng hạ huyết áp nên bị loại bỏ như một dấu hiệu của sốc lâm sàng” (4).
Các loại SỐC lâm sàng
Có 4 loại sốc khác nhau (hội chứng sốc) và chúng có thể được xác định bằng cách sử dụng các mối quan hệ thủy lực sau: tức là, dòng chảy ổn định (Q) qua một mạch thủy lực kín có liên quan trực tiếp đến độ chênh áp suất (áp suất đẩy tạo ra dòng chảy) trên toàn mạch (Pin – Pout) và liên quan nghịch với sức cản dòng chảy (R) qua mạch.
Q = (Pin – Pout)/R (14.1)
Nếu mạch thủy lực này là hệ thống tuần hoàn, thì dòng chảy là lưu lượng tim (CO), áp suất dòng chảy vào là áp suất động mạch trung bình (MAP), áp suất dòng chảy ra là áp suất tâm nhĩ phải (RAP) và sức cản dòng chảy là sức cản mạch máu toàn thân (SVR). Phương trình 14.1 hiện được biểu thị lại như sau:
CO = (MAP – RAP)/SVR (14.2)
Vì huyết áp giảm là tình trạng thường gặp trong sốc, nên các thuật ngữ trong phương trình trên có thể được sắp xếp lại để xác định các yếu tố quyết định huyết áp động mạch trung bình (là áp lực thúc đẩy lưu lượng máu):
MAP = (CO X SVR) + RAP (14.3)
Sau đó, các hội chứng sốc khác nhau được xác định bằng các yếu tố quyết định MAP: tức là,
- RAP thấp = sốc giảm thể tích máu
- CO thấp = sốc tim, sốc tắc nghẽn
- SVR thấp = sốc giãn mạch
Dạng thay đổi huyết động ở từng loại sốc được thể hiện trong Bảng 14.1, cùng với tỷ lệ mắc bệnh đã báo cáo của từng loại (2). Lưu ý rằng 3 trong số 4 hội chứng sốc có liên quan đến lưu lượng tim thấp và SVR cao. Sự gia tăng SVR (tức là co mạch) là phản ứng bù trừ cho trạng thái lưu lượng thấp và hạn chế sự sụt giảm huyết áp. Phản ứng này là do hoạt động tăng lên của hệ thần kinh giao cảm và kích hoạt hệ thống renin-angiotensin-aldosterone.
| BẢNG 14.1 Các mô hình huyết động trong hội chứng sốc | |||
| Các hội chứng sốcf | CVP | Cung lượng tim | SVR |
| Giảm thể tích (16%) | Thấp | Thấp | Cao |
| Tắc nghẽn (2%) | Thấp | Thấp | Cao |
| Sốc tim (16%) | Cao | Thấp | Cao |
| Sốc dãn mạch (66%) | Thấp | Bình thường hoặc Cao | Thấp |
| Các số trong ngoặc đơn | biểu thị tần suất xảy ra tương đối (từ Tài liệu tham khảo 2). CVP = áp lực tĩnh | ||
mạch trung tâm, SVR = sức cản mạch máu toàn thân.
Sốc giảm thể tích
Sốc giảm thể tích máu hầu như luôn là kết quả của mất máu, và thường xuất hiện khi lượng máu giảm vượt quá 30% (5). Mất nước (ví dụ, do nôn mửa hoặc tiêu chảy) thường không dẫn đến sốc vì mất nước dẫn đến tăng áp suất thẩm thấu keo của huyết tương, làm kéo dịch kẽ vào khoang mạch máu. Giảm huyết áp do mất nước dễ dàng được điều chỉnh bằng dịch truyền tĩnh mạch.
Sốc do tim
Sốc do suy bơm tim thường là kết quả của hội chứng vành cấp, chiếm gần một nửa số trường hợp sốc tim (6). Các nguyên nhân ít gặp hơn bao gồm bệnh cơ tim không do thiếu máu cục bộ (28% trường hợp) và rối loạn chức năng van tim hoặc loạn nhịp tim (17% trường hợp). Sốc tim là thách thức lớn nhất trong việc xử trí sốc; tức là, mặc dù có những tiến bộ trong tái thông mạch máu và hỗ trợ tim cơ học, tỷ lệ tử vong vẫn ở mức khoảng 50% (7).
Sốc tắc nghẽn
Sốc tắc nghẽn là do các tình trạng cản trở hoặc chặn quá trình đổ đầy các buồng tim, chẳng hạn như thuyên tắc phổi lớn, tràn khí màng phổi có áp lực và chèn ép tim. Tình trạng này không phổ biến và chỉ chiếm 2% các trường hợp sốc lâm sàng (2). Điều trị hướng đến tình trạng nền gây ra.
Sốc dãn mạch
Sốc giãn mạch (còn được gọi là “sốc phân phối”) là tình trạng giãn mạch lan rộng liên quan đến cả động mạch và tĩnh mạch. Đây là loại sốc thường gặp nhất (xem Bảng 14.1) và sốc nhiễm trùng chiếm phần lớn các trường hợp. Sốc nhiễm trùng là nguyên nhân hàng đầu gây tử vong trong bệnh viện tại Hoa Kỳ (8) và cũng được coi là nguyên nhân tử vong hàng đầu trên toàn thế giới (9). Các nguồn sốc giãn mạch ít phổ biến hơn bao gồm sốc phản vệ, choáng tủy và cơn thượng thận cấp.
THEO DÕI HUYẾT ÁP
Theo dõi huyết áp là bắt buộc trong trường hợp sốc lâm sàng và nên ghi trực tiếp huyết áp động mạch.
Các phương pháp đo trực tiếp
Bản ghi áp suất động mạch trực tiếp được lấy từ động mạch quay, cánh tay, nách hoặc đùi và vị trí đặt catheter có thể ảnh hưởng đến dạng sóng được ghi lại (xem tiếp).
Sóng huyết áp động mạch
Dạng sóng áp suất động mạch thay đổi khi di chuyển ra xa động mạch chủ gần, như thể hiện trong Hình 14.1. Lưu ý rằng khi sóng áp suất di chuyển về phía ngoại vi, áp suất tâm thu tăng dần và phần tâm thu của dạng sóng thu hẹp lại. Áp suất tâm thu có thể tăng tới 20 mm Hg từ động mạch chủ gần đến động mạch quay hoặc động mạch đùi (10). Sự gia tăng áp suất tâm thu đỉnh này được bù đắp bằng sự thu hẹp của sóng áp suất tâm thu, do đó áp suất động mạch trung bình vẫn không đổi.
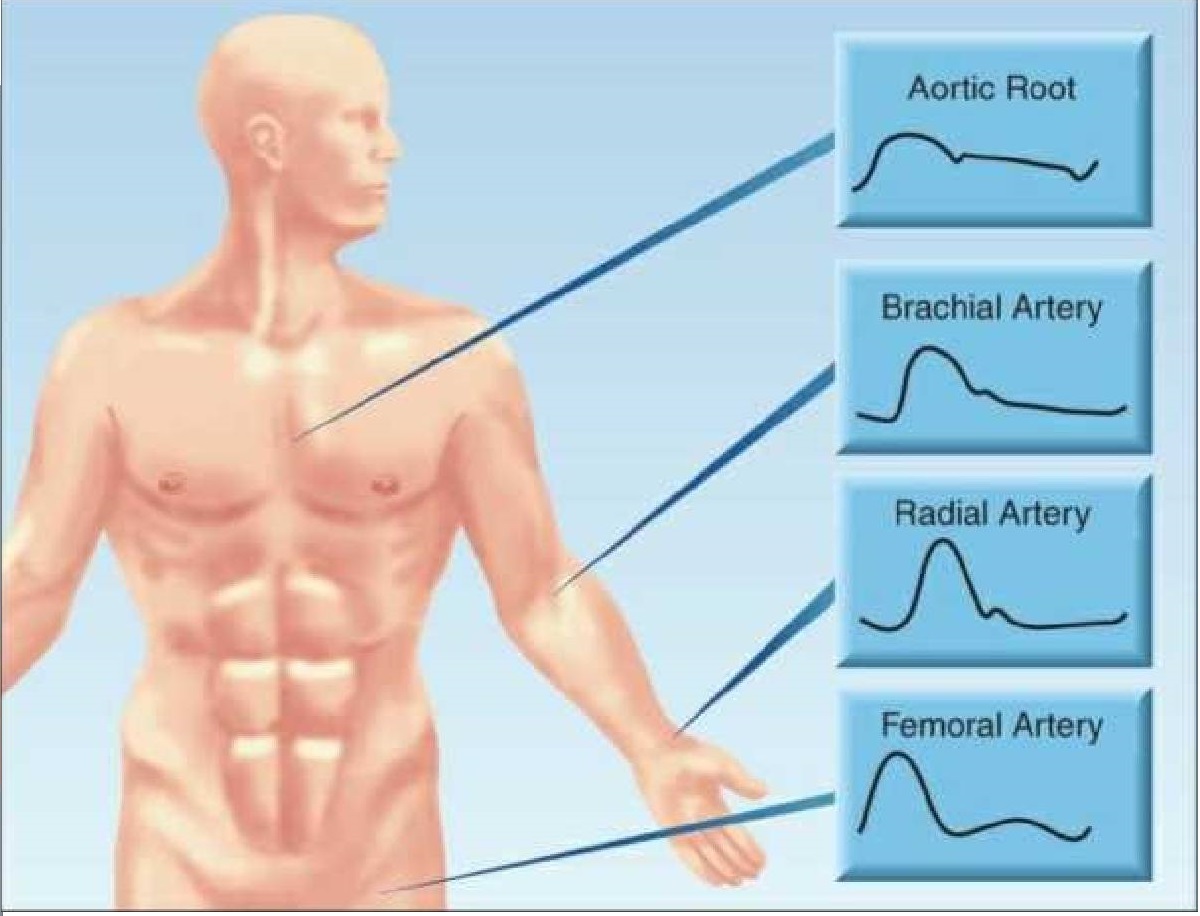
Sự khuếch đại sóng tâm thu
Sự gia tăng huyết áp tâm thu ở động mạch ngoại vi là kết quả của sóng áp suất phản xạ trở lại từ các nhánh mạch máu và các mạch máu hẹp (11). Sóng phản xạ di chuyển nhanh hơn khi động mạch cứng và chúng đạt đến dạng sóng áp suất động mạch trước khi nó có thời gian giảm. Sự hội tụ của sóng áp suất thuận và nghịch sau đó có tác dụng làm tăng đỉnh của dạng sóng áp suất. (Bạn có thể thấy hiệu ứng này khi sóng biển gặp nhau từ hướng ngược nhau. Hiệu ứng phóng đại này có liên quan đến sự hình thành của “sóng quái vật”.) Vì khuếch đại tâm thu là kết quả của sóng áp suất nghịch, nó làm tăng hậu tải thất trái, nhưng không thúc đẩy lưu lượng máu toàn thân.
Huyết áp động mạch trung bình – MAP
Áp suất động mạch trung bình (MAP) là áp suất được ưa chuộng để theo dõi huyết động vì hai lý do: đây là lực đẩy chính thúc đẩy lưu lượng máu toàn thân (10,12) và không thay đổi khi dạng sóng áp suất di chuyển ngoại vi (không giống như áp suất tâm thu). MAP được đo bằng thuật toán điện tử dưới dạng diện tích dưới sóng áp suất động mạch, chia cho thời gian của chu kỳ tim. Việc quản lý sốc lâm sàng sử dụng mục tiêu MAP > 65 mm Hg (2).
Cách đo gián tiếp
Việc ghi lại huyết áp trực tiếp không phải lúc nào cũng có sẵn hoặc khả thi, do đó cần có mô tả ngắn gọn về phép đo huyết áp gián tiếp.
Nguyên lý
Đo huyết áp gián tiếp (HA) sử dụng một túi bơm hơi (gắn vào bên dưới của ống vải) được quấn quanh cánh tay trên hoặc đùi ở vùng nằm trên động mạch chính. Sau đó, túi trong ống vải được bơm hơi để nén động mạch bên dưới. Các tác động của lực nén động mạch được minh họa trong Hình 14.2. Khi áp suất cuff tăng lên và động mạch bên dưới bị nén, các xung động trong động mạch tăng dần rồi giảm dần cho đến khi động mạch bị tắc nghẽn. Các “phản xung động” này tạo ra các dao động áp suất trong túi và các thiết bị đo huyết áp tự động (là tiêu chuẩn trong các khoa ICU) sau đó đo các dao động này và chuyển đổi chúng thành các phép đo áp suất tâm thu, tâm trương và trung bình. Đây là phương pháp đo dao động để đo HA. Các phản xung động cũng có thể được chuyển đổi thành sóng âm, đây là cơ sở cho phương pháp nghe tim cũ hơn để đo HA.
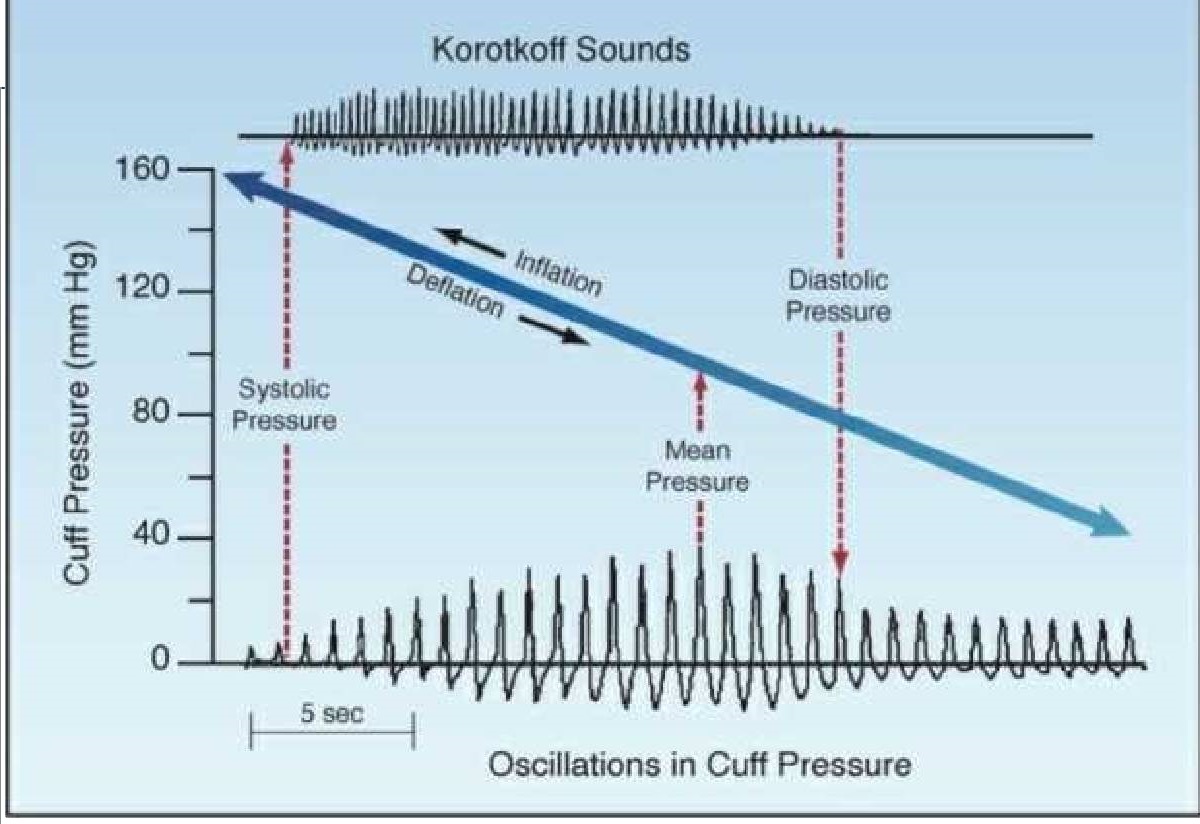
Các lỗi thông thường
Phản xung có thể tái tạo được nhiều hơn và các phép đo HA đáng tin cậy hơn khi động mạch bị nén đồng đều. Nén đồng đều có nhiều khả năng xảy ra hơn nếu kích thước của túi hơi phù hợp với chu vi của cánh tay trên. Mối quan hệ tối ưu giữa chiều cao và chiều rộng của túi hơi vòng bít và chu vi cánh tay trên được thể hiện trong Hình 14.3. Sau đây là một số điểm quan trọng về mối quan hệ giữa kích thước túi hơi và kích thước cánh tay:
- Để tạo ra sự tắc nghẽn động mạch đồng đều, chiều dài của túi hơi phải bằng ít nhất 80% chu vi của cánh tay trên (đo ở giữa vai và khuỷu tay) và chiều rộng của túi phải bằng ít nhất 40% chu vi cánh tay trên (13).
- Nếu túi hơi quá nhỏ so với kích thước của cánh tay trên, các phép đo áp suất sẽ bị cao giả tạo (1). (Các lỗi đo lường ít rõ rệt hơn nhiều khi túi quá lớn so với chu vi cánh tay.)
- Việc sử dụng túi hơi cánh tay có kích thước không phù hợp là nguồn lỗi phổ biến nhất trong các phép đo HA gián tiếp (13,14). Trong một nghiên cứu liên quan đến bệnh nhân ICU, hai phần ba số phép đo HA gián tiếp được thực hiện bằng kích thước vòng bít không phù hợp và trong những trường hợp này, 62% số phép đo HA khác với các phép đo trực tiếp, trong động mạch hơn 10 mm Hg (14).
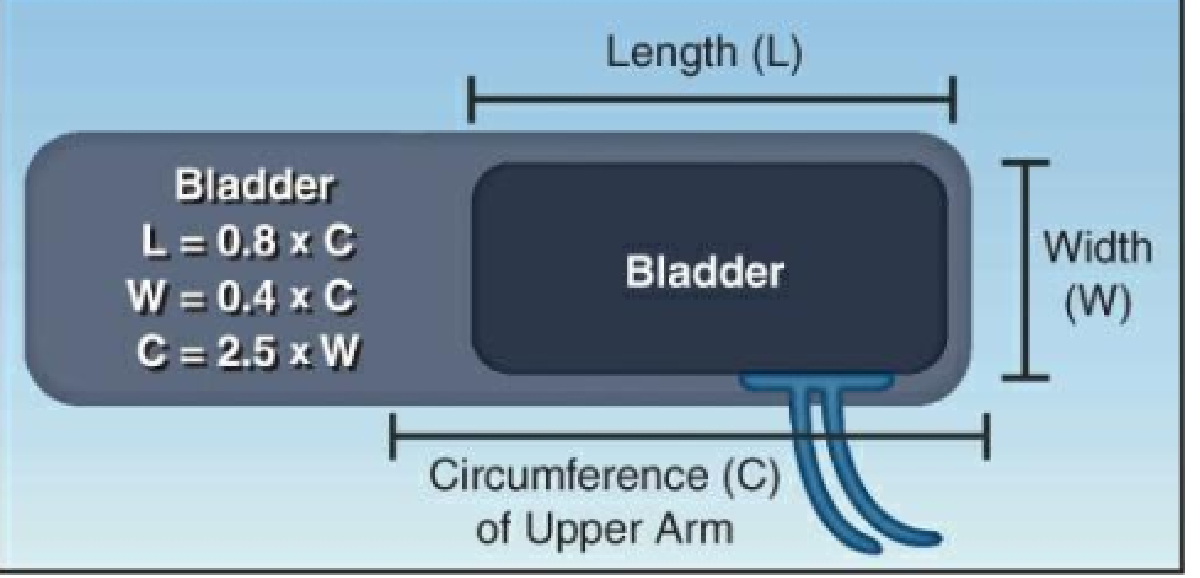
Để giúp lựa chọn kích thước vòng bít phù hợp, Bảng 14.2 trình bày kích thước vòng bít được khuyến nghị cho các kích thước khác nhau của cánh tay trên (hoặc đùi). Một cách dễ dàng hơn để xác định kích thước vòng bít phù hợp được mô tả tiếp theo.
| BẢNG 14.2 Kích thước cuff đo huyết áp phù hợp với chu vi cánh tay trên | ||
| Vòng chu vi cánh tay trên | Cuff đo huyết áp | |
| Kích cỡ | Kích thước | |
| 22 to 26 cm | Người lớn nhỏ | 12 x 24 cm |
| 27 to 34 cm | Người lớn | 16 x 30 cm |
| 35 to 44 cm | Người lớn to | 16 x 36 cm |
| 45 to 52 cm | Đùi người lớn | 16 x 42 cm |
Phương pháp đơn giản để đánh giá kích thước vòng bít
Căn chỉnh vòng bít sao cho trục dài của cuff chạy dọc theo trục dài của cánh tay. Sau đó lật vòng bít lại sao cho túi ở mặt dưới của vòng bít hướng lên trên và quấn vòng bít quanh cánh tay trên. Túi hơi (chiều rộng) phải bao quanh gần một nửa (40%) cánh tay trên. Nếu túi hơi bao quanh ít hơn một nửa cánh tay trên, vòng bít quá nhỏ và nên sử dụng vòng bít lớn hơn. Không cần thay đổi kích thước vòng bít nếu túi hơi quá lớn (tức là nếu nó bao quanh hầu hết cánh tay trên), vì sự khác biệt này không tạo ra lỗi đáng kể trong phép đo (13).
Độ chính xác
Độ chính xác hạn chế của phép đo HA gián tiếp ở những bệnh nhân bệnh nặng đã được nghiên cứu đầy đủ (14,15). Điều này được chứng minh trong một phân tích tổng hợp gần đây của 7 nghiên cứu so sánh phép đo HA tự động và trực tiếp ở những bệnh nhân ICU (15), cho thấy phép đo HA tự động có thể khác với HA trực tiếp tới 55 mm Hg (từ -15 mm Hg đến +40 mm Hg) ở từng bệnh nhân. Đây là phạm vi biến thiên không thể chấp nhận được và nó chứng minh nhu cầu (14.4) ghi HA trực tiếp ở những bệnh nhân bệnh nặng.
TƯỚI MÁU MÔ & OXI HÓA
Phương pháp tiếp cận sốc đòi hỏi nhiều hơn là theo dõi huyết áp, vì các biện pháp tưới máu mô và oxy hóa là cần thiết cho cả việc phát hiện và quản lý sốc. Các thông số này được thể hiện trong Bảng 14.3, cùng với giá trị ngưỡng của từng số đo cho biết sốc có thể xảy ra hoặc có khả năng xảy ra. Mỗi giá trị trong số này đã được mô tả ở nơi khác trong sách và những nội dung sau đây chỉ là bản tóm tắt ngắn gọn.
| BẢNG 14.3 Các thông số toàn thân về tưới máu mô và oxy hóa | ||
| Thông số | Ngưỡng nặng | Giải thích |
| Chỉ số tim | (CI) <2.5 L/min/m2 | Inadequate Perfusion |
| Vận chuyển oxi | ||
| Phân phối Oxi (DO2)
Tiêu thụ Oxy (VO2) Chiết xuất Oxy(VO2 /DO2) |
<300 mL/min/m2
<110 mL/min/m2 >50% <20% |
Cung cấp O2 không đủ Sử dụng O2 không đủf Cung cấp O2 không đủ Chiết xuất O2 không đủ |
| Bão hòa O2 tĩnh mạch trung (ScvO2) | <50%
>80% |
Cung cấp O2 không đủ
Chiết xuất O2 không đủ |
| PCO2 Gap | >6 mm Hg (>0.8 kPa) | Tưới máu mô không đủ |
| Lactate huyết tương | >2 mmol/L | Sử dụng O2 không đủf |
Hiện diện ở mọi loại sốc.
Các thông số vận chuyển Oxy
Có ba thông số đánh giá vận chuyển oxy toàn thân: cung cấp oxy (DO2), hấp thụ oxy (VO2) và chiết xuất oxy (VO2/DO2). Các biến số này, được mô tả chi tiết trong Chương 9, cung cấp đánh giá về sự cân bằng toàn thân giữa cung cấp O2 và nhu cầu O2, bị mất cân bằng trong mọi hình thức sốc.
Chỉ số tim
Vận chuyển oxy phụ thuộc vào cung lượng tim, được đo chính xác nhất bằng kỹ thuật pha loãng nhiệt sử dụng catheter động mạch phổi (xem Chương 8). Các phương pháp thay thế bao gồm xác định thể tích nhát bóp từ dạng sóng áp lực động mạch (xem Hình 11.5) hoặc đo vận tốc dòng chảy động mạch chủ bằng siêu âm Doppler. (Những phương pháp này được mô tả trong Chương 11.) Thể tích nhát bóp được nhân với nhịp tim để có được cung lượng tim.
Như đã giải thích trong Chương 8, các phép đo huyết động thường được biểu thị theo kích thước cơ thể bằng cách sử dụng diện tích bề mặt cơ thể tính bằng mét vuông. Cung lượng tim điều chỉnh theo kích thước được gọi là chỉ số tim (CI) và phạm vi bình thường là 2,4-4 L/phút/m2 (xem Bảng 8.1). CI dưới mức bình thường (<2,5 L/phút/m2) được coi là bằng chứng của tình trạng tưới máu mô không đầy đủ.
Phân phối Oxy
Tốc độ cung cấp oxy trong máu động mạch (DO2) được tính bằng tích của chỉ số tim (CI) và nồng độ oxy trong máu động mạch (CaO2); tức là,
DO2 = CI X CaO2 (14.4)
(Để biết biểu thức chi tiết hơn về phương trình này, hãy xem Phương trình 9.8.) Giảm cung cấp O2 là thủ phạm gây ra ba trong bốn loại sốc lâm sàng (tức là sốc giảm thể tích, sốc tim và sốc tắc nghẽn). DO2 thường là 520-600 mL/phút/m2 (xem Bảng 9.2) và DO2 là 300 mL/phút/m2 đã được xác định là ngưỡng oxy hóa mô không đủ (16). Tuy nhiên, đây không phải là dấu chứng nhất quán và một số nghiên cứu không thể xác định được điểm DO2 làm suy yếu quá trình chuyển hóa hiếu khí (17).
Tiêu thụ Oxy
Tốc độ hấp thụ oxy vào mô (VO2), tương đương với lượng tiêu thụ O2, được tính bằng tích của chỉ số tim và sự chênh lệch nồng độ O2 giữa (14.5) máu động mạch và tĩnh mạch (CaO2 – CvO2); tức là,
VO2 = CO X (CaO2 – CvO2) (14.5)
(Để biết biểu thức chi tiết hơn về phương trình này, hãy xem Phương trình 9.10.) VO2 bình thường là 110- 160 mL/phút/m2 và VO2 thấp bất thường (<110 mL/phút/m2) là bằng chứng của việc sử dụng O2 bị suy giảm (khi không có tình trạng giảm chuyển hóa hiếu khí, tình trạng này không phổ biến ở những bệnh nhân bệnh nặng).
Chiết xuất Oxy
Chiết xuất oxy là tỷ lệ giữa lượng O2 hấp thụ và lượng O2 cung cấp, xác định tỷ lệ oxy cung cấp được đưa vào các mô.
Chiết xuất O2 = VO2/DO2 (14.6)
Khi độ bão hòa O2 động mạch gần 100%, Phương trình 14.6 có thể được rút gọn thành các biến dễ theo dõi; tức là,
Chiết xuất O2 = (SaO2 – ScvO2) (14.7)
trong đó SaO2 và ScvO2 lần lượt là độ bão hòa O2 động mạch và tĩnh mạch trung tâm. (Để biết cách suy ra phương trình này, hãy xem Phương trình 9.12-9.14.) Phương trình này thể hiện quá trình chiết xuất O2 là mức độ mất bão hòa hemoglobin khi máu chảy qua các mao mạch.
Quá trình chiết xuất O2 thường là 0,2-0,3 (20-30%) và có thể tăng lên khoảng 0,5 (50%) để đáp ứng với sự giảm DO2, giúp duy trì VO2 không đổi (xem Hình 9.3). Việc giảm DO2 thêm nữa vượt quá điểm này sẽ không gây ra sự gia tăng bù trừ trong quá trình chiết xuất O2 và VO2 sẽ bắt đầu giảm (chỉ ra sự khởi đầu của quá trình chuyển hóa kỵ khí). Do đó, quá trình chiết xuất O2 >50% cho thấy việc cung cấp O2 đủ thấp để đe dọa hoặc làm suy yếu quá trình chuyển hóa hiếu khí (18). Ngoài ra còn có những tình trạng làm suy yếu quá trình chiết xuất O2 (ví dụ, nhiễm trùng huyết, suy gan) và những tình trạng này có thể được xác định bằng cách chiết xuất O2 cố định (tức là không tăng lên khi DO2 giảm) hoặc <20%. Trong tình huống này, chiết xuất O2 không phải là chỉ báo đáng tin cậy về những thay đổi trong quá trình cung cấp O2.
Độ bão hòa O2 tĩnh mạch trung tâm
Khi SaO2 không đổi hoặc gần bằng 1,0 (100%), Phương trình 14.7 có thể được viết lại thành:
Chiết xuất O2 = (1 – ScvO2) (14.8)
Do đó, độ bão hòa O2 tĩnh mạch trung tâm (ScvO2) có thể được sử dụng riêng để theo dõi quá trình trích xuất O2 (19). ScvO2 bình thường là khoảng 65-75% và việc tăng quá trình trích xuất O2 sẽ làm giảm ScvO2 xuống dưới phạm vi này. Quá trình trích xuất O2 tối đa (khoảng 50%) tương ứng với ScvO2 khoảng 50% và do đó, ScvO2 <50% có thể được sử dụng làm dấu hiệu của tình trạng oxy hóa mô bị đe dọa hoặc suy giảm (20).
Ở đầu kia, ScvO2 cao bất thường (>80%) là bằng chứng của tình trạng trích xuất O2 mô bị suy giảm, đây là một đặc điểm đặc trưng của sốc nhiễm trùng. Trong tình huống này, ScvO2 cũng có thể được cố định (tức là không thay đổi theo những thay đổi về quá trình cung cấp O2) và nếu điều này xảy ra, ScvO2 không phải là chỉ báo đáng tin cậy về những thay đổi trong quá trình cung cấp O2. Khi đó nên tính đến khoảng cách PCO2 (xem phần tiếp theo).
Độ chênh PCO2
Độ chênh PCO2 tĩnh mạch động mạch, còn được gọi là khoảng trống PCO2, là phép đo gián tiếp quá trình rửa trôi CO2 khỏi các mô (tức là tưới máu mô). Khoảng trống PCO2 thường là 2-5 mm Hg (0,3-0,7 kPa) và việc tăng khoảng trống lên >6 mm Hg (>0,8 kPa) là bằng chứng của tình trạng giảm tưới máu mô (21). Không giống như ScvO2, khoảng trống PCO2 chỉ phụ thuộc vào tưới máu mô và không cung cấp thông tin về oxy hóa toàn thân. Khoảng trống PCO2 dễ dàng thu được và nên được theo dõi ở tất cả các bệnh nhân bị sốc, đặc biệt là những bệnh nhân bị sốc lưu lượng thấp (sốc giảm thể tích, sốc tim và sốc tắc nghẽn). Nó cũng có thể hữu ích để phát hiện trạng thái lưu lượng thấp trong sốc nhiễm trùng, thường thấy ở các trường hợp tiến triển. (Lưu ý: Nhiễm toan chuyển hóa có thể làm tăng khoảng cách PCO2. Đây là kết quả của việc tăng sản xuất CO2 không chuyển hóa và có thể bị hiểu sai là bằng chứng của tình trạng giảm tưới máu mô. Khi có nhiễm toan chuyển hóa, chỉ có khoảng cách PCO2 bình thường mới có liên quan.)
Lactate huyết tương
Nồng độ lactat huyết tương được coi là một trong những thông số quan trọng nhất trong tình trạng sốc lâm sàng và có cả ứng dụng chẩn đoán và tiên lượng. Như đã đề cập trước đó, nồng độ lactat huyết tương >2 mmol/L được coi là bằng chứng về việc sử dụng O2 của tế bào không đầy đủ, khi không có các tình trạng khác gây ra “tăng lactat huyết hiếu khí” (xem Bảng 9.5). Nếu sốc là nguyên nhân gây ra nồng độ lactat tăng cao, thì việc không bình thường hóa nồng độ trong vòng 24 giờ sẽ có tác động tiêu cực đến kết quả khả quan (xem Hình 9.4). (Nồng độ lactat huyết tương được mô tả chi tiết trong Chương 9.)
QUẢN LÝ ĐIỀU TRỊ TỔNG QUÁT
Việc quản lý sốc lâm sàng có hai thành phần: điều trị tình trạng gây sốc và quản lý huyết động học tổng quát. Thành phần sau là trọng tâm ở đây.
Hồi sức thể tích
Truyền dịch tĩnh mạch là bước đầu tiên trong quá trình xử trí sốc, bất kể loại sốc nào. (Điều này có vẻ phản tác dụng trong sốc tim, nhưng áp lực đổ đầy tim thường không tối ưu trong suy tim cấp, đặc biệt là khi suy tim liên quan đến bên phải tim.) Truyền dịch tinh thể được ưu tiên, mặc dù khoảng 75% lượng dịch tinh thể truyền vào làm tăng thể tích kẽ, không phải thể tích huyết tương (xem Chương 11).
Thể tích truyền
Thể tích truyền ban đầu có thể phụ thuộc vào một số biến số (ví dụ: loại sốc, loại bệnh nhân). Đối với hội chứng sốc phổ biến nhất (sốc nhiễm trùng), thể tích hồi sức được khuyến cáo là >30 mL/kg, sử dụng trọng lượng cơ thể lý tưởng, trong 3 giờ đầu tiên (22). Thể tích truyền tối thiểu cho người lớn 70 kg sau đó sẽ là khoảng 2 lít và đối với dịch tinh thể, điều này có nghĩa là khoảng 500 mL (25%) sẽ được thêm vào thể tích huyết tương và 1,5 lít còn lại (75%) sẽ góp phần hình thành phù nề. Sự gia tăng thể tích huyết tương này chiếm khoảng 15% thể tích huyết tương đối với nam giới trưởng thành 70 kg (có thể tích huyết tương khoảng 40 mL/kg), điều này có vẻ hợp lý nếu bạn coi rằng mức giảm 15% thể tích máu là ngưỡng gây ra các triệu chứng (xem chương tiếp theo). Tuy nhiên, cách tiếp cận “một kích thước phù hợp với tất cả” này có thể không phù hợp với người lớn có kích thước cơ thể khác nhau và đối với phụ nữ (có thể tích huyết tương thấp hơn nam giới). Sau đây là một số khuyến nghị về hồi sức dịch ban đầu:
- Thể tích hồi sức ban đầu nên tính đến loại sốc (nếu biết) và loại bệnh nhân (ví dụ: kích thước cơ thể và giới tính), và có lẽ không nên vượt quá 2 lít (dịch tinh thể) trong vòng 1-2 giờ.
- Mục tiêu trước mắt là phục hồi huyết áp cơ bản.
- Nếu không đạt được mục tiêu huyết áp và có bằng chứng khác về tình trạng suy tuần hoàn (ví dụ: lượng nước tiểu thấp, thay đổi trạng thái tinh thần hoặc nồng độ lactat tăng cao), thì nên bắt đầu truyền thuốc co mạch.
- Hồi sức thể tích sau giai đoạn ban đầu nên được hướng dẫn bằng cách đánh giá khả năng đáp ứng với dịch (được mô tả trong Chương 11).
Truyền thuốc vận mạch
Vấn đề đầu tiên xuất hiện đối với truyền thuốc co mạch là khuyến cáo truyền thống rằng thuốc co mạch nên được truyền qua catheter tĩnh mạch trung tâm (để giảm thiểu nguy cơ thuốc thoát mạch và hoại tử mô). Đây là nguồn gốc của sự lo lắng khi truyền thuốc co mạch là nhu cầu cấp thiết và không có đường truyền trung tâm lưu. May mắn thay, ít nhất 16 nghiên cứu lâm sàng đã chỉ ra rằng thuốc co mạch có thể được truyền an toàn qua catheter ngoại vi (ở cánh tay trên) trong tối đa 48 giờ (23) và truyền dịch thuốc co mạch qua catheter đường giữa đã tiếp tục trong 7 ngày mà không có sự cố nào (24). Nếu có vấn đề trong việc cố định catheter ngoại vi lưu, thì việc đưa catheter vào xương sẽ cung cấp giải pháp tạm thời (xem Chương 1).
Thuốc thoát mạch
Việc thoát mạch của thuốc co mạch nên được xử lý như sau:
- Khi lần đầu tiên phát hiện có hiện tượng thoát mạch, hãy dừng truyền ngay lập tức, ngắt kết nối đường truyền tĩnh mạch và gắn vào ống tiêm, nhẹ nhàng hút hết dung dịch còn lại trong catheter và bất kỳ dịch thoát mạch nào có thể lấy ra được. Sau đó, tháo catheter. Không plus đường truyền trước khi tháo ra.
- Thuốc được sử dụng trong tình huống này là phentolamine, thuốc chẹn alpha tác dụng kéo dài. Liều dùng là 5-10 mg trong 10 mL dung dịch muối đẳng trương, được tiêm trực tiếp vào vùng thoát mạch (25). Nếu có hiện tượng da tái nhợt (do co mạch tại chỗ), hiện tượng này sẽ biến mất gần như ngay lập tức.
- Phentolamine phải được sử dụng trong vòng 12 giờ sau khi xảy ra hiện tượng này để có hiệu quả.
Huyết áp mục tiêu
Khuyến cáo đồng thuận là nên chuẩn độ truyền thuốc co mạch để duy trì huyết áp động mạch trung bình (MAP) ít nhất là 65 mm Hg (2,4,22), đây là huyết áp tối thiểu cần thiết để duy trì tự điều hòa não (quá trình duy trì lưu lượng máu não khi huyết áp giảm) (26). Mối lo ngại rằng huyết áp mục tiêu cao hơn có thể cần thiết ở những bệnh nhân bị tăng huyết áp lâu năm vẫn chưa được xác nhận trong các nghiên cứu lâm sàng (27).
CÁC THUỐC CO MẠCH
Có nhiều loại thuốc co mạch khác nhau, và được sử dụng chủ yếu trong sốc giãn mạch (nhiễm trùng huyết). Hầu hết là catecholamine thúc đẩy co mạch bằng cách kích thích thụ thể adrenergic loại al. Các thuốc co mạch hiện có được liệt kê trong Bảng 14.4, cùng với phạm vi liều cho từng loại thuốc. Các thuốc này được truyền liên tục (không có liều tải), bắt đầu ở liều thấp và tăng dần khi cần. Kháng thuốc co mạch liều cao thường thúc đẩy việc bổ sung thêm thuốc thứ hai, mặc dù không có bằng chứng nào về lợi ích sống sót từ phương pháp này (xem LỜI CUỐI ở cuối chương).
Norepinephrine
Norepinephrin là thuốc co mạch được sử dụng rộng rãi nhất và là thuốc co mạch được ưa chuộng trong sốc nhiễm trùng (22,28). Tác dụng chính của nó là co mạch qua trung gian thụ thể al, nhưng nó cũng là chất chủ vận thụ thể p yếu, tạo ra một số mức độ kích thích tim. Điều này có thể giải thích tại sao co mạch từ norepinephrin (ở liều thông thường) không làm suy giảm chức năng thận (29).
Chế độ liều lượng
Truyền norepinephrine thường bắt đầu ở tốc độ 5-10 µg/phút, tăng dần khi cần thiết. Kích thích thụ thể p có thể làm tăng lưu lượng tim ở phạm vi liều thấp (<10 µg/phút), trong khi co mạch do kích thích thụ thể a bắt đầu chiếm ưu thế ở liều trên 10 p.g/phút. Khi liều đạt 30 µg/phút, việc tăng thêm liều không có khả năng tạo ra phản ứng co mạch nhiều hơn và có thể thêm thuốc co mạch thứ hai tại thời điểm này.
Các tác dụng phụ
Các tác dụng phụ nghiêm trọng liên quan đến truyền norepinephrine bao gồm các biến cố thiếu máu cục bộ (thiếu máu cục bộ cơ tim, não hoặc chi) và loạn nhịp tim (nhịp tim nhanh và nhịp tim chậm). Những biến chứng này đã được báo cáo ở khoảng 10% bệnh nhân (30), nhưng có thể nhiều biến chứng này là kết quả của sốc chứ không phải thuốc co mạch.
ỨC CHẾ MIỄN DỊCH: Có bằng chứng cho thấy hoạt hóa bạch cầu do các sản phẩm của vi khuẩn (là một phần quan trọng của phản ứng miễn dịch) bị ức chế trong quá trình truyền norepinephrine (31). Điều này được cho là do norepinephrine liên kết với các thụ thể adrenergic trên bề mặt bạch cầu, và nó làm tăng khả năng norepinephrine hoạt động như một chất ức chế miễn dịch và làm tăng nguy cơ nhiễm trùng. Ý nghĩa lâm sàng của điều này vẫn chưa rõ ràng, nhưng ý nghĩa trớ trêu thì khá rõ ràng, xét đến sự phổ biến của norepinephrine trong điều trị sốc nhiễm trùng.
| BẢNG 14.4 Thuốc làm co mạch ngoài đường tiêu hóa | ||
| Thuốc | Liều | Bàn luận |
| Norepinephrine | 5-40 µg/phút | Thuốc co mạch được sử dụng rộng rãi nhất trong sốc lâm sàng |
| Epinephrine | 0.1-0.5µg/kg/phút | Thuốc lựa chọn cho tình trạng sốc phản vệ và là thuốc điều trị thứ hai cho tình trạng sốc nhiễm trùng Thúc đẩy sản xuất lactat |
| Dopamine | 5-50 µg/kg/phút | Trước đây phổ biến nhưng bị hạn chế bởi kích thích tim không mong muốn |
| Phenylephrine | 0.5-6 µg/kg/phút | Một chất chủ vận a thuần túy được sử dụng chủ yếu để điều trị hạ huyết áp liên quan đến gây mê |
| Vasopressin | 0.01-0.04 Unit/h | Được sử dụng như một thuốc thứ hai trong các trường hợp sốc nhiễm trùng trơ với norepinephrine |
| Angiotensin II | 0.02-0.08 µg/kg/phút ban đầu, sau đó truyền <0.04 µg/kg/phút
Có thể thúc đẩy huyết khối tĩnh mạch |
|
Epinephrine
Epinephrine là một chất chủ vận thụ thể β mạnh tạo ra sự gia tăng phụ thuộc vào liều lượng về nhịp tim, thể tích nhát bóp và huyết áp (32). Nó có vai trò quan trọng trong hồi sức tim phổi (xem Chương 21) và trong hồi sức sốc phản vệ (xem Chương 17), nhưng nó là thuốc co mạch hàng thứ hai trong sốc nhiễm trùng và được dành riêng cho các trường hợp hạ huyết áp không đáp ứng với norepinephrine.
Chiến lược liều
Liều lượng khuyến cáo cho epinephrine trong hồi sức tim phổi và sốc phản vệ được trình bày lần lượt trong Chương 21 và 17. Đối với sốc nhiễm trùng, epinephrine được truyền liên tục mà không có liều tải, bắt đầu từ 0,1 µg/kg/phút và tăng dần khi cần. Liều tối đa là 0,5 µg/kg/phút (27).
Các tác dụng phụ
Các tác dụng phụ của epinephrine bao gồm kích thích tim không mong muốn (tức là nhịp tim nhanh và loạn nhịp tim), và giảm tưới máu tạng do co mạch qua trung gian a (33), có thể làm hỏng hàng rào niêm mạc trong ruột. Epinephrine cũng có các tác dụng chuyển hóa không mong muốn, bao gồm tăng tỷ lệ chuyển hóa (phản tác dụng trong hội chứng sốc), tăng đường huyết (do ức chế tiết insulin qua trung gian thụ thể a) và tăng nồng độ lactat huyết tương (do tăng sản xuất lactat hiếu khí) (34). Sự gia tăng nồng độ lactat có thể gây hiểu lầm trong hội chứng sốc.
Dopamine
Dopamine là một catecholamine nội sinh đóng vai trò là tiền chất của norepinephrine. Trước đây, nó là thuốc làm co mạch được ưa chuộng trong sốc nhiễm trùng, nhưng xu hướng gây nhịp tim nhanh và loạn nhịp tim đáng kể đã khiến nó không còn được ưa chuộng nữa. Dopamine có nhiều tác dụng phụ thuộc vào liều lượng (35):
- Ở tốc độ truyền thấp (<3 µg/kg/phút), dopamine kích hoạt chọn lọc các thụ thể đặc hiệu dopamine trong tuần hoàn thận và tạng, dẫn đến tăng lưu lượng máu ở các vùng này.
- Ở tốc độ truyền vừa phải (3-10 µg/kg/phút), dopamine kích thích các thụ thể p ở tim và tuần hoàn ngoại vi, tạo ra sự gia tăng cung lượng nhát bóp tim.
- Ở tốc độ truyền cao (>10 µg/kg/phút), dopamine tạo ra sự kích hoạt phụ thuộc vào liều lượng của các thụ thể a trong tuần hoàn ngoại vi, dẫn đến co mạch tiến triển và tăng sức cản mạch máu toàn thân. Tác dụng làm co mạch này làm tăng hậu tải tâm thất và có thể đối kháng sự gia tăng thể tích nhát bóp do liều dopamine thấp hơn gây ra.
Chiến lược liều
Dopamine thường được bắt đầu ở liều 5 µg/kg/phút và được tăng dần khi cần thiết. Liều 5-10 µg/kg/phút thường sẽ làm tăng cung lượng tim, nhưng có thể cần liều cao hơn (>10 µg/kg/phút) để làm tăng huyết áp. Lợi ích của dopamine thường thấy ở liều 5-20 µg/kg/phút, nhưng liều 50 µg/kg/phút và thậm chí cao hơn đã được báo cáo (35).
Các tác dụng phụ
Rủi ro chính với dopamine là nhịp tim nhanh và loạn nhịp nhanh (ví dụ, rung nhĩ), xảy ra thường xuyên hơn với dopamine so với các thuốc làm co mạch khác (36). Như đã đề cập, rủi ro này đã dẫn đến sự suy giảm đáng kể về mức độ sử dụng phổ biến của dopamine đối với cả sốc tim và sốc nhiễm trùng. Một rủi ro khác với dopamine đáng được đề cập là tăng nhãn áp, đã được báo cáo ở liều thấp (1-4 µg/kg/phút) (37).
Phenylephrine
Phenylephrine là chất chủ vận thụ thể α tinh khiết gây co mạch lan rộng, có thể đi kèm với nhịp tim chậm, giảm cung lượng tim (thường ở những bệnh nhân suy tim) và giảm tưới máu thận và ruột. Công dụng chính của phenylephrine là để điều trị hạ huyết áp do gây mê (tủy sống hoặc toàn thân), trong đó thuốc thường được dùng với liều bolus. Phenylephrine không được khuyến cáo cho bất kỳ hội chứng sốc nào (22,38), mặc dù một nghiên cứu lâm sàng so sánh phenylephrine và norepinephrine trong sốc nhiễm trùng cho thấy không có sự khác biệt về tác dụng huyết động hoặc kết quả lâm sàng với bất kỳ loại thuốc nào (39). Trong ICU, phenylephrine hữu ích trong việc kiểm soát sốc nhiễm trùng ở những bệnh nhân bị rung nhĩ nhanh (quan sát của tác giả).
Chiến lược liều
- Để điều trị hạ huyết áp trong khi gây mê, phenylephrine có thể được dùng dưới dạng liều bolus 50-100 µg, có thể lặp lại một lần sau vài phút nếu cần. Nếu hạ huyết áp không giảm, thì nên truyền liên tục thuốc, bắt đầu với liều 10-35 µg/phút và tăng dần. Liều tối đa được khuyến cáo là 200 µg/phút (38).
- Để kiểm soát sốc nhiễm trùng, phenylephrine được dùng dưới dạng truyền liên tục mà không cần liều bolus ban đầu, bắt đầu với liều 0,5 µg/kg/phút và tăng dần khi cần. Liều trên 6 µg/kg/phút khó có thể mang lại bất kỳ lợi ích nào nữa (38).
Vasopressin
Vasopressin, còn được gọi là hormone chống bài niệu, gây co mạch do các thụ thể vasopressin (V1) chuyên biệt trên cơ trơn mạch máu. Co mạch nổi bật nhất ở da, cơ xương và tuần hoàn tạng (39). Vasopressin không làm tăng huyết áp ở những người tình nguyện khỏe mạnh, nhưng nó có thể gây tăng huyết áp đáng kể ở những bệnh nhân bị sốc giãn mạch (40). Các tác dụng khác của vasopressin bao gồm tăng cường tái hấp thu nước ở ống thận xa (qua trung gian thụ thể V2) và kích thích tuyến yên trước giải phóng ACTH (qua trung gian thụ thể V3).
Sử dụng như là một thuốc co mạch
Vasopressin có thể được sử dụng trong các tình huống lâm sàng sau.
- Trong quá trình hồi sức ngừng tim, vasopressin có thể được dùng dưới dạng liều IV duy nhất (40 đơn vị) để thay thế liều epinephrine đầu tiên hoặc thứ hai.
- Trong trường hợp sốc nhiễm trùng kháng với hỗ trợ huyết động bằng norepinephrine (thường được định nghĩa là liều norepinephrine >0,2 µg/kg/phút mà không có huyết áp thích hợp), nên bổ sung vasopressin (22), vì điều này có thể làm tăng huyết áp và giảm nhu cầu catecholamine (tác dụng tiết kiệm catecholamine). Tuy nhiên, việc bổ sung vasopressin không có lợi ích sống sót đã được chứng minh (41).
Chiến lược liều
Đối với sốc nhiễm trùng, vasopressin được truyền liên tục với tốc độ 0,03-0,04 đơn vị/giờ. Liều lượng này không được chuẩn độ (không giống như thuốc làm co mạch catecholamine). Các tác dụng phụ của vasopressin tương tự về loại và tần suất như những tác dụng phụ đã đề cập trước đó đối với norepinephrine (30).
Angiotensin II
Angiotensin II là một chất tương tự tổng hợp của angiotensin ở người, tác động lên cơ trơn mạch máu để thúc đẩy co mạch toàn thân và cũng kích thích giải phóng vasopressin từ tuyến yên sau. Thuốc đã được chấp thuận sử dụng trong sốc giãn mạch vào năm 2018 và chủ yếu được sử dụng trong các trường hợp trơ norepinephrine. Thuốc đã làm tăng huyết áp ở 67% các trường hợp (42), nhưng tác động đến tỷ lệ tử vong vẫn chưa nhất quán (42,43).
Chiến lược liều
Angiotensin II được dùng bằng cách truyền tĩnh mạch liên tục: liều khởi đầu là 20 ng/kg/phút (0,02 µg/kg/phút), có thể tăng liều sau mỗi 10-15 phút nếu cần, lên đến 80 ng/kg/phút (0,08 µg/kg/phút) trong 3 giờ đầu tiên (44). Sau đó, liều duy trì không được vượt quá 40 ng/kg/phút (0,04 µg/kg/phút). Không có sự điều chỉnh liều cho tình trạng suy gan hoặc suy thận.
Các tác dụng phụ
Rủi ro chính với angiotensin II là huyết khối tĩnh mạch. Angiotensin kích thích giải phóng chất ức chế hoạt hóa plasminogen-1 từ cơ trơn mạch máu, ngăn chặn quá trình tiêu fibrin và cũng làm tăng sự kết dính tiểu cầu. Trong một thử nghiệm lâm sàng, tỷ lệ các biến cố huyết khối với angiotensin II cao gấp đôi so với tỷ lệ với giả dược (lần lượt là 13% so với 5%) (44).
Midodrine
Midodrine là thuốc chủ vận thụ thể a dùng đường uống đã được FDA chấp thuận vào năm 1996 để điều trị hạ huyết áp tư thế đứng. Kinh nghiệm lâm sàng với midodrine trong ICU được tóm tắt dưới đây.
- Midodrine đã được chứng minh là có hiệu quả trong việc hạn chế hoặc ngăn ngừa hạ huyết áp trong quá trình thẩm phân máu (45). Liều hiệu quả thay đổi từ 5 mg đến 20 mg, dùng 20-30 phút trước khi thẩm phân. Có thể dùng thêm một liều nhỏ hơn trong quá trình thẩm phân nếu cần.
- Điều trị bổ trợ bằng midodrine (20 mg mỗi 8 giờ) không làm tăng tốc độ ngừng liệu pháp thuốc co mạch ngoài đường tiêu hóa (46,47).
Mặc dù được coi là thuốc co mạch dễ dùng, midodrine không mang lại lợi ích gì trong việc kiểm soát tình trạng sốc.
CÁC MỤC TIÊU HỒI SỨC
Mục tiêu hồi sức cho tình trạng sốc lâm sàng đã được đề cập trong suốt chương này và được tóm tắt ngắn gọn tại đây. Các mục tiêu có thể được nhóm thành hai loại, tưới máu mô và vận chuyển oxy, như thể hiện trong Bảng 14.5.
Tưới máu mô
Tầm quan trọng của lưu lượng máu trong tình trạng sốc dễ thấy khi bạn xem xét rằng ba trong bốn loại sốc (tức là giảm thể tích máu, sốc do tim và sốc tắc nghẽn) là tình trạng lưu lượng máu thấp. Một trong những mục tiêu đầu tiên trong hồi sức sốc là đo chính xác huyết áp động mạch trung bình (MAP), đây là áp suất thúc đẩy lưu lượng máu ngoại vi. Điều này đòi hỏi phải ghi lại áp suất động mạch trực tiếp từ catheter động mạch. Khi đạt được điều này, MAP phải được duy trì ở mức >65 mm Hg. Không theo dõi huyết áp tâm thu (nếu có thể), vì đây là sóng áp suất phản xạ truyền trở lại tim (tức là ra khỏi ngoại vi). Hãy nhớ rằng lưu lượng máu trong hệ tuần hoàn vi mô là dòng chảy tầng, không phải dòng chảy xung và không có thành phần tâm thu và tâm trương.
Theo dõi cung lượng tim bằng catheter động mạch phổi (PA) từng là phương pháp chính trong quản lý chăm sóc đặc biệt, nhưng phương pháp này đã giảm mạnh cách đây khoảng 25 năm do có bằng chứng cho thấy catheter động mạch phổi không cải thiện khả năng sống sót ở những bệnh nhân nguy kịch. (Một phán đoán khắc nghiệt, vì catheter là thiết bị theo dõi, không phải là liệu pháp.) Nếu có thể đo cung lượng tim, mục tiêu là duy trì cung lượng tim điều chỉnh theo kích thước (chỉ số tim) trên 2,5 L/phút/m2.
Cũng có thể đánh giá tưới máu mô bằng cách sử dụng khoảng trống PCO2, đây là phép đo lượng CO2 đào thải khỏi mô. Khoảng trống PCO2 <6 mm Hg được coi là bằng chứng tưới máu mô đầy đủ. Phép đo này dễ dàng thu được và nên được theo dõi ở tất cả bệnh nhân bị sốc, ngay cả khi có thể đo cung lượng tim (vì lưu lượng vi tuần hoàn có thể chậm khi lưu lượng tim toàn phần ở mức bình thường). Lưu ý: Nhiễm toan chuyển hóa có thể làm tăng sản xuất CO2 không chuyển hóa và điều này có thể dẫn đến sự gia tăng không mong muốn khoảng trống PCO2.
Cuối cùng, có thể đánh giá tưới máu mô bằng cách theo dõi chức năng cơ quan và lượng nước tiểu phù hợp cho mục đích này vì lượng nước tiểu giảm thường là một trong những dấu hiệu sớm nhất của tình trạng sốc sắp xảy ra. Vì thiểu niệu được xác định bằng lượng nước tiểu <0,5 mL/kg/giờ, mục tiêu hồi sức là vượt ngưỡng này. Trạng thái tinh thần cũng có thể được theo dõi, nhưng không dễ định lượng như lượng nước tiểu.
| BẢNG 14.5 Mục tiêu hồi sức cho bệnh nhân sốc | |
| Phân loại | Các mục tiêu |
| Tưới máu mô | • MAP >65 mm Hg
• CI >2.5 L/phút/m2 • PCO2 Gap <6 mm Hg • Lưu lượng nước tiểu >0.5 mL/kg/hr |
| Vận chuyển Oxy | • DO2 >300 mL/phút/m2.
• VO2 >110 mL/phút/m2 • Chiết xuất O2 <50% • ScvO2 >50% • Lactate <2 mmol/L |
Vận chuyển Oxy
Việc theo dõi các biến số vận chuyển O2 có ý nghĩa rõ ràng vì sự rối loạn ở một trong những biến số này gây ra tình trạng sốc lâm sàng.
- Ba trong số các hội chứng sốc chính (sốc giảm thể tích, sốc tim và sốc tắc nghẽn) là kết quả của việc cung cấp O2 không đủ cho các mô, thường là do cung lượng tim không đủ, với sự góp phần của mức hemoglobin thấp trong một trường hợp (sốc mất máu). Mục tiêu trong những trường hợp này là chỉ số tim (CI) >2,5 L/phút/m2, cung cấp O2 (DO2) >300 mL/phút/m2 và hấp thụ O2 (VO2) >110 mL/phút/m2. Nếu các biến số này không được theo dõi (điều này xảy ra trong hầu hết các trường hợp), thì mục tiêu hồi sức là độ bão hòa O2 tĩnh mạch trung tâm (ScvO2) >50% và nồng độ lactat huyết tương <2 mmol/L.
- Sốc nhiễm trùng KHÔNG phải là kết quả của việc cung cấp O2 không đủ, mà là kết quả của khiếm khuyết trong quá trình phosphoryl hóa oxy hóa ở ty thể bị rối loạn chức năng (48,49). Tình trạng này được gọi là tình trạng thiếu oxy tế bào (48) và có thể liên quan đến khiếm khuyết trong quá trình chiết xuất O2 từ máu mao mạch. Mục tiêu quản lý trong trường hợp này bao gồm chiết xuất O2 <80% và hấp thụ O2 (VO2) >110 mL/phút/m2. (ScvO2 có thể không đáng tin cậy trong nhiễm trùng huyết do quá trình chiết xuất O2 bị khiếm khuyết.) Nếu các biến số này không được theo dõi, mục tiêu hồi sức chỉ đơn giản là mức lactat huyết tương bình thường. (Việc quản lý sốc nhiễm trùng được trình bày chi tiết trong Chương 17.)
- Mục tiêu chung của hồi sức trong mọi dạng sốc là bình thường hóa mức lactat huyết tương (<2 mmol/L).
Tất nhiên, mục tiêu ngầm của hồi sức trong sốc lâm sàng là sự sống còn.
LỜI KẾT
Hạ huyết áp là hậu quả, không phải là nguyên nhân, của sốc
Việc hồi sức sốc chủ yếu là do mong muốn tăng huyết áp, dựa trên giả định rằng huyết áp thấp là nguyên nhân gây ra sốc. Những quan sát sau đây tạo ra một số nghi ngờ về cách tiếp cận này.
- Sốc được định nghĩa là sự rối loạn trong việc sử dụng O2 của tế bào (2), không phải là sự rối loạn trong huyết áp.
- Giảm hạ huyết áp là trọng tâm chính của việc quản lý sốc trong hơn 70 năm (kể từ khi norepinephrine được đưa vào sử dụng lâm sàng vào năm 1950), tuy nhiên tỷ lệ tử vong do sốc vẫn ở mức cao không thể chấp nhận được và việc sử dụng hai hoặc thậm chí ba thuốc co mạch không mang lại lợi ích về khả năng sống sót (50).
- Huyết áp thấp xảy ra trong các tình trạng khác ngoài sốc (ví dụ: bệnh thần kinh tự chủ, suy tuyến thượng thận, 5% người lớn khỏe mạnh) và chúng gây tổn thương cơ quan thiếu oxy hoặc tăng nồng độ lactat. Trên thực tế, huyết áp thấp đã được chứng minh là có lợi trong các vết thương xuyên thấu bằng cách hạn chế mất máu (xem chương tiếp theo).
Một lời giải thích khả thi cho những quan sát này là hạ huyết áp không gây ra sốc, mà thay vào đó là hậu quả của sốc. Sốc được biết đến là nguyên nhân gây ra rối loạn chức năng đa cơ quan, và một trong những cơ quan rối loạn chức năng có thể là mạch máu. Nếu đúng như vậy, thì việc điều chỉnh huyết áp sẽ không điều chỉnh được tình trạng sốc (hoặc cải thiện khả năng sống sót), giống như việc chạy thận nhân tạo để điều trị suy thận liên quan đến sốc sẽ không điều chỉnh được tình trạng sốc (hoặc cải thiện khả năng sống sót).
Tài liệu tham khảo
- Manji R, Wood KE, Kuman A. The history and evolution of circulatory shock. Crit Care Clin 2009; 25:1-29.
What is Shock?
- Vincent J-L, De Backer D. Circulatory shock. N Engl J Med 2013; 369:1726-1734.
- Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345:1368-1377.
- Cecconi M, De Backer D, Antonelli M, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med 2014; 40:1795-1815.
- Advanced Trauma Life Support® Student Course Manual. 10th ed., Chicago: American College of Surgeons, 2012; 49-50.
- Berg DD, Bohula EA, Morrow DA. Epidemiology and causes of cardiogenic shock. Curr Opin Crit Care 2021; 27:401-408.
- Rob D, Bẽlohlávek J. The mechanical support of cardiogenic shock. Curr Opin Crit Care 2021; 27:440-446.
- Liu V, Escobar GJ, Greene JD, et al. Hospital deaths in patients with sepsis from 2 independent cohorts. JAMA 2014; 312:90-92.
- Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the Global Burden of Disease Study. Lancet 2020; 395:200211.
Blood Pressure Monitoring
- Augusto J-L, Teboul J-L, Radermacher P, Asfar P. Interpretation of blood pressure signal: physiological bases, clinical relevance, and objectives during shock states. Intensive Care Med 2011; 37:411-419.
- Nichols WW, O’Rourke MF. McDonald’s blood flow in arteries. 3rd ed. Philadelphia: Lea & Febiger, 1990; 251-269.
- Shapiro DS, Loiacono LA. Mean arterial pressure: therapeutic goals and pharmacologic support. Crit Care Clin 2010; 26:285-293.
- Pickering TG, Hall JE, Appel LJ, et al. Recommendations for blood pressure measurement in humans and experimental animals: Part 1: Blood pressure measurement in humans: a statement for professionals from the Subcommittee of Professional and Public Education of the American Heart Association Council on High Blood Pressure Research. Circulation 2005; 111:697-716.
- Bur A, Hirschl M, Herkner H, et al. Accuracy of oscillometric blood pressure measurement according to the relation between cuff size and upper-arm circumference in critically ill patients. Crit Care Med 2000; 28:371-376.
- Nedel WL, Vasconcellos AT, Gunsch KA, Soares PHR. Accuracy and precision of oscillometric noninvasive blood pressure measurement in critically ill patients: systematic review and metaanalysis. Anaesthesiol Intensive Ther 2022; 54:425-431.
Tissue Perfusion and Oxygenation
- Komatsu T, Shibutani K, Okamoto K, et al. Critical level of O2 delivery after cardiopulmonary bypass. Crit Care Med 1987; 15:194-197.
- Mohsenifar Z, Goldbach P, Tashkin DP, et al. Relationship between O2 delivery and O2 consumption in the adult respiratory distress syndrome. Chest 1983; 84:267-272.
- Wilkerson DK, Rosen AL, Gould SA, et al. Oxygen extraction ratio: a valid indicator of myocardial metabolism in anemia. J Surg Res 1987; 42:629-634.
- Maddirala S, Khan A. Optimizing hemodynamic support in septic shock using central venous and mixed venous oxygen saturation. Crit Care Clin 2010; 26:323-333.
- Vallet B, Robin E, Lebuffe G. Venous oxygen saturation as a physiologic transfusion trigger. Crit Care 2010; 14:213-217.
- Scheeren TWL, Wicke JN, Teboul J-L. Understanding the carbon dioxide gaps. Curr Opin Crit Care 2018; 24:181-189.
General Management
- Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med 2021; 47:1181-1247.
- Owen VS, Rosgren B, Cherak SJ, et al. Adverse events associated with administration of vasopressor medications through a peripheral intravenous catheter: a systematic review and meta-analysis. Crit Care 2021; 25:146.
- Prasanna N, Yamane D, Haridasa N, et al. Safety and efficacy of vasopressor administration through midline catheters. J Crit Care 2021; 61:1-4.
- Phentolamine mesylate. AHFS Drug Information, 2022. Bethesda, MD: American Society for Health System Pharmacists, 2022; 1436-1439.
- Guyton AC, Hall JE. Medical Physiology. 10th ed. Philadelphia: W.B. Saunders, Co., 2000; 178.
- Asfar P, Meziani F, Hamel JF, et al. High versus low blood-pressure target in patients with septic shock. N Engl J Med 2014; 370:1583-1593.
Vasopressor Drugs
- Russell JA. Vasopressor therapy in critically ill patients with shock. Intensive Care Med 2019; 45:1503-1517.
- Desairs P, Pinaud M, Bugnon D, Tasseau F. Norepinephrine therapy has no deleterious renal effects in human septic shock. Crit Care Med 1989; 17:426-429.
- Anantasit N, Boyd JH, Walley KR, Russell JA. Serious adverse events associated with vasopressin and norepinephrine infusion in septic shock. Crit Care Med 2014; 42:1812-1820.
- Stolk RF, van der Pasch E, Naumann F, et al. Norepinephrine dysregulated the immune response and compromises host defense during sepsis. Am J Respir Crit Care Med 2020; 202:830-842.
- AHFS Drug Information, 2022. Bethesda, MD: American Society of HealthSystem Pharmacists, 2022; 1424-1431.
- De Backer D, Creteur J, Silva E, Vincent J-L. Effects of dopamine, norepinephrine, and epinephrine on the splanchnic circulation in septic shock: Which is best? Crit Care Med 2003; 31:1659-1667.
- Levy B. Bench-to-bedside review: Is there a place for epinephrine in septic shock? Crit Care 2005; 9:561-565.
- Dopamine hydrochloride. AHFS Drug Information, 2022. Bethesda, MD: American Society of Health-System Pharmacists, 2022; 1388-1392.
- Avni T, Lador A, Lev S, et al. Vasopressors for the treatment of septic shock: systematic review and meta-analysis. PLoS One 2015; 10:e0129305.
- Brath PC, MacGregor DA, Ford JG, Prielipp RC. Dopamine and intraocular pressure in critically ill patients. Anesthesiology 2000; 93:1398-1400.
- Phenylephrine hydrochloride. AHFS Drug Information, 2022. Bethesda, MD: American Society of Health System Pharmacists, 2022; 1379-1384.
- Morelli A, Ertmer C, Rehberg S, et al. Phenylephrine versus norepinephrine for initial hemodynamic support of patients with septic shock: a randomized, controlled trial. Crit Care 2008; 12:R143.
- Treschan TA, Peters J. The vasopressin system: physiology and clinical strategies. Anesthesiology 2006; 105:599-612.
- Polito A, Parisini E, Ricci Z, et al. Vasopressin for treatment of vasodilatory shock: an ESICM systematic review and metaanalysis. Intensive Care Med 2012; 38:9-19.
- Wieruszewski PM, Wittwer ED, Kashani KB, et al. Angiotensin II infusion for shock. A multicenter study of postmarketing use. Chest 2021; 159:596-605.
- Khanna A, English SW, Wang XS, et al. Angiotensin II for treatment of vasodilatory shock. N Engl J Med 2017; 377:419-430.
- giapreza.com. Accessed June 23, 2023.
- Chang TI. Impact of drugs on intradialytic hypotension: antihypertensive and vasoconstrictors. Semin Dial 2017; 30:532-536.
- Santer P, Anstey MH, Patrocinio MD, et al. Effect of midodrine versus placebo on time to vasopressor discontinuation in patients with persistent hypotension in the intensive care unit (MIDAS): an international randomized clinical trial. Intensive Care Med 2020; 46:1884-1893.
- Costa-Pinto R, Yong Z-T, Yanase F, et al. A pilot, feasibility, randomized controlled trial of midodrine as adjunctive vasopressor for low-dose vasopressor-dependent hypotension in intensive care patients: The MAVERIC study. J Crit Care 2022; 67:166-171.
Goals of Resuscitation
- Fink MP. Cytopathic hypoxia. Mitochondrial dysfunction as mechanism contributing to organ dysfunction in sepsis. Crit Care Clin 2001; 17:219-237.
- Ruggieri AJ, Levy RJ, Deutschman CS. Mitochondrial dysfunction and resuscitation in sepsis. Crit Care Clin 2010; 26:567-575.
A Final Word
- Oriyanka P, Chang C-CH, Chawla LS, et al. Vasopressor-resistant hypotension, combination vasopressor therapy, and shock phenotypes in critically ill adults with vasodilatory shock. Shock 2022; 58:260-268.
TẢI FILE PDF TẠI ĐÂY
